Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.11 no.8 Madrid dic. 2004
CASO CLÍNICO
Hepatotoxicidad por gabapentina
M. Santana1, R. Pernas1, E. Martínez-Fernández1, J. Díaz-Sanguino1, J. Gómez-Sánchez1 y F. Rodríguez-Huertas1
| Santana M, Pernas R, Martínez-Fernández E, Díaz-Sanguino J, Gómez-Sánchez J, Rodríguez-Huertas F. Hepatotoxicity by gabapentin. Rev Soc Esp Dolor 2004; 11: 521-523.
|
1Servicio de Anestesia, Reanimación y Terapéutica del Dolor
Hospital del Servicio Andaluz de Salud. Jerez de la Frontera. Cádiz
Recibido: 14-09-04.
Aceptado: 14-09-04.
INTRODUCCIÓN
Son muchas las sustancias que pueden dañar el hígado, desde medicamentos a remedios a base de plantas medicinales. La toxicidad medicamentosa es la primera causa de insuficiencia hepática aguda y la hepatotoxicidad es la razón más común por la que se retiran fármacos del mercado.
Algunos medicamentos, como el paracetamol son dañinos para el hígado a partir de ciertas dosis, casi todos los demás son más imprevisibles y sólo causan daño en algunas personas. Recientemente esta idiosincrasia individual se ha relacionado con factores genéticos (1).
En más de la mitad de los casos de hepatotoxicidad medicamentosa hay una necrosis hepatocelular, por destrucción de los hepatocitos por el fármaco, pero también es posible la obstrucción del flujo biliar, causando colestasis, o bien una presentación mixta (citolisis + colestasis).
La relevancia de este caso clínico que presentamos es dar a conocer un efecto indeseable grave en un fármaco cuya principal utilidad radica en la ausencia de efectos colaterales y en el que la mayoría de los autores preconizan su uso a cada vez más dosis y sin ningún control analítico.
Los fármacos antiepilépticos de primera generación, fenitoína, carbamazepina y ácido valproico se han relacionado con lesión hepática, a veces severa.
La gabapentina es un agente anticonvulsivante de segunda generación, muy utilizado en nuestro país, es un derivado cíclico de ácido gamma-aminobutírico. Este fármaco se absorbe activamente por un sistema de transporte saturado, circula unido en una alta proporción a las proteínas plasmáticas y se elimina sin metabolizar por el riñón. La gabapentina no se metaboliza en el hígado, esto hizo que estuviera indicada en pacientes con patología hepática.
La gabapentina, como otros antiepilépticos, se ha usado en el tratamiento del dolor neuropático. Se ha publicado que la gabapentina era más eficaz que la amitriptilina en el dolor y parestesia asociada a la neuropatía diabética (2). Los resultados de un estudio a doble ciego, randomizado han demostrado que este medicamento es eficaz en el tratamiento de la neuralgia post-herpética (3). Se han publicado efectos secundarios pero suelen ser moderados y transitorios. Dosis por encima de 2.400 mg.día-1 son bien tolerados.
En la unidad de dolor de nuestro hospital hemos detectado un caso de toxicidad hepática reversible en una mujer de 63 años diagnosticada de neuropatía diabética.
Entre sus antecedentes personales destacaba hipertensión arterial (tratada con enalapril y nebivolol), diabetes mellitus tipo I, colecistectomía laparoscópica hace un año y alergia a pirazolonas. Las determinaciones de VHB, VHC y VIH eran negativas antes del episodio de hepatotoxicidad y posteriormente seguían negativas.
La paciente fue admitida en nuestra unidad, cinco meses antes del episodio de toxicidad, siendo tratada con tramadol y administración de lidocaína intravenosa con pocos resultados. Al mes siguiente se decidió, empezar con gabapentina, la dosis inicial fue de 300 mg.día-1, aumentando la dosis progresivamente hasta 300 mg cada 8 horas.
A los cuatro meses del inicio del tratamiento con gabapentina la paciente acude a Urgencias con dolor en hipogastrio, astenia, apatía y sensación de enfermedad grave; no había ningún dato de encefalopatía, apreciándose en la exploración hepatomegalia. En la ecografía abdominal se detectó dilatación moderada de la vía biliar.
En este momento tomaba 1.800 mg de gabapentina y 200 mg de tramadol al día, así como la insulina y los fármacos mencionados para el tratamiento de la hipertensión.
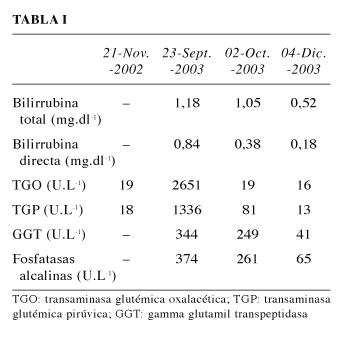
La analítica realizada ese día mostró un gran aumento de la enzimas hepáticas, siendo la analítica previa al tratamiento con gabapentina normal, que recogimos en los archivos informáticos del hospital (Tabla I).
El médico que la atendió en Urgencias consideró que la causa era una lesión hepática inducida por drogas, que como hemos mencionado es la causa más frecuente de insuficiencia hepática aguda y como es conocido el potencial hepatotóxico de los antiepilépticos, identificó a la gabapentina como responsable del cuadro y la retiró. No fue tomada ninguna otra medida. Valorada en nuestra unidad se objetivó una normalización de estas enzimas en 10 días, que fue completa a los tres meses (Tabla I).
No consideramos necesaria la realización de una biopsia hepática porque habría dado, en todo caso, una lesión inespecífica y además cuando la paciente fue revisada por nosotros a los diez días, la mejoría clínica y analítica era evidente, por lo que no nos parecía indicada.
En nuestra paciente no había dudas de que la gabapentina es la causante de la hepatotoxidad, ya que sólo con su retirada se logró la normalización de las enzimas hepáticas, sin ninguna secuela. Los demás fármacos que tomaba la paciente no son hepatotóxicos, aunque no es descartable que hubiera interacciones entre estos y la gabapentina, porque hay fármacos, incluso alimentos que modifican el metabolismo de otros o inhiben el citocromo P450 aumentando la toxicidad de determinadas drogas.
Se ha publicado un caso de hepatotoxicidad a la gabapentina en un paciente con dosis de 1.500 mg, en este caso aumentaron las aminotransferasas, pero los valores de fosfatasa alcalina y gamma glutamil transferasas (GGT) eran normales (4). Otro caso de hepatototoxidad se ha publicado con un patrón mixto de colestasis y citolisis, asociado a toxicodermia con eosinofilia (5). Este caso es controvertido porque se usaron otras drogas, como el ciprofloxacino, que puede ser responsable de los efectos tóxicos en este paciente (6). Recientemente se ha comunicado un caso de colestasis sin citolisis (7). En nuestra paciente había un dilatación de vías biliares ligera, que no se modificó, cuando ya estaban normales las enzimas hepáticas, por lo que creemos que guardaba relación con la colecistectomía reciente.
La coincidencia de hepatotoxicidad y eosinofilia en el caso publicado que hemos comentado anteriormente (la eosinofilia no apareció en la paciente que presentamos) y su mejora con tratamiento con esteroides, sugieren que el mecanismo responsable puede ser inmunológico. Aunque estamos lejos de conocer el mecanismo por el cual la gabapentina produce lesión hepática, el mecanismo metabólico que es el más frecuente de producción de daño hepático por fármacos no parece el responsable, porque la gabapentina no se metaboliza en el hígado.
Como conclusión de nuestro caso y la revisión de la literatura consideramos que no se justifica la monitorización de los parámetros bioquímicos en el tratamiento con gabapentina, pero la posibilidad de hepatotoxicidad hay que tenerla siempre en cuenta y aunque es un fármaco más seguro que los antiepilépticos antiguos, no es un fármaco inocuo desde el punto de vista hepático.
| CORRESPONDENCIA: Fernando Rodríguez Huertas Servicio de Anestesiología, Reanimación y Terapéutica del Dolor Hospital del Servicio Andaluz de Salud C/ Circunvalación, s/n 11407 Jerez de la Frontera (Cádiz) Tel.: 956 032 018 - Fax: 956 032 239 e-mail: Fer16@telefonica.net |
BIBLIOGRAFÍA
1. Andrade RJ, Lucena MI, Alonso A, et al. HLA class II genotype influences the type of liver injury in drug-induced idiosyncratic liver disease. Hepatology 2004; 39: 1603-12. [ Links ]
2. Dallocchio C, Buffa C, Mazarello P, Chiroli S. Gabapentin vs. amitriptyline in painful diabetic neuropathy: an open label pilot study. J Pain Symptom Manage 2000; 20: 280-5. [ Links ]
3. Rowbotham M, Harnden N, Stacey B, Bernstein P, Magnus-Miller L. Gabapentin for the treatment of postherpetic neuralgia: a randomized controlled trial. JAMA 1998; 280: 1837-42. [ Links ]
4. Baldev KS, White-Scott S. Side effects of add-on gabapentin in individuals with epiepsy, mental retardation, and developmental disabilities. Epilepsia 1997; 38 (Supl. 8): 180. [ Links ]
5. Lasso de la Vega MC, Zapater P, Such J, Perez-Mateo M, Horga JF. Gabapentin-associated hepatotoxicity. Am J Gastroenterol 2001; 96: 3460-2. [ Links ]
6. Hauben M. Re: Lasso de la Vega, et al. Gabapentin as a probable cause of hepatotoxicity and eosinophilia. Am J Gastroenterl 2002; 97: 2156-7. [ Links ]
7. Richardson CE, Williams DW, Kingham GC. Gabapentin induced cholestasis. Br Med J 2002; 325: 635. [ Links ]