Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.12 no.1 Madrid ene./feb. 2005
REVISIÓN
Fisiología y farmacología clínica de los opioides epidurales e intratecales
B. Mugabure1, E. Echaniz1 y M. Marín2
| Mugabure B, Echaniz E, Marín M. Physiology and clinical pharmacology of epidural and intrathecal opioids. Rev Soc Esp Dolor 2005; 12: 33-45.
| ||
| SUMMARY The history of intrathecal and epidural anaesthesia is in parallel with the development of general anaesthesia. The first published report on opioids for intrathecal anaesthesia belongs to a Romanian surgeon, who presented his experience at Paris in 1901. It was almost a century before the opioids were used for epidural analgesia. Epidural and intrathecal opioids are today part of a routine regimen for intra and postoperative analgesia. Over the last 30 years, the use of epidural opioids has became a standard for analgesia in labor and delivery, and for the management of acute and chronic pain. It has been widely asumed that any opioid placed in the epidural or intrathecal spaces will produce highly selective spinally mediated analgesia that is superior to that produced by other analgesic techniques. Unfortunately, this is simply not true. In fact, multiples opioids are currently employed for spinal use despite the fact that clinical evidence has shown that spinal administration does not produce analgesia with a selective spinal mechanism or the analgesia produced is not superior to that produced by intravenous administration. Appropriate use of spinal opioids necessitates under-standing the physiology and clinical pharmacology of these drugs and which opioids produce selective spinal analgesia and which do not. In short, spinal selectivity is greatest for hidrophilic opioids and least for lipophilic opioids. This differences result from inherent differences in the bioavility of opioids at spinal cord opioid receptors. Bioavility differs because lipophilic drugs are more rapidly cleared into plasma than hidrophilic drugs, consequently they produce more early supraspinal side-effects and have a considerably shorter duration of analgesic action. Morphine is probably the most spinally selective opioid currently used in the intrathecal and epidural spaces. Methadone is another opioid that has been shown to have moderate spinal selectivity after epidural administration. However, the long plasma half-life of this opioid results in its acumulation in plasma and greater supraspinal effects over time. Epidural administration of fentanyl offers little or no benefit over the intravenous route except in obstetrics where it does appear to produce modestly selective spinal analgesia. Finally, epidurally administered sufentanil and alfentanil appear to produce analgesia by systemic uptake and redistribution to brainstem opioid receptors. © 2005 Sociedad Española del Dolor. Published by Arán Ediciones, S. L. Key words: Epidural. Intrathecal. Opioids. Spinal. Analgesia.
| RESUMEN La historia de la anestesia intratecal y epidural ha discurrido en paralelo al desarrollo de la anestesia general. La primera reseña publicada sobre el uso de opioides para anestesia intradural la realizó un cirujano rumano, que presentó su experiencia en 1901 en París. Ha pasado casi un siglo hasta conseguir la utilización de opioides por vía epidural. En nuestros días, el uso de opioides intradurales y epidurales constituye una práctica clínica habitual para conseguir analgesia intra y postoperatoria. En los últimos 30 años, el uso de opioides epidurales se ha convertido en rutinario para el tratamiento del dolor del trabajo del parto y del manejo tanto del dolor agudo como crónico. Ha sido ampliamente asumido que cualquier opioide depositado en el espacio epidural o intratecal producirá una analgesia altamente selectiva medular y que esta será superior a la conseguida por otras técnicas analgésicas o vías de administración. Desafortunadamente esto simplemente no es verdad. De hecho, en multitud de ocasiones, los opioides son utilizados vía perimedular a pesar de que la evidencia clínica nos demuestra que no producen un efecto específico medular, o que la analgesia producida no es superior a la conseguida tras su administración intravenosa. Para realizar un uso apropiado de los opioides espinales, debemos comprender adecuadamente la fisiología y la farmacología clínica de estos fármacos y cuál produce analgesia selectiva medular y cuál no. Las diferencias son producto de la biodisponibilidad en los receptores específicos de su biofase medular en la sustancia gris. Esta es menor para los opioides lipofílicos, ya que son aclarados hacia el plasma con mayor rapidez que los hidrofílicos, y consecuentemente producen con mayor antelación efectos adversos supramedulares y su vida media es de menor duración. La morfina es probablemente el opioide con mayor acción selectiva medular tras su administración epidural o intradural. La metadona es otro fármaco al que se le ha observado una selectividad medular moderada tras su administración epidural. Sin embargo, su prolongada vida media puede resultar en su acumulación plasmática y presencia de efectos supraespinales a lo largo del tiempo. La administración epidural de fentanilo ofrece muy pocas ventajas sobre su utilización intravenosa, salvo en obstetricia donde parece producir una analgesia selectiva medular de grado moderado. Finalmente, la administración epidural de sufentanilo o alfentanilo parece producir analgesia por recaptación sistémica y redistribución hacia los receptores opioides cerebrales. © 2005 Sociedad Española del Dolor. Publicado por Arán Ediciones, S. L. Palabras clave: Epidural. Intradural. Opioides. Espinal. Analgesia.
|
1FEA Anestesiología. Médico Adjunto de la Unidad del Dolor.
2FEA Anestesiología. Jefe de Sección de la Unidad del Dolor.
Unidad del Dolor. Hospital de Donostia. Donostia-San Sebastián
Recibido: 04-12-04.
Aceptado: 14-12-04.
1. RECUERDO HISTÓRICO
La historia de la anestesia intratecal y epidural ha discurrido en paralelo a la de la anestesia general. Así como se consideró el éter como la primera anestesia moderna al ser usado por Morton en 1846, Bier hizo historia utilizando cocaína intratecal en 1898. La primera reseña publicada de uso de opioides en una anestesia raquídea se debe a un cirujano rumano, Racoviceanu-Pitesti que presentó su experiencia en París en 1901. Behar y cols. publicaron el primer artículo de uso de morfina epidural para tratamiento del dolor en "The Lancet" en 1979. Ha pasado casi un siglo hasta conseguir la utilización rutinaria de opioides vía espinal como tratamiento analgésico intra y postoperatorio, del trabajo del parto y del dolor crónico (1).
2. INTRODUCCIÓN
La administración epidural e intratecal de opiodes se ha convertido en una práctica habitual en nuestros días y en parte se ha asumido que cualquier opioide localizado en el espacio epidural o intradural, producirá una analgesia selectiva espinal superior a la conseguida por cualquier otra vía de administración. Desafortunadamente esto no es así, y el uso de algunos agentes vía espinal no supera a su efecto vía intravenosa (i.v.). Presentaremos los datos clínicos y científicos para ayudar a decidir qué opiode es adecuado para su uso espinal y cuál no (2).
En la década de los años 70 se identificaron los receptores opioides espinales y se creyó que la analgesia producida no tenía techo, y que estaba ausente de los efectos secundarios de la vía sistémica. Desgraciadamente tras varios fallecimientos se comprobó que los opioides pueden alcanzar los centros superiores cerebrales y causar secundarismos de igual manera, al difundir rostralmente a través del LCR o mediante su redistribución vía sanguínea. Para utilizarlos dentro de un margen de seguridad debemos elegir la vía espinal adecuada (epidural o intradural), el opioide adecuado y la dosis adecuada para cada paciente.
3. FISIOLOGÍA DE LA VÍA ESPINAL
En el ámbito de nuestra revisión, la biodisponibilidad de un opioide tras su administración perimedular se referirá a la capacidad de distribución de dicha sustancia desde su lugar de entrada hasta su punto de acción o biofase medular. Este último reside en el asta posterior de sustancia gris de la médula espinal (lámina II), que está rodeado de un manto de sustancia blanca. Por lo tanto un fármaco epidural deberá atravesar además del contenido del propio espacio epidural, las meninges, el líquido cefalorraquídeo, y la sustancia blanca. Tras la administración intradural lógicamente estos tejidos se reducen. Este viaje a recorrer se podría definir en una persona adulta del orden de decenas de milímetros. En cambio tras su administración sistémica el flujo sanguíneo depositará el opioide a una distancia mucho menor, de tan sólo unos pocas micras de su biofase supramedular, teniendo tan sólo que cruzar la barrera capilar de los vasos cerebrales. Esta diferencia en las distancias de difusión marcará posteriormente las diferentes potencias relativas de cada opioide según su vía de administración (2).
3.1. Espacio epidural
Supone el espacio circunscrito entre las estructuras osteoligamentosas que componen el conducto vertebral, delimitado en su parte posterior por el ligamento amarillo y la duramadre por la cara interna. En la especie humana contiene un importante volumen de tejido graso de manera compartimentada especialmente en la zona antero lateral. El plexo venoso epidural también ocupa un gran espacio y conecta las venas de la pelvis con la vena ácigos, y drena las venas de la grasa epidural y de la médula espinal así como otras provenientes de los cuerpos vertebrales (3,4).
Cualquier droga depositada en el espacio epidural disminuirá su concentración en función de la redistribución a los tejidos periféricos. Esto a su vez dependerá del volumen y de las propiedades fisicoquímicas relativas de dichos tejidos con relación a las del opioide en particular. Las leyes de farmacocinética determinan que una droga hidrofóbica (lipofílica) se distribuirá preferentemente en los tejidos también hidrófobos. Consecuentemente los opioides lipofílicos como sufentanilo o fentanilo, difundirán más en la grasa epidural que en el LCR, y no estarán muy disponibles para su acción sobre los receptores medulares.
Por ello la elección de un opioide cuya captación por los tejidos extra espinales sea mínima redundará en mayor cantidad disponible en su lugar de acción específico medular, condición que cumplen en mayor medida los fármacos hidrofílicos. De todas maneras hay que tener en cuenta los muy diversos entornos que deben atravesar los fármacos, y que determinarán su biodisponibilidad, como son la grasa epidural, los ligamentos epidurales, las meninges, el LCR, la sustancia blanca medular, la mielina, las membranas axonales, la sustancia gris medular, el líquido del espacio extracelular, las organelas intracelulares, los plexos venosos y otros muchos.
3.2. Meninges
3.2.1. Duramadre
Es esencialmente acelular, y exceptuando algunos fibroblastos se compone de colágeno y fibras de elastina. Sin embargo, está moderadamente vascularizada en la cara adyacente a la aracnoides, supuestamente para aportarle nutrientes dado que su función es desconocida. Esta red capilar actúa también aclarando parte de los opioides epidurales, durante su difusión hacia el espacio subaracnoideo (5-7). Debido a que las moléculas lipofílicas son más permeables a través de las células endoteliales capilares, este es otro lugar donde dichos opioides podrían tener un mecanismo de aclaramiento más importante. Estos hechos tienen una corroboración en estudios en animales (8), al comprobar que la adición de adrenalina epidural reduce el flujo sanguíneo en la duramadre, en paralelo a la reducción en el aclaramiento de la droga administrada epidural.
Debido a que la duramadre es la más gruesa de todas las meninges, se ha sugerido que sea la barrera más importante en la difusión de fármacos espinales en su discurrir entre el espacio epidural e intradural, sin embargo esto no es cierto. Los datos experimentales demuestran claramente que es la aracnoides la que realiza dicha función (9). Este hecho explica por qué el LCR está confinado al espacio subaracnoideo, y no al espacio subdural, ya que es impermeable al agua, electrolitos y proteínas contenidas en el propio LCR.
3.2.2. Aracnoides
Está compuesta de 6 a 8 capas solapadas y entrelazadas de células epiteliales unidas por uniones tipo "tight juntions" (10,11). Esta arquitectura celular permite muy poca permeabilidad, y de hecho la aracnoides representa el 90% de la resistencia a la difusión de fármacos (9).
La permeabilidad depende de la liposolubilidad de la molécula, pero no en la medida que podíamos esperar. La relación entre el carácter lipofílico y la permeabilidad aracnoidea es bifásica (12); mientras la liposolubilidad aumenta también lo hace la permeabilidad, pero sólo hasta una cifra moderada del coeficiente de distribución octanol/buffer de aproximadamente 125. A partir de aquí, a medida que la liposolubilidad aumenta, la permeabilidad disminuye significativamente. Consecuentemente la permeabilidad de la morfina, coeficiente de distribución octanol/buffer de 1 y de sufentanilo, 1787, es similar. Este hecho se ha comprobado en todos los tejidos estudiados, y así la córnea, la piel e incluso la barrera hematoencefálica presentan la misma relación entre liposolubilidad y permeabilidad, aunque con distintos puntos de inflexión.
La razón de esta relación bifásica radica en el hecho de que los fármacos deben difundir a través de las barreras lipídicas de las células madre de la aracnoides, y luego por el líquido del espacio extra e intracelular. Los fármacos muy liposolubles realizan bien la primera parte pero mal la segunda y los hidrosolubles al revés. Por ello el hecho de que la aracnoides sea la principal barrera a la permeabilidad, explica que los opioides de liposolubilidad intermedia consiguen un mejor movimiento a través del tejido.
Otro aspecto es la presencia de granulaciones o vellosidades aracnoideas, situadas en la región de los manguitos de las raíces nerviosas espinales que contactan con las venas epidurales, o libremente en el espacio epidural. Son similares a las presentes en el cerebro cuya función es la reabsorción del LCR, y se ha sugerido que podrían servir para el paso de los fármacos hacia el LCR, pero se ha demostrado que realizan un transporte activo por pinocitosis, no por poros abiertos, de carácter unidireccional hacia el exterior del espacio subaracnoideo (13).
3.2.3. Piamadre
La piamadre descansa sobre la superficie de la médula espinal y está compuesta por células similares a las de la aracnoides. La diferencia más importante es que está constituida sólo por una capa de espesor celular y que no contiene uniones oclusivas intercelulares y es fenestrada. Por lo tanto presenta muy poca dificultad a la difusión de fármacos.
3.3. Líquido cefalorraquídeo
Exceptuando los efectos de la baricidad y de la energía cinética producida por la inyección, los opioides que alcanzan el LCR se deben comportar de igual manera tanto si lo hacen por inyección directa o por difusión epidural.
Una de las propiedades clínicas que les distinguen de otros fármacos es su propensión a la progresión rostral en el LCR. Se ha sugerido que los opioides hidrofílicos lo hacen de manera más rápida y en una extensión mayor que los lipofílicos, sin embargo esto es correcto sólo parcialmente. Respecto a la progresión rostral todos los opioides se desplazan con casi exactamente la misma velocidad. Para entender porqué esto es así, explicaremos los dos mecanismos por los cuales un fármaco se desplaza en el LCR: la difusión simple y la dinámica de fluidos. El rango de difusión simple de cualquier molécula en un líquido ideal, es proporcional a la temperatura de dicho líquido e inversamente proporcional a la raíz cuadrada del peso molecular de la molécula. Debido a que la temperatura del LCR es constante, y a que el resultado de dicha raíz cuadrada es semejante para todos los opioides (rango 17-20), los porcentajes de difusión son similares para todos los opioides y no pueden explicar las diferencias de extensión en el LCR (2).
La principal causa de extensión de un fármaco en el LCR es el propio movimiento del LCR. La energía necesaria proviene del flujo sanguíneo pulsátil en el interior del SNC, que de manera alternante, modifica el volumen cerebral y en menor medida el de la médula espinal, actuando como un émbolo que fuerza al LCR en dirección caudal por la superficie dorsal de la médula espinal, y en dirección craneal por la superficie ventral de la misma, transportando en suspensión las moléculas diluidas en él (14).
Llegados a este punto nos preguntamos; ¿cómo se pueden explicar las diferencias entre las dosis de opioide que por difusión rostral alcanzan los centros cerebrales superiores? La respuesta reside en los diferentes porcentajes de aclaramiento de dichos fármacos del LCR. Si un fármaco se elimina rápidamente por aclaramienro del LCR, quedará una cantidad remanente muy pequeña para realizar una progresión rostral. Por ejemplo, el aclaramiento del LCR en humanos del sufentanilo (27 µg.kg-1.min-1) es casi 10 veces el valor de la morfina (2,8 µg.kg-1.min-1), por ello esta última residirá más tiempo en el LCR y tendrá mayor posibilidad de difusión rostral y de provocar efectos secundarios supraespinales como sedación y depresión respiratoria (15). Sin embargo los opioides lipofílicos, también pueden causarlos, al ser más rápidamente redistribuidos vía sanguínea y alcanzar de esta forma el SNC.
La importancia clínica respecto a la analgesia no es conocer la rapidez de aclaramiento o extracción de un fármaco del LCR, sino más bien su destino, y según su biodisponibilidad cuando finalizará su acción. Obviamente, un fármaco dirigido hacia el asta posterior de la médula espinal, tendrá una mayor biodisponibilidad que aquel dirigido al plasma o al espacio epidural.
4. DISTRIBUCIÓN FARMACOLÓGICA EN LA MÉDULA ESPINAL
Se han sugerido tres mecanismos para explicar la difusión de opioides entre el espacio epidural y la médula espinal: la difusión a través de las vellosidades aracnoideas en los manguitos de las raíces nerviosas espinales (13), la recaptación por las arterias radiculares epidurales en su camino de irrigación medular (16) y la difusión a través de las meninges (el único que ha podido ser comprobado experimentalmente) (12).
Los fármacos opioides diluidos en el LCR deben alcanzar el interior de la médula espinal para actuar sobre sus receptores específicos. De igual manera que sucede en el espacio epidural, el SNC contiene un grupo de microentornos heterogéneos entre los cuales estos fármacos deben difundir para progresar hacia su lugar de acción. Este hecho quedó bien demostrado por el ya clásico estudio experimental de Herz y Teschemacher (17).
Estos investigadores administraron morfina, dihidromorfina y fentanilo marcados radioactivamente dentro del LCR del ventrículo lateral en conejos, y midieron la distancia de progresión en los tejidos adyacentes del SNC a lo largo del tiempo. Encontraron que en los primeros 7 min los tres fármacos penetraban prácticamente lo mismo (unas 700 micras), pero a medida que pasaba el tiempo, el fentanilo no podía progresar más y era aclarado del cerebro en unos 120 min. Opuestamente a esto, la morfina e hidromorfina seguían penetrando más profundamente y al finalizar el tiempo del estudio, unas 5 horas, la morfina lo había hecho en una profundidad de 3.000 micras. Pero quizás todavía más importante que este hecho resultaba la observación de que el fentanilo demostraba una preferencia por la sustancia blanca en oposición a los fármacos hidrosolubles que lo tenían por la sustancia gris.
La sustancia blanca está formada principalmente por membranas axonales plasmáticas que sucesivamente están envueltas por múltiples capas de células de Schwann, por lo que está constituida por lípidos en un 80%, lo que conlleva una mayor afinidad por los opioides lipofílicos como fentanilo o sufentanilo. Como la sustancia gris carece de mielina, es relativamente hidrofílica, y tiene una mayor afinidad por los opioides hidrofílicos como la morfina.
Los receptores opioides se localizan en el interior de la sustancia gris de la médula espinal, que está rodeada de un manto de sustancia blanca. Los opioides lipofílicos presentes en el LCR difundirán en la sustancia blanca y desde allí serán aclarados al plasma con rapidez lo que explicaría su alto volumen de distribución tras su administración intratecal. En contraste, los opioides hidrofílicos no penetrarán tan bien pero debido a su mayor tiempo de estancia en el LCR o a su difusión a través del líquido extracelular de la sustancia blanca alcanzarán los receptores específicos en la profundidad de la sustancia gris. Consecuentemente, la biodisponibilidad sobre los receptores opioides medulares de la morfina supera a la del fentanilo o sufentanilo.
Este hecho lo comprobaron Ummenhofer y cols. (18) en un modelo experimental en cerdos, al medir las concentraciones en el espacio extracelular de la médula espinal tras la administración intratecal de morfina, alfentanilo, sufentanilo y fentanilo a dosis equimolares. La concentración de morfina excedía a todos los fármacos lipofílicos, alcanzando el triple de valor y duración a lo largo del tiempo, calculando la exposición a la médula espinal como el área bajo la curva de la relación concentración/tiempo, tanto en la inyección lumbar L2-3, o torácica T11. Observaron como el volumen de distribución mantenía una relación directa con la liposolubilidad; morfina < alfentanilo < fentanilo < sufentanilo. Finalmente constataron que la velocidad de aclaramiento era mucho más rápida para el alfentanilo, un opioide de solubilidad intermedia.
También McQuay (19) demostró que la potencia analgésica de los opioides intratecales en la rata presenta una relación inversa con la liposolubilidad.
Bernards y cols. (20,21) realizaron un completísimo estudio en un modelo animal (cerdos anestesiados) administrando en el espacio epidural morfina, alfentanilo, sufentanilo y fentanilo, y recogiendo por microdiálisis muestras del espacio intradural e intratecal a lo largo del tiempo. También obtuvieron muestras venosas de una vía central y de las venas epidurales y se estudiaron múltiples parámetros farmacocinéticos de dichos fármacos en cada compartimento.
Demostraron que en el espacio epidural lumbar, existía una correlación importante entre la liposolubilidad y el tiempo de residencia ("mean residence time") del opioide y la concentración de las venas epidurales, siendo dicho tiempo mayor cuanto más lipofílico fuera. Así mismo, la vida media de eliminación del espacio epidural lumbar y la concentración en la grasa epidural mantenían una correlación directa con la liposolubilidad; sufentanilo > fentanilo > alfentanilo > morfina. Por dicho motivo los opioides lipofílicos no producían analgesia vía espinal, al no tener acceso a la médula por su secuestro epidural o recaptación vascular.
Sin embargo en el espacio epidural torácico, el peso molecular (PM) del opioide, y no la liposolubilidad, se correlacionaba directamente con la vida media de eliminación epidural; alfentanilo > sufentanilo > fentanilo > morfina. El rango de difusión era inversamente proporcional al PM siendo la morfina el opioide que mayor progresión rostral alcanzaba.
En el espacio intratecal, la farmacocinética no se parecía a la epidural, existiendo una relación pero no 1/1, siendo la vida media de eliminación de los opioides lipofílicos similar entre ambos compartimentos, aunque limitada por las barreras meningeas y la de la morfina era mayor debido al bajo nivel de aclaramiento del LCR. Por ello la mayor disponibilidad en los receptores medulares, por su carácter hidrofílico, de la morfina epidural e intradural, la convertían en el opioide con mayor efecto analgésico espinal.
Por último añadieron adrenalina (1/200.000) a los opioides para comprobar si el efecto vasoconstrictor local era efectivo para disminuir la absorción sanguínea. En el espacio epidural lumbar, la adrenalina aumentaba la vida media y disminuía el aclaramiento epidural de la morfina, hecho que no sucedía a nivel torácico. En cambio el efecto sobre fentanilo y sufentanilo era disminuir el tiempo de residencia y el de eliminación epidural. Postularon que los fármacos lipofílicos se aclaran del espacio epidural por una vía diferente a los hidrofílicos pudiendo ser esta última por pequeños capilares como los de la duramadre, sobre los que actuaría la adrenalina, y no por las venas epidurales.
Este hallazgo coincidía con el dato ya conocido del efecto de la adición de adrenalina a los anestésicos locales. Ya que prolonga el bloqueo nervioso y disminuye el aclaramiento plasmático de aquellos que se comportan como hidrofílicos como lidocaína y mepivacaína, y carece de dicho efecto o en un grado muy pequeño en los lipofílicos como la bupivacaína o la etidocaína.
Concluyeron que sus hallazgos indicaban que la farmacocinética espinal de estos opioides era compleja y en algunos casos iba en contra de lo que dictaba la intuición, y que los datos apuntaban claramente que la biodisponibilidad medular guardaba una relación inversa con la liposolubilidad y que los efectos de la adrenalina no pueden ser predecidos a partir de la concentración plasmática del fármaco.
El mismo autor (22) ha realizado recientemente una revisión sobre los estudios experimentales en animales desarrollados en los últimos años, en los cuales se obtenían medidas de las concentraciones de los opioides en el espacio epidural, intradural, en la médula espinal y en los tejidos perimedulares, siempre tras su administración espinal. Estos datos, ayudan a entender lo que múltiples ensayos clínicos apuntan sobre el efecto analgésico de los opioides lipofílicos: se debe en parte, si no exclusivamente, a reabsorción plasmática y redistribución hacia los receptores opioides cerebrales.
5. FARMACOLOGÍA CLÍNICA DE LOS OPIOIDES ESPINALES
5.1. Opioides epidurales
Cualquier opioide administrado en cualquier lugar del cuerpo humano producirá un efecto analgésico debido a su absorción plasmática y redistribución al SNC. Por ello, el hecho de que un opioide depositado en el espacio epidural produzca analgesia no es un dato que confirme su acción selectiva espinal. Consecuentemente, la decisión de utilizar un opioide determinado en el espacio epidural debe basarse en una apropiada evidencia de que su acción está determinada en los receptores específicos medulares. Pero incluso este hecho por sí mismo no justifica su empleo, ya que debe demostrar que la analgesia conseguida es superior a las otras vías de administración menos invasivas como la intravenosa con ACP (analgesia controlada por el paciente), con menos efectos secundarios o ambas cosas a la vez (2).
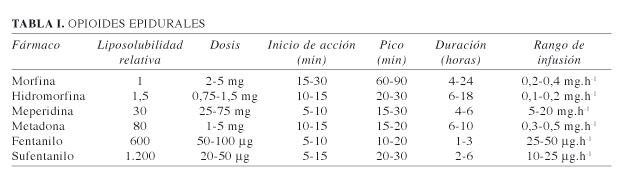
Las diferentes dosis de administración epidural, y la liposolubilidad relativa a la morfina están detalladas en la Tabla I.
5.1.1. Morfina epidural
La morfina se ha utilizado ampliamente para analgesia epidural e intratecal en pacientes quirúrgicos y en dolor oncológico, y se podría considerar como el "gold-standard" de los opioides espinales. Debido a su efecto medular, la dosis recomendada es mucho menor que la parenteral y es del orden de 3-5 mg.día-1, aunque dosis menores han conseguido buen efecto analgésico. Se recomienda no pasar de 10 mg.día-1. La dosis intratecal es 1/10 de la calculada vía epidural y de vida media más larga, de hasta 24 h (23). Las preparaciones recomendadas para este uso deben estar libres de conservantes y debe constar su aceptación para el uso espinal, aunque la morfina genérica sin conservantes diluida convenientemente, también puede ser válida (24).
Existen numerosos estudios que demuestran que la morfina es un fármaco adecuado para su utilización epidural y de entre todos ellos destacaremos el de Kilbride y cols., (25) sobre dolor postoperatorio en cirugía colorrectal, comparando el uso de morfina epidural, intramuscular e intravenosa en forma de ACP. Los pacientes en el grupo de morfina epidural, presentaban una analgesia de mayor calidad, con un consumo diario menor, alrededor de un 25% de la dosis necesitada en el segundo grupo en calidad que era el intravenoso, y con menor número de efectos secundarios salvo el prurito, que era de menor incidencia en el grupo intramuscular, y en el intravenoso.
5.1.2. Fentanilo epidural
Durante los años 80 se realizaron múltiples estudios sobre los opioides lipofílicos en el espacio epidural y por supuesto concluían que producían analgesia. Desafortunadamente ninguno con los controles adecuados para comprobar si estaba mediada por un efecto espinal.
Uno de los primeros investigadores que se cuestionó este hecho fue Loper y cols. (26). Estudió pacientes que tras cirugía reconstructiva de rodilla se trataron con fentanilo epidural o intravenoso, no encontrándose diferencias entre la calidad analgésica ni los efectos secundarios ni en las concentraciones plasmáticas del fármaco tras 18 h de administración. Concluyeron que la analgesia estaba mediada por recaptación sistémica y redistribución cerebral. Glass y cols. (27) realizaron un ensayo clínico controlado doble ciego comparando la analgesia postoperatoria mediante ACP intravenosa y AECP (analgesia epidural controlada por el paciente), sin encontrar diferencias entre ellos y concluían de igual manera a los autores anteriores.
Se cuestionaron algunos trabajos debido a que el fentanilo epidural no había sido depositado en el espacio epidural a nivel metamérico. Guinard y cols. (28) despejaron esta duda al realizar un estudio en dolor postoperatorio tras toracotomía, comparando la analgesia con ACP intravenosa, AECP epidural lumbar, y AECP epidural torácica. No hubo diferencias entre los grupos ni en reposo ni frente a la tos, ni en efectos secundarios y concluyeron que no encontraron efecto analgésico selectivo espinal.
Todos estos estudios se realizaron con el fentanilo como único fármaco, pero la práctica clínica habitual nos conduce a asociarlo a un anestésico local (AL). Berti y cols. (29) estudiaron 2 grupos que recibieron ropivacaína 0,2% epidural, como terapia única y la misma concentración de AL asociada a 2 µg.ml-1 de fentanilo para tratamiento de dolor postoperatorio. Encontraron una ligera disminución de la dosis total de AL administrada, pero sin diferencias en la puntuación EVA, ni en el grado de bloqueo motor, ni en las dosis de rescate de ketoprofeno o episodios de hipotensión o bradicardia. Sin embargo sí constataron más casos de desaturación (Sat O2 < 90%) en el grupo del fentanilo.
Tan y cols. (30), en un ensayo clínico controlado sobre dolor postoracotomía, estudiaron la concentración óptima de fentanilo asociada a bupivacaína 0,1% epidural, y concluyeron que la dosis de 5 µg.ml-1 conseguía el balance más equilibrado entre el control del dolor y los efectos adversos.
Recientemente Ginosar y cols. (31) han realizado un estudio sobre voluntarios sanos para intentar confirmar la hipótesis sobre el diferente lugar de acción del fentanilo epidural según se administre en forma de bolos o en infusión continua. En su grupo observaron cómo la administración en bolos producía una analgesia segmentaria medular y en cambio tras la administración en infusión continua se conseguía analgesia vía sistémica.
Fentanilo epidural en la paciente obstétrica
En contraposición a lo expuesto anteriormente, los estudios sobre el fentanilo epidural en el trabajo del parto, parecen demostrar una selectividad espinal de este opioide.
D´Angelo y cols. (32) estudiaron a embarazadas durante el parto, mediante analgesia epidural (AECP) con infusión continua de bupivacaína 0,125%, que dividieron en cuatro grupos, perfusión continua de fentanilo epidural (20 µg.h-1), fentanilo i.v. (20 µg.h-1), o de suero salino fisilógico por ambas vías. Encontraron que la dosis de bupivacaína fue menor en el grupo del fentanilo epidural sin observar diferencias en el número de efectos secundarios. Sin embargo este último dato en el grupo de mayor consumo de AL, el de perfusión continua de suero salino, les hacía dudar de la eficacia clínica de la mezcla de fentanilo con AL.
Lee y cols. (33) también estudiaron el dolor del trabajo del parto, con analgesia epidural con ropivacaína 0,1%, ropivacaína 0,1% más fentanilo 2 µg.ml-1, y ropivacaína 0,2% en infusión continua a 10 ml.h-1. La calidad analgésica fue buena en el primer estadio del parto con ropivacaína 0,1%, y la asociación de fentanilo mejoraba la analgesia equiparándola al grupo de ropivacaína 0,2%. No hubo diferencias entre el número de rescates o de efectos secundarios salvo más incidencia de hipotensión en el de la ropivacaína al 0,2%.
Ambos trabajos concluyeron que la adición de fentanilo epidural en el trabajo del parto reduce la cantidad de AL para conseguir una analgesia equivalente posiblemente por un efecto directo espinal, pero no mejora la satisfacción de la paciente ni reduce la incidencia de efectos adversos.
Ginosar y cols. (34), en un estudio más reciente, estudiaron el trabajo del parto en nulíparas bajo la administración epidural de un volumen de 20-30 ml de bupivacaína 0,125% hasta conseguir la desaparición total del dolor, y continuaron con una infusión epidural de 20 ml.h-1 de bupivacaína 0,0625%, a la cual añadieron en dos grupos, fentanilo epidural o intravenoso al mismo ritmo de 30 µg.h-1. Determinaron las diferentes concentraciones medias efectivas de bupivacaína en infusión continua durante el trabajo del parto y que la infusión de fentanilo era más de tres veces, más potente cuando se administraba vía epidural, que cuando se hacía vía intravenosa, sugiriendo una acción selectiva espinal en estas condiciones.
El motivo de este comportamiento en mujeres embarazadas no está claro pero se le dan varias explicaciones. Muchos estudios en humanos y otros mamíferos han demostrado que los sistemas analgésicos endógenos están activados durante el parto. Si los opioides endógenos están aumentados durante el trabajo del parto, la cantidad necesaria de fentanilo exógeno para conseguir la misma analgesia será menor (35,36). De la misma manera, si los requerimientos de AL están disminuidos en la mujer embarazada, la dosis de opioide necesaria para conseguir efecto analgésico en presencia de dicho AL será también menor (37).
5.1.3. Sufentanilo epidural
Se sugirió que debido a su gran liposolubilidad, este opioide sería una buena opción para su uso epidural en el tratamiento del dolor postoperatorio. Sin embargo el uso de sufentanilo epidural produce un efecto analgésico mediado por recaptación vascular y posterior redistribución cerebral. Miguel y cols. (38) realizaron un estudio tras cirugía abdominal con sufentanilo intravenoso o epidural torácico bajo, y no encontraron ninguna diferencia entre los dos grupos observados. Hasta el momento actual ningún estudio ha demostrado una selectividad espinal de este fármaco, por lo que su uso epidural como única terapia debería de ser abandonado.
5.1.4. Alfentanilo epidural
Como hemos comentado anteriormente, en estudios experimentales en animales, la liposolubilidad intermedia del alfentanilo lo convierte en el opioide más permeable a través de las meninges. Pero esto no redunda en una buena efectividad clínica cuando es depositado en el espacio epidural, debido a que es muy permeable en todo tipo de tejidos y es aclarado muy rápidamente hacia el plasma desde el espacio epidural y la médula espinal, por lo que la analgesia se produce por redistribución sistémica al SNC.
Coda y cols. (39) realizaron un estudio usando un modelo experimental de la percepción del dolor sobre la mano o el pie, como prueba del efecto metamérico o sistémico, tras la administración de alfentanilo en infusión epidural o intravenosa. Calcularon la farmacocinética particular de cada individuo, para equiparar las perfusiones por ambas vías, de tal manera que la concentración de alfentanilo en plasma fuera la misma en cada uno independientemente de la vía de administración. No hubo diferencias en la puntuación EVA, ni en el número de efectos secundarios ni en el territorio estudiado. Concluyeron que no encontraron ningún efecto analgésico espinal de dicho opioide.
Van der Nieuwenhuyzen y cols. (40) realizaron otro estudio sobre dolor postoperatorio con infusiones de bupivacaína 0,125% epidural, combinada con con alfentanilo intravenoso o epidural, ambas a 0,36 mg.h-1. No encontraron diferencias entre ninguno de los parámetros estudiados.
5.1.5. Otros opioides epidurales
Todos los opioides disponibles para la práctica clínica han sido utilizados para conseguir analgesia tras ser depositados en el espacio epidural, pero desgraciadamente no existen estudios detallados sobre muchos de ellos. En general los opioides hidrofílicos, como hidromorfina o heroína, se comportan como la morfina y se supone en ellos una acción selectiva espinal. La meperidina nos presenta un caso especial debido a que sus propiedades como anestésico local no nos permiten determinar cuál es el mecanismo por el que produce analgesia espinal. Además la acumulación de su metabolito, normeperidina, le hace inviable para uso continuado en el espacio epidural (2).
La metadona es un opioide al cual se le atribuye una moderada actividad analgésica espinal, pero su larga vida media puede resultar en acumulación plasmática y presencia se efectos secundarios supraespinales. Sin embargo esto no ha impedido su uso rutinario en nuestro país en los últimos años con buenos resultados. Parramon y cols. (41) estudiaron el dolor postoperatorio tras toracotomía, mediante ACP intravenosa o epidural con metadona. Se administró una dosis de carga de 0,05 mg.kg-1 seguida de una perfusión de 0,5 mg.h-1. La dosis de rescate fue 0,5 mg con un tiempo de cierre de 10 min, y un máximo de 4 dosis/hora. La puntuación EVA fue menor en grupo epidural a partir de la 2ª hora, y la dosis total administrada fue también menor en dicho grupo. No hubo diferencias en cuanto a número de efectos adversos. Concluyeron, que independientemente de su posible efecto sistémico por microabsorción plasmática, la metadona presentaba una acción espinal intrínseca, y que ambos métodos producían una analgesia de buena calidad.
5.2. Opioides intradurales
Cualquier opioide inyectado vía intratecal, se presupone que producirá parte de su efecto analgésico por un mecanismo espinal directo. La principal diferencia, respecto a la administración epidural, reside en la duración del efecto clínico, la velocidad de redistribución hacia los centros cerebrales y el mecanismo por el cual el fármaco alcanza dichos centros.
En general, los opioides lipofílicos producen una analgesia de corta duración, de 1-3 horas, que los convierte en una mala opción para analgesia posoperatoria tras punción intradural única, pero útiles en el tratamiento del dolor del trabajo del parto, especialmente en el primer estadio o en el expulsivo. Los efectos adversos supraespinales que producen, aparecen con mayor rapidez que con los opioides hidrofílicos, debido a que las dosis que debemos administrar son relativamente altas y su pico plasmático más precoz.
Para intentar explicar las diferencias entre ambos grupos, qué parte de la analgesia observada es espinal o supraespinal, cuándo aparece esta última y si es necesaria para el efecto clínico final alcanzado, compararemos un representante de cada uno de ellos, la morfina y el sufentanilo.
La morfina es un opioide que depositado en el espacio intratecal, a dosis de 100-200 µg, produce una analgesia que puede durar hasta 24 h (42). Este dato no la convierte en una buena opción para su uso en anestesia espinal en pacientes de cirugía ambulatoria por la alta incidencia de efectos secundarios de duración prolongada, como la retención urinaria (43). Esta larga duración no es posible conseguirla vía i.v., ni por supuesto con las mismas dosis administradas, lo que demuestra su efecto espinal. Tampoco es fácilmente entendible su duración clínica, cuando la vida media de eliminación del LCR es del orden de 73-140 min, lo que supone un tiempo de estancia máximo de 6-12 h (44,45). La explicación más racional es que el tiempo de persistencia en su biofase medular es mayor que el del LCR, aunque el hecho de ser un fármaco con una progresión rostral muy importante, produce un efecto supraespinal que podría ser el complemento a la analgesia observada de larga duración. Este efecto sinérgico, o aditivo espinal/supraespinal, ha sido comprobado en modelos animales pero es desconocido si ocurre de la misma manera en humanos (46,47). Este punto es importante porque nos replantearía el hecho de prohibir sistemáticamente el uso de opioides por vía sistémica en un paciente que los está recibiendo vía espinal.
El sufentanilo es un claro ejemplo de comportamiento de opioide lipofílico y ha sido ampliamente estudiado pera observar su efecto analgésico vía intradural. Lu y cols. (48) examinaron el efecto analgésico de este fármaco en mujeres voluntarias, midiendo dolor basal y luego tras la administración de sufentanilo intratecal a dosis de 12,5, 25, o 50 mg, en un modelo experimental de presión tibial. Encontraron que las tres concentraciones disminuían el dolor, pero acompañadas de depresión respiratoria, determinada por Pa CO2, y de hecho coincidía en el tiempo con la menor puntuación en la escala del dolor. Debido a que claramente es un efecto supraespinal concluyeron que era razonable suponer que parte de la analgesia conseguida era mediada por un efecto central, aunque no se puede determinar qué medida corresponde a cada lugar de acción. También determinaron las concentraciones plasmáticas de los tres grupos, y todas excedían la concentración mínima para producir analgesia en humanos (49). La rápida redistribución cerebral, explicaría muchos de los casos de depresión respiratoria encontrados en su uso en el trabajo del parto (50-52).
Otro aspecto muy importante es la potencia relativa según su vía de administración: en el compartimento intradural, los opioides lipofílicos se comportan con menor potencia relativa que la morfina, respecto a su administración intravenosa. Cuando inyectamos fentanilo sistémico es alrededor de 100 veces más potente que la morfina, y el sufentanilo unas 1.000. Cuando utilizamos morfina intratecal lo hacemos en dosis de 100 mg y producen una calidad analgésica similar a 10 mg de sufentanilo, pero de mayor duración. Por ello el sufentanilo intradural es tan sólo 10 veces más potente que la morfina por esta misma vía. La dosis eficaz intratecal de fentanilo es de 25-50 mg tan sólo el 25-50% de la dosis utilizada de morfina, lo que implica una potencia de alrededor de 2-4 veces mayor.
Esta menor potencia relativa de los opioides lipofílicos intratecales se debe probablemente a una baja biodisponibilidad en los receptores específicos medulares, debido a una mayor difusión en los tejidos lipofílicos de dicho compartimento, lo que hace que sean necesarias mayores dosis para conseguir una analgesia adecuada y por ello se detectan mayores picos plamáticos tras su administración por esta vía, que con los opioides hidrofílicos.
Recientemente, Eisenach y cols. (53), han formulado la hipótesis del papel que jugaría la adenosina, con efecto analgésico en humanos, en la acción mediada por los opioides vía intratecal, y opinan que aunque el papel de la liberación de adenosina en la médula espinal para la activación de los receptores opioides es controvertido en los estudios de laboratorio, en su estudio en voluntarios sanos, la administración de opioides intratecales (morfina y fentanilo) aumentaba la concentración de adenosina, evento que no sucedía tras la administración intravenosa de remifentanilo.
5.2.1. Fentanilo intradural
El fentanilo es uno de los fármacos más usados para producir analgesia tras su administración intratecal, especialmente asociado a anestésicos locales. Varios trabajos han demostrado su acción espinal. Reuben y cols. (54) estudiaron el dolor postoperatorio tratado con fentanilo intradural tras cirugía vascular de extremidad inferior, y encontraron que la duración de la analgesia aumentaba a medida que incrementaban la dosis de opioide desde 5 µg (20 min), hasta 40 µg (300 min), sin notar mejoría con la dosis de 50 µg. Aunque no se incluyó un grupo control de fentanilo i.v., es razonable asumir que 40 mg vía sistémica no producirán una analgesia de casi 5 horas.
Liu y cols. (55) estudiaron la duración de la analgesia y el bloqueo motor en voluntarios que recibieron 50 mg de lidocaína y 20 µg de fentanilo intradural en una ocasión y posteriormente la misma dosis sin opioide. La adición de fentanilo prolongó la duración del bloqueo sensorial sin afectar al motor. En un nuevo estudio, los mismos autores (56) advirtieron que dicha asociación de fármacos intradurales era comparable al efecto de asociar adrenalina a la lidocaína, sin el efecto indeseable de prolongar el bloqueo motor.
En la paciente obstétrica también ha sido demostrado su efecto medular. Jain y cols. (57), estudiaron los efectos de varias dosis de fentanilo (10 ó 20 µg), o suero salino asociadas a dosis bajas de bupivacaína (7,5 mg) intratecal pera cesárea en embarazadas hipertensas. Concluyeron que la adición de 20 µg de fentanilo, conseguía el mejor efecto analgésico, de mayor duración (5,55 ± 1,18 h), sin diferencias en el número de efectos adversos hemodinámicos o en la puntuación Apgar del neonato.
Aragón y cols. (58) comprobaron cómo la adición de 50 µg de fentanilo a 12,5 mg de bupivacaína hiperbara en anestesia subaracnoidea para cesáreas es una técnica eficaz, que permite un aumento en la intensidad y duración del bloqueo sensitivo, prolongando la analgesia postoperatoria durante más de 6 h sin repercusión fetal y con baja incidencia de efectos adversos exceptuando el prurito de carácter leve.
Wong CA y cols. (59), realizaron un ensayo clínico controlado doble ciego, para determinar la dosis óptima de fentanilo (0, 5, 10, 15, 20, 25 µg), más bupivacaína intradural (2,5 mg) en el tratamiento del dolor del trabajo del parto en su primer estadio (dilatación cervical de 3-5 cm). Los resultados sugerían que la dosis óptima era de 15 µg, ya que conseguía una mejor calidad analgésica que dosis menores, y no era superada por dosis mayores. El prurito fue mayor en todos los grupos que recibieron fentanilo.
Respecto a la potenciación de la administración intravenosa sobre la intradural, Karamaz y cols. (60), realizaron un estudio en el que asociaron fentanilo intradural 20 µg, o suero fisiológico a una dosis común de 10 µg de bupivacaína. Posteriormente administraron 50 mg de fentanilo intravenoso a dos de los tres grupos. Observaron que la coadministración de fentanilo (i.v./intradural) produjo una mayor progresión cefálica del nivel sensitivo.
El grado de selectividad medular de los opioides que han sido estudiados para el tratamiento del dolor postoperatorio, aparecen reflejados en la Tabla II.
6. CONCLUSIONES
En la práctica clínica diaria, los anestesiólogos nos vamos a encontrar numerosas ocasiones en las que deberemos decidir qué opioide perimedular administrar, en qué dosis y por qué vía, intradural o epidural, si hacerlo en forma de bolo único o en perfusión continua, si asociarlo a un anestésico local, e incluso si debemos pautar otro opioide vía sistémica. Todo ello nos puede ocurrir en el curso de una anestesia quirúrgica, en el tratamiento del dolor agudo (postoperatorio o no), en la analgesia del trabajo del parto o el ámbito de una Unidad de Dolor Crónico. Esta decisión conlleva un acto de reflexión médica, que debemos fundamentar sobre unas bases fisiológicas y farmacológicas, que contribuyan a esclarecer las dudas que se nos planteen en el desarrollo de nuestra profesión.
Queremos insistir en que la analgesia obtenida tras la administración perimedular de un opioide no necesariamente se consigue por un mecanismo medular selectivo. Y aunque así fuera, debería superar en calidad analgésica a las otras vías de administración que nos podamos plantear como alternativa, o al menos igualarla con menor incidencia de efectos adversos, que son frecuentes a dosis terapéuticas. Debemos consensuar la técnica con el paciente y explicarle los posibles riesgos y complicaciones. Así mismo, es nuestra obligación detallar al personal sanitario el procedimiento a seguir sobre las órdenes médicas, los cuidados y la vigilancia necesaria en el curso de un tratamiento con opioides mayores, así como determinar un médico responsable en caso de ser necesaria una consulta de urgencia.
La farmacocinética espinal es muy compleja y deberemos esperar nuevos estudios para definir el comportamiento de los opioides tras ser administrados vía perimedular, comprobar su lugar específico de acción y sus vías de aclaramiento, su posible efecto sinérgico tras su doble administración (espinal/i.v.), así como el mecanismo de producción de efectos adversos, su prevención y tratamiento.
A pesar de todo ello nos atreveremos a formular unos consejos prácticos que pueden ser útiles:
-La biodisponibilidad espinal, entendida como la cantidad de fármaco que se une a los receptores medulares específicos, es mayor para los opioides hidrofílicos como morfina, hidromorfina o heroína, que para los lipofílicos.
-La morfina es el opioide con mayor selectividad medular tras su administración perimedular, con el cual se comparan todos los demás.
-La administración epidural de fentanilo parece tener una selectividad medular en la paciente obstétrica. En el resto, tras la administración en bolo epidural, también parece comportarse de la misma forma, hecho que no parece confirmarse tras su uso en perfusión continua epidural, aunque sí permite disminuir la dosis de anestésico local.
-La administración epidural de alfentanilo o sufentanilo, sugiere un efecto clínico analgésico supramedular, por redistribución plasmática, y su uso no debe ser recomendado.
-La metadona epidural presenta una selectividad medular moderada, por lo que su uso es aceptable, aunque debemos vigilar su efecto acumulativo.
-Todos los opioides administrados por vía intratecal producen parte de su efecto clínico por un mecanismo de acción medular, pero la rápida redistribución plasmática de los fármacos lipofílicos puede contribuir con un efecto supraespinal a la analgesia observada.
-La morfina intratecal produce analgesia por un mecanismo medular en los estadios iniciales, pero puede progresar rostralmente por el LCR y producir un efecto tardío supraespinal.
-La morfina espinal no es una opción adecuada en pacientes ambulatorios en el contexto del tratamiento del dolor agudo postoperatorio por su larga vida media de eliminación.
-Debemos prescribir a cada paciente el fármaco y la dosis adecuada y establecer un protocolo de vigilancia ya que está en relación directa con la seguridad en la utilización clínica de los opioides perimedulares.
| CORRESPONDENCIA: Borja Mugabure Bujedo Paseo de Berio, 22, 3ºB 20018 San Sebastián Telf.: 943 313 861 e-mail: mugabure@yahoo.es |
BIBLIOGRAFÍA
1. Brill S, Gurman GM, Fisher A. A history of neuroaxial administration of local analgesics and opioids. Eur J Anesthesiology 2004; 21 (4): 329-30. [ Links ]
2. Bernards CM. Understanding the physiology and farmacology of epidural and intrathecal opiods. Best Practice and Reseach Clinical Anaesthesiology 2002; 16: 489-505. [ Links ]
3. Hogan QH. Epidural anatomy examined by cryomicrotome section. Influence of age, vertebral level, and disease. Regional Anaesthesia 1996; 21: 395-406. [ Links ]
4. Hogan Q, Toth J. Anatomy of soft tissues of the spinal canal. Regional Anaesthesia and Pain Medicine 1999; 24: 303-10. [ Links ]
5. Kerber CW, Newton TH. The macro and microvasculature of the dura mater. Neuroradiology 1973; 6: 175-179. [ Links ]
6. Reshetilov VI. Angioarchitectonics of the dura mater of the human spinal cord. Zh Vopr Neirokhir Im NN Burdenko 1981; 1: 58-50. [ Links ]
7. Reshetilov VI. Morphofunctional characteristics of the microcirculatory bed of the human spinal dura mater; Arkh Anat Gistol Embriol 1979; 76: 31-6. [ Links ]
8. Kozody R, Palahniuk RJ, Wade JG, et al. The effect of subarachnoid epinephrine and phenylephrine on spinal cord blood flow. Canadian Anaesthesiology Society Journal 1984; 31: 503-8. [ Links ]
9. Bernards CM, Hill HF. Morphine and alfentanil permeability through the spinal dura, aracnoid, and piamater of dogs and monkeys. Anaesthesiology 1990; 73: 1214-9. [ Links ]
10. Nabeshima S, Reese TS, Landis DM, et al. Juntions in the meninges and marginal glía. J. Comp Neur 1975; 164: 127-169. [ Links ]
11. VandenabeeleF, Creemers J, Lambrichts I. Ultrastructure of the human spinal arachnoid mater and dura mater. Journal of Anatomy 1996; 189: 417-30. [ Links ]
12. Bernards C, Hill HF. Physical and chemical properties of drugs molecules governing tueir diffusion trough the spinal meninges. Anaesthesiology 1992; 77: 750-6. [ Links ]
13. Bernards CM, Hill HF. The spinal nerve root sleeve is not a preferred route for redistribution of drugs from the epidural space to the spinal cord. Anaesthesiology 1991; 75: 827-32. [ Links ]
14. DiChiro GD, Hammock MK, Bleyer WA. Spinal descent of cerebrospinal fluid in man. Neurology 1976; 26: 1-8. [ Links ]
15. Nordberg Getal. Pharnacokinetic aspects of intratecal morphine analgesia. Anaesthesiology 1984; 60: 448-54. [ Links ]
16. Bernards CM, Sorkin LS. Radicular artery blood flow does not redistribute fentanyl from the epidural space to the spinal cord. Anaesthesiology 1994; 80: 872-8. [ Links ]
17. Herz A, Teschemacher H. Activities and sites of antinociceptive action of morphine-like analgesics and kinetics of distribution following intravenous, intracerebral and intraventricular application. In: Simmonds E, ed. Advances in Drug Research. London: Academic Press, 1971. p. 79-117. [ Links ]
18. Ummenhofer WC, et al. Comparative spinal distribution and clearance kinetics of intrathecally administered morphine, fentanil, and sufentanil. Anaesthesiology 2000; 92: 739-53. [ Links ]
19. McQuay H, et al. Intrathecal opioids, potency and lipophilicity. Pain 1989; 36: 111-5. [ Links ]
20. Bernards CM, Shen DD, Sterling ES, et al. Epidural, cerebrospinal fluid, and plasma pharmacokinetics of epidural opioids (part 1): differences among opioids. Anaesthesiology 2003; 99: 455-65. [ Links ]
21. Bernards CM, Shen DD, Sterling ES, et al. Epidural, cerebrospinal fluid, and plasma pharmacokinetics of epidural opioids (part 2): effect of epinephrine. Anaesthesiology 2003; 99: 466-75. [ Links ]
22. Bernards CM. Recent insights into the pharmacokinetics of spinal opioids and the relevance to opoid selection. Current Opinion in Anaesthesiology 2004; 17: 441-7. [ Links ]
23. Lugo RA, Kern SE. Clinical pharmacokinetics of morphine. J Pain Palliat Care Pharmacother 2002; 16: 5-18. [ Links ]
24. Gaudette KE, Weaver SJ. Intraspinal use of morphine. Ann Pharmacoter 2003; 37: 1132-5. [ Links ]
25. Kilbride MJ, Senagore AJ, Mazier WP, et al. Epidural analgesia. Surg Gynecal Obstet 1992; 174: 137-40. [ Links ]
26. Loper KA, et al. Epidural and intravenous fentanil infusions are clinically equivalent after knee surgery. Anaesthesia and Analgesia 1990; 70: 72-5. [ Links ]
27. Glass S, et al. Use of patient-controlled analgesia to compare the efficacy of epidural to intravenous fentanyl administration. Anaesthesia and Analgesia 1992; 74: 345-51. [ Links ]
28. Guinard J, et al. A randomized comparasion of intrevanous versus lumbar and thoracic epidural fentanyl for analgesia after thoracotomy. Anaesthesilogy 1992; 77: 1108-15. [ Links ]
29. Berti M, et al. 0.2% ropivacaine with or without fentanyl for patient-controlled epidural analgesia after mayor abdominal surgery: a double blind study. Journal of Clinical Anaesthesiology 2000; 12: 292-7. [ Links ]
30. Tan CNH, Guha A, Scawn NDA, et al. Optimal concentration of epidural fentanyl in bupivacaine 0.1% after thoracotomy. British Journal of Anaesthesilogy 2004; 92 (5); 670-4. [ Links ]
31. Ginosar Y, Riley ET, Angst MS. The site of action of epidural fentanyl in humans volunteers, difference between infusion and bolus administration. Anaesthesia and Analgesia 2003; 97 (5): 1428-38. [ Links ]
32. Dángelo R, et al. Epidural fentayl produces labour analgesia by a spinal mechanism. Anaesthesiology 1998; 88: 1519-23. [ Links ]
33. Lee BB, Ngan Kee WD, Lau WM, et al. Epidural infusions for labor analgesia: a comparation of 0.2% ropivacaine, 0.1% ropivacaine, and 0.1% ropivacaine with fentanil. Reg Anaesth Pain Med 2002; 27: 31-6. [ Links ]
34. Ginosar Y, Columb MO, Cohen SE, et al. The site of action of epidural fentanyl infusions in the presence of local anaesthesics: a minimum local analgesic concentration infusion study in nulliparous labor. Anaesthesia and Analgesia 2003; 97 (5): 1439-45. [ Links ]
35. Scull TJ, et al. Epidural analgesia in early labor blocks the stress response but uterine contractions remain unchange. Canadian Journal of Anaesthesiology 1998; 45: 626-30. [ Links ]
36. Zanardo V, et al. Labour pain effects on colostral milk beta-endorfins concentrations of lactating mothers. Biology of the neonate 2001; 79: 87-90. [ Links ]
37. Butterworth JFT, Walter FO, Lysac SZ. Pregnancy increases nerve susceptibility to lidocaine. Anaesthesiology 1990; 72: 962-5. [ Links ]
38. Miguel R, Barlow I, Morrell M, et al. A prospective, randomized, double-blind comparision of epidural and intravenous sufentanil infusions. Anaesthesiology 1994; 81: 346-52. [ Links ]
39. Coda BA, et al. A pharmacokinetic approach to resolving spinal and systemic contributions to epidural al fentanil analgesia and side effects. Pain 1995; 62: 329-37. [ Links ]
40. Van der Nieuwenhuyzen MC, et al. Alfentanil as an adyuvant to epidural bupivacaine in the management of postoperative pain arfter laparotomies: lack of evidence of spinal action. Anaesthesia and Analgesia 1998; 86: 574-8. [ Links ]
41. Parramon F, García Ch, Cambus P, et al. Postoperative patient-controlled analgesia is more effective with epidural methadone than with intravenous methadone in thoracic surgery. Revista Española de Anestesiología y Reanimación 2003; 50: 326-31. [ Links ]
42. Lauretti GR, et al. Dose-response study of intrathecal morphine versus intrathecal neostigmine, their combination, or placebo, for postoperative analgesia in patients undergoing anterir and posterior vaguinoplasty. Anaesthesia and Analgesia 1996; 82: 1182-7. [ Links ]
43. Gurkan Y, Canatay H, Ozdamar D, et al. Spinal anaesthesia for arthroscopic knee surgery. Acta Anaesthesiologica Scandinavica 2004; 48: 513-7. [ Links ]
44. Sjostrong S, et al. Pharmacokinetics of intrathecal morphine and meperidine in humans. Anaesthesiology 1987; 67: 889-95. [ Links ]
45. Caute B, et al. CSF morphine levels after lumbar intrathecal administration of isobaric and hyperbaric solutions for cancer pain. Pain 1998; 32: 141-6. [ Links ]
46. Yeung JC, Judy TA. Multiplicative interaction between narcotics ogonisms expressed at spinal and supraspinal sites of antinociceptive action as reaveled by concurrent intrathecal and intraventricular injections of morphine. Journal of Pharmacology and Experimental Therapy 1980; 215: 542-633. [ Links ]
47. Bian D, et al. Loss of antiallodynic and antinociceptive spinal/supraspinal morphine synergy in nerve- injury rats: restoration by MK-801 or dynorphyn antiserum. Brain Reseach 1999; 831: 55-63. [ Links ]
48. Lu JK, et al. The dose response pharmacology of intrathecal sufentanil in female volunteers. Anaesthesia and Analgesia 1997; 85: 372-9. [ Links ]
49. Lehmann KA, et al. Postoperative patient-controlled analgesia with sufentanil: analgesic efficacy and minimun effective concentrations. Acta Anaesthesiologica Scandinavica 1991; 35: 221-6. [ Links ]
50. Hays RL, Palmer CM. Respiratory depression after intrathecal administration of sufentanilo during labor. Anaesthesiology 1994: 81: 511-2. [ Links ]
51. Norris MC, Fogel ST, Holtman B. Intratecal sufentanil (5 vs. 10 mg) for labour analgesia: efficacy and side effects. Regional Anaesthesia and Pain Medicine 1998; 23: 252-7. [ Links ]
52. Herman NL, et al. Analgesia, pruritus, and ventilation exibit a dose response relationship in parturients receiving intrathecal fentanyl during labor. Anaesthesia and Analgesia 1999; 89: 378-83. [ Links ]
53. Eisenach JC, Hood DD, Curry R, et al. Intrathecal but not intravenous opioids release adenosine from de spinal cord. Journal of Pain 2004; 5: 64-8. [ Links ]
54. Reuben SS, Dunn SM, Duprat KM, et al. An intrathecal fentanyl dose-response study in lower extremity revascularization procedures. Anaesthesiology 1994; 81: 1371-5. [ Links ]
55. S Lui S, Chiu AA, Carpenter RL, et al. Fentanyl prolongs lidocaine spinal anaesthesia without prolonging recovery. Anaesthesia and Analgesia 1995; 80: 730-4. [ Links ]
56. Chiu AA, Lui, Carpenter RL, et al. The effects of epinefrine on lidocaine spinal anaesthesia: a cross-over study. Anaesthesia and Analgesia 1995; 80: 735-9. [ Links ]
57. Jain K, Grover VK, Mahajan R, et al. Effect of varyng doses of fentanyl with low doses of spinal bupivacaine for caesaren delivery in patients with pregnancy-induced hypertension. Int J Obstet Anaesthesia 2004; 13 (4): 215-20. [ Links ]
58. Aragón MC, Calderón E, Pernia A, et al. Analgesia perioperatoria en cesárea: eficacia y seguridad del fentanilo intratecal. Rev Soc Esp Dolor 2004; 11: 68-73. [ Links ]
59. Wong CA, Scavone BM, Slavenas JP, et al. Efficacy and side effect profile of varyng doses of intrathecal fentanyl added to bupivacaine for labor analgesia. Int J Obstet Anaesthesia 2004; 13: 19-24. [ Links ]
60. Kararmaz A, Kaya S, Turhanoglu S, et al. Which administration route of fentanyl enhances the spread of espinal anaesthesia: intravenous, intrathecal or both? Acta Anaesthesiologica Scandinavica 2003; 47: 1096-100. [ Links ]