Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.12 no.4 Madrid may. 2005
NOTA CLÍNICA
Gabapentina en dolor raquídeo crónico. Valoración de su eficacia analgésica
J. Cartagena1, J. P. Vicente1, E. Borrás1, J. A. Castillo1 y G. Motos2
| Cartagena J, Vicente JP, Borrás E, Castillo JA, Motos G. Gabapentin in chronic rachidian pain. Assessment of its analgesic effectiveness. Rev Soc Esp Dolor 2005; 12: 217-223.
| ||
| SUMMARY Objectives: To assess the analgesic effectiveness of gabapentin (GBP) in patients with chronic rachidian pain (CRP) refractory to standard pharmacological therapies (non-steroid anti-inflammatory drugs, NSAIDs, minor and major opiates, muscular relaxants, antidepressants, etc.). Material and methods: Forty one patients with CRP (cervical, dorsal and lumbar pain) refractory to prior standard drug therapies were prospectively and randomly studied, regardless their etiology, with or without associated radiculopathy. However, during the study, due to ethical reasons and in order to obtain the greatest analgesic effectiveness as possible with such drugs, their use was allowed, although with a prior dose titration performed by the Pain Unit specialist. If the response was inadequate even after dose titration, treatment with gabapentin was gradually introduced up to a dose of 300 mg each 8 hours; such dose was increased until obtaining a therapeutic response (up to a maximum of 2400 mg.day-1) or causing intolerable side effects. From the beginning of the treatment with gabapentin, a three-month follow-up was conducted in which pain features, location and irradiation were assessed and quantified using a visual analogical scale (VAS) (100 mm) and the Lattinen's test. Quality of sleep was also determined using a modified VAS. Doses required to relief pain, as well as side effects reported and dropout causes were also recorded. Results: Since the first month of therapy and with low doses of gabapentin, a significant improvement was observed in VAS scores, Lattinen's test scores and quality of life, even in patients without associated radiculopathy or pain with clear neuropathic features. Improvement of such parameters was progressive, sometimes even without requiring increased doses of gabapentin. Tolerance was very good and none of the patients had to discontinue the treatment due to side effects, most of which were light and self-limited. Conclusion: Gabapentin as coadjuvant of the standard therapy, is an effective drug in patients with chronic rachidian pain at low doses, showing good tolerance and low incidence of side effects. © 2005 Sociedad Española del Dolor. Published by Arán Ediciones, S. L. Key words: Gabapentin. Rachidian pain. Chronic pain.
| RESUMEN Objetivos: Valorar la eficacia analgésica de la gabapentina (GBP) en pacientes con dolor raquídeo crónico (DRC), que no han respondido adecuadamente a los tratamientos farmacológicos habitualmente empleados (antiinflamatorios no esteroideos -AINE-, opioides menores o mayores, relajantes musculares, antidepresivos, etc.). Material y métodos: Se han estudiado de modo prospectivo y aleatorio 41 pacientes afectos de DRC (cervical, dorsal y/o lumbar), independientemente de su etiología, con o sin radiculopatía asociada, que no hubieran respondido previamente a los tratamientos farmacológicos habituales. No obstante, durante el estudio, por razones éticas y, en un intento de obtener la mayor eficacia analgésica posible con tales fármacos, se permitió el empleo de los mismos, aunque realizando, previamente, un reajuste de las dosis por parte de un especialista de la Unidad de Dolor. Si tras este ajuste no se obtenía una respuesta adecuada, se iniciaba el tratamiento con gabapentina de manera gradual hasta alcanzar una dosis de 300 mg cada 8 h; dicha dosis se fue incrementando hasta obtener una respuesta terapéutica (con un máximo de 2400 mg.día-1) o la aparición de efectos secundarios intolerables. A partir del inicio del tratamiento con gabapentina se realizó un seguimiento durante tres meses en el que se valoraban características del dolor, localización, irradiación, y se cuantificaba mediante una escala analógica visual -EVA- (100 mm) y test de Lattinen. Asimismo, se evaluó la calidad del sueño mediante una EVA modificada. Se recogieron también la dosis utilizadas para el control del dolor así como los efectos secundarios aparecidos y las causas de abandono. Resultados: Desde el primer mes de tratamiento y ya con dosis bajas de gabapentina se observó una mejoría significativa en los valores de la EVA del dolor, test Lattinen y calidad de sueño, incluso en aquellos pacientes en los que no existía radiculopatía asociada o dolor de características neuropáticas claras. Dicha mejora en los parámetros mencionados fue progresiva incluso sin necesidad de seguir aumentando la dosis de gabapentina. La tolerancia fue muy buena no siendo preciso interrumpir en ningún caso el tratamiento por los efectos secundarios, los cuales han sido en general leves y autolimitados. Conclusión: La gabapentina, como coadyuvante de la terapia habitual, es un fármaco eficaz en pacientes con dolor crónico raquídeo, no precisando dosis elevadas y presentando buena tolerancia con una baja incidencia de efectos secundarios. © 2005 Sociedad Española del Dolor. Publicado por Arán Ediciones, S. L. Palabras clave: Gabapentina. Dolor raquídeo. Dolor crónico.
|
1FEA. Anestesiología, Reanimación y Tratamiento del Dolor.
2Jefe de Servicio. Anestesiología, Reanimación y Tratamiento del Dolor.
Hospital General Universitario J. Mª. Morales Meseguer. Murcia
Recibido: 12-05-04.
Aceptado: 06-04-05.
INTRODUCCIÓN
El dolor raquídeo es una de las primeras causas de dolor crónico no oncológico. Se calcula que la prevalencia del dolor lumbar (1), localización más frecuente de entre los dolores raquídeos, es de un 45% en la población española, generando unos 2 millones de consultas anuales en Atención Primaria siendo una de las causas principales de baja laboral en España (2) y de invalidez y discapacidad en el mundo occidental (3). Es además influenciado, por factores psicológicos y sociales que desempeñan un importante papel en su mantenimiento, confiriéndole un gran impacto socioeconómico constituyendo un importante problema de salud pública.
Hasta un 20-25% de los dolores raquídeos crónicos se caracteriza por tener un origen indefinido y una respuesta insuficiente a los distintos esfuerzos terapéuticos (4). Incluso el tratamiento quirúrgico de las anomalías detectadas en las pruebas de imagen, en múltiples ocasiones no aporta la solución esperada, aún cuando su indicación haya sido oportuna y adecuada. Ni siquiera los tratamientos multimodales, intensivos o no, en centros especializados, con muy elevados costos, han logrado los resultados esperados. En tal caso, quedan pocas alternativas terapéuticas siendo los tratamientos farmacológicos habituales, aún correctamente manejados, incapaces de obtener beneficios significativos, mostrándose los pacientes desesperanzados, con frecuentes problemas psicológicos asociados, y reacios a recibir tratamientos agresivos. En cuanto a su fisiopatología, parece ser que factores mecánicos, inflamatorios, vasculares y de inmunidad actuando sobre cualquiera de las estructuras capaces de generar dolor de espalda (huesos, ligamentos, discos intervertebrales, carillas articulares, músculos, etc.) pueden determinar, más allá de la lesión anatómica, cambios funcionales múltiples en el nervio raquídeo y/o sus raíces, similares a los que se producen en el dolor neuropático, que expliquen la aparición de un dolor persistente o automantenido aún después que el proceso inflamatorio deje de estar presente y la lesión tisular reparada. Esto explicaría el que las características clínicas del dolor raquídeo crónico (DRC) sean similares a las de otros tipos de dolor neuropático (5,6).
La gabapentina (GBP) fármaco análogo estructural del neurotransmisor inhibidor GABA, diseñado en principio como fármaco antiespástico, ha demostrado su eficacia en el tratamiento de gran variedad de síndromes de dolor neuropático (7) incluido el dolor por lesión traumática o cirugía fallida de columna (8,9) o el dolor lumbar con componente neuropático y espasmos miofasciales, mejorando tanto el componente neuropático como el nociceptivo (10). También, ha sido utilizada con éxito en espasmos musculares de diferente etiología (11) e incluso en pacientes con dolor central o en aquellos con espasmos dolorosos tras paraplejía (12).
Dado que en el DRC, existe casi siempre un cierto grado de espasmo muscular asociado, así como dolor de características neuropáticas y, que por otro lado, la GBP, con un buen perfil de seguridad y muy pocas interacciones farmacológicas, parece también mejorar la calidad del sueño y los síntomas de ansiedad y depresión que suelen acompañar a todo tipo de dolor crónico (13), cabe suponer que la asociación de dicho fármaco a su tratamiento habitual, pudiera ser una alternativa eficaz en los casos que no hayan respondido adecuadamente a los tratamientos previos, y es este el objetivo de nuestro estudio, el valorar la eficacia analgésica de la GBP en este grupo de pacientes.
MATERIAL Y MÉTODOS
Se han estudiado de modo prospectivo 41 pacientes de ambos sexos mayores de 18 años afectos de dolor raquídeo (cervical, dorsal y/o lumbar) crónico (> 3 meses de evolución), independientemente de su posible etiología, con o sin radiculopatía asociada, que no hayan respondido de manera adecuada a los tratamientos farmacológicos convencionales.
Han sido excluidos todos los pacientes con contraindicación para la administración de GBP y aquellos a los que en los últimos 2 meses se les haya iniciado tratamiento con anticonvulsivantes o antidepresivos.
Durante el estudio se permitió el uso de los fármacos habitualmente empleados para tratar este tipo de dolor (antiinflamatorios no esteroideos -AINE- opioides menores o mayores, relajantes musculares, etc.), aunque, para obtener una mayor eficacia analgésica, se realizó un ajuste previo de las dosis por parte de un especialista de la Unidad de Dolor. Sólo si tras este ajuste no se obtenía una respuesta adecuada, se le planteaba al paciente la posibilidad de participar en el estudio obteniéndose entonces el consentimiento informado para ello.
Tras la exploración cuidadosa del paciente detallamos las características del dolor, localización, irradiación, tratamientos previos y cuantificamos el dolor mediante una escala visual analógica -EVA- (100 mm donde el valor "0" es nada de dolor y el valor "100" es el dolor máximo imaginable), y test de Lattinen, así como la calidad del sueño con una EVA modificada (100 mm donde el valor "0" es "no duerme" y el "100" es que lo hace "sin dificultades").
Estos mismos criterios fueron utilizados para valorar su evolución a la semana, al mes, 2 meses y 3 meses desde el inicio del tratamiento con GBP, el cual, se inició de manera gradual (incrementos 300 mg.día-1 cada 48 h) hasta alcanzar una dosis de 300 mg.8 h-1. En caso de aparición de efectos secundarios con esta forma de introducción del fármaco y en mayores de 65 años se les pautaba incrementos diarios de 100 mg de gabapentina cada 24, 48 o más horas (según tolerancia), comenzando con una dosis nocturna de 100 mg el primer día, que se aumentaba a 100 mg cada 12 h a los 2 días, posteriormente 100 cada 8 h, y así progresivamente hasta la dosis de 300 mg.8 h-1. Para ello se les indicaba diluir el contenido de la cápsula (300 mg) en 9 ml de agua (medidos con una jeringa de 10 ml) que volverían a ser recogidos en la jeringa de manera que cada 3 ml de la dilución contuvieran 100 mg de gabapentina. Esta pauta de introducción del fármaco les era entregada a todos los pacientes por escrito.
Una vez alcanzada la dosis inicial de 300 mg.8 h-1 esta se iba incrementando progresivamente hasta obtener una respuesta terapéutica (con un máximo de 2.400 mg.día-1) o la aparición de efectos secundarios intolerables, en cuyo caso se consideraba abandono del tratamiento.
Se recogió también, la dosis de inicio, dosis media y máxima utilizadas, así como la dosis más utilizada para el control del dolor. Se valoró la eficacia, los efectos secundarios aparecidos y las causas de abandono.
Los resultados han sido expresados en porcentajes, medias ± desviación estándar (DE), y para las comparaciones de medias (de la escala EVA, resultados del test de Lattinen y escala de sueño) se utilizó el análisis de la varianza (ANOVA) considerándose significación estadística cuando p < 0,05.
RESULTADOS
Se han estudiado 41 pacientes, 29 mujeres (71%) y 12 hombres (29%), con una edad media de 55 años ± 14.
La localización más frecuente del dolor raquídeo ha sido la lumbar o dorsolumbar (68%), seguida de la cervical o cervicodorsal (17%); refiriendo dolor a ambos niveles 6 pacientes (14%). Ninguno de los pacientes de nuestro estudio presentaba dolor circunscrito a la región dorsal de la columna.
En cuanto al diagnóstico etiológico más probable del dolor ha destacado la patología discal, en 17 casos (41%), seguida del síndrome de cirugía fallida de espalda y de la espondiloartrosis, presentes cada una de ellas en 9 pacientes (22%). En 8 pacientes (20%) no existía una causa específica que pudiera justificar el dolor, 3 (7%) presentaban fractura vertebral (traumática u osteoporótica), otros 3 (7%) estenosis de canal, 2 (5%) escoliosis, y otros 2 (5%) síndrome el latigazo cervical. Como vemos, en algunos de nuestros pacientes existía más de un posible origen del dolor, mientras que en otros no se encontraron datos objetivos que pudieran justificarlo.
Un 51% de nuestros enfermos presentaba irradiación del dolor a las extremidades, según un patrón anatómico de distribución metamérica (radiculopatía).
En cuanto a las características del dolor, este fue mayormente definido por uno o más de los siguientes calificativos: profundo (90%), punzante (56%), quemante (49%) y sordo (41%), acompañándose frecuentemente (sobre todo en los casos de radiculopatía asociada) de signos de dolor neuropático tales como parestesias (67%), disestesias (38%), hipostesia (33%), alodinia (18%), etc.
De los pacientes objeto de nuestro estudio, un 92% había sido previamente tratado con analgésicos no opioides (ANOs), un 50% con opioides menores y un 12% con mayores. Los relajantes musculares habían sido empleados en el 33% de los pacientes y la medicación coadyuvante (corticoides, antidepresivos, sedantes, hipnóticos, etc.) en un 25%.
Tras el ajuste por nuestra parte del tratamiento analgésico, previo a la introducción de la GBP, el porcentaje de pacientes tratados con ANOs se redujo hasta el 83%, aumentando el porcentaje de los tratados con opioides menores hasta el 68% y manteniéndose el de los opioides mayores en 12%. Se disminuyó, asimismo, el tanto por ciento de pacientes tratados con relajantes musculares (8%) y coadyuvantes (5%).
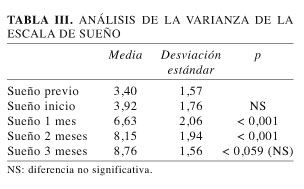
En cuanto a la evolución del dolor (Tabla I), del test de Lattinen (Tabla II) y del sueño (Tabla III), el ajuste previo del tratamiento analgésico (antes de la introducción de la GBP) produjo pocos cambios. Sin embargo, desde el primer mes de tratamiento con GBP, se observó una mejoría significativa (p < 0,001) y progresiva de dichos parámetros, respecto de los valores de inicio, hasta la finalización del estudio a los 3 meses. Es de destacar también, que de los 5 pacientes que comenzaron el estudio siendo tratados con opioides mayores, a 3 de ellos, dada su buena evolución se les pudieron retirar durante el mismo.
No han existido diferencias significativas en cuanto a la mejora dichos parámetros (EVA dolor, Lattinen y EVA sueño) entre los pacientes con dolor raquídeo localizado y aquellos con dolor irradiado (radiculopatía) (Tabla IV), ni tampoco entre las distintas localizaciones del dolor (lumbar o dorsolumbar frente a cervical y cervicodorsal).
Las dosis medias utilizadas de gabapentina fueron de 814 mg.día-1 durante el primer mes de tratamiento, 910 mg.día-1 a los dos meses y 1.024 mg.día-1 a los tres meses.
Por último, en cuanto a la tolerancia al tratamiento, es de destacar que tan sólo uno de nuestros pacientes abandonó el estudio, y lo hizo por miedo a los efectos secundarios, sobre los cuales había sido previamente informado, pero posteriormente, tras meditarlo decidió no seguir el tratamiento prescrito. Cinco pacientes (13%) tuvieron dificultades para alcanzar la dosis de 900 mg.día-1, no obstante todos ellos decidieron continuar con el estudio al haber obtenido mejoría con dosis inferiores a la pautada durante el primer mes. De ellos, a los tres meses de tratamiento sólo 3 continuaban con dosis inferiores a 900 mg.día-1, 2 de ellos con 600 mg.día-1 y uno con 300 mg.día-1, afirmando los tres obtener beneficio con la medicación.
Los efectos secundarios más frecuentes han sido sensación de somnolencia y mareo en 6 casos (15%), náuseas en 3 casos (7%), torpeza al andar, alteraciones de memoria, impotencia, diplopía, obesidad y molestias gástricas en un caso cada uno, no obstante en ninguno de estos pacientes se hizo necesario retirar el tratamiento y en todos los casos se fueron limitando dichos secundarismos.
DISCUSIóN
En nuestra serie, por razones éticas, se mantuvo el tratamiento convencional previo, aunque ajustándolo, antes del inicio del tratamiento con GBP, para conseguir una mayor eficacia analgésica y que así, los efectos obtenidos tras la introducción de la misma se vieran menos afectados con sucesivos cambios de tratamiento. De hecho, en esta primera visita se aumentó el porcentaje de pacientes tratados con opioides (80%) y disminuyó el de los tratados con relajantes musculares y coadyuvantes (corticoides, sedantes, etc.) por tratarse de situaciones de dolor crónico. Sólo los pacientes que no mejoraron, tras este ajuste de dosis, se incluyeron en el estudio, siendo por ello normal que, como se aprecia en las Tablas I, II y III, no existan diferencias significativas entre los resultados antes y después de dicho reajuste (tiempos "previo" e "inicio").
Fueron excluidos los pacientes a los que, en los 2 últimos meses, se les hubiera iniciado tratamiento con antiepilépticos o antidepresivos, para evitar que la aparición de resultados positivos pudiera ser atribuida a los mismos, no obstante, si el tratamiento con ellos ya estaba teóricamente estabilizado (> 2 meses), este se mantuvo.
A pesar de padecer todos nuestros enfermos una situación de dolor crónico, y de haber previamente probado, en todos ellos, un tratamiento convencional adecuado sin obtener respuesta, tras la aplicación del tratamiento con GBP, se observó, desde el primer mes de tratamiento, una disminución significativa y progresiva tanto de la EVA del dolor como del test Lattinen que continuó haciéndolo mientras duró el estudio.
La explicación a estos buenos resultados podemos encontrarla en la propia fisiopatología el dolor raquídeo crónico, tan similar como hemos comentado a la del dolor neuropático. Al parecer, tras una lesión aguda, se puede alterar la actividad aferente del SNC por alteraciones en los canales de sodio, que regulan la transmisión de los impulsos vinculados al dolor, lo que puede generar una actividad espontánea atípica de origen ectópico en los sectores lesionados que se manifiesta como disestesia (mecanorreceptores) o dolor (nociceptores). Dicha actividad anómala, puede a su vez, ser contrarrestada por sustancias estabilizadoras de membrana como los anestésicos locales y algunos anticomiciales como la gabapentina (14). También se ha propuesto que tanto como consecuencia de la injuria tisular y sensibilización de los nociceptores como por la pérdida de la inhibición central, por disfunción de las neuronas medulares del asta posterior vinculadas a dicha función, pueda producirse un aumento de la excitabilidad de las neuronas del asta posterior medular que pueda generar espasmos musculares reflejos anormales y otros reflejos (como incremento de la actividad simpática) que contribuyan al desarrollo y mantenimiento del dolor (5); la GBP tanto por su efecto antiespástico como antiepiléptico, y su similitud estructural con el neurotransmisor inhibidor GABA puede contribuir a la rotura de este círculo vicioso espasmo/vasoconstricción-dolor-espasmo/vasoconstrición-dolor. Por otro lado, en los casos de lesión de alguna estructura nerviosa (nervio raquídeo o alguna de sus ramas) las modificaciones de la microglia permiten la formación de interconexiones (efapsis) entre los distintos tipos de fibras, generando auténticos cortocircuitos. Además, los mecanismos reparadores como la producción incrementada de neurotrofinas (15) pueden también facilitar la formación de interconexiones anómalas (ramificaciones) entre neuronas nociceptivas e, incluso con las del sistema nervioso autónomo o propioceptivo generando impulsos anómalos. Estos mismos mecanismos han sido implicados en la producción del síndrome de dolor regional complejo y en otros síndromes de dolor neuropático, donde la GBP también ha demostrado su eficacia analgésica (16,17).
Además de todo lo comentado, pensamos que los buenos resultados obtenidos están también influenciados por el papel positivo que puede tener la GBP en el tratamiento de las alteraciones psicopatológias que suelen presentar este tipo de pacientes (13). Ello viene avalado a su vez por la mejora importante en su calidad de sueño, ya patente desde el primer mes y que lo sigue haciendo durante el resto del estudio.
En definitiva, estos resultados implican una mejora importante de la calidad de vida de los pacientes desde el inicio del tratamiento.
Además, debemos a todo ello añadir la excelente tolerancia mostrada al tratamiento (18), ya que en ningún caso fue necesaria la retirada del mismo debido a los efectos secundarios. Pensamos que esto es así, primero porque se han obtenido los efectos deseados con dosis relativamente bajas de GBP (media de 1.024 mg.día-1 al 3er mes de tratamiento) y, por otro lado, la pauta de introducción del fármaco con incrementos diarios de 100 mg.24 h-1, 48 h-1 o más horas, según tolerancia, hace que ante la aparición de algún efecto secundario, el paciente deje de incrementar la dosis hasta adaptarse a la nueva dosis, con lo que se minimizan los secundarismos. Creemos que sería interesante la existencia de una presentación en cápsulas de 100 mg (30 cápsulas) para facilitar esta pauta de introducción del fármaco.
Es de destacar también que no existieron, en cuanto a los resultados, diferencias significativas entre el grupo de enfermos con radiculopatía, y el grupo de enfermos sin ella y por tanto sin un dolor claramente neuropático. Es decir, que el fármaco se ha mostrado también eficaz en el dolor raquídeo localizado, profundo, punzante, quemante y sordo que describieron nuestros pacientes.
Si bien, tampoco se han encontrado diferencias significativas entre el grupo de pacientes con dolor dorsolumbar y lumbar y el grupo con dolor cervical y cervicodorsal, se trata de una muestra pequeña como para poder sacar conclusiones.
Debido a los efectos neuroprotectores que se atribuyen a la GBP (19) y dada la fisiopatología del dolor crónico, pensamos que, como ocurre en los casos de dolor neuropático, cuanto antes se inicie el tratamiento mejores resultados se obtendrán a largo plazo, con lo que, la administración temprana de dicho fármaco a pacientes resistentes a las terapias habituales, quizá pueda disminuir el porcentaje de casos de dolor raquídeo que acaban cronificándose. Sería interesante realizar estudios prospectivos y a largo plazo basados en esta hipótesis.
En definitiva, podemos concluir que en enfermos con dolor raquídeo crónico que no responden a los tratamientos convencionales, la gabapentina como coadyudante de la terapia habitual, se ha mostrado eficaz a dosis relativamente bajas disminuyendo de manera significativa la EVA del dolor, el test de Lattinen y mejorar la calidad del sueño. Además, con una pauta de introducción lenta, dicho fármaco, ha sido muy bien tolerado presentando pocos efectos secundarios y autolimitados. No obstante, habría que realizar un estudio controlado, aleatorizado, doble ciego con placebo para discernir realmente la aportación del fármaco a estos resultados.
| CORRESPONDENCIA: J. Cartagena Sevilla Servicio de Anestesiología, Reanimación y Tratamiento del Dolor (4ª planta) Hospital J. Mª Morales Meseguer Av. Marqués de los Vélez, s/n 30008 Murcia Tel.: 968 360 900. Fax: 968 232 484 e-mail: atupin@wanadoo.es |
BIBLIOGRAFÍA
1. Rull M. Consideraciones en torno al dolor de espalda (editorial). Rev Soc Esp Dolor 2001; 8 (Supl. II): 1. [ Links ]
2. Rull M, Catalá E, Ferrándiz M. Manual de Tratamiento del Dolor. Barcelona: Publicaciones Permanyer, 2003. p. 335-57. [ Links ]
3. Fordyce WE. Back pain in the workplace. Manegement of disability in nonspecific conditions. Seattle: IASP Press, 1995. p. 5-9. [ Links ]
4. Bogduk N, Barnsley L. Back pain and neck pain: an evidence-based update. Pain 1999 an updated review. Seattle: IASP Press, 1999. p. 371-7. [ Links ]
5. Loeser JD, Butler SH, Chapman R, et al. Bonica's Management of Pain. 3ª ed. Filadelfia: Lippincott & Wilkins, 2001. p. 241-54. [ Links ]
6. Rull M, Miralles RC, Añez C. Fisiopatología del dolor radicular. Rev Esp Soc Dolor 2001; 8 (Supl. II): 22-34. [ Links ]
7. Rose MA, Kam PC. Gabapentin: pharmacology an its use in pain management. Anaesthesia 2002; 57: 451-65. [ Links ]
8. Putzke JD, et al. Long-term use of gabapentin for treatment of pain after traumatic spinal cord injury. Clin J Pain 2002; 18: 116-21. [ Links ]
9. Braverman DL, et al. Using gabapentin to treat failed back surgery syndrome caused by epidural fibrosis: A report of 2 cases. Arch Phys Rehabil 2001; 2: 691-3. [ Links ]
10. Rosemberg J, Hrrell C, Ristic H. The effect of gabapentin on neuropathic pain. Clin J Pain 1997; 13: 251-5. [ Links ]
11. Serrao M, Rosi P, Cardinali P. Gabapentin for muscle-cramp, an open-label trial. Clin Neuropharmacol 2000; 23: 45-8. [ Links ]
12. Gruenthal M, Mueller M, Olsen NL, et al. Gabepentin for treatment of spasticity in patien with spinal cord injury. Spinal Cord 1997; 35: 686-9. [ Links ]
13. Carta MG, Hardoy MC, Hardoy MJ, et al. The clinical use of gabapentin in bipolar spectrum disorders. J Affect Dissord 2003; 15: 83-91. [ Links ]
14. Dib-Hajj SD, Fjell J, Cummins TR, et al. Plasticity of sodium channel expression in DRG neurons in the chronic constriction injury model of neuropathic pain. Pain 1999; 83: 591-600. [ Links ]
15. Boucher TJ, Kerr BJ, Ramer MS, et al. Neurotrophic factor effects on pain signalling systems. Proceedings of the 12th World Congress on Pain. Viena: IASP Press 1999; 16: 175-88. [ Links ]
16. Cerdá-Olmedo G, Quiles F, de Andrés JA. Perspetivas de la aportación de la gabapentina al tratamiento del síndrome de dolor regional complejo (SDRC). Rev Esp Soc Dolor 2002; 9: 29-36. [ Links ]
17. Herrera Silva J. Gabapentina en el tratamiento de otros síndromes de dolor neuropático. Rev Esp Soc Dolor 2002; 9: 37-42. [ Links ]
18. Rose MA, Kam PC. Gabapentin: pharmacology and its use in pain management. Anaesthesia 2002; 57: 451-65. [ Links ]
19. Taylor CP. Mechanisms of action of gabapentin. Rev Neurol 1997; 153: 829-41. [ Links ]