My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Sociedad Española del Dolor
Print version ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.12 n.5 Madrid Jun./Jul. 2005
COLABORACIÓN ESPECIAL
Guía de manejo clínico de la artrosis de cadera y rodilla
I. Morgado1, A. C. Pérez2, M. Moguel1, F. J. Pérez-Bustamante2 y L. M. Torres3
| Morgado I, Pérez AC, Moguel M, Pérez-Bustamante FJ, Torres LM. Guide for the clinical management of osteoarthritis of the hip and the knee. Rev Soc Esp Dolor 2005; 12: 289-302.
| ||
| SUMMARY Guides of clinical practice can help to take evidence-based and patient-focused decisions. However, these must not be understood as strict rules, but as recommendations based on clinical effectiveness studies. The physician is in the best position to decide between the different therapeutic options available for each individual patient. These guides are based on the updated review of the medical literature, combined with the opinion of experts in the relevant field. Different guides have been published recently for the management of osteoarthritis of the hip and the knee that help the physician to decide the best treatment for the patients with such condition. Despite being based on the same evidences, recommendations issued by different work groups are in disagreement. This work has aimed to review the current clinical management of osteoarthritis of the hip and the knee, as well as to identify its optimum approach according to the evidence-based medicine. © 2005 Sociedad Española del Dolor. Published by Arán Ediciones, S. L. Key words: Osteoarthritis of the hip and the knee. Guides of clinical practice. Analgesia. Physical and educational therapy. Paracetamol. Non steroid anti-inflammatory drugs (NSAIDs). Selective inhibitors of the cyclooxigenase-2 (COX-2). Chondroprotective drugs.
| RESUMEN Las guías de práctica clínica son importantes a la hora de tomar decisiones basadas en la evidencia y centradas en el paciente, no debiéndose interpretar como mandatos rígidos sino como recomendaciones basadas en estudios de efectividad clínica, siendo el médico quien está en la mejor situación a la hora de decidir entre las distintas aproximaciones terapéuticas para cada uno de sus pacientes. Estas guías surgen de la revisión actualizada de la literatura médica en combinación con la opinión de los expertos en la materia. Recientemente han sido publicadas varias guías para el manejo de la artrosis de cadera y rodilla con el objeto de ayudar al clínico en el tratamiento de pacientes con tal patología; a pesar de basarse en una misma evidencia, existen puntos discrepantes en las recomendaciones hechas por distintos grupos de trabajo. El objetivo de este trabajo es revisar el manejo clínico actual de la artrosis de cadera y rodilla así como identificar el abordaje óptimo de la misma en función de la medicina basada en la evidencia. © 2005 Sociedad Española del Dolor. Publicado por Arán Ediciones, S. L. Palabras clave: Artrosis de cadera y rodilla. Guías de práctica clínica. Analgesia. Terapia física y educacional. Paracetamol. Antiinflamatorios no esteroideos (AINE). Inhibidores selectivos de la ciclooxigenasa-2 (COX-2). Fármacos condroprotectores.
|
1MIR
2Médico Adjunto
3Jefe de Servicio
Servicio de Anestesiología, Reanimación y Unidad Dolor.
Hospital Universitario Puerta del Mar. Cádiz.
Recibido: 03-06-05.
Aceptado: 15-06-05.
INTRODUCCIÓN
La artrosis, también llamada osteoartritis o enfermedad degenerativa articular, es una enfermedad del aparato locomotor caracterizada por la degeneración y pérdida del cartílago articular, junto a la proliferación osteocartilaginosa subcondral y de los márgenes articulares (1). Se trata de la enfermedad reumatológica más frecuente en los países occidentales y la principal causante de incapacidad o invalidez de todas las enfermedades crónicas (2). Puede incluso tratarse de la enfermedad más frecuente del hombre desde el momento en que se adopta la marcha en bipedestación, apareciendo articulaciones que van a estar sometidas a una carga en ocasiones excesiva (3).
Alrededor del 10% de los adultos presentan artrosis moderada o grave, aumentando la incidencia con la edad, con un crecimiento aritmético hasta los 50-55 años y geométrico a partir de esa edad. Se ha señalado que después de los 35 años el 50% de las personas presentan al menos una localización artrósica. Hasta los 55 años la artrosis es ligeramente más frecuente en el varón, siendo a partir de esta edad más prevalente entre las mujeres (1).
Las principales articulaciones implicadas son las manos, los pies, las rodillas y las caderas, si bien el patrón distributivo varía por sexos; la artrosis de rodillas y manos predomina en las mujeres, habiendo un ligero predominio masculino en la artrosis de cadera (3).
La rodilla es la principal gran articulación afecta en la artrosis, siendo el riesgo de sufrir incapacidad por gonartrosis tan grande como el secundario a enfermedades cardiológicas y mayor que por cualquier otra patología médica en la ancianidad (4). Un informe reciente de la OMS sobre la carga global de la enfermedad, indica que la artrosis de rodilla está próxima a ser la cuarta causa más importante de discapacidad en mujeres y la octava en varones, siendo los costes anuales atribuidos a tal patología inmensos (5).
En cuanto a la etiopatogenia, y siguiendo al Colegio Americano de Reumatología, podemos clasificar la artrosis en primaria o idiopática y en secundaria o de causa conocida, quedando aquí englobados los traumatismos, las enfermedades congénitas, las metabólicas, las endocrinas, las microcristalinas y las iatrogénicas (3).
Siendo mucho más frecuente la artrosis primaria, se han podido identificar distintos factores que influyen en su desarrollo, tales como la edad, la carga genética, el sexo, el exceso relativo o absoluto de estrógenos y la obesidad (1,6,7).
En la prevalencia de la gonartrosis hay un componente genético importante, con estimaciones de herencia a partir de estudios en gemelos del 0,39 al 0,65, con independencia de factores ambientales conocidos o factores demográficos de confusión (8,9). De igual manera, el estrés biomecánico que afecta al cartílago articular y al hueso subcondral, así como los cambios en la membrana sinovial son importantes en su patogénesis (10-12).
Es probable que en la patogénesis de la artrosis de cadera, además de lo mencionado, sean importantes los cambios bioquímicos en el cartílago articular así como enfermedades preexistentes de la cadera, tanto congénitas como adquiridas (13).
El síntoma más importante es el dolor, de características mecánicas, apareciendo con la deambulación y mejorando con el reposo, si bien en las formas severas el dolor puede aparecer incluso en reposo, pudiendo despertar al paciente durante la noche. La instauración del dolor es progresiva, apareciendo en fases avanzadas importante limitación de la movilidad articular (3). La artrosis es la causa más común de dolor músculo-esquelético e invalidez, reduciendo la calidad de vida e incrementando el riesgo adicional de morbimortalidad.
Otros síntomas son la rigidez articular matutina, que puede durar hasta 30 minutos tras el inicio de la movilización articular, los crujidos articulares, la inestabilidad y la contractura muscular, todo ello acompañado de una ausencia de sintomatología sistémica. A diferencia de la artritis reumatoide y de otras artritis inflamatorias, la inflamación, si presente, normalmente es leve (14,15).
Los hallazgos radiológicos típicos son la disminución de la interlínea articular, la esclerosis subcondral, los osteofitos, los quistes subcondrales, el contorno alterado de los límites óseos y los cuerpos libres intraarticulares (1). Es importante tener en cuenta que los cambios en la radiología no se correlacionan con cambios en los síntomas ni en la función articular y que los criterios radiológicos tienden a sobreestimar la prevalencia de la enfermedad artrósica. Se calcula que existe evidencia radiográfica de gonartrosis en un 30% de los sujetos de aproximadamente 65 años, siendo sintomática en un tercio de ellos (16).
El diagnóstico se basa en la conjunción de manifestaciones clínicas, hallazgos exploratorios y signos radiológicos, junto a valores de laboratorio dentro de la normalidad. A pesar de ser un proceso muy frecuente, es un error atribuir cualquier síntoma articular a la artrosis, siendo fundamental realizar un correcto diagnóstico diferencial con otras enfermedades reumatológicas antes de establecer el diagnóstico de artrosis (3,8).
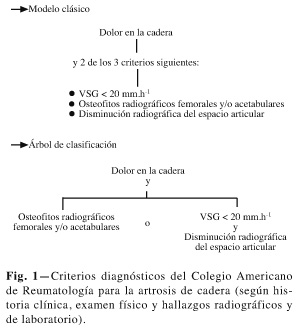
Existen unos criterios diagnósticos para la artrosis de rodilla y cadera propuestos por el Colegio Americano de Reumatología, que tienen una excelente precisión en la identificación de pacientes con gonartrosis y coxartrosis sintomática (15,17) (Figs. 1 y 2).
La enfermedad evoluciona en general muy lentamente, con periodos de mejoría sintomática, siendo frecuente una mejoría clínica a largo plazo. Son factores de mal pronóstico, entre otros, la obesidad y la inestabilidad articular (3,18).
Hoy por hoy el tratamiento de la artrosis es sintomático, y debe ser individualizado, teniendo en cuenta numerosas variables, incluyendo la presencia de condiciones comórbidas, tales como la hipertensión, la enfermedad cardiaca, la enfermedad ulcerosa péptica o el fallo renal, que influenciarán la elección farmacológica.
Los objetivos terapéuticos fundamentales son el alivio del dolor, la educación del paciente, el restablecimiento de la funcionalidad y con ello la mejora en la calidad de vida del paciente, la prevención de la incapacidad y la mejora de las deformidades y el enlentecimiento en la progresión de la enfermedad (2,14).
MODALIDADES DE TRATAMIENTO NO FARMACOLÓGICO
La información debería ser una parte integral en el manejo de cualquier patología crónica, debiendo incluir detalles acerca de la enfermedad, de la investigación al respecto y de su manejo actual, todo ello en el marco de un programa educacional, tanto para el paciente como para su familia (2,14). Son muchos los ensayos clínicos y metanálisis que han demostrado los beneficios de distintas técnicas educacionales en la reducción del dolor así como en el incremento de las habilidades físicas. De igual forma dichos programas han mostrado ser útiles al conseguir una disminución en el número de visitas que el paciente realiza a su médico de familia, con la consiguiente repercusión en los costes (19-22).
Las técnicas educacionales que han demostrado efectividad incluyen programas individualizados de educación, llamadas telefónicas regulares, grupos de apoyo y entrenamiento en la adquisición de habilidades (23-26).
La educación sanitaria debe tener como objetivo enseñar al paciente a vivir de acuerdo con sus limitaciones articulares, evitando sobrecargas, modificando posturas incorrectas y realizando actividades adecuadas.
Las medidas higiénico dietéticas incluyen el reposo como primera medida ante un episodio de dolor agudo. Se recomienda alternar dicho reposo con una deambulación progresiva, desaconsejándose la inmovilización prolongada que no hará sino favorecer la atrofia muscular y la progresión de la enfermedad artrósica. El reposo nocturno será como mínimo de 8 horas (1,3).
Se aconseja tratamiento dietético en pacientes con sobrepeso, al ser la obesidad el mayor factor de riesgo para el desarrollo y progresión de la artrosis de rodilla y cadera (7).
De entre los distintos estudios existentes, encontramos uno en el que la pérdida de peso se asoció con un menor grado de desarrollo de artrosis de rodilla sintomática en la mujer (27); bien es cierto que permanece aún por dilucidar si la pérdida de peso enlentece la progresión o alivia los síntomas en pacientes con gonartrosis preexistente (15). Sin embargo, los pacientes con artrosis de rodilla afectos de sobrepeso, especialmente si se consideran candidatos para la artroplastia total de rodilla, deberían ser animados a participar en un programa racional de pérdida de peso, que incluyese consejo dietético y ejercicio aeróbico (28).
No se recomiendan terapias dietéticas específicas en el manejo de estos pacientes (29).
La terapia física y ocupacional juega un papel central en el manejo de pacientes con limitaciones funcionales que con frecuencia les impiden desarrollar actividades de la vida diaria (14). Tiene como objetivos prevenir la lesión y la incapacidad, mejorar el dolor y la rigidez y mantener la funcionalidad el mayor tiempo posible.
El terapeuta valora la fuerza muscular, la estabilidad articular y la movilidad del paciente con artrosis, y recomienda el uso de distintas modalidades terapéuticas, como el uso de calor (infrarrojos, ultrasonidos, microondas, diatermia, parafina líquida, etc.), especialmente útil antes de iniciar el movimiento, programas de ejercicios controlados que mejoren el grado de movilidad articular y la fuerza muscular periarticular, y proporciona diversos instrumentos ortopédicos de ayuda, tales como férulas, zapatos con suelas viscoelásticas que absorban el shock, plantillas de descarga que corrijan las anormalidades biomecánicas en una rodilla en varo o las secundarias a la diferencia de altura entre las piernas en el caso de la artrosis de cadera, bastones, muletas o andadores (14,30,31).
Tanto en el caso de la artrosis de cadera como en la de rodilla, el uso apropiado de un bastón, en la mano contralateral a la cadera o rodilla afectas, reduce las fuerzas de carga en la articulación y se asocia con una disminución del dolor y una mejora en la función (15,17).
El frío es también útil en la fase aguda de dolor, aplicado mediante bolsas heladas o de gelatina durante 10-15 minutos, evitando la aplicación directa sobre la piel.
Los ejercicios aeróbicos han demostrado ser útiles y eficaces en pacientes con artrosis de rodilla y cadera, sobre todo los acuáticos o de paseo, durante 30-60 minutos diarios, iniciando la deambulación en función de la tolerancia del paciente (2,15,32).
Distintos estudios llevados a cabo en pacientes con artrosis de rodilla han demostrado que la potenciación muscular del cuádriceps mediante ejercicios isométricos o isotónicos se asocian con una mejoría significativa en la fuerza de dicho músculo, así como con una disminución en el dolor de la rodilla y una mejoría en la función, al comparar al grupo estudio con el grupo control (33,34).
En el caso de la artrosis de cadera, los objetivos de un programa de ejercicios son preservar al menos 30º de flexión y la extensión completa de la cadera, y el fortalecimiento de los músculos abductores y extensores de la cadera (35,36).
Estos programas de ejercicio, sin embargo, requieren una disponibilidad de tiempo y un esfuerzo por parte del paciente. El grado de adherencia a la terapia física se asocia significativamente con la magnitud de la mejoría clínica, tanto del dolor como de la capacidad funcional (14).
TERAPIA FARMACOLÓGICA
El alivio del dolor es la primera indicación para el tratamiento farmacológico en pacientes con artrosis de cadera o rodilla.
Cualquier agente farmacológico debe entenderse como complementario a las medidas no farmacológicas expuestas anteriormente, lo que supone la piedra angular en el manejo de la artrosis, y debería mantenerse durante todo el proceso terapéutico. No existe en la actualidad tratamiento médico curativo ni preventivo (37).
Paracetamol
Inicialmente el fármaco oral de elección es el paracetamol, tanto por su demostrada eficacia como por su perfil de seguridad y sus razonables costes, siendo el preferido a largo plazo en caso de resultar efectivo (2,14,38).
Hay pocas interacciones y contraindicaciones para el uso de paracetamol, aun en gente anciana, mostrándose efectivo a dosis de 2-4 g.día-1 durante largos periodos de tiempo, sin efectos adversos significativos, siendo comparable en muchos pacientes al ibuprofeno a corto plazo. De cualquier modo la dosis diaria de paracetamol no debería exceder de 4 gramos.
Entre sus escasos efectos adversos cabe destacar la hepatotoxicidad, si bien es rara a la dosis usada habitualmente, debiendo emplearse con cautela en pacientes con daño hepático conocido y evitándose en sujetos con abuso alcohólico crónico, por el incrementado riesgo en esta población (39-41). El paracetamol puede aumentar la vida media de la warfarina, por lo que se recomienda estrecha monitorización del tiempo de protrombina en pacientes que estando en tratamiento con warfarina van a iniciar tratamiento con dosis altas de paracetamol (42,43).
Aunque tiempo atrás se informó de una débil asociación entre el paracetamol y el fallo renal terminal, actualmente se recomienda como fármaco analgésico de elección en pacientes con función renal alterada (44).
Sin embargo y a pesar de lo expuesto, son pocos los estudios que han avalado directamente la eficacia del paracetamol en la artrosis de rodilla o cadera, y aquellos que lo han hecho son de escasa calidad o recogen un número excesivamente pequeño de pacientes. La cuestión de la eficacia se confunde por el hecho de que la mayoría de los ensayos clínicos usan paracetamol como analgesia adicional, convirtiendo los estudios de monoterapia en estudios complementarios parciales (2).
Recientemente hay una gran controversia sobre la seguridad gastrointestinal del paracetamol, particularmente al compararlo con los antiinflamatorios no esteroideos (AINE); un reciente trabajo trata ampliamente este asunto, con una revisión exhaustiva de la literatura actualizada, y concluye que actualmente el peso de la evidencia clínica avala el mejor perfil de seguridad gastrointestinal del paracetamol en relación a los AINE (45).
Antiinflamatorios no esteroideos (AINE)
Se trata de un conjunto de fármacos químicamente heterogéneos, caracterizados por tener, en grado diverso, actividad analgésica, antiinflamatoria y antipirética, y que poseen como principal mecanismo de acción la inhibición de la ciclooxigenasa y con ello la reducción en la liberación de mediadores inflamatorios. Hay que tener en cuenta que existen variaciones cuali y cuantitativas entre los diversos AINE, lo que conlleva el que un enfermo concreto pueda responder mejor a un AINE que a otro, tanto en lo referido a beneficio terapéutico como en lo referente a la tolerancia frente a las reacciones adversas (46).
Estos agentes se consideran una lógica elección en aquellos pacientes que no responden a paracetamol, sobre todo los aquejados de una sinovitis clínica, si bien no hay evidencia científica que avale la premisa de que su uso debería reservarse para cuando el paracetamol no es efectivo. Muchos de los trabajos publicados al respecto están pobremente diseñados (2).
En pacientes con gonartrosis y dolor de moderado a severo junto a signos inflamatorios, la prescripción de AINE merece tenerse en consideración como alternativa en una aproximación terapéutica inicial.
Existen estudios que han comparado directamente paracetamol y AINE, encontrando estos últimos más eficaces pero con mayor número de efectos indeseables, principalmente a nivel gastrointestinal. La toxicidad es la mayor razón para no recomendar el empleo de AINE como primera línea terapéutica en pacientes con artrosis (17,47,48).
A la hora de iniciar un tratamiento individualizado con AINE, merece una consideración especial la valoración de comorbilidad y terapias asociadas en el paciente, así como los efectos colaterales y el coste de tratamientos específicos.
Entre los efectos adversos, cabe destacar los gastrointestinales y los renales. Los estudios disponibles muestran que entre personas de 65 años o más, entre un 20 y un 30% de todas las hospitalizaciones y fallecimientos se deben a enfermedad ulcerosa péptica atribuible al consumo de AINE, siendo en esta población el riesgo dosis dependiente (49,50). Los factores de riesgo para el desarrollo de un fallo renal reversible en pacientes con enfermedad renal de base (creatinina sérica ≥ 2 mg.dl-1) que han sido tratados con AINE, incluyen la edad mayor o igual a 65 años, la hipertensión arterial y/o el fallo cardiaco congestivo, y el uso concomitante de diuréticos e inhibidores del enzima convertidor de angiotensina (IECAS) (51).
Otros efectos secundarios mucho más infrecuentes son las reacciones de hipersensibilidad, que suelen ser específicas y no cruzadas para otros AINE, y las reacciones hematológicas (actividad antiagregante plaquetaria, episodios hemolíticos en pacientes con deficiencia de G-6PD, reacciones inmunitarias del tipo agranulocitosis, anemia aplásica, trombocitopenia, etc.) (46).
Las dosis iniciales deben ser bajas, incrementándolas sólo si son ineficaces en el alivio sintomático.
En pacientes con artrosis que ya toman un AINE pero que no siguen un programa adecuado de medidas no farmacológicas, debería iniciarse de modo inmediato, lo que permitiría la reducción de dosis del AINE o incluso la sustitución de dicho fármaco por paracetamol (14).
En todos aquellos pacientes cuyos síntomas estén bien controlados, deberían hacerse intentos periódicos para reducir las dosis de fármacos, determinando si es posible, el uso de tales agentes a demanda en lugar de tratamiento continuado de fondo.
Debe evitarse la asociación de varios AINE, ya que la combinación no aumentará el poder antiinflamatorio y sí sus efectos adversos, excepto para el uso concomitante de aspirina (dosis de 81-325 mg.día-1) por su efecto cardioprotector (17).
Los agentes más frecuentemente prescritos son ibuprofeno y naproxeno, si bien hay un amplio grupo de fármacos disponibles. De entre ellos, la indometacina puede asociarse con una destrucción articular acelerada en pacientes con artrosis de cadera, por lo que probablemente no debería usarse como tratamiento a largo plazo (17,52).
La elección del AINE frecuentemente es empírica y determinada en gran parte por la frecuencia en su administración y por el coste (53).
La vía de administración será preferentemente la oral, reservándose la rectal o la parenteral para contadas excepciones (Tabla I).
Analgésicos opioides
Otra aproximación válida para artrosis sintomática que no responde a los fármacos hasta aquí mencionados, principalmente cuando el enfermo valora el dolor en la escala analógica visual por encima de 4, son los analgésicos del tipo codeína, tramadol, buprenorfina transdérmica, fentanilo transdérmicos y oxicodona. Son útiles también a corto plazo en el tratamiento de las exacerbaciones agudas del dolor (Tablas II y III).
Existe un ensayo clínico que mostró como el tramadol, agonista opioide sintético que también inhibe la recaptación de serotonina y noradrenalina, permitía la reducción de la dosis de naproxeno en pacientes con artrosis de rodilla. Así mismo, la eficacia del tramadol se ha encontrado comparable a la del ibuprofeno en pacientes con artrosis de rodilla o cadera, demostrando ser útil como terapia adyuvante en pacientes cuyos síntomas no se controlan adecuadamente con AINE (54-56).
Analgésicos tópicos
De eficacia controvertida, parece que producen una analgesia moderada de la zona donde se aplican, derivada tanto de la inhibición de las terminaciones nerviosas nociceptivas dérmicas y subdérmicas, como del efecto beneficioso del masaje en el drenaje venoso y linfático de mediadores inflamatorios, sin descartar un cierto efecto placebo.
Son agentes bien tolerados y en general del agrado de los pacientes. De especial interés en pacientes con artrosis y dolor de leve a moderado, que no responden a paracetamol y que no desean pasar a otro tratamiento sistémico. Su uso es apropiado tanto como tratamiento coadyuvante a la terapia oral, como en monoterapia.
Cabe destacar los AINE y la capsaicina tópica.
Múltiples AINE están disponibles en forma tópica. Distintos ensayos comparan diclofenaco y eltenaco tópicos con placebo, demostrando mejoría significativa en el alivio doloroso en el grupo tratado (57,58). Un ensayo realizado por nosotros demostró que el piroxicam administrado con cremophor fue eficaz en el tratamiento del dolor y el edema de pacientes con artrosis de rodilla (59).
Los AINE tópicos tienen un gran nivel de seguridad, siendo las reacciones cutáneas locales la principal complicación. Un gran estudio casos-control no encontró asociación alguna entre el empleo de AINE tópicos y complicaciones gastrointestinales (60).
La capsaicina al 0,025%, fármaco que actúa sobre los receptores VR-1 desensibilizando de manera reversible las fibras C nociceptivas, está usándose ampliamente en la artrosis, habiendo buena evidencia de su eficacia principalmente en la artrosis de rodilla, donde parece que el beneficio es sostenido en el tiempo (61,62). No se han comunicado efectos secundarios sistémicos, siendo frecuente una sensación de quemazón local, que raramente obliga a interrumpir la terapia (2,15).
Los agentes tópicos no han sido estudiados en la artrosis de cadera, y su eficacia es cuestionable debido a la profundidad articular (14).
TRATAMIENTO FARMACOLÓGICO EN PACIENTES CON RIESGO AUMENTADO PARA PADECER EFECTOS ADVERSOS GASTROINTESTINALES
Las opciones médicas en pacientes con artrosis que no han respondido a analgésicos simples orales o a tratamiento tópico, y que presentan un riesgo elevado de sufrir un evento gastrointestinal grave secundario a la toma de AINE, tal como la hemorragia digestiva, la perforación gástrica o la obstrucción intestinal, merecen una consideración especial.
Los factores de riesgo para desarrollar efectos secundarios gastrointestinales graves incluyen la edad mayor o igual a 65 años, la historia previa de úlcera péptica o de sangrado digestivo alto, el uso concomitante de corticosteroides o anticoagulantes orales, la presencia de comorbilidad y posiblemente el hábito tabáquico y el enólico (63).
Los inhibidores selectivos de la ciclooxigenasa 2 (COX-2), celecoxib, rofecoxib y los coxibs de segunda generación: valdecoxib, parecoxib, etoricoxib y lumiracoxib han sido estudiados con este fin en pacientes con artrosis. Grandes ensayos comparando COX-2 con placebo y con AINE convencionales han mostrado la superioridad de los COX-2 sobre placebo con una eficacia similar a los AINE no selectivos en el alivio del dolor, pero con una reducción cercana al 50% en las perforaciones gástricas, úlceras pépticas y sangrados gastrointestinales (64-67).
A las dosis recomendadas en el tratamiento de la artrosis, tanto celecoxib como rofecoxib y valdecoxib parecen ser bien tolerados, con una baja incidencia de dispepsia y otros efectos colaterales gastrointestinales al ser comparados con los AINE no selectivos (68); es lumiracoxib el que presenta la máxima seguridad desde el punto de vista gastrointestinal (69) (Tabla IV).
Además, ninguno de los COX-2 ha demostrado tener efecto clínicamente significativo sobre la agregación plaquetaria o el tiempo de hemorragia, consideración especialmente importante en el manejo pre y perioperatorio de pacientes con artrosis, y en los pacientes que toman warfarina sódica (14).
Los informes actuales muestran que los efectos secundarios a nivel renal y cardiovascular ocurren por igual en pacientes tratados con AINE no selectivos y en aquellos tratados con coxibs, por lo que deberán usarse con precaución en pacientes con HTA, fallo cardiaco congestivo o insuficiencia renal de moderada a severa.
El uso de celecoxib está contraindicado en pacientes con historia de reacción alérgica a sulfonamidas (14).
Una alternativa al empleo de COX-2 es el uso de AINE no selectivos junto a agentes gastroprotectores. Los estudios más recientes realizados con objeto de examinar la efectividad de tal combinación concluyen que distintos fármacos son útiles a tal efecto. Así, el misoprostol reduce significativamente el riesgo de úlceras endoscópicas, viéndose limitado su efecto beneficioso por los efectos secundarios, en especial la diarrea y la flatulencia (70). De igual forma, los anti-H2 a dosis estándar reducen el riesgo de úlceras duodenales, pero no el de úlceras gástricas. Los anti-H2 a dosis doble y los inhibidores de la bomba de protones, reducen con efectividad el riesgo de úlceras duodenales y gástricas, siendo ambos fármacos mejor tolerados que el misoprostol (71,72).
En estos pacientes, pues, la evidencia avala el uso de COX-2 o la adicción de un agente gastroprotector a los convencionales AINE.
El uso concomitante de misoprostol o inhibidores de la bomba de protones/anti-H2H2 junto a AINE, no está recomendado en pacientes de bajo riesgo (2).
FÁRMACOS CONDROPROTECTORES (SYSADOA: SYMPTOMATIC SLOW ACTION DRUGS OSTEOARTRITIS)
Se trata de un grupo heterogéneo de fármacos que actúan sintomática y lentamente en la artrosis de rodilla, y que incluyen fundamentalmente el sulfato de glucosamina, el condroitín sulfato, la diacereina y el ácido hialurónico. La clasificación de las mismas varía de unos países europeos a otros, etiquetándose en el Reino Unido, por ejemplo, de suplementos alimenticios, estando disponibles en tiendas y siendo su consumo muy amplio (2).
Tanto el condroitín sulfato como el sulfato de glucosamina han sido objeto de un metanálisis que recogía toda la información disponible hasta 1999, concluyendo el informe que poseían un efecto de moderado a intenso sobre el dolor y la funcionalidad en pacientes con artrosis, al ser comparados con placebo (73).
Son productos seguros que se asocian con pocos efectos indeseables.
Distintos ensayos clínicos han comparado los efectos del condroitín y la glucosamina frente a distintos AINE en la artrosis de rodilla, encontrando una respuesta más lenta pero sostenida en el tiempo con estos fármacos; sin embargo el AINE resultó ser más efectivo en la disminución del dolor a corto plazo (74).
Otro ensayo clínico demostró un retraso en la progresión de la pérdida del espacio articular y una mejoría en el dolor y la funcionalidad al comparar glucosamina con placebo, sugiriendo que la glucosamina podría ser usada como un agente modificador estructural en la artrosis de rodilla (75).
El papel del ácido hialurónico intraarticular en la reducción del dolor, la mejora funcional y la modificación de la enfermedad en la artrosis de rodilla ha sido bien establecido. Algunos estudios han examinado directamente el efecto sobre la modificación estructural, observándose menos deterioro articular cuando se trató con ácido hialurónico, mostrando el grupo tratado una mejora en la realización de actividades de la vida diaria y en la disminución en el consumo de AINE, así como la reducción en la necesidad de corticoides intraarticulares tras un periodo de seguimiento de un año (76). Hay que advertir, eso sí, que la mayoría de los estudios con ácido hialurónico intraarticular excluyen a los pacientes con artrosis severa.
Hay evidencia, pues, que apoya la eficacia del ácido hialurónico en la artrosis de rodilla, tanto en el alivio del dolor como en la mejora funcional, si bien el inicio de acción es lento, más que con los corticoides intraarticulares, y precisa administrar 1 dosis semanal durante 3 a 5 semanas, con los costes y la infraestructura que ellos supone (2).
La infiltración articular con ácido hialurónico no está aprobada para la artrosis de cadera (14).
INYECCIÓN INTRAARTICULAR DE CORTICOIDES
Indicada fundamentalmente en pacientes con artrosis de rodilla y dolor importante con o sin derrame articular que no cede con las medidas hasta aquí descritas. En el caso de que exista derrame está indicada la artrocentesis previa, enviándose el líquido articular para contaje celular y procediéndose a cultivo y tinción de Gram ante la sospecha de infección, seguida de la infiltración de corticoides, que a medio y corto plazo disminuirá el dolor y aumentará la fuerza del cuádriceps (77).
Ocasionalmente los corticoides intraarticulares pueden usarse en la artrosis de cadera, debiendo realizarse la técnica bajo control fluoroscópico, o en su defecto sólo por personal entrenado en dicha técnica (14).
El efecto de los corticoides ha sido avalado por distintos estudios, demostrando ser más efectivos que placebo, y encontrándose los mayores beneficios en pacientes con efusión articular. El beneficio es, sin embargo, relativamente corto (78).
La inyección puede ser usada como monoterapia en pacientes seleccionados o como adyuvante a la terapia sistémica.
Se recomienda que la inyección intraarticular de corticoides no se realice más de 3 ó 4 veces al año, por el posible daño cartilaginoso que puede producirse tras inyecciones repetidas, principalmente en articulaciones sometidas a carga (15).
No debe olvidarse que se trata de una técnica invasiva, habiéndose de realizar en condiciones asépticas.
LAVADO ARTICULAR
En individuos con artrosis de rodilla evolucionada y sintomática que no han respondido satisfactoriamente a las medidas farmacológicas y no farmacológicas hasta aquí expuestas, o que rehúsen o tengan contraindicaciones para la cirugía ortopédica, puede ser una buena alternativa, poco agresiva y que evita la polimedicación del paciente.
Los lavados articulares con suero fisiológico pueden realizarse de manera ambulatoria bajo anestesia local, consiguiendo la distensión articular transitoria, liberando potenciales adhesiones articulares, y contribuyendo a la retirada de detritus, citoquinas inflamatorias y microcristales, consiguiendo así una mejoría sintomática de hasta 6 meses (78,79).
Otra modalidad es el lavado artroscópico con desbridamiento cartilaginoso, lo que consigue regularizar las superficies articulares reavivando el hueso subcondral, con la consiguiente cicatrización de la superficie articular y la evolución hacia la formación de fibrocartílago. Es especialmente útil en pacientes con artrosis de rodilla y patología meniscal asociada y/o síntomas de bloqueo de rodilla (15).
TRATAMIENTO QUIRÚRGICO
El momento de la cirugía y la mejor opción para cada paciente requiere de una cuidadosa evaluación por parte del cirujano ortopédico. La cirugía está indicada fundamentalmente en pacientes con artrosis sintomática severa, cuyo dolor no ha respondido al tratamiento médico, y en quienes las limitaciones para realizar actividades de la vida diaria van en aumento (12).
En pacientes con artrosis de rodilla las opciones van desde la osteotomía de normoalineación hasta la artroplastia total. La osteotomía, dependiendo del compartimento articular predominantemente afecto, será valguizante de tibia proximal (en caso de afectación unicompartimental interna), o femoral supracondílea de apertura (en afectación del compartimento externo). Se indica principalmente en pacientes jóvenes, menores de 60 años, con desalineación varo-valgo inferior a 20º, estadios evolutivos radiológicos iniciales (grados I y II), con flexión mínima de 90º y ausencia de subluxación de espinas tibiales o de bostezo articular importante. La osteotomía puede proporcionar un alivio sintomático importante y prevenir la progresión de la enfermedad (14,80).
La artroplastia o recambio articular es una intervención irreversible usada en aquellos pacientes en los que han fallado otras modalidades terapéuticas, y en los que tienen una enfermedad articular severa. El recambio articular es seguro y efectivo, mejorando la calidad de vida, reduciendo el dolor y mejorando la función en los pacientes más severamente incapacitados. Distintas revisiones de lo publicado hasta la actualidad concluyen que todas las formas de recambio articular de rodilla mejoran la calidad de vida. No hay ensayos clínicos que comparen la artroplastia total de rodilla con intervenciones no quirúrgicas (2,81,82).
Las indicaciones para el recambio total de cadera incluyen la evidencia radiológica de daño articular, y el dolor y/o la incapacidad persistentes, de moderado a severo, que no mejoran sustancialmente tras un correcto abordaje no quirúrgico (80,83).
En cualquier caso, los resultados dependen en gran medida del momento en que se realice la cirugía, de la experiencia del cirujano y del estado preoperatorio del paciente, así como del manejo peri y postoperatorio y de la rehabilitación ulterior (14).
RESONANCIA MAGNÉTICA TERAPÉUTICA
La resonancia magnética, como terapéutica del dolor producido por la artrosis, es un concepto de tratamiento relativamente nuevo.
Al aplicar un campo magnético de magnitud similar al producido por las células, en función de las frecuencia de inducción que se aplique, determinadas partículas entran en resonancia. Esto se traduce clínicamente en la paliación del dolor en las estructuras afectas.
El Ministerio de Sanidad y Consumo ha autorizado el empleo de la resonancia magnética terapéutica (RMT) para el tratamiento de la gonartrosis, basándose en diversos ensayos clínicos randomizados, doble ciego, frente a placebo (83).
Nosotros hemos aplicado el procedimiento en pacientes afectos de gonartrosis de larga evolución con el fin de paliar su dolor.
Los pacientes, reciben varias sesiones de RMT. Nuestra experiencia clínica indica que a mayor tiempo de evolución del dolor, es necesario un número mayor de sesiones de RMT para que el dolor desaparezca por completo.
Los pacientes experimentan una disminución media del dolor del 70%, la sensación subjetiva de la rodilla de los pacientes unos días después de finalizar la terapia es positiva en todos los casos, encontrándose todos mejor o mucho mejor que antes de comenzar la terapia.
Aunque los estudios actuales no son concluyentes debido al escaso número de pacientes tratados. No obstante, sí pueden orientarnos acerca del comportamiento de este tipo de terapia en un uso habitual hospitalario, con diferentes tipos de pacientes y diversos tratamientos concomitantes.
La aplicción de la RMT es de forma automática, sin la necesidad de personal especializado asignado al paciente. Únicamente se necesita personal que se encarge de colocar al paciente en la camilla y le ayude a levantarse al finalizar la sesión.
En la tarjeta de tratamiento queda grabado el protocolo de artrosis, en el que se incluyen los parámetros adecuados a cada una de las estructuras que pueden ser origen de dolor en dicha patología, con lo que nos ahorramos la determinación las estructuras que originan el dolor para dirigir el tratamiento. La RMT parece una buena alternativa en el tratamiento del dolor asociado a la gonartrosis (84).
CONCLUSIONES
El tratamiento de pacientes con artrosis de rodilla y cadera debería individualizarse, adaptándose a la severidad de los síntomas. Cuando la artrosis sintomática es leve, el tratamiento debería limitarse a la educación del paciente, a la terapia física y educacional y a otras modalidades no farmacológicas, así como a tratamiento farmacológico que incluyese analgésicos orales simples, analgésicos tópicos y fármacos condroprotectores. En pacientes que no responden a este régimen terapéutico, el uso de AINE sumado al tratamiento no farmacológico es adecuado, a menos que exista contraindicación médica.
El uso juicioso de corticoides intraarticulares, en el caso de la artrosis de rodilla, tiene un papel reconocido, tanto en monoterapia como asociados al tratamiento sistémico (84).
Los pacientes con artrosis severa y sintomática requieren un tratamiento agresivo, con el objetivo de disminuir el dolor, incrementar la movilidad y disminuir la incapacidad funcional, debiendo ser valorados por el cirujano ortopédico quien planteará la mejor opción quirúrgica (Fig. 3).
|
BIBLIOGRAFÍA
1. Martín A, Cano JF. Atención Primaria: conceptos, organización y práctica clínica. Madrid: Harcourt-Brace, 1999. p. 1128-52. [ Links ]
2. Jordan KM, Arden NK, Doherty M, et al. EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of de Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann Rheum Dis 2003; 62: 1145-55. [ Links ]
3. Consejo General de Colegios Oficiales de Farmacéuticos. Revisión Artrosis. Panorama actual de medicamento 2000; 238.http://www.portalfarma.com [ Links ]
4. Guccione AA, Felson DT, Anderson JJ, et al. The effects of specific medical conditions on the functional limitations of elders in the Framingham study. Am J Publ Health 1994; 84: 351-8. [ Links ]
5. Murray CJL, López AD. The global burden of disease. Ginebra: World Health Organisation, 1997. [ Links ]
6. Felson DT. Osteoarthritis new insights. Part 1: the disease and its risk factors. Ann Intern Med 2000; 133: 637-9. [ Links ]
7. Cooper C, Snow S, McAlindon TE, et al. Risk factors for the incidence and progression of radiographic knee osteoarthritis. Arthritis Rheum 2000; 43: 995-1000. [ Links ]
8. Holderbaum D, Haqqi TM, Moskowitz RW. Genetics and osteoarthritis: exposing the iceberg. Arthritis Rheum 1995; 38: 1535-40. [ Links ]
9. Spector TD, Cicuttini F. Baker J, et al. Genetic influences in women: a twin study. BMJ 1996; 312: 940-3. [ Links ]
10. Mow VC, Setton LA, Guilak F, Ratcliffe A. Osteoarthritic disorder: mechanical factors in articular cartilage and their role in osteoarthritis. Rosemont: Kuettner KE, Goldberg VM, eds. 1995. p. 147-72. [ Links ]
11. Poole AR. Osteoarthritic disorder: Imbalances of anabolism and catabolism of cartilage matrix components in osteoarthritis. Rosemont: Kuettner KE, Goldberg VM, eds. 1995. p. 247-60. [ Links ]
12. Goldberg VM, Ketteldamp DB, Colyer RA. Osteoarthritis: diagnosis and medical/surgical management. Moskowitz RW, Howell DS, Goldberg VM, Mankin HJ. Filadelfia: Saunders WB, 1992. [ Links ]
13. Wilson MG, Poss R. Osteoarthritis: diagnosis and medical/surgical management. Moskowitz RW, Howell DS , Goldberg VM, Mankin HJ. Filadelfia: Saunders WB, 1992. [ Links ]
14. Altman R, Hochberg M, Moskowitz R, et al. Recommendations for the medical management of osteoarthritis of the hip and knee. Arthritis Rheum 2000; 43: 1905-15. [ Links ]
15. Hochberg M, Altman R, Brandt K, et al. Guidelines for the medical management of osteoarthritis. Part II: Osteoarthritis of the Knee. Arthritis Rheum 1995; 38: 1541-6. [ Links ]
16. Cooper C. Epidemiology of osteoarthritis. Londres: Mosby, 1998. p. 1-20. [ Links ]
17. Hochberg M, Altman R, Brandt K, et al. Guidelines for the medical management of osteoarthritis. Part I: Osteoarthritis of the hip. Arthritis Rheum 1995; 38: 1541-6. [ Links ]
18. Massardo L. Artrosis. available at: http://escuela.med.puc.cl/publ/reumatologia/Apuntes/13Artrosis.html [ Links ]
19. Mazzuca SA, Brandt KD, Katz BP, et al. Effects of self-care education on the health status of inner-city patients with osteoarthritis of the knee. Arthritis Rheum 1997; 40: 1466-74. [ Links ]
20. Superio-Cabuslay E, Ward MM, Loring KR. Patient education interventions in osteoarthritis and rheumatoid arthritis: a meta-analytic comparison with nonsteroidal antiinflammatory drug treatment. Arthritis Care Res 1996; 9: 292-301. [ Links ]
21. Mazzuca SA, Brandt KD, Katz BP, et al. Reduced utilisation and cost of primary care clinic visits resulting from self-care education for patients with osteoarthritis of the knee. Arthritis Rheum 1999; 42: 1267-73. [ Links ]
22. Loring KR, Mazonson PD, Holman HR. Evidence suggesting that health education for self-management in patiens with chronic arthritis has sustained health benefits while reducing health care cost. Arthritis Rheum 1993; 36: 439-46. [ Links ]
23. Weinberger M, Tierney WM, Booher P, et al. Can the provision of information to patients with osteoarthritis improve functional status? A randomised, controlled trial. Arthritis Rheum 1989; 32: 1577-83. [ Links ]
24. Maurer BT, Stern AG, Kinossian B, et al. Osteoarthritis of the knee: isokinetic quadriceps exercise versus an educational intervention. Arch Phys Med Rehabil 1999; 80: 1293-9. [ Links ]
25. Keefe FJ, Caldwell DS, Williams DA, et al. Pain coping skills training in the management of osteoarthritic knee pain-II: follow-up results. Behavior Therapy 1990; 21: 435-47. [ Links ]
26. Keefe FJ, Caldwell DS, Baucom D, et al. Spouse-assisted coping skills training in the management of knee pain in osteoarthritis: long-term follow-up results. Arthritis Care Res 1999; 12: 101-11. [ Links ]
27. Felson DT, Zhang Y, Anthony JM, et al. Weight loss reduces the risk for symptomatic knee osteoarthritis in women. The Framingham Study. Ann Intern Med 1992; 116: 535-9. [ Links ]
28. Messier SP, Loeser RF, Mitchell MN, et al. Exercise and weight loss in obese older adults with knee osteoarthritis: a preliminary study. J Am Geriatr Soc 2000; 48: 1062-72. [ Links ]
29. Panush RS. Is there a role for diet or other questionable therapies in managing rheumatic diseases? Bull Rheum Dis 1993; 42: 1-4. [ Links ]
30. Maillefert JF, Hudry C, Baron G, et al. Laterally elevated wedged insoles in the treatment of medial knee osteoarthritis: a prospective randomized controlled study. Osteoarthritis Cartilage 2001; 9: 738-45. [ Links ]
31. Voloshin D, Wosk J. Influence of artificaial shock absorbers on human gait. Clin Orthop Rel Res 1981; 160: 52-6. [ Links ]
32. Van Baar ME, Dekker J, Oostendorp RAB, et al. The effectiveness of exercise therapy in patients with osteoarthritis of the hip or knee: a randomized clinical trial. J Rheumatolol 1998; 25: 2432-9. [ Links ]
33. Pennix BWJH, Messier SP, Rejeski WJ, et al. Physical exercise and the prevention of disability in activities of daily living in older persons with osteoarthritis. Arch Intern Med 2001; 161: 2309-16. [ Links ]
34. Ettinger WH Jr, Burns R, Messier SP, et al. A randomized trial comparing aerobic exercise and resistance exercise with a health education program in older adults with knee osteoarthritis: the Fitness Arthritis and Seniors Trial (FAST). JAMA 1997; 277: 25-31. [ Links ]
35. Puett DW, Griffin MR. Published trials of nonmedicinal and noninvasive therapies for hip and knee osteoarthritis. Ann Intern Med 1994; 121: 133-40. [ Links ]
36. Minor MA. Exercise in the management of osteoarthritis of the knee and hip. Arthritis Care Res 1994; 7: 198-201. [ Links ]
37. American Geriatrics Society Panel on Chronic Pain in Older Persons. The management of chronic pain in older persons. J Am Geriatric Soc 1998; 46: 635-51. [ Links ]
38. Holzer SS, Cuerdon T. Development of an economic model comparing acetaminophen to NSAIDs in the treatment of mild-to-moderate osteoarthritis. Am J Managed Care 1996; 2: 15-56. [ Links ]
39. Schiodt FV, Rochling FA, Casey DL, et al. Acetaminophen toxicity in an urban country hospital. N Engl J Med 1997; 337: 1112-7. [ Links ]
40. Whitcomb DC, Block GD. Association of acetaminophen hepatotoxicity with fasting and ethanol use. JAMA 1994; 273: 1845-50. [ Links ]
41. Seifert CF, Lucas DS, Vondracek TG, et al. Patterns of acetaminophen use in alcoholic patients. Pharmacotherapy 1993; 13: 391-5. [ Links ]
42. Hyiek EM, Heiman H, Skates SJ, et al. Singer DE. Acetaminophen and other risk factors for excessive warfarin anticoagulation. JAMA 1998; 279: 657-62. [ Links ]
43. Fitzmaurice DA, Murray JA. Potentiation of anticoagulant effect of warfarin. Postgrad Med J 1997; 73: 439-40. [ Links ]
44. Henrich WL, Agodaoa LE, Barret B, et al. Analgesics and the kidney: summary and recommendations to the Scientific Advisory Board of the National Kidney Foundation from an Ad Hoc Committee of the National Kidney Foundation. Am J Kidney Dis 1996; 27: 162-5. [ Links ]
45. Abramson SA. Et tu acetaminophen? Arthritis Rheum 2002; 46: 2831-5. [ Links ]
46. Flórez J, Reig E. Terapéutica farmacológica del dolor. Pamplona: Ediciones Universidad de Navarra, S.A., 1994. [ Links ]
47. Williams HJ, Ward JR, Egge MJ, et al. Comparison of naproxen and acetaminophen in a two-year study of treatment of osteoarthritis of the knee. Arthritis Rheum 1993; 36: 1196-206. [ Links ]
48. Geba GP, Weaver AL, Polis AB, et al. Efficacy of rofecoxib, celecoxib, and acetaminophen in osteoarthritis of the knee. JAMA 2002; 287: 64-71. [ Links ]
49. Griffin MR, Piper JM, Daugherty JR, et al. Nonsteroidal anti-inflammatory drug use and increased risk for peptic ulcer disease in elderly persons. Ann Intern Med 1991; 114: 257-63. [ Links ]
50. Smalley WE, Griffin MR. The risk and costs of upper gastrointestinal disease attributable to NSAIDs. Gastroenterol Clin North Am 1996; 25: 373-96. [ Links ]
51. Garell S, Matarese RA. Renal effects of prostaglandins and clinical adverse effects of nonsteroidal anti-inflammatory agents. Medicine (Baltimore) 1984; 63: 165-81. [ Links ]
52. Rashad S, Revell P, Hemmingway A, et al. Effect of non-steroidal anti-inflammatory drugs on the course of osteoarthritis. Lancet 1989; 2: 519-22. [ Links ]
53. Greene JM, Winickoff RN. Cost conscious prescribing of non-steroidal antiinflammatory drugs for adults with arthritis: a review and suggestions. Arch Intern Med 1992; 152: 1995-2002. [ Links ]
54. Dalgin P, and the TPS-OA Study Group. Comparison of tramadol and ibuprofen for the chronic pain of osteoarthritis. Arthritis Rheum 1997; 9: S86. [ Links ]
55. Roth SH. Efficacy and safety of tramadol HCL in breakthrough musculoskeletal pain attributed to osteoarthritis. J Rheumatol 1998; 25: 1358-63. [ Links ]
56. Schnitzer TJ, Kamin M, Olson WH. Tramadol allows reduction of naproxen dose among patients with naproxen-responsive osteoarthritis pain. Arthritis Rheum 1999; 42: 1370-7. [ Links ]
57. Grace D, Rogers J, Skeith K, et al. Topical diclofenac versus placebo: a double blind, randomised clinical trial in patients with osteoarthritis of the knee. J Rheumatol 1999; 26: 2659-63. [ Links ]
58. Ottilinger B, Gomor B, Michel BA, et al. Efficacy and safety of eltenac gel in the treatment of knee osteoarthritis. Osteoarthritis Cartilage 2001; 9: 273-80. [ Links ]
59. Torres LM, Jolin T, Noriega JJ, et al. Piroxicam cremophor gel versus piroxicam gel estándar en el tratamiento del dolor musculoesquelético. Rev Soc Esp Dolor 1996; 3: 235-40. [ Links ]
60. Evans JMM, McMahon AD, McGilchrist MM, et al. Topical non-steroidal anti-inflammatory drugs and admission to hospital for upper gastrointestinal bleeding and perforation: a record linkage case control study. BMJ 1995; 311: 22-6. [ Links ]
61. Deal CL, Schnitzer TJ, Lipstein E, et al. Treatment of arthritis with topical capsaicin: a double-blind trial. Clin Ther 1991; 13: 383-95. [ Links ]
62. Altman RD, Aven A, Holmburg CE, et al. Capsaicin cream 0.025% as monotherapy for osteoarthritis: a double-blind study. Semin Arthritis Rheum 1994; 23: 25-33. [ Links ]
63. Lanza FL, and the Members of the Ad Hoc Committee on Practice Parameters of the American College of Gastroenterology. A guideline for the treatment and prevention of NSAID-induced ulcers. Am J Gastroenterol 1998; 93: 2037-46. [ Links ]
64. Cannon GW, Caldwell JR, Holt P, et al. Rofecoxib, a specific inhibitor of cyclooxygenase 2, with clinical efficacy comparable with that of diclofenac sodium: results of a one-year, randomized, clinical trial in patients with osteoarthritis of the knee and hip. Arthritis Rheum 2000; 43: 978-87. [ Links ]
65. Clemett D, Goa KL. Celecoxib: a review of its use in osteoarthritis, rheumatoid arthritis, and acute pain. Drugs 2000; 59: 957-80. [ Links ]
66. Day R, Morrison B, Luza A, et al. A randomized trial of the efficacy and tolerability of the COX-2 inhibitor rofecoxib vs ibuprofen in patients with osteoarthritis. Arch Intern Med 2000; 160: 1781-7. [ Links ]
67. McKenna F, Borenstein D, Wendt H, et al. Celecoxib versus diclofenac in the management of osteoarthritis of the knee. Scand J Rheumatol 2001; 30: 11-8. [ Links ]
68. Langman MJ, Jensen DM, Watson WJ, et al. Adverse upper gastrointestinal effects of rofecoxib compared with NSAIDs. JAMA 1999; 282: 1929-33. [ Links ]
69. Stichtenoth DO, Frolich JC. The second generation of COX-2 inhibitors: what advantages do the newest offer? Drugs 2003; 63: 33-45. [ Links ]
70. Raskin JB, White RH, Jackson JE, et al. Misoprostol dosage in the prevention of nonsteroidal anti-inflammatory drug-induced gastric and duodenal ulcers: a comparison of three regimens. Ann Intern Med 1995; 123: 241-9. [ Links ]
71. Hawkey CJ, Karrasch JA, Szczepanski L, et al. Omepraxole compared with misoprostol for ulcers associated with nonsteroidal antiinflammatory drugs. N Engl J Med 1998; 338: 727-34. [ Links ]
72. Rostmon A, Dube C, Wells G, et al. Prevention of NSAID induced gastroduodenal ulcers (Cochrane review). The Cochrane Library. Oxford: Update software, 2003. Nº 1. [ Links ]
73. McAlindon TE, LaValley MP, Gulin JP, et al. Glucosamine and chondroitin for treatment of osteoarthritis: a systematic quality assessment and meta-analysis. JAMA 2000; 283: 1469-75. [ Links ]
74. Mazieres B, Combe B, Phan Van A, et al. Chrondoitin sulphate in osteoarthritis of the knee: a prospective, double blind, placebo-controlled multicenter clinical study. J Rheumatol 2001; 28: 173-81. [ Links ]
75. Reginster JY, Deroisy R, Ravati LC, et al. Long-term progression of glucosamina sulphate on osteoarthritis progression: a randomised, placebo-controlled clinical trial. Lancet 2001; 357: 251-6. [ Links ]
76. Listrat V, Ayral X, Patarnello F, et al. Arthroscopic evaluation of potential structure modifying activity of hyaluronan in osteoarthritis of the knee. Osteoarthritis Cartilage 1997; 5: 153-60. [ Links ]
77. Creamer P. Intra-articular corticosteroid injections in osteoarthritis: do they work and if so, how? Ann Rheum Dis 1997; 56: 634-6. [ Links ]
78. Ravaud P, Moulinier L, Giraudeau B, et al. Effects of joint lavage and steroid injection in patients with osteoarthritis of knee. Results of a multicenter, randomised, controlled trial. Arthritis Rheum 1999; 42: 475-82. [ Links ]
79. Ike RW, Arnold WJ, Rothschild EW, et al. Tidal irrigation versus conservative medical management in patients with osteoarthritis of the knee: a prospective randomized study. J Rheumatol 1992; 19: 772-9. [ Links ]
80. Buckwalter JA, Lohmander S. Operative treatment of osteoarthrosis: current practice and future development. J Bone Joint Surg 1994; 76: 1405-18. [ Links ]
81. Dieppe P, Basler HD, Chard J, et al. Knee replacement surgery for osteoarthritis: effectiveness, practice variations, indications and possible determinants of utilization. Rheumatology 1999; 38: 73-83. [ Links ]
82. Chard J, Lohmander S, Smith C, Scott D. Osteoarthritis: clinical evidence. A compendium of the best evidence for effective health care. Londres: BMJ Publishing Group, 2002. p. 1212-37. [ Links ]
83. NIH. Total hip replacement. NIH Consensus Statement 1994; 12: 1-31. [ Links ]
84. Wolsko PM, Eisenberg DM, Simon LS, et al. Double-blind placebo-controlled trial of static magnets for the treatment of osteoarthritis of the knee: results of a pilot study. Altern Ther Health Med. 2004;10:36-43. [ Links ]
85. Vidal M, Martínez J, Torres LM. Resonancia Magnética Terapéutica en la Artrosis de Rodilla. Rev Soc Esp Dolor, 2005, en prensa. [ Links ]
86. Torres LM. Medicina del Dolor. Barcelona: Ed. Masson, 1997: 3-7. [ Links ]