Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.13 no.2 Madrid mar. 2006
ORIGINAL
El dolor neuropático como causa de ansiedad, depresión y trastornos del sueño en condiciones de práctica médica habitual: resultados del estudio naturalístico DONEGA
Neurophatic pain as a cause of anxiety, depressión and sleep disturbance in standard condition of care: DONEGA naturalistic study
R. Gálvez1, C. Marsal2, J. Vidal3, Mª A. del Real4, M. Ruiz5 y J. Rejas6.
1Unidad del Dolor y Cuidados Paliativos, Hospital Virgen de las Nieves, Granada
2Servicio de Neurología, Hospital Virgen de la Salud, Toledo
3Servicio de Reumatología,Hospital General Universitario de Guadalajara
4Servicio de Neurología, Hospital Alarcos, Ciudad Real
5Área de Neurociencias, Unidad Médica Pfizer España, Madrid
6Departamento de Investigación de Resultados en Salud, Unidad Médica, Pfizer España, Madrid
Dirección para correspondencia
SUMMARY
Aim: The goal of this cross-sectional evaluation was to assess pain impact on sleep and symptoms of depression and anxiety in patients with neuropathic pain (NeP).
Methods: Participants in an observational, prospective and multicenter study (DONEGA study) with NeP of broad etiologies, completed the Short Form-McGill Pain Questionnaire (SF-MPQ), the COVI Anxiety Scale, the RASKIN Depression Scale, and the MOS Sleep Scale at baseline.
Results: A total of 1,519 patients above 18 years [mean ± SD; 56.9±13.6 years old (61.2% female)] with NeP for 1.1±2.8 years were enrolled in the study. Average present pain intensity was 2.8±1.0 (range 0-5) and mean pain past week was 71.2±18.9 mm (range 0-100). Pain substantially interfered with patient normal sleep and its attributes, obtaining high scoring in composite measures (9-items); 47.1±21.3 (range 0-100). The 19.7% and 12.9% of patients had symptoms of depression and anxiety, respectively. Severity of previous and present pain were the most important determinants causing negative impact on patient sleep. Scoring on sleep scale and, alternately, depression and anxiety scales scoring were the main determinants for depression and anxiety, respectively.
Conclusions: NeP negatively impact on patient sleep and its attributes, while causes a substantial proportion of patients with symptoms of anxiety and depression. Pain severity amplifies these findings.
Key words: neuropathic pain, standard condition of care, anxiety, depression, sleep, sleep attributes.
RESUMEN
Objetivo: El objetivo de este análisis transversal ha sido describir el impacto del dolor sobre el sueño y los síntomas de ansiedad y depresión en pacientes con dolor de tipo neuropático (DN).
Métodos: Pacientes con DN de etiología diversa, incluidos en un estudio observacional, prospectivo y multicéntrico (estudio DONEGA) completaron el cuestionario de dolor de McGill (SF-MPQ), las escalas COVI de ansiedad y RASKIN de depresión, y el cuestionario de sueño MOS Sleep antes de recibir el tratamiento del estudio.
Resultados: Se incluyeron 1.519 pacientes, > 18 años (edad media± DT; 56,9±13,6 años, 61,2% mujeres) y 1,1±2,8 años de evolución. La puntuación media del dolor en la semana previa fue 71,2±18,9 mm (rango 0 a 100) y la intensidad actual de 2,8±1,0 (rango 0-5). El dolor impactó severamente al sueño de forma global en todos sus atributos incluido la arquitectura del mismo; componente resumen de 9-ítems corregido; 47,1±21,3 (rango 0 a 100). El 19,7% y el 12,9% de los pacientes mostraron síntomas de depresión y ansiedad, respectivamente. La intensidad del dolor, previo y actual, fueron las variables más determinantes en el impacto negativo en el sueño, mientras que la puntuación en el cuestionario de sueño y, alternativamente, las puntuaciones en las escalas de depresión y ansiedad, lo fueron para depresión o ansiedad, respectivamente.
Conclusiones: El DN se asocia a un impacto negativo en el sueño y sus atributos, a la vez que ocasiona una proporción considerable de pacientes con síntomas de ansiedad y depresión. La intensidad del dolor magnifica estos hallazgos.
Palabras claves: Ansiedad. Atributos del sueño. Depresión. Dolor neuropático. Práctica médica habitual. Sueño. Vida real.
Introducción
Según la Asociación Internacional para el Estudio del Dolor (International Association for the Study of Pain -IASP-), el dolor neuropático (DN) se define como un dolor iniciado o causado por una lesión primaria en el sistema nervioso, siendo un síntoma común a un grupo diverso de patologías entre las que se incluye la neuropatía diabética, la neuralgia del trigémino o la neuralgia postherpética y el asociado a lesiones medulares entre otros cuadros patológicos.(1,2) Generalmente se distinguen dos tipos distintos de dolor; nociceptivo y neuropático. El dolor nociceptivo con o sin componente inflamatorio es un síntoma crucial en los mecanismos adaptativos de defensa del organismo, y se asocia frecuentemente con daño tisular o inflamación. El DN surge cuando se lesiona sistema nervioso a nivel periférico o central, llevando a la aparición de hiperexcitabilidad neuronal, hallazgo típico en los pacientes con DN. (2) El dolor de tipo mixto, neuropático y nociceptivo, es lógicamente una combinación de ambos tipos de dolor. (3) El DN figura como uno de los problemas crónicos de salud más común y destacado. Se estima que la prevalencia puntual del DN oscila entre el 5-7.5% en Europa (según el Grupo de Dolor Neuropático de la IASP) en la población adulta, y ocasiona hasta el 25% de las causas de consulta en las clínicas del dolor.(4) Sin embargo, esta cifra puede infraestimar la carga asis-tencial real por este motivo, toda vez que muchos pacientes con dolor crónico permanecen sin consultar al médico por este problema de salud.(5,6)
Se considera que el tratamiento del DN puede ser extremadamente complicado, particularmente cuando en asociación aparecen otros síntomas comórbi-dos, lo que además es bastante frecuente.(7) Los pacientes con DN persistente sufren discapacidad en mayor o menor medida para realizar su trabajo con normalidad, padecen limitaciones considerables de su actividad habitual, y su funcionamiento social se ve limitado(8). En estas circunstancias, se habla con frecuencia de la llamada triada del dolor, a saber; dolor, trastornos de la esfera emocional (ansiedad y depresión) y alteraciones del sueño con mayor o menor intensidad(7-11). Se comprende fácilmente, que el DN constituye un inconveniente importante para la salud, no sólo para el propio paciente y sus familiares, sino que también se convierte en un problema de salud pública por el impacto que supone en el consumo y utilización de recursos sanitarios, y por el agravio que ocasiona en la productividad laboral de los individuos con esta patología que todavía son activos.(12)
La literatura científica mundial hace referencia a esta triada en el DN, particularmente fundamentada en las observaciones realizadas en ensayos clínicos y revisiones sistemáticas de la literatura.(7,13-16) La prevalencia de depresión se ha cifrado hasta en un 20% de los pacientes con neuralgia postherpética, y la presencia de ansiedad es notoria en sujetos con dolor neuropático central o asociado a miembro fantasma.(17,18) Sin embargo, las condiciones en las que se realizan los ensayos clínicos, están alejadas en muchas ocasiones de lo que realmente ocurre en la vida real en condiciones de práctica médica habitual. Esto último es de importancia crucial, por cuanto no solo impacta en el propio bienestar del paciente, sino que se traslada también al Sistema Sanitario donde se encuentra, puesto que se traduce en una fuente considerable de consumo de recursos sanitarios.
Las recomendaciones Europeas recientes de tratamiento y control de los pacientes con DN incluyen la exploración y búsqueda, además de la causa etiológica del dolor, de síntomas de ansiedad y depresión, así como de presencia de trastornos del sueño entre otros(19,20). No se dispone en España de mucha información en nuestro entorno sanitario sobre la asociación de depresión, ansiedad y trastornos del sueño en pacientes con DN de diferentes etiologías y causas. En dos recientes trabajos sobre el dolor neuropático publicados en nuestro entorno, se revisa con profundidad tanto la epidemiología del mismo, como los avances en la fisiopatología y su tratamiento, pero se hace escasa mención a la prevalencia de las alteraciones del sueño o los trastornos de la esfera emocional(6,21). Por tanto, el objetivo de este trabajo es presentar la frecuencia de asociación de las patologías mencionadas anteriormente en pacientes con dolor neuropático de causa etiológica variada, cuando son tratados y controlados en condiciones de práctica médica habitual, así como el impacto del mismo en el sueño (estudio DONEGA)(22).
Material y métodos
Población del estudio
Se ha analizado la muestra de 1.519 pacientes, de ambos sexos, > 18 años, incluida en un estudio abierto, de corte naturalístico, prospectivo y multicéntrico desarrollado en consultas especializadas de asistencia al paciente con dolor (unidades del dolor, neurología, reumatología, etc.) de todo el territorio español, entre los años 2002 y 2003 (estudio DONEGA), (22) en el que se evaluaba la efectividad del tratamiento analgésico del DN de etiología diversa con dosis flexibles de gabapentina durante 3 meses. La evaluación que se presenta en este trabajo se realizó de forma transversal, a partir de los datos basales de la muestra, antes de recibir cualquier tratamiento por el hecho de participar en el estudio. Los criterios de selección incluyeron los siguientes: pacientes >18 años, ambos sexos, sin incapacidad para participar en estudios clínicos, diagnóstico clínico de dolor de origen neuropático, y que estuvieran dispuestos a otorgar el consentimiento por escrito para participar en el estudio. Se excluyeron pacientes con hipersensibilidad conocida a gabapentina y mujeres embarazadas o en periodo de lactancia, así como sujetos con incapacidad manifiesta para entender o cumplimentar cuestionarios de salud. El estudio intentaba replicar las condiciones de vida real en las que se manejan y tratan los pacientes en condiciones de práctica médica habitual con esta patología. En la tabla I se detallan las principales características demográficas de la muestra analizada.
La predeterminación del tamaño de muestra se realizó con el objetivo de encontrar diferencias significativas en la puntuación de dolor de la escala visual analógica del cuestionario abreviado de dolor de McGill (23), en la muestra global, y en las subpoblaciones principales según la enfermedad de base asociada al DN, después de tratamiento con dosis flexibles de gabapentina durante 3 meses. Los pacientes fueron incluidos de forma consecutiva, mediante un muestreo no probabilístico, una vez que se confirmaba el deseo del paciente de ser incluido en el estudio y de que se constatase que reunía los criterios de elegibilidad del mismo. Para la selección de los centros participantes se realizó un muestreo por conglomerados (centros y/o consultas de atención al paciente con dolor), siendo aleatoria la selección de los especialistas en dolor en cada centro.
Descripción de las escalas utilizadas
Escala abreviada de dolor de McGill (SF-MPQ);(23) se utilizó como herramienta de valoración de la variable principal del estudio, en particular la respuesta al dolor total según la escala visual analógica (EVA) de dolor que recoge el dolor promedio en la última semana. La EVA es una escala milimetrada con un recorrido de 100 mm y 2 extremos fijados en las 2 puntuaciones extremas; 0 (no dolor) y 100 (peor dolor imaginable). El cuestionario SF-MPQ incluye, también, un ítem (ítem PPI) que interroga por la intensidad actual del dolor en una escala ordinal tipo Likert de 6 categorías, ordenadas desde 0 (no-dolor) a 5 (dolor extremo). Aunque el paciente cumplimenta los ítems del cuestionario, éste es administrado por el entrevistador.
Escala de ansiedad de COVI; (24,25) éste es un instrumento de medición de salud autoadministrado de 3 ítems, cada uno de ellos corregidos en una escala tipo Likert de 5 categorías de recorrido desde nunca sucede o se observa (1) hasta siempre ocurre o sucede (5). Cada uno de los 3 ítems explora aspectos básicos de la presencia de ansiedad: comunicación verbal, comportamiento y quejas secundarias. La puntuación total se consigue mediante la suma de los 3 ítems, y puede oscilar entre 3 y 15 puntos. Según los autores que la desarrollaron, 9 o más puntos es compatible con presencia de ansiedad.
Escala de depresión de RASKIN; (26) es también un instrumento de medición de salud, autoadminis-trado de 3 ítems, cada uno de ellos corregidos en una escala tipo Likert de 5 categorías de recorrido desde nunca sucede o está presente (1) hasta siempre sucede o está presente (5). Cada uno de los 3 ítems explora aspectos considerados básicos de la presencia de depresión: experiencia subjetiva de depresión (expresión verbal), indicadores primarios de comportamiento depresivo, y signos secundarios de depresión (apetito, sueño o cambios cognitivos). La puntuación total se consigue mediante la suma de los 3 ítems, y puede oscilar entre 3 y 15 puntos. Según los autores de la escala, 9 o más puntos es compatible con presencia de depresión.
Escala de sueño del MOS; (27,28) la escala de sueño del Medical Outcomes Study (MOS) consiste en un instrumento de 12 ítems que explora el impacto o interferencia ocasionado por la enfermedad o un tratamiento o, en general, cualquier estímulo externo sobre los atributos de la arquitectura del sueño: idoneidad, sueño óptimo, cantidad, despertares bruscos, ronquidos, sueño alterado y somnolencia. Además, produce un índice global de interferencia del sueño que oscila entre 0 (ninguna interferencia o impacto) a 100 (máxima interferencia posible), y que puede obtenerse mediante la suma de 9 ó 6 de los 12 ítems del instrumento (la correlación entre los 2 indicadores resumen es óptima, por lo que pueden utilizarse indistintamente para la interpretación de los resultados). Cada atributo se puntúa independientemente, también de menor a mayor impacto en el mismo (a mayor puntuación impacto mas negativo), excepto para los atributos idoneidad y sueño óptimo (menos puntuación significa peor puntuación en el atributo), y cantidad de sueño (número de horas dormidas por día).
Métodos estadísticos
La intensidad del dolor se midió con la escala de dolor abreviada de McGill, y se evaluaron la respuesta en la escala visual analógica (EVA) de dolor para valorar su intensidad media en la última semana, y la puntuación en la escala ordinal de intensidad actual del dolor (ítem PPI). Los pacientes fueron agrupados según el dolor que presentaban en el momento de la inclusión en el estudio, utilizando la respuesta en la EVA, en dolor leve (EVA < 40), moderado (EVA > 40 e < 70) e intenso (EVA > 70). La muestra también fue segmentada de acuerdo al índice de masa corporal (IMC) en normopeso (<27), sobrepeso (>27 y <30) y obesos (>30), de acuerdo a la presencia o no de tratamiento analgésico actual, y al tiempo de evolución del dolor neuropático o mixto; naives (pacientes de diagnóstico en el momento actual), menos de 1 año y 1 año o más de evolución.
Se realizó un análisis descriptivo incluyendo estadísticos de tendencia central y dispersión, o frecuencias y proporciones en caso de variables categóricas, y pruebas de distribución normal de las variables analizadas mediante el test de Kolmogorov-Smirnov. Para identificar posibles variables explicativas del impacto del dolor en el sueño del paciente, se utilizó un modelo multivariante de regresión lineal mediante bloques en el que se mantuvo fijo el tipo de especialidad en un bloque, mientras que el resto de posibles variables explicativas se incluyeron en otro bloque en el que se seleccionaron mediante un procedimiento de eliminación por pasos. Las variables incluidas inicialmente en el modelo fueron el tipo de dolor, neuropático o mixto, la edad, el sexo, el tiempo de evolución desde el diagnóstico, la existencia de tratamiento analgésico actual, el índice de masa corporal, la intensidad del dolor en la escala visual analógica y en el ítem PPI. Se utilizó el cambio en la probabilidad de F como criterio para la exclusión de variables en el bloque de eliminación por pasos (entrada <0,05; salida >0,10). Se utilizó el análisis de la covarianza (ANCOVA), con las variables tipo de especialidad, sexo, tipo de dolor, tratamiento analgésico previo, índice de masa corporal e intensidad del dolor, actual o previa según correspondía, como covariables, para analizar el impacto en el sueño (global y por cada de uno de sus atributos) según la intensidad del dolor. También se utilizó el ANCOVA para comparar el impacto en el sueño (puntuación global) según índice de masa corporal, tipo de dolor y tratamiento analgésico previo. El impacto del dolor actual en el sueño según sexo e intensidad se analizó mediante un modelo de análisis de la varianza (ANOVA) para 2 factores corregido por covariables. Se calculó la distribución de la muestra por deciles según respuesta en el cuestionario de sueño, calculándose la distribución porcentual de pacientes según intensidad del dolor, actual y previa, en cada decil.
La prevalencia de síntomas de ansiedad y depresión se analizó mediante sendos modelos de regresión logística mediante bloques para la puntuación total (suma de los 3 ítems). En todos los casos, las variables inicialmente incluidas en el modelo fueron el tipo de dolor, neuropático o de tipo mixto, la edad, el sexo, el tiempo de evolución desde el diagnóstico, la existencia de tratamiento analgésico actual, el índice de masa corporal, la intensidad del dolor en la escala visual analógica y en el ítem PPI, la puntuación en la escala de sueño, el tipo de especialidad médica y, en cada caso, la puntuación en la escala de ansiedad o de depresión. Se utilizó la prueba de Wald y un nivel de significación < 0,1 para seleccionar las variables explicativas. La variable tipo de especialidad se mantuvo constante en un bloque, mientras que el resto de variables se seleccionaron en otro bloque mediante un procedimiento de eliminación por pasos. Se utilizó la prueba Chi2 y la Chi2 lineal para comparar las prevalencias corregidas de ansiedad y depresión según diferentes subgrupos, y se calcularon las prevalencias corregidas de ansiedad y depresión según grupos de edad y deciles de respuesta en la escala de sueño.
Se aplicó el ajuste de Bonferroni para las comparaciones múltiples, y la prueba de Levene para comprobar el supuesto de homocedasticidad de las variables, aceptándose como estadísticamente significativo un nivel de error de p<0,05. Todos los análisis se realizaron con el paquete estadístico SPSS 12.0.
El estudio DONEGA se realizó siguiendo la legislación vigente para estudios post-autorización, y se solicitó la autorización de 3 Comités Éticos hospitalarios de Investigación Clínica. El estudio se desarrolló de acuerdo a los principios éticos y recomendaciones de estudios en humanos establecidos en la Declaración de Helsinki de la Asociación Médica Mundial.(29,30) En todos los pacientes se requirió el consentimiento por escrito para participar en el estudio.
Resultados
Se incluyeron 1.519 pacientes (603 con dolor neuropático puro (DN), 856 con dolor mixto (DM), y 60 no filiados por lo que estos últimos fueron excluidos de la evaluación), de los que un 61,2% eran mujeres. Todos los pacientes eran mayores de 18 años, con una edad media (desviación típica) de 56,9 (13,6) años, y 1,1 (2,8) años de evolución desde el diagnóstico. En la tabla I se muestran las características demográficas principales y la respuesta en la escala de dolor de McGill, y se presenta la distribución de la muestra de pacientes según la intensidad del dolor en la escala visual analógica. La intensidad media actual del dolor en el ítem ordinal de dolor (PPI) fue 2.8±1.0 (media ± desviación típica), mientras que la intensidad media del dolor en la semana previa en la escala visual analógica (EVA) fue de 71,2±18,9 mm en toda la muestra. De los 603 pacientes con DN, un 10,9% presentaban neuropatía diabética, un 9,6% neuralgia del trigémino, un 12,8% síndrome doloroso regional complejo, un 14,8% neuralgia post-herpética, un 19,1% algún tipo de síndrome de atrapamiento, un 3,6% dolor central post-ictus, un 2,7% dolor del miembro fantasma y el 26,5% restante otras neuropatías periféricas, otros tipos de neuralgias y causas de origen central de baja incidencia. De los 856 pacientes con dolor mixto, el 28,6% presentaba algún tipo de radiculopatía, un 22,5% dolor lumbar mixto, el 17,2% cuadros de aplastamiento del disco intervertebral, un 7,9% estenosis del canal medular, un 6,5% espondilosis, un 5,3% dolor secundario a traumatismos quirúrgicos, un 2% espondilolistesis, y el 10,2% restante dolor derivado de otras causas (osteoporosis, fracturas óseas, etc.).
El dolor crónico neuropático, particularmente cuando se le asoció un componente nociceptivo (dolor mixto), mostró un impacto negativo en el sueño de intensidad considerable, tanto si se expresa con el componente resumen de 9-ítems como con el de 6-ítems: 47,1±21,3 versus 45,8±22,0, mostrando una correlación óptima entre las 2 medidas (r=0,975; p<0,0001), por lo que todo el análisis se realiza con el componente resumen de 9-ítems. La intensidad del dolor, tanto el presente en el momento de la exploración (ítem PPI) como el medido en la EVA en la semana previa, fueron las variables con mayor peso explicativo en la puntuación resumen del cuestionario MOS-sleep (tabla II). Las puntuaciones en las escalas de depresión y ansiedad presentaron una colinealidad muy elevada por lo que fueron eliminadas del modelo de regresión. De forma global, como en cada uno de los atributos de la arquitectura del sueño, la intensidad del dolor, actual (tabla III) o en la semana previa (tabla IV), se asoció significativamente con un impacto más negativo sobre el sueño del paciente; a mayor intensidad del dolor le corresponde un impacto global o en los atributos más negativo, excepto para la dimensión ronquidos que fue un atributo independiente de la intensidad del dolor actual (F=0,8; P=0,555). El impacto negativo en el sueño del dolor en la semana previa se debió fundamentalmente a los pacientes con dolor intenso (EVA > 70), no observándose diferencias significativas entre los pacientes con dolor leve y moderado. Asimismo, la proporción de pacientes con categoría de dolor intenso aumentó significativamente conforme se aumenta en los deciles de respuesta global de la escala de sueño, tanto en el dolor actual (F=17,1; p<0,0001, figura 1; panel A) como en la severidad del dolor previo (F=2,9; p=0,004, figura 1; panel B).
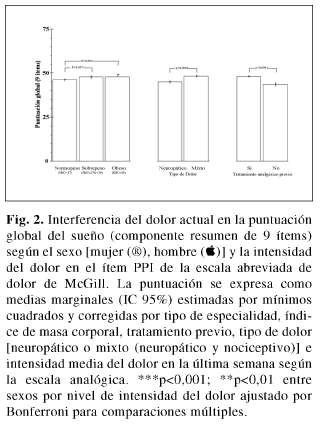
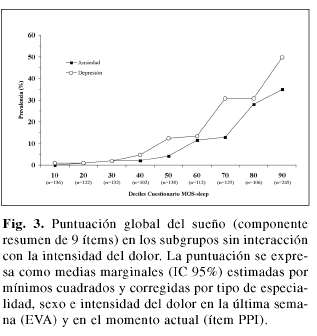
El sexo fue la tercera variable con más peso explicativo, mostrando las mujeres una puntuación significativamente mayor (impacto más negativo) que los hombres en la escala de sueño (tabla II, p< 0,0001). La mayor puntuación en la escala de sueño, en ausencia de diferencias en la intensidad del dolor entre varones y mujeres (EVA; 71,4+18,8 vs 71,3+19,2 (p=0,936); ítem PPI; 2,81+0,96 vs 2,83+0,96 (p=0,708)) se debió a que las mujeres con intensidad del dolor de leve a intenso en el ítem PPI muestran un impacto más negativo en el sueño que los hombres (F=2,2; p=0,052, figura 2). De forma global, el impactó en el sueño fue significativamente mayor (más negativo) en los pacientes con dolor mixto que en los que tenían dolor neuropático, en los pacientes con tratamiento analgésico previo que los que no habían recibido ningún tratamiento, y en los sujetos con sobrepeso que en los que tenían normo-peso (los obesos mostraron una tendencia hacia la significación estadística con respecto a los normope-sos), en todos los casos independiente de la intensidad del dolor ya que no se observó interacción estadísticamente significativa entre esta variable y los subgrupos mencionados (figura 3).
La puntuación en la escala de sueño y la puntuación en la escala de depresión (o de ansiedad) se asociaron significativamente a la presencia de síntomas de ansiedad (o de depresión); mayor probabilidad de encontrar síntomas de ansiedad (o depresión) conforme aumenta la puntuación en las mencionadas escalas (tabla II), mientras que la edad, aunque con poca intensidad, fue un factor protector; a mayor edad menor probabilidad de presentar síntomas de ansiedad (o de depresión). La intensidad del dolor en la semana previa, el índice de masa corporal y el sexo fueron también factores asociados a la presencia de síntomas de depresión; a mayor intensidad previa del dolor más probabilidad de presentar depresión, y ser varón disminuye la probabilidad de presentar síntomas de depresión (tabla II). La prevalencia corregida global de síntomas de depresión fue del 19,7%, mientras que la de síntomas de ansiedad fue del 12,9%. La presencia de síntomas de ansiedad y depresión se asociaron significativamente a la intensidad del dolor, tanto actual como previo (la prevalencia aumenta con la intensidad del dolor), a la evolución (la prevalencia aumenta a mayor tiempo desde el diagnóstico), y al sexo (proporción significativamente más alta de ansiedad y depresión en mujeres que en varones), pero no al tipo de dolor (tabla V). Una vez corregido, el 53,4% de los pacientes con síntomas de depresión (Raskin > 9) presentó también síntomas de ansiedad (Covi > 9), mientras que no se observó ningún paciente con ansiedad en los pacientes sin depresión; Chi2=508,1; p<0,0001 (tabla V). De la misma manera, el 94,5% de los pacientes con síntomas de ansiedad presentaban depresión, y sólo un 5,5% de los que no mostraban ansiedad; Chi2=679,9; p<0,0001 (tabla V).
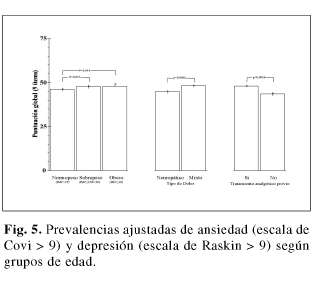
La prevalencia de síntomas de ansiedad y depresión aumentaron significativamente con el decil de respuesta en la escala de sueño, desde el 0% en el decil 10 hasta el 34,9% y 49,8% en el decil 90; Chi2 lineal = 143,4 (p< 0,0001) y 191,4 (p<0,0001), respectivamente (figura 4). Por el contrario, mientras que la prevalencia de síntomas de depresión aumento significativamente con el grupo etario; Chi2 lineal = 7,5 (p= 0,006), la prevalencia de síntomas de ansiedad no mostró una asociación lineal con la edad (Chi2 lineal = 0,7; p= 0,414), aunque fue significativamente mayor en el grupo de 55-64 años y menor en el de >75 años (Chi2 = 12,2; p= 0,035, figura 5).
Discusión
El estudio DONEGA (22) incluyó una muestra consecutiva de pacientes con dolor neuropático o mixto, cuyas causas subyacentes son tratadas en la práctica clínica habitual en asistencia especializada del dolor; unidad del dolor, rehabilitación, traumatología, reumatología, neurología, etc. Desde ésta perspectiva, se puede considerar que la muestra incluida en el estudio es representativa de la distribución etiológica o de las causas subyacentes mas frecuentemente asociadas al dolor neuropático puro y al dolor de tipo mixto, nociceptivo y neuropático, que es tratado en el nivel especializado de nuestro entorno sanitario. Además, el tamaño de muestra reclutado en el estudio, suficientemente amplio, permite que los hallazgos de este estudio sean tomados como de utilidad para la comunidad científica. No obstante, cabe señalar dos limitaciones relevantes que conviene comentar. Por un lado, la principal limitación de esta evaluación transversal se encuentra en que el estudio no se diseñó con la finalidad inicial de valorar el impacto del dolor neuropático o mixto en la calidad del sueño y en detectar la prevalencia de ansiedad y depresión en este tipo de pacientes, sino que eran objetivos secundarios de la evaluación de la efectividad de gabapentina en condiciones de práctica médica habitual sobre el dolor. No obstante, como se ha mencionado, el tamaño de la muestra reclutada, y la representatividad etiológica y de centros participantes, permiten estimar el impacto de estos cuadros patológicos sobre la calidad del sueño y la esfera emocional (ansiedad y depresión) del paciente con cierta precisión, particularmente si se tiene en cuenta que el estudio representa la práctica médica habitual y que se desconoce la existencia de estudios semejantes que hayan reclutado una muestra del tamaño aquí recogida, lo que pensamos que le confiere un elevado interés para la comunidad científica.
El otro tipo de limitación hace referencia al tipo de escalas utilizadas en el estudio para valorar depresión y ansiedad. Estas escalas, de acuerdo con los autores que las desarrollaron, así como con trabajos más recientes (17,24-26) parecen más encaminadas a servir como instrumentos de detección de síntomas de ansiedad y depresión, pudiendo hablarse a favor de una tendencia hacia la ansiedad o la depresión, más que un diagnóstico completo de estos cuadros clínicos como podría hacerse con las escalas de depresión de Beck o la escala de ansiedad de Hamilton. No obstante, y aunque esto es cierto, las escalas utilizadas en el estudio DONEGA, por su simplicidad, permiten ayudar a detectar alteraciones del estado emocional del paciente, y en éste estudio los hallazgos logrados con ellas han venido a corroborar la elevada frecuencia de posibles trastornos de ansiedad y depresión asociados al dolor neuropático como se ha señalado previamente por otros autores.(7-10)
Nuestro estudio ha comprobado que el dolor es un importante factor que daña la calidad del sueño del paciente, de forma global y en cada uno de los atributos de la arquitectura del mismo, y que éste se deteriora conforme aquel se hace más intenso, independientemente de que se esté hablando del dolor en la semana previa o el dolor que presenta el paciente en el momento de la exploración. En este sentido, nuestros hallazgos son consistentes con otros autores que han reportado previamente de la existencia de impacto negativo sobre el sueño de algún tipo de dolor neuropático (dolor central, dolor de espalda crónico y dolor de tipo mixto), y de la existencia también de correlación de la interferencia en el sueño con la intensidad del dolor.(31,32,33) Aunque algunos estudios han señalado la existencia de una correlación negativa entre la interferencia en el sueño y el tiempo de evolución (cronicidad), implicando una gradual adaptación del patrón del sueño al dolor crónico, en nuestro estudio, por el contrario, esto no se ha observado y el impacto negativo del dolor ha sido independiente de la duración de la evolución del mismo.(33,34)
Por otro lado, no sólo se deteriora la calidad del sueño sino que también lo hace la cantidad del mismo, aunque está ultima parece tener un impacto más limitado, toda vez que los pacientes con dolor extremo duermen un promedio de 4,9 horas al día y éste es solo 1,5 horas menor al promedio de los que reconocen no presentar dolor en el momento de la administración de la escala. Parece por tanto, que el dolor neuropático afecta negativamente en mayor medida a la calidad del sueño (elevado impacto en el atributo sueño alterado, somnolencia y sueño interrumpido), sobre todo en los sujetos con dolor más intenso, lo que se debe tener en cuenta, particularmente en población activa por las repercusiones en la vida laboral y menoscabo de la productividad que puede ocasionar éste tipo de trastornos. Caviedes y cols, Berger y cols, y Meyer-Rosberg y cols, (12,21,35) ya han señalado previamente las repercusiones económicas en cuanto a coste para la Sociedad que supone el dolor crónico de tipo neuropático, particularmente por el número de horas de trabajo perdidas o con menor productividad. En nuestro trabajo hemos observado que para un mismo nivel de dolor, las mujeres muestran un impacto mayor que los hombres, al menos en los niveles de intensidad leve a intenso del dolor neuropático, aunque no hemos encontrado una razón que justifique este hallazgo, ni tampoco literatura científica que lo confirme. También se ha observado que los pacientes con dolor mixto presentan un impacto mayor en el sueño que los pacientes con dolor neuropático, aunque la intensidad del mismo no mostró diferencias estadísticamente significativas. La justificación para este hallazgo cabría encontrarlo en la misma naturaleza mixta del dolor, y que en los pacientes con éste tipo de dolor el componente inflamatorio o nociceptivo puede también interferir por si solo en el deterioro del sueño independientemente de su intensidad (limitaciones en la movilidad, tipo de medicación adicional recibida, etc.). Resultados semejantes fueron comunicados previamente por Galer y cols (36), que también encontró un impacto considerable del dolor neuropático, en este caso de origen diabético, en el sueño del paciente, entre otros aspectos de la salud del paciente.
La prevalencia corregida global de síntomas de depresión fue del 19,7%, mientras que la de síntomas de ansiedad fue del 12,9%. Aunque ya hemos señalado que las escalas utilizadas en este estudio no permiten realizar un diagnóstico de confirmación, y que la escala de ansiedad refleja síntomas inespecí-ficos de ansiedad los valores de prevalencia de ambos trastornos emocionales parecen bastante elevados en comparación con las cifras conocidas de prevalencia anual para estas alteraciones en la población general que rondarían el 4% y 6%, respectivamente,(37) y que estarían más acordes con los valores dados por otros autores para algún tipo de dolor neuropático, como la neuralgía post-herpética, (17,18) la neuropatía diabética, (36) o el dolor crónico de espalda.(38) Los síntomas de depresión parecen estar presentes en todos los pacientes con ansiedad, mientras que ésta se presenta en algo más de la mitad de los pacientes con depresión. A su vez, las mujeres muestran prevalencias significativamente mayores que los hombres de síntomas de ansiedad y depresión, que no dependen de la intensidad ni del tipo de dolor. La intensidad del dolor, tanto actual en el momento de la exploración como en la semana previa se asociaron significativamente con una mayor prevalencia de síntomas de ansiedad y depresión, como ha sido señaldo por otros autores.(7,33) En nuestro estudio, hemos observado que la interferencia del dolor con el sueño se asocia de forma independiente a una mayor frecuencia de síntomas de depresión y ansiedad, lo que también ha sido comunicado previamente por Widerstrom-Noga y cols.(31) Estos hallazgos vienen a confirmar que los trastornos de la esfera emocional observados en pacientes con dolor crónico, y en particular con dolor de tipo neuropático, se desarrollarían no solo por el efecto del dolor per se, sino también probablemente, de forma secundaria a las alteraciones del sueño inducidas en el paciente por el propio dolor.
Aunque los pacientes incluidos en este estudio fueron reclutados entre aquellos que eran referidos o seguidos en unidades de atención especializada para control del dolor, a juzgar por los hallazgos de este estudio, los pacientes con dolor neuropático parece que no esten recibiendo el tratamiento óptimo o presentan serías resistencias al tratamiento actual (cerca del 85% de los pacientes estaban recibiendo algún tratamiento analgésico en la visita basal del estudio), ya que el dolor persiste y se acompaña de enfermedades concomitantes que agravan el bienestar y la calidad de vida del paciente. Como asevera Harden et al,(19) el conocimiento que tenemos del dolor neuropático ha mejorado sustancialmente en los últimos años, pero todavía continúa siendo una patología desafiante para la comunidad médica en lo relativo al apropiado manejo de la enfermedad. No solo se trataría de lograr la analgesia del paciente, sino que también constituiría un objetivo del tratamiento del paciente el adecuado manejo de los síntomas asociados al dolor, como los trastornos del sueño, las alteraciones de la esfera emocional, y cualquier otra comorbididad asociada al mismo.(32,39-41) La adecuada selección del tipo de tratamiento para los pacientes con dolor de tipo neuropático, puede ser, por tanto, determinante para alcanzar el restablecimiento del paciente y su calidad de vida correspondiente.(42)
Teniendo en cuenta las limitaciones anteriores, se puede concluir que los resultados de éste estudio en condiciones de práctica médica habitual, en una muestra representativa de pacientes con dolor neuropático o mixto, muestran una pobre calidad del sueño, y una elevada frecuencia de síntomas de ansiedad, depresión o ambos, en todos los casos de estos trastornos con una fuerte asociación con la intensidad del dolor. De manera que a mayor intensidad del dolor, mayor impacto en el sueño y mas frecuencia de ansiedad y depresión. Las alteraciones de la esfera emocional, independientemente de su intensidad y evolución, parecen impactar más negativamente en las mujeres que en los hombres (peor calidad de sueño y mayor frecuencia de ansiedad y depresión). Por último, estos hallazgos pueden ayudar a mejorar la atención que se presta a este tipo de pacientes, además de orientar el manejo terapéutico del dolor neuropático.
Agradecimientos
Los autores desean agradecer sinceramente a todos los médicos participantes en el estudio DONE-GA por la aportación de los datos sin los que no hubiera sido posible realizar esta evaluación. Los autores desean, también, agradecer a la Dra Teresa León, en la Unidad Médica de Pfizer, Madrid, por el apoyo y apropiados comentarios al diseño del estudio.
Bibliografía
1. IASP Task Force in Taxonomy. Pain Terms: A Current List with Definitions and Notes on Usage. In: Merksey H, Bogduk N, editors. Classification of chronic pain syndromes and definitions of pain terms. Second Edition. Seattle, Washington: IASP Press, 1994:206-213. [ Links ]
2. Jensen TS, Gottrup H, Sindrup SH, et al. The clinical picture of neuropathic pain. Eur J Pharmacol 2001; 429: 1-11. [ Links ]
3. Nicholson BD. Diagnosis and management of neuropathic pain: a balanced approach to treatment. JAANP Supplement 2003; 15: 3-9. [ Links ]
4. Bowsher D. Neurogenic pain syndromes and their management. Br Med Bull 1991; 47: 644-66. [ Links ]
5. Smith TE, Chong MS. Neuropathic pain. Hosp Med 2000; 6: 760-6. [ Links ]
6. Gálvez R, Rejas J, Pérez M, Gómez M. Prevalencia del dolor neuropático en España: implicaciones clínicas, laborales y asistenciales. Med Clin (Barc) 2005 (en prensa). [ Links ]
7. Nicholson B, and Verma S. Comorbidiries in chronic neuropathic pain. Pain Medicine 2004; 5 (S1): S9-S27. [ Links ]
8. Gureje O, Von Korff M, Simon GE, et al. Persistent pain and well-being: a World Health Organization Study in Primary Care. JAMA 1998; 280:147-51. [ Links ]
9. McWilliams LA, Cox BJ, Enns MW. Mood and anxiety disorders associated with chronic pain: an examination in a nationally representative sample. Pain 2003;106:127-33 [ Links ]
10. Harrris S, Morley S, Barton SB. Role loss and emotional adjustment in chronic pain. Pain 2003; 105: 363-70. [ Links ]
11. Nicholson BD. Diagnosis and management of neuropathic pain: a balanced approach to treatment. J Am Acad Nurse Pract 2003; 15 (12 Suppl): 3-9. [ Links ]
12. Berger A, Dukes EM, Oster G. Clinical characteristics and economic costs of patients with painful neuropathic disorders. J Pain 2004; 5: 143-9. [ Links ]
13. Rowbotham M, Harden N, Stacey B, et al. Gabapentin for the treatment of postherpetic neuralgia: a randomized controlled trial. JAMA 1998; 280: 1837-42. [ Links ]
14. Backonja M, Beydoun A, Edwards KR, et al. Gabapentin for the symptomatic treatment of painful neuropathy in patients with diabetes mellitus: a randomized controlled trial. JAMA. 1998; 280:1831-6. [ Links ]
15. Jensen PG, Larson JR. Management of painful diabetic neuropathy. Drugs Aging 2001; 18: 737-49. [ Links ]
16. Collins SL, Moore RA, McQuay HJ, et al. Antidepressants and antoconvulsivants for diabetic neuropathy and postherpetic neuralgia: a quantitative systematic review. J Pain Symptom Manage 2000; 20: 449-458. [ Links ]
17. Haythornthwaite JA, Benrud-Larson LM. Psychological assessment and treatment of patients with Neuropathic Pain. Current Pain and Headache Reports 2001; 5: 124-129. [ Links ]
18. Clark MR, Heinberg LJ, Haythornthwaite JA, et al. Psychiatric symptoms and distress differ between patients with postherpetic neuralgia and peripheral vestibular disease. J Psychosom Res 2000; 48: 51-57. [ Links ]
19. Harden N, and Cohen M. Unmet needs in the management of neuropathic pain. J Pain Symptom Manage 2003; 25 (5S): S12-S17. [ Links ]
20. Cruccu G, Anand P, Attal N, et al. EFNS guidelines on neuropathic pain assessment. Eur J Neurol 2004; 11: 153-162. [ Links ]
21. Caviedes BE, Herranz JL. Avances en la fisiopatología y en el tratamiento del dolor neuropático. Rev Neurol 2002; 35: 1037-1048. [ Links ]
22. Gálvez R and the Spanish team for Study of Neuropathic Pain. Pharmacoepidemiologic and multidisciplinary study of gabapentin in neuropathic pain (abstract). Neuropathic Pain. Changing Paradigms in Diagnosis and Treatment. An International Congress of NeuPSIG. Madrid, 2004. [ Links ]
23. Melzack R. The short-form McGill Pain Questionnaire. Pain 1987;30:191-7. [ Links ]
24. Lipman RS. Differentiating anxiety and depression in anxiety disorders: use of rating scales. Psychopharmacol Bull 1982; 18: 69-77. [ Links ]
25. Lipman RS, Covi L. Outpatient treatment of neurotic depression: medication and group psychotherapy. In: Spitzer R, Klein D, eds. Evaluation of Psychological Therapies. Baltimore, MD: Johns Hopkins University Press; 1976: 178-218. [ Links ]
26. Raskin A, Schulterbrandt J, Reating N, et al. Replication of factors of psychopathology in interview, ward behaviour and self report ratings of hospitalized depressives. J Nerv Ment Dis 1969; 148: 87-98. [ Links ]
27. Hays RD, Stewart AL. Sleep Measures. In: Stewart AL and Ware JE Jr, eds. Measuring Functioning and Well-Being: The Medical Outcomes Study Approach. Durham, NC: Duke University Press, 1992: 235-59 & 399-400. [ Links ]
28. Stewart AL, Greenfield S, Hays RD, et al. Functional Status and Well-being of patients with Chronic Conditions. Results from the Medical Outcomes Study. JAMA 1989; 262: 907-913. [ Links ]
29. Directrices para la realizacion de estudios de Farmacovigilancia. CIRCULAR 18/90, de 21 de noviembre de 1999, de la Direccion General de Farmacia y Productos Sanitarios. Available at: http://www.ub.es/legmh/disposici/cir1890.htm .
30. World Medical Association Declaration of Helsinki: ethical principles for medical research involving human subjects. J Postgrad Med 2002;48:206-8. [ Links ]
31. Widerstrom-Noga EG, Felipe-Cuervo E, Yezierski RP Chronic pain after spinal injury: interference with sleep and daily activities. Arch Phys Med Rehabil 2001; 82: 1571-7. [ Links ]
32. Morin CM, Gibson D, Wade J. Self-reported sleep and mood disturbance in chronic pain patients. Clin J Pain 1998; 14: 311-4. [ Links ]
33. Atkinson JH, Ancoli-Israel S, Slater MA, et al. Subjective sleep disturbance in chronic back pain. Clin J Pain 1988; 4: 225-32. [ Links ]
34. Haythornthwaite JA, Hegel MT, Kerns RD. Development of a sleep diary for chronic pain patients. J Pain Symptom Manage 1991; 6: 65-72. [ Links ]
35. Meyer-Rosberg K, Kvarnström A, Kinnman E, et al. Peripheral neuropatic pain: a multidimensional burden for patients. Eur J Pain 2001; 5: 379-389. [ Links ]
36. Galer BS, Gianas A, Jensen MP Painful diabetic polyneuropathy: epidemiology, pain description, and quality of life. Diabetes Res Clin Pract 2000; 47: 123-128. [ Links ]
37. Alonso J, Angermeyer MC, Bernert S, et al. Prevalence of mental disorders in Europe: results from the European Study of the Epidemiology of Mental Disorders (ESEMeD) project. Acta Psychiatr Scand 2004; 109 (Suppl. 420): 21-27. [ Links ]
38. Atkinson JH, Slater MA, Grant I, et al. Depressed mood in chronic low back pain: relationship with stressful life events. Pain 1988; 35: 47-55. [ Links ]
39. Harden RN, Cole PA. New developments in rehabilitation of neuropathic pain syndromes. Neurol Clin 1998; 16: 937-50. [ Links ]
40. Kanazi GE, Johnson RW, Dworkin RH. Treatment of postherpetic neuralgia: an update. Drugs 2000; 59: 1113-26. [ Links ]
41. Sullivan MJ, Lynch ME, Clark AJ. Dimensions of catastrophic thinking associated with pain experience and disability in patients with neuropathic pain conditions. Pain 2005; 113: 310-5. [ Links ]
42. Verma S, Gallagher RM. The psychopharmacologic treatment of depression and anxiety in the context of chronic pain. Curr Pain Headache Rep 2002; 6: 30-9. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. Rafael Gálvez
Unidad de dolor y Cuidados Paliativos
Hospital Universitario Virgen de las Nieves
Avda de las Fuerzas Armadas, 218014 Granada
Tel.: 34-958-020040
e-mail: rafaelgalvez@hotmail.com
Recibido: 28/11/05
Aceptado: 17/02/06