Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista de la Sociedad Española del Dolor
versão impressa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.14 no.4 Madrid Mai. 2007
ORIGINAL
Asociación de Fentanilo TTS matricial + Citrato de Fentanilo Oral Transmucosa (CFOT), en pacientes que no han recibido tratamiento previo con opioides y padecen dolor crónico intenso de etiología osteoarticular. Haciendo realidad el Ascensor Analgésico
Combination of TTS-Fentanyl and Oral Transmucosal Fentanyl citrate (OTFC) in opioid-naive patients suffering severe osteoarticular pain. Towards a fast-track analgesic ladder
F. Collado1, L. M. Torres2
1 F.E.A. Clínica del Dolor y Coordinador de la Unidad de Dolor Agudo. Hospital Universitario “Puerta del Mar”. Cádiz.
2 Jefe de Servicio de Anestesia Reanimación y Terapéutica del Dolor. Hospital Universitario “Puerta del Mar”. Cádiz.
Dirección para correspondencia
SUMMARY
This 6-month observational prospective study was conducted to assess the efficacy of fentanyl TTS associated with oral transtnucosal fentanyl citrate (OTFC) for breakthrough pain in 250 patients with intense chronic (≥ 6 months) osteoarthritis pain. A VAS score ≥ 8 at entry was required. The starting dose of 12 µg/h fentanyl TTS was titrated in 25 µg/h increments to a VAS score ≤ 4. OTFC was administered as single-unit doses of 400 µg. The mean (SD) VAS score decreased from 8.86 (0.25) at baseline to 2.1 (0.74) at 6 months. The percentage of patients with poor quality of sleep decreased from 80.4% at baseline to 4,7% at the end of the study. The percentage of patients with inadequate pain control decreased from 12.4% at month 1 to 2.14% at month 6. Pain control was achieved with the 50 µg/h dose in 59.65% of patients, the 75 µg/h dose in 4.72%, and the 100 µg/h dose in 1.71%. Only 1 patient required 125 µg/h at the end of the study. The daily consumption of single-unit doses of OTFC decreased from 5.08 at month 1 to 2.88 at month 3, and 1.45 at month 6. Headache, nausea/vomiting, constipation, and somnolence of mild or modérate intensity were the most common side effects. Treatment was discontinued because of nausea/vomiting in 11 patients, somnolence in 5, and dermatitis in 1. Fentanyl TTS associated with OTFC for breakthrough pain is a feasible and effective strategy in opioid naive patients with intense chronic osthoeoartritis pain.
Keywords: Intense chronic pain. Analgesic Ladder. Fentanyl TTS. OTFC. Analgesic Elevator. Osthoeoartritis pain.
RESUMEN
Objetivos: Exponer los resultados obtenidos en 250 pacientes que sin haber tenido contacto previo con opioides, acceden a nuestra Unidad de Tratamiento del Dolor, padeciendo un dolor intenso (EVA ≥ 8) de más de 6 meses de evolución y afectos de un dolor de origen osteoarticular.
Métodos: Estudio abierto, prospectivo y controlado. Los pacientes fueron tratados, inicialmente, con fentanilo TTS matricial de 12 µg/h + citrato de fentanilo oral transmucosa (CFOT) de 200-400 pg., para el dolor irruptivo. A los 12 días de tratamiento, se aumento la dosificación del parche matricial de fentanilo TTS, a 25 ug/h. Se valoró la situación de los pacientes mensualmente y si el dolor no estaba controlado, se aumento la dosificación de fentanilo TTS matricial. Si por el contrario, el dolor permanecía controlado durante más de un mes y no se precisaba ningún comprimido de CFOT, se redujo la dosificación del fentanilo TTS matricial. Se analizaron los registros de intensidad del dolor, calidad del descanso nocturno, efectos secundarios y consumo medio de fetanilo TTS y CFOT, obtenidos al inicio, 1º, 3º y 6º mes de tratamiento.
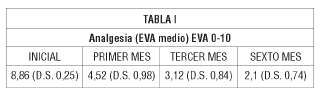
Resultados: La EVA medio pasó del 8,86 + 0,25, inicial hasta un 2,1 + 0,74, al 6º mes. El descanso nocturno, mejoró en una proporción idéntica a la del alivio del dolor. Solo 17 pacientes (6,80%) abandonaron el tratamiento por efectos secundarios 11 por náuseas-vómitos, 5 por sedación excesiva y 1 por dermatitis).
Al final del estudio, solo 1 paciente precisaba dosis superiores a los 100 µg/h. de fentanilo TTS. La mayoría de ellos (58,64%) estaban tratados con un parche de 50 µg/h, el 33,47% seguía con el parche de 25 µg/h, el 4,72% necesitaba un parche de 75 µg/h y un 1,71% alcanzó el parche de 100 µg/h. Un solo paciente (0,42%), precisó 125 µg/h de fentanilo TTS. Al final del primer mes, el consumo medio de CFOT fue de 5,08 comprimidos/día. El tercer mes, su consumo descendió a una media de 2,88/día. Al final del periodo estudiado, los pacientes necesitaron una media de 1,45 comprimidos de CFOT/día.
Conclusiones: Los resultados analgésicos obtenidos, junto a la aceptable incidencia y entidad de los efectos secundarios y el razonable consumo de fentanilo TTS y CFOT, nos conduce a afirmar que la sistemática terapéutica expuesta, basada en la posibilidad de acceder de inmediato a un opioide mayor, desde que existe una presentación que permite dosificarlo más adecuadamente (el parche matricial de fentanilo TTS) y los evidentes beneficios que comporta su asociación con CFOT: fármaco de gran ayuda en la fase de titulación (donde aún puede no haberse alcanzado la dosis eficaz de fentanilo TTS), puede ser una opción útil para aquellos pacientes que padecen dolor crónico intenso y no han tenido contacto previo con opioides, ahorrándoles el tormento de tener que soportar un sufrimiento injustificable, mientras recorren durante meses la Escalera Analgésica de la OMS.
Palabras clave: Dolor intenso. Escalera analgésica. Fentanilo TTS. CFOT. Ascensor analgésico. Dolor osteoarticular.
Introducción
Durante el año 2006, nuestra Clínica del Dolor, atendió un total de 6.395 consultas relacionadas con el tratamiento del dolor crónico, de las que solo un 8,3% (531 consultas), estaban motivadas por un dolor etiología oncológica. Durante el año 2.004, atendimos a un número similar de consultas (5.869), de las que un 10,3% (606) presentaban un origen oncológico.
Vivimos pues, una realidad que se consolida año tras año y que se traduce en que la inmensa mayoría de nuestros pacientes sufren un dolor crónico de naturaleza no oncológica, siendo la etiología osteoarticular la mayoritaria (63,9%), siendo en estos pacientes, donde se muestran con un mayor dramatismo las consecuencias de los graves déficits de formación que en materia de tratamiento del dolor afecta al colectivo sanitario y a nuestra sociedad, en general (1); la opiofobia y el desconocimiento inexcusable les privan de los analgésicos más eficaces y con mejor balance beneficio/riesgo: los opioides y muy especialmente, los opioides potentes. Así se explican datos tan contundentes como los aportados por la macroencuesta europea de 46.394 personas “Pain in Europe” (2) Tabla I.
En nuestra Clínica del Dolor, Unidad de referencia provincial para 1.200.000 habitantes, el “paciente tipo” a su acceso a la Unidad, viene aquejado de un dolor crónico de más de 6 meses de evolución, gran intensidad (EVA> 8) y está siendo tratado mayoritariamente (72%) con AINEs, frecuentemente infradosificados y combinados entre sí, recibiendo opioides débiles un 21% y solo están siendo tratados con opioides potentes un 7%.
Es muy fácil imaginar como la influencia sobre la calidad de vida, descanso nocturno, repercusiones familiares y laborales de tal situación es enorme, tanto en términos de sufrimiento como de impacto económico.
El reforzamiento progresivo del arsenal terapéutico farmacológico y muy especialmente de los opioides potentes (primero fue la introducción de la morfina de liberación sostenida y posteriormente los parches transdérmicos de buprenorfina y fentanilo), han posibilitado una auténtica revolución terapéutica en las clínicas del dolor, donde mayoritariamente, se logra controlar el dolor crónico, sin necesidad de técnicas invasivas.
En nuestra Unidad, hasta un 83% de las consultas son, actualmente, de naturaleza farmacológica. Sin embargo, cuando dialogamos con los pacientes o con otros especialistas, se evidencia que uno de los mayores obstáculos que retrasa el establecimiento de un tratamiento eficaz, es la eternización de los escalones terapéuticos, motivada por una interpretación dogmática de la Escalera Analgésica de la O.M.S (3); frases como “es que el paciente todavía no está para tomar morfina”, “aún no hemos agotado las posibilidades de los AINEs”, etc., rebelan la naturaleza del problema.
Todo esto, llevó a Torres et al. a propugnar en un editorial de la Revista de la Sociedad Española del Dolor (4), la sustitución de un esquema de tanta tradición basándose en que: “La situación actual del tratamiento del dolor, los avances en el conocimiento de su fisiopatología, su evaluación continuada y la aparición de nuevos fármacos y nueva tecnología, hacen que el seguimiento de la escalera analgésica de la OMS se convierta en una barrera y en un retraso para el adecuado tratamiento de muchos cuadros dolorosos, al obligar al paciente a recorrer unos escalones farmacológicos hasta llegar a encontrar el fármaco más adecuado para su dolor” y propugnando además “sustituir el concepto de “escalera analgésica” por el de “ascensor analgésico”, el cual simula al paciente dentro de un ascensor cuyo suelo son los coadyuvantes analgésicos y que dispone de 4 botones para pulsar según el grado de dolor sea: leve, moderado, severo o insoportable. Existe así mismo, como en los ascensores convencionales un botón de alarma en el caso de que el VAS sea >5.
Si el paciente aprieta el botón de leve, el paciente bajará en un piso donde dispone de analgésicos no opiáceos (paracetamol, metamizol o ibuprofeno a dosis bajas) como prototipos. Si el paciente pulsa el botón moderado, se bajará en un piso donde encontrará tramadol, o codeína habitualmente combinado con paracetamol o AINEs.
Si el paciente toca el botón grave, dispondrá de opiáceos potentes y si pulsa el botón insoportable se bajará en un piso de unidades especializadas de tratamiento del dolor, donde será tratado con bloqueos nerviosos u opioides por vía intratecal.”
Esta audaz propuesta, puede que fuera adelantada a su tiempo, porque lo cierto es que conocíamos la extraordinaria eficacia de los opioides potentes, pero no disponíamos aún de una presentación que posibilitara su administración precoz, sin necesidad de una experiencia previa con los opioides menores. Lamentablemente, la potencia de estos fármacos no solo se expresa en su eficacia analgésica, sino también, en su alta capacidad para producir efectos secundarios, que sin ser graves, son capaces de motivar el abandono del tratamiento (náuseas, vómitos, sedación, mareos, cefalea y estreñimiento). Una situación que además, es muy difícil de revertir: es casi imposible convencer a un paciente que debe volver a administrarse unos medicamentos que pudieron ocasionarle aquellos efectos secundarios, por una errónea estrategia terapéutica, casi siempre motivada por una precipitación en la fase de titulación.
Sin embargo, poco más de dos años después de la publicación del citado editorial, la industria farmacéutica pudo atender la mayoritaria solicitud de los especialistas en el tratamiento del dolor, respecto a la necesidad de contar con un opioide potente (como fentanilo), pero en una presentación que posibilitase una más cómoda titulación inicial y así en el año 2.004, llega a nuestra farmacopea el parche de fentanilo TTS matricial y más recientemente, hace unos 6 meses, disponemos del parche matricial de 12 µg/h.
Conscientes de la importancia de todo lo expuesto, desde la introducción del parche matricial de fentanilo, comenzamos a trabajar (5) con el siguiente objetivo: buscar una sistemática que mediante la utilización conjunta de fentanilo TTS y CFOT, posibilitase el acceso precoz a un tratamiento eficaz, para los numerosos pacientes que acuden a nuestra Clínica del Dolor, afectados de un síndrome doloroso crónico, de etiología no oncológica, pero de gran intensidad y que sin embargo, no habían tenido contacto previo con los opioides. No son muchas las experiencias publicadas (6-8), en este sentido y casi todas, circunscritas al ámbito del dolor oncológico (9-12).
En resumen, el objetivo de este estudio es testar la eficacia de un esquema terapéutico que se beneficiase de la posibilidad de combinar:
las ventajas de una titulación más adecuada, basada en la prescripción inicial de 12 µg/h de fentanilo TTS.
Incluir, como complemento fundamental, los comprimidos de CFOT (200 µg ó 400 µg), fármaco de elección en el tratamiento del dolor irruptivo (13-17) y que además de cumplir con muchos de los requisitos que debe poseer el fármaco ideal para el tratamiento de este tipo de dolor (18), puede ejercer un papel complementario fundamental, tanto en la fase inicial de titulación, donde el parche de 12 µg/h, puede ser a menudo insuficiente, como en fases posteriores, cubriendo, la eventualidad de una agudización incidental del dolor crónico.
Material y método
Estudio abierto, prospectivo y controlado. A los pacientes seleccionados se les explico detalladamente y posteriormente se les prescribió un protocolo analgésico, consistente en la administración de un parche de fentanilo TTS matricial 12 µg/h, cada 72 h. Cuando el paciente se había administrado 4 parches transdérmicos (habrán transcurrido 12 días de tratamiento), se le indico que pasase a administrarse 1 parche de 25 µg/h.
Además y como componente fundamental del tratamiento, se le explicó y prescribió citrato de fentanilo oral transmucosa (CFOT), para el tratamiento del dolor irruptivo. Como quiera que corresponde a la presentación de 400 µg, los mejores registros de eficacia (19) y menores efectos secundarios, es la que utilizamos mayoritariamente, reservando la presentación de 200 µg, para los casos de especial susceptibilidad a los efectos secundarios de los opioides o cuando podemos retirar el tratamiento, por haberse logrado un mejoría estable de la sintomatología dolorosa. Si el paciente sufría dolor en el momento de la visita inicial (lo que es muy habitual), se le administró el primer comprimido de CFOT, durante o inmediatamente después de concluir la historia clínica. En ancianos y especialmente del sexo femenino, debido a que muestran una mayor susceptibilidad a los efectos secundarios de los opioides (20-23), los primeros comprimidos de CFOT, se los administrábamos en decúbito supino, para minimizar el riesgo de mareos o náuseas.
Cuando el dolor no estaba controlado (VAS> 4) o el consumo de CFOT era superior a 4 comprimidos/día, durante más de 1 semana, se aumentaba la dosificación del parche matricial de fentanilo TTS. Cuando el dolor estaba controlado, durante más de 1 mes y el paciente no necesitaba recurrir a los comprimidos de CFOT, se indicaba una reducción en la dosificación del fentanilo TTS.
Como coadyuvante, se prescribió metoclopramida, para el caso de que aparecieran náuseas o vómitos. En cuyo caso, se administró 1 comprimido de 10 mg, 30 minutos antes de cada comida principal. Solo si existían antecedentes de estreñimiento, se prescribió lactulosa.
Se proporcionó al paciente un teléfono de contacto y se le aleccionó para que si transcurridas 2 semanas, el dolor no estaba controlado o si para lograrlo, tenia que recurrir a más de 4 comprimidos de CFOT/día, de forma continuada, se comunicara con la Clínica del Dolor, con la finalidad de aumentar la dosificación del fentanilo TTS. También, se le indicó que contactara telefónicamente en caso de que aparecieran efectos secundarios y en general, siempre que tuviera alguna duda, respecto al tratamiento prescrito.
Se programaron revisiones al primer, tercero y sexto mes, de iniciado el tratamiento.
En cada visita se midió la intensidad media del dolor (mediante la Escala Visual Analógica: EVA), la calidad del descanso nocturno (valorando como “malo” todos aquellos casos en que el dolor tenía una importancia decisiva en la imposibilidad de conseguir un buen descanso nocturno al menos 6 horas consecutivas) y la dosificación necesaria de fentanilo TTS y CFOT, para mantener el dolor controlado (EVA < 4). En las revisiones programadas, se recogió, además, la cuantía de los efecto secundarios definidos estos como leve cuando la entidad del efecto secundario era mínima y no requería tratamiento, moderado cuando obligaba a establecer un tratamiento específico (laxante, antiemético, etc.) y severo cuando provocaba la retirada del tratamiento. Al completar los 6 meses de tratamiento el Servicio de Epidemiología y Estadística, de nuestro hospital, procedió al análisis estadístico de los resultados.
Análisis estadístico
Análisis descriptivo expresado en porcentajes en variables categóricas y media y desviación típica en variables cuantitativas. Análisis bivariante cuantitativo de cada valor medio de EVA y descanso nocturno obtenido al primer, tercer y sexto mes tras tratamiento, respecto a sus valores iniciales, mediante comparación de dos medias pareadas (T Test para medidas intrasujeto). Análisis de la varianza de medidas repetidas intrasujeto en el seguimiento durante los 6 meses, mediante Modelo Lineal General (MLG). Se consideró estadísticamente significativo un valor de p<0.05. Para el análisis se utilizó el programa SPSS v.12.
Resultados
Tras la adecuada información y aceptación por escrito para participar en el estudio, se incluyeron 250 pacientes (102 hombres y 148 mujeres), con edades comprendidas entre los 34 y los 75 años (media 59,32 ±12.22), que accedieron a nuestra Clínica del Dolor, por padecer un dolor crónico de etiología osteoarticular (Figura 1), de más de 6 meses de evolución y de alta intensidad (EVA ≥ 8).
Analgesia
Los resultados analgésicos se exponen en las Tablas II y III, observándose, como desde el primer mes, se produce una reducción de casi la mitad del EVA medio. Esta disminución del dolor, se consolida en los registros correspondientes a los meses siguientes. Respecto a los pacientes que permanecen con un dolor no controlado (EVA> 4), 5 pacientes (2,14%), se encuentran en esta situación al final del periodo estudiado.
Cada uno de los valores obtenidos de EVA al primer, tercer y sexto mes tras tratamiento resultó inferior en relación al valor inicial, de forma estadísticamente significativa (p<0.001) (t-test).
Descanso nocturno
El patrón del sueño, se refleja en la Tabla IV
El descanso mejoró de forma estadísticamente significativa en cada una de las mediciones realizadas al primer, tercer y sexto mes, en relación al descanso basal (p<0.001).
La sucesión de los valores obtenidos en medidas repetidas de EVA y descanso nocturno en cada sujeto o caso, tras el tratamiento al primer, tercer y sexto mes, en relación al valor inicial pretratamiento, también obtuvo una mejora estadísticamente significativa en ambas variables (MLG con p<0.001).
Efectos secundarios
Se muestran en las Figuras 2, 3 y Tabla V.
Al primer mes de tratamiento, 36 pacientes (14,4%), presentaron cefalea, de los que solo 5 (2%), precisaron tratamiento adicional 79 pacientes (31,60 %) refirieron haber padecido algún episodio aislado de náuseas. En 21 de ellos (8,4%) fue necesario administrar metoclopramida y en 11 (4,40%) la intensidad de las náuseas y/o vómitos obligó a la retirada del tratamiento. 68 pacientes (27,20%) presentaron estreñimiento leve y otros 52 (20,80%), requirieron la administración de laxantes. 99 pacientes (39,60%), refirieron padecer un cierto grado de somnolencia, que fue calificado como leve en 62 (24,80%), moderado en 34 (13,60%) y obligó a retirar el tratamiento en tres casos (1,20%).
Al final del estudio (6º mes de tratamiento), solo el estreñimiento y la somnolencia (frecuentemente relacionada con los periodos inmediatamente posteriores al aumento en la dosificación del fentanilo TTS), permanecen como efectos secundarios reseñables. De esta forma, 63 pacientes (27,03 %) padecen estreñimiento leve y otros 54 (23,17 %) precisan tomar algún laxante. Respecto a la somnolencia, se registró en 102 pacientes (43,77 %), considerándose como leve en 74 (31,75 %) de ellos, moderada en 27 (11,58 %) y obligó a retirar el tratamiento en un caso (0,42 %). Entre el segundo y el sexto mes, hubo que retirar otro 2 tratamientos por sedación y 1 por dermatitis en la zona de aplicación del parche matricial.
Consumo de medicación analgésica
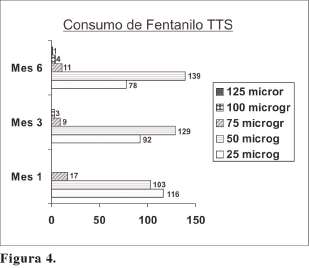
Se presentan en la Figura 4 y en la Tabla V.
Al final del periodo estudiado, 92 pacientes (39,48%), consumían menos de un comprimido de CFOT al día.
Discusión
Como se desprende de los resultados expuestos, durante el primer mes, la mayoría de los pacientes (el 87,60%), se encontraban tratados con el parche transdérmico de 25 µg/hora (116 pacientes) o 50 µg/hora (103 pacientes). Al tercer mes, aumentó la proporción de los que precisaban 50 µg (129 pacientes) y comenzaron a aparecer pacientes tratados con 100 yig (3 pacientes, un 1,26%). A la conclusión del estudio, 78 pacientes (33,47%) estaban tratados con 25 µg/hora, 139 (un 59,65%) con 50 µg/ hora, 11 pacientes (4,72%) precisaban 75 µg/hora, solo 4 pacientes (1,71%) necesitaron el parche de 100 µg/h. y 1 solo paciente (0,42%), alcanzó los 125 µg/h.
Un paciente con intensas crisis de dorsalgia, secundarias a aplastamientos vertebrales osteoporóticos, reconoció haber consumido domiciliariamente, hasta 8 comprimidos de CFOT/día. Actualmente consume 3-4 a la semana. Ello es una muestra, bastante frecuente, de cómo los pacientes adaptan el consumo de CFOT a sus necesidades inmediatas, no existiendo un riesgo importante de adicción y tolerancia imparable, como se esgrime a menudo, para justificar su no utilización (24-31). De la misma forma, 35 pacientes (afectados de gonartrósis o artrosis de cadera), iniciaron la sistemática mencionada, llegando a consumir hasta 100 µg/hora de fentanilo TTS y al cabo de unas semanas o meses, tras someterse a cirugía ortoprotésica (prótesis de cadera o rodilla), lograron reducir progresivamente el tratamiento opioideo, hasta su eliminación total. Esto también sucedió en 3 pacientes afectos de síndrome postlaminectomia, tras una reintervención quirúrgica (artrodésis instrumentada de columna).
Los resultados obtenidos demuestran una alta eficacia analgésica, de la sistemática propuesta, incluso en modelos de dolor que durante mucho tiempo se han creído refractarios a la terapéutica opioidea. Obsérvese que se incluyen en el estudio, un considerable número de pacientes con dolor con componente neuropático (aplastamientos vertebrales, espondiloartrósis, escoliósis, etc.).
A la conclusión del estudio, solo 5 pacientes (un 2,14%) presentaban una EVA> 4.
La intensidad de los efectos secundarios fue moderada, solo obligó a retirar el tratamiento en 17 pacientes (6,8% de la muestra estudiada). Esto tiene una especial significación, si tenemos en cuenta que se trata de un grupo de pacientes que no había tenido contacto previo con los opioides.
Durante el primer mes y sobre todo, en la fase inicial de titulación, es cuando se hace más evidente la incidencia de náuseas, vómitos y somnolencia. Pasado el primer mes, solo hubo que retirar 2 tratamientos por somnolencia excesiva y 1, por dermatitis local. Al igual que han publicado otros autores (32), a medida que se estabiliza la dosificación del opioide, el efecto que más molesta y que perdura durante todo el tratamiento es el estreñimiento, aunque no conviene olvidar que fentanilo está considerado como el opioide mayor menos astringente (33-36). Así, al final del estudio solo 45 pacientes (un 19,31%), todos ellos del sexo femenino, precisaban tratamiento coadyuvante con algún laxante. La somnolencia suele ser proporcional a la dosificación del fentanilo, siendo más susceptibles de padecerla, los ancianos; sin embargo son los pacientes más jóvenes, los que peor la toleran por las interferencias que les ocasionan en sus actividades cotidianas, como la conducción de vehículos, actividad laboral, etc. (37-39).
El nuevo parche matricial de 12 µg/h, ofrece una ventaja adicional, a las ya expuestas: facilita el paso de 25 µg a 50 µg, que puede ser muy abrupto en determinados pacientes. Es decir, en estos casos indicamos un periodo transitorio (9 días) con un parche de 25 µg + otro de 12 µg, antes de pasar al de 50 µg, para de esta forma mitigar el riesgo de posibles efectos secundarios.
La sistemática analgésica propuesta, se basa fundamentalmente, en conseguir un alivio estable de la sintomatología dolorosa, mediante la liberación continuada, de fentanilo transdérmico. Esto se consigue en unas 3-4 semanas y mayoritariamente, con el parche de 50 µg/h (19).
Los comprimidos de CFOT, son de especial importancia en la fase inicial de titulación, cuando aún no se alcanzado la dosis necesaria de fentanilo TTS, una vez que esto se ha logrado, sigue siendo un complemento ideal de “la terapéutica de fondo” con el parche matricial, para garantizar una cobertura adecuada del dolor irruptivo (40).
Nuestra sistemática, al contrario de la práctica habitual (3), consigue un alivio notable de la sintomatología dolorosa, en la casi totalidad de los casos estudiados.
Conclusiones
La estrategia terapéutica propuesta, de dosificación progresiva de fentanilo TTS, comenzando por 12 días de titulación inicial, con 12 µg/h. y su combinación simultánea con los comprimidos de CFOT, demuestra una buena eficacia, en el tratamiento del dolor crónico intenso, en pacientes que no han tenido contacto previo con opioides. Como demuestra la alta significación estadística de las variables estudiadas (mejoría del dolor y del descanso nocturno). La cuidadosa titulación inicial minimiza la incidencia de efectos secundarios y por ello, del riesgo de abandono terapéutico. Desaparece así, el obstáculo fundamental que dificultaba llevar a la práctica, en el tratamiento del dolor crónico, la idea del Ascensor Analgésico.
Entendemos, que la sistemática desarrollada, es lo suficientemente simple y segura para que pueda extender su ámbito de actuación más allá de las Clínicas del Dolor y que su generalización, propiciaría un impulso importante, que ayudaría a corregir el enorme déficit que presenta el control del dolor crónico no oncológico, en nuestro país.
Este trabajo demuestra que la hipótesis que contiene la propuesta del Ascensor Analgésico (4) es viable, en la actualidad, desde el punto de vista clínico y aporta ventajas sobre el seguimiento “dogmático” del concepto de Escalera Analgésica, consiguiendo una mayor y más rápida eficacia del tratamiento del dolor crónico intenso.
Bibliografía
1. Collado F y Torres L M. Debemos hacer mucho más. Editorial. Rev. Soc. Esp. Dolor, mar. 2005, vol.12, nº.2, p.71-73. ISSN 1134-8046. [ Links ]
2. Breivik H, Collett B, Ventafridda V, Cohén R, Gallacher D. Survey of chronic pain in Europe: prevalence, impact on daily life, and treatment. Eur J Pain. 2006; 10: 287-333. [ Links ]
3. Ventafridda V, Tamburini M, Caraceni A, De Conno F, Naldi F. A validation study of the WHO method for cáncer pain relief. Cáncer. 1987; 59: 850-856. [ Links ]
4. Torres L M, Calderón E, Pernia A, Martínez-Vázquez J. De la Escalera al Ascensor. Rev Soc Esp Dolor 2002; 9: 289-290. [ Links ]
5. Collado F . “Escalera Analgésica de la O.M.S... ¿Regla o recomendación?”. Ponencia del VI Fórum de Dolor de las Islas Atlánticas. Isla de Sal. Cabo Verde 26-28 de Mayo de 2005. (Comunicación persnal). [ Links ]
6. Otis J, Rothman M. A Phase III study to assess the clinical utility of low-dose fentanyl transdermal system in patients with chronic nonmalignant pain.Curr Med Res Opin. 2006; 22: 1493-501. [ Links ]
7. Milligan K . Evaluation of long-term efficacy and safety of transdermal fentanyl in the treatment of chronic noncancer pain. Journal of Pain. 2001; 2: 197-204. [ Links ]
8. Alian L Transdermal fentanyl versus sustained reléase oral morphine in strong opioid naive patients with chronic low back pain. Spine. 2005; 30: 2484-90. [ Links ]
9. Tawfik M O, Bryuzgin V, Kourteva G. FEN-INT-20 Study Group. Use of transdemal fentanyl without prior opioid stabilization in patients with cáncer pain. Curr Med Res Opin 2004; 20: 259-267. [ Links ]
10. Mystakidou K, Tsilika E, Parpa E, Kouloulias V, Kouvaris I, Georgaki S, Vlahos L. Long-term cáncer pain management in morphine pretreated and opiod naive patients with transdermal fentanyl. Int J Cáncer; 2003; 107: 486-492. [ Links ]
11. Mystakidou K, Tsilika E, Parpa E, Papageorgiou C, Georgaki S, Vlahos L. investigating the effets of TTS-fentanyl for cáncer pain on the psychological status of patients naive to strong opioids: an open label study. Cáncer Nurs. 2004; 27: 127-133. [ Links ]
12. Ordoñez A, de Castro J y González Barón M. Transdermal Fentanyl treatment in opioid naive cáncer patients. Rev Oncol 2003; 5; 162-165. [ Links ]
13. Portenoy R, Hagen N. Breakthrough pain: definition, prevalence and characteristics. Pain 1990; 41: 273-281. [ Links ]
14. Coluzzi P H, Schwartzberg L, Conroy J D, Charapata S, Gay M, Busch M A, et al. Breakthrough cáncer pain: a randomized trial comparing oral transmucosal fentanyl citrate (OTFC) and morphine sulfate immediate reléase (MSIR). Pain. 2001; 91: 123-130. [ Links ]
15. Fine P G, Streisand J B. A review of oral transmucosal fentanyl citrate: potent, rapid and noninvasive opioid analgesia. J Palliat Med. 1998; 1: 55-63. [ Links ]
16. Farrar J T, Cleary J, Rauck R, Busch M, Nordbrock E. Oral transmucosal fentanyl citrate: randomized, double-blinded, placebo-controlled trial for treatment of breakthrough pain in cáncer patients. J Nati Cáncer Inst. 1998; 15: 90: 611-616. [ Links ]
17. Rees E. The role of oral transmucosal fetanyl citrate in the management of breakthrough cáncer pain. Int J Palliat Nurs. 2002; 8: 304-308. [ Links ]
18. Collado F. “¿Que se puede hacer con el dolor intercurrente?”. Editorial. Rev. Soc. Española del Dolor 2004; 11: 181-183. [ Links ]
19. Trelis J, Pérez Hernández C, Sánchez Domínguez F, Martínez Calderón F, Gracia A, Zsolt I. Citrato de fentanilo oral transmucosa en el tratamiento del dolor irruptivo en pacientes con cáncer en España: Resultados del estudio EDIPAD. Rev Soc Esp Dolor 2004; 11: 184-196. [ Links ]
20. Cepeda M S, Farrar J T, Baumgarten M, Bostón R, Carr D B, Strom B L. Side effects of opioids during short-term administration: effect of age, gender, and race. Clin Pharmacol Ther. 2003; 74: 102-112. [ Links ]
21. Freye E, Levy J V. Use of opioids in the elderly—pharmacokinetic and pharmacodynamic considerations. Anasfhesiol Intensivmed Notfallmed Schmerzther. 2004; 39: 527-537. [ Links ]
22. Wilder-Smith O H. Opioid use in the elderly. Eur J Pain. 2005; 9: 137-40. [ Links ]
23. Terrell K M, Heard K, Miller D K. Prescribing to older ED patients. Am J Emerg Med. 2006; 24: 468-78. [ Links ]
24. Compton W M, Volkow N D. Major increases in opioid analgesic abuse in the United States: concerns and strategies. Drug Alcohol Depend. 20061; 81: 103-7. [ Links ]
25. Weaver M, Schnoll S. Abuse liability in opioid therapy for pain treatment in patients with an addiction history. Clin J Pain. 2002; 18: S61-9. [ Links ]
26. Compton P, Athanasos P. Chronic pain, substance abuse and addiction. Nurs Clin North Am. 2003; 38: 525-37. [ Links ]
27. Kirsh K L, Whitcomb LA, Donaghy K, Passik S D. Abuse and addiction issues in medically ill patients with pain: attempts at clarification of terms and empirical study.Clin J Pain. 2002; 18: S52-60. [ Links ]
28. Passik S D, Hays L, Eisner N, Kirsh K L. Psychiatric and pain characteristics of prescription drug abusers entering drug rehabilitation. J Pain Palliat Care Pharmacother. 2006; 20: 5-13. [ Links ]
29. Chabal C, Erjavec M K, Jacobson L, Mariano A, Chaney E. Prescription opiate abuse in chronic pain patients: clinical criteria, incidence, and predictors. Clin J Pain. 1997; 13: 150-5. [ Links ]
30. Ivés T J, Chelminski P R, Hammett-Stabler C A, Malone R M, Perhac J S, Potisek N M, et al. Predictors of opioid misuse in patients with chronic pain: a prospective cohort study. BMC Health Serv Res. 2006; 4: 6: 46. [ Links ]
31. Reid M C, Engles-Horton L L, Weber M B, Kerns R D, Rogers E L, O’Connor P G. Use of opioid medications for chronic noncancer pain syndromes in primary care. J Gen Intern Med. 2002; 17: 173-9. [ Links ]
32. Furlan A D, Sandoval J A, Mailis-Gagnon A, Tunks E. Opioids for chronic noncancer pain: a meta-analysis of effectiveness and side effects. CMAJ. 2006; 174: 1589-94. [ Links ]
33. Donner, B. Zenz, M. Tryba, M. Strumpf, M. Direct conversión from oral morphine to transdermal fentanyl: a multicenter study in patients with cáncer pain. Pain. 1996; 64: 527-34. [ Links ]
34. Ahmedzai S, Brooks D. Transdermal fentanyl versus sustained-release oral morphine in cáncer pain: preference, efficacy, and quality of life. The TTS-Fentanyl Comparative Trial.J Pain Symptom Manage. 1997; 13: 254-61. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
lmtorres@arrakis.es
pacollado@ono.com
Recibido: 02/01/2006
Aceptado: 13/03/2007