Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.15 no.5 Madrid jun./jul. 2008
Estimulación Medular (EEM) en el tratamiento de la enfermedad vascular periférica. Parte I
Spinal Cord Stimulation for peripheral vascular disease treatment. Part I
Enrique Freire Vila1; Aurora de la Iglesia López1, Alberto Camba Rodríguez2
1 Adjunto del Servicio de Anestesiología, Reanimación y Tratamiento del Dolor.
2 Jefe de Servicio de Anestesiología, Reanimación y Tratamiento del Dolor.
Hospital Arquitecto Marcide/Prof. Novoa Santos.
Dirección para correspondencia
RESUMEN
Las técnicas de neuromodulación suponen un abordaje no destructivo y reversible en el tratamiento del dolor. Su utilización se establece como estrategia de control del dolor no controlable dentro de las directrices de la O.M.S. y como alternativa a otras terapias invasivas menores o neuroablatibas que no han sido eficaces o que están contraindicadas. De entre ellas el uso clínico de la estimulación eléctrica medular (EEM) o neuroestimulación, demuestra día a día su utilidad y eficacia en el tratamiento de diferentes síndromes de dolor crónico.
Estudios de Cook y cols en 1.976, ya demostraron en sus trabajos la efectividad de esta técnica en la manifestación clínica del dolor isquémico así como en la arterioesclerosis o vasculopatía diabética, o en el dolor isquémico producido por vasoespasmo periférico, en entidades específicas como la Enfermedad de Buerguer, Esclerodermia o Síndrome de Raynaud.
Durante la última década, se ha extendido la utilización de la EEM en la cardiopatía isquémica de carácter intratable (angina de pecho refractaria a tratamientos, síndrome "X",...) y la patología vascular periférica, objeto de esta revisión.
Esta técnica se presenta como una de las principales indicaciones con altos niveles de efectividad (80%), tanto en el aspecto clínico por el alivio sintomático que produce, como en los beneficios isquémicos fisiopatológicos que induce la neuroestimulación.
Palabras clave: Neuromodulación; enfermedad vascular periférica; estimulación medular.
ABSTRACT/SUMMARY
The Neuromodulation technologies are a not destructive and reversible approach in the treatment of the pain. They are used as a strategy for the control of untreatable pain according to the directives of the OMS and as an alternative of other invasive minor or neuroablatives therapies that have been not effective or that are not indicated. Between them the clinical use of spinal cord stimulation (SCS) has demonstrated its usefulness and efficiency in the treatment of different syndromes of chronic pain.
Cook's and cols. in 1.976, demonstrated in their reports the efficiency of this technique in the clinical manifestation of ischemic pain as well as in the arteriosclerosis, diabetic vasculopaty, or in the ischemic pain related with peripheral vasospasm, in specific pathologies as the Buerguer's disease, Scleroderma or Raynaud's syndrome.
During the last decade, the utilization of the SCS has spread in the ischemic cardiopathy of untreatable character (refractory angina pectoris, syndrome "X",...) and vascular peripheral pathology, subject of this review.
This technique appears as one of the main indications with high levels of efficiency (80%), so much in the clinical aspect for the symptomatic relief as well as in the ischemic physiopatologic benefits that induces the neuroestimulation.
Key words: Neuromodulation; vascular peripheral disease; spinal cord stimulation.
Introducción
Las técnicas de neuromodulación suponen un abordaje no destructivo y reversible en el tratamiento del dolor. Su utilización se establece como estrategia de control del dolor no controlable dentro de las directrices de la OMS (1) o como alternativa a otras terapias invasivas menores o neuroblatibas que no han sido eficaces o que están contraindicadas. De entre ellas el uso clínico de la estimulación eléctrica medular (EEM) o neuroestimulación, demuestra día a día su utilidad y eficacia en el tratamiento de diferentes síndromes de dolor crónico (2).
La ya conocida y vigente teoría de la estimulación de los cordones posteriores de la médula espinal, es uno de los elementos explicativos fundamentales en el tratamiento del dolor crónico. Esta teoría de la "puerta de entrada" de Melzack y Wall expuesta en 1.965 se basa en la activación de fibras aferentes encargadas de la inhibición de la transmisión de la información nociceptiva a nivel segmentario en el lugar de aplicación del estímulo eléctrico (3,4).
Otras teorías postuladas e implicadas en los fenómenos explicativos del alivio del dolor incluyen los múltiples estudios experimentales en animales, dónde se demuestra la existencia de circuitos supraespinales en los que encontramos diversos neurotransmisores (sistema GABAérgico, sistema CGRP, aminoácidos excitatorios (AAEs), etc,...) implicados en el alivio del dolor.
Desde los estudios de Cook y cols en 1.976 (5) se demostró la efectividad en el tratamiento de las distintas expresiones clínicas del dolor isquémico como en alteraciones de la circulación periférica en relación con arterioesclerosis o vasculopatía diabética, o en el dolor isquémico producido por vasoespasmo periférico, en entidades específicas como la Enfermedad de Buerguer, Esclerodermia o Síndrome de Raynaud (6).
Durante la última década, se ha extendido la utilización de la EEM en otro tipo de patología vascular: la cardiopatía isquémica de carácter intratable (angina de pecho refractaria a tratamientos, síndrome "X",...) (7) y la patología vascular periférica, objeto de esta revisión.
Se presenta como una de las principales indicaciones con altos niveles de efectividad (80%), tanto en el aspecto clínico por el alivio sintomático que produce, como en los beneficios isquémicos fisiopatológicos que induce la neuroestimulación (8-10).
Definición
El término dolor isquémico lo referiremos a un síndrome doloroso determinado por la insuficiencia total o parcial en el aporte de oxígeno a los tejidos. El disbalance absoluto o relativo, agudo o crónico entre la demanda y el aporte de oxígeno tisular será el responsable principal del sufrimiento de los tejidos implicados.
Los procesos oclusivos o inflamatorios de los vasos arteriales serán los de mayor expresividad clínica en cuanto al dolor, aunque los pacientes afectos de patología venosa crónica podrían llegar a manifestar similares niveles de dolor.
Es importante reconocer cómo el dolor de carácter isquémico es un fenómeno complejo cuya patogénesis implica mecanismos tanto nociceptivos como neuropáticos siendo este último el más relevante. Entre los mecanismos fisiopatológicos incluiremos las alteraciones metabólicas asociadas a las lesiones de los "vasa nervorum" de los pacientes diabéticos, el daño por hipoxemia o la reacción edematosa resultante de una compresión nerviosa, entre otras.
Básicamente la combinación de dos mecanismos podrían estar implicados en el alivio del dolor de características isquémicas. Por un lado, la acción analgésica directa por el efecto inhibidor de las neuronas del asta dorsal de la médula espinal y por otro; el efecto analgésico indirecto del incremento del flujo de sangre periférico y con ello un aumento en el aporte de oxígeno a los tejidos de zonas deficitarias. Otros mecanismos complementarios, inducidos por la EEM, podrían existir influyendo en la actividad simpática cutánea. Dicho de otra forma, la neuroestimulación podría influenciar en el alto tono simpático mantenido que explicaría la vasoconstricción y el vasoespasmo vascular pero induciría antidrómicamente la vasodilatación en pacientes con bajo tono simpático.
Es por todo esto, y ante la evidencia de las distintas aplicaciones clínicas y los buenos resultados obtenidos con la EEM en la patología vascular, que se hace necesario un conocimiento cada vez más profundo y preciso de las bases anatomofisiológicas y de los diferentes mecanismos neurobiológicos de acción implicados en las técnicas de electroestimulación medular que cada vez están más presentes como técnicas de control de dolor en patologías de difícil tratamiento convencional.
Fisiopatología
BASES ANATÓMICAS
La mayoría de las fibras nerviosas aferentes una vez acceden a la médula espinal se dirigen hacia los cordones posteriores donde se bifurcan entre rama ascendente y descendente. En comparación con las fibras longitudinales que componen los cordones posteriores, las fibras aferentes posteriores, tienen un perfil curvado y por tanto se diferencian en la orientación con respecto a la médula espinal. Strujik y Holsheimer (11) han estudiado el efecto de esta curvatura en su umbral de estimulación y de acuerdo con su modelo desde que las proyecciones axonales están inmersas en el LCR y penetran en la médula espinal que posee una baja conductividad, el umbral más bajo de conducción está localizado a nivel de los cordones posteriores, en el asta dorsal medular.
En estos estudios se confirmó que el ángulo con el que las fibras entraban en la médula espinal tenía un efecto significativo en su umbral de excitación que aumentaba de forma directa el ángulo de entrada y su relación con el plano transverso, siendo también relevante la curvatura del manguito dural para el umbral de excitación. Finalmente se observó que si el ángulo de la curvatura se alejaba del cátodo, el umbral disminuía y el sentido contrario del ángulo producía un aumento del umbral.
Los cordones posteriores están formados por colaterales de fibras mielínicas aferentes gruesas que son responsables de la transmisión propioceptiva, y que una vez entran en la médula espinal envían fibras colaterales que entran en el asta dorsal medular desde su aspecto medial acabando en la lámina profunda de las sustancia gris (12). El diámetro de los cordones posteriores disminuye a medida que ascienden cranealmente, desde los 12 micrones en su origen hasta 8 micrones, pocos segmentos medulares cefálicamente. Además de las proyecciones de las aferentes primarias los cordones posteriores poseen los axones de las células localizadas en el asta dorsal medular. Estos axones de las vías postsinápticas de los cordones posteriores y las células de origen están localizadas en las láminas III-V del asta dorsal medular.
BASES NEUROFISIOPATOLÓGICAS
A. Propiedades eléctricas de las estructuras intraespinales
Entre las estructuras más importantes desde el punto de vista de la conductividad eléctrica, dentro de las estructuras intraespinales, destacan el espacio epidural dorsal (grasa, duramadre y líquido cefalorraquídeo), las raíces espinales y la médula espinal. Reina y cols (13), demostraron en varios trabajos, como la máxima conductividad recae en el LCR. La conductividad de la duramadre es desconocida y su espesor es un factor importante en la transmisión del impulso eléctrico y variable dependiendo del nivel segmentario dónde se desarrolle y en la relación a la lateralidad del mismo (medial (+) / lateral (-).
Tras el LCR, la sustancia blanca es la que presentó la mayor conductividad eléctrica y el resto de las estructuras anatómicas estudiadas como el hueso, sustancia gris y grasa epidural, presentaron una conductividad mínima.
La corriente producida por los contactos eléctricos fluye desde el electrodo a través del LCR, siendo el espesor de su capa el factor más importante en la distribución de la corriente entre el electrodo y el asta dorsal de la médula. Es conocido como el espesor varía según los distintos segmentos del raquis así como las dimensiones del canal espinal y de la médula espinal. Desde 2,5 mm en la región cervical media; 5,8 mm en la región media torácica; y 3,6 mm en la región torácica inferior (14).
B. Mecanismos generales neurofisiológicos
La EEM es una alternativa terapéutica aplicada al tratamiento del dolor en la enfermedad vascular. Los pacientes afectos de enfermedad vascular periférica experimentarán alivio del dolor, incrementos en la distancia de claudicación, mejoría de las úlceras vasculares y las posibilidades de caminar. Los efectos beneficiosos de la EEM en la extremidad isquémica se relacionan como consecutivos al incremento del flujo sanguíneo en los miembros inferiores.
MECANISMOS FISIOPATOLÓGICOS EN EL DOLOR ISQUÉMICO
A. Efectos anti-anginosos
Un doble mecanismo: por un lado el estímulo generado con la capacidad de intervenir sobre la compleja función moduladora de la percepción del dolor a nivel del dermatoma elegido. Por otro lado, la regulación antiisquémica a través de la acción conseguida sobre los centros supraespinales.
*En cuanto a la acción sobre la percepción del dolor, ya desde 1.967, Wall y Sweet publicaron un efecto analgésico que incluso se mantenía tras el cese de la electroestimulación, efecto que posteriormente confirmaron otros autores. Hasta ahora se han planteado diversas hipótesis implicando un mecanismo multifactorial. La estimulación podría elevar el umbral del dolor mediante la reducción de la cantidad de impulsos nociceptivos ascendentes a través de los haces espinotalámicos.(15) Sin embargo, esto no explicaría la persistencia del efecto analgésico tras la detención de la estimulación como se ha comentado anteriormente. Es probable que durante la misma, se liberen sustancias neurohumorales (serotonina, sustancia P, etc,...), como comprueba Linderoth (16) en estudios experimentales en animales, que podrían seguir modulando la capacidad analgésica de las células espinotalámicas durante largo tiempo tras la detención del estímulo eléctrico.
* En cuanto a la regulación del efecto antiisquémico, se dirigen los estudios la evaluación del efecto de sustancias como la adenosina y bradicidina en el papel de "originadores" del dolor de características anginosas. En este sentido ya se apuntaba en la década de los 90', la interacción de la EEM con la liberación de adenosina por parte del miocardio pudiendo ser esta otra vía de modulación del dolor isquémico.
B. Efectos anti-isquémicos
Como ya se ha comentado, el dolor con características isquémicas se origina por un desequilibrio entre el aporte y demanda de oxígeno en los tejidos ya sea por oclusión, vasoespasmo o por incremento del consumo en los mismos.
En este sentido varios mecanismos son los implicados en la mejoría del flujo sanguíneo y en el alivio del dolor consecuente al proceso isquémico. En primer lugar, el consistente en que la EEM a intensidades bajas y moderadas, mejora las condiciones isquémicas vasculares al eliminar la actividad simpática. Esto es un fenómeno comprobado a nivel cardíaco al producirse una inhibición de la vasoconstricción mediada por receptores nicotínicos en los ganglios simpáticos y receptores alfa-1 en la unión neuromuscular (17).
Por otra parte la utilización de la EEM a intensidades altas, ejerce un efecto de "reclutamiento" de efectos vasodilatadores periféricos antiandrómicos mediante la activación del asta dorsal medular mediada por el péptido del gen relacionado con la calcitonina (CGRP) y el óxido nítrico. El incremento en el flujo sanguíneo aparecería entonces como un efecto independiente del conseguido por abolición del sistema simpático y a altas intensidades de estimulación dependería de la información transmitida por los nervios sensitivos (18).
En este sentido, este doble mecanismo de control por vasoconstricción simpática y la acción vasodilatadora antiandrómica mediada por el sistema CGRP mejoraría la sintomatología en pacientes como en el Síndrome de Raynaud, ya que éstos presentan una sensibilidad anormal o un exceso de receptores alfa-1 adrenérgicos y/o sufren disfunción del sistema CGRP (19,20).
La utilización de altas intensidades de EEM, no toleradas por los pacientes, deberían ser utilizadas en crisis de vasoespasmo durante el ejercicio físico, frío, etc...
MECANISMOS FISIOPATOLÓGICOS EN EL DOLOR NEUROPÁTICO
A. Mecanismos neurofisiológicos
En el segmento proximal de las células nerviosas se desarrolla un aumento de la expresividad celular de los marcadores inflamatorios (interleucinas entre otros), que se verán relacionados con la gravedad de la alodinia en los pacientes afectos. Este fenómeno de alodinia estará mediado por las fibras de bajo umbral A-Beta que establecen un nivel generalizado de hiperexcitabilidad celular.
Los cambios producidos a nivel de la médula espinal tras una lesión de un nervio periférico se manifestarán como un aumento de la sensibilidad y en forma de un alto grado de descargas espontáneas de las neuronas del asta dorsal. Esto se debe a la "sensibilización" de los mecanorreceptores periféricos que interpretarán los estímulos inocuos como dolorosos.
Las vainas de Schwann alterarán su morfología produciendo una excitación cruzada entre las fibras A básicamente, algunas A-C y en menor lugar entre C-A. Se producirán descargas periféricas debido al acercamiento de las fibras intactas adyacentes al nervio lesionado para inervar las áreas originales a través de las vainas de Schwann con la inclusión de fibras simpáticas que contribuirán al desarrollo del dolor evocado, demostrado el porqué al realizar una simpatectomía o al cortar el nervio adyacente a la lesión se alivia la alodinia e hiperalgesia (21,22).
El efecto de la EEM induce un decremento significativo de los síntomas "excesivos", que permanecen durante un tiempo (más de 10 minutos) tras el cese de la estimulación al suprimir la actividad de las células presentes en el asta dorsal medular, cuya función ha sido distorsionada por la lesión del nervio periférico. La activación antiandrómica de las fibras del asta dorsal pueden imitar las aferencias normales de esas células y al mismo tiempo producir una inhibición presináptica de las aferencias dañadas encargadas de perpetuar la excitabilidad de las células de rango dinámico ancho. La inhibición postsináptica de estas células mediante interneuronas de colaterales también ocurriría.
La obligatoriedad de obtener parestesias en la zona diana durante el implante de los electrodos epidurales para conseguir alivio de la sintomatología dolorosa, explica la necesidad la integridad e la anatomía neuronal estimulada para que la transmisión eléctrica sea efectiva. Esto explica que en las avulsiones de plexos nerviosos, las parestesias sean ineficaces como terapia por la imposibilidad de transmisión nerviosa (23,24).
B. Mecanismos neuroquímicos
Durante el tratamiento con EEM se objetiva el alivio de los síntomas durante horas después de la estimulación que se reflejarían en cambios de los neurotransmisores del asta dorsal o de centros supraespinales. El alivio de la sintomatología se obtiene sobre todo en dolores rebeldes considerados como "resistentes a opioides". Con la EEM conseguimos un aumento de b-lipoproteínas y bendorfinas en LCR con acción analgésica no bloqueada por la naloxona. Sin embargo algunos estudios demuestran que tras estimulación transcutánea a altas frecuencias (TENS) podría activarse el sistema dinorfina y el receptor k de los opioides sería inactivado con menor eficacia por la naloxona (22,25).
En diferentes estudios se ha observado el LCR antes y después de la EEM obteniéndose incrementos en los niveles de serotonina, ácido gamma-amino butírico (GABA) y de sustancia P, este último neurotransmisor involucrado en la modulación de la respuesta dolorosa, con propiedades nociceptivas en distintos niveles del sistema nervioso central.
El GABA es el neurotransmisor inhibitorio más importante a nivel de las láminas I-III del asta dorsal medular. Involucrado en la inhibición de las terminales de las aferencias primarias tanto pre como post-sinápticas en fibras grandes y en las amielínicas de la transmisión de la nocicepción.
Diferentes animoácidos excitatorios (AAE) como glutamato y aspartato, presentes en los sistemas aferentes primarios que contribuyen a la transmisión de la nocicepción son liberados masivamente tras excitotoxicidad por descargas ectópicas de fibras nerviosas lesionadas (26). Se ha comprobado como inyecciones intratecales de glutamato y aspartato inducen hiperalgesia y alodinia y antagonista del glutamato inhiben la hiperalgesia (27).
Otro neurotransmisor importante, la adenosina, se presenta como neuromodulador a nivel del LCR. Actúa estableciendo una acción sinérgica entre los efectos antialodinia que produce la EEM por la activación simultánea de GABA-B y de los receptores A-1 de la adenosina. De esta manera, bloqueando ambos receptores, cesaría el efecto de la EEM en relación con estos dos últimos.
En resumen, diríamos que el dolor neuropático en algunas neuronas del asta dorsal medular estaría en un estado de hiperexcitabilidad debido a la lesión del nervio periférico, produciendo múltiples disregulaciones de los neurotransmisores y moduladores del asta dorsal. Específicamente existe un incremento de los AAE, en parte debido a un defecto local del sistema GABAérgico. La EEM produce un efecto de incremento de la actividad del sistema GABA, sobre todo el GABA-B, disminuyendo los AAE. Del mismo modo, similares mecanismos explicarían en otros sistemas el aumento de adenosina, galanina y de sustancia P o de serotonina.
Casos clínicos
FENÓMENO DE RAYNAUD
Motivo consulta: Paciente mujer de 74 años enviada desde el Servicio de Reumatología por dolor y crisis de vasoespasmo vascular en relación con Artritis Reumatoide (AR) y fenómeno de Raynaud (FR).
Antecedentes Personales: Alérgica a la Penicilina. Crisis comiciales (convulsiones hemibraquiales derechas con diplopia en ojo derecho y estrabismo divergente). Accidentes cerebrovasculares (ACV) de repetición. Glaucoma. Sdme. Depresivo.
Diagnosticada de Síndrome de Solapamiento ARLES (Lupus eritematoso sistémico), conocida y seguida por el Servicio de Reumatología desde 1.988 por artritis, deformidad de manos y FR de 17 años de evolución. Vasculitis cutánea espasmódica de predominio digital en extremidades superiores. Lesiones de Lupus discoide en cuero cabelludo. La paciente fue intervenida quirúrgicamente en varias ocasiones: colecistectomizada (1.983), fisura anal e implante de EEE cervical para simpatectomía cervical.
Tratamiento actual: Imurel® 50; Epanutin®; Prednisona® 5mg; Natecal® D comp.; Idalprem®; Seroxat®; Voltarén Retard®; Adiro® 150 mg/día.
Enfermedad Actual: La paciente se puso en contacto con la Unidad de Dolor hace 14 años con los diagnósticos de Artritis Reumatoide (AR) y Fenómeno Raynaud (FR).
La paciente en el momento de la consulta inicial, presentaba varias lesiones maculopapulosas de aspecto eriternatovioláceo que se reagudizaban con el frío. La paciente insistió en el empeoramiento clínico de sus lesiones, y que llegada en la temporada fría del año (otoño-invierno) (fig. 1).
En cuanto el dolor la paciente presentó inicialmente una puntuación EVA de 7-8 puntos en el momento de las crisis vasoespásticas por frío; y una puntuación de 12 puntos en el test de Lattinen. Tras estudiar el caso clínico, desde el principio de decidió el implante de un electrodo de estimulación medular (EEM) a nivel cervical con objeto de vasodilatación, para control de crisis vasoespásticas y alivio del dolor sobre el territorio de ambas extremidades superiores.
Se explica el procedimiento de implante a la paciente y tras ser evaluada por el Servicio de Psiquiatría para el mismo y aceptada, se recogió el consentimiento informado y se programó a la paciente para implante en quirófano en condiciones de asepsia, profilaxis antibiótica habitual y con apoyo fluoroscópico.
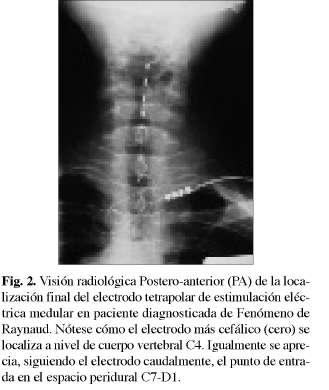
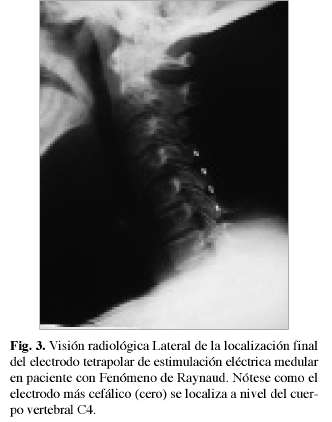
Durante el implante del EEM, la paciente relata parestesias en ambas extremidades superiores y en los territorios implicados por los cambios vasculares y por el dolor. Se ubicó la punta del electrodo tetrapolar a nivel de cuerpo vertebral C4 tras abordaje medial a nivel de C7-D1 (Fig. 2 y 3).
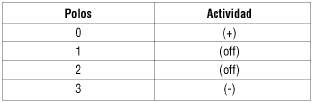
Se programa con los siguientes parámetros: Amplitud (V): 1,3 voltios; Frecuencia (Hz): 85; Duración del impulso (ms): 120. Programa cíclico 30'' apagados y 6 min encendido.

Tras el implante la paciente presentó importante mejoría clinica, muchas menos crisis vasoespásticas y de menor duración e intensidad con puntuación EVA (2-3) y Lattinen (7).
Habitualmente la paciente acude a la Unidad del Dolor bianualmente para activar y/o desactivar el neuroestimulador una vez llegada la temporada de otoño-invierno y primavera-verano respectivamente, dependiendo de cómo experimenta la paciente los pródromos de las crisis vasoespásticas digitales de su enfermedad.
Ulceras vasculares
Motivo de consulta: Se trata de un paciente varón de 82 años, enviado a nuestra Unidad del Dolor procedente de su médico de cabecera por evolución tórpida y dolorosa de ulceras vasculares en ambas extremidades inferiores (fig. 4).
Antecedentes personales: Paciente alérgico al esparadrapo y Tramadol. Intolerancia a glucoca. Prostatismo e insuficiencia renal crónica moderada. Fumador moderado. Cardiopatía isquémica por enfermedad de un vaso (cateterismo cardíaco) y enfermedad valvular degenerativa (doble lesión aórtica de predominio estenótico severo, insuficiencia mitral y tricuspídea moderada-severa). AcxFA. HTP leve-moderada. Insuficiencia venosa crónica. NYHA III/VI.
Tratamientos actuales: Digoxina®, Sintrom®, Dinisor® 60, Omnic®, Seguril®, Pariet®, Trankimazin®, Durogesic® 50mg/h/48h, Nolotil®.
Enfermedad actual: El paciente presenta unas lesiones ulcerosas profundas y anfractuosas de diámetro superior a 3x2 cms con fondo fibrinoso y supuestamente infectado con componente inflamatorio periférico, de dos años de evolución. Intenso dolor que en la escala EVA (10/10) y Lattinen 16 puntos.
Se explica el procedimiento de implante a la paciente y tras ser evaluada por el Servicio de Psiquiatría para el mismo y aceptada, se recogió el consentimiento informado y se programó a la paciente para implante en quirófano en condiciones de asepsia, profilaxis antibiótica habitual y con apoyo fluoroscópico.
Se implanta un electrodo tetrapolar tras abordaje paramedial a nivel lumbar L1-L2 situando la punta del mismo (según control fluoroscópico y posterior radiológico) a nivel de cuerpo vertebral D9. Desde esta ubicación, se consiguen parestesias en ambas extremidades inferiores coincidente con las zonas coincidentes del dolor y de localización de las úlceras. En el momento quirúrgico al paciente el estímulo eléctrico le supone una sensación parestésica agradable y con baja intensidad desde el generador de impulsos de prueba.
Tras dos meses (53 días) de seguimiento y estimulación, y comprobada la efectividad del funcionamiento del sistema y la mejoría clínica del paciente; queda programado con los siguientes parámetros: Amplitud (V): 1,5 voltios; Frecuencia (Hz): 31; Duración del impulso (ms): 210. Programa continuo.
El paciente describe una reducción de un 40% en la intensidad del dolor, relata que le es posible conciliar el sueño durante toda la noche (>7 horas). El aspecto de las lesiones ha dado un giro importante hacia la mejoría apreciándose tejido de granulación y cicatriz cutánea con puente cutáneo signo de epitelización. Afirma que de seguir así en un par de semanas ya no tendrá que seguir haciendo curas a las heridas (fig. 5).
El último control realizado con el paciente a los 70 días del inicio de estimulación, supone una mejoría en cuanto al control del dolor de un 70% según el nivel inicial de este así como una resolución al 90% de las heridas ulceradas que presentaba al inicio del cuadro.
Bibliografía
1. World Health Organization Cancer Pain Relief. Albany, NY: WHO Publications Center; 1.986. [ Links ]
2. Barolat G, Sharan AD, Future trends in spinal cord stimulation. Neurol Res. 2000; 22 (3): 279-84. [ Links ]
3. Melzack R, Wall PD. Pain mechanisms:a new theory. Science 1.965; 150: 971-8. [ Links ]
4. López-Alarcón MD. Fisiología de la neuromodulación. Rev Soc. Esp. Dolor 2.003; 10-(S1): 77-85. [ Links ]
5. Cook AW, Oygar A, Baggenston P, Pacheco S, Kleriga E. Vascular disease of extremities. Electrical stimulation of spinal cord and posterior roots. N Y State J Med 1.976; 76: 366-8. [ Links ]
6. Augustinsson LE, Linderoth B, Mannheimer C. Spinal cord stimulation in various ischaemic conditions. En: lilis L, eds. Spinal cord Dysfunction. Vol III Functional Stimulacion Oxford Medical Publications, 1.992. p. 272-295. [ Links ]
7. Hernández A, Fernández A, Peláez E, Rodríguez A, García, Santos J y Muriel C. Manejo del Síndrome X con electroestimulación medular. A propósito de un caso clínico. Rev Soc Esp Dolor 2003; 10: 119-122. [ Links ]
8. Elliasson T, Augustinsson LE, Manheimer C. Spinal cord stimulation in severe angina-pectoris presentation of current studies, indications and clinical experience. Pain 1.996; 65: 169-79. [ Links ]
9. Ferrandis P, De Andrés J, Gargallo C, Valía JC, López MD, Peiró M y Monsalve V. Neuroestimulación epidural de la médula espinal en pacientes con angina refractaria. Estudio Retrospectivo. Rev Soc Esp Dolor 2.003; 10: 24-31. [ Links ]
10. De Vries J, De Jongste MJ, spincemaille G, Staal MJ. Spinal cord stimulation for ischemic Heart disease and peripheral vascular disease. Adv Tech Stand Neurosurg 2.007; 32: 63-89. [ Links ]
11. Strujik JJ, Holsheimer J, Boom HB. Excitation of dorsal roots fibers in spinal cord stimulation: A Theoretical study. IEEE Trans Biomed Eng 1.993; 40: 632-8. [ Links ]
12. Martín JH, Jessell TM. Anatomy of the somatic sensory system. In Kandel ER, Schwartz JH, Jessell TM, eds. Principies of Neural Science. 3rd ed. New York: Elsevier, 1991; pps: 353-66. [ Links ]
13. Reina MA, López A, Dittman M, De Andrés J. Análisis estructural del espesor de la duramadre humana mediante microscopía electrónica de barrido. Rev Esp Anestesiol Reanim 1.996; 43: 135-7. [ Links ]
14. Strujik JJ, Holsheimer J, Barolat G, He J, Boom HB. Parestesia thresholds in spinal cord stimulation: A comparison of theorical results with clinical data. IEEE Trans Rehab Eng 1.993; 1: 101-8. [ Links ]
15. Chandler MJ, Brennan TJ, Garrison DW, Kim KS, Schwarts PJ, Foreman RD. A Mechanism of cardiac pain supresión by spinal cord stimulation implications for patients with angina pectoris. Eur Heart J 1.993; 14: 96-105. [ Links ]
16. Linderoth B, Gazalius B, Franck J, Brodin E. Dorsal column stimulation induces release of serotonin and substance Pin the car dorsal horn. Neurosurgery 1.992; 31: 289-97. [ Links ]
17. Norrsell H, Eliasson T, Mainheimer C. Effects of pacind-induced myocardial stress and spinal cord stimulation on whole body and cardiac norepinephrine spillover. Eur Heart J 1997; 18: 1890-6. [ Links ]
18. Eliasson T, Mainheimer C, Waagstein F Myocardial turnover of endogenous opioids and CGRP in the human Heart and the effects of spinal cord stimulation. Cardiology 1.998: 170-7. [ Links ]
19. Croom JE, Barron KW, Chandler MJ, Foreman RD. Cutaneous vasodilation during dorsal column stimulation in mediated by dorsal roots and CGRP. An J Physiol 1997; 272: H950-H7. [ Links ]
20. Turnipseed WD. Commentary regarding "microcirculatory investigations to determine the effect of spinal cord stimulation for critical leg ischemia: the Dutch multicenter randomised controlled trial". J Vasc Surg 1999; 30 (2): 370-1 (coment on: J Vasc Surg 1.999; Aug 30 (2): 236-44. [ Links ]
21. Linderoth B, Foreman RD. Physiology of spinal Cord Stimulation: Review and update. Neuromodulation 1.999; 3 (II): 150-164. [ Links ]
22. López-Alarcón MD. Fisiología de la Neuroestimulación. Rev Soc Esp Dolor 2003; 10 (Supp I); 77-85. [ Links ]
23. Selzer Z, Dubner R, Shir Y. A novel behavioral model of neuropathic pain disorders produced in rats by partial sciatic nerve injury. Pain 1.990; 43: 205-18. [ Links ]
24. Ghajar AW, Miles JB. The differential effect of the level of spinal cord stimulation on patients with advanced peripheral vascular disease in the lower limbs. Br. J. Neurosurg 1998; 12 (5): 402-8. [ Links ]
25. Meyerson BA, Cui JG, Yakhnistsa V. Modulation os spinal pain mechanism by spinal cord stimulation and the potential role of adyuvant pharmacotherapy. Stereotact Funct Neurosurg 1.997; 68: 129-40. [ Links ]
26. Onaka M, Minan T, Nishihara I, Ito S. Involvement of glutamato receptors in strychmine -and bicuculline-induced alldynia in conscious mice. Anesthesiology 1.996; 84: 1215-22. [ Links ]
27. Pellicciari R, Constantina G, Marinozzi M, Natalini B. Modulation of glutamate receptor pathways in the search for new neuroprotective agents. Farmaco 1998; 53: 255-61. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. Enrique Freiré Vila
Secretaría del Servicio de Anestesiología,
Reanimación y Tratamiento del Dolor
Hospital Arquitecto Marcide / Prof. Novoa Santos
Área Sanitaria de Ferrol
C/ Estrada San Pedro de Leixa-Catabois, s/n
15.405 Ferrol - (Coruña, La), Spain
Tel.: 981.33.40.00 (Ext): 138-137
Fax: 981.33.40.15
enriquefreire2000@yahoo.es
Financiación: Ninguna
Conflictos de interés: No declarados
Recibido: 11/05/2008
Aceptado: 11/06/2008