Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.15 no.6 Madrid ago./sep. 2008
Estimulación Medular (EEM) en el tratamiento de la enfermedad vascular periférica. Parte II
Spinal Cord Stimulation for peripheral vascular disease treatment. Part II
E. Freire1; A. de la Iglesia1, A. Camba2
1 Adjunto del Servicio de Anestesiología, Reanimación y Tratamiento del Dolor.
2 Jefe de Servicio de Anestesiología, Reanimación y Tratamiento del Dolor.
Servicio de Anestesiología, Reanimación y Tratamiento del Dolor. Hospital Arquitecto Marcide/Prof. Novoa Santos.
A.S.F. (Área Sanitaria de Ferrol), Ferrol, (Coruña, La), España.
Dirección para correspondencia
RESUMEN
Las técnicas de neuromodulación suponen un abordaje no destructivo y reversible en el tratamiento del dolor. Su utilización se establece como estrategia de control del dolor no controlable dentro de las directrices de la O.M.S. y como alternativa a otras terapias invasivas menores o neuroablatibas que no han sido eficaces o que están contraindicadas. De entre ellas el uso clínico de la estimulación eléctrica medular (EEM) o neuroestimulación, demuestra día a día su utilidad y eficacia en el tratamiento de diferentes síndromes de dolor crónico.
Estudios de Cook y cols en 1.976, ya demostraron en sus trabajos la efectividad de esta técnica en la manifestación clínica del dolor isquémico así como en la arterioesclerosis o vasculopatía diabética, o en el dolor isquémico producido por vasoespasmo periférico, en entidades específicas como la Enfermedad de Buerguer, Esclerodermia o Síndrome de Raynaud.
Durante la última década, se ha extendido la utilización de la EEM en la cardiopatía isquémica de carácter intratable (angina de pecho refractaria a tratamientos, síndrome X,...) y la patología vascular periférica, objeto de esta revisión.
Esta técnica se presenta como una de las principales indicaciones con altos niveles de efectividad (80%), tanto en el aspecto clínico por el alivio sintomático que produce, como en los beneficios isquémicos fisiopatológicos que induce la neuroestimulación.
Palabras clave: Neuromodulación; enfermedad vascular periférica; estimulación medular.
ABSTRACT
The Neuromodulation technologies are a not destructive and reversible approach in the treatment of the pain. They are used as a strategy for the control of untreatable pain according to the directives of the OMS and as an alternative of other invasive minor or neuroablatives therapies that have been not effective or that are not indicated. Between them the clinical use of spinal cord stimulation (SCS) has demonstrated its usefulness and efficiency in the treatment of different syndromes of chronic pain.
Cook´s and cols. in 1.976, demonstrated in their reports the efficiency of this technique in the clinical manifestation of ischemic pain as well as in the arteriosclerosis, diabetic vasculopaty, or in the ischemic pain related with peripheral vasospasm, in specific pathologies as the Buerguer´s disease, Scleroderma or Raynaud´s syndrome.
During the last decade, the utilization of the SCS has spread in the ischemic cardiopathy of untreatable character (refractory angina pectoris, syndrome X,
) and vascular peripheral pathology, subject of this review.
This technique appears as one of the main indications with high levels of efficiency (80%), so much in the clinical aspect for the symptomatic relief as well as in the ischemic physiopatologic benefits that induces the neuroestimulation.
Key words: Neuromodulation; vascular peripheral disease; spinal cord stimulation.
Indicaciones de la EEM en la patología vascular
DOLOR ISQUEMICO
En líneas generales, los pacientes que mejores resultados presentan son los afectados por angiopatía periférica. El dolor en relación con isquemia de origen arterioesclerótico, concomitante o no con diabetes, presentan mejoría clínica del dolor aunque según diferentes series de pacientes, continua presentándose una incidencia elevada de amputación de miembros (28).
Las lesiones ulcerosas en las extremidades inferiores, afectan a la población en un 1% y están causadas por insuficiencia venosa (90%) e insuficiencia arterial (5%) y más raramente por causas neurológicas (mal perforante plantar) o bien por infecciones, tumores, traumatismos, etc..
Las lesiones por insuficiencia venosa (Insuficiencia valvular) crónica congénita o adquirida (trombosis/tromboflebitis) origina hipertensión venosa que es transmitida al plexo venoso superficial por los vasos perforantes originando varices externas. Las lesiones de origen arterial, más pequeñas, profundas y dolorosas, se dan en pacientes con signos y síntomas de insuficiencia arterial (claudicación intermitente, angor, frialdad distal, aumento del tiempo de llenado capilar y disminución de pulsos) (29). También se detecta un incremento del diferencial de tensión arterial pierna brazo mediante la oscilometría. A diferencia de las úlceras venosas, el dolor de causa arterial mejora al bajar la pierna y la piel está atrófica y brillante, con reducción del pelo. Los pacientes con úlceras arteriales suelen tener factores de riesgo como tabaquismo, diabetes, hipertensión arterial, hipercolesterolemia o arterioesclerosis. Se podrían distinguir en líneas generales hasta cuatro tipos de lesiones ulcerosas arteriales: las arterioescleróticas (isquémicas); las asociadas a tromboangeitis obliterante (Enfermedad de Buerguer) que se ven en pacientes fumadores con anticuerpo anticolágeno III y se asocian a tromboflebitis; las ulceras hipertensivas (ulceras de Martorell), que afectan a la cara externa de la pierna, a nivel de la unión del tercio medio y del tercio inferior de la pierna; y las úlceras diabéticas, multifactoriales y que con frecuencia se sobreinfectan.
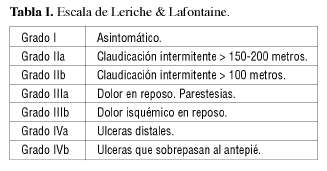
Los candidatos a estimulación serían los pacientes de los grupos IIIa, IIIb y IVa de Leriche & LaFontaine (Tabla I) aunque en diferentes revisiones, muchos autores incluyen también como candidatos a los pacientes del grupo IIb (30-34).
Un grupo particular de pacientes es aquel que presenta como única manifestación clínica la impotencial funcional, una disfunción eréctil de base vasculogénica formando parte de una manifestación de enfermedad arterial pélvica (35).
SÍNDROME ISQUÉMICO CRÓNICO OBSTRUCTIVO (ARTERIOESCLEROSIS)
Para este grupo de pacientes utilizaremos una serie de criterios comunes que nos indicarán el implantes del dispositivo de EEM (36-40).
a) Grados III y IV, excluyendo los pacientes con mayores grados de afectación isquémica con signos de necrosis extensa o infarto muscular.
b) Antecedentes de simpatectomía quirúrgica inefectiva o que ha revertido.
c) Pacientes de grado IIb con amputación en el miembro contralateral.
d) Lesiones necróticas con excelente evolución tras infusión de prostaglandinas (se pretendería con la EEM mantener el nivel analgésico conseguido con la infusión).
e) Necrosis extensa con indicación de amputación en el sentido de favorecer amputación infracondílea en lugar de supracondílea.
ARTERIOPATÍA DIABÉTICA (41)
Candidatos para EEM serían los pacientes afectos de:
a) Arterioesclerosis asociada no susceptible de revascularización quirúrgica.
b) Lesiones necróticas que han presentado evolución positiva tras la administración de prostaglandinas bien intraarteriales bien intravenosas.
c) Lesiones ulcerosas no extensas.
d) Serán excluidos los pacientes cuya valoración del sistema nervioso autónomo cardiovascular demuestre afectación simpática.
ARTERIOPATÍAS FUNCIONALES (42,43)
Entre las entidades que se incluyen dentro de las alteraciones funcionales por vasoconstricción encontramos: Fenómeno de Raynaud (FR), Livedo reticularis (LR), acrocianosis (Acr).
A) Fenómeno de Raynaud
Descrito en 1.882 por Maurice Raynaud como una asfixia local y gangrena simétrica de las extremidades. Un fenómeno que se sabe cinco veces más frecuente en mujeres y cuya edad de aparición suele estar entre los 18 y 30 años. Se caracteriza por episodios vasoespásticos, como respuesta al frío o a la tensión emocional, que suelen tener una duración de pocos minutos hasta una hora, y que determinarían una serie de cambios intermitentes en el color de la piel de los dedos de las manos y de los pies. Una interrupción del flujo sanguíneo provocada por espasmos de las pequeñas arterias que irrigan las zonas periféricas de las extremidades.
Son varios los mecanismos etiopatogénicos implicados: a) hipotensión u obstrucción arterial proximal; b) estenosis de la luz de las arterias digitales, por vasoespasmo (actividad simpática aumentada, hiperreactividad vascular local a un estímulo simpático) u oclusión de los vasos (hiperplasia de la íntima, vasculitis, trombosis); y c) aumento de la viscosidad sanguínea, secundaría a modificaciones de algunas proteínas circulantes (exceso de fibrinógeno, defectos en la fibrinolisis, presencia de crioaglutininas, mayor cantidad de inmunoglobulinas o inmunocomplejos, crioglobulinas) o a alteraciones de los elementos celulares (deformidad reducida de los hematíes, actividad aumentada de las palquetas y de los neutrófilos, con la posibilidad, por tanto, de lesión endotelial) (44-46).
El cuadro clínico es mucho más frecuente en mujeres 60-90% con una prevalencia que oscila entre 4-6% de la población. Las manifestaciones clínicas consisten principalmente en un cambio trifásico de color de los dedos. Las crisis casi siempre tiene un comienzo brusco tras una exposición al frío o un trastorno emocional. Durante las crisis se producen sucesivas alteraciones sensoriales y cambios de coloración de la piel: en la primera fase y como disminución del aporte de sangre en los dedos, la piel se torna extremadamente blanca y fría; en la segunda fase, llamada fase cianótica, el color de la piel se hace azulado debido a la ausencia de oxígeno en los tejidos, produciéndose una sensación de profundo adormecimiento (parestesias) en la zona afectada. Finalmente, las arteriolas se relajan permitiendo la entrada masiva de sangre acompañada del enrojecimiento súbito de la piel y de un hormigueo característico (fase de hiperemia reactiva-rubeosis), en este momento la crisis ha pasado.
B) Acrocianosis
La más rara de las manifestaciones vasoespásticas y que afecta a mujeres jóvenes. El espasmo es permanente lo que provoca coloración cianótica sostenida de las manos y/o de los pies. Mejora discretamente con el calor y el pulso es siempre palpable. Generalmente no requiere tratamiento y el pronóstico es bueno, ya que nunca ocasiona complicaciones isquémicas.
C) Livedo reticularis
Más frecuente que la acrocianosis. Coloración de la piel cianótica y adopta una disposición en forma de malla. Afecta a manos, los pies, los brazos y en algunos casos, el tronco y las nalgas. Se acentúa con el frío, pero está siempre presente prácticamente en todo momento. Puede ser primaria o en relación con numerosos procesos (secundaria), como: lupus eritematoso, poliarteritis nodosa, síndromes de hiperviscosidad, émbolos de colesterol, crioglobulinemias, síndrome de Cushing y por efecto de calor local (brasero). Rara vez se producen lesiones o úlceras isquémicas y no requiere tratamiento.
Los pacientes con cualquiera de los síntomas de este grupo, que presente dolor rebelde a otras terapias, lesiones necróticas o incapacidad funcional con importante repercusión en la calidad de vida.
ENFERMEDAD DE BUERGER O TROMBOANGEITIS OBLITERANTE (47,48)
Pacientes afectos de tromboangeitis obliterante y que habiendo dejado de fumar, presentan dolor rebelde a otro tipo de tratamientos, lesiones necróticas o incapacidad funcional con importante repercusión en su calidad de vida.
DOLOR NEUROPÁTICO
Como ya se ha mencionado el componente neuropático en el dolor isquémico vascular aparece fisiopatológicamente dentro del conjunto de los complejos mecanismos implicados en la génesis del dolor.
Los mejores resultados se obtienen en las enfermedades con una base vascular como el síndrome de dolor regional complejo tipo I (SDRC-I) y tipo II (SDRC-II); en lesiones radiculares y en el Síndrome de cirugía fallida lumbar (SCFL-FBSS). (49).
El empleo de la EEM en el dolor neuropático, a pesar de no ser tan eficaz como en el dolor de origen vascular, ha de considerarse su utilización dados sus condicionantes de nula mortalidad, baja morbilidad y absoluta reversibilidad de la técnica dada la posibilidad del empleo de la técnica en fase de prueba con un generador externo.
SÍNDROME DE DOLOR REGIONAL COMPLEJO TIPO I (SDRC-I) (50)
La fisiopatología del SDRC continua siendo hoy en día mal definida y comprendida. La teoría de que una de sus causas es la disfunción del sistema nervioso simpático continúa siendo objeto de controversia, así como la posibilidad de que un componente inflamatorio periférico podría jugar un papel en los mecanismos fisiopatológicos. Otros condicionantes involucrados han sido algunos condicionantes médicos como la neuropatía diabética, esclerosis múltiple, infarto de miocardio o infiltraciones tumorales de plexos nerviosos (51).
A lo largo de los últimos años, se ha empleado la EEM en este tipo de patología, incluso en estadíos avanzados de la enfermedad con resultados más que prometedores, mostrándose como una técnica muy efectiva (52).
En la experiencia de algunos autores como Pallarés (30), presenta la EEM como una alternativa muy útil en cuanto a la obtención de analgesia hasta en un 83% de los pacientes tratados a pesar de encontrarse éstos en fases muy evolucionadas y sometidos a bloqueos simpáticos con anterioridad.
La mejoría clínica en general aparece de manera inmediata, a las 24-48 horas del inicio de la estimulación, y cuando su efecto no es permanente, se mantiene dicho beneficio durante períodos de tiempo mucho más prolongados que los conseguidos por los bloqueos simpáticos regionales y la simpatectomía quirúrgica aunque no tenga un efecto curativo radical en muchas ocasiones (53).
DOLOR ANGINOSO INTRATABLE
La angina refractaria viene definida como el cuadro clínico de dolor severo y prácticamente invalidante que no se controla con la máxima alternativa farmacológica tolerada y el buen cumplimiento del mismo, en pacientes con un tipo de patologías no corregibles desde el punto de vista de la reperfusión miocárdica bien por cirugía o bien por angioplastia (54-56).
La angina de pecho intratable, dentro del dolor de origen coronario no susceptible de tratamiento, es una de las patologías que más se beneficia de los resultados de la EEM en cuanto al alivio del dolor.
El tratamiento de la angina de pecho mediante técnicas de neuroestimulación fue inicialmente estudiado por distintos grupos. Las técnicas de electroestimulación para el tratamiento de la angina de pecho fueron empleadas por Mannheimer, de Sandric, de Murphy y Dermot en sus distintos grupos de estudio, y posteriormente fueron publicados por el grupo de Mannheimer los primeros resultados en 1.982 utilizando la técnica de estimulación transcutánea (TENS). Desde entonces, diferentes autores como el ya mencionado Mannheimer, Melero o Augustinsson, entre otros, han publicado múltiples trabajos experimentales y clínicos dedicados específicamente al tratamiento del dolor de índole anginosa con alentadores resultados a lo largo de los últimos quince años durante los cuales se han multiplicado las aportaciones científicas en cuanto a la eficacia y seguridad de esta técnica como tratamiento alternativo de la angina refractaria (57-60).
DISFUNCIONES MOTORAS (30,61,62)
En la Esclerosis múltiple cuando existe una paraparesia espástica y trastornos vesicales con dolor. En Lesiones medulares postraumáticas que presentan alteraciones motoras similares a enfermedades degenerativas. En la parálisis cerebral: La atetosis es el primer síntoma que se debe disminuir, así como la distonía y la tortícolis y la tortícolis espasmódica.
LESIONES POR FRÍO Y CONGELACIÓN DE EXTREMIDADES
Las lesiones por exposición al frío son tan frecuentes como poco conocidas en su tratamiento y prevención. En ocasiones incluso y por no concederles la importancia merecida llegan a tener consecuencias irreversibles por necrosis de los tejidos; el abanico de lesiones y gravedad de las mismas se extiende desde la simple expresión de se me ha quedado helada la nariz al salir a la calle..., hasta la amputación de un dedo del pié por congelación de la extremidad en un homeless o vagabundo... escenas estas nada ajenas a los primeros días de la época invernal.
La severidad de este tipo de lesiones relacionadas con las bajas temperaturas depende de múltiples factores: las condiciones ambientales, la duración de la exposición, el número y calidad de las ropas con las que se protege el individuo y el estado de salud general de éste. Así mismo y de forma general podemos hablar de patología por exposición al frío según las lesiones se acompañen o no de congelación.
Lesiones sin congelación: Respecto a las lesiones sin congelación por exposición breve al frío y por tanto sin resultado de daño serio para los tejidos, todos hemos oído hablar en alguna ocasión del célebre pié de trinchera descrito con ocasión de los conflictos bélicos, típica de los soldados que en condiciones de bajas temperaturas y alta humedad refieren unas lesiones dolorosas en los dedos de sus pies, seguidos de palidez cutánea y adormecimiento que son reversibles con medidas básicas de recalentamiento de la extremidad.
Del mismo estilo y poca severidad lesional son las típicas lesiones presentadas en los sujetos con una breve exposición al frío pero de forma repetida tipificadas como eritema pernio o sabañón vulgar, que constituye una lesión dermatológica primaria típica de los escaladores o montañeros y de los habitantes de ciudades no muy acostumbrados al frío y por tanto no preparados para evitar su aparición (digamos con poca cultura de prevención para la hipotermia y sus lesiones), generalmente acontece en la cara (lóbulo de la oreja), dorso de las manos y zonas descubiertas de las piernas... donde aparecen unas lesiones o placas enrojecidas, inicialmente pruriginosas y posteriormente dolorosas, que incluso tras exposiciones repetidas y sin la adecuada prevención pueden progresar a lesiones ulcerativas de difícil cicatrización.
Lesiones con presencia de congelación: En cuanto a las lesiones con presencia de congelación podemos comentar que se tratan ya de lesiones importantes donde la formación de cristales de hielo intracelulares da lugar a mala oxigenación en los tejidos y subsiguiente necrosis de distinta severidad según el grado de afectación: hablamos entonces del término quemadura por exposición al frío, que al igual que las quemaduras térmicas se pueden clasificar en distintos grados según la profundidad de piel involucrada.
Quemadura por exposición al frío: Lesión de primer grado: se caracteriza por la aparición de enrojecimiento cutáneo y mínimo edema en la extremidad afectada, con sensación de prurito moderado. Lesión de segundo grado: son visibles claramente la presencia de vesículas (ampollas) sobre una piel con aumento en su coloración inicial y posterior palidez, mayor grado de edematización y cierto grado de necrosis de las capas mas superficiales de la piel. Son lesiones muy dolorosas. Lesión de tercer grado: hay necrosis cutánea con exudación y desvitalización de tejidos, son ya indoloras debido a que el grado de destrucción tisular abarca también a las terminaciones nerviosas sensoriales y el pronóstico de la lesión es infausto. Para evitar llegar a un grado lesional importante, podemos seguir unos consejos básicos de manejo en las lesiones por exposición al frío y que suponen:
Consejos básicos de manejo:
1) Prevención de lesiones ante bajas temperaturas: permanecer bien abrigados, proteger del frío las partes del cuerpo expuestas habitualmente (cara y nariz, manos y pies), evitar largas exposiciones al aire libre.
2) Retirar de inmediato ropas húmedas y ajustadas para permitir la recuperación de temperatura y la buena circulación sanguínea por la extremidad afectada.
3) Si las lesiones son más importantes y extensas y ya en un ambiente cálido, comenzar proceso de recalentamiento progresivo aplicando mantas en zonas dañadas y administrar líquidos calientes por vía oral.
4) De no ser suficiente con las medidas previas, se puede practicar la inmersión de la extremidad afecta en agua templada o caliente durante 20-30 minutos, evitando en este tipo de lesiones ya importantes la aplicación de masajes o calor seco... que podrían empeorar el cuadro.
5) En caso de presentar quemaduras por frío de segundo o tercer grado, la consulta médica es obligada para evaluar la profundidad de las lesiones, el tratamiento analgésico y del edema presente, así como las curas locales posteriores que determinarán la favorable evolución de las lesiones.
En Zaragoza, el Dr. Arregui y cois, han establecido el Centro Nacional de referencia para el tratamiento de lesiones extremas por congelación en alpinistas mediante EEM presentando es ese tipo de trastornos muy buenos resultados desde que instauraron la técnica en 1.987 (63,64).
Bibliografía
28. Horsch S, Schulte S, Hess S. Spinal cord stimulation in the treatment of peripheral vascular disease: results of a single-center study of 258 patients, Angiology 2.004; 55: 111-118. [ Links ]
29. Galley D, Rettori R, Boccalon H, Med vedowsky A, Lefebvre JM. Sellier F, Chauvreau C, Serise JM, Pieronne A. Electric stimulation of the spinal cord in arterial disease of the legs. A multicenter study of 244 patients. J Vasc 1992; 17 (3): 208-13. [ Links ]
30. Pallarés JJ. Indicaciones y evidencias clínicas en la aplicación terapéutica de la estimulación eléctrica medular. Rev Soc Esp Dolor 2.003; 10 (SI): 86-102. [ Links ]
31. Broseta J, Barberá J, De Vera JA, Barcia JL, García-March C, González-Darder J, et al. Spinal cord stimulation in peripheral arterial disorders. Cooperative Study J Neurosurg 1.986; 64: 71-80. [ Links ]
32. Boccalon H. Vascular exploration tests. Importance for the indicactions and monitoring of epidural medullary neurostimulation. J Vasc 1992; 17 (2): 131-7. [ Links ]
33. Jivegard LE, Augustinsson LE, Holm J, risberg B, Ortenwall P. Effects of spinal cord stimulation (SCS) in patients with inoperable severe lower limb ischaemia: a prospective randomised controlled study. Eur J Vasc Endovasc Surg 1.995; 9 (4): 421-5 (Coment in: 1.996; 12 (4): 512-3). [ Links ]
34. Costantini A. Spinal cord stimulation; Minerva Anestesiol 2.005; 71: 471-474. [ Links ]
35. DePalma RG, Emsellem HA, Edwards CM, Druy EM, Shultz SW, Miller HC, Bergsrud D. A screening sequence for vasculogenic impotence. J Vasc Surg 1987; 5 (2): 228-36. [ Links ]
36. Claeys LG, Matamoros R. Spinal cord stimulation in critical limb ischemia. Acta Chir Belg 2001; 101 (2): 84-5. [ Links ]
37. Leng GC, Davis M, Baker D. Bypass surgery for chronic lorwe limb ischaemia. Cocchrane Datábase Syst Rev 2.000; 3: CD002000. [ Links ]
38. Petrakis IE, Sciacca V Spinal cord stimulation in critical limb ischemia of the lower extremities: our experience. J Neurosurg Sci. 1.999; 43 (4): 285-93. [ Links ]
39. Spincemaille GH, de Vet HC, Ubbink DT, Jacobs MJ. The results of spinal cord stimulation in critical limb ischaemia: a rewiew. Eur J Vasc surg 2001; 21 (2): 99-105. [ Links ]
40. Spincemaille GH, Klomp HM, Steyerberg EW, Habbema JD. Pain and quality of life in patients with critical limb ischaemia: results of a randomissed controlled multicenter study on the effect of spinal cord stimulation. ESES study group. Eur J Pain 2.000; 4 (2): 173-84. [ Links ]
41. Petrakis IE, Sciacca V. Epidural spinal cord electrical stimulation in diabetic critical lower limb ischemia. J Diabetes Conmplications 1.999; 13 (5-6): 293-9. [ Links ]
42. Neuhauser B, Perkmann R, Klingler PJ, Giacomuzzi S, Kofler A, Fraedrich G. Clinical and objective data on spinal cord stimulation for the treatment of severe Raynaud's phenomenon. [ Links ]
43. Lepantalo M, Rosenberg P, Pohjola J, Augustinsson LE. Holm J. Epidural spinal cord stimulation in the treatment of limb threatening vasospasmreport of a case wifh a five year follow-up. Eur J Vasc Endovasc Surg 1996; 11 (3): 368-70. [ Links ]
44. Ting JC, Fukshansky M, Burton AW. Treatment of refractory oschemic pain from chemofherapy-induced Raynaud's syndrome wifh spinal cord stimulation. Pain Pract 2.007; 7: 143-146. [ Links ]
45. Benyamin R, Kramer J, Vallejo R. A case of spinal cord stimulation in Raynaud's Phenomenon: can subfhreshold sensory stimulation have an effect? Pain Physician 2.007; 10: 473-478. [ Links ]
46. Sibell DM, Colantonio AJ, Stacey BR. Successfull use of spinal cord stimulation in the treatment of severe Raynaud's disease of the hands. Anesthesiology 2.005; 102: 225-227. [ Links ]
47. Pace AV, Saratzis N, Karokis D, Dalainas D, Kitas GD. Spinal cord Stimulation in Buerguer's disease. Ann Rheum dis 2002. Dec; 61 (12): 1114. [ Links ]
48. Chierichetti F, Mambrini S, Bagliani A, Odero A. Treatment of Buerguer's disease with electrical spinal cord stimulation -review of three cases. Angiology 2002; 53 (3): 341-7 [ Links ]
49. Freiré E y Camba MA. Dolor neuropático en cirugía fallida de espalda. En: Gálvez R y cois. Abordaje actual del dolor neuropático. Madrid, ed Master Line & Prodigio Ia ed. 2.003; pps 333-362. [ Links ]
50. Ahmed SU. Complex regional pain syndrome typi I after myocardial infarction treated with spinal cord stimulation. Reg anesth Pain Med 2003; 28 (3): 245-7. [ Links ]
51. Kelmer MA, Baendse GAM, Van Kleef M, de Vet HCW, Rijks CPM et al. Spinal cord stimulation in patients with chronic reflex sympathetic dystrophy. N Engl J Med 2.000; 343: 618-24. [ Links ]
52. Bennet DS, Aló KM, Oakley J, Feler CA. Spinal cord stimulation for complex regional pain síndrome I (RSD): a retrospective multicenter experience from 1995 to 1998 of 101 patients. Neuromodulation 1999; 2, 3: 202-10 [ Links ]
53. Vázquez ML, Pallarés JJ, Canos MA. Distrofia simpático refleja. Enfoque general del tratamiento del dolor neuropático. En: Torres LM, Elorza J, Gómez-Sancho M, et al. Eds. Medicina del Dolor. Barcelona: Masson, 1.997; pps: 281-92. [ Links ]
54. Shinonaga M, Takanashi Y. Vasodilating effect of spinal cord stimulation for cerebral vasospasm. Acta Neurochir Suppl 2001; 77: 229-30 [ Links ]
55. Mesa JE, Yakovlev AE. Treatment of intractable angina pectoris utilizing spinal cord stimulation. Rev Cardiovasc Med 2.008; 9: 70-74. [ Links ]
56. Parker JO. Angina pectoris: a review of current and emerging therapies. Am J Manag Care 2.004; 10 (11 Suppl): S 332-338. [ Links ]
57. Mannheiner C, Augustinsson LE, Carlsson CA, Manhen K, Wilhelmsson C. Epidural spinal electrical stimulation in severe angina pectoris. Br Heart J. 1988; 59: 56-61. [ Links ]
58. Melero A, Martínez R, de Teresa E, Reig E, Artaza M. Estimulación medular epidural en el control del dolor en pacientes con angina refractaria e incapacitante. Medicina Geriátrica 1988; 1: 241-51. [ Links ]
59. García Molí M, Serra R, García-Moll X. Tratamiento de la angina refractaria con electroestimulación medular. Resultados del seguimiento a largo plazo. Rev Esp Cardiolog 2.000; 53: 321-6. [ Links ]
60. Augustinsson LE, Linderoth B, Mannheimer C, Eliasson T. Spinal cord stimulation in cardiovascular disease. Neurosurg Clin N Am. 1995; 6 (1): 157-65. [ Links ]
61. Broseta J, Barberá J, García-March G. Estimulación de la médula cervical a alta frecuencia en el tratamiento de la espasticidad y disquinesias. Cir Esp 1.986; 64: 71-80. [ Links ]
62. Waltz JM, Reynolds LO, Riklan M. Multilead spinal cord stimulation for control of motor disorders. Appl Neurophysiol 1.987; 44: 244-58. [ Links ]
63. Pallarés J. Insuficiencia vascular periférica. En: Rull M, ed Dolor agudo y crónico. Actitudes terapéuticas, Barcelona: Martgraf SA, 1990. p 119-24. [ Links ]
64. Arregui R, Calatayud V, Calatayud J. Neuroestimulación epidural en lesiones por congelación. En: Barberá J, ed. Estimulación eléctrica biológica. Ed Serv. De Public de la Univ. de Cádiz. Cádiz, 1989. p 61-1. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Dr. Enrique Freire Vila
Secretaría del Servicio de Anestesiología,
Reanimación y Tratamiento del Dolor
Hospital Arquitecto Marcide / Prof. Novoa Santos
Área Sanitaria de Ferrol
C/ Estrada San Pedro de Leixa-Catabois, s/n
15.405 Ferrol - (Coruña, La), Spain
Tel.: 981.33.40.00 (Ext): 138-137
Fax: 981.33.40.15
enriquefreire2000@yahoo.es
Financiación: Ninguna
Conflictos de interés: No declarados
Recibido: 11/05/2008
Aceptado: 11/06/2008