Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.17 no.1 Madrid ene./feb. 2010
Toxina botulínica tipo A para el manejo del dolor en pacientes con síndrome de dolor miofascial crónico
Botulinum toxin type A for the management of pain in patients with chronic myofascial pain
J.C. Torres Huerta, J.R. Hernández Santos, E.M. Ortiz Ramírez y S. Tenopala Villegas
Servicio de Anestesiología- Algología, Clínica del Dolor, Centro Médico Nacional 20 de Noviembre, ISSSTE, México DF, México
Dirección para correspondencia
RESUMEN
Introducción: El síndrome de dolor miofascial es uno de los principales problemas de dolor crónico en la práctica clínica, comúnmente asociado a un traumatismo o a microtraumatismos repetitivos. La toxina botulínica tipo A (Botox®) es una alternativa aceptada como opción terapéutica.
Objetivo: Valorar la funcionalidad de las actividades diarias mejorando la intensidad del dolor con el uso de la toxina botulínica tipo A, infiltrada en puntos gatillo, en pacientes con síndrome de dolor miofascial crónico.
Material y métodos: 30 pacientes con síndrome de dolor miofascial crónico con edad entre 25 y 50 años de ambos sexos. A todos se les realizó infiltración de puntos gatillo mediante equipo de electrosonomiografía para la aplicación de toxina botulínica tipo A a una dilución de las 100 Um de toxina en 1 ml de solución salina infiltrando de 200 a 400 Um totales, dependiendo del sitio del dolor.
Se valoró la calidad analgésica mediante la escala visual analógica (EVA) y el índice de funcionalidad con el cuestionario de Oswestry durante 4 semanas.
Resultados: La valoración de la EVA promedio inicial fue de 7,23 y la final de 3,13 (p < 0,01), y el índice de Oswestry promedio inicial de 67,7% y al finalizar el estudio de 35,5% (p < 0,0001).
Conclusiones: La aplicación de toxina botulínica tipo A en pacientes con síndrome de dolor miofascial crónico es efectiva para disminuir la intensidad del dolor, mejorando así su funcionalidad y, por lo tanto, su calidad de vida.
Palabras Clave: Síndrome de dolor miofascial; Toxina botulínica A.
ABSTRACT
Introduction: Myofascial syndrome is one of the main chronic pain syndromes encountered in clinical practice and is commonly associated with trauma or repetitive microtrauma. Botulinum toxin type A (Botox®) is an accepted therapeutic option.
Objective: To evaluate the use of botulinum toxin type A (Botox®), infiltrated in trigger points, as an option in the management of pain in patients with chronic myofascial syndrome.
Material and Methods: Thirty men and women with myofascial pain syndrome, aged between 25 and 50 years were included. In all patients, botulinum toxin type A (Botox®) was infiltrated in trigger points by means of electrosonomyographic equipment. A dilution of 100 Um toxin in 1 cc saline solution was used and a total of 200 to 400 Um was administered depending on the site of the pain.
Analgesic quality was evaluated through a Visual Analog Scale (VAS) and the disability index was evaluated with the Oswestry questionnaire over 4 weeks.
Results: The mean initial VAS score was 7.23 and the mean final score was 3.13 (p < 0.01). The mean initial Oswestry index was 67.7%, decreasing to 35.5% at the end of the study (p < 0.0001).
Conclusions: The application of botulinum toxin type A in patients with postsurgical myofascial syndrome is effective in reducing pain intensity and in improving disability and quality of life.
Key words: Miofascial syndrome; Botulinum toxin type A.
Introducción
El síndrome de dolor miofascial se define como un trastorno osteomuscular que presenta síntomas sensoriales, motores y autonómicos, que son ocasionados principalmente por puntos gatillo (trigger point) musculares activos. Los disturbios sensoriales que se manifiestan son hiperalgesia, disestesia y dolor referido1.
El punto gatillo se define como un punto hiperirritable, entre una banda tensa muscular o en la fascia muscular, el cual es doloroso a la compresión, que puede ser referido y con características de disfunción motora y fenómenos autonómicos (lagrimeo, salivación, cambios en la temperatura de la piel, sudoración, piloerección y trastornos propioceptivos)2.
Hay 2 tipos de puntos gatillo, los activos y los latentes; estos últimos son los más comunes.
El dolor que se relaciona con una contracción muscular excesiva o involuntaria puede estar ocasionado por una gran variedad de condiciones clínicas, algunas de las cuales se asocian a trastornos del movimiento o a padecimientos en donde el dolor y el espasmo muscular son los únicos síntomas, entre los que se encuentran problemas oteomusculares dolorosos, como el síndrome de dolor miofascial, lumbalgias, disfunción temporomandibular y el dolor cervicotorácico3-5.
Además, diversos estudios han sugerido un papel importante en el control de las cefaleas crónicas, como la migraña, la cefalea tensional, la cefalea cervicogénica y la cefalea en racimos6-8.
Hay reportes de la utilización de la toxina botulínica A en algunos síndromes neuropáticos (neuralgia trigeminal, neuralgia postherpética, síndrome doloroso complejo regional tipo I)9-11.
La finalidad del tratamiento debe ser la restauración de la función. La inyección de anestésicos locales o antiinflamatorios esteroideos en los puntos gatillo puede producir un alivio temporal.
Cuando el cuadro doloroso mejora parcialmente con los tratamientos convencionales, se puede considerar la utilización de toxina botulínica tipo A para brindar un beneficio más prolongado, lo cual facilitará la terapia física y, por lo tanto, mejorará la funcionalidad12,13.
Se menciona que un requisito primordial para la utilización racional de la toxina botulínica A en el control del dolor es que el paciente debe tener dolor crónico secundario a un diagnóstico conocido o presumible, para el cual no hay un tratamiento curativo y que éste no ha respondido exitosamente a los diferentes tratamientos antiálgicos conservadores y no invasivos14.
Las neurotoxinas botulínicas son proteínas sintetizadas de la bacteria anaerobia gramnegativa (o grampositiva en cultivos jóvenes) Clostridium botulinum.
Se han identificado 7 neurotoxinas serológicamente distintas: A, B, C, D, E, F, y G, de las cuales 2 están comercialmente disponibles (A y B).
Por lo tanto, el mecanismo clásico de la neurotoxina es la inhibición en la liberación de la acetilcolina de las terminaciones nerviosas periféricas15.
El objetivo de este estudio fue demostrar que el uso de la toxina botulínica tipo A (Botox®) en los pacientes con dolor crónico miofascial en nuestro servicio es efectivo en el alivio del dolor, mejorando la funcionalidad y la calidad de vida en los pacientes.
Material y métodos
El estudio fue aprobado por el Comité de Ética del Centro Médico Nacional 20 de Noviembre ISSSTE y todos los pacientes admitidos firmaron la hoja de consentimiento informado.
El diseño del estudio fue de tipo prospectivo, descriptivo, longitudinal y aleatorio.
Se estudió a un total de 30 pacientes de ambos sexos, que acudieron a la consulta externa del servicio de Clínica del Dolor del Centro Médico Nacional 20 de Noviembre del ISSSTE con diagnóstico de síndrome de dolor miofascial crónico cervical o lumbar de 1 año de evolución, clínicamente con presencia de bandas musculares y/o puntos gatillo, con una respuesta parcial al tratamiento con analgésicos no opiáceos y adyuvantes, sin tratamiento intervencionista previo y con edades comprendidas entre 25 y 50 años de edad.
Se localizaron los puntos gatillo cervicales y lumbares mediante la palpación de éstos, y para la realización del procedimiento de infiltración se utilizó un electrosonomiógrafo (ESMG) (Allergan Inc. Irvine California) con una aguja de 27 G × 37 mm (Botox® injection needle Allergan Inc. Irvine, California), inyectándose el complejo de toxina botulínica tipo A a dosis de 10 Um por punto en región cervical y de 40 Um por punto en región lumbar, con una dosis total 200 a 400 Um, respectivamente (100 a 200 Um por lado afectado). La dilución de las 100 Um de toxina botulínica tipo A se hizo con un volumen de 1 ml de solución salina.
A todos los pacientes se les realizó la técnica de infiltración de músculos superficiales y profundos afectados, localizados por la aguja conectada al ESMG, que al estar en el punto gatillo incrementaba la señal acústica indicando el sitio de aplicación de la toxina.
Se valoró la intensidad del dolor a través de la escala visual analógica (EVA; donde 0 = nada de dolor, 10 = el peor dolor), así como el índice de discapacidad de Oswestry16 (porcentaje de discapacidad del 0 al 100%), el cual valora la capacidad del paciente para realizar sus actividades de la vida diaria. Este cuestionario comprende 10 diferentes subtipos de 6 variables cada uno, en donde cada paciente elige la acción más adecuada para su condición, cada variable esta graduada de 0 (normal) a 5 (más afectado), previo a la infiltración y a la 1.a, 2.a, 3.a, y 4.a semanas posteriores al tratamiento.
Para el análisis estadístico se utilizaron la prueba comparativa multifactorial de Tuckey, ANOVA, coeficiente de correlación de Pearson y estadística descriptiva, considerando una p < 0,05 para establecer diferencias estadísticas.
Resultados
Se incluyó a 30 pacientes en el estudio. Las características demográficas relacionadas con el sexo y la edad se muestran en las figuras 1 y 2.

Figura 1 Histograma: distribución por sexo.
El promedio de edad de los pacientes incluidos fue de 35 ± 5 años (fig. 3).

Figura 3 Histograma: distribución por edad.
En lo que respecta al control del dolor, el promedio inicial de la EVA fue de 7,23 y al finalizar el estudio de 3,13, con una p < 0,01, estadísticamente significativa (fig. 4).
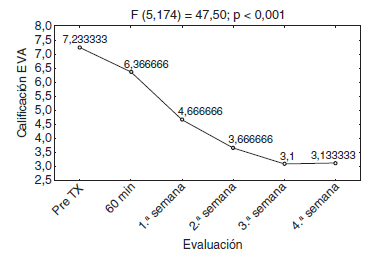
Figura 4 Respuesta promedio de la escala visual analógica (EVA).
Con relación al índice de discapacidad de Oswestry, la evaluación inicial fue del 67,7% y al término del estudio del 35,8%, con una p < 0,0001, estadísticamente significativa (fig. 5).
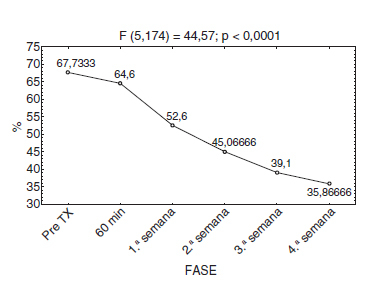
Figura 5 Respuesta promedio del índice de Oswestry.
Cabe mencionar que ningún paciente había recibido tratamiento con toxina botulínica y que la disminución del dolor y la mejoría del índice de discapacidad de Oswestry se presentaron a partir de la primera semana posterior a la infiltración de la neurotoxina; esto se debió al inicio de la acción de ésta. Es importante decir que existe una relación estadísticamente significativa en la disminución del dolor y la capacidad funcional de los pacientes infiltrados con la toxina, tal como muestra la figura 6.
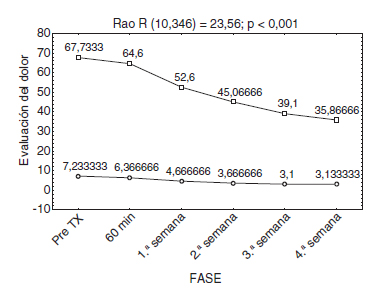
Figura 6 Comparación de la Escala Visual Análoga (EVA) y
el índice de Oswestry.
El 80% de los pacientes (24) tuvo un período de alivio del dolor somático de 6 meses, el 10% (3) de 4 meses y el 10% (3) de 3 meses.
Es importante citar que al término del estudio los pacientes se enviaron al servicio de medicina física y rehabilitación como parte de la terapia interdisciplinaria.
Únicamente se reportó como complicación dolor en el sitio de infiltración posterior al procedimiento en 30 pacientes (100%).
Discusión
El dolor miofascial es una causa importante de incomodidad en los pacientes con sintomatología dolorosa regional. La prevalencia de dolor miofascial es de aproximadamente el 20% en los pacientes con dolor lumbar crónico, en un 30% de la población que acude a la consulta de primer nivel y superior al 85% en las clínicas del dolor17-19.
Se menciona que hay diversas limitaciones inherentes en el tratamiento farmacológico del dolor miofascial. En primer lugar, éste representa un grupo heterogéneo de trastornos, los cuales tienen su propia fisiopatología; en segundo lugar, hay diferentes mecanismos de nocicepción en estos grupos, y, por último, porque las causas de dolor miofascial son tan amplias como lo son los tratamientos a utilizar.
Es importante considerar que el tratamiento del dolor miofascial debe ser multimodal y multidisciplinario, considerando utilizar tanto métodos no intervencionistas como intervencionistas, como la retroalimentación biológica, el entrenamiento en relajación, la acupuntura y las inyecciones de puntos gatillo20.
Childers21 refiere que el uso de la toxina botulínica en el síndrome miofascial se puede considerar cuando los pacientes no responden a los tratamientos conservadores.
En nuestro estudio hubo una mayor incidencia de dolor miofascial en el sexo femenino (63,3%) en relación con el masculino (36,6%), datos compatibles con los de otros estudios realizados22.
La disminución de la intensidad del dolor valorada de acuerdo a la EVA fue de 7,2 a 3,1 (p < 0,05), la cual se sostuvo durante todo el estudio. Estos resultados fueron similares a los reportados por Foster et al23, De Andrés et al22 y Cheshire24.
Igualmente que en otros estudios realizados22, también se decidió utilizar el cuestionario de Oswestry, el cual ha demostrado ser de gran valor para la evaluación de la discapacidad en el paciente postoperado de columna, así como un factor predictivo en el aspecto laboral25. La escala demostró una disminución estadísticamente significativa, p < 0,05, durante el estudio con los valores de 67,7 a 35,8%.
Comparando ambas escalas (EVA y Oswestry), se observó que a menor dolor menor discapacidad, con esto el resultado se traduce en una mejor calidad de vida de los pacientes y un desarrollo mejor de sus actividades diarias.
Es importante mencionar que se utilizaron volúmenes bajos (100 Um de toxina botulínica A en 1 ml de solución salina) para disminuir el posible riesgo de difusión del medicamento a otros grupos musculares y evitar complicaciones.
Es importante mencionar que otros estudios realizados22, en los que se utilizaron volúmenes mayores, no reportan complicaciones severas, lo que nos habla de un perfil de seguridad importante del medicamento.
También sugerimos la utilización de un equipo de ESMG para la localización del punto gatillo y que se logre una infiltración adecuada y segura de la neurotoxina a volúmenes bajos.
Es importante señalar que la mayoría de los problemas en donde se ha producido control del dolor con la toxina botulínica son padecimientos que producen espasmo muscular importante, aminorándolo debido a su efecto relajante. Dicho efecto produce disminución en la compresión de los vasos sanguíneos por el espasmo, mejorando la isquemia local muscular. Otro posible mecanismo es la activación de nociceptores aferentes, ocasionada por la compresión de un nervio, que al liberarse puede aliviar el dolor. Por último, se menciona que al reducir el espasmo muscular los efectos sobre los husos musculares aferentes (Ias aferentes) mejoran26-28.
Sin embargo, hay datos que sugieren que no sólo la disminución del espasmo muscular explica el alivio del dolor, por ejemplo los trastornos ostemusculares como las distonías, en los cuales el efecto analgésico es en ocasiones más importante que el efecto motor, lo que sugiere una actividad analgésica directa que puede justificar el control de éste en síndromes en los cuales no hay espasmo muscular.
Diversos estudios han demostrado in vitro que hay una disminución en la liberación de neuropéptidos en neuronas del ganglio dorsal en ratas o en músculos del iris de conejo, o sobre los vasos sanguíneos, inhibiendo un cotransmisor de acetilcolina. También se ha discutido que la toxina botulínica A puede actuar en el cordón espinal29-33.
La toxina botulínica A puede reducir la inflamación neurogénica mediante la inhibición de la liberación de neuropéptidos, como la sustancia P y el péptido relacionado con el gen de calcitonina y, por tanto, aliviar el dolor.
Esta reducción en la liberación de neuropéptidos de los nociceptores aferentes primarios mediante la neurotoxina A puede también quitar el entumecimiento y el dolor en condiciones en donde el tejido dañado altera la sensibilidad34.
Esto podría explicar la mejoría del dolor con la administración de la neurotoxina en las cefaleas, incluyendo la migraña.
Varios estudios han evidenciado la inhibición del dolor por proceso inflamatorio con la utilización de toxina botulínica tipo A mediante modelos en ratas induciendo este tipo de dolor con formalina. Los resultados suponen que hay un efecto antinociceptivo mediante la inhibición en la liberación de neuropéptidos de las terminaciones aferentes primarias, así como disminución en la liberación de glutamato.
Por lo tanto, se propone que la neurotoxina A puede bloquear la sensibilización periférica e indirectamente reducir la sensibilización central35,36.
Cabe mencionar que la regulación mediante mediadores inflamatorios en la superficie de los receptores de expresión y de los canales en las terminales de neuronas aferentes nociceptivas puede ser un mecanismo para el desarrollo y el mantenimiento de la hiperalgesia inflamatoria. Se estimularon neuronas del ganglio de la raíz dorsal in vitro, lo que resultó en una expresión aumentada de los receptores vaniloides tipo 1 (TRPV1) en la superficie neuronal y que este incremento de la expresión de los TRPV1 se bloqueó por la toxina botulínica A. Esto puede representar otro mecanismo por el cual la neurotoxina reduciría el dolor inflamatorio, principalmente el desarrollo de la hiperalgesia37.
Conclusiones
Por lo tanto, podemos resumir que el dolor es un fenómeno complejo y que tiene muchos componentes que se deben atender.
Aunque la toxina botulínica A no se considera como un tratamiento de primera elección para el manejo de dolor miofascial crónico, puede ser una opción terapéutica en los casos en que éste es refractario. Además, consideramos de suma importancia iniciar la terapia física en los pacientes a la segunda semana posterior a la infiltración de la neurotoxina, para obtener un mejor alivio de su dolor.
Recientes avances en el entendimiento de la estructura de la neurotoxina y su función han presentado la oportunidad de modificar la molécula para producir nuevas estructuras moleculares que sean capaces de inhibir la función nociceptiva aferente sin efectos sobre otras neuronas, incluyendo las motoras38.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Lavelle ED, Lavelle W, Smith HS. Myofascial trigger points. Anesthesiol Clin N Am. 2007;25:841-51. [ Links ]
2. Travell JG, Simons DG. Myofascial pain and dysfunction: the trigger point manual. Baltimore (MD): Williams and Wilkins; 1983. [ Links ]
3. Royal M. Botulinum toxins in pain management. Phys Med Rehabil Clin N Am. 2003;14:805-20. [ Links ]
4. Lang AM. A pilot study of botulinum toxin type A (Botox®), administered using a novel injection technique, for the treatment of miofascial pain. Am J Pain Manage. 2000;10:108-12. [ Links ]
5. Jabbari B, Difazio M, Ney J. Treatment of refractory low back pain with botulinum toxin A: a prospective 14-month study. Am Acad Pain Med. 2005;47:107. [ Links ]
6. Argoff CE. The use of botulinum toxins for chronic pain and headaches. Curr Treat Options Neurol. 2003;5:483-92. [ Links ]
7. Silberstein SD. Review of botulinum toxin type A and its clinical application in migraine headaches. Expert Opin Pharmacother. 2001;2:1649-54. [ Links ]
8. Durham PL, Cady R, Cady R. Regulation of calcitonin gene-related peptide secretion from trigeminal nerve cells by botulinum toxin type A: implications for migraine therapy. Headache. 2004;44:35-42. [ Links ]
9. Argoff CE. A focused review on the use of botulinum toxins for neuropathic pain. Clin J Pain. 2002;18 Suppl 6:S177-81. [ Links ]
10. Piovesan EJ. An open study of botulinum-A toxin treatment of trigeminal neuralgia. Neurology. 2005;65:1306-8. [ Links ]
11. Sindrup SH, Jensen TS. Pharmacotherapy of trigeminal neuralgia. Clin J Pain. 2002;18:22-7. [ Links ]
12. Stephen S. Botulinum neurotoxins: origins and basic mechanisms of action. Pain Practice. 2004;4:S19-26. [ Links ]
13. Humeau Y, Doussau F, Grant NJ, Poulain B. How botulinum and tetanus neurotoxins block neurotransmitter release. Biochimie. 2000;82:427-66. [ Links ]
14. Raj PP. Botulinum toxin therapy in pain management. Anesthesiol Clin North Am. 2003;21:715-31. [ Links ]
15. Schantz EJ, Johnson EA. Properties and use of botulinum toxin and other microbial neurotoxin in medicine. Microbiol Rev. 1992;56:80-99. [ Links ]
16. Fairbank J, Couper J, Davies JB. The Oswestry low back pain questionnaire physiotherapy. Spine. 1980;66:271-3. [ Links ]
17. Long DM, BenDebba M, Torgerson WS, Dawson EG, Hardy RW, Robertson JT, et al. Persistent back pain and sciatica in the United States: patient characteristics. J Spinal Disord. 1996;9:40-58. [ Links ]
18. Skootsky SA, Jaeger B, Oye RK. Prevalence of myofascial pain in general internal medicine practice. West J Med. 1989;151: 157-60. [ Links ]
19. Gerwin RD. Classification, epidemiology, and natural history of myofascial pain syndrome. Curr Pain Headache Rep. 2001;5:412-20. [ Links ]
20. CohenSP, Mullings R, Abdi S. The pharmacologic treatment of muscle pain. Anesthesiology. 2004;101:495-526. [ Links ]
21. Childers MK, Wilson DJ, Gnatz SM. Botulinum toxin type A use in piriformis muscle syndrome: a pilot study. Am J Phys Med Rehabil. 2002;81:751-9. [ Links ]
22. De Andrés J, Cerda-Olmedo G, Valía JC, Monsalve V, López-Alarcón, Mínguez A. Use of botulinum toxin in the treatment of chronic myofsacial pain. Clin J Pain. 2003;19:269-75. [ Links ]
23. Foster L, Clapp L, Erickson M. Botulinum toxin A and chronic low back pain. Neurology. 2001;56:1290-3. [ Links ]
24. Cheshire WP. Disorders of sweating. Semin Neurol. 2003;23:399-406. [ Links ]
25. Donceel P, Du Bois M. Predictors for work incapacity continuing after disc surgery. Scand J Work Environ Health. 1999;25:264-71. [ Links ]
26. Arezzo JC. Possible mechanisms for the effects of botulinum toxin on pain. Clin J Pain. 2002;18:125-32. [ Links ]
27. Filippi GM, Errico P, Santarelli R, Bagolini B, Manni E. Botulinum A toxin effects on rat jaw muscle spindles. Acta Otolaryngol. 1993;113:400-4. [ Links ]
28. Porta M, Perretti A, Gamba M, Luccarelli G, Fornari M. The rationale and results of treating muscle spams and myofascial syndromes with botulinum toxin type A. Pain Digest. 1998;8:346-52. [ Links ]
29. Purkiss J, Welch M, Doward S, Foster K. Capsaicin-stimulated release of substance P from cultured dorsal root ganglion neurons: involvement of two distinct mechanisms. Biochem Pharmacol. 2000;59:1403-6. [ Links ]
30. Ishikawa H, Mitsui Y, Yoshitomi T. Presynaptic effects of botulinum toxin type a on the neuronally evoked response of albino and pigmented rabbit iris sphincter and dilator muscles. Jpn J Ophthalmol. 2001;45:550-1. [ Links ]
31. Morris JL, Jobling P, Gibbins IL. Differential inhibition by botulinum neurotoxin A of cotransmitters released from autonomic vasodilator neurons. Am J Physiol Heart Circ Physiol. 2001;281:2124-32. [ Links ]
32. Guyer BM. Mechanism of botulinum toxin in the relief of chronic pain. Curr Rev Pain. 1999;3:427-31. [ Links ]
33. Cui M, Li Z, You S, Khanijou S, Aoki KR. Mechanisms of the antinociceptive effect of subcutaneous Botox®: inhibition of peripheral and central nociceptive processing. Naunyn Schmiedebergs Arch Pharmacol. 2002;365 Suppl 2:17. [ Links ]
34. Aoki KR. Pharmacology and immunology of botulinum toxin serotypes. J Neurol. 2001;248:3-10. [ Links ]
35. Aoki KR. Evidence for antinociceptive activity of botulinum toxin type A in pain management. Headache. 2003;43:S9-15. [ Links ]
36. Cui M. Subcutaneous administration of botulinum toxin A reduces formalin-induced pain. Pain. 2004;107:125-33. [ Links ]
37. Morenilla-Palao C. Regulated exocytosis contributes to protein kinase C potentiation of vanilloid receptor activity. J Biol Chem. 2004;279:25665-72. [ Links ]
38. Foster KA. A new wrinkle on pain relief:re-engineering clostridial neurotoxins for analgesics. Drugs Discovery Today. 2005;10: 563-9. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Correo electrónico: semili@avantel.net,
aneshams@hotmail.com
(J.C. Torres Huerta).
Recibido el 7 de abril de 2009;
Aceptado el 21 de septiembre de 2009















