Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.18 no.5 Madrid sep./oct. 2011
Tapentadol retard en el dolor crónico intenso
Tapentadol retard for severe chronic pain
L. M. Torres Morera
Servicio de Anestesia, Reanimación y Terapia del Dolor. Hospital Puerta del Mar. Cádiz
Financiación: Ninguna
Conflicto de intereses: No declarados
Dirección para correspondencia
ABSTRACT
Since the first orally administered morphine was introduced in Spain back in 1988 the bioavailability of potent opioid drugs to be administered via a route other than the intravenous one has increasingly evolved. Formulations allowing these drugs to be absorbed via the skin or oral mucosa have made a major difference in the administration of analgesic medication. Later still, novel immediate-release or controlled-release forms have finished off the positive efficacy and safety profile of these new opioid drugs.
Tapentadol retard is a latest-generation, central-acting pain killer that was approved by the EMA (European Medicines Agency) in 2010 and recently by Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) for the treatment of severe chronic pain. The synergy between its two mechanisms of action - μ-opioid agonism and noradrenaline uptake inhibition -- allows approaching pain from two different physiological aspects. Tapentadol retard is rapidly absorbed following oral administration, and excreted almost exclusively by the kidneys. While the analgesic efficacy of other opioids, including codeine and tramadol, depend upon their metabolic actions, the analgesia resulting from tapentadol administration derives from its primary molecule's action, with no active metabolites involved.
The papers analyzed in this review show the efficacy of tapentadol retard in the management of moderate to severe pain in patients with chronic low-back pain, chronic knee or hip osteoarthritis, and diabetic neuropathy. Regarding safety, this drug has a superior tolerability profile when compared to current opioid analgesics, which confers a significant potential for the treatment of pain resulting from chronic conditions.
This literature review analyzes tapentadol retard's mechanism of action, pharmacokinetics, pharmacodynamics, efficacy, and safety, as well as its exchangeability for opioid pain killers.
Key words: Tapentadol. Chronic pain. Opioid.
RESUMEN
Desde la introducción en España de la primera morfina de administración oral, en el año 1988, se ha ido evolucionando en la biodisponibilidad de fármacos opioides potentes no administrados por vía endovenosa. Las formulaciones que permiten la absorción de estos fármacos por la piel o por la mucosa oral han supuesto un antes y un después en la administración de medicación analgésica. Posteriormente, las nuevas formas de liberación inmediata o liberación controlada han acabado de perfilar la seguridad y eficacia de estos nuevos fármacos opioides.
Tapentadol retard es un fármaco analgésico de acción central de última generación, aprobado tanto por la EMA ("European Medicines Agency") en 2010 como recientemente por la Agencia Española de Medicamentos y Productos Sanitarios ("AEMPS") para el tratamiento del dolor crónico intenso. La sinergia de sus dos mecanismos de acción, el agonismo μ-opioide y la inhibición de la recaptación de noradrenalina permite abordar el dolor desde diferentes mecanismos fisiológicos. Tapentadol retard se absorbe rápidamente tras su administración oral y es excretado casi exclusivamente vía renal. Así como la eficacia analgésica de otros opioides, como codeína y tramadol dependen de su actividad metabólica, la analgesia producida por tapentadol se debe a la acción de la molécula principal, sin metabolitos farmacológicamente activos.
Los trabajos analizados en esta revisión demuestran la eficacia de tapentadol retard en el tratamiento del dolor de moderado a intenso en pacientes con dolor lumbar crónico, dolor crónico por artrosis de rodilla o cadera y también en pacientes con dolor por neuropatía diabética. En aspectos de seguridad, este fármaco presenta un perfil de tolerabilidad superior al de los analgésicos opioides actuales, lo cual le confiere un potencial importante en el tratamiento de dolor por procesos crónicos.
En esta revisión bibliográfica se hace análisis del mecanismo de acción de tapentadol retard, de su farmacocinética y farmacodinamia, eficacia y seguridad y de su intercambiabilidad respecto a analgésicos opioides.
Palabras clave: Tapentadol. Dolor Crónico. Opioides.
Introducción e historia
En el año 1988 se introdujo en el vademécum español la primera morfina de administración oral, en forma de comprimidos orales de liberación retardada, formalizando la disponibilidad de fármacos opioides potentes para su administración oral. Seguidamente, en 1990, se incorporaron al arsenal farmacológico analgésico los comprimidos de morfina oral de liberación inmediata. A partir de entonces, aparecieron nuevos opioides, como fentanilo y buprenorfina, bien en forma de parches transdérmicos o en forma de aplicador bucal. En junio de 2004, reapareció en el mercado español un fármaco opioide, la oxicodona, que aunque era una sustancia ya conocida en Europa desde 1915, su nueva formulación de liberación controlada retardada incrementaba la biodisponibilidad del principio activo, controlando la seguridad y tolerabilidad del mismo. En Estados Unidos, la formulación de comprimidos de liberación retardada de oxicodona se viene utilizando desde 1996 formando parte del tercer escalón para el dolor moderado-intenso de la Escala de Analgesia de la OMS (1). Si la oxicodona de liberación retardada fue un avance importante en el desarrollo de fármacos analgésicos eficaces y, sobre todo, seguros para el dolor agudo y crónico (2), la aparición de tapentadol, ha supuesto un paso adelante en la obtención de analgésicos de acción central con un perfil de seguridad mejorado, tanto a nivel gastrointestinal como de sistema nervioso central, además de disminuir de forma relevante el grado de dependencia farmacológico (3).
En breve dispondremos en el mercado de la formulación retard de tapentadol. En esta revisión se va a analizar cuáles han sido las líneas de desarrollo de este nuevo fármaco y qué beneficios aporta frente a los analgésicos habitualmente utilizados en el tratamiento del dolor crónico intenso, como oxicodona (4-6).
Farmacología de tapentadol retard
Farmacodinamia
La activación de los receptores opioides μ (MOR) es muy efectiva en la inhibición del dolor nociceptivo agudo. Sin embargo, esta efectividad y/o el margen terapéutico de los agonistas MOR pueden verse limitados en condiciones de dolor neuropático. La inhibición de la recaptación de la noradrenalina (NRI) en los axones terminales de la vía descendente inhibitoria noradrenérgica aumenta la concentración extracelular de noradrenalina a nivel medular, produciendo antinocicepción mediante la activación de los receptores α2 adrenérgicos (7); se conoce que este hecho es particularmente relevante en los estados de dolor crónico, especialmente en el dolor crónico neuropático (8,9). Por tanto, la combinación de dos mecanismos analgésicos diferentes, actuando sobre varias vías de transmisión del dolor, ofrece la oportunidad de aumentar la eficacia analgésica reduciendo los efectos adversos debido al ahorro del efecto μ-opioide (10).
Tapentadol presenta dos mecanismos de acción, el agonismo μ opioide y la inhibición de la recaptación de la noradrenalina, en una sola molécula (11). Tapentadol se une a los receptores μ-opioides selectivamente, de forma moderada (Ki = 0,1 μM, en ratas), en comparación con morfina (Ki = 0,002 μM, en ratas) u oxicodona (Ki = 0,018 μM, en ratas) (11,12). Sin embargo, una afinidad menor de tapentadol por MOR no lleva a una disminución en la eficacia analgésica; la acción analgésica sinérgica de su segundo mecanismo de acción no opioide, contribuye a su efecto analgésico (11,13). De hecho, el efecto analgésico es mayor al esperado de la adición de la analgesia producida por la inhibición de la recaptación de noradrenalina y la analgesia provocada por los efectos agonistas directos sobre los receptores μ-opioides (8,13), demostrado en modelos preclínicos, tanto de dolor agudo nociceptivo como de dolor crónico neuropático (8,12,13). Esta sinergia no aparece en los fármacos agonista μ-opioide puros, como oxicodona (2,14).
Se ha observado además que existe una diferente contribución relativa de cada uno de los mecanismos de acción del fármaco: el componente μ-opioide actúa predominantemente en los efectos antinociceptivos de tapentadol mientras que la inhibición de la recaptación de noradrenalina media predomina en el dolor neuropático (7,15).
Farmacocinética
El principio activo tapentadol se absorbe rápidamente después de la administración oral del mismo. Su biodisponibilidad es baja, del 32% debido a su importante metabolismo de primer paso. Se distribuye ampliamente por todo el organismo y sólo el 20% se encuentra unido a proteínas plasmáticas (8,16,17).
Tapentadol es un enantiómero puro (18) y, a diferencia de otros fármacos opioides como codeína o tramadol (19), sus metabolitos son farmacológicamente inactivos (11,18). Por tanto, los beneficios que se pueden obtener de estas características son claros, la analgesia producida por tapentadol se debe a la acción de la molécula principal, evitando la acción indeseable de enantiómeros que pueden tener influencia en la actividad analgésica y la acción que metabolitos activos pueden presentar en el perfil de tolerabilidad (18). En un resumen, recientemente publicado, se compara la farmacocinética de oxicodona, tramadol y tapentadol, tal y como se recoge en la tabla I (4).
La vía metabólica primaria del principio activo tapentadol es la glucuronidación catalizada por la UDP-glucuronosyltransferasa (UGT): enzimas UGT1A9 y UGT2B7. El metabolito más importante es el O-glucuronido. Pequeñas cantidades del fármaco son N-demetiladas por el citocromo P450 (CYP), isoenzimas 2C9 y 2C19 para formar N-desmetil tapentadol (13%) y oxidadas por la isoenzima CYP2D6 para formar hidroxitapentadol (2%), ambos inactivos (18,20,21).
Tapentadol y sus metabolitos son excretados rápida y completamente (> 95% de la administración en las primeras 24 horas; > 99,9% a los 5 días). La excreción se produce casi exclusivamente por vía renal, con un 70% de la dosis oral excretada por la orina en forma de conjugados (55% como tapentadol O-glucuronido y 15% con conjugados sulfatos), un 27% como otros metabolitos y un 3% como fármaco inalterado. La excreción fecal es inapreciable (1%) (16-18).
Las concentraciones de tapentadol fueron similares entre grupos de pacientes con diferentes grados de función renal (desde normal a alteración grave), pero debido a falta de datos no se recomienda el uso de tapentadol en pacientes con afectación renal grave (16,17). Por otro lado, los pacientes con deterioro hepático leve no requieren ajuste de la dosis, aunque debe procederse con cautela en los casos de afectación hepática moderada; el tratamiento de estos pacientes debe iniciarse con la dosis más baja disponible, esto es, 50 mg de tapentadol retard, y la frecuencia de administración no debe ser mayor de una vez cada 24 horas. Al inicio del tratamiento no se recomienda una dosis diaria superior a 50 mg de tapentadol retard (17). A la espera de estudios que aporten nuevos datos, no se recomienda su utilización en pacientes con afectación hepática severa. En general, no es necesario ajustar la dosis en los pacientes ancianos (17) aunque se recomienda iniciar el tratamiento con dosis bajas (16).
Interacciones farmacológicas y combinaciones de fármacos
Tapentadol tiene un bajo potencial de interacción farmacocinética con otros fármacos debido a la falta de inducción e inhibición por el citocromo P450 (CYP) (22). Las interacciones estudiadas que han analizado tapentadol administrado con paracetamol, naproxeno o ácido acetil salicílico han revelado pocos cambios en la concentración sérica de tapentadol (23). Tampoco se han observado interacciones farmacológicas con omeprazol, metroclopramida o probenecid (24-26).
Ahora bien, el uso de tapentadol está contraindicado en el periodo de 14 días después de finalizar el tratamiento con inhibidores de la monoaminooxidasa (IMAO) y, al igual que otros analgésicos, debe administrarse con precaución en tratamientos con fármacos de acción sobre el sistema nervioso central o con alcohol (27).
A la espera de nuevos estudios con la formulación retard, cabe esperar que tapentadol retard no presente interacciones con otros fármacos, a excepción de las descritas anteriormente.
Eficacia y tolerabilidad de tapentadol retard
La eficacia y la tolerabilidad de tapentadol retard como tratamiento analgésico se ha estudiado en diferentes modelos de dolor: pacientes con dolor por artrosis de rodilla y/o cadera (28,29), pacientes con dolor lumbar crónico (30) y pacientes con dolor por neuropatía diabética (31).
Tapentadol retard comparado con oxicodona y/o placebo
En el análisis conjunto de datos predefinido de los ensayos de fase III, aleatorizados y doble ciego de 15 semanas de tratamiento, en pacientes con dolor crónico por artrosis de rodilla o lumbalgia, se evaluó la eficacia y seguridad de tapentadol de liberación prolongada o retard (TLP) 100-250 mg dos veces al día, en comparación con oxicodona liberación controlada (OLC) 20-50 mg y placebo (32). Se evaluó un total de 2.974 pacientes para el análisis de seguridad (placebo, n = 993; TLP, n = 980; OLC, n = 1.001) y 2.968 pacientes para el análisis de eficacia (placebo, n = 991; TLP, n = 978; OLC, n = 999). Comparado con placebo, el tratamiento con tapentadol u oxicodona mostró reducciones significativas en la intensidad del dolor a las 12 semanas y al final del seguimiento (p < 0,001).
Tapentadol LP se asoció a una incidencia significativamente menor de efectos adversos a nivel gastrointestinal: tapentadol presentó un 43% menos de náuseas, un 61% menos de vómitos y un 49% menos de estreñimiento que oxicodona LC (p < 0,001). La incidencia de efectos adversos a nivel de sistema nervioso fue menor en el grupo tratado con TLP (40,2%) comparado con OLC (46,3%) (Fig. 1).
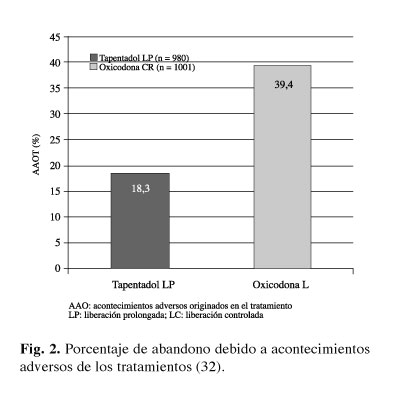
Además una proporción superior de pacientes tratados con oxicodona discontinuaron el tratamiento frente a aquellos tratados con tapentadol (61,7 vs. 43,5%). El abandono del tratamiento debido a efectos adversos del mismo fue del 18,3 % en el grupo de tapentadol y de 39,4 % en el grupo de oxicodona (Fig. 2).
Tapentadol retard en dolor neuropático y otras indicaciones médicas
La neuropatía periférica diabética dolorosa afecta entre el 10-20% de pacientes con diabetes y muchos pacientes deben ser tratados con antidepresivos y anticonvulsivantes (33). A pesar de que algunos opioides han demostrado efectividad comparable a los antidepresivos tricíclicos, gabapentina y pregabalina, en general no se considera su uso en primera línea de tratamiento debido a su baja tolerabilidad (34).
En un ensayo aleatorizado, controlado por placebo, se analizó la eficacia y seguridad de tapentadol de liberación prolongada (TLP) para el manejo del dolor por neuropatía diabética periférica (31). En este estudio se observó una diferencia de TPL vs. placebo, estadística y clínicamente significativa [-1,3, (95% CI, -1,70 a -0,92; p < 0,001)]. Un 60,8 y un 59,8% de los pacientes del grupo TLP (100-250 mg dos veces al día) presentaron una mejoría del 30 y del 50% respectivamente al dolor comparado con el grupo placebo. Los efectos adversos más comunes fueron: náuseas 21,4%, mareos 15,8%, somnolencia 15,1% y estreñimiento 10,7%, de intensidad baja-moderada.
A día de hoy, tapentadol está siendo estudiado en el tratamiento analgésico de otras patologías como dolor por procesos neoplásicos, dolor post-quirúrgico y en dolor provocado por neuralgia post-herpética (35).
Efectos adversos de tapentadol retard
La dualidad del mecanismo de acción de tapentadol y su efecto ahorrador μ-opioide, pueden contribuir a la reducción de los efectos adversos típicos relacionados con los opioides (11), especialmente de los efectos adversos gastrointestinales y a una menor tasa de interrupciones de tratamiento, por tanto, puede producir una mejora de la tolerabilidad y redundar en una mejor adherencia al tratamiento (32).
Como era de esperar en el estudio a largo plazo, a un año de tratamiento, la incidencia de efectos adversos fue ligeramente mayor que en los ensayos clínicos de fase III de 15 semanas de tratamiento. En el análisis de los estudios fase III, los efectos adversos más frecuentes (experimentados por ≥ 5% de los pacientes en cualquier grupo de tratamiento) fueron naúseas, estreñimiento, prurito, diarrea, sequedad de boca, insomnio e hiperhidrosis (36).
Tapentadol retard en pacientes pediátricos
La seguridad y eficacia en pacientes pediátricos menores de 18 años de edad no se han establecido, por lo tanto, no se recomienda el uso de tapentadol, en ninguna de sus formulaciones, en esta población (21).
Embarazo y lactancia
No hay estudios adecuados de tapentadol, en ninguna de sus formulaciones, en mujeres embarazadas. Se considera una droga de clase C con respecto a su uso durante el embarazo (es decir, debe utilizarse durante el embarazo sólo si el beneficio potencial justifica el riesgo potencial para el feto) (4). Tapentadol no está recomendado en mujeres durante el parto ni inmediatamente antes del mismo (17).
Los recién nacidos cuyas madres han estado tomando tapentadol deben ser monitorizados para controlar la depresión respiratoria. No debe usarse durante la lactancia (17).
Precauciones y recomendaciones
Tapentadol es considerado a nivel legal como sustancia controlada por su potencial abuso similar al resto de analgésicos opiáceos. La principal preocupación de su utilización, al igual que con otros fármacos agonistas μ-opioides, es la depresión respiratoria. Por lo tanto, debe utilizarse con precaución en pacientes con insuficiencia respiratoria o cuando su uso se acompaña de hipoxia, hipercapnia, obstrucción de vías respiratorias bajas o disminución de capacidad de ventilación pulmonar (reserva respiratoria) y está contraindicado en pacientes no monitorizados con depresión respiratoria, hipoxia o asma agudo o crónica (17).
Puede inducir espasmos del esfínter de Oddi y debe usarse con cautela en presencia de enfermedad del tracto biliar (17).
Tapentadol está contraindicado en pacientes con historia de íleo paralítico (17).
La experiencia con sobredosis de tapentadol es limitada. La atención inicial debe centrarse en el restablecimiento de la vía aérea y la restitución de ventilación controlada. Los antagonistas opiáceos, como naloxona o nalmefene, son antídotos específicos para la depresión respiratoria causada por sobredosis de opiáceos.
Tapentadol puede ser utilizado con un perfil de abuso similar al de otros agonistas opiáceos, legales o ilegales. Es importante señalar que los test habituales de detección de opiáceos en orina no detectan la presencia de tapentadol (4).
Equivalencia de dosis frente a otros opiáceos
Tal y como se ha analizado con anterioridad, la formulación de tapentadol de liberación retardada se ha estudiado en modelos de dolor crónico lumbar (28,30) y de dolor por artrosis (28,29), además de un estudio en el que se ha evaluado su utilización en dolor por neuropatía diabética (31).
Aunque no se trata de un metanálisis sistemático, en la tabla II se puede observar tanto las dosificaciones propuestas para tapentadol como la equivalencia de dosificación con otros analgésicos opiáceos (9,17,37-39).
La pauta posológica debe personalizarse en función de la intensidad de dolor del paciente (17). Una pauta de ajuste en incrementos de 50 mg/12 h de tapentadol retard cada 3 días es adecuada para alcanzar un control de dolor adecuado en la mayoría de los pacientes (17).
Debido al menor agonismo μ-opioide (11-13) podría ocurrir que se diese síndrome de abstinencia al rotar de dosis altas de un opioide potente a tapentadol, por tanto, sería conveniente no disminuir la dosis al realizar la rotación a TPL o bien utilizar un agonista μ-opioide de liberación rápida al inicio del tratamiento.
Conclusiones
Los opioides clásicos son importantes en el manejo del dolor de larga evolución y tienen un gran potencial para ser utilizados entre pacientes seleccionados. A pesar de ello, su utilización a menudo queda limitada por la frecuencia de efectos adversos, lo que potencia la discontinuación de los tratamientos.
La importancia del nuevo analgésico de acción central, tapentadol, es presentar una eficacia similar a la de los opioides clásicos, asociada a una menor presencia de efectos adversos, lo cual lo hace muy interesante para intentar reducir las discontinuaciones de tratamientos en pacientes que se pueden beneficiar de una mejor calidad de vida con las propiedades antiálgicas de los opiáceos en tratamientos crónicos (3).
Con la disponibilidad de tapentadol retard se incorporará al arsenal terapéutico una nueva alternativa para el tratamiento crónico del dolor intenso que amplía las posibilidades de analgesia eficaz en nuestros pacientes, disminuyendo la incidencia de efectos adversos y, por tanto, consolidando un perfil de tolerabilidad superior a los opiáceos conocidos hasta el momento.
Habrá que seguir investigando, en futuros estudios, la incorporación de nuevas indicaciones de analgesia.
Bibliografía
1. Reidenberg MM. Pain control and the World Health Organization analgesic ladder. JAMA 1996;275:835; author reply 6. [ Links ]
2. Coluzzi F, Mattia C. Oxycodone. Pharmacological profile and clinical data in chronic pain management. Minerva Anestesiol 2005;71:451-60. [ Links ]
3. Ahlbeck K. Opioids: A two-faced Janus. Current Medical Research and Opinion 2011;27 (2):439-48. [ Links ]
4. Gevirtz C. A Comparative Analysis of Tapentadol, Tramadol, and the Opiates. Topics in Pain Management 2010;25:1. [ Links ]
5. Nossaman VE, Ramadhyani U, Kadowitz PJ, Nossaman BD. Advances in perioperative pain management: use of medications with dual analgesic mechanisms, tramadol & tapentadol. Anesthesiol Clin 2010;28:647-66. [ Links ]
6. Candiotti KA, Gitlin MC. Review of the effect of opioid-related side effects on the undertreatment of moderate to severe chronic non-cancer pain: tapentadol, a step toward a solution? Curr Med Res Opin 2010;26: 1677-84. [ Links ]
7. Schroder W, Vry JD, Tzschentke TM, Jahnel U, Christoph T. Differential contribution of opioid and noradrenergic mechanisms of tapentadol in rat models of nociceptive and neuropathic pain. Eur J Pain 2010;14: 814-21. [ Links ]
8. Hartrick CT, Rozek RJ. Tapentadol in pain management: A mu-Opioid receptor agonist and noradrenaline reuptake inhibitor. CNS Drugs 2011;25 (5):359-70. [ Links ]
9. Tzschentke TM, Christoph T, Kogel B, et al. (-)-(1R,2R) -3-(3-dimethylamino-1-ethyl-2-methyl-propyl)-phenol hydrochloride (tapentadol HCl): a novel mu-opioid receptor agonist/norepinephrine reuptake inhibitor with broad-spectrum analgesic properties. J Pharmacol Exp Ther 2007;323:265-76. [ Links ]
10. Christoph T, De Vry J, Tzschentke TM. Tapentadol, but not morphine, selectively inhibits disease-related thermal hyperalgesia in a mouse model of diabetic neuropathic pain. Neurosci Lett 2010;470:91-4. [ Links ]
11. Tzschentke TM, Jahnel U, Kogel B, et al. Tapentadol hydrochloride: a next-generation, centrally acting analgesic with two mechanisms of action in a single molecule. Drugs Today (Barc) 2009;45:483-96. [ Links ]
12. Tzschentke TM DVJ, Terlinden R, et al. Tapentadol HCl. Drugs Future 2006;31:1053-61. [ Links ]
13. Schroder W, Tzschentke TM, Terlinden R, et al. Synergistic interaction between the two mechanisms of action of tapentadol in analgesia. Journal of Pharmacology and Experimental Therapeutics 2010;337 (1):312-20. [ Links ]
14. Davis MP, Varga J, Dickerson D, Walsh D, LeGrand SB, Lagman R. Normal-release and controlled-release oxycodone: pharmacokinetics, pharmacodynamics, and controversy. Support Care Cancer 2003;11:84-92. [ Links ]
15. Kress HG. Tapentadol and its two mechanisms of action: is there a new pharmacological class of centrally-acting analgesics on the horizon? Eur J Pain 2010;14: 781-3. [ Links ]
16. Frampton JE. Tapentadol immediate release: a review of its use in the treatment of moderate to severe acute pain. Drugs 2010;70:1719-43. [ Links ]
17. Ficha técnica de Palexia® retard. [ Links ]
18. Terlinden R, Ossig J, Fliegert F, Lange C, Gohler K. Absorption, metabolism, and excretion of 14C-labeled tapentadol HCl in healthy male subjects. Eur J Drug Metab Pharmacokinet 2007;32:163-9. [ Links ]
19. Cascorbi. Pharmacogenetics of cytochrome p4502D6: genetic background and clinical implication. Eur J Clin Invest 2003;33:17-22. [ Links ]
20. Kneip C, Terlinden R, Beier H, Chen G. Investigations into the drug-drug interaction potential of tapentadol in human liver microsomes and fresh human hepatocytes. Drug Metab Lett 2008;2:67-75. [ Links ]
21. Terlinden R, Kogel BY, Englberger W, Tzschentke TM. In vitro and in vivo characterization of tapentadol metabolites. Methods Find Exp Clin Pharmacol; 32:31-8. [ Links ]
22. Package I. Nucynta (tapendatol). Raritan, NJ: Ortho-Mceil-Janssen Pharmaceuticals. March 2010. [ Links ]
23. Smit JW, Oh C, Rengelshausen J, et al. Effects of acetaminophen, naproxen, and acetylsalicylic acid on tapentadol pharmacokinetics: results of two randomized, open-label, crossover, drug-drug interaction studies. Pharmacotherapy;30:25-34. [ Links ]
24. Smit J OC, Lannie C, et al. Effects of probenecid on tapentadol immediate release pharmacokinetics: results of an open-label, crossover, drug-drug interaction study (abstract no. 61). J Clin Pharmacol 2009;49:1104. [ Links ]
25. Mangold B OC, Jaeger D, et al. The pharmacokinetics of tapentadol are not affected by omeprazole: results of a 2-way crossover drug-interaction study in healthy subjects (abstract no. P1126). Pain Pract 2007;7:1:55. [ Links ]
26. Smit J OC, Mangold B, et al. Effects of metoclopramide on tapentadol pharmacokinetics: results of an open-label, cross-over, drug-drug interaction study (abstract no. 62). J Clin Pharmacol 2009;49:1104. [ Links ]
27. Vorsanger G, Biondi D, Sorra K, et al. Post hoc analyses of data from phase 3 clinical trials of immediate-release tapentadol suggest no evidence of the serotonin syndrome. Journal of Clinical Pharmacology 2009; Conference: 38th Annual Meeting American College of Clinical Pharmacology San Antonio, TX United States. Conference Start: 20090913 Conference End: 20090915. Conference Publication: (var.pagings). 49 (9):1101. [ Links ]
28. Wild JE, Grond S, Kuperwasser B, et al. Long-term safety and tolerability of tapentadol extended release for the management of chronic low back pain or osteoarthritis pain. Pain Pract 2010;10:416-27. [ Links ]
29. Afilalo M, Etropolski MS, Kuperwasser B, et al. Efficacy and safety of Tapentadol extended release compared with oxycodone controlled release for the management of moderate to severe chronic pain related to osteoarthritis of the knee: a randomized, double-blind, placebo- and active-controlled phase III study. Clin Drug Investig 2010;30:489-505. [ Links ]
30. Buynak R, Shapiro DY, Okamoto A, et al. Efficacy and safety of tapentadol extended release for the management of chronic low back pain: Results of a prospective, randomized, double-blind, placebo- and active-controlled Phase III study. Expert Opinion on Pharmacotherapy 2010;11 (11):1787-804. [ Links ]
31. Schwartz S, Etropolski M, Shapiro DY, et al. Safety and efficacy of tapentadol ER in patients with painful diabetic peripheral neuropathy: results of a randomized-withdrawal, placebo-controlled trial. Curr Med Res Opin;27:151-62. [ Links ]
32. Lange B, Kuperwasser B, Okamoto A, et al. Efficacy and safety of tapentadol prolonged release for chronic osteoarthritis pain and low back pain. Adv Ther 2010;27:381-99. [ Links ]
33. Veves A, Backonja M, Malik RA. Painful diabetic neuropathy: epidemiology, natural history, early diagnosis, and treatment options. Pain Med 2008;9:660-74. [ Links ]
34. Eisenberg E, McNicol ED, Carr DB. Efficacy and safety of opioid agonists in the treatment of neuropathic pain of nonmalignant origin: systematic review and meta-analysis of randomized controlled trials. JAMA 2005;293:3043-52. [ Links ]
35. http://clinicaltrials.gov/ct2/results?term=tapentadol& recr=Open&rslt=&type=&cond=&intr=&outc=& lead=&spons=&id=&state1=&cntry1=&state2=&cntry2=&state3=& cntry3=&locn=&gndr=&rcv_s=&rcv_e=&lup_s=&lup_e=. [ Links ]
36. Weber H LR, Kuperwasser B, McCann B, Okamoto A, steup A, Etropoolski M, et al. Tolerability of tapentadol prolonged release based on discontinuations due to adverse events in a 1-year randomized Phase 3 safety study. Poster presented at the 6 th triennial congress of the european Federation of IASP® Chapters (EFIC); 2009 Sep 9-12; Lisbon, Portugal 2009. [ Links ]
37. Mercadante S BE. Opioid switching: A systematic and critical review. Cancer treatments reviews. Cancer treatments reviews 2006;32:302. [ Links ]
38. Sarhill N, Walsh D, Nelson KA. Hydromorphone: pharmacology and clinical applications in cancer patients. Support Care Cancer 2001;9:84-96. [ Links ]
39. Sittl R. LR, Poulsen Nautrup B. Equipotent doses of transdermal fentanyl and transdermal buprenorphine in patients with cancer and noncancer pain: results of a retrospective cohort study. ClinTher 2005;27:225-37. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Luis Miguel Torres Morera
Servicio de Anestesia, Reanimación y Terapia del Dolor
Hospital Puerta del Mar
Avda. Ana de Villa, 21
11009 Cádiz
e-mail: lmtorres@arrakis.es
Recibido: 01-05-11
Aceptado: 10-07-11