My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Sociedad Española del Dolor
Print version ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.19 n.2 Madrid Mar./Apr. 2012
Actualizaciones en el manejo clínico de los opioides espinales en el dolor agudo postoperatorio
Up to date in clinical management of neuraxial opioids for the treatment of postoperative pain
B. Mugabure Bujedo, S. González Santos, A. Uría Azpiazu y L. Torán García
Servicio de Anestesiología, Reanimación y Tratamiento del Dolor. Hospital Universitario Donostia. San Sebastián
Dirección para correspondencia
RESUMEN
Los opioides son los fármacos más potentes utilizados en el tratamiento del dolor. En los últimos 40 años, tras el descubrimiento de los receptores opioides medulares, la práctica clínica ha conllevado el uso de opioides espinales con el propósito de producir una intensa analgesia metamérica desprovista de los efectos adversos de su utilización sistémica. Existe el concepto erróneo de que la administración epidural o intratecal de opioides producirá siempre una analgesia selectiva espinal junto con un menor riesgo de secundarismos, como la depresión respiratoria. Esta creencia no es cierta, ya que varios de ellos pueden alcanzar los centros cerebrales por redistribución sanguínea o vía líquido cefalorraquídeo (LCR), produciendo tanto analgesia supraespinal como efectos adversos.
Los estudios demuestran que la liposolubilidad es inversamente proporcional a su selectividad medular, siendo esta mayor para el fármaco más hidrosoluble, la morfina. Su administración epidural liposomal retardada (MELR) ofrece buena analgesia sin la necesidad de un catéter epidural. El fentanilo es el opioide más recomendable en cirugía ambulatoria y parece producir un mayor efecto espinal tras su administración epidural en forma de bolos, y supraespinal en el modo de infusión continua. La metadona y la hidromorfona epidural son alternativas válidas para este uso en el periodo postoperatorio.
Todos los opioides administrados vía intratecal producirán, al menos en parte, analgesia por un mecanismo espinal. Las diferencias principales entre ellos se presentan en relación a la duración de acción, velocidad de aclaramiento y vías por las que el fármaco alcanza los receptores cerebrales. En general, los opioides lipofílicos producen una analgesia de corta duración (1-4 h), que los hace útiles para el control del dolor postoperatorio inmediato. Sin embargo, la morfina produce una intensa analgesia de hasta 24 h, con dosis de tan solo 100-200 μg.
Palabras clave: Analgesia espinal. Opioides epidurales. Opioides intratecales. Dolor postoperatorio.
ABSTRACT
Opioids are the strongest drugs currently used for the treatment of pain. Over the last 40 years, because of the discovery of the spinal cord opioid receptors, the use of spinal opioids has become a standard for producing intense segmental analgesia without side effects associated with systemic administration. There is a widespread misconception that any opioid administered epidurally or intrathecally will always produce analgesia by a selective mechanism without central adverse effects. This is simply not true because multiple of these opioids produce analgesia by uptake into the systemic circulation or cerebrospinal fluid (CSF), with subsequent redistribution to brain opioid receptors.
The findings indicate that increasing lipid solubility decreases the spinal cord bioavailability, therefore morphine is the most spinally selective opioid currently used in the epidural and intrathecal spaces. Extended release epidural morphine (EREM) utilizes a proprietary liposomal carrier to provide prolonged analgesia without the need for an indwelling catheter. Fentanyl is the best option for ambulatory surgery and it becomes apparent that epidural fentanyl acts predominantly spinally when administered as a bolus, and predominantly supraspinally as a continuous infusion. Epidural methadone and hydromorphone are valid alternatives for improve analgesia in the postoperative setting.
All opioids injected intrathecally can be expected to produce analgesia, at last in part, by a spinal mechanism. The principal difference among opioids is in their duration of analgesic action, speed of re-distribution and the mechanism by which the drug reaches brainstem sites. In general, lipophilic opioids produce short durations of action (1-4 hours), which makes them attractive for short-term postoperative states. However, morphine doses of only 100 to 200 μg produce potent analgesia lasting as long as 24 hours.
Key words: Spinal analgesia. Epidural opioid. Intrathecal opioid. Postoperative pain.
Recuerdo histórico
La historia de la anestesia intratecal y epidural ha discurrido en paralelo a la de la anestesia general. Así como se consideró el éter como la primera anestesia moderna al ser usado por Morton en 1846, Bier y su asistente hicieron historia utilizando cocaína intratecal, uno sobre el otro, en el Royal Chirurgical Clinic de Kiel en 1898. La primera reseña publicada de uso de opioides en una anestesia raquídea se debe a un cirujano rumano, Racoviceanu-Pitesti que presentó su experiencia, con una mezcla de cocaína y morfina, en París en 1901 (1). Esta carrera ha estado plagada de adversidades que se vieron superadas en la década de los 70 al descubrirse los receptores opioides medulares, y evidenciar que la aplicación directa de morfina espinal producía analgesia (2). Esta realidad fue tangible tras la utilización con éxito por Wang y cols. de bolos de morfina intratecal en humanos (3) y ser publicado por Behar y cols. en "The Lancet" el 10 de marzo del 1979, el primer artículo de uso de morfina epidural a dosis de 2 mg, en 10 pacientes para tratamiento del dolor tanto agudo como crónico, con una duración del alivio entre 6-24 h, sugiriendo sus autores un efecto espinal directo sobre los receptores específicos de la sustancia gelatinosa del asta posterior medular (4). Por lo tanto, ha transcurrido más de un siglo hasta conseguir la utilización rutinaria de opioides vía espinal como tratamiento analgésico intra y postoperatorio, del trabajo del parto así como del dolor crónico especialmente de origen oncológico. Es un hecho llamativo como en los primeros 50 años de la historia de la anestesia espinal el papel protagonista lo asumían los propios cirujanos, y con el paso del tiempo lo fueron abandonando hasta ser en la actualidad un campo exclusivo de los anestesiólogos.
Introducción
En los últimos años el esfuerzo científico se ha centrado en definir que opioide es adecuado para uso espinal y cual no. Ya que, se había asumido que cualquier opioide depositado en el espacio epidural o intratecal, producirá una analgesia selectiva espinal superior a la conseguida por cualquier otra vía de administración y desprovista de los efectos adversos más temidos como la depresión respiratoria, que puede conducir al fallecimiento del paciente. Desafortunadamente, en la mayor parte de los casos este hecho no se cumple, ya que pueden alcanzar los centros superiores cerebrales a través del LCR o por recaptación sanguínea y muchos de ellos solo consiguen una biodisponibilidad medular muy baja, produciendo su efecto analgésico a nivel supraespinal (5).
Es un hecho demostrado que la administración espinal de anestésicos locales produce un efecto analgésico segmentario medular. Sin embargo, persiste un debate activo sobre si el uso de opioides en solitario o junto con dichos fármacos consigue la misma finalidad en el periodo perioperatorio (6). El objetivo de esta revisión es definir qué opioides consiguen alcanzar su biofase medular en concentración suficiente para producir analgesia selectiva medular tras su administración epidural o intratecal, y dar unas recomendaciones para su uso racional en nuestro medio hospitalario en el ámbito del dolor postoperatorio, para lo cual hemos revisado en Medline todos los artículos publicados hasta el año 2011 con las palabras clave; "analgesia espinal, opioides epidurales, opioides intratecales, dolor postoperatorio".
Acción analgésica opioide
Los opioides son los fármacos con mayor eficacia analgésica de cuantos se conocen. Esto se debe a que su acción es el resultado de una interacción combinada sobre cuatro tipos de receptores, a su vez divididos en varios subtipos (μ1-3, δ1-2, κ1-3, ORL-1), situados a diversos niveles del neuroeje desde la corteza cerebral a la médula espinal, así como en alguna localización periférica, que intervienen tanto en los mecanismos aferentes como eferentes de la sensibilidad nociceptiva. También forman parte del sistema endógeno neuromodulatorio del dolor y están relacionados con el sistema adrenérgico, serotoninérgico y gabaérgico (7).
- Sistema aferente: los opioides interactúan en la médula espinal con los receptores situados en las terminaciones sensoriales primarias que penetran en las astas posteriores, así como con los localizados en somas y dendritas de las neuronas de las láminas I y V que dan origen a las vías espinotalámicas. En el mesencéfalo y diencéfalo deprimen la actividad a nivel de la sustancia gris periacueductal y periventricular. Actúan finalmente en los abundantes receptores de la corteza cerebral y sistema límbico, deprimiendo la capacidad de integrar la información y alterando la incorporación de los procesos afectivos en la sensación y percepción del dolor.
- Sistema eferente: en el asta posterior espinal, láminas I y II, la acción es eminentemente inhibidora y con carácter selectivo de la transmisión nociceptiva. A nivel presináptico, inhiben la liberación de neurotransmisores excitadores como el glutamato, la sustancia P, el adenosin trifosfato (ATP) o el péptido relacionado con el gen de la calcitonina (CGRP). A nivel postsináptico debido a la hiperpolarización, inhiben las neuronas encargadas de la transmisión nociceptiva como la de las vías espinotalámicas.
-Terminaciones sensoriales periféricas: diversos trabajos apuntan que los opioides pueden también actuar periféricamente sobre las terminaciones sensoriales como las existentes en el tejido articular. Existe una razón lógica para pensar que tanto las terminaciones primarias como las periféricas, al pertenecer a una misma neurona bipolar situada en el ganglio raquídeo, conseguirían que los receptores de dicha neurona pudieran emigrar centrípetamente hacia la médula y centrífugamente hacia la periferia.
Todos los opioides producen analgesia por el mismo mecanismo molecular (5). La localización de los receptores es transmembranal y se acoplan a la proteína G, lo que provoca la inhibición de la enzima adenil-ciclasa con la consiguiente disminución del adenosil monofosfato cíclico (AMPc). Como resultado surgen dos acciones directas sobre la función neuronal: a) inhibición de los canales de Ca++ voltaje-dependientes en las neuronas primarias con disminución de la liberación de neurotransmisores presinápticos; y b) activación de los canales intracelulares de K+ que produce una hiperpolarización postsináptica. Todo ello conlleva a disminuir la excitabilidad neuronal. En cualquier caso, la hiperpolarización resultante no parece suficiente para explicar el mecanismo analgésico global alcanzado, por lo que tras la utilización de receptores clonados se ha demostrado que los receptores opioides también activan otras vías modulatorias mediadas por otras enzimas como protein-kinasas o la fosfolipasa A, así como la producción de segundos mensajeros como el fosfato de inositol y el diacilglicerol.
Hiperalgesia inducida por opioides (HIO)
El consumo crónico de opioides condiciona en los pacientes unos cambios fisiopatológicos que les predisponen a un mayor consumo de analgésicos en el periodo perioperatorio. Entre ellos destacan la dependencia, la tolerancia y la hiperalgesia inducida por los propios fármacos, denominada HIO (8). Este último efecto también ha sido descrito tras una exposición corta por vía sistémica y espinal, tanto en modelos animales como humanos, pero está aún por definir su verdadero papel en el periodo perioperatorio.
Las evidencias clínicas disponibles en la actualidad nos sugieren que los opioides tienen tanto la capacidad de aumentar como de disminuir el umbral de sensibilidad frente al estímulo doloroso, de tal manera que su efecto global será determinado por la interacción de los dos sistemas, anti y pronociceptivo, según la denominada Teoría de los Procesos Opuestos (9). Basándonos en la observación de que los opioides pueden modular y activar los sistemas inhibitorios y facilitadores de las vías del dolor, la hipersensibilidad al dolor ha sido atribuida al predominio relativo de los mecanismos pronociceptivos (10). Entre estos se encuentran, una disociación aguda de la unión opioide-receptor de la proteína-G que conduce a una desensibilización e internalización de los receptores mediado por la fosforilación de la proteína kinasa C, una regulación al alza de la vía mediada por la adenil-ciclasa (↑ cAMP) que provoca un aumento de neurotransmisores excitadores presinápticos medulares, la facilitación de las vías descendentes en las neuronas del asta posterior medular tras una exposición prolongada con agonista-m de péptidos con propiedades antagonistas opioides como la colecistokinina, el neuropéptido FF o la nociceptina.
La hiperalgesia se caracteriza por una desviación hacia la izquierda y/o abajo de la curva que relaciona la intensidad del estímulo con el grado de dolor observado, de tal manera que uno habitualmente doloroso se percibe como un dolor de mayor intensidad y así mismo otro estímulo no doloroso se percibe como molesto, lo que se define como alodinia. La hiperalgesia puede ser observada tanto en el sistema nervioso periférico como en el central. La hiperalgesia primaria es consecuencia de una sensibilización de nociceptores periféricos durante la fase inflamatoria mantenida por la isquemia y la acidosis local frente a estímulos térmicos o mecánicos en zonas cercanas a la incisión quirúrgica. La hiperalgesia secundaria es en cambio debida a la sensibilización central por una aferencia dolorosa mantenida en el tiempo que desencadena un aumento espontáneo de la actividad neuronal del asta posterior medular, solo manifestada frente a estímulos mecánicos y extendida a los tejidos alejados de la lesión. También se define como secundaria la hiperalgesia producida por fármacos opioides (11).
La importancia clínica de la hiperalgesia radica por una parte en el aumento de la intensidad del dolor, del consumo de analgésicos, de la morbilidad y del disconfort en el periodo postoperatorio así como en la mayor presencia de dolor crónico, e incluso se ha sugerido una mayor probabilidad de desarrollar un síndrome de dolor regional complejo. Además, el mayor inconveniente reside en la dificultad de su medición, ya que no se ve habitualmente reflejada en las escalas de valoración subjetivas de dolor tradicionales como la escala visual analógica (EVA). Son necesarios test de valoración objetiva de neuroplasticidad que aporten una información complementaria y se recomienda realizar una exploración frente a estímulos eléctricos y de presión sobre el territorio cutáneo, mediante una exploración con filamentos de Von Frey, de cara a realizar un diagnóstico y un ajuste correcto del tratamiento con fármacos neuromoduladores o anestestesia regional (12).
Estudios farmacológicos experimentales
- Remifentanilo: a pesar de no tener una indicación espinal, es el opioide del que existen más evidencias clínicas tanto en voluntarios sanos como en animales, de que tras un periodo corto de administración, produce una relevante activación de los sistemas pronociceptivos y como consecuencia tras su suspensión, un aumento de los requerimientos analgésicos. Pacientes sometidos a cirugía abdominal, anestesiados con una perfusión alta de remifentanilo (0,3 μg/kg/min), presentaban unos requerimientos de morfina postoperatoria mayores (59 vs. 32 mg/día) que aquellos que recibieron una perfusión baja (0,1 μg/kg/min) o una exposición al fármaco de menor duración. Estos datos implican que la activación de dichos sistemas esta directamente relacionada con el tiempo y la dosis total (13). También se ha comprobado en un ensayo clínico randomizado sobre 75 pacientes sometidos a cirugía mayor abdominal, como en el grupo de alta dosis del remifentanilo (0,4 μg/kg/min), la hiperalgesia secundaria postoperatoria detectada en los tejidos adyacentes a la incisión y el consumo de morfina era mayor respecto al grupo de dosis baja de fármaco (0,05 μg/kg/min), así como el papel protector de la ketamina iv a dosis bajas (bolo 0,5 μg/kg más perfusión de 5 μg/kg/min intraoperatorias y 2 μg/kg/min durante 48 h postoperatorias) (14). En un reciente estudio randomizado, doble ciego y cruzado, realizado sobre 16 voluntarios sanos, se comprobó cómo una infusión iv de remifentanilo durante 30 min indujo una hiperalgesia frente a estímulos eléctricos y frío en contraposición al suero salino (p < 0,001 y p < 0,005 respectivamente), y cómo la administración iv previa de antiinflamatorios (AINE), tanto inhibidores de la ciclooxigenasa-1 (ketorolaco 30 mg) o de la ciclooxigenasa-2 (parecoxib 40 mg), fue eficaz en disminuir el área de hiperalgesia frente al prick-test (p < 0,001), con una mayor duración para el parecoxib, concluyendo que ambos grupos de fármacos tienen un papel protector frente a HIO (15).
- Fentanilo: en experimentación animal, la aplicación repetida de este fármaco provoca una disminución del umbral doloroso dosis dependiente que se mantiene una vez desaparecido el efecto analgésico, de tal manera que tras una dosis única iv de 80 μg/kg su duración es de un día y tras 400 μg/kg de hasta cinco días. En estos casos, la hiperalgesia mejora tras la administración de ketamina, por lo que se supone que el fentanilo es capaz de activar el sistema mediado por el receptor NMDA (N-Metil-D-Aspartato) tras una aplicación breve (16). Este dato podría explicar la pérdida parcial del efecto analgésico de la morfina cuando se administra inmediatamente tras el final de una analgesia basada en fentanilo, que se restaura tras la aplicación nuevamente de este opioide junto con ketamina (17). De hecho, existen estudios en humanos que demuestran que los pacientes con dosis altas de fentanilo iv intraoperatorio (15 μg/kg) presentan un consumo mayor de morfina postoperatoria que aquellos que lo hacen en dosis bajas (1 μg/kg) (18). Asimismo, la administración intraoperatoria de óxido nitroso (N2O), por sus propiedades antagonistas del receptor NMDA, ha demostrado ser eficaz en la disminución de la intensidad y duración de la hiperalgesia inducida tanto por un proceso inflamatorio, como por fentanilo en ratas (19). También ha sido efectiva la aplicación de gabapentina intratecal o intraperitoneal en la hiperalgesia inducida por fentanilo en estos animales, al parecer por compartir mecanismos fisiopatológicos con el dolor neuropático (20). Finalmente, existe cierta evidencia de que la administración intratecal de fentanilo podría producir un efecto de hiperalgesia aguda, ya que se ha comprobado como la administración de este fármaco, a dosis de 25 μg junto a bupivacaína, para cirugía de cesárea aumentaba en un 63% los requerimientos postoperatorios de morfina iv frente al grupo control tratado con salino junto al AL (21).
- Morfina: la presencia de hiperalgesia acontece tras un periodo largo de administración, días o semanas, en contraste con la heroína (diacetilmorfina), que puede presentarla incluso tras una administración única (22). Se ha observado como la aplicación de morfina sistémica o intratecal activa el sistema del receptor NMDA y como consecuencia la combinación de este opioide junto con ketamina o dextrometorfano produce una reducción importante de la hiperalgesia (23). Además del aumento o los cambios de las características del dolor, pueden presentarse fenómenos dosis-dependientes excitatorios, como mioclonías o convulsiones, atribuidos a la acumulación plasmática de M-3-G (24), que mejoran tras una rotación de opioides, siendo la metadona el más indicado por su mecanismo anti-NMDA. La hiperalgesia es más frecuente con dosis altas vía intratecal y en tratamientos crónicos, y se han sugerido como responsables mediadores como el propio M-3-G (25) u otros neurotransmisores del tipo aminoácidos excitatorios (26).
- Sufentanilo: este opioide vía intratecal a dosis altas (50 mg) produjo hiperalgesia en la mitad inferior del cuerpo, en un paciente en tratamiento crónico por dolor neuropático (aracnoiditis) que intoleró la morfina espinal por vómitos incoercibles y que desapareció al suspender el sufentanilo (27).
A pesar de todo lo expuesto anteriormente, en una revisión realizada en el año 2009, se incluyeron todos los estudios sobre hiperalgesia opioide en humanos (n = 48) y se puntuaron por dos revisores independientes con un patrón común de 14 criterios de calidad, con el fin de contestar a 10 hipótesis preestablecidas sobre la posibilidad real de HIO. Fue imposible comprobar 7 de ellas por falta de trabajos. Únicamente se encontró un nivel alto de evidencia clínica (NE A) sobre la aparición de hiperalgesia secundaria en voluntarios sanos que recibieron una infusión continua iv de opioides. El nivel de evidencia fue inconsistente (NE C) en los estudios sobre pacientes con dolor crónico que recibieron una infusión de opioides, así como los que intentaron demostrar un aumento del dolor o del consumo de opioides cuando se utilizaron opioides perioperatorios (28).
Mecanismo de distribución farmacológica espinal
Cualquier opioide depositado en cualquier punto del organismo producirá un efecto analgésico al alcanzar los receptores cerebrales vía sanguínea según su grado de absorción, por lo que tras la administración espinal la analgesia conseguida no demuestra un mecanismo específico medular. Además, aunque lo tuviera, para justificar su uso debemos demostrar que conseguiremos un mejor efecto analgésico con menores secundarismos, que otras vías de administración menos invasivas como la intravenosa.
Una parte importante de la explicación de las diferencias farmacológicas encontradas entre los opioides reside en su capacidad de alcanzar sus receptores específicos medulares. En el ámbito de nuestra revisión, la biodisponibilidad de un opioide tras su administración perimedular se referirá a la capacidad de distribución de dicha sustancia desde su lugar de entrada hasta su punto de acción o biofase medular. Este último reside en el asta posterior de la sustancia gris de la médula espinal (láminas I, II), que está rodeada de un manto de sustancia blanca. Por lo tanto un fármaco administrado vía epidural deberá atravesar además del contenido del propio espacio epidural, las meninges, el líquido cefalorraquídeo y la sustancia blanca. Tras la administración intradural lógicamente estos tejidos se reducen. Este viaje a recorrer se podría definir en una persona adulta del orden de decenas de milímetros. En cambio tras su administración sistémica el flujo sanguíneo depositará el opioide a una distancia mucho menor, tan solo a unas pocas micras de su biofase supramedular, teniendo tan solo que cruzar la barrera capilar de los vasos cerebrales. Esta diferencia en las distancias de difusión marcará posteriormente las diferentes potencias relativas de cada opioide según su vía de administración (29).
Difusión epidural
Desde el espacio epidural, un fármaco opioide deberá desplazarse para alcanzar su lugar específico de acción en la sustancia gris del asta posterior medular, ya que el papel analgésico de los receptores opioides en el ganglio de raíz dorsal está aún por determinar. Por lo tanto, uno de los factores más importantes será la capacidad de redistribución en los tejidos circundantes en el esfuerzo del fármaco por abandonar el espacio epidural, que deberá atravesar además diversos entornos heterogéneos adversos como las meninges, el líquido cefalorraquídeo (LCR), y la sustancia blanca medular.
Bernards y cols. (30) administraron en un modelo animal varios opioides epidurales en forma de bolo (morfina, fentanilo, alfentanilo y sufentanilo) y midieron su concentración a lo largo del tiempo en el espacio y la grasa epidural, espacio intradural, sangre venosa central y plexo epidural. Demostraron como el tiempo de estancia epidural y la concentración en la grasa de dicho espacio se correlacionaba directamente con la liposolubilidad, siendo mayor para el sufentanilo y fentanilo y menor para la morfina. Así mismo, como era de suponer, una mayor proporción de morfina alcanzaba el LCR, en comparación con el resto de opioides lipofílicos, que se quedaban secuestrados en la grasa, y comprobaron que el alfentanilo presentaba la mayor concentración plasmática debido a su rápido aclaramiento hacia el compartimento vascular central.
La grasa epidural, dispuesta de forma compartimentada mayoritariamente postero-lateral, amortigua los movimientos pulsátiles del saco dural y facilita su deslizamiento sobre el periostio del canal vertebral durante los movimientos de flexo-extensión de la columna. Por sus propiedades lipofílicas se comporta como un depósito de fármacos liposolubles, que produciría una liberación prolongada y sostenida de los mismos. El fentanilo y alfentanilo se acumulan 32 y 20 veces más que la morfina respectivamente, por lo que están disponibles en menor cantidad para alcanzar su biofase medular (31).
Difusión meníngea
Los estudios experimentales sugieren que la difusión simple a través de las meninges, acompañada por la energía cinética pulsátil sistólica recibida del movimiento de la médula espinal, es el mecanismo fundamental de los opioides de alcanzar el LCR, ya que se ha comprobado que la difusión a través de las vellosidades aracnoideas de las raíces nerviosas espinales (32) y de las arterias radiculares en su función de vascularización medular (33), no forman parte de este proceso. Aunque las diferencias entre los fármacos opioides existen, no son determinantes en la redistribución del espacio epidural al subaracnoideo.
La relación entre el carácter lipofílico y la permeabilidad aracnoidea es bifásica (34); inicialmente cuando la liposolubilidad aumenta lo hace también la permeabilidad, pero solo hasta una cifra moderada del coeficiente de distribución octanol/buffer de aproximadamente 125. A partir de aquí, a medida que la liposolubilidad aumenta, la permeabilidad disminuye significativamente. Consecuentemente el coeficiente de permeabilidad meníngea de la morfina (M), coeficiente de distribución octanol/buffer de 1 y de sufentanilo (S) 1787, es similar: 0,6 para M y 0,75 para S. La razón de esta relación bifásica radica en el hecho de que los fármacos deben difundir a través de las barreras lipídicas de las células madre de la aracnoides, y luego por el líquido del espacio extra e intracelular. Los fármacos muy liposolubles realizan bien la primera parte pero mal la segunda y los hidrosolubles al revés. Por ello, el hecho de que la aracnoides sea la principal barrera a la permeabilidad (90%), explica que los fármacos de liposolubilidad intermedia (lidocaína, alfentanilo), consigan un mejor movimiento a través del tejido.
Aún así, a pesar de que las meninges no juegan un papel relevante como barrera física selectiva en la difusión opioide espinal, sí merece la pena destacar su importante función como lugar de aclaramiento de los fármacos en su dirección intratecal, debido a la riqueza capilar que descansa sobre la cara interna de la duramadre. Esta conclusión se debe al resultado de dos estudios experimentales en animales: Kozody y cols. (35) demostraron que la administración espinal de adrenalina y fenilefrina reducía significativamente el flujo sanguíneo a la duramadre sin afectar al de la médula espinal, y Bernards y cols. (36) descubrieron que la asociación de adrenalina a los opioides epidurales hidrofílicos (morfina), reducía su aclaramiento plasmático debido probablemente a la reducción del flujo sanguíneo dural.
Difusión intradural
A excepción del lugar de punción, el volumen administrado, los efectos de la baricidad y de la energía cinética producida por la inyección, los opioides que alcanzan el LCR se deberían comportar de igual manera tanto si lo hacen por inyección directa o por difusión epidural. Ummenhofer y cols. (37) comprobaron que el volumen de distribución de los opioides intratecales guardaba una relación directa con la liposolubilidad, siendo unas 40 veces mayor para sufentanilo que para morfina. Este dato conlleva una rápida redistribución del compartimento intratecal hacia entornos más lipofílicos y en su estudio la mayor vía de eliminación fue la vía transmeningea, hacia el espacio epidural. La consecuencia más directa para los opioides lipofílicos es una limitada difusión rostral por el LCR y una baja biodisponibilidad medular.
La principal causa de extensión de un fármaco en el LCR es elpropio movimiento del LCR. El rango de difusión simple de cualquier molécula en un líquido ideal, es proporcional a la temperatura de dicho líquido e inversamente proporcional a la raíz cuadrada del peso molecular. Debido a que la temperatura del LCR es constante y a que el resultado de dicha raíz cuadrada es semejante para todos los opioides (rango 17-20), los porcentajes de difusión son similares para todos los opioides y no pueden explicar las diferencias de extensión en el LCR. Las diferencias entre los fármacos de este mismo grupo acontecen por los diferentes porcentajes de aclaramiento de dichos opioides del LCR, ya que si un fármaco se elimina rápidamente, quedará una cantidad remanente muy pequeña para realizar una progresión rostral y un efecto analgésico medular. Por ejemplo, el aclaramiento del LCR en humanos del sufentanilo (27 μg/kg/min) es casi 10 veces el de la morfina (2,8 μg/kg/min), por ello esta última residirá más tiempo en el LCR y tendrá mayor posibilidad de difusión cefálica y de provocar efectos secundarios supraespinales como sedación y depresión respiratoria (29). Se ha estimado que tras la administración de morfina en la cisterna lumbar, esta alcanza la cisterna magna en 1-2 h y el 4o y los ventrículos laterales en 3-6 h. Sin embargo los opioides lipofílicos, también pueden causar efectos centrales, al ser más rápidamente redistribuidos por vía sanguínea y alcanzar de esta forma el SNC, hecho que también sucede en menor medida por vía LCR, ya que se han encontrado restos de opioides en la cisterna magna cerebral tan solo 30 minutos después de su administración intratecal lumbar, incluso con sufentanilo (38).
Se ha comprobado en voluntarios sanos, cómo tras la administración de 50 μg de fentanilo (F) junto con la misma dosis de morfina (M) intratecal en el espacio más inferior (L5-S1) de la cisterna lumbar, y tras analizar varias muestras de LCR hasta pasados 120 min a través de un 2o abordaje en el espacio lumbar más superior posible (L2-L3), ambos fármacos alcanzaban la concentración pico en la muestra más cefálica en un tiempo similar (41 ± 13 min para F y 57 ± 12 min para M). La proporción M/F se fue incrementando de 2/1 a los 36 min hasta 4/1 a los 103 min; no se correlacionó con el peso, la talla, ni el volumen del LCR lumbar y se podía explicar mediante un simple modelo farmacocinético con bastante variabilidad individual. Concluyeron que el fentanilo es aclarado con mayor rapidez que la morfina del LCR, aunque la distribución en la primera hora no difiere mucho entre ambos fármacos (39).
Recientemente Bernards (40) en un estudio experimental animal, tras una infusión continua de bupivacaína y baclofén, ha comprobado que el LCR constituye un espacio con una difusión interna pobre, que presenta un gradiente circunferencial postero-anterior añadido al importante gradiente rostro-caudal, ya conocido para albúmina y glucosa, mantenido por la escasa energía cinética pulsátil obtenida en sístole del ciclo cardiaco, y por la gran compartimentación anatómica interna. En su estudio, tras 8 horas de infusión, los fármacos se detectaban únicamente 7 cm. alejados del punto de inyección, en una cantidad mucho menor del lugar de entrada y a una concentración mayor en el segmento medular posterior respecto del anterior.
La relevancia clínica analgésica reside en conocer la rapidez de aclaramiento de un fármaco del LCR y en determinar la cantidad de fármaco disponible en su biofase medular, así como su vida media de eliminación. Obviamente, un fármaco dirigido hacia el asta posterior de la médula espinal tendrá una mayor biodisponibilidad que aquel redistribuido al plasma o al espacio epidural. Además deberemos conocer qué parte del efecto analgésico corresponde a una acción espinal y cuál a otra acción supraespinal, así como si esta última es necesaria para el efecto global alcanzado.
Difusión medular
Finalmente, el último paso que debe dar un opioide ya situado en el entorno de la médula espinal, es atravesar la sustancia blanca y unirse a los receptores específicos de la sustancia gris. En un clásico estudio de von Cube y cols. (41) administraron morfina, dehidromorfina y fentanilo marcados radiactivamente dentro del LCR del ventrículo lateral en conejos, y midieron la distancia de progresión en los tejidos adyacentes del SNC a lo largo del tiempo. Encontraron que en los primeros 7 min, los tres fármacos penetraban unas 700 micras, pero a medida que pasaba el tiempo, el fentanilo no progresaba más y era aclarado del cerebro en unos 120 min. Contrariamente a esto, la morfina y la dehidromorfina seguían penetrando más profundamente y al finalizar el tiempo del estudio, unas 5 horas, la morfina conseguía una profundidad de 3.000 micras. Todavía más importante resultaba la observación de que el fentanilo demostraba una preferencia por la sustancia blanca en oposición a los fármacos hidrosolubles que lo tenían por la sustancia gris. Este hecho se comprobó en un modelo experimental en cerdos (37), al medir las concentraciones en el espacio extracelular de la médula espinal tras la administración intratecal de morfina, alfentanilo, sufentanilo y fentanilo a dosis equimolares. La concentración de morfina excedía a todos los fármacos lipofílicos, alcanzando el triple del valor y duración a lo largo del tiempo, tanto en la inyección lumbar L2-3, como torácica T11. La explicación reside en que la sustancia blanca está formada principalmente por membranas axonales plasmáticas que sucesivamente están envueltas por múltiples capas de células de Schwann, por lo que está constituida por lípidos en un 80%, lo que conlleva una mayor afinidad por los opioides lipofílicos. Como la sustancia gris carece de mielina, es relativamente hidrofílica y tiene una mayor afinidad por la morfina.
Bernards (42) realizó una revisión sobre los estudios experimentales en animales en los que se obtenían medidas de las concentraciones de los opioides en el espacio epidural, intradural, en la médula espinal y en los tejidos perimedulares, siempre tras su administración espinal. Concluyó que estos datos ayudan a entender lo que múltiples ensayos clínicos apuntan sobre el efecto analgésico de los opioides lipofílicos: se debe en parte, sino exclusivamente en algunos casos, a reabsorción plasmática y redistribución hacia los receptores opioides cerebrales.
Como consecuencia de todos los estudios experimentales anteriormente descritos, se puede deducir que la biodisponibilidad sobre los receptores opioides medulares de los opioides hidrofílicos como morfina supera a la de los lipofílicos como fentanilo o sufentanilo. De hecho, la Food and Drugs Administration Norteamericana (FDA) solo tiene aprobado los opioides hidrofílicos dentro de la primera línea de tratamiento para uso espinal, siendo el resto de opioides solo recomendados en caso de falta de eficacia de estos e incluso utilizados fuera de ficha técnica ("Off label") en el contexto del dolor agudo postoperatorio, debido a la gran cantidad de estudios que avalan su efectividad. Estos datos están resumidos en la tabla I.
Utilización clínica
Una vez hemos llegado a este punto, debemos comprobar si existe una correlación entre las conclusiones extraídas de los estudios anteriores y los ensayos clínicos en humanos para así definir unas recomendaciones aplicables a la práctica diaria habitual.
Opioides epidurales
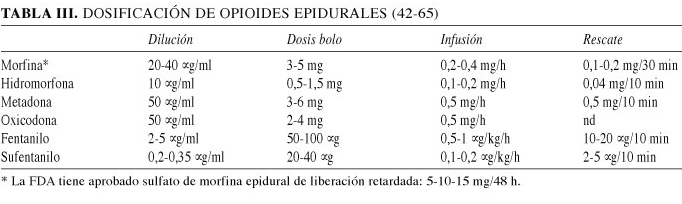
- La morfina ha sido el opioide epidural más utilizado y se podría considerar el "estándar de oro" de los fármacos espinales, ya que debido a su selectividad medular la dosis empleada epidural es mucho menor que la parenteral (1/5-1/10), con un máximo recomendado diario de 10 mg. Se puede administrar tanto en forma de bolos (30-100 μg/kg) como en infusión continua, ya que esta última parece inducir una mayor calidad analgésica, y como fármaco en solitario o junto a AL, ya que estos últimos potencian el efecto global analgésico mediante un efecto sinérgico (NEA). La preparación de 20 mg en 500 ml de fisiológico (40) para su administración en 48 h, nos ofrece la ventaja de conocer con gran facilidad los mg/día que recibirá el paciente al coincidir con los ml/h de la perfusión epidural (10 ml/h ↔ 9,6 mg/día). En pacientes ancianos o con factores de riesgo respiratorio es recomendable la dilución a la mitad, 20 μg/ml (10 mg en 500 ml), en la cual los mg/día serán la mitad de los ml/h programados en la bomba epidural.
A pesar de considerar la morfina epidural un fármaco eficaz en una vía de administración igual de eficaz, el uso como dosis única está limitado por la vida media efectiva inferior a 24 h, una corta duración en relación a la del dolor postoperatorio. Es por esto que en el año 2004 la FDA aprobó para uso epidural la morfina en forma liposomal retardada (MELR) con una vida media de 48 h tras inyección única, retrasando el pico de concentración en LCR hasta las 3 h, sin los problemas asociados con el catéter y con la expectativa de mejorar la tasa de fallo global cercana al 30% de la técnica continua epidural. Las recomendaciones básicas sobre su uso son su administración al menos 15 minutos tras la dosis test de AL epidural, y ningún fármaco más epidural durante 48 h, ya que la perfusión continua de un AL aumenta la liberación de morfina (43). Los efectos adversos son comparables a la morfina de liberación normal, encontrándose por encima del 10 % las náuseas y vómitos, el prurito, la sedación y la hipotensión, entre 1-10% la retención de orina y un riesgo de depresión respiratoria (máximo a las 16 h) hasta un 4% con dosis ≥ 20 mg y < 1% con dosis ≤ 15 mg, por lo que son estas últimas las presentaciones aprobadas para uso clínico. En un metaanálisis sobre el riesgo de depresión respiratoria comparado con morfina iv en analgesia controlada por el paciente (ACP), se estimó un odds ratio de 5,80 (IC 95% 1,05- 31,93 p = 0,04) para la utilización de MELR (44). Se está diseñando el mismo sistema para el fentanilo e hidromorfona y los ensayos clínicos con bupivacaína se encuentran en fase avanzada.
En una excelente revisión sobre 5 ensayos clínicos controlados (n = 913) que comparaban la ACP-iv asociada a placebo epidural, con un grupo de 5 mg de morfina epidural y con otro de MELR a diversas dosis (5 a 30 mg), se ha comprobado como este último grupo ha resultado el más eficaz en el control del dolor post-operatorio en artroplastia de rodilla, cirugía abdominal y cesárea, tras administración única epidural previa a la cirugía (analgesia preventiva). Se midieron el dolor en reposo y en movimiento en 10 ocasiones durante 48 h, los efectos adversos, así como el consumo de analgésicos de rescate y el grado de satisfacción de los pacientes. Los resultados demostraron 3 conclusiones significativas: a) todos los grupos con morfina epidural reflejaron un mayor grado de satisfacción en los pacientes a pesar de una mayor incidencia de efectos adversos, ya que los que describieron un nivel "excelente" o "muy bueno" utilizaron menos el rescate de ACP iv y puntuaron por debajo de la media en el grado de dolor; b) la morfina epidural conllevó un menor consumo de opioides de rescate iv que el grupo de placebo epidural y este efecto fue dosis dependiente. Respecto a la morfina de liberación normal esta diferencia fue mayor solo en las primeras 24 h. Por otro lado, el grupo de MELR 10 mg frente al de 5 mg de liberación normal, presentó un dolor en actividad menor tanto en el 1o como en el 2o día de postoperatorio, con un menor consumo de opioides iv de rescate, pero no una menor puntuación del dolor en reposo; y c) la utilización de morfina epidural produjo un mayor porcentaje de prurito, siendo este último moderado a severo en el 15 % de los pacientes, independientemente de la formulación de morfina administrada. No se encontraron diferencias significativas respecto a las náuseas y vómitos entre los diferentes grupos de tratamiento. Concluyeron que la asociación de morfina epidural a una pauta de ACP iv produce una analgesia de mayor calidad que esta última en solitario y que la formulación de MELR de 10 mg presenta ventajas respecto a la dosis de 5 mg de liberación normal, validando ambas para su uso clínico (45).
- La hidromorfona es una cetona hidrogenada de la morfina sintetizada en Alemania en 1921. Por vía epidural (10-20 μg/kg), presenta una relación equianalgésica de 1:2 frente a su administración parenteral y unavida media variable, estando comprendida entre 7,7 y 19,3 h, pudiendo prolongarse si se administra conjuntamente con adrenalina. Entre sus metabolitos, a diferencia de morfina, no se encuentra el 6-glucurónido, por lo que no existe efecto analgésico acumulativo en presencia de insuficiencia renal, aunque la hidromorfona-3-glucurónido tiene un efecto neuroexcitatorio 2,5 veces más potente en relación a su homónimo de la morfina, pudiendo causar náuseas y delirium (46). Partiendo del hecho comprobado de que la utilización epidural de AL y opioides produce una analgesia de mayor duración y mejor calidad que la administración parenteral de opioides en forma de ACP tras cirugía mayor, se ha preconizado el uso de AECP (analgesia epidural controlada por el paciente) con la finalidad de reducir la dosis global administrada, mejorar la satisfacción de los pacientes así como disminuir los efectos adversos como las náuseas y el bloqueo motor (47). La hidromorfona presenta varias ventajas en este sentido frente a morfina, ya que tiene una solubilidad intermedia (525), con un rápido inicio de acción (5-10 min), moderada duración de acción (vida media efectiva 4-6 h) y un mínimo riesgo de depresión respiratoria tardía, junto con una mayor potencia vía epidural (3:1 en infusión hasta 5:1 en bolos). La selectividad medular está demostrada, ya que en un estudio prospectivo en cirugía pélvica, comparando el uso de hidromorfona iv frente a este fármaco epidural en perfusión continua sin AL, se consiguió un similar alivio del dolor con la mitad de dosis en el grupo epidural (48). Un reciente estudio ha demostrado su efectividad en 3.736 pacientes tras cirugía ortopédica de EEII en combinación epidural a dosis de 10 μg/ml junto con bupivacaína 0,06%, programando una infusión basal de 4 ml/h y bolos de 4 ml cada 10 min, con un máximo horario de 20 ml (0,2 mg/h). Los efectos adversos fueron náuseas (30%), prurito (15%), hipotensión (10%) y sedación (0,08%), sin episodios de depresión respiratoria ni aparición de hematomas ni abscesos espinales (49). Para conseguir un uso rutinario de este fármaco vía epidural, estos resultados deberán ser corroborados en cirugía mayor toraco-abdominal ya que hasta la fecha los escasos trabajos publicados se restringen a cirugía pediátrica en forma de bolos o cirugía de abdomen inferior como prostatectomía o cesárea (50).
- La metadona es un opioide al cual se le atribuye una moderada actividad analgésica espinal, pero su larga vida media puede resultar en acumulación plasmática y presencia de efectos secundarios supraespinales. Su mecanismo de acción medular está mediado por el sistema opioide, serotoninérgico y noradrenérgico, así como posiblemente por su antagonismo NMDA. Se caracteriza por una potencia inferior a la de la morfina vía espinal y destaca la falta de paralelismo entre la duración de la actividad analgésica (4-8 h) y la de otras acciones como la depresión respiratoria, debido a su larga vida de eliminación (18 h tras dosis única o hasta 48 h en administración crónica). Esto es debido a su heterogénea distribución y fijación cerebral, su metabolismo por el citocromo P-450, así como a su acumulación y posterior liberación retardada desde su reservorio tisular y/o hepático. Sin embargo, no presenta metabolitos activos o tóxicos y tampoco se acumula en pacientes con insuficiencia renal. A pesar de ello, se ha comprobado, en un estudio doble ciego (n = 90) en pacientes sometidos a cirugía de abdomen o de extremidades inferiores, que la infusión continua epidural (3-6 mg bolo + 6-12 mg perfusión/24 h) alcanzó menores concentraciones plasmáticas que la administración en bolos epidurales (3-6 mg/8 h) con menor incidencia de miosis, sin efecto acumulativo y con similar buen control del dolor en los 2 grupos, durante los 3 días que duró el tratamiento (51). En otro estudio, la analgesia postoperatoria controlada por el paciente fue más efectiva con metadona epidural que por vía intravenosa tras cirugía torácica, consumiendo 18 mg/día epidural frente a 24 mg iv en 24 h (52).
- La oxicodona es un opioide semi-sintético derivado de la tebaína que fue introducido en la práctica clínica en 1917. Su estructura es similar a la morfina así como su liposolubilidad, pero se le ha atribuido un inicio de acción mas rápido debido en parte a su agonismo κ medular, añadido al ya conocido μ compartido con la morfina, aunque con una afinidad 10 veces menor. Su potencia analgésica parece depender de la vía de administración, ya que se le ha atribuido un rango 0,7-1,3 mayor que la morfina vía iv y a diferencia de su utilización subcutánea, intramuscular o rectal, la administración espinal presenta un efecto global analgésico variable, atribuyéndole incluso una potencia 14 veces menor que morfina vía intratecal en estudios animales. Existen pocos trabajos sobre su efecto analgésico postoperatorio vía epidural, pero se ha comprobado su eficacia tras cirugía abdominal a dosis de 0,15 mg/kg en bolo seguidos de 0,03 mg/kg/h, con un ratio respecto a morfina epidural de 1/9,8 (potencia 10 veces inferior) (53). Asimismo, en un estudio doble ciego, prospectivo y randomizado sobre 75 pacientes tras cirugía abdominal ginecológica, se compararon 2 grupos de oxicodona (2 mg + 6 mg/día y 4 mg +12 mg/día) con uno de control de 2 mg + 6 mg/día de morfina, todos mantenidos en infusión continua epidural durante 72 h. La EVA en reposo del grupo de oxicodona 6 mg fue mayor que el de morfina tanto a las 6 h (p = 0,01) como a las 24 h (p = 0,004) y significativamente mayor que el grupo de oxicodona 12 mg a las 24 h (p = 0,002). La incidencia de náuseas, vómitos y prurito fue menor en ambos grupos de oxicodona, sin ningún episodio de depresión respiratoria. No hubo diferencias entre los 3 grupos en la valoración del dolor frente a la tos, ni en el índice de satisfacción de los pacientes. Concluyeron por tanto, que la oxicodona es igual de efectiva que la morfina epidural, cuando se administra al doble de dosis, con menos efectos adversos pero con una mayor variabilidad individual (54).
- El fentanilo es el opioide lipofílico del que se han publicado más estudios tras su administración epidural con resultados contradictorios acerca de su selectividad medular (NEC). El motivo de la controversia parece tener visos de solucionarse tras la publicación por parte de Ginosar y cols. (55) de un estudio doble ciego y cruzado en voluntarios sanos para comprobar su hipótesis de trabajo, en la cual se produciría analgesia sistémica tras la administración epidural de fentanilo en perfusión continua (30 μg/h a 10 ml/h durante 210 min seguidos de 10 μg/h durante otros 200 min), mientras que la administración epidural en bolos lo haría de manera selectiva medular (30 μg seguidos de 100 μg 210 min después). A los 410 min se administró 0,4 mg de naloxona iv, para comprobar que la analgesia estaba mediada por el opioide y al finalizar el tiempo de observación, se administraron 5 ml de lidocaína al 1,5% con vasoconstrictor para comprobar la correcta colocación del catéter epidural. Se estudió la respuesta al dolor tras estímulos eléctricos y calor en 2 territorios, cabeza (supramedular) y pierna (medular), y se midieron las concentraciones plasmáticas de fentanilo, que solo superaron su concentración analgésica efectiva mínima, CAEM (0,63 ng/ml), tras la infusión continua a dosis altas. Encontraron una relación lineal entre la analgesia y la concentración plasmática de fentanilo en el modo de infusión continua epidural pero no para el modo de bolos epidurales. Esto coincidía mayoritariamente con la revisión que hicieron de los estudios publicados con anterioridad y se explicaba por la mayor cantidad de fármaco que alcanzaba la biofase medular en el grupo de bolos. Se ha sugerido que este efecto es debido al gradiente de concentración alcanzado entre el espacio epidural y el intratecal tras la administración en bolos y no en perfusión continua. Parece que el modelo correcto podría ser bifásico, en el cual la acción inicial supramedular se debería a la absorción plasmática desde el espacio epidural y posteriormente la administración en perfusión continua epidural tendría un efecto predominante también central, en contraposición a los bolos epidurales con un efecto mayormente medular. La cifra más baja a partir de la cual el fentanilo produciría analgesia medular se ha estimado en 10 μg/ml, por lo que si en la práctica habitual lo asociamos a un anestésico local en perfusión continua a dosis de 2-5 μg/ml, lo que conseguiremos será una potenciación de su efecto analgésico disminuyendo la dosis de AL, con un probable efecto sistémico y por lo tanto de carácter aditivo y no sinérgico medular (56). Autores como Tan y cols. (57), en un ensayo clínico controlado sobre dolor post-toracotomía, estudiaron la concentración óptima de fentanilo asociada a bupivacaína 0.1% epidural, y concluyeron que la dosis de 5 μg/ml conseguía el balance más equilibrado entre el control del dolor y los efectos adversos frente a 2 y 10 μg/ml, pero no hay que menospreciar que la dosis administrada de fentanilo en una infusión epidural continua a 10 ml/h llega a ser de 50 μg/h.
- Se sugirió que debido a su gran liposulubilidad, el sufentanilo sería una buena opción para su utilización epidural en el tratamiento del dolor postoperatorio. Sin embargo este uso sugiere un efecto analgésico mediado por recaptación vascular y posterior redistribución cerebral, ya que su CAEM tan baja (0,03 ng/ml) es alcanzada fácilmente en plasma tras su administración espinal (42). Para comprobar esta hipótesis, Miguel y cols. (58) realizaron un estudio prospectivo doble ciego y aleatorizado tras cirugía abdominal baja, comparando sufentanilo intravenoso y epidural torácico bajo durante 48 h, y no encontraron ninguna diferencia entre los dos grupos observados, ni en la puntuación del dolor, número de rescates de morfina, ni en efectos adversos como las náuseas, ni lo más importante, en las concentraciones plasmáticas del fármaco que fueron prácticamente idénticas a partir de la primera hora de infusión. Concluyeron que el mecanismo analgésico era el mismo en ambas vías de administración. A pesar de ello, se utiliza ampliamente como adyuvante de los AL epidurales, especialmente en obstetricia (59), con una potencia mayor que fentanilo en un ratio máximo de 6:1 ya que mejora la analgesia y permite disminuir la dosis de AL y por lo tanto el bloqueo motor.
- La utilización epidural de alfentanilo no redunda en una buena efectividad clínica cuando es depositado en el espacio epidural, debido a que es muy permeable en todo tipo de tejidos (coeficiente de permeabilidad meníngea de 2,3), es aclarado muy rápidamente hacia el plasma desde el espacio epidural y la médula espinal, por lo que la analgesia se produce por redistribución sistémica al SNC. Coda y cols. (60) realizaron un estudio usando un modelo experimental de la percepción del dolor sobre la mano o el pie, como prueba del efecto metamérico o sistémico, tras la administración de alfentanilo epidural (400 μg bolo + 400 μg/h durante 2 h) o intravenosa (infusión controlada por ordenador según parámetros farmacocinéticos preestablecidos) divididos en 2 test individuales, en 2 días diferentes. No hubo diferencias en las curvas de concentración plasmática, en el territorio estudiado ni en los efectos secundarios. Concluyeron que el efecto analgésico se producía mayoritariamente tras su redistribución plasmática desde el espacio epidural. Van der Nieuwenhuyzen y cols. (61) realizaron otro estudio sobre dolor postoperatorio tras laparotomía sobre 32 pacientes, todos con infusiones de bupivacaína 0,125% epidural, comparando 2 grupos (alfentanilo intravenoso o epidural, ambos a 0,36 mg/h), alcanzando unas concentraciones plasmáticas similares (< 20 ng/ml) y sin encontrar diferencias entre ninguno de los parámetros estudiados incluido el consumo de morfina de rescate. Concluyeron que no les fue posible demostrar un efecto espinal de este opioide.
- La buprenorfina es un agonista parcial lipofílico con una mayor afinidad sobre los receptores específicos opioides y mayor potencia tras su administración sistémica que morfina. Su unión a dichos receptores es rápida (100% 30 min) pero con una velocidad de disociación lenta (T½ = 166 min) e incompleta. Tras su administración epidural se alcanzan concentraciones máximas similares tanto plasmáticas como en LCR, a los 10 y 30 min respectivamente, y por lo tanto puede causar depresión respiratoria precoz. Su uso no está muy extendido debido a que no existen estudios que demuestren una clara selectividad medular, ya que comparando dosis de 2 y 4 μg/kg tanto vía epidural como iv, se comprobó un efecto clínico mayoritariamente supraespinal de 2-6 h de duración, y únicamente se sugirió un posible limitado efecto medular dosis dependiente (62). Su mejor perfil de efectos adversos ha mantenido su utilización clínica, especialmente en países asiáticos, y se ha comprobado su efectividad vía epidural a dosis de 200 μg inyectados 2 niveles cefálicos por encima de la incisión quirúrgica tras cirugía de columna lumbar en pacientes sometidos a anestesia general (63), así como en cesáreas a dosis de 300 μg vía epidural, encontrándose la misma calidad analgésica y por lo tanto equipotente a la dosis de 150 μg intradural (64).
- El tramadol se ha utilizado por esta vía con el propósito de disminuir los efectos adversos de los opioides mayores, pero a dosis similares a las utilizadas vía iv (1-2 mg/kg) debido a su baja selectividad medular, pero aprovechando su mecanismo de acción no opioide, como es la inhibición de la recaptación de serotonina y noradrenalina. Tras cirugía torácica, se ha comprobado como 100 mg mostraban una eficacia similar a 4 mg de morfina, ambos administrados en el espacio epidural lumbar en dosis repetidas (2 dosis/12h), con una duración menor para tramadol (p = 0,01), con un menor índice de efectos secundarios, como sedación y disminución de la presión arterial de oxígeno (65).
En resumen, la administración de un opioide hidrofílico como morfina, especialmente en infusión continua o de liberación retardada epidural, redunda en una analgesia postoperatoria de gran calidad y duración pero a expensas de una mayor incidencia de efectos adversos. Los opioides lipofílicos como fentanilo y sufentanilo producen su efecto analgésico mayormente por recaptación sistémica y su administración en solitario no ofrece ventajas frente a la vía parenteral. No obstante, su asociación a AL consigue una potenciación del efecto analgésico, disminuyendo la dosis total de cada uno de los fármacos así como sus efectos adversos (66).
Las características de los opioides más utilizados vía epidural están resumidas en la tabla II, y su dosificación en la tabla III.
Opioides intradurales
La distribución opioide tras su administración espinal es compleja y sigue un patrón multicompartamental. Un fármaco depositado intratecal realiza, simultáneamente un desplazamiento cefálico en el LCR, una difusión medular uniéndose a receptores no específicos en la sustancia blanca así como específicos en la sustancia gris y un aclaramiento hacia el espacio epidural, fijándose a la grasa de dicho espacio, redistribuyéndose hacia el plasma por recaptación vascular desde estos dos últimos compartimentos. Las características clínicas de cada opioide serán la consecuencia de la suma de todos estos movimientos, que marcarán la biodisponibilidad y su efecto medular (67).
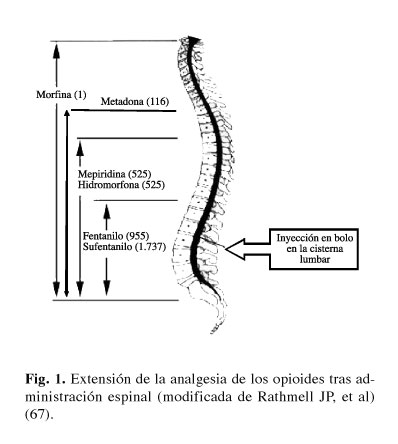
Los opioides lipofílicos como fentanilo y sufentanilo, atraviesan rápidamente la barrera meníngea, sufren un importante secuestro en la grasa epidural y una gran recaptación vasculary se unen por igual a los receptores de la sustancia blanca y gris medular. Clínicamente esto redunda en un tiempo de latencia corto, una difusión rostral limitada y por lo tanto una banda analgésica espinal circunscrita al lugar de inyección, una duración de acción corta y la posibilidad de producir depresión respiratoria precoz debido a su difusión sanguínea. Los opioides hidrofílicos como morfina, atraviesan más lentamente las meninges, se unen en menor medida a la grasa epidural y de manera más fuerte a los receptores específicos de la sustancia gris, sufren una reabsorción plasmática lenta, manteniendo concentraciones mayores y por más tiempo en el LCR. Esto conlleva un inicio de acción lento, una extensión analgésica espinal muy amplia y de mayor duración junto con una posibilidad de depresión respiratoria tardía (Fig. 1).
La mejor evidencia clínica de lo expuesto anteriormente, es la disminución de la potencia relativa entre los opioides respecto a su vía de administración. Una inyección intravenosa de 10 mg de morfina equivaldrían a 10 μg de sufentanilo iv. Sin embargo, para conseguir esta misma equipotencia vía intradural nos bastarían solo 100 μg de morfina, por lo que se deduce que el sufentanilo ha perdido 100 veces de potencia vía espinal debido a la baja dosis de fármaco que alcanzaría su biofase medular (42).
- La morfina intratecal sin AL suele ser utilizada junto a anestesia general para prevenir el dolor tras cirugía mayor. En un metaanálisis (68), se incluyeron 27 estudios (15 cirugía cardio-torácica, 9 abdominal y 3 de columna) sobre 645 pacientes que recibieron dosis entre 100 y 4.000 μg, y se comprobó cómo la EVA en reposo fue 2 cm menor a las 4 h y 1cm menor a las 12 y 24 h, en una escala sobre 10 cm en el grupo de morfina intratecal, y este efecto fue más pronunciado frente al movimiento, ya que la mejoría se mantuvo en 2 cm durante todo el tiempo de control. Esta reducción de la puntuación EVA fue manifiestamente superior a otras técnicas analgésicas como la administración de dosis bajas de ketamina iv (reducción 0,4 cm), o una pauta de AINE postoperatoria (reducción de 1 cm) e incluso la técnica epidural continua (reducción 1 cm), tal y como habían definido los mismos autores con anterioridad (69). Los requerimientos de opioides intra y postoperatorios hasta 48 h fueron menores en el grupo de la morfina intratecal, y el consumo de morfina a las 24 h fue significativamente menor en el grupo de cirugía abdominal (-24,2 mg: IC-29,5 a -19) frente al grupo de cirugía cardiotorácica (-9,7 mg: IC-17,6 a -1,80). Esta pobre mejoría en el 2o grupo hace cuestionable el uso de morfina intratecal en cirugía torácica ya que el efecto ahorrador de morfina iv puede ser alcanzado con otras estrategias, como la ketamina intraoperatoria (-16 mg/24 h), AINE postoperatorios (-10 a 20 mg/24 h) o incluso 4 mg iv de paracetamol pueden ahorrar hasta 8 mg de morfina en el 1o día del postoperatorio (70). Los efectos adversos sí fueron más frecuentes en el grupo de morfina intratecal con un odds ratio (OR) de 7,8 para la depresión respiratoria, OR 3,8 para el prurito, y OR 2,3 para la retención de orina, aunque curiosamente no hubo una mayor incidencia de náuseas o vómitos. Finalmente, concluyeron que no encontraron una relación lineal entre la dosis administrada y el grado de analgesia alcanzado, ni tampoco en ninguno de los efectos deletéreos, por lo que no pudieron recomendar una dosis efectiva mínima. No hubo beneficio estadístico sobre la aparición de complicaciones pulmonares, pero sí en los días de estancia hospitalaria (12 h menor para el grupo de morfina intratecal), aunque este último dato es probable que no sea clínicamente muy significativo.
Sin embargo, en un metaanálisis más reciente (71) realizado sobre estudios de anestesias raquídeas con morfina como coadyuvante de un AL sin anestesia general, una práctica más habitual entre los anestesiólogos, se analizó la frecuencia de los efectos adversos de morfina intradural (n = 790) frente a placebo (n = 524), y sí se observó una relación entre la dosis y la aparición de estos últimos. El grupo de morfina a dosis bajas, M < 0,3 mg, presentó un mayor riesgo relativo (RR) de náuseas 1,4 (IC 1,1-1,7), de vómitos RR 3,1 (IC 1,5-6,4), y prurito RR 1,8 (IC 1,4-2,2), y el grupo de dosis altas, M ≥ 0,3 mg, una mayor incidencia de prurito RR 5,0 (IC 2,9-8,6) con similares valores para el resto de parámetros, siempre comparados con el grupo placebo. Asimismo, el grupo de dosis altas presentó mayor numero de episodios de depresión respiratoria (7/80) que el de dosis bajas (2/247), concluyendo que el uso de morfina intratecal a dosis < 0,3 mg, aunque se asociaba a un moderado aumento de efectos secundarios, era una dosis segura, al no encontrar más episodios de depresión respiratoria que en el grupo placebo a los que se administraron opioides sistémicos. Los mismos autores, en un estudio muticéntrico sobre 188 pacientes sometidos a cirugía ortopédica, comprobaron cómo el grupo de 200 μg de morfina intratecal redujo significativamente el consumo de opioides de rescate comparado con el de 100 μg (p < 0,05) y ambos grupos respecto a placebo durante 72 h (p < 0,0001). La administración de morfina intratecal no se asoció a un aumento de los episodios de depresión respiratoria pero sí a un gran número de pacientes sin necesidad de rescates durante 48 h (70% en el grupo de M 200 μg) (72).
En una excelente revisión de Rathmell y cols. (67) sobre la utilización de fármacos intratecales en el tratamiento del dolor agudo, también se recomendaba una dosis efectiva máxima de morfina a partir de la cual los efectos negativos parecen superar a los beneficiosos; tras dosis > 300 μg suelen aparecer tanto náuseas y picor, como retención urinaria en grado severo, y en estudios en voluntarios sanos, todos presentaron depresión respiratoria, al superar los 600 μg. Asimismo, resumieron una dosis demandada en relación a la intensidad del proceso quirúrgico (Tabla IV), oscilando entre 50-100 μg para resección de próstata o cesárea, hasta 500 μg tras cirugía mayor abdominal o cardiaca, aunque en estos últimos casos su efectividad real ya ha sido discutida con anterioridad en el presente texto.
Con el fin de disminuir el riesgo de depresión respiratoria, la naloxona ha sido utilizada con éxito de modo profiláctico en pacientes que recibieron altas dosis de opioides intratecales para control del dolor postoperatorio. En un estudio retrospectivo realizado en mujeres sometidas a cirugía mayor pélvica bajo anestesia general, se comprobó como el grupo al que se le administró morfina intratecal (1,1 ± 0,2 mg) junto con fentanilo (49 ± 6 μg), al que se le añadió una perfusión iv postoperatoria de naloxona (5 μg/kg/h durante 22 h), presentó un menor grado de sedación que el grupo control de opioides iv, con una deambulación óptima a las 12 h en todos los casos. Asimismo, la EVA fue menor en el grupo de morfina intratecal durante las 48 h del estudio (p < 0,05), así como el consumo de morfina iv de rescate (6,8 ± 10,2 mg en el grupo intratecal vs. 76,1 ± 44,4 mg en el grupo iv, p < 0,05). (73).
A pesar de todo, el uso de morfina intratecal no ha demostrado un beneficio a largo plazo en términos como la reducción de las complicaciones respiratorias, cardiovasculares o renales, en comparación con el uso de opioides parenterales. Hay que recordar que no es recomendable su uso en cirugía ambulatoria y que la FDA Norteamericana solo tiene aprobado para utilización intratecal la formulación libre de aditivos (74).
- La hidromorfona ha sido utilizada como alternativa a la morfina en gran número de pacientes, especialmente oncológicos, tanto en el contexto del dolor agudo como crónico, demostrando una buena eficacia con un similar perfil de efectos adversos (75). La vía intratecal en el dolor postoperatorio es quizás la menos utilizada siendo escasos los estudios publicados, como el de Drakeford y cols. sobre 60 pacientes sometidos a cirugía de cadera, que recibieron 500 μg de morfina, 2 μg/kg de hidromorfona o suero salino intradural, encontrando unos resultados similares entre los 2 opioides (76). Los limitados datos clínicos sugieren que para conseguir una buena analgesia vía espinal son necesarias dosis muy inferiores a las utilizadas vía sistémica, así como ocurre con la morfina, y que la administración de 50-100 μg de hidromorfona intradural producen una analgesia similar a 100-200 μg de morfina con los mismos efectos adversos y duración clínica (67).
- Existen pocos trabajos sobre metadona intradural ya que parece que no ofrece grandes ventajas frente a la morfina. En un estudio sobre cirugía urológica y traumatológica, Jacobson y cols. (77), compararon la dosis de 1 mg de metadona con morfina 0,5 y 1 mg intradural, y se encontraron valores de EVA superiores en el grupo de metadona (p < 0,05), así como un mayor tiempo al 1o rescate (6,5 h vs. 24 h y 29 h) para los dos grupos de morfina (p < 0,05). Solo se detectaron episodios de depresión respiratoria en el grupo de 1 mg de morfina intratecal. Hubo una mayor incidencia de prurito facial, náuseas y vómitos en ambos grupos de morfina. Concluyeron que 1 mg de metadona es muy inferior a la misma dosis de morfina intradural. Ante estos desalentadores resultados (78), el mismo grupo de trabajo diseñó un nuevo estudio en pacientes sometidos a sustitución de cadera o rodilla y compararon la ya conocida como efectiva dosis de 0,5 mg de morfina intratecal con dosis de 5, 10 y 20 mg de metadona por la misma vía. Todos los grupos de metadona presentaron puntuaciones EVA mayores que morfina (p < 0,05) con una sorprendentemente corta vida media efectiva de 4-6 h. También presentaron un tiempo al primer rescate menor y similar para las tres dosis de metadona (6,25 h, 6,2 h y 6 h para 5, 10 y 20 mg respectivamente, con una p < 0,05). Solo hubo 3 episodios de depresión respiratoria en el grupo de 20 mg (n = 8) y un mayor grado de sedación y picor facial con las dosis más altas de metadona. El resto de efectos fueron similares entre los grupos. Concluyeron que las dosis de 10 y 20 mg de metadona no son recomendables para su aplicación clínica, por su mayor número de efectos adversos centrales por probable difusión rostral vía LCR, y que presentan una vida media efectiva similar a la dosis baja de 5 mg, que sí produce una analgesia de buena calidad, pero inferior a morfina en intensidad y duración.
- La diamorfina, un derivado purificado de la heroína (diacetilmorfina), se considera un pro-fármaco que carece de actividad opioide intrínseca, pero que al ser metabolizado por esterasas, se transforma en los principios activos 6-acetilmorfina y morfina, que actúan sobre los receptores medulares específicos. En contraposición al resto de los países, es el opioide más utilizado vía intratecal en el Reino Unido. En una reciente encuesta, el 78,2% de los servicios de anestesia lo utilizaban con asiduidad, seguido de fentanilo con un porcentaje del 74,1% y morfina con un 21,3%. Las dosis reflejadas fueron 0,2-0,5 mg, 12,5-25 μg y 0,1-0,5 mg respectivamente (79). Este uso está sustentado en unas potenciales ventajas del fármaco respecto a morfina debido a una mayor liposolubilidad (coeficiente octanol/agua de 280 frente a 1,4 para morfina), lo que le otorgaría una mayor rapidez de acción y una menor vida media clínica junto con un mejor perfil de efectos adversos. Se ha comprobado una eficacia similar a morfina tras cesárea (80) y se ha establecido en esta misma cirugía la dosis eficaz para alcanzar una efectividad en el 95% de los casos (DE95) en 0,4 mg (p = 0,003), asociada a 12,5 mg de bupivacaína hiperbárica, con menor número de suplementos de opioides sistémicos, así como un mayor tiempo de duración clínica hasta el primer rescate (601 min), respecto a dosis menores (446 min/0,2 mg, 489 min/0,3 mg). Las náuseas, vómitos y el prurito son los efectos secundarios más frecuentes y fueron también dosis dependientes (81).
- La meperidina es un fármaco opioide con conocidas propiedades como AL, y de hecho se ha comunicado su efectividad en cirugía perineal y de extremidades inferiores como agente intradural único en comparación con bupivacaína (82). En un estudio sobre población africana, la duración del bloqueo sensitivo demostró ser dosis dependiente, ya que tras una dosis de 1,5 mg/kg fue de 112 ± 19 min en comparación con la dosis de 1,2 mg/kg que fue de 79 ± 27 min; el efecto adverso más frecuente fue la hipotensión (30%), seguido de náuseas y vómitos (83). Su uso asociado a AL no está muy extendido y se limita a cirugía urológica, cesárea y analgesia en el parto a dosis de 10-25 mg intratecal (0,2-0,3 mg/kg) a expensas de una mayor incidencia de náuseas, pero con un posible efecto protector frente a los temblores, aunque este último punto está en controversia (84).
- Los opioides más lipofilicos como fentanilo y sufentanilo son los más estudiados y utilizados por vía intradural en el contexto del dolor postoperatorio debido a su rápido inicio de acción (10-15 min) y su corta duración (2-5 h). Las ventajas de estos fármacos también han sido bien definidas en el área obstétrica como analgésicos durante el trabajo del parto, en el expulsivo o en la cesárea, atribuyendo al sufentanilo una potencia 4,5 veces superior en este ámbito. Se han recomendado dosis de 20-30 μg de fentanilo o 5-7,5 μg de sufentanilo asociadas a bupivacaína con el fin de mejorar la latencia, la analgesia intra y postoperatoria inicial, así como disminuir las náuseas y los vómitos durante la cirugía de cesárea. Los estudios más recientes se han centrado en demostrar el beneficio de la asociación de opioides lipofilicos a los AL en cirugía ambulatoria. De esta manera, la asociación de fentanilo o sufentanilo a bupivacaína o lidocaína conduce a un acortamiento de la instauración del bloqueo y una mejora de la analgesia intraoperatoria y de las primeras horas del postoperatorio sin prolongar el bloqueo motor o alargar el tiempo hasta el alta (85).
La utilización de dosis bajas intradurales de AL puede acortar el tiempo de recuperación así como limitar la extensión del bloqueo, aunque puede comprometer un adecuado nivel sensitivo para la cirugía. La asociación de 20-25 μg de fentanilo a 4 mg de bupivacaína ha demostrado su eficacia en mejorar el bloqueo sensitivo con menores repercusiones cardiovasculares en el paciente anciano, así como 5 μg de sufentanilo añadidos a 7,5 mg de bupivacaína, ambos tras cirugía de fractura de cadera (86,87). Tras resección uretral de próstata en pacientes ancianos, se ha corroborado cómo la asociación de 4 mg de bupivacaína intradural a estas mismas dosis de opioides redundó en una gran calidad analgésica con pocos efectos adversos. El grupo de 5 μg de sufentanilo presentó un nivel sensitivo más alto así como un menor consumo de analgésicos (p = 0,049) y mayor tiempo al primer rescate (p = 0,008) que el grupo de 25 μg de fentanilo. Los autores justifican estos resultados debido a una posible diferente baricidad de la mezcla con sufentanilo, una mayor afinidad de este último por los receptores opioides, así como por la variabilidad interpersonal en el volumen del LCR (88). Estos resultados son concordantes con otros estudios que afirman que existe un sinergismo entre opioides y AL cuando se utilizan dosis subterapéuticas de estos últimos, mejorando la analgesia somática sin afectar al nivel de bloqueo simpático o motor. Dos trabajos independientes (89,90) han revelado que la dosis efectiva media (DE50) de sufentanilo y fentanilo intratecal se corresponde con 2,6 y 14 mg respectivamente, y aplicando la equivalencia entre ellos comentada con anterioridad (91), las dosis recomendadas equipotentes para su aplicación clínica en cirugía serían 25 μg de fentanilo y 5 μg de sufentanilo.
Repercusión clínica de la densidad de las mezclas anestésicas con opioides
La relación entre la densidad del anestésico local y del LCR, conocida como baricidad, es uno de los determinantes más importantes de la distribución de los fármacos dentro del espacio subaracnoideo, junto con la velocidad de inyección y la posición del paciente. La densidad se define como el peso por unidad de volumen (g/ml) de una solución a determinada temperatura y no es uniforme para el LCR, ya que puede variar en relación a la edad, sexo (> varones), embarazo, menopausia o determinadas enfermedades. La temperatura del LCR es siempre la misma del cuerpo humano (± 37 oC) pero la mayoría de las soluciones administradas se encuentran a una temperatura ambiente de quirófano de 21 oC, por lo que deberán equilibrarse con la del LCR antes de ejercer su acción espinal. Con el objetivo de predecir la difusión final de los AL y/o opioides se debería determinar su baricidad en solitario y en forma de mezcla a una temperatura similar a la corporal. Por definición, cuando la baricidad de una solución es 1,0000 se define como isobárica, siendo por encima de este valor hiperbárica e hipobárica por debajo de él. Sin embargo, algunos autores, necesitando para ello aparatos de medida más precisos, han sugerido que sean consideradas hiperbáricas aquellas soluciones que excedan del límite alto del intervalo de confianza de la baricidad de LCR (1,00059 ± 0,00040 g/ml) e hipobáricas por debajo de su límite inferior.
En un preciso estudio (92) se determinó la baricidad de diferentes AL a 5 oC, 20 oC, 30 oC y 37 oC. Se comprobó la disminución de la densidad en relación con el aumento de temperatura y, estableciendo una curva logarítmica, se definió la temperatura ideal de inyección para la cual los AL se comportarían como isobaricos a temperatura corporal, con los siguientes resultados: bupivacaína 5 mg/ml y ropivacaía 5 mg/ml (35,1 oC), L-bupivacaína 5 mg/ml (37 oC), articaína 20 mg/ml (39 oC). En otro estudio, se compararon (93) fármacos para uso intradural sin contenido de glucosa y se comprobó de nuevo cómo la densidad era inversamente proporcional a la temperatura, disminuyendo la densidad cuando esta última se acercaba a la corporal, ya que cambios en la temperatura de + 0,20 oC implicaban una disminución en la densidad de -0,00007 g/ml. Asimismo, se observó que todas las muestras, a excepción de la lidocaína al 2 y 1,5% con adrenalina que resultaron hiperbáricas, se comportaron como hipobaras, incluyendo los opioides en solitario o en combinación con AL o entre ellos diluídos con suero fisiológico a dosis de uso clínico habitual (morfina 250 μg, fentanilo 2,5-25 μg, sufentanilo 3,3-12,5 μg). De la misma manera, en otro trabajo brasileño (94) utilizando un densitómetro de última generación (DM-4500) que utiliza la técnica de oscilación mecánica por resonancia con una precisión de 0,00001 g/ml, se midieron las densidades de los diversos AL y coadyuvantes más utilizados en la anestesia raquídea. Se obtuvo la densidad y sus variaciones con la temperatura de todos los AL y de sus combinaciones con opioides a 20 oC, 25 oC y 37 oC. Los resultados fueron concluyentes, ya que ambos grupos mostraron una reducción de la densidad al aumentar la temperatura, pero sin embargo hubo pocos cambios en la baricidad, ya que a 37 oC, todas las soluciones que contenían glucosa se mantuvieron hiperbáricas en solitario y en sus respectivas mezclas y a su vez aquellas sin glucosa se comportaron como hipobaras. Las densidades de los opioides (morfina 100 μg, fentanilo 20 μg, sufentanilo 5 μg) y clonidina (30 μg), fármacos isobáricos a temperatura ambiente, fueron hipobáricos a 37 oC, y cuando se añadieron a los AL, redujeron la densidad de la nueva solución haciéndola ligeramente más hipobárica pero sin presentar ningún efecto significativo en la practica clínica. Finalmente, al mezclar el AL hiperbárico (glucosa al 8%) con su misma formulación isobárica en volúmenes iguales, mantuvo en su estado final (glucosa al 4%) su condición de hiperbara.
En una reciente publicación (95), se han estudiado las diversas concentraciones de los fármacos comúnmente utilizados en infusión intratecal en el ámbito del dolor crónico, como son morfina (1,10,25,50 mg/ml), bupivacaína (2,5, 5, 10, 20 mg/ml), clonidina (0,05, 0,5, 1,3 mg/ml) y baclofeno (1, 1,5, 2, 4 mg/ml), todas a 37 oC ± 0,01. Estas 2 últimas se mostraron hipobáricas en todas las presentaciones. Sin embargo, la morfina (M) y la bupivacaína (B) fueron hiperbáricas a concentraciones altas (M > 8 mg/ml y B > 12 mg/ml) e hipobaricas a concentraciones bajas (M < 4 mg/ml y B < 7 mg/ml), definiendo una relación lineal entre densidad y concentración (r2 > 0,99), afirmando que la concentración afecta a la baricidad y sugiriendo, por lo tanto, que afecta también a la difusión final del fármaco.
Recomendaciones sobre la vigilancia en pacientes que reciben opioides neuraxiales
El nivel de vigilancia postanestésica de los pacientes que han recibido opioides espinales ha constituido un tema de debate desde 1982, cuando Morgan (96) llegó a la conclusión de que el uso de opioides epidurales e intratecales era impracticable en la mayoría de los pacientes, debido al alto nivel de monitorización postoperatoria necesario, por lo que en 1989 recomendó que todos aquellos que recibieran este tipo de analgesia fueran monitorizados en una sala de recuperación postquirúrgica durante 24 h. En aquellos tiempos el fármaco más utilizado era la morfina intradural a dosis altas (> 1 mg) y el riesgo de depresión respiratoria se estimaba en porcentajes tan altos como del 4-7%. Posteriormente, se fueron disminuyendo las dosis, introduciendo nuevos opioides y definiendo otros factores de riesgo como la edad avanzada, el uso concomitante de otros fármacos depresores vía sistémica (opioides o benzodiacepinas), enfermedades sistémicas como la obesidad, diabetes mellitus o el síndrome. de apnea del sueño, así como los pacientes no habituados a opioides (97). La hipermagnesemia secundaria al tratamiento con sulfato de magnesio en la paciente gestante con preeclamsia, es también un factor potenciador de la sedación de los opioides espinales (98). Todo esto conllevó a una disminución del índice de depresión respiratoria, que llegó a calcularse en un 0,03-0,36%, menor que el estimado para la administración intramuscular (0,9%) o intravenosa en forma de ACP (1,2%). La Sociedad Sueca de Anestesiología publicó en 1992 una guía práctica de vigilancia en la que flexibilizaba las directrices anteriores y permitía el cuidado por la enfermería de la planta de hospitalización, siempre que este personal estuviera entrenado en su manejo, basado en unas guías impresas sobre las potenciales complicaciones a tratar, se hubieran utilizados dosis apropiadas en pacientes seleccionados y se comprobaran la frecuencia respiratoria y el nivel de conciencia cada hora durante las primeras 12 h (79). Este tiempo de vigilancia se definió tras la revisión de pacientes en los que la depresión respiratoria tras morfina espinal aconteció durante este periodo, con un pico a las 6 h, y la comprobación de que en el caso de los opioides lipofílicos, como fentanilo o sufentanilo, este periodo se limitaba a los primeros 30 min. La Sociedad Europea de Anestesia Regional (ESRA) (99) realizó unas recomendaciones similares en relación al uso de opioides epidurales en 1997. La implantación de las unidades de dolor agudo (UDA) contribuyó al aumento del manejo de estos pacientes en planta bajo las directrices de personal especializado, mayoritariamente de enfermería, y de hecho, en 1998 se publicó una encuesta sobre prácticas hospitalarias en 17 países, que reveló que en el 60% de hospitales estos pacientes eran controlados por la enfermería en planta, e incluso en los casos de grado ASA III-IV, en un 26% de hospitales europeos y en un 40% del Reino Unido (100).
Sin embargo, las más recientes recomendaciones provenientes de la Sociedad Americana de Anestesiología (ASA) (101), que resumiremos a continuación, adoptadas en el año 2007 y recién actualizadas en 2009, son de nuevo mucho más restrictivas, haciendo realmente difícil su total cumplimiento en nuestro ámbito sanitario.
Identificación de pacientes de riesgo de depresión respiratoria
- Historia clínica para determinar enfermedades coexistentes.
- Exploración física exhaustiva.
Prevención de la depresión respiratoria
- En el paciente con síndrome de apnea del sueño debe traer al hospital su equipo de ventilación no invasiva.
- Selección del fármaco:
• La inyección única de un opioide espinal es segura en vez de su administración parenteral sin alterar el riesgo de depresión respiratoria o hipoxemia.
• Fentanilo o sufentanilo son alternativas seguras a morfina en inyección única.
• La morfina de liberación retardada puede ser usada como alternativa a la vía intravenosa o epidural en dosis única, pero requiere una mayor vigilancia.
• Los opioides epidurales en infusión continua son una mejor alternativa a su administración parenteral, con el fin de disminuir el riesgo de depresión respiratoria.
• La infusión epidural continua de fentanilo o sufentanilo puede ser utilizada como alternativa a morfina o hidromorfona, sin aumentar el riesgo de depresión respiratoria.
• La morfina o hidromorfona espinal no deben utilizarse en pacientes ambulatorios.
• Adecuar el tiempo de vigilancia a la farmacodinamia del opioide.
-Selección de la dosis:
• Elegir la dosis mínima eficaz.
• Otros fármacos opioides o sedantes vía parenteral deben ser administrados con cautela.
• La co-administración de opioides espinales y fármacos parenterales como otros opioides, sedantes, hipnóticos o magnesio, requiere una mayor monitorización en intensidad, duración o con métodos adicionales.
Detección de la depresión respiratoria
-Definición:
• Frecuencia respiratoria < 10-12 /min.
• Saturación arterial de oxígeno < 90-92%.
• Hipercapnia o hipercarbia > 50 mmHg.
• Otros: bajo volumen corriente, sedación, apneas periódicas o cianosis.
-Monitorización respiratoria en todos pacientes:
• Ventilación adecuada sin interrumpir el sueño del paciente (frecuencia respiratoria y profundidad de la respiración).
• Oxigenación (pulsioximetria si fuera necesario).
• Nivel de conciencia.
-Opiodes lipofílicos (fentanilo) en inyección única:
• Monitorización mínima de 2 h tras su administración.
• Inicialmente la monitorización debe ser continua durante los primeros 20 min, seguida de 1 vez cada hora hasta que hayan pasado las 2 primeras horas.
• Tras 2 h la monitorización dependerá de las condiciones generales del paciente, así como la medicación coadyuvante administrada.
-Opioides lipofílicos (fentanilo) en infusión continua o en forma de AECP:
• Monitorización durante TODO el tiempo de la infusión.
• Inicialmente la monitorización debe ser continua durante los primeros 20 min, seguida de 1 vez cada hora hasta que hayan pasado 12 horas.
• De 12 a 24 h la monitorización debe de realizarse al menos 1 vez cada 2 horas.
• Tras 24 h la monitorización debe de realizarse al menos 1 vez cada 4 horas.
• Al desconectar la infusión, la monitorización dependerá de las condiciones generales del paciente, así como la medicación coadyuvante administrada.
-Opioides hidrofílicos (morfina) en inyección única (no en liberación retardada):
• La monitorización debe cubrir un mínimo de 24 h tras su administración.
• Inicialmente la monitorización debe realizarse 1 vez cada hora hasta que hayan pasado las 12 primeras horas y 1 vez cada 2 h durante las siguientes 12 h (12-24 h).
• Tras 24 h la monitorización dependerá de las condiciones generales del paciente así como la medicación coadyuvante administrada.
-Opioides hidrofílicos (morfina) en infusión continua o en forma de AECP:
• Monitorización durante TODO el tiempo de la infusión.
• Inicialmente la monitorización debe realizarse 1 vez cada hora hasta que hayan pasado las 12 primeras horas y 1 vez cada 2 h durante las siguientes 12 h (12-24 h).
• Tras 24 h la monitorización debe realizarse 1 vez cada 4 h.
• Al desconectar la infusión, la monitorización dependerá de las condiciones generales del paciente, así como la medicación coadyuvante administrada.
-Morfina epidural de liberación retardarda:
• Inicialmente la monitorización debe realizarse 1 vez cada hora hasta que hayan pasado las 12 primeras horas y 1 vez cada 2 h durante las siguientes 12 h (12-24 h).
• Tras 24 h la monitorización debe realizarse 1 vez cada 4 h durante un mínimo de 48 h.
-La vigilancia debe incrementarse en duración o métodos adicionales en los pacientes con riesgo aumentado de depresión respiratoria (inestabilidad cardiovascular, obesidad, edad extrema, síndrome de apnea del sueño o medicación sedante añadida).
Tratamiento de la depresión respiratoria
-Oxígeno suplementario:
• Debe de estar siempre disponible.
• Debe de ser administrado en caso de alteración del nivel de conciencia, hipoxemia o signos de depresión respiratoria hasta que el paciente esté alerta.
• Su uso rutinario puede aumentar la duración de los episodios de apnea, así como enmascarar la detección de las atelectasias, apneas transitorias o hipoventilación.
-Agentes reversores (naloxona):
• Debe mantenerse un acceso intravenoso si los signos de depresión respiratoria se presentan de manera recurrente.
• Deben de estar disponibles para su administración en todos los lugares donde se encuentren pacientes bajo los efectos de opioides espinales.
• En el caso de una depresión respiratoria severa se deberá comenzar con las maniobras de resucitación (RCP).
- Ventilación no invasiva (VNI):
• Debe considerarse su uso de cara a mejorar la mecánica ventilatoria.
• Debe iniciarse si se presentan episodios de obstrucción severa de la vía aérea o hipoxemia en el periodo postoperatorio.
Conclusiones
La administración espinal de un fármaco opioide no garantiza una acción selectiva medular. La biodisponibilidad en su biofase medular, avalada por los estudios experimentales en animales, está en relación inversa con su liposolubilidad, siendo mayor para los opioides hidrofílicos como morfina, que para los lipofílicos como fentanilo, sufentanilo o alfentanilo. Los ensayos clínicos confirman que la administración de opioides lipofílicos en forma de perfusión continua epidural no produce analgesia por mecanismo espinal, en contraposición con la inyección de un bolo epidural donde una cantidad suficiente de fármaco puede alcanzar su lugar específico de acción medular, aunque al potenciar el anestésico local permite disminuir la dosis total de AL. Todos los opioides intratecales producen parte de su efecto analgésico vía selectiva medular, aunque los fármacos lipofílicos pueden también alcanzar rápidamente los centros superiores debido a su gran redistribución vascular.
La morfina es el opioide con mayor selectividad espinal tras su administración perimedular, pero su larga vida de eliminación y la posibilidad de depresión respiratoria tardía, limitan su uso rutinario y requiere una selección previa de los pacientes. La formulación liposomal de liberación retardada ha demostrado una buena eficacia en el dolor postoperatorio durante un periodo de 48 h. La metadona es una buena alternativa epidural, así como la hidromorfona en forma de analgesia epidural controlada por el paciente, aunque se deben realizar un mayor número de estudios para definir una pauta de recomendación adecuada. Tanto el fentanilo como el sufentanilo intradural son de elección en la paciente obstétrica y en cirugía ambulatoria, y son los coadyuvantes más utilizados por vía espinal junto con anestésicos locales, en el periodo postoperatorio.
Es importante recordar que el tratamiento del dolor agudo postoperatorio requiere un abordaje multimodal (102), asociando anestesia regional, analgésicos de acción central como paracetamol y de acción anti-inflamatoria periférica, opioides a través de una de sus múltiples vías de administración, junto con fármacos coadyuvantes como los destinados al dolor de tipo neuropático. En el futuro, la analgesia óptima deberá basarse en la evidencia clínica para cada proceso quirúrgico y todo ello deberá asociarse a un programa de fisioterapia y rehabilitación, con la finalidad de acortar el periodo de recuperación y convalecencia postoperatoria de nuestros pacientes.
Todos los pacientes que reciban opioides neuraxiales, deberán ser vigilados y monitorizados sobre su nivel de ventilación, oxigenación y sobre todo de su nivel de conciencia. Adecuando su duración en tiempo y en medios humanos y materiales, a la farmacocinética del opioide administrado, a la patología de base del paciente y medicación coadyuvante (farmacodinamia) y por último a la disponibilidad de personal sanitario entrenado para mantener un adecuado protocolo de vigilancia y actuación frente a la temida depresión respiratoria.
Bibliografía
1. Brill S, Gurman GM, Fisher A. A history of neuroaxial administration of local analgesics and opioids. Eur J Anesthesiology 2004;21(4):329-30. [ Links ]
2. Yaks TL, Rudy TA. Analgesia mediated by a direct spinal action of narcotics. Science 1976;192:1357-8. [ Links ]
3. Wang JK, Nauss LA, Thomas JE. Pain relief by intrathecally applied morphine in man. Anesthesiology 1979;5:149-51. [ Links ]
4. Behar M, Magora F, Olswang D, Davidson JT. Epidural morphine in treatment of pain. Lancet 1979;1:527-9. [ Links ]
5. Bernards CM. Understanding the physiology and farmacology of epidural and intrathecal opiods. Best Practice and Reseach Clinical Anaesthesiology 2002;16(4):489-505. [ Links ]
6. Mugabure Bujedo B, Tranque Bizueta I, González Santos S, García Retegui E. Utilización clínica racional de los opioides espinales en el dolor postoperatorio. Algia Hospital 2007;3:160-71. [ Links ]
7. Inturrisi CE. Clinical Pharmacology of opioids for pain. Clin J Pain 2002;18 (4):3-13. [ Links ]
8. Mugabure Bujedo B, González Santos S, Tranque Bizueta I, Araujo López A, Torán García L. Manejo del dolor perioperatorio en el paciente en tratamiento crónico con opioides. Rev Soc Esp Dolor 2009;16 (5):288-97. [ Links ]
9. Simonet G, Rivat C. Opioid-induced hyperalgesia: abnormal or normal pain. Neuroreport 2003;14:1-7. [ Links ]
10. Koppert W, Schmelz M. The impact of opioid-induced hyperalgesia for postoperative pain. Best Pract Res Clin Anesthesiol 2007;21(1):65-83. [ Links ]
11. Lavand'nhomme P. Perioperative pain. Curr Opin Anaesthesiol 2006;19:556-61. [ Links ]
12. Wilder-Smith OHG, Arentd-Nielsen L. Postoperative hyperalgesia: its clinical importance and relevance. Anesthesiology 2006;104:601-7. [ Links ]
13. Guignard B, Bossard AE, Coste C, Sessler DI, Lebrault C, Alfonsi P, et al. Acute opioid tolerance: intraoperative remifentanil increases postoperative pain and morphine requirement. Anesthesiology 2000;93 (2):409-17. [ Links ]
14. Joly V, Richebe P, Guignard B, Fletcher D, Maurette P, Sessler DI, et al. Remifentanil-induced postoperative hyperalgesia and its prevention with small-dose ketamina. Anesthesiology 2005;103(1):147-55. [ Links ]
15. Lenz H, Raeder J, Draegni T, Heyerdahl F, Schmelz M, Stubhaug A. Effects of COX inhibition on experimental pain and hyperalgesia during and after remifentanil infusion in humans. Pain 2011; ahead of print. [ Links ]
16. Rivat C, Laulin JP, Corcuff JB, Celeries E, Pain L, Simmonet G. Fentanyl enhancement of carrageenan-induced hyperalgesia in rats: prevention by the N-Methyl-D-Aspartate receptor antagonist ketamina. Anesthesiology 2002;96:381-91. [ Links ]
17. Richebe P, Rivat C, Laulin JP, Maurette P, Simonnet G. Ketamine improves the management of exaggerated postoperative pain observed in perioperative fentanyl treated rats. Anesthesiology 2005;102 (2):421-8. [ Links ]
18. Chia YY, Liu K, Wang JJ, Kuo HC, Hc ST. Intraoperative high dose fentanyl induces postoperative fentanyl tolerance. Can J Anaesth 1999;46:872-7. [ Links ]
19. Richebe P, Rivat C, Creton C, Laulin JP, Maurette P, Lemaire M, Simonnet G. Nitrous oxide revisited: evidence for potent antihyperalgesic properties. Anesthesiology 2005;103 (4):845-54. [ Links ]
20. Van Elstraete AC, Sitbon P, Mazoit JX, Benhamou D. Gabapentin prevents delayed and long-lasting hyperalgesia induced by fentanyl in rats. Anaesthesiology 2008;108 (3):484-94. [ Links ]
21. Cooper DW, Lindsay DM, Ryall M, Kokri MS, Eldabe SS, Lear GA. Does intrathecal fentanyl produce acute cross-tolerance to i.v. morphine? Br J Anaesth 1997;78:311-3. [ Links ]
22. Mao J, Price DD, Mayer DJ. Mechanisms of hyperalgesia and morphine tolerance: a current view of their possible interactions. Pain 1995;65:259-74. [ Links ]
23. Weinbroum AA. A single small dose of postoperative ketamine provides rapid and sustained improvement in morphine analgesia in the presence of morphine-resistant pain. Anesth Analg 2003;96:789-95. [ Links ]
24. Smith MT. Neuroexcitatory effects of morphine and hydromorphone: evidence implicating the 3-glucuronide metabolites. Clin Exper Pharmcol & Physiol 2000;27:524-8. [ Links ]
25. Sakurada T, Komatsu T, Sakurada S. Mechanisms of nocicepcion evoked by intrathecal high-dose morphine. Neurotoxicology 2006;26:801-9. [ Links ]
26. Angst MS, Clark JD. Opioid induced hyperalgesia. A Qualitative systematic review. Anesthesiology 2006; 104:570-87. [ Links ]
27. Devulder J. Hyperalgesia induced by high-dose inthratecal sufentanil in neuropathic pain. J Neurosug Anesthesiol 1997;9(2):146-8. [ Links ]
28. Fishbain DA, Cole B, Lewis JE, Gao J, Rosomoff RS. Do opioids induce hiperalgesia in humans? An evidence-based structured review. Pain Med 2009; 10(5):829-39. [ Links ]
29. B Mugabure, E Echaniz, M Marín. Fisiología y Farmacología clínica de los opioides epidurales e intratecales. Rev Soc Esp Dolor 2005;12:33-45. [ Links ]
30. Bernards CM, Shen DD, Sterling ES, Adkins JE, Risler L, Philips B, et al. Epidural, cerebrospinal fluid and plasma pharmacokinetics of epidural opioids: Part 1. Differences among opioids. Anesthesiology 2003:99:455-65. [ Links ]
31. Reina MA, Pulido P, Castedo J, Villanueva MC, López A, Sola RG. Características y distribución de la grasa epidural humana normal. Rev. Esp Anestesiol Reanim 2006;53:363-72. [ Links ]
32. Bernards CM, Sorkin LS. Radicular artery blood flow does not redistribute fentanyl from the epidural space into the spinal cord. Anesthesiology 1994; 80:872-8. [ Links ]
33. Bernards CM, Hill HF. The spinal nerve root sleeve is not a preferred route for the redistribution of drugs from the epidural space to the spinal cord. Anesthesiology 1991;75:827-32. [ Links ]
34. Bernards C, Hill HF. Physical and chemical properties of drugs molecules governing their diffusion trough the spinal meanings. Anesthesiology 1992; 77:750-6. [ Links ]
35. Kozody R, Palahniuk RJ, Wade JG, Cumming MD, Pucci WR. The effect of subarachnoid epinephrine and phenylephrine on spinal cord blow flow. Can Anaesth Soc J 1984;31:503-8. [ Links ]
36. Bernards CM, Shen DD, Sterling ES, Adkins JE, Risler L, Philips B, et al. Epidural, cerebrospinal fluid and plasma pharmacokinetics of epidural opioids: Part 2. Effect of epinephrine. Anesthesiology 2003: 99:466-75. [ Links ]
37. Ummenhofer WC, Arends RH, Shen DD, Bernards CM. Comparative spinal distribution and clearance kinetics of intrathecally administered morphine, fentanyl, alfentanil, and sufentanil. Anesthesiology 2000;92:739-53. [ Links ]
38. Swenson JD, Owen J, Lamoreaux W, Viscomi C, McJames S, Cluff M. The effect of distance from injection site to the brainstem using spinal sufentanil. Reg Anesth Pain Med 2001;26:306-9. [ Links ]
39. Eisenach JC, Hood DD, Curry R, Shafer SL. Cephalad movement of morphine and fentanyl in humans after intrathecal injection. Anesthesiology 2003; 99(1):166-73. [ Links ]
40. Bernards CM. Cerebrospinal fluid and spinal cord distribution of baclofen and bupivacaine during low intrathecal infusion in pigs. Anesthesiology 2006; 105 (1):169-78. [ Links ]
41. von Cube B, Teschemacher H, Herz A, Hess R. Permeation of active morphine-like substances at their sites of antinociceptive action in the brain as a function of their lipid-solubility following intravenous and intraventricular application. Naunyn Schmiedebergs Arch Pharmakol 1970;265 (5):455-73. [ Links ]
42. Bernards CM. Recent insights into the pharmacokinetics of spinal opioids and the relevance to opioid selection. Curr Opin Anaesthesiol 2004;17:441-7. [ Links ]
43. Heitz JW, Witkowski TA, Viscusi ER. New and emerging analgesics and analgesic technologies for acute pain management. Curr Opin Anaesthesiol. 2009;22:608-17. [ Links ]
44. Sumida S, Lesley MR, Hanna MN, Murphy JD, Kurmar K, Wu, CL. Meta-analysis of the effect of extended-release epidural morphine versus intravenous patient-controlled analgesia on respiratory depression. J Opioid Manag 2009;5(5):301-5. [ Links ]
45. Ni Mhuircheartaigh RJ, Moore RA, McQuay HJ. Analysis of individual patient data from clinical trials: epidural morphine for postoperative pain. B J Anaesth 2009;103:874-81. [ Links ]
46. García B, Latorre S, Torre F, Gómez C, Postigo S, Callejo A, et al. Hidromorfona: una alternativa en el tratamiento del dolor. Rev Esp Dolor 2010;17(3): 155-63. [ Links ]
47. Wu CL, Cohen SR, Richman JM, Rowlingson AJ, Courpas GE, Cheung K, et al. Efficacy of postoperative patient-controlled and continous infusion epidural analgesia versus intravenous patient-controlled analgesia with opioids: a meta-analysis. Anesthesiology 2005;103:1079-88. [ Links ]
48. Liu S, Carpenter RL, Mulroy MF, Weissman RM, Mc Gill TM, Rupp SM, et al. Intravenous versus epidural administration of hydromorphone. Effects on analgesia and recovery after radical retropubic prostatectomy. Anesthesiology.1995;82:682-8. [ Links ]
49. Liu SS, Bieltz M, Wucovits B, Raymond SJ. Prospective survey of patient-controlled epidural analgesia with bupivacaine and hydromorphone in 3736 postoperative orthopedic patients. Reg Anesth Pain Med 2010;35(4):351-4. [ Links ]
50. Mulroy MF. Epidural hydromorphone: A step closer to the view from the top. Reg Anesth Pain Med 2010;35(4):333-4. [ Links ]
51. Prieto-Alvarez P, Tello-Galindo I, Cuenca-Peña J, Rull-Bartomeu M, Gomar-Sancho C. Continuous epidural infusion of racemic methadone results in effective postoperative analgesia and low plasma concentrations. Can J Anaesth 2002;49 (1):25-31. [ Links ]
52. Parramon F, Garcia Ch, Gambus P, Vilaplana J, Aragonés N, Villalonga A. Postoperative patient-controlled analgesia is more effective with epidural methadone than with intravenous methadone in thoracic surgery. Rev Esp Anestesiol Reanim 2003;50(7):326-31. [ Links ]
53. Backlund M, Lindgren L, Kajimoto Y, Rosemberg PH. Comparision of epidural morphine and oxycodone for pain after abdominal surgery. J Clin Anesth 1997;9:30-5. [ Links ]
54. Yanagidate F, Dohi S. Epidural oxycodone or morphine following gynaecological surgery. Br J Anaesth 2004;93:362-7. [ Links ]
55. Ginosar Y, Riley ET, Angst MS. The site of action of epidural fentanyl in humans volunteers, difference between infusion and bolus administration. Anesth Anal 2003;97 (5):1428-38. [ Links ]
56. George MJ. The site of action of epidurally administered opioids and its relevance to postoperative pain management. Anaesthesia 2006;61:659-64. [ Links ]
57. Tan CN, Guha A, Scawn ND, Pennefather SH, Russell GN. Optimal concentration of epidural fentanyl in bupivacaine 0.1% after thoracotomy. Br J Anaesth 2004;92(5):670-4. [ Links ]
58. Miguel R, Barlow I, Morrell M, Schorf J, Sanusi D, Fu E. A prospective, randomized, double-blind comparison of epidural and intravenous sufentanil infusions. Anesthesiology 1994;81(2):346-52. [ Links ]
59. Lilker S, Rofaeel A, Balki M, Carvalho JC. Comparision of fentanyl and sufentanil as adjuncts to bupivacaine for labor epidural analgesia. J Clin Anesth 2009;21(2):101-12. [ Links ]
60. Coda BA, Brown MC, Risler L, Syrjala k, Shen DD. Equivalent analgesia and side effects during epidural and pharmacokinetically tailored intravenous infusion with matching plasma alfentanil concentration. Anesthesiology 1999;40:1112-8. [ Links ]
61. van der Nieuwenhuyzen MC, Stienstra R, Burm AG, Vietter AA, Van Kleef JW. Alfentanil as an adjuvant to epidural bupivacaine in the management of postoperative pain after laparotomies: lack of evidence of spinal action. Anesth Analg 1998;86:574-8. [ Links ]
62. Yoshimi Inagaki, Takashi Mashimo, Ikuto Yoshiya. Mode and site of analgesic action of epidural buprenorphine in humans. Anesth Analg 1996;83:530-6. [ Links ]
63. Hashimoto K, Monma F, Amagasa M, Seo N. Prospective study on anesthesia for lumbar spine surgery: the effectiveness of the perioperative epidural anesthesia with buprenorphine. Masui 2009;58(6):708-12. [ Links ]
64. Ipe S, Korula S, Varma S, George GM, Abraham SP, Koshy LR. A comparative study of intrathecal and epidural buprenorphine using combined spinal-epidural technique for cesarean section. Indian J Anaesth 2010;54:205-9. [ Links ]
65. Turker G, Goren S, Bayram S, Sahin S, Korfali G. Comparison of lumbar epidural tramadol and lumbar epidural morphine for pain relief after thoracotomy: a repeated-dose study. J Cardiothor Vasc Anesth 2005;19(4):468-74. [ Links ]
66. de Leon Casasola OA, Lema MJ. Postoperative epidural opioid analgesia: what are the choices? Anesth Analg 1996;83:867-75. [ Links ]
67. Rathmell JP, Lair TR, Nauman B. The role of intrathecal drugs in the treatment of acute pain. Anesth Analg 2005;101:S30-S45. [ Links ]
68. Meylan NM, Elia N, Lysakowski C, Traimer MR. Benefit and risk of intrathecal morphine without local anaesthesic in patients undergoing major surgery: meta-analysis of randomized trials. Br J Anaesth 2009;102:156-67. [ Links ]
69. Elia N, Lysakowski C, Traimer MR. Does multimodal analgesia with acetaminophen, nonsteroideal antiinflamatory drugs or selective ciclooxygenase-2 inhibitors and patient controlled analgesia morphine offer advantajes over morphine alone: Meta-analyses of randomized trials. Anesthesiology 2005;103:1296-304. [ Links ]
70. Remy C, Marret E, Bonnet F. Effects of acetaminophen on morphine side effects and consumption after mayor surgery: meta-analysis of randomized controlled trials. Br J Anaesth 2005;94(4):505-13. [ Links ]
71. Gehling M, Tryba M. Risks and side-effects of intrathecal morphine combined with spinal anaesthesia: a meta-analysis. Anaesthesia 2009;64(6):643-51. [ Links ]
72. Gehling M, Luesebrink T, Kulka PJ, Tryba M. The effective duration of analgesia after intrathecal morphine in patients without additional opioid analgesia: a randomized double-blind multicentre study on orthopaedic patients. Eur J Anaesthesiol 2009; 26:683-8. [ Links ]
73. Rebel A, Sloan P, Andrykowsky. Retrospective analysis of high-dose intrathecal morphine for analgesia after pelvic surgery. Pain Res Manag 2011; 16(1):19-26. [ Links ]
74. Fléron MH, Weiskopf RB, Bertrand M, Mouren S, Eyraud D, Godet G et al. A comparision of intrathecal opioid and intravenous analgesia for the incidence of cardiovascular, respiratory, and renal complications after abdominal aortic surgery. Anesth Analg 2003;97:2-12. [ Links ]
75. Quigley C. Hydromorphone for acute and chronic pain. Cochrane Database of Systematic Review. (1):CD003447,2002. [ Links ]
76. Drakerford MK, Pettine KA, Brookshire L, Ebert F. Spinal narcotics for postoperative analgesia in total joint arthroplasty: a prospective study. J Bone Joint Surg Am 1991;73:424-8. [ Links ]
77. Jacobson L, Chabal C, Brody MC, Ward RJ, Ireton RC. Intrathecal methadone and morphine for postoperative analgesia: a comparison of the efficacy, duration and side effects. Anesthesiology 1989; 70(5):742-6. [ Links ]
78. Jacobson L, Chabal C, Brody MC, Ward RJ, Wasse L. Intrathecal methadone: a dose-response study and comparision with intrathecal morphine 0,5 mg. Pain 1990;43(2):141-8. [ Links ]
79. Giovannelli M, Bedford N, Aitkenhead A. Survey of intrathecal opioid usage in the UK. Eur J Anaesth 2008;25:118-22. [ Links ]
80. Husaini SW, Russell IF. Intrathecal diamorphine compared with morphine for postoperative analgesia after caesarian section under spinal anaesthesia. Br J Anaesth 1998;81:135-9. [ Links ]
81. Saravanan S, Robinson APC, Qayoum Dar A, Columb MO, Lyons GR. Minimun dose of intrathecal diamorphine required to prevent intraoperative supplementation of spinal anaesthesia for caesarian section. Br J A Anaesth 2003;91(3):368-72. [ Links ]
82. Ehikhamelator KO, Nelson M. Intrathecal pethidine as sole anaesthetic agent for operative procedures of the lower limb, inguinal area and perineum. West Indian Med J 2001;50:313-6. [ Links ]
83. Hansen D, Hansen S. The effect of three graded doses of meperidine for spinal anesthesia in African men. Anesth Analg 1999;88:827-30. [ Links ]
84. Yu SC, Ngan Kee WD, Kwan AS. Intrathecal meperidine and shivering in obstetric anesthesia. Anesth Analg 2004;99(4):1272-3. [ Links ]
85. Hamber EA, Viscomi CM. Intrathecal lipophilic opioids as adjunts to surgical spinal anesthesia. Reg Anesth Pain Med 1999;24(3):255-63. [ Links ]
86. Olofson C, Nygards EB, Bjersten AB, Hessling A. Low-dose bupivacaine with sufentanil prevents hypotension after spinal anesthesia for hip repair in ederly patients. Acta Anaesthesil Scand 2004;48: 1240-4. [ Links ]
87. Ben-David B, Frankel R, Arzumonov T, Marchevsky Y, Volpin G. Minidose bupivacaine-fentanyl spinal anesthesia for surgical repair of hip fracture in the aged. Anesthesiology 2000;92:6-10. [ Links ]
88. Kim SY, Cho JE, Hong JY, Koo BN, Kim JM, Kill HK. Comparison of intrathecal fentanyl and sufentanil in low-dose dilute bupivacaine spinal anaesthesia for transurethral prostatectomy. Br J Anaesth 2009;103(5):750-4. [ Links ]
89. Herman NL, Calicott R, Van Decar TK, Conlin G, Tilton J. Determination of the dose-response relationship for intrathecal sufentanil in laboring patients. Anesth Analg 1997;84:1256-61. [ Links ]
90. Palmer CM, Cork RC, Hays R, Van Maren G, Alves D. The dose-response relation of intrathecal fentanyl for labor analgesia. Anesthesiology 1998;88: 355-61. [ Links ]
91. Nelson KE, Rauch T, Terebuh V, D'Angelo R. A comparition of intratecal fentanyl and sufentanil for labor analgesia. Anesthesiology 2002;96;1070-3. [ Links ]
92. Heller AR, Zimmerman K, Seele K, Rössel T, Koch T, Litz RJ. Modifying the baricity of local anesthetics for spinal anesthesia by temperature adjustment. Anesthesiology 2006;105:346-53. [ Links ]
93. Richardson MG, Wissler RN. Densities of dextrose-free intrathecal local anesthetics, opioids, and combinations measured at 37 oC. Anesth Analg 1997;84:95-9. [ Links ]
94. Imbelloni LE, Moreira AD, Gaspar FC, Gouveia MA, Cordeiro JA. Assessment of the densities of local anesthetics and their combination with adjuvants: an experimental study. Rev Bras Anestesiol 2009;59 (2):154-65. [ Links ]
95. Hejtmanek MR, Harvey TD, Bernards CM. Mesured density and calculated baricity of custom-compounded drugs for chronic intrathecal infusión. Reg Anesth Pain Med 2011;36:7-11. [ Links ]
96. Morgan M. The rational use of intrathecal and extradural opioids. Br J Anaesth 1989;63:165-88. [ Links ]
97. Etches RC, Sander AN, Daley MD. Respiratory depression and spinal opioids. Can J Anaesth 1989;36:165-85. [ Links ]
98. Carvalho B. Respiratory depression after neuraxial opioids in the obstetric setting. Anesth Analg 2008;107:956-61. [ Links ]
99. Aguilar JL, Benhamou D, Bonnet F, Dahl J, Rawal N, Rubin A et al. ESRA guidelines for the use of epidural opioids. Int Monitor Reg Anaesth 1997;7: 3-8. [ Links ]
100. Rawal N, Allvin R. Acute pain services in Europe; a 17-nation survey of 105 hospitals. Eur J Anaesthesiol 1998;15 (3):354-63. [ Links ]
101. An updated report by the American Society of Anesthesiologists Task Force on neuraxial opioids. Practice Guidelines for the prevention, detection and management of respiratory depression associated with neuraxial opioid administration. Anesthesiology 2009;110:218-30. [ Links ]
102. Mugabure B, Tranque I, González Santos S, Adrián R. Estrategias para el abordaje multimodal del dolor y la recuperación postoperatoria. Rev. Esp. Anestesiol Reanim 2007;54:29-40. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Borja Mugabure Bujedo
Paseo de Berio, 22, 3º B
20018 San Sebastián
e-mail: mugabure@yahoo.es
Financiación: Ninguna
Conflicto de intereses: No declarados
Recibido: 07-04-11.
Aceptado: 10-06-11.