Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.19 no.4 Madrid jul./ago. 2012
Tratamiento del dolor secundario al síndrome de ATM mediante estimulación nerviosa periférica
The management of pain secondary to TMJ syndrome using peripheral nerve stimulation
M. J. Rodríguez, C. Aldaya, M. Fernández-Baena
Unidad del Dolor. Hospital Regional Universitario Carlos Haya. Málaga
Dirección para correspondencia
RESUMEN
Introducción: con el nombre de síndrome témporo-mandibular o síndrome de Costen se hace referencia a una patología cuyos síntomas más frecuentes son: dolor y chasquidos articulares, dificultad para abrir la boca e incomodidad en la articulación témporo-mandibular. Su diagnóstico es básicamente clínico. La ATM está inervada por el nervio aurículo-temporal rama colateral del nervio mandibular, III rama del trigémino.
Material y método: presentamos un total de seis pacientes, tratadas entre el 2008 al 2010, todas ellas con un cuadro de dolor secundario a un síndrome ATM, unilateral en cinco pacientes y bilateral en una de ellas. Todas las pacientes habían sido tratadas de forma previa en Cirugía Maxilofacial así como distintos tratamientos farmacológicos y rehabilitadores sin resultado en el alivio del dolor ni el la mejoría de la apertura de la boca.
Previo al implante del sistema de estimulación se realizó, en todos los casos, bloqueos nerviosos aurículo-temporales con lidocaína al 2%, con el fin de determinar la zona y el nivel de analgesia obtenidos. En todos los casos se implantó en quirófano un electrodo en la región preauricular de la articulación témporo-mandibular afectada.
Se valoró tanto la intensidad del dolor como la situación general de las pacientes antes del inicio del tratamiento y a las dos semanas, en las cuales se dio por terminado el periodo de prueba y se procedió a la implantación de un generador definitivo.
Resultados: todas las pacientes fueron del sexo femenino, con una edad media de 32 años. Todas ellas presentaban dolor continuo con gran dificultad en la apertura de la boca y estaban en tratamiento farmacológico sin obtener un alivio adecuado del dolor. En todas las pacientes el resultado analgésico obtenido fue del 84% a las cuatro semanas de la implantación del electrodo.
Palabras clave: Síndrome témporo-mandibular. Estimulación eléctrica periférica. Nervio aurículo-temporal.
ABSTRACT
Introduction: the term temporomandibular joint syndrome or Costen's syndrome refers to a disorder whose most common symptoms include: joint pain and clicking, difficulty opening the mouth, and temporomandibular joint discomfort. Basically, its diagnosis is clinical. The TMJ is supplied by the auriculotemporal nerve, a collateral branch of the mandibular nerve, V3 branch of the trigeminal nerve.
Material and method: we report on a total of six female patients who were treated between 2008 and 2010, all of them with pain secondary to TMJ syndrome, unilateral in five cases and bilateral in one. All these patients had previously received maxillofacial surgery, as well as various drug therapies and rehabilitation, with no pain or mouth opening improvements.
All patients were subjected to auriculotemporal nerve blocks using 2% lidocaine to determine analgesia extent and level prior to stimulation system implantation. In all cases an electrode was surgically implanted in the preauricular area of the involved temporomandibular joint.
Both pain severity and general health status were assessed before treatment onset and after two weeks, at which time the trial period ended and a definitive stimulator was implanted.
Results: all patients were females with a mean age of 32 years. All of them had continuous pain and great difficulty opening their mouths, and all were on drug therapy without adequate pain relief. All patients had their pain reduced by 84% at four weeks after electrode implantation.
Key words: Temporo-pertaining to the jaw syndrome. Electrical peripheral stimulation. Auriculo-temporary nerve.
Introducción
Con el nombre de síndrome témporo-mandibular (STM) o síndrome de Costen, se hace referencia a una patología, con frecuencia de tipo funcional, cuyos síntomas más frecuentes son: dolor y chasquido articular, dificultad para abrir la boca e incomodidad en la articulación témporo-mandibular (ATM) (1).
Desde el punto de vista clínico, el síndrome ATM cursa, habitualmente, con un cuadro de dolor muy intenso en la articulación TM o en la mandíbula, este dolor puede extenderse hacia un lado del cuero cabelludo, nuca o cuello y puede empeorar al masticar, bostezar o hablar demasiado. En algunos pacientes el dolor se acompaña de rigidez témporo-mandibular con dificultad para abrir la boca o masticar, junto con chasquidos y crujidos articulares y una sensación de cierre o enganche breve de la mandíbula al intentar abrirla o cerrarla (Fig. 1).
El diagnóstico del síndrome ATM es básicamente clínico e incluye la presencia de: 1) chasquidos articulares; 2) examen detenido de los dientes y de las articulaciones mandibulares; 3) la palpación de las articulaciones mandibulares y de los músculos de la cabeza y cara; y 4) el estudio radiológico que puede ser de gran ayuda diagnóstica, si bien en la actualidad el procedimiento principal de diagnóstico es la RNM, con ella se comprueba que en el 100% de los casos de ATM existe una luxación anterior del menisco (2).
Inervación
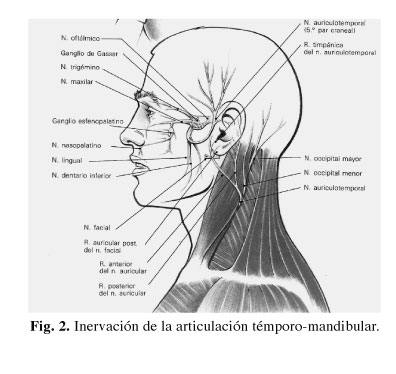
La ATM está inervada por el nervio aurículo-temporal, rama colateral del nervio mandibular que a su vez es una rama del trigémino. Nace de dos raíces procedentes de la división posterior del nervio mandibular, estas ramas forman un ojal por donde pasa la arteria meníngea media y luego se unen para formar un solo nervio. Pasa lateral al cuello de la mandíbula, donde da las ramas parotídeas y continúa hacia arriba donde inerva la oreja, el conducto auditivo externo, la cara externa de la membrana timpánica y la piel de la región temporal, asimismo da un par de ramas articulares para la articulación témporo-mandibular. Es un nervio muy sensible al dolor, por lo que su irritación produce la sintomatología tan abundante y fuerte que nos relatan los pacientes.
El nervio aurículo-temporal está constituido por fibras nerviosas sensitivas y vegetativas. Proporciona la inervación sensitiva, entre otras, de la articulación témporo-mandibular, pabellón auricular y de la piel de las regiones temporal pterional y del pabellón auricular. Su papel vegetativo comprende la inervación parasimpática y simpática de la ATM y la inervación parasimpática y simpática de las regiones temporal, pterional y pabellón auricular (Fig. 2).
Material y método
En este estudio retrospectivo se han incluido un total de seis pacientes, todas de sexo femenino, con edades comprendidas entre los 49 y los 24 años (edad media de 32,66 años). Todas ellas presentaban un cuadro de dolor témporo-mandibular, unilateral en cinco de las pacientes y bilateral en una de ellas. El dolor fue descrito con características neuropáticas, percibido como eléctrico, lancinante, opresivo, con sensación de disestesia y parestesia. Todas asociaban a su cuadro clínico un mal descanso nocturno, con un cuadro depresivo asociado y limitación en la apertura de la boca. Todas habían sido sometidas, de forma previa, a una o varias intervenciones quirúrgicas en el Servicio de Cirugía Máxilofacial sin resultado satisfactorio en el alivio del dolor así como en la apertura de la boca. Así como a distintos tratamientos farmacológicos y a distintas prótesis dentales, sin obtener con ello alivio en su patología. El tiempo de evolución del dolor era superior, en todos los casos, a los dos años llegando en dos de las pacientes a los ocho años de duración.
Todas las pacientes habían sido tratadas, sin éxito, mediante infiltraciones intra-articulares con anestésicos locales y corticoides, ante ello se les propuso la realización de un bloqueo pre-auricular de la articulación témporo-mandibular afectada con 5 ml de lidocaína al 2%. Este bloqueo proporcionó un alivio inmediato del dolor en este grupo de pacientes así como un aumento en la capacidad de apertura de la boca, el inconveniente es que el efecto analgésico fue temporal y tanto el dolor como la dificultad para abrir la boca aparecieron de nuevo al desaparecer la vida media de la lidocaína. De todas formas, los bloqueos nerviosos son considerados como la herramienta estándar para confirmar la presencia de una neuralgia periférica, por ello, la desaparición del dolor tras su realización se considera como un pre-requisito antes de considerar a un paciente candidato a implante de un neuroestimulador periférico. En estas seis pacientes tras el bloqueo pre-auricular con anestesia local, el dolor cedió entre el 80 al 100% de su intensidad inicial con un tiempo de duración superior en todos los casos a las 6 horas (Fig. 3), en estos casos se indicó la estimulación témporo-mandibular en periodo de prueba mediante el implante de un electrodo pre-auricular.
Los principales criterios de inclusión para la estimulación eléctrica periférica (3) en estas pacientes, han sido: 1) presentar un cuadro de dolor de intensidad severa en la articulación témporo-mandibular, uni o bilateral con una duración superior a los seis meses; 2) haber recibido, sin éxito, otros tratamientos, incluidos las infiltraciones intra-articulares y el tratamiento quirúrgico; 3) haber obtenido alivio duradero, tanto del dolor como un aumento en la capacidad de la apertura de la boca, mediante infiltraciones con anestesia local en la región pre-auricular del lado afectado; 4) haber sido declarado apto para recibir tratamiento neuroestimulador por un psicólogo.
Los criterios de exclusión han sido los comunes a todos los candidatos a Neuroestimulación.
Todas las pacientes, de forma previa, firmaron el preceptivo consentimiento informado. Los sistemas implantados han sido 6 electrodos, de la firma ANS (Advances Neurological Systems Inc, Plano. USA), cinco tetrapolares y uno octopolar (Octrode). Todos los electrodos fueron implantados por vía subcutánea sobre la zona preauricular de la articulación afectada, hasta conseguir la superposición de la parestesia eléctrica sobre la zona del dolor, una colocación superficial atravesando la dermis o demasiado profunda a través de la fascia podría ocasionar una estimulación ineficaz y dolorosa. Una vez conseguida la parestesia se tunelizó subcutáneamente el electrodo hacia la espalda de la paciente y se conectó este a un generador externo de prueba. Se establecieron los parámetros de estimulación de acuerdo con los procedimientos convencionales de los sistemas de estimulación medular, buscando el programa que mejor alivio proporcionase al paciente (Fig. 4).
En todos los casos se evaluó tanto la intensidad del dolor como la situación general del paciente antes del inicio del tratamiento estimulador de prueba así como a las 2 semanas después del implante del electrodo, en ese momento se dio por terminado el periodo de prueba y se procedió, en quirófano, a la implantación de un generador definitivo marca Génesis. Después de ello, se volvió a revisar a los pacientes a las 4, 12 y 24 semanas después de la implantación definitiva del generador.
Las herramientas utilizadas para valorar la situación de los pacientes han sido el cuestionario de Salud SF-12 y el cuestionario breve para la evaluación del dolor (BPI). Asimismo, los datos de los actos quirúrgicos y de las programaciones se registraron en formularios preparados al efecto, realizándose en cada paciente un cuestionario de satisfacción y un registro de las complicaciones aparecidas durante el tratamiento.
Resultados
Todos los pacientes fueron sometidos a varios cuestionarios antes de iniciar el tratamiento mediante estimulación eléctrica, siendo los resultados obtenidos los siguientes:
- El EVA medio de los pacientes previo al implante del estimulador era de 7 puntos en una escala del 0 al 10 (6-10), siendo el alivio medio obtenido con la medicación previa al implante del 30% del EVA. En todos los pacientes el dolor se localizaba en la región témporo-mandibular lo que además dificultaba la apertura de la boca.
- Cinco de las seis pacientes han experimentado un alivio del dolor superior al 80% de la intensidad del dolor basal. De las seis pacientes, cinco continúan en tratamiento con un nivel de analgesia que les permite abrir la boca, bostezar y masticar sin que se lo impida el dolor. Una paciente ha abandonado el tratamiento, por estimulación del facial lo que le provocaba retracción de la boca y estimulación desagradable en el ojo del lado estimulado.
- Dado que el acto quirúrgico es de una relativa simplicidad no se produjeron complicaciones quirúrgicas o postquirúrgicas inmediatas, por lo que todas las pacientes se sometieron durante un periodo de tiempo de dos semanas a una fase de prueba antes de recibir el implante definitivo del generador.
- La programación de los parámetros de estimulación se realizó sin complicaciones, en todos los casos a la salida del paciente del quirófano, debido a que todos los sistemas se programaron con un único conjunto de parámetros (sin sub-programas o "stim-sets").
- Cuestionario de salud SF-12: es una versión reducida del Cuestionario de Salud SF-36 diseñada para usos en los que este sea demasiado largo ya que el SF-12 se contesta en una media de 2 minutos. Es un cuestionario autoadministrado que sirve para medir la salud desde el punto de vista del paciente puntuando respuestas estandarizadas a preguntas también estandarizadas. Es la versión española del SF-12 Health Survey, adaptado a la población española por Alonso y cols. (4,5), se expresa en percentiles y su valor es directamente proporcional al grado de salud del paciente.
- Los resultados fueron muy positivos en todas las respuestas a preguntas puntuales, especialmente en el componente físico (Tabla I). Es preciso resaltar que las pacientes no contestaron positivamente a la pregunta genérica "¿en general usted diría que su salud es ....? y, de hecho, hubo un empeoramiento del 7%. Paradójicamente, este resultado no se corresponde con el resto de las preguntas, ya que en todas ellas se observaron mejorías importantes.
- Cuestionario breve para la evaluación del dolor BPI: es un cuestionario multidimensional de valoración del dolor que proporciona información no solo sobre la intensidad del dolor, sino también su interferencia en las actividades diarias de los pacientes, resultando por tanto idóneo para evaluar la efectividad del tratamiento analgésico. Fue desarrollado por Daut en 1983 (6) y se validó en su versión española por Badía y cols. en 2002 (7). Consta de dos dimensiones: "intensidad del dolor" con 4 items e "interferencia en las actividades diarias" con 7 items. Cada uno de ellos se puntúa mediante una escala numérica de 0 (ausencia de dolor/ausencia de interferencia en la vida diaria) a 10 (peor dolor imaginable/afectación máxima en la vida diaria) a partir de los resultados obtenidos se obtiene una puntuación resumen para cada una de las dos dimensiones. Todos las pacientes experimentaron una mejoría drástica en la evaluación del dolor, siendo la mejoría media del 84% a las 4 semanas, del 78% a las 12 semanas y del 90% a las 24 semanas (Tabla II). La totalidad de las pacientes han normalizado tanto su actividad física así como el descanso nocturno.
- Ingesta de medicamentos y utilización del sistema: al final del estudio, cuatro de los pacientes habían suspendido totalmente la medicación analgésica que tomaban antes de iniciar la estimulación eléctrica y en un caso había reducido la dosis previa de gabapentina en un 50%.
- Cinco de los pacientes continúan en el estudio y utilizaban de forma regular el sistema de neuroestimulación al término del estudio. Los cinco pacientes hicieron un uso intensivo de los sistemas de estimulación, utilizándolos un tiempo comprendido entre las 13 y las 18 horas al día.
Complicaciones
De las seis pacientes, cinco continuaron el tratamiento de estimulación eléctrica con la implantación de un generador definitivo (Génesis. ANS) manteniendo un nivel efectivo de analgesia que les permite además abrir la boca, bostezar y masticar sin que se lo impida el dolor. Una paciente ha abandonado el tratamiento, por estimulación del nervio facial que le provocaba retracción de la boca y estimulación desagradable en el ojo del lado estimulado, debido a ello la paciente no quiso continuar el tratamiento y se le retiró el electrodo.
La principal complicación ha sido la rotura del eléctrodo en dos pacientes, en un caso a los tres meses y en el segundo caso al año de la colocación del electrodo, en los dos casos se reimplantaron los electrodos sin que se haya vuelto a producir esta complicación.
Discusión
Los desórdenes de la articulación témporo-mandibular (ATM) se describieron ya en tiempos de Hipócrates, si bien fue James Costen, en 1934, el primero que reunió un grupo de síntomas y los relacionó con los desórdenes funcionales de la ATM en lo que posteriormente se conocería como síndrome de Costen.
Entre las causas más frecuentes que originan este síndrome nos encontramos con las siguientes: 1) una tensión excesiva de los músculos de la mandíbula, que produce un movimiento limitado de la articulación, 2) un alineamiento defectuoso entre los dientes inferiores y superiores, que origina un movimiento desequilibrado de la articulación mandibular, 3) una posición o desplazamiento anormal de la articulación mandibular o del disco de cartílago dentro de la articulación y 4) algunas anomalías evolutivas como; alteración de los cóndilos, defectos congénitos, acromegalia, traumatismos o luxaciones, inflamación o infección de la articulación, tumores óseos: sarcoma, metástasis, osteomas, etc. (8).
Existen una serie de factores de riesgo en el síndrome ATM, entre los más frecuentes están los siguientes: 1) sexo femenino, 2) edad de 30 a 50 años, 3) apretar o rechinar los dientes, 4) uso de dentaduras mal ajustadas y 5) la presencia de otras patologías asociadas como; fibromialgia, estrés o artritis, etc.
Dado que en un elevado número de pacientes con síndrome de ATM se asocian componentes de ansiedad y trastornos psico-fisiológicos, el paso inicial en estos pacientes es eliminar el estrés e intentar relajar la articulación, con ello a veces se consigue controlar tanto el bruxismo como los chasquidos articulares. El tratamiento de estos pacientes incluye los siguientes puntos (9):
1. Administración de una dieta blanda que ayude a obviar el esfuerzo articular, no recomendándose masticar chicle ni tomar bebidas excitantes, tales como café, té o alcohol. Con estas medidas se intenta conseguir un alivio del dolor, este también puede tratarse mediante la aplicación de compresas frías o tibias, la restricción del movimiento de la mandíbula o mediante fármacos, los más utilizados son: paracetamol, AINE, relajantes musculares y antidepresivos. En ocasiones también se puede administrar ansiolíticos durante un par de semanas.
En algunos casos es aconsejable asociar el tratamiento farmacológico con la infiltración de la articulación témporo-mandibular con una mezcla de anestésicos locales y corticoides.
2. También es recomendable la utilización de un protector dental, su objetivo es conseguir una relajación de la musculatura mandibular y de esta forma evitar el apretar o rechinar de los dientes.
3. La Fisioterapia se ha mostrado como un método útil en el tratamiento del síndrome ATM. El paciente puede aprender a hacer pequeños ejercicios destinados a fortalecer los músculos zonales y a mejorar la estabilidad de la articulación, por ejemplo: mediante un suave masaje del músculo masetero durante unos 5 minutos dos o tres veces al día, comprimiendo, posteriormente, entre los dientes un lápiz grueso durante unos 5 minutos.
4. Los procedimientos quirúrgicos se consideran como el último recurso en aquellos pacientes en los cuales los tratamientos anteriores no han obtenido éxito y el dolor no ha cedido.
La estimulación eléctrica de nervios periféricos se está convirtiendo, en estos últimos años, en una práctica de uso común con buenos resultados a medio y largo plazo en el tratamiento del dolor crónico. Su utilización sobre los nervios periféricos no está muy documentada todavía y su aplicación en pacientes con dolor crónico secundario a un síndrome de Costen no cuenta, en estos momentos, con trabajos que la avalen en la literatura médica. El objetivo de este artículo ha sido evaluar tanto la efectividad como la seguridad de esta terapia en una serie de pacientes con dolor secundario a síndrome ATM mediante un estudio retrospectivo en seis pacientes con este cuadro. El dolor crónico secundario a síndrome ATM es un problema que puede incidir en una población mucho mayor de lo que se puede pensar comúnmente. El número de ellos que, debido a la intensidad del cuadro de dolor y a la falta de éxito de otros tratamientos, puedan ser candidatos a tratamiento con neuroestimulación es incierto, si bien puede constituir un grupo poblacional importante.
Los procedimientos invasivos son muy eficaces en el tratamiento de diferentes síndromes dolorosos refractarios al tratamiento médico, si bien su utilización está, hoy en día, controvertida, ya que una vez que se destruye una estructura nerviosa difícilmente podrá ser reconstruida en un futuro. Por el contrario, la neuroestimulación es un procedimiento completamente reversible, si el paciente decide, en un futuro, no continuar con este tipo de tratamiento, el sistema puede ser retirado sin ningún inconveniente.
Los sistemas de estimulación eléctrica se dividen en intra y extra-espinales, dependiendo de los elementos que se estimulen en cada caso. Aló y Holsheimer (10) establecen esta clasificación (la intraespinal y la extraespinal) y consideran que el primer tipo, el intraespinal, tiene siempre como objetivo la estimulación de un nervio espinal específico y, el segundo tipo, el extraespinal, es aquel cuyo objetivo es la estimulación de nervios extraespinales.
Clásicamente, se ha denominado como estimulación "periférica" aquella en la que se implantaba un electrodo sobre un nervio periférico (tibial posterior, mediano, ciático, humeral, etc.), dejando el término de estimulación "subcutánea" para denominar la estimulación realizada en una localización donde no se encuentra un nervio periférico específico, si bien existen ocasiones en las que ambos conceptos se mezclan (11). En la actualidad, el mayor problema que nos encontramos es la combinación de las denominaciones, ya que en unos casos se clasifica según la técnica quirúrgica y en otros casos según el tipo de estimulación realizada. Aunque ambos procedimientos, tanto la Estimulación Nerviosa Periférica (PNS) como la Estimulación Subcutánea (PSFS), se realizan de manera similar desde un punto de vista técnico, los resultados que se buscan y que se obtienen en cada uno de ellos son diferentes. La Estimulación Nerviosa Periférica (PNS) busca, en todos los casos, obtener una parestesia en el territorio inervado por el nervio estimulado y en cambio cuando se realiza estimulación Subcutánea (PSFS) la distribución de la parestesia se obtiene en forma de campo eléctrico alrededor de los polos activos sin alcanzar una distribución nerviosa definida (12).
La estimulación Nerviosa Periférica (PNS) se remonta a 1967, tras los trabajos realizados por Wall y Sweet (13), en los que demostraban que la estimulación eléctrica de un nervio provocaba una hipoestesia y analgesia distal al punto estimulado, si bien su mayor auge se adquirió en la década de los 80 (14,15). La principal indicación para realizar este tipo de estimulación es la existencia de dolor neuropático en el territorio correspondiente a 1 o 2 nervios, de manera que la estimulación se realiza de forma específica en la distribución de los nervios afectados. La NPS se basa en los mismos principios que la Estimulación de Cordones Posteriores, precisamente una de las dificultades de esta técnica es la colocación correcta del electrodo para que proporcione una correcta estimulación del territorio deseado, pues tanto las intervenciones anteriores como los traumatismos previos pueden dificultad la colocación del electrodo en el lugar seleccionado. Las zonas bien inervadas como el tronco, cuello, cabeza y macizo orofacial son las más favorables para este tipo de estimulación, que se ha utilizado en pacientes con cefalea, neuralgias faciales, inguinales, periféricas, lumbalgias crónicas y en dolores pélvicos y perineales (16).
La técnica quirúrgica es relativamente sencilla, sobre todo en el periodo de prueba. Los electrodos se introducen percutáneamente, llevándose a cabo con anestesia local para que el paciente nos pueda localizar la zona de parestesia. Durante dicho periodo de prueba solo se implantan los electrodos unidos a un generador externo de parestesias. La localización de los electrodos puede rodear la zona dolorosa o bien colocarse en el centro de máximo dolor. La profundidad de su colocación es lo más delicado, ya que si están muy superficiales la parestesia provocada puede ser muy dolorosa y se colocan demasiado profundos puede que no se perciba o aparezca distorsionada, pudiendo dar lugar a una contractura muscular (17). Lo que se pretende, en definitiva, es conseguir la cobertura del área dolorosa con las parestesias con la mayor confortabilidad para el paciente. El periodo de prueba puede durar entre 2 y 3 semanas y una vez comprobada su efectividad se implanta el generador en la región glútea o abdominal en un segundo tiempo quirúrgico.
Conclusiones
El dolor secundario a un síndrome TM es, en determinados pacientes, un problema clínico de difícil solución y que puede llevar a situaciones con un deterioro severo de la calidad de vida de los pacientes, con repercusiones tanto en la vida familiar, social y laboral de estas personas. Es en este grupo de pacientes, refractarios a todos los tratamientos previos (farmacológicos, rehabilitadores, etc.) en los cuales la estimulación nerviosa periférica puede ser la solución. Su técnica es relativamente sencilla teniendo en cuenta que no deben colocarse ni muy profundos ni muy superficiales, con un nivel de complicaciones pre y postoperatorias relativamente bajo.
Bibliografía
1. Benscher JJ. Temporomandibular joint disorders. Am Fam Physician. 2007;76:1477-86. [ Links ]
2. Scrivani SJ, Keith DA, Kaban CB. Temporomandibular disorders. N Engl J Med. 2008;359:2693-705. [ Links ]
3. Abejón D, Rubio G, Del Sanz J, Pérez J. Nuevas indicaciones y actualizaciones en la Neuroestimulación. Rev Soc Esp Dolor. 2007;Supl. II:31-44. [ Links ]
4. Alonso J. Cuestionario de salud SF-12. Med Care. 1996;34:220-33. [ Links ]
5. Vilagut G, Ferrer M, Rajmil L, Rebollo P, Permanyer-Miralda G, Quintana JM. The spanish version of the short form 36 health survey: a decade of esperiencie and new developments. Gar Sanit. 2005;19:135-50. [ Links ]
6. Daut RL, Cleeland CS, Flannery R. Devalopment of the Wisconsin Brief Pain Questionnaire to assess pain incancer and other diseases. Pain. 1983;17:197. [ Links ]
7. Badia X, Muriel C, Gracia A, Nuñez-Olarte JM, Gálvez R, Carulla J. Validación española del cuestionario Brief Pain Inventory en pacientes con dolor de causa neoplásica. Med Clin. 2003;120:52-9. [ Links ]
8. Lobbezoo F. Topical review: new insights into the pathology and diagnosis of disorders of the temporomandibular joint. J Orofac Pain. 2004;18:181-91. [ Links ]
9. Simons DC, Travell JG. Myofascial pain and dysfunction: The trigger point manual. Vol 1. Upper Half of the Body. 2nd Ed. Atlanta, GA: Emory University. 1998. [ Links ]
10. Alo K, Holsheimer J. New trends in neuromodulation for the management of neurophatic pain. Neurosurgery. 2002;50:690-704. [ Links ]
11. Abejón D. Estimulación periférica: tipos y técnica. En. Guía Práctica de la Neuroestimulación. Grupo Español de Neuromodulación. Ed: ESRA-España Living & Working 2009; Cap.5: p. 36-50. [ Links ]
12. Franco Gay ML, López Alarcón MD. Estimulación periférica & subcutánea. Indicaciones. En. Guía Práctica de la neuroestimulación. Grupo español de Neuromodulación. Ed: ESRA-España. Living & Working 2009; Cap.3: p.15-9. [ Links ]
13. Wall PD, Sweet WH. Temporary abolition of pain in man. Science. 1967;155:108-9. [ Links ]
14. Meglio M, Cioni B, Rossi GF. Spinal cord stimulation in management of chronic pain. A 9-year experience. J Neurosurg. 1989;70:519-24. [ Links ]
15. Barolat C, Massaro F, He J, Zeme S, Ketcik B. Mapping of sensory responses to epidural stimulation of the intraspinal neural structures in man. J Neurosurg. 1993;78(2):233-9. [ Links ]
16. Weiner RI. Peripheral nerve stimulation. In: Burchiel KJ (editor). Surgical Management of Pain. New York. Thieme Medical Publishers, Inc 2002. p. 498-504. [ Links ]
17. Tamimi MA, Davids HR, Barolat G, Krutsch J. Subcutaneous Peripheral Nerve Stimulation Treatment for Chronic Pelvic. Neuromodulation. 2008;11:277-81. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Manuel J. Rodríguez.
e-mail: maje1946@yahoo.es
Financiación: Ninguna
Conflicto de intereses: No declarados
Recibido: 05-06-11.
Aceptado: 15-08-11.