Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista de la Sociedad Española del Dolor
versão impressa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.21 no.5 Madrid Set./Out. 2014
https://dx.doi.org/10.4321/S1134-80462014000500003
Comparación de resultados obtenidos en el tratamiento del dolor miofascial de la cintura pélvica con toxina botulínica sola y asociada con lidocaína
Comparison of results obtained in the treatment of the myofascial pain of the pelvic girdle with botulinum toxin alone and associated with lidocaine
I. Velázquez Rivera1, M. Muñoz Vico1, L. Velázquez Clavarana2, P. García Velasco3, A. Zénner del Castillo1 y J. Ruiz Olivares4
1Servicio de Anestesiología y Unidad del Dolor. Hospital Alta Resolución de Guadix. Granada.
2Enfermería. Centro Gámez Morón. Melilla.
3Enfermería. Hospital de Alta Resolución de Guadix. Granada.
4Vacunación. C. A. Melilla
Dirección para correspondencia
RESUMEN
Objetivos: entre el 70 y el 85 % de la población adulta sufre de dolor de espalda alguna vez en su vida. El síndrome de dolor miofascial (SDM) ha sido descrito recientemente definiéndose como dolor musculoesquelético no inflamatorio, localizado, desarrollado sin causa aparente, refractario a tratamientos farmacológicos y físicos, y se acompaña de la presencia de puntos gatillos y de bandas tensas palpables en el músculo. Su prevalencia se estima que varía entre un 30 y un 85 %.
Los músculos psoas, cuadrado lumbar y piramidal son los más frecuentemente implicados en el SDM de cintura pélvica. Una de las principales alternativas para tratar el SDM es la toxina botulínica tipo A (TB), que actúa en la membrana sináptica en la placa neuromuscular, inhibiendo la liberación de acetilcolina, produciendo relajación muscular y alivio del dolor, aunque, en muchas ocasiones, su efecto no se hace evidente hasta transcurridos varios días. La lidocaína es un anestésico local (AL) tipo amida con duración de acción intermedia que actúa impidiendo la propagación del impulso nervioso disminuyendo la permeabilidad de los canales de sodio.
El objetivo de este estudio era comprobar si al añadir AL a ladosis de TB, conseguíamos un acortamiento en el tiempo dela reducción de la EVA y mejoría de la calidad de vida.
Material y métodos: el diseño del estudio fue prospectivo, controlado, longitudinal y aleatorizado en el que se ha valorado la evolución de 20 pacientes divididos en dos grupos. Al primer grupo se les administró TB tipo A (grupo T). Al segundo grupo se les trató con TB tipo A y dosis adicional de lidocaína al 2% (grupo TL). Previamente, ambos grupos, habían respondido de forma positiva a un test con infiltración del músculo afecto con lidocaína al 2 %. El seguimiento de los pacientes se hizo secuencialmente a los 3, 7, 15 y 90 días de iniciado el tratamiento.
Para el análisis estadístico se utilizó un análisis de la varianza, ANOVA, complementada por la prueba de Mauchly para comprobación de la esfericidad y la prueba de Greenhouse-Geisser, con un intervalo de confianza del 95 %, considerando una p<0,05 para establecer diferencias estadísticas.
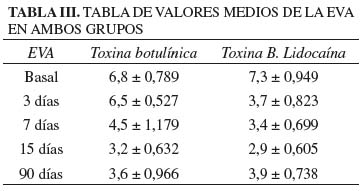
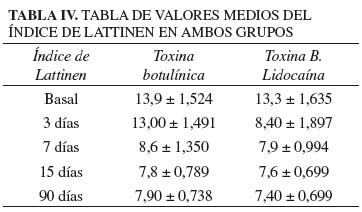
Resultados: hubo diferencia estadísticamente significativa entre la EVA del grupo TL Y TB en la valoración a los tres días, del mismo modo en la evaluación del índice de Lattinen. No hubo diferencias significativas en el resto de valoraciones. En ambos grupos hubo diferencia significativa en la reducción del EVA y mejoría del índice de Lattinen, al principio y final del estudio.
Conclusiones: la TXB-A presenta una alternativa al tratamiento de este cuadro cuando la terapia conservadora ha fracasado. Los anestésicos locales producen una relajación previsible, breve y reversible de la musculatura provocada por el bloqueo de la conducción nerviosa en las terminaciones nerviosas, mientras que la TXB actúa en las terminaciones neuronales de la placa motora, impidiendo la liberación de la acetil colina. Su acción la ejercen en lugares distintos y con características diferentes. La acción de los anestésicos locales es casi instantánea y breve, la de la TXB es diferida y duradera en el tiempo, por lo que pueden ser complementarias y agonistas en su efecto final.
Palabras clave: Síndrome miofascial. Toxina botulínica. Lidocaína.
ABSTRACT
Objectives: Between 70 and 85 % of the adult population suffers from back pain sometime in their life. Myofascial pain syndrome (MPS) has been described recently and defined as a localized non-inflammatory musculoskeletal pain, developed without apparent cause, being refractory to pharmacological and physical treatments, and is accompanied by the presence of trigger points and palpable taut bands in the muscle. Its prevalence is estimated to vary between 30 and 85 %.
The psoas, quadratus lumborum and pyramidal muscles are the most frequently involved in the pelvic girdle MPS. One of the main alternatives to treat MPS is botulinum toxin type A (BT), which acts in the synaptic membrane at the neuromuscular junction, inhibiting the release of acetylcholine, producing muscle relaxation and pain relief, although in many cases its effect is not evident until several days have passed.
Lidocaine is an amide type local anesthetic with an intermediate duration of action, which act by preventing the propagation of nerve impulses by decreasing the permeability of sodium channels.
The objective of this study was to test whether adding LA to the BT dose, we got a shortening in the time of the reduction of EVA and improvement in quality of life.
Material and methods: The study design was prospective, controlled, longitudinal and randomized in which we have evaluated the evolution of 20 patients randomly divided into two groups. The first group were given BT A type (group T). The second group was treated with BT A type and an additional dose of 2 % lidocaine (group TL). Previously, both groups had responded positively to a test with lidocaine 2 % infiltration of the affected muscle. Monitoring patients was sequentially to 3, 7, 15 and 90 days of treatment performed. For statistical analysis we used an analysis of variance, ANOVA, complemented by Mauchly test for sphericity check and by Greenhouse-Geisser test, with a confidence interval of 95 %, considering p < 0.05 to establish statistical differences.
Results: There was statistically significant difference between group EVA TL and TB in the assessment on the third day, just as in the evaluation of Lattinen Index. No significant differences in the other reviews. In both groups there was significant difference in EVA reduction and Lattinen Index improvement at the beginning and end of the study.
Conclusions: BT-A presents an alternative to the management of this condition when conservative therapy has failed. Local anesthetics cause a predictable, short and reversible muscle relaxation caused by blocking nerve conduction in nerve endings, while BT acts on the neuronal endings of the motor plate, preventing the release of acetylcholine. Its action is exercised in different places and with different characteristics. The action of local anesthetics is almost instantaneous and short, the TXB action is delayed and long lasting, so both can be complementary and agonists in their final effect.
Key words: Myofascial syndrome. Botulinum toxin. Lidocaine.
Introducción
Los procesos musculoesqueléticos son la causa más frecuente de dolor y de discapacidad temporal o permanente. Al menos un 30 % de la población presenta síntomas en el aparato locomotor, en el que el dolor de origen muscular tiene una alta prevalencia. Dentro del dolor muscular, el de la cintura pélvica es, sin duda, el más frecuente, entre el 70 y el 85 % de la población adulta sufre de dolor lumbar alguna vez en su vida. La prevalencia anual se sitúa entre el 15 y el 45 %, la mayoría son episodios benignos y autolimitados pero recurrentes siendo la causa más frecuente de visita médica por dolor crónico después de la cefalea (1-3).
Con mucha frecuencia este dolor lumbar reúne las características de síndrome miofascial crónico. Algunos autores consideran que hasta el 80 % del dolor lumbar crónico que llega a las Unidades del Dolor se trata de dolor miofascial de la cintura pélvica (4-6). El síndrome miofascial es un cuadro clínico de reciente descripción (7) generalmente infradiagnosticado y, por ende, infratratado. La prevalencia en general de este síndrome varía desde el 20 % de los pacientes vistos en consulta de Reumatología, el 30 % de los pacientes en consulta de Atención Primaria y entre un 85-93 % de los pacientes que acuden a Unidades del Dolor (8-11).
Lo podríamos definir como aquel dolor musculoesquelético no inflamatorio, localizado en un músculo o grupo muscular, refractario a tratamientos farmacológicos y/o a la aplicación de métodos de terapia física, acompañándose de rigidez y síntomas autonómicos, expresión de cambios patológicos en el sistema nervioso periférico, junto con la presencia de puntos gatillos (12-14). Debe tener tres componentes básicos: a) una banda palpable en el músculo afectado; b) un punto gatillo; c) un patrón característico de dolor referido.
La banda palpable puede no ser vista al examen ocular; esta representa un espasmo segmentario de una pequeña porción del músculo, siendo percibida si se realiza una adecuada exploración, moviendo los pulpejos de los dedos deslizándose a lo largo del músculo aprovechando la movilidad del tejido celular subcutáneo que lo rodea. El punto gatillo es un foco de irritabilidad en el músculo cuando este es deformado por presión, estiramiento o contractura, lo que produce dolor local, referido y ocasionalmente fenómenos autonómicos. Los puntos gatillos pueden clasificarse en: a) activos, son dolorosos sin estimulación, siempre sensibles, el paciente los siente como un punto de dolor constante; b) latentes o satélites, causan disfunción cuando se realizan ciertas maniobras, sólo son dolorosos a la palpación. También pueden ser clasificados como primarios, cuando no existe ninguna otra enfermedad o causa subyacente que los produzca o ser secundario a patologías tales como atrapamientos nerviosos o radiculopatías.
El tercer componente es el dolor referido. Es un dolor que proviene de un punto gatillo, pero que se siente a distancia del origen del mismo. La distribución del dolor referido no coincide con la total distribución de un nervio periférico o raíz, aunque puede remedar el dolor producido por compresión nerviosa o atrapamientos. Tampoco presenta déficit motor o neurológico (1,3,11,15-21).
Existe un gran número de teorías acerca de la fisiopatología del síndrome miofascial, ninguna de ellas aún completamente comprobadas. Sí existe coincidencia entre los autores que existe una serie de factores que pueden predisponer a la aparición de puntos gatillos: microtraumatismos repetidos, traumatismos agudos, posturas inadecuadas y sostenidas, sobreuso, factores mecánicos como escoliosis o acortamientos de miembros, factores físicos como enfriamiento brusco del cuerpo o de zonas corporales parciales, agotamiento físico, factores psicológicos como estrés, depresión o alteraciones del sueño, deficiencias nutricionales del grupo vitamínico B o de minerales (Ca, Fe, K y Mg), obesidad y/o enfermedades endocrinas como hipotiroidismo, cambios hormonales o menopausia (13,22-24).
La hipótesis que más consenso concierta, atribuye como etiología del punto gatillo (PG) a la disfunción de la placa motora, donde las motoneuronas alfa contactan con las fibras musculares. Esta disfunción se debería a una despolarización anormal de la placa motora en la que se sumarían mecanismos presinápticos (excesiva liberación de acetil colina), sinápticos (defecto de la enzima colinesterasa) y postsinápticos (aumento de la actividad del receptor nicotínico de la acetil colina). Estos mecanismos actuarían de forma sinérgica provocando en la membrana postsináptica una rápida y sostenida activación de los receptores nicotínicos, induciendo un potencial de acción y contracción muscular mantenida en condiciones de reposo con acortamiento persistente de los sarcómeros. La contracción muscular provocaría un cuadro de isquemia local con disminución del flujo arterial, de la llegada de oxígeno, de calcio y de otros nutrientes necesarios para inducir la relajación muscular. La creciente demanda de energía local provocada por los mecanismos presinápticos, sinápticos y postsinápticos, ocasiona un rápido consumo de ATP, lo que implica un fallo metabólico denominado "crisis energética". La isquemia tisular, por su parte, induciría la síntesis y liberación de sustancias algógenas e inflamatorias, tales como: bradiquininas, noradrenalina, serotonina, histamina, prostaglandinas, leucotrienos, sustancias P, péptido relacionado con el gen de la calcitonina (GCRP), todo ello en un medio ácido, que activan los nociceptores musculares e incrementan la actividad en la placa motora, con la consecuente aparición del dolor completando el círculo de la denominada "hipótesis integrada" de Simons (1,25-28).
La primera secuela de esta sensibilización periférica sería el espasmo muscular que se sumaría al dolor ocasionado por las descargas espontáneas de potenciales de acción. Bajo circunstancias normales esta lesión se recupera con tratamiento precoz y los nociceptores retornan a su umbral normal de sensibilidad. Por razones aún desconocidas, en algunos pacientes la sensibilización local se expande hacia nociceptores vecinos y de esta manera la lesión comienza a cronificarse, haciéndose el músculo menos elástico, acortándose más, haciéndose más limitado y débil. El principal efecto es un incremento en la excitabilidad de algunos nociceptores vecinos e incluso neuronas de segundo y tercer orden, provocando la sensibilización central que puede ser la responsable del dolor referido (3,22,29,30).
Para el diagnóstico no existe actualmente un test que sea el patrón de oro definitivo. Tampoco existen datos de laboratorio ni radiológico objetivables que puedan orientarnos en el diagnóstico. Solo un minucioso examen físico y una exhaustiva historia clínica son los elementos básicos para orientarnos hacia el diagnóstico. Nos puede ser útil el uso de algómetros, el umbral de presión, el cual es la mínima cantidad de presión que induce dolor, es considerado anormal si es menor a 2 kg/cm2 (1,3,31), relacionándolo con un punto de control normal usualmente medido en el lado opuesto. En una revisión de la literatura médica se observó que los cuatro criterios diagnósticos aplicados con mayor frecuencia fueron: el nódulo doloroso en la banda tensa, el reconocimiento del dolor por parte del paciente, el patrón característico de dolor referido y la respuesta local de sacudida (32).
La exploración de la columna lumbar debe realizarse valorando la movilidad general de la zona lumbar en todos sus posibles movimientos, flexo-extensión, rotación y lateralización, lo que nos dará un patrón de limitación que nos ayudará a identificar el músculo o músculos afectados. Es frecuente en la zona lumbar la asociación de más de un músculo en la producción de dolor. La historia detallada del dolor, su localización y los mecanismos agravantes del mismo, nos permitirán llegar a la identificación de los músculos afectados. Los tres músculos que con mayor frecuencia ocasionan dolor miofascial de la cintura pélvica son: cuadrado lumbar, iliopsoas y piramidal.
El cuadrado lumbar es un extenso músculo que presenta tres haces de fibras: a) iliolumbares: desde la cresta iliaca hasta apófisis transversa de L1 a L4; b) iliocostales: desde la cresta iliaca hasta la duodécima costilla; y c) lumbocostales: desde la duodécima costilla hasta las apófisis transversas de la lumbares. Su función es la extensión e inclinación homolateral de la columna, contribuyendo a la espiración forzada. Es el músculo principal en el mantenimiento de la posición erecta. Su contractura es la causa más frecuente de lumbalgia. El dolor aumenta con la bipedestación prolongada, la tos y el estornudo. El dolor se puede irradiar a la ingle, a los testículos y al trayecto ciático. Presentan dificultad para girarse en la cama, para levantarse de la silla y del decúbito supino, parestesias en pantorrillas y sensación de quemazón en piernas y pies. Gran hipersensabilidad en trocánter mayor. Caminan bien a gatas, el dolor mejora al descargar el peso de la parte superior del cuerpo apoyando la espalda, apoyándose los brazos sobre la mesa o cogiéndose las caderas con las manos.
En primer lugar exploraremos la movilidad de la columna lumbar, encontrándose afectada la flexión lateral. Para su exploración física resulta extremadamente importante la colocación del paciente, pues los PG de este músculo resultan difícil de encontrar debido al escaso espacio que existe entre la última costilla y la cresta iliaca. El examen se debe efectuar con el paciente en decúbito lateral, lado sintomático arriba. Debe colocarse un pequeño cojín bajo la cadera para aumentar la distancia entre la última costilla y la cresta iliaca. Se le pide al paciente que extienda el brazo del lado afecto, por encima de la cabeza para atrapar el reborde de la costilla. De esta manera fija la parte superior de su cuerpo y aumenta aún más el espacio entre costilla y cresta iliaca.
El cuadrado lumbar está situado por delante y fuera del borde externo de la masa muscular espinal. Sus fibras se palpan perpendiculares fácilmente a lo largo de la parte interna de la cresta iliaca, también en el ángulo formado por la masa paravertebral y la duodécima costilla y en el ángulo formado por la cresta iliaca y los músculos paravertebrales. La palpación del PG provocará dolor que se irradia hacia trocánter mayor y cara externa del muslo o hacia región sacroiliaca y nalga.
El psoas es un músculo grueso compuesto de dos partes: a) iliaco: que va desde la pala iliaca al trocánter menor; y b) psoas: que va desde la cara lateral y borde inferior de las apófisis transversas de las vértebras lumbares hasta el trocánter menor.
Su función principal es la flexión de la cadera y ayuda en su abducción y rotación externa.
Su contractura provoca lumbalgia de carácter longitudinal, si es unilateral, pudiéndose irradiar el dolor hacia la cara anterior del muslo. Si la lesión es bilateral, el dolor se distribuye de manera horizontal en la parte lumbar baja. El dolor empeora con la bipedestación y produce dificultad para levantarse de asientos bajos. No hay dolor con la tos o con la espiración forzada. Mejora con el reposo sin desaparecer y con el decúbito lateral con las piernas encogidas. Puede dar clínica de compresión de los nervios femoral, femorocutáneo, femorogenital e ilioinguinal. Para lograr una deambulación sin dolor, el paciente hiperextiende la columna lumbar presionando hacia abajo el trocánter mayor del lado afecto.
Para su exploración el paciente debe estar tumbado sobre su espalda. Se deben buscar los PG entre localizaciones: a) presionando sobre la inserción distal del músculo en el trocánter menor. Produce dolor irradiado a cara anteromedial de muslo e ingle; b) por dentro de la cresta iliaca, procurando el paciente relajar los músculos abdominales. Produce dolor lumbar y en región sacroiliaca; y c) palpación indirecta del psoas a través de la pared abdominal, presionando el psoas de forma gradual, lenta y suave por debajo del recto abdominal contra la columna lumbar. El dolor puede aparecer periumbilical o por debajo de la columna lumbar.
El piramidal va desde la cara anterointerna del sacro al trocánter mayor del fémur, aunque suele presentar grandes variaciones anatómicas.
Su función principal es ser rotador externo y abductor del fémur. También parece ayudar a mantener la cabeza femoral en el acetábulo.
Su contractura provoca dolor en zona de la nalga, entre el sacro y el trocánter mayor. El dolor se irradia hacia la cadera y a la parte posterior del muslo. Aumenta al permanecer sentado o en bipedestación, empeorando con la actividad, aunque sin mejoría con el reposo. El paciente sentado cambia continuamente de posición, buscando una postura antiálgica (enfermedad del camionero). Presenta dificultad para cruzar las piernas. Puede comprimir estructuras nerviosas vecinas (ciático) remedando una ciatalgia.
Para su exploración el glúteo mayor debe estar relajado. La contracción del piramidal se acompaña de una marcada sensibilidad a lo largo de la línea que une el trocánter mayor con la cara medial del sacro. Los PG se sitúan en la vecindad de su inserción en el trocánter y en el borde inferior del sacro por debajo de la espina iliaca postero-inferior.
Una amplia variedad de métodos de terapia están hoy disponibles para el manejo del síndrome miofascial, todos con el mismo principio básico: restaurar la longitud normal de reposo de la fibra muscular y eliminar los puntos gatillos palpables dentro de las bandas fibrosas del músculo. El tratamiento debe ser individualizado para cada individuo y multidimensional. Es más acertado iniciar el tratamiento con procedimientos conservadores y reservar las técnicas invasivas para cuando estos fracasen (1,3,33).
Entre las medidas terapéuticas iniciales a tener en consideración, contemplaremos: a) eliminar los factores desencadenantes, especialmente aquellos factores predisponentes; b) rehabilitación y terapias físicas, técnicas de estiramiento, aplicación de calor o frío, masaje, láser, acupuntura, ultrasonidos y electroestimulación transcutánea; estas medidas pueden ayudar a liberar el músculo de la tensión acumulada; y c) el tratamiento farmacológico se basará en el uso de AINE, relajantes musculares, analgésicos, antidepresivos. Pocos estudios hay diseñados sobre la eficacia a corto y largo plazo de este tipo de fármacos en la mejora del síndrome miofascial. Los antidepresivos tricíclicos solo existe evidencia científica para su empleo en la cefalea tensional y en las alteraciones de la articulación temporomandibular. El grado de evidencia de las benzodiacepinas para su efectividad en el espasmo muscular es moderado. Los relajantes musculares son eficaces en el tratamiento de espasmos musculares que afecten a la región cervical y alteraciones de la articulación temporomandibular, siendo de valor muy limitado en otros síndromes miofasciales. Los opioides, aunque suelen utilizarse, no hay en la literatura estudios adecuados que valoren con evidencia científica su eficacia en este tipo de dolor (34-39).
Si estas técnicas no mejoran al paciente en un periodo de 2 a 4 semanas se deben tener en cuenta procedimientos más agresivos, en concreto las infiltraciones de los PG. Las infiltraciones pueden ser "seca", sin administración de fármacos o bien añadiendo anestésicos locales, toxina botulínica o esteroides (40-43).
La infiltración con anestésico local (AL) va a producir una relajación breve y reversible de la musculatura por bloqueo de la conducción en las terminaciones nerviosas; también va a producir un bloqueo de los nociceptores situados en el espesor del músculo, lo que conduce a un bloqueo sensitivo del que carece la infiltración con toxina botulínica (TB). Los anestésicos locales inhiben el transporte de sodio del exterior al interior de la membrana al ocupar un sitio específico en la misma (receptor de canal), disminuyendo el número de potenciales de acción, la velocidad de despolarización y conducción nerviosa, prolongando el periodo refractario, inhibiendo por completo la despolarización de la membrana. La zona específica a la cual se unen los anestésicos locales parece ser la región D4-S6 de la subunidad alfa del canal de sodio ligado a voltaje, una región a la que solo puede accederse desde el lado intracelular de la membrana (44,45).
La TB representa una de las toxinas biológicas más potente conocida hasta la actualidad, está producida por la bacteria anaeróbica Clostridium botulinum. Posee una fracción neurotóxica consistente en una proteína con un peso molecular de aproximadamente 150.000 daltons. Existen 7 serotipos inmunológicamente distintos del Clostridium botulinum (A, B, C1, D, E, F y G), todos ellos inhiben la liberación de acetilcolina aunque difieren considerablemente con respecto a las características de sus efectos y sus potencias. El tipo A ha sido el más extensamente estudiado y ha demostrado tener buenas aplicaciones terapéuticas; también el tipo B se ha comercializado pero tiene efectos menos duraderos y se requiere el uso de dosis más altas (46-50). La TB tiene una alta afinidad por la unión neuromuscular, en donde las terminaciones nerviosas motoras contienen las vesículas de acetilcolina. En circunstancias normales la acetilcolina está contenida en vesículas de las terminaciones nerviosas. La estimulación del nervio produce un aumento de la concentración intraneuronal de calcio, lo cual causa la fusión de la membrana de la vesícula con el plasmalema de la terminación nerviosa y mediante un proceso de exocitosis la acetilcolina se libera, atraviesa la hendidura sináptica y al unirse a los receptores musculares, produce la contracción muscular. Para que se facilite este acoplamiento entre la membrana celular y las vesículas de acetilcolina existen unos complejos de proteínas esenciales para la fusión de las membranas conocidos como SNARE (Soluble N-ethylmeleimide-sensitive factor Attacchment Protein Receptor), los cuales incluyen: a) proteínas vesiculares: VAMP (vesicle-associated membrana protein); b) proteínas de la membrana sináptica: SNAP-25 (synaptosome-associated protein of 25 kD); y c) sintaxina (50,51).
La TB se inyecta en el vientre muscular y actúa sobre la placa motora y sobre las fibras colinérgicas del sistema nervioso autónomo. La toxina es endocitada por la neurona presináptica de la unión neuromuscular e inhibe la exocitosis de la acetilcolina a la hendidura sináptica. Este proceso se lleva a cabo en tres pasos:
1. Unión: es la unión irreversible de la TB con los receptores colinérgicos presinápticos. Existen distintos receptores protéicos para las diferentes neurotoxinas.
2. Internalización: consiste en la entrada de la TB en las terminales presinápticas a través de un proceso de endocitosis.
3. Bloqueo neuromuscular: es el tercer y último paso, una vez internalizada la toxina actúa mediante peptidasas dividiendo a una o más de las proteínas SNARE de cada neurotoxina, inhibiendo el acoplamiento y la fusión entre vesículas y receptores.
La TB-A ejerce su acción preferentemente sobre la proteína de membrana presináptica SNAP-25, mientras que la TB-B actúa especialmente sobre la proteína de membrana de la vesícula presináptica VAMP (49,50,52-55).
La inhibición de la liberación de acetilcolina paraliza la célula muscular y provoca un estado de denervación química. Como reacción a la denervación química, el axón de las motoneuronas alfa emite nuevas ramificaciones dendríticas hacia la célula muscular de las que sólo sobrevive una a los pocos meses. La reacción de los axones a la denervación química explica la pérdida de efecto de la TB, y en la práctica clínica se traduce en un efecto terapéutico transitorio que habitualmente dura entre 3 y 4 meses (49,53).
El uso de la TB-A como tratamiento en los padecimientos neuromusculares se ha asociado a un efecto analgésico importante. Como requisito esencial para la utilización racional de esta terapia en el control del dolor, el paciente debe padecer dolor crónico secundario a un diagnóstico conocido o presumible y que no haya respondido con éxito a los diferentes tratamientos analgésicos habituales (56).
El efecto analgésico de la TB-A se debe a una doble acción:
- Indirecta: al modificar la actividad muscular excesiva o disfuncionante, disminuyendo el espasmo muscular. Los trastornos musculares distónicos mejoran con la toxina al inhibir la transmisión colinérgica de las motoneuronas alfa a nivel de la placa motora y al inhibir la función de las motoneuronas gamma que disminuyen el input aferente de las fibras Ia sobre el arco reflejo de tracción (57,58).
- Directa: al modificar la actividad de las mismas fibras nociceptivas. Varios estudios han venido a demostrar que la TB-A puede reducir la liberación de neuropéptidos como la sustancia P y el péptido relacionado con el gen de la calcitonina. También suprime la liberación de glutamato y de otros neurotransmisores y de moduladores de la función neural como adrenalina y noradrenalina. Se puede plantear con estos efectos que la toxina A puede bloquear la sensibilización periférica e indirectamente reducir la sensibilización central (48,57-62).
Material y métodos
El diseño del estudio fue prospectivo, controlado, longitudinal y aleatorizado en el que se ha valorado la evolución de 20 pacientes divididos en dos grupos. Al primer grupo se les administró TB tipo A (grupo T). Al segundo grupose les trató con TB tipo A y dosis adicional de lidocaína al 2 % (grupo TL). Previamente, ambos grupos, habían respondido de forma positiva a un test con infiltración del músculo afecto con lidocaína al 2 %.
El objetivo principal del estudio era comprobar si al añadir AL a la dosis de TB, conseguíamos un acortamiento en el tiempo de la reducción de la EVA.
Como objetivos secundarios nos plateamos la misma posibilidad en la calidad de vida de los pacientes, utilizando para su medición el índice de Lattinen y, finalmente, valorar la aparición de efectos secundarios desagradables.
Los tratamientos previos de los pacientes incluían antiinflamatorios no esteroideos, opioides, relajantes musculares y anticonvulsivantes. Todos habían mantenido un tratamiento farmacológico durante, al menos, tres meses sin conseguir reducir la EVA por debajo de 5. A todos los pacientes se les realizó una exploración pormenorizada y detenida de los músculos afectos hasta conseguir un diagnóstico preciso.
Todos los pacientes fueron debidamente informados, firmando previamente el correspondiente consentimiento de tratamiento compasivo.
Los criterios de exclusión fueron la presencia de déficit neurológico en el área afectada, tratamiento previo con toxina botulínica y embarazo.
Las infiltraciones se realizaron en quirófano con contraste y bajo control de escopia. Utilizamos para la infiltración aguja espinal con punta tipo Quinque 22 Gx3 ½ de 0,70 x 88 mm.
Para la localización de estos músculos se colocó al paciente en decúbito prono y, previa desinfección de la piel, se introduce aguja en un ángulo de 90 grados, guiándonos con la fluoroscopia, buscando la llamada visión en túnel de la misma, por la que únicamente se visualizará la cabeza de la aguja. Para cada músculo contaremos con dos puntos de referencia, uno en superficie y otro en profundidad, para una vez alcanzada esta introducir el contraste para verificar la posición.
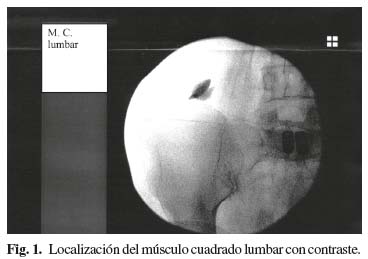
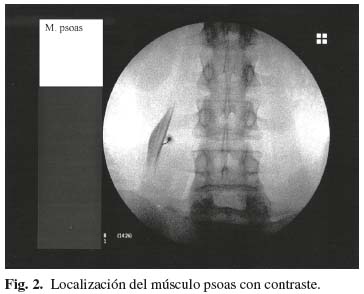
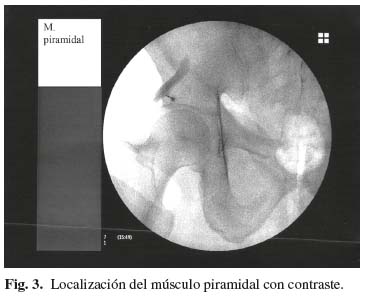
Para la localización del cuadrado lumbar se tomó como referencia de superficie un punto a dos centímetros por encima del punto más alto de la cresta iliaca y, después de girar los Rx 90 grados, la lámina vertebral como punto de referencia en profundidad (Fig. 1). Para la localización del iliopsoas tomamos como referencia en superficie el punto de cruce de la línea que une las apófisis espinosas lumbares con la línea intervertebral L3-L4 o L4-L5 y, después de girar los Rx 90 grados, avanzamos hasta la mitad del cuerpo vertebral correspondiente, como punto de referencia en profundidad (Fig. 2). Para la localización del piramidal tomamos como referencia superficial el ángulo superior de la ceja cotiloidea y el propio ángulo del cotilo en profundidad, previa retirada de 0,5 cm de la aguja, pues en este caso no hace falta girar los Rx 90 grados (3) (Fig. 3).
Se infiltró 100 U de TB tipo A, disueltas en 10 cc de suero fisiológico en psoas y cuadrado lumbar y 50 U disueltas en 8 cc en piramidal. Las dosis de lidocaína fueron de 60mg para músculos psoas y cuadrado lumbar y 40 mg para músculo piramidal, sin diluir.
El seguimiento de los pacientes se realizó por vía telefónica a los 3 y 7 días, y con visita presencial a los 15 y 90 días. Se valoró la intensidad del dolor a través de la escala visual analógica (EVA, en una escala de 0 a 10) y para control de calidad de vida hemos usado el índice de Lattinen. Es un índice que también se ha usado como criterio de control del dolor o como índice de capacidad funcional. Este instrumento de medida se caracteriza por su brevedad, recogiendo cinco ítems que a su vez agrupan cinco dimensiones del paciente con dolor crónico. Estas dimensiones son: intensidad del dolor, nivel de actividad, frecuencia del dolor, utilización de analgésicos y sueño nocturno. También se obtiene una puntuación total, configurada por la suma de las puntuaciones en cada una de las dimensiones anteriores. La puntuación de cada ítem se realiza en una escala de cuatro puntos, que va de la menor incidencia a la mayor gravedad o distorsión (63-67).
El profesional que realizó la valoración desconocía la pauta analgésica empleada, preguntándoles a todos los pacientes por la aparición de efectos secundarios.
Para el análisis estadístico se utilizó un análisis de la varianza, ANOVA, complementada por la prueba de Mauchly para comprobación de la esfericidad y la prueba de Greenhouse-Geisser, con un intervalo de confianza del 95%, considerando una p < 0,05 para establecer diferencias estadísticas.
Resultados
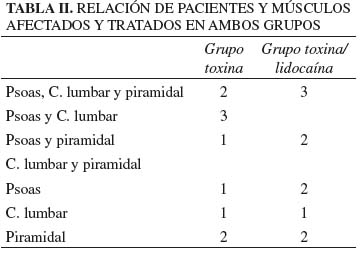
Se incluyó a 20 pacientes en el estudio. Las características demográficas relacionadas con la edad y el sexo se muestran en la tabla I. En la tabla II recogemos los músculos afectados e infiltrados por paciente en cada grupo.
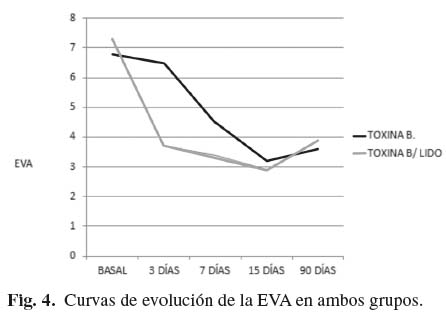
En lo que respecta al dolor, la EVA basal del grupo T fue de 6,8 ± 0,789, mientras que en el grupo TL fue de 7,3 ± 0,949. A los 90 días en ambos grupos hubo una importante y significativa estadísticamente reducción de la EVA (p < 0,001). En la valoración a los tres días la EVA en el grupo T es de 6,5 ± 0,527, mientras en el grupo TL es de 3,7 ± 0,823, apreciándose una diferencia estadísticamente significativa (p < 0,001). En la valoración a los 7 y 15 días, la EVA del grupo TL es inferior al grupo de toxina sola pero sin diferencia estadística significativa. A los 90 días la EVA del grupo T es superior al del grupo TL pero tampoco se aprecia diferencia significativa (Tabla III). En la figura 4 se puede apreciar la evolución de la curva de la EVA en el tiempo en ambos grupos.
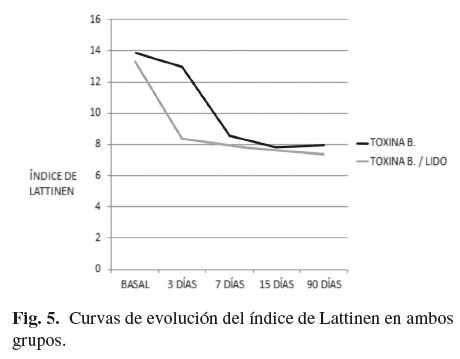
Con relación al índice de Lattinen, la valoración basal en el grupo T es de 13 ± 1,524 y de 13,3 ± 1,635 en el grupo TL. En ambos grupos se redujo de forma estadísticamente significativa (p < 0,001) el valor del índice a los 90 días, 7,9 ± 0,738 en el grupo T y 7,4 ± 0,699 en el grupo TL. También se apreció diferencia estadística significativa en la comparación de ambos grupos en la valoración realizada a los tres días. En el grupo T el valor era de 13,00 ± 1,491 y en el grupo TL el valor fue de 8,4 ± 1,897 (p < 0,001). Si bien los valores del grupo TL son inferiores a los del grupo T en los controles a los 7, 15 y 90 días, en estos casos no se aprecia diferencia estadística (Tabla IV). En la figura 5 se puede apreciar la evolución de la curva del índice de Lattinen en el tiempo en ambos grupos.
No hubo descripción de ningún efecto secundario relevante, solo tres pacientes presentaron ciertos secundarismos. Uno presentó impotencia funcional transitoria en miembro inferior derecho que cedió espontáneamente a los tres días de la infiltración, y dos pacientes con leve cuadro gripal acompañado de leves mialgias.
Discusión
El dolor miofascial es una de las principales causas de dolor en la población en general, evolucionando generalmente hacia la cronicidad a pesar de los tratamientos utilizados de forma empírica (24,68). A pesar de su alta prevalencia sigue estando infradiagnosticada e infratratada. Caracterizada por la presencia de dolor agudo o crónico desencadenado por la presencia de uno o varios puntos musculares con hipersensibilidad, Travel y Simon atribuyeron, en su hipótesis integrada, como posible etiología de los puntos gatillos a una disfunción de la placa motora, existiendo como predisponente una lesión muscular por sobrecarga (7).
No existe una doctrina pacífica a la hora de establecer una cascada gradual para el tratamiento de este síndrome. La principal dificultad para establecer un patrón terapéutico preestablecido radica en la propia heterogeneidad etiológica y fisiopatológica del síndrome miofascial. No obstante, se considera que el tratamiento debe ser individualizado, multidisciplinario y multimodal, considerando utilizar terapia farmacológica, técnicas intervencionistas, fisioterapia de estiramiento de los músculos afectados, masaje sobre los nódulos dolorosos, prácticas de relajación y retroalimentación biológica y acupuntura, siendo el objetivo fundamental del tratamiento aliviar el dolor y el restablecimiento de la función perdida (24,50,69,70).
Si bien hay diversos estudios que confirman la bondad de la TB-A en el tratamiento del síndrome miofascial gracias a su capacidad de controlar el espasmo muscular y a su acción directa analgésica (21,42,71), en una revisión sistematizada publicada en 2001 de 23 ensayos clínicos aleatorizados con infiltración de puntos gatillos, se concluyó que la naturaleza de la sustancia inyectada no marca diferencias en los resultados y que la infiltración de una sustancia no obtiene beneficios terapéuticos, comparado con la punción seca, apoyado por los ensayos clínicos de alta calidad (43). Tampoco encuentra beneficio Pereda en su revisión (72). Sí hay posiciones comunes cuando se admite que el uso de la TB-A en el tratamiento del dolor del síndrome miofascial, debe reservarse para los casos refractarios, en aquellos que los tratamientos conservadores han fracasado (21,73-75).
Otros trabajos demuestran un beneficio de la TB-A frente a la solución salina o aguja seca o frente a triancinolona o metilprednisolona, curiosamente, en este caso, la diferencia en eficacia de la TB-A es mayor que cuando el control es suero salino (40-42,76-78). Precisamente en el estudio de Kamanli (40) no se demuestra superioridad de la toxina botulínica frente a la lidocaína. En una recopilación que recoge los resultados de todos los estudios sobre la eficacia de la TB, se ha observado una mejora del dolor entre el 76 % de los 278 pacientes incluidos en los distintos estudios (79). Por el contrario en el trabajo de Wheeler no se encontraron diferencias significativas entre la toxina botulínica y la solución salina, tanto en la escala de dolor como en la calidad de vida (80). Lang, por su parte, sostiene que el dolor del síndrome miofascial mejora al colocar agujas en los puntos gatillos sin inyectar ningún fármaco o infiltrando suero fisiológico (81), sin embargo, el dolor postinfiltración generado por la infiltración seca es más intenso y duradero que el experimentado por los pacientes tratados con lidocaína (1).
A pesar de que Pereda en su revisión nos apunta que no hay una evidencia suficiente para confirmar la efectividad de la TB-A, no es menos cierto que esto se debe más a la pobre calidad de los estudios y a una muestra insuficiente que a la falta de eficacia intrínseca demostrada de la toxina, de hecho, en la misma revisión, se apunta que no se recomienda pero tampoco se desaconseja el empleo de la TB-A, insistiendo en que es necesario realizar estudios prospectivos con un mayor número de pacientes y con un diseño más apropiado (72).
De cualquier forma, en la clínica diaria está muy extendido el uso de la TB-A en el tratamiento del síndrome miofascial de diversa localización. Este amplio uso se ve reflejado en las numerosas publicaciones que describen las distintas técnicas y dosificación de aplicación de la toxina. Los resultados obtenidos en estos estudios apuntan a un importante efecto beneficioso de la toxina con clara mejoría de los pacientes tanto en la evolución de la EVA como en los índices de calidad de vida (2,24,42,43,50,70,73-76).
Otra cuestión discutible es la dosis de TB-A y la dilución empleada para su administración. La cantidad inyectada debe ser la mínima necesaria para conseguir los objetivos clínicos deseados (70,82), mientras que se recomienda emplear un volumen de inyección mínimo, diluir en poca cantidad de suero fisiológico, para reducir al máximo la difusión del fármaco a otros grupos musculares próximos no deseados y evitar la aparición de efectos secundarios (83). No obstante, es importante mencionar que otros estudios realizados, en los que se utilizaron volúmenes mayores, no reportan complicaciones importantes, lo que nos habla de un perfil de seguridad importante del fármaco (21,50).
Existen diversas orientaciones para el uso de la TB-A en el síndrome miofascial. Las más comunes son dos, aquella que propone la infiltración dentro del punto gatillo o cerca, guiada por los hallazgos de EMG o por palpación y la segunda que se dirige al músculo a tratar, con el objeto de infiltrarlo ampliamente. Las dosis y diluciones utilizadas varían considerablemente en función de cada una de estas perspectivas y explican la gran variedad existente entre las distintas y diversas recomendaciones de dosis y diluciones propuestas por los autores. En general, las propuestas más centradas en los puntos gatillos proponen dosis y diluciones más bajas y las dirigidas al músculo utilizan dosis y diluciones más altas (68,84).
En nuestro caso, al enfocar la infiltración hacia el músculo utilizamos diluciones de 10 cc para los músculos psoas y cuadrado lumbar y de 8 cc para el músculo piramidal, con dosis de 100 U para los primeros músculos y de 50 U para este último, sin que hayamos apreciado difusión a grupos musculares vecinos ni efectos adversos desagradables.
La TB-A tiene un efecto analgésico prolongado que supera incluso al efecto motor, cuyo intervalo es de 2-6meses, siendo conocida también la existencia de un corto periodo de latencia de 7-10 días hasta el inicio efectivo de su acción (42,74,85). El hecho de que a los veinte pacientes de los dos grupos se les había administrado, con anterioridad al tratamiento con TB-A, infiltración con lidocaína, siendo positivo en todos los casos, nos animó a acortar el periodo de latencia de la TB-A con dosis adicionales de lidocaína, en esta ocasión sin diluir para evitar una excesiva administración de volumen en el músculo afecto. Los anestésicos locales producen una relajación previsible, breve y reversible de la musculatura provocada por el bloqueo de la conducción nerviosa en las terminaciones nerviosas, mientras que la TB actúa en las terminaciones neuronales de la placa motora, impidiendo la liberación de la acetil colina. Su acción la ejercen en lugares distintos y con características diferentes. La de los anestésicos locales, como queda dicho, su acción es casi instantánea y breve, la de la TB es diferida y duradera en el tiempo, por lo que pueden ser complementarias y agonistas en su efecto final.
El hecho, estadísticamente significativo, que la EVA y el índice de Lattinen sean menores en la valoración a los tres días en el grupo TL frente al grupo T, nos confirma clínicamente lo que apuntamos. La ausencia de efectos adversos en ambos grupos nos confirma la bondad de la técnica y el escaso riesgo que supone añadir a la dosis de TB-A, pequeñas cantidades de lidocaína para alivio del dolor y de la calidad en los primeros días de la administración del tratamiento.
Conclusiones
El síndrome miofascial de la cintura pélvica presenta una elevada prevalencia, engloba a cuadros muy variados, llegándose a calcular que representa hasta un 80 % del dolor crónico lumbar que llega a las unidades del dolor. Su tratamiento debe ser individualizado, multidisciplinar y multimodal.
La TB-A presenta una alternativa al tratamiento de este cuadro cuando la terapia conservadora ha fracasado. Si bien, en las últimas revisiones sistemáticas no muestra evidencia suficiente para confirmar su efectividad, esto es más en función de la pobre calidad de los estudios realizados, por lo que se desprende la urgente necesidad de realizar estudios metodológicamente rigurosos que confirmen la efectividad real de la TB-A en este síndrome.
La lidocaína es un anestésico local ampliamente usado en la terapia del síndrome miofascial por su menor efecto miotóxico. En ocasiones se ha usado como test previo a la administración de TB y en otras ocasiones como propio tratamiento del síndrome. Su adición al tratamiento con TB-A permite acortar el tiempo de latencia en la mejoría del dolor y de la calidad de vida sin que aparezcan efectos adversos resaltables.
Los avances en el entendimiento de la estructura de la TB-A y de su función permitirán modificar la molécula para producir nuevas estructuras que sean capaces de inhibir la función nociceptiva aferente, sin efecto sobre otras neuronas, incluyendo las motoras.
Bibliografía
1. Francisco F M. Síndromes miofasciales. Reumatol Clin 2009;5(52):36-39. [ Links ]
2. Anderson GBJ. Epidemiological features of chronic low-back pain. Lancet, 1999;354:581-5. [ Links ]
3. Gil E, Martínez GL. Aldaya C, Rodríguez M J. Síndrome de dolor miofascial de la cintura pélvica. Rev Soc Esp Dolor 2007;14(5):358-68. [ Links ]
4. Ho KY, Tan KH. Botulinum toxin A for miofascial trigger point injection: A qualitative systematic review. Eur J Pain 2006;26. [ Links ]
5. Ferreira JJ, Couto M, Costa J, Coelho M, Rosa MM, Sampaio C. Botulinum toxin for the treatment of pain syndromes. Acta Reumatol Port 2006;31:49-62. [ Links ]
6. Monnier G, Tatu L, Michel F. New indicatins for botulinum toxin in rheumatology. Joint Bone Spine 2006;30. [ Links ]
7. Travell JG, Simon DG. Myofascial pain and dysfunction: The trigger point manual. Vol II. Baltimore: Williams & Wilkins; 1991. [ Links ]
8. Vanhoof J, Declerk K, Geusens P. Prevalence of rheumatic diseases in a rheumatological outpatient. Ann Rheum Dis 2002;61:453-5. [ Links ]
9. Skootsky S, Jaeger B, Oye RK. Prevalence of miofascial pain in general internal medicine practice. West J Med 1989;151:157-60. [ Links ]
10. Fishbain DA, Goldberg M, Meagher BR, Steele R, Rosomof H. Male and female chronic pain patients categorized by DSM-III psychiatric diagnostic criteria. Pain 1986;26:181-97. [ Links ]
11. Gerwin RD. A study of 96 subjects examined both for fibromyalgia and myofascial pain. J Musculoske Pain 1993;3:121 (abstract). [ Links ]
12. Simons DG. The nature of miofascial trigger point. Clin J Pain 1995;11:83-4. [ Links ]
13. Gerwin RD. Classification, epidemiology, and natural history of miofascial pain syndrome. Curr Pain Headache Rep 2001;5:412-20. [ Links ]
14. Gobel H, Heinze A, Reichel G, Hefter H, Benecke R; Dysport myofascial pain study group. Dysport miofascial pain study group. Efficacy and safety of a single botulinum type A toxin complex treatment (Dysport) for the relief of upper back miofascial pain syndrome: results from a randomized double-blind placebo-controlled multivcentre study. Pain 2006;125:82-8. Epub 2006 Jun 5. [ Links ]
15. Van Devender J. Myofascial trigger points. Phys Ther 2001;5:412-20. [ Links ]
16. Staud R. Are tender point injections beneficial: the role of tonic nocicepcion in fibromyalgia. Curr Pharm Des 2006;12:23-7. [ Links ]
17. Ferrante Fm, Bearn L, Rothrock R, King L. evidence against trigger point injection technique for the treatment of cervicothoracic miofascial pain with botulinum toxin type A. anesthesiology. 2005; 103:377-83. [ Links ]
18. López JF. Síndrome miofascial en la mujer. Asociación Colombiana para el Estudio del Dolor (ACED). Bogotá; 2008. [ Links ]
19. Velasco M. Toxina botulínica y dolor crónico. En: Pállele C, Bilbeny N, editor. De lo molecular a lo clínico. Mediterráneo. Santiago. 2005; 212. [ Links ]
20. Abram SE. Does botulinum toxin have a role in the management of myofascial pain? Anesthesiology 2005;103:233-4. [ Links ]
21. De Andrés J, Cerdá-Olmedo G, Valia JC, Monsalve V, López MD, Mínguez A. Use of botulinum toxin in the treatment of chronic myofascial pain. Clin J Pain 2003;19:269-75. [ Links ]
22. Ruiz M, Nadador V, Fernández-Aleantud J, Hernández-Salván J, Riquelme I, Benito G. Dolor de origen muscular: dolor miofascial y fibromialgia. Rev Soc Esp Dolor 2007;14. [ Links ]
23. Zohn DA. The quadratus lumborum: An unrecoggnized source of back pain. Orthop Rev 1985;14:87. [ Links ]
24. García Franco M, Climent-Barberá JM, Marimón-Hoyos V, Garrido-Arredondo AM, Pastor-Saura GM, Lópe-García C. Estudio comparativo con dos técnicas de infiltración miofascial en puntos gatillos: punción seca e inyección de anestésico local. 20. Rehabilitación (Madrid) 2006;40:188-92. [ Links ]
25. Oyarzábal A, Laparte MP. Toxina botulínica y dolor miofascial cervical crónico. Estudio piloto. Rehabilitación (Madrid) 2011. Doi:10.1016/j.rh.2011.03.024. [ Links ]
26. Travell J, Simons D, Simons L. Travel&Simons miofascial pain and dysfunction: The trigger manual. Vol 1. 2nd ed. Baltimore: Wiliams & Wilfins; 1999. [ Links ]
27. Travell JG, Simon DG. Dolor y disfunción miofascial: el manual de los puntos gatillo, Vol I. Ed Panamericana; 2001. [ Links ]
28. Windish A, Retinger A, Traxler H, Radner H, Neumayer C, Feigl W, et al. Morphology and histochemistry on myelogelosis. Clin Anat 1999;12:266-71. [ Links ]
29. Shah JP, Philips T, Danoff Jv, Gerber LH. An in vivo microanalytical technique for measuring the local biochemical milieu of human skeletal muscle. J Appl Physiol 2005;99:1977-84. [ Links ]
30. Fisher A. Miofascial pain. Update in diagnosis and treatment. Phys Med 1997;8:69-86. [ Links ]
31. Sluka KA, Dougherthy PM, Sorrkin LS, Willis WD, Westlund KN. Neural changes in acute arthritis in monkeys. Changes in substancia P, calcitonin gene relates peptide, and glutamate in the dorsal horn of the spinal cord. Brain Res Rev 1992;17:29-38. [ Links ]
32. Fischer AA. Pressure algometry (dolometry) in the differential diagnosis of muscle pain. In Rachlin ES, editor. Myofascial pain and fibromyalgia. Trigger point Management. St Louis: Mosby; 1994:121-41. [ Links ]
33. Tough EA, White AR, Richards S, Campbell J. Variability of criteria used to diagnose miofascial trigger point pain syndrome. Evidence from a review of the literature. Clin J Pain 2007;23:278-86. [ Links ]
34. Cordivari C, Misra VP, Catania S, Lee AJ. New therapeutic indications for botulinum toxins. Mov Disord 2004;19(Supl. 8):S 157-61 Review. [ Links ]
35. Acupuncture National Institutes of Health Consens Statement 1997;15:1-34. [ Links ]
36. Cohen SP, Mullings R, Abdi S. The pharmacologic treatment of muscle pain. Anesthesiology 2004;101:495-526. [ Links ]
37. Alonso Ruíz A, Pereda-Testa CA, Uson-Jager J, Sánchez-Magro I, Neira-Álvarez M, Carmona-Ortells L. Fundamentos y evidencia de los antidepresivos y anticonvulsivos en el dolor reumático. Reumatol Clin 2006;2:18-22. [ Links ]
38. Jaeger B, Reeves JL. Quantification of changes in miofascial trigger point sensivity with the pressure algometer following passive strectch. Pain 1986;27:203-10. [ Links ]
39. Bendtsen L, Jensen R. Amitriptyline reduces miofascial tenderness in patients with chronic tension-type headache. Cephalalgia 2000;20(6):603-10. [ Links ]
40. Hermán CR, Schiffman EL, Look JO, Rindal DB. The effectiveness of adding pharmacologic treatment with clonazepam or cyclobebzaprine to patient education and sefcare for the treatment of jaw pain upon awakening: a randomized clinical trial. J Orofac Pain 2002;16(I):64-70. [ Links ]
41. Kamanli A, Kaya A, Ardicoglu O, Ozgocmen S, Zengin FO, Bayik Y. Comparison of lidocaine injection, botulinum toxin injection, and dry needling to trigger points in myofascial pain syndrome. Rheumatol Int 2005;25:604-11. [ Links ]
42. Cheschire WP, Abashian SW, Mann JD. Botulinum toxin in the treatment of myofascial pain syndrome. Pain 1994;59:65-9. [ Links ]
43. Porta MA. A comparative trial of botulinum toxin type A and methylprednisolone for the treatment of myofascial pain syndrome and pain from chronic muscle spasm. Pain 2000;85:101-5. [ Links ]
44. Cummings TM, With AR. Needling therapies in the management of miofascial trigger point pain: A systematic review. Arch Phys Med Rehabil 2001;82:986-92. [ Links ]
45. Catterall WA, Mackie K. Local Anesthestics. En: Hardman JG, Limbird LE, editors. Goodman & Gilman's The Pharmacological Basis of Therapeutic. 10th ed. McGraw - Hill. USA. 2001. p. 367-84. [ Links ]
46. Chan SK, Karmakar MK, Chui PT. Local anaesthesia outside the operating room. HKMJ; 2002;8(2):106-13. [ Links ]
47. Brin MF. Botulinum toxin: Chemistry, pharmacology, toxicity and immunology. Muscle nerve 1997;6(Supl.):S146-168. [ Links ]
48. Callaway JE. Botulinum toxin type B (Myobloc): Pharmacology and biochemistry. Clin Dermatol 2004;22:23-8. [ Links ]
49. Aoki KR. Botulinum toxin: A successful therapeutic protein. Cur Med Chem 2004;11:3085-92. [ Links ]
50. Dolly O. Synaptic transmission: inhibition of neurotransmitter release by botulinum toxins. Headache 2003;43(Supl. 1):S16-24. [ Links ]
51. Torres JC. Toxina botulínica A: mecanismo de acción en el manejo del dolor. Rev Iberoamericana del Dolor 2007;3:32-40. [ Links ]
52. Rowland LP. Stroke, spascity and botulinum toxin. N Engl J Med 2002;347:382-3. [ Links ]
53. Humeu Y, Doussau F, Grant NJ, Poulain B. How botulinum and tetanus neurotoxins block neurotransmitter release. Biochimie 2000;82:427-46. [ Links ]
54. Blasi, Chapman ER, Link E. Botulinum neurotoxin A selectively cleaves the synaptic protein SAP-25. Nature 1993;265:160-3. [ Links ]
55. Black JD, Dolly JO. Interaction of 5I-labeled botulinum neurotoxins with nerve terminals. I. Ultraestructural autoradiographic localitation and quantitation of distinc membrane acceptors for types A and B on motor nerves. J Cell Biol 1986;103:521-34. [ Links ]
56. Sollner T, Whiteheart SW, Brunner M, Erdjument-Bromage H, Geromanos S, Tempst P. SNAP receptors implicated in vesicle targeting and fusion. Nature;362:318-24. [ Links ]
57. Thant ZS, Tan EK. Emerging therapeutic applications of botulinum toxin. Med Sci Monit 2003;9:40-8. [ Links ]
58. Rosales RL, Arimura K, Takenaga S, Osame M. Extrafusal and intrafusal muscle effects in experimental botulinum toxin-A injection. Muscle Nerve 1996;19:488-96. [ Links ]
59. Mense S. Neurobiological basis for the use of botulinum toxin in pain therapy. J Neruol 2004;251(Supl. 1):11-7. [ Links ]
60. Cui M, Aoki KR. Botulinum toxin type A reduces inflammatory pain in the rat formalin model. Cephalalgia 2000;20:414. Abstract 369. [ Links ]
61. Cui M, Li Z, You S, Khanijou S, Aoki KR. Mechanisms of the antinociceptive effect of subcutaneous BOTOX: inhibition of pheripheral and central nociceptive processing. Abstract of the international conference 2002: Basic and Therapeutic Aspects of Botulinum and Tetanus Toxins. Naunyn Schmiedeberg Arch Pharmacologic. 2002;365:R17:Abstract 33. [ Links ]
62. Welch MJ, Purkiss JR, Foster KA. Sensitivity of embryonic rat dorsal root ganglia neurons to Clostridium botulinum neurotoxins. Toxicon 2000;38:245-58. [ Links ]
63. Aoki KR. Pharmacology and immunology of botulinum toxin serotypes. J. Neurol 2001;248:3-10. [ Links ]
64. Monsalve V, Soriano J, De Andrés J. Utilidad del Índice de Lattinen (IL) en la evaluación del dolor crónico: relaciones con afrontamiento y calidad de vida. Rev Soc Esp Dolor 2006;4:216-29. [ Links ]
65. Sriwatanakul K, Kelvie, Lasagna L. Studies with different types of visual analogue scales for measurement of pain. Clin Pharmacol Ther 1983;34:234-9. [ Links ]
66. Torres LM, Calderón E, Rey RM. Fentanilo transdérmico (Durogesic): características farmacológicas y aplicación clínica. Rev Soc Esp Dolor 1999;6:121-31. [ Links ]
67. Abejón D, Delgado C, Nieto C, et al. Tratamiento de la radiculopatía lumbar con radiofrecuencia pulsada. Rev Soc Esp Dolor 2004;11:345-52. [ Links ]
68. Casals M, Samper D. Epidemiología, prevalencia y calidad de vida del dolor crónico no oncológico. Estudio ITACA. Rev Soc Esp Dolor 2004;11:260-9. [ Links ]
69. Casals M, Samper D. Efectividad, tolerabilidad y calidad de vida en el tratamiento del dolor crónico no oncológico, con tramadol de liberación controlada en dosis única diaria. Rev Soc Esp Dolor 2004;11:129-40. [ Links ]
70. Reilich P, Fheodoroff K, Kern U, Mense S, Seddigh S, Wissel J, et al. Consensus statement: Botulinum toxin in myofsacial pain. J Neurol 2004;251:Supl. 1:36-8. [ Links ]
71. Cohen SP, Mullings R, Abdi S. The pharmacologic treatment of muscle pain. Anesthesiology 2004;101:495-526. [ Links ]
72. Castro M, Cánovas L, García Rojo B, Morillas P, Martínez Salgado J, Gómez Pombo A. Tratamiento del síndrome de dolor miofascial con toxina botulínica tipo A. Rev Soc Esp Dolor 2006;2:96-102. [ Links ]
73. Hubbard DR. Chronic and recurrent muscle pain: Pathophysiology and treatment, an review of pharmacologic studies. J Musculoskeletal Pain 1996;4:123-4. [ Links ]
74. Pereda CA, Usón J, Carmona L. Revisión sistemática: ¿es recomendable el empleo de toxina botulínica como tratamiento del dolor en el síndrome miofascial? Reumatol Clin 2006;2(4):173-82. [ Links ]
75. Childers MK, Wilson DJ, Gnatz SM, Conway RR, Sherman AK. Botulinum toxin type A use in piriformis muscle syndrome: a pilot study. Am J Phys Med Rehabil 2002;81:751-9. [ Links ]
76. Raj PP. Botulinum toxin therapy in pain management. Anesthesiol Clin North America 2003;21:715-31. [ Links ]
77. Royal MA. Botulinum toxin in pain management. Phys Med Rehabil Clin N Am 2003;14:805-20. [ Links ]
78. Foster l, Clapp L, Erickson M, Jabbari B. Botulinum toxin A and chronic low back pain: a randomized, double-blind study. Neurology 2001;56:1290-3. [ Links ]
79. Voller B, Sycha T, Gustorff B, Schmetterer L, Lehr S, Eichler HG, et al. A randomized, double blind, placebo controlled study on analgesic effects of botulinum A toxin. Neurology 2003;61:940-4. [ Links ]
80. Porta M. Botulinum toxin type a injections for myofascial pain syndrome and tension-type headache. Eur J Neurol 1999;6(Supl.4):S103-9. [ Links ]
81. Lang AM. A preliminary comparison of the efficacy and tolerability of botulinum toxin serotypes A and B in the treatment of myofascial pain syndrome: A restrocpective, open-1 abel chart review. Clin Ther 2003;25:2268-78. [ Links ]
82. Wheeler AH, Goolkasian P, Gretz SS. Botulinum toxin A for the treatment of chronic neck pain. Pain 2001;94:255-60. [ Links ]
83. Lang AM. Botulinum toxin type A therapy in chronic pain disorders. Arch Phys Med Rehabil 2003;84:S69-73. [ Links ]
84. Jankovic J, Schwartz K. Response and inmunoresistance to botulinum toxin injections. Neurology 1995;45:1743-6. [ Links ]
85. Stell R, Thompson PD, Marsden CD. Botulinum toxin in spasmodic torticollis. J Neurol Neurosurg Psychiatry 1988;52:920-3. [ Links ]
86. Gobel H. Botulinum toxin A in pain management: Mechanisms of action and rationales for Optimun use. Pain Headache 2003;14:4-22. [ Links ]
87. Wheeler AH. Myofascial pain in disorders: Theory to therapy. Drug 2004;64:45-62. [ Links ]
88. Foster KA. A new wrinkle on pain relief re-engineering clostridial neurotoxins for analgesics. Drugs Discovery Today 2005;10(5):563-9. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Ignacio Velázquez Rivera
Servicio de Anestesiología y Unidad del Dolor
Hospital Alta Resolución de Guadix
Avda. de Mariana Pineda, s/n
18500 Guadix, Granada
e-mail: ignavel50@hotmail.com
Recibido: 27-04-13.
Aceptado: 02-07-13.