Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.21 no.5 Madrid sep./oct. 2014
https://dx.doi.org/10.4321/S1134-80462014000500006
Tratamiento del dolor neuropático central; futuras terapias analgésicas. Revisión sistemática
Treatment of central neuropathic pain; future analgesic therapies. Systematic review
R. Mora Moscoso1, M. Guzmán Ruiz2, A.M. Soriano Pérez1 y R. de Alba-Moreno1
1Servicios de Anestesiología, Reanimación y Tratamiento del Dolor, y
2Medicina Familiar y Comunitaria. Complejo Hospitalario de Jaén. Jaén
Dirección para correspondencia
RESUMEN
Introducción: el dolor neuropático central (DNC) es aquel causado por una lesión primaria o disfunción del sistema nervioso central que genera una patología incapacitante, difícil de reconocer y tratar. Las causas más frecuentes son accidente cerebrovascular (ACV), esclerosis múltiple y lesión medular traumática.
Objetivos: realizar revisión sistemática de las principales causas de dolor neuropático central, presentar evidencia de la efectividad y tolerabilidad de las opciones terapéuticas actuales y analizar las tendencias analgésicas futuras.
Material y métodos: se realizó búsqueda de metaanálisis y revisiones sistemáticas en MEDLINE/PubMed, EMBASE, Ovid y Registro Cochrane de Ensayos Controlados (CENTRAL) usando diferentes estrategias de búsqueda. Los artículos relacionados con el DNC se clasificaron según su etiopatogenia en dolor post-ACV (CPSP), dolor por esclerosis múltiple (EM) y dolor post-lesión medular (LME), y fueron evaluados de forma sistémica.
Resultados: actualmente se tiene una incompleta compresión de la fisiopatología de este tipo de dolor; existen muy pocos estudios, en comparación con otros tipos de dolor, siendo estos en su mayoría estudios con muestras pequeñas, diseño abierto en humanos o modelos animales. Se precisa la utilización de instrumentos específicos de evaluación del dolor, validadas para cada patología, así como incluir un enfoque multi-modal para tratar este dolor de reconocida naturaleza multifactorial, combinando terapias farmacológicas, físicas, psicológicas e intervenciones cognitivo-conductuales.
Conclusiones: se necesitan más estudios para comprender la fisiopatología del dolor neuropático central, mejorar la eficacia de los tratamientos y definir pacientes candidatos a cada uno según características clínicas, síntomas o signos predictivos. Así como investigar las nuevas modalidades terapéuticas, comparándolas con fármacos activos de referencia. En la actualidad no hay suficiente evidencia científica sólida para poder realizar protocolos estandarizados para el tratamiento del DNC.
Palabras clave: Dolor neuropático central. Tratamiento. Dolor post-ACV. Esclerosis múltiple. Lesión médula espinal.
ABSTRACT
Background: The central neuropathic pain (DNC) is that caused by a primary lesion or dysfunction of the central nervous system that generates an incapacitating condition, difficult to recognize and treat. The most common causes are stroke (CVA), multiple sclerosis and spinal cord injury.
Objectives: To perform a systematic review of the main causes of central neuropathic pain, present evidence of the effectiveness and tolerability of current treatment options and analyze trends analgesic for future.
Material and methods: We performed meta-analysis and search for systematic reviews in MEDLINE/PubMed, EMBASE, Ovid and Cochrane Central Register of Controlled Trials (CENTRAL) using different search strategies. The DNC related articles were classified by etiopathogenesis poststroke pain (CPSP), pain of multiple sclerosis (MS) and pain after spinal cord injury (SCI), and were evaluated systemically.
Results: Currently we have an incomplete understanding of the pathophysiology of this type of pain, there are few studies, in comparison with other types of pain, and these studies mostly with small samples, open design in human or animal models. It requires the use of specific and validated assessment instruments specific to each condition, and to include a multi-modal approach to treatment, combining drug therapies, physical, psychological and cognitive behavioral interventions.
Conclusions: We need more studies to understand the pathophysiology of the central neuropathic pain, improve the effectiveness of treatments and identify eligible patients each according to clinical characteristics, symptoms or signs predictive, and to investigate new therapeutic modalities, comparing drug reference assets. At present there is not enough solid evidence to perform standardized protocols for treatment of DNC.
Key words: Central neuropathic pain. Neuralgia treatment. Central poststroke pain. Multiple sclerosis. Spinal cord injuries.
Introducción
El dolor neuropático es aquel generado por cualquier lesión o enfermedad que afecta al sistema somatosensorial (de forma total o parcial), tanto en sistema nervioso central como periférico, afectando los mecanismos neuromoduladores de las vías de transmisión nociceptivo (1). Se acompaña de diferentes trastornos neurológicos a distintos niveles (sensitivo, motor, vegetativo). Presenta una fisiopatología compleja y multifactorial. Además genera una elevada intensidad de dolor con gran comorbilidad (componente emocional, interferencia del sueño, perdida de actividad física, y falta de energía) siendo difícil su manejo, no obteniendo alivio superior al 60 % con tratamiento adecuado.
El dolor neuropático según su origen se divide en dolor neuropático central, periférico o mixto (2). La Asociación Internacional para el Estudio del Dolor (IASP) define el dolor central como "dolor iniciado o causado por una lesión primaria o disfunción del sistema nervioso central". Las causas más frecuentes de dolor neuropático central son accidente cerebrovascular (ACV), esclerosis múltiple y lesión medular traumática.
La mejora de los métodos diagnósticos demuestra un aumento de la prevalencia del DNC debido al envejecimiento de la población, constituyendo una patología cuya frecuencia va en aumento, y que puede llegar a ser incapacitante.
El objetivo del estudio es realizar una revisión sistemática de las principales causas de DNC, presentar evidencia de la efectividad y tolerabilidad de las opciones terapéuticas presentes, proponer recomendaciones y analizar las tendencias actuales en investigación y las terapias analgésicas futuras.
Material y métodos
Se buscaron artículos sobre tratamiento del DNC que fueron recogidos mediante diferentes estrategias de búsqueda en distintas bases de datos. Se seleccionaron los artículos de mayor relevancia (metaanálisis, revisiones sistemáticas) publicados en los últimos diez años en lengua inglesa o española. En detalle se realizaron búsquedas en las bases de datos MEDLINE/PubMed, EMBASE, Ovid y Registro Cochrane de Ensayos Controlados (CENTRAL) en las que se introdujeron diferentes combinaciones de las palabras clave "central neuropathic pain", "neuralgia", "treatment", "therapy", "central poststroke pain"," multiple sclerosis", "spinal cord injuries". Se obtuvieron 25 artículos relacionados con el DNC que se clasificaron según etiopatogenia del mismo en artículos sobre dolor post ACV, dolor por esclerosis múltiple y dolor lesionados medulares. Después fueron evaluados de forma sistémica.
Resultados
Dolor post-ACV (CPSP)
CPSP (central post stroke pain) se caracteriza por ser un dolor constante o intermitente que se produce después del accidente cerebrovascular isquémico o hemorrágico; habiéndose demostrado que la lesión en la vía espinotalámica es una condición necesaria, pero no suficiente, para desarrollar el CPSP (3), aunque la fisiopatología del proceso aún no se conoce totalmente se han sugerido fenómenos como la desinhibición central, el desequilibrio de los estímulos (hiperexcitación en vías sensoriales dañadas, daños en vías inhibitorias centrales) y la sensibilización central (4). Las revisiones de los diferentes estudios clínicos en pacientes con ictus presentan una prevalencia de CPSP del 8 % al 46 %, atribuyendo esta variabilidad a la heterogeneidad de etiologías, localizaciones de la lesión, diseño del estudio y momento desde el accidente (5). En el 40 %-60 % de los pacientes CPSP, la aparición de dolor central tras un derrame cerebral se produce más de 1 mes (hasta tres años) después del accidente, creando incertidumbre diagnóstica o el retraso significativo en el tratamiento (6). Debido a que los accidentes cerebrovasculares son una patología frecuente y en progresivo aumento por el envejecimiento de la población, el CPSP que es una condición difícil de tratar afectará un gran número de personas, de las cuales no todas están bajo control médico (3,7).
Además de dolor crónico, pueden presentar complicaciones motoras (debilidad, espasticidad y afasia) e importantes de anormalidades somatosensoriales (alodinia, hiperalgesia) y alteraciones funcionales comórbidas (depresión, ansiedad, pérdida de sueño, apetito y libido) que también precisan tratamiento y además se potencian por la intensidad del dolor y falta de eficacia del tratamiento analgésico, generando alto riesgo de suicidio (3), precisándose un examen exhaustivo del paciente para evaluación clínica antes de iniciar el tratamiento (6).
El tratamiento de CPSP sigue siendo un desafío con opciones terapéuticas limitadas en número y eficacia; el objetivo del tratamiento debe ser la reducción del dolor y no el alivio de este (5-7), informando al paciente de la naturaleza de su dolencia y de que no aparecerá alivio hasta alcanzar dosis máximas de drogas que se logran gradualmente en un periodo de tiempo (7) (Tabla I).
Tratamiento farmacológico
El enfoque terapéutico que utilizan algunos autores de ir sumando paso a paso medicación de diferente grupo al ir siendo insuficiente con el fármaco anterior, no ha sido aprobado debido a falta de pruebas sólidas en su eficacia (5).
Antidepresivos
Especialmente los tricíclicos (ADT) han demostrado actividad analgésica específica independientemente de su efecto antidepresivo. Existe gran variabilidad individual en cuanto a dosis óptima de ADT para alivio del dolor. La amitriptilina se iniciará dosis bajas 10-20 mg/día, que ascenderá semanalmente, siendo eficaz 4-7 días después de alcanzar dosis optima (hasta 100 mg/d); aunque la mayoría de los pacientes son incapaces de alcanzar una dosis óptima que alivie el dolor debido a los efectos secundarios anticolinérgicos; a pesar de ello la amitriptilina es eficaz, segura y bien tolerada en comparación con placebo (PCB) para el tratamiento de CPSP (nivel de evidencia IIb), pero no es eficaz para prevenir este. Antidepresivos con mejor perfil de seguridad (como inhibidores selectivos de la recaptación de serotonina) parecen ser significativamente menos eficaces en CPSP, pero no existen estudios que lo confirmen; la fluvoxamina fue parcialmente eficaz en CPSP en estudio abierto (4,5,7).
Antiepilépticos
Reducen la hiperexcitabilidad neuronal a través de modulación de canales de sodio, calcio y/o su efecto sobre aminoácidos excitatorios y/o desinhibición mediada por GABA. La carbamazepina (CBZ) 800 mg/día, precisando escala gradual de dosis, no produjo un alivio significativo del dolor en comparación con PCB, además su uso está limitado por sus efectos secundarios, aunque un tercio de los pacientes respondieron con tendencia a la mejoría, por esto se usa como coadyuvante a la terapia antidepresiva. La oxcarbacepina puede sustituira CBZ en pacientes intolerantes a este, pero los ensayos controlados son insuficientes. La lamotrigina (LMT) 200 mg/d en un ECA presentó eficacia significativa en pacientes CPSP (nivel evidencia IB) con reducción media del dolor espontáneo del 30 %, siendo también eficaz en alodinia fría, pero no en la mecánica, por lo que no existían diferencias en el dolor que afecta a las actividades de la vida diaria o en cuanto a el uso de medicación de rescate (8). Varios estudios sugieren el beneficio de gabapentina (GBP) en el CPSP, las dosis varían 1.200-3.600 mg/d y, aunque es bien tolerada, presenta efectos adversos como: mareos, somnolencia y aumento de peso a largo plazo. La zonisamida fue útil en dos pacientes con infartos talámicos posterolaterales. La fenitoína demostró ser eficaz en series de casos, pero no existe ningún ensayo doble ciego, por tanto no existen pruebas concluyentes para zonisamida ni fenitoína. Topiramato, clonazepam y valproato no son útiles en DNC. Se espera el resultado de un estudio multicéntrico aleatorizado, doble ciego controlado con PCB que evalúa la eficacia de pregabalina (PGB), que actualmente se muestraeficaz (4,5,7). Aunque en un primer ensayo clínico la pregabalina no mostró ningún efecto en la puntuación de dolor o de respuesta en pacientes con CPSP, en un segundo ensayo sobre pacientes con diversos tipos de DNC la PGB fue significativamente mejor que el placebo para el grupo en general sin existir diferencias entre los subgrupos de pacientes con CPSP o dolor debido a lesión de la medula espinal (8).
Opioides
Varios estudios controlados sugerían que los opioides pueden aliviar el dolor neuropático utilizando el doble de dosis que se precisa para el dolor nociceptivo. La morfinaIV no produjo un alivio significativo en comparación con los controles, sin embargo un 46 % de los pacientes refiere beneficio significativo de la administración aguda de la droga, y la mayoría se sintieron aliviados con morfina sostenida incluso tras un mes, sugiriendo que la morfina IV es eficaz para ciertos tipos de dolor neuropático (alodinia inducida). También fue informado eficaz el tramadol IV en pacientes refractarios a CBZ y ADT. Los opioides orales parecen ser eficaces en un subgrupo de pacientes con DNC. Sin embargo el beneficio de los opioides es menor del 20% por encima de 1-2 años por lo que se puede concluir que la morfina es ineficaz para CPSP (evidencia IIB) y solo un estudio mostró el tramadol como beneficioso. La naloxona IV no es de ningún valor. No existen estudios controlados para uso de metadona en CPSP (4,5,7).
Antiarrítmicos
Anestésicos locales y derivados: son bloqueadores de canales de sodio. Alivian dolor espontáneo, alodinia mecánica, dinámica y estática. La lidocaína IV es el agente más eficaz para DNC mejorando significativamente la calidad del dolor, alodinia inducida e hiperalgesia mecánica en 69% de pacientes, aliviando hasta 45 min después de la inyección (evidencia IIB). La mexiletina, análogo oral, se utilizó a 400-800 mg/d sin ser tan eficaz (4,5,7).
N-metil-D-aspartato (NMDA)
Ketamina IV produjo mejoría en un paciente CPSP no respondedor, pudiendo utilizarse en CPSP refractario como medida a corto plazo. La dosis de mantenimiento oral: ketamina (50mg/8 h) y diazepam oral (5 mg/8 h) para la disforia producida por ketamina. El problema de la ketamina es su estrecha ventana terapéutica. Bloqueantes NMDA orales como dextrometorfano demostraron menor efectividad que la ketamina.
Pentotal y propofol
En administración intravenosa pueden ser eficaces durante un corto periodo de tiempo.
Baclofeno
Eficaz en reducir el dolor en CPSP pero solo por vía intratecal.
Ziconotide
Ha demostrado ser eficaz en dolor neuropático; sólo existe vía intratecal. Sugiere la necesidad de estudios adecuados de otros bloqueadores de canales de calcio vía oral (7).
Tratamiento no farmacológico
Lesión DREZ (Dorsal Root Entry Zone)
Lesión en zona de entrada del ganglio de la raíz dorsal; procedimiento quirúrgico (mediante radiofrecuencia) que es una opción de tratamiento en pacientes refractarios a medidas conservadoras y la estimulación de la ME. Otros tipos de cirugías como rizotomías, simpatectomías, cordotomías, talamotomía, gyrectomía postcentral, lobotomía central y cingulotomía se han utilizado principalmente en pacientes LME con resultados impredecibles a corto plazo, asociando morbilidad y mortalidad significativas (7).
Estimulación de la columna dorsal
La estimulación de las columnas posteriores de la ME ha demostrado cierta eficacia en la reducción del DNC debido a LME; los estudios futuros deben examinar eficacia de esta en pacientes CPSP (7).
Estimulación cerebral profunda (Deep Brain Stimulation, DBS)
Mediante electrodos implantados en sustancia gris periventricular, los núcleos talámicos específicos sensoriales o la capsula interna; demostraron una reducción del DN intratable farmacológicamente del 40-50 % debido al efecto inhibidor en tálamo sensorial, la liberación endógena de opiáceos y la alteración de ciertos sistemas vasomotores (7).
Estimulación de la corteza motora (MCS)
Inhibe vías ascendentes nociceptivas por estimulación de la corteza motora. Se ha demostrado reducción significativa del dolor en pacientes CPSP con diferentes tasas de respuesta (hasta 67 %) en múltiples estudios; la estimulación cerebral profunda ha sido eficaz en el síndrome del ictus talámico. Datos de resonancia magnética han relevado que hay una reorganización funcional en el dolor del miembro fantasma en curso, pudiendo proporcionar bases fisiológicas de la eficacia de la estimulación cortical. Actualmente esta prometedora modalidad de tratamiento se utiliza al tratamiento del dolor neuroquirúrgico en pacientes que no han respondido a todo lo demás. La estimulación magnética transcraneal repetitiva (rTMS) es un tipo no invasivo de estimulación de la corteza cerebral que ha sido eficaz en CPSP y puede producir alivio duradero, pero no es tan eficaz en ACV del tronco cerebral (4,5,7).
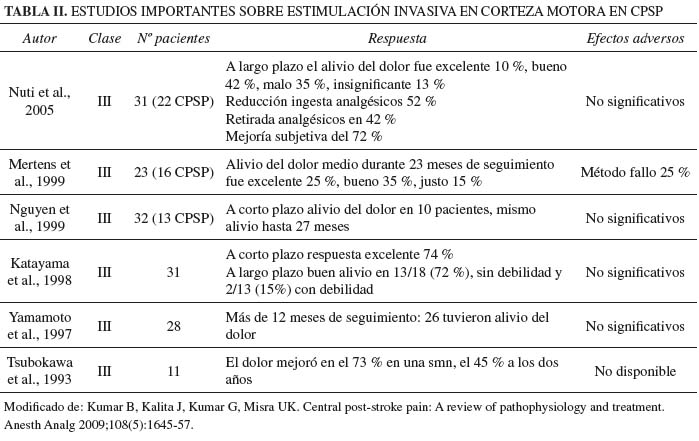
Estudios recientes demuestran que la respuesta tanto a la DBS como a la MCS es menos eficaz en CPSP que en DNP, precisándose estudios adicionales para mejorar eficacia y definir pacientes candidatos que obtendrían mayor beneficio de este procedimiento (7) (Tabla II).
La estimulación calórica vestibular (VCS)
Sin datos de eficacia en CPSP; precisa más estudios.
La estimulación nerviosa transcutánea (TENS) y acupuntura
Útil en ocasiones como complemento de la terapia farmacológica y psicológica, tanto TENS estándar como de baja frecuencia. Pero la mejora no se observa en muchos pacientes y su efecto suele ser temporal.
Dolor en esclerosis múltiple (EM)
La mitad de los pacientes con EM padecen dolor y el 75 % de estos refieren haberlo sufrido en el último mes (9), el tratamiento para el dolor representa casi el 30 % del consumo total de medicamentos para estos pacientes que pueden experimentar más de un tipo de dolor al mismo tiempo, siendo difícil diferenciar neuropático de nociceptivo, y en cualquier momento durante el curso de la enfermedad (incluso en los casos de reciente diagnóstico). El dolor en la EM puede estar asociado con otros síntomas (espasticidad, fatiga y trastornos del humor). Muchas de las características clínicas del dolor son difíciles de describir y reconocer. La mayoría de la evidencia clínica se deriva de estudios piloto de diseño abierto y con pequeños tamaños muestrales, sin poder realizar estudios controlados con PCB debido a las consideraciones éticas, basándose la terapia analgésica en informes anecdóticos y la experiencia de los clínicos (10).
Es crucial la correcta identificación y gestión del dolor, ya que influye en su calidad de vida y afecta a las actividades cotidianas, empeorando la salud mental y produce una desventaja social en el paciente (9-11).
La EM no se produce de forma aislada. La patogénesis de múltiples facetas de la EM implica interacciones complejas entre el sistema inmune y el SNC, siendo las terapias actuales solo parcialmente eficaces. Para aumentar la eficacia del tratamiento se pueden combinar dos o más fármacos con mecanismos de acción complementarios, obteniendo efectos terapéuticos aditivos o sinérgicos (12,13). Existen comorbilidades frecuentes sobre todo al envejecer la población. El dolor puede tener orígenes diversos (dolor en el lugar de punción asociado a la terapia).
Tratamiento DNC en LEM
El DNC tiene una prevalencia de casi 50 % en EM, asocia signos como hiperalgesia y alodinia en el 38 % de los pacientes. Se ha demostrado aumento de astrocitos macrófagos y reactividad de la glía en asta dorsal superficial como principales mediadores del DN (10).
ADT
Todos los tricíclicos son fármacos de elección, estudios clínicos aleatorizados proporcionan indicios sobre su eficacia. Efectos adversos anticolinérgicos (10,11).
Antiepilépticos
Estos parecen ser eficaces en DNC en parte; su potencial no ha sido estudiado en riguroso ensayo clínico; además muchos pacientes no pueden avanzar en su régimen terapéutico hasta controlar el dolor por la presencia de efectos adversos. La CBZ es la más usada en DNC por EM, aunque a menudo es insuficiente o problemática por sus efectos adversos. La LMT 400 mg/d presenta resultados dispares: en un estudio generó mejoría parcial del dolor como coadyuvante, manteniendo beneficio hasta un año, pero un ensayo aleatorizado doble ciego no encontró diferencias en cambio medio de intensidad de dolor ni en la calidad de vida, entre este y PCB (8). La GBP a 600 mg/d se muestra eficaz en estudio abierto con muestra pequeña, pero con una tasa de efectos adverso del 50 %. Levetiracetam a 3.000 mg/d redujo notablemente el dolor en un ensayo aleatorio doble ciego controlado con PCB (8,10,11). La PGB también se ha mostrado eficaz en estudio piloto abierto, pero mostró mayor tasa de abandono de tratamiento por efectos adversos que el resto, sobre todo en pacientes mayores con medicación adicional que actúan sobre SNC (10,11).
Opioides
Solo hay un estudio aleatorizado doble ciego; falta de evidencia para usar morfina en DNC en pacientes con EM (10,11).
Antiarrítmicos y anestésicos locales
La combinación de lidocaína 6 mg/kg/h con mexiletina (300-400 mg/d) reduce dolor, convulsiones tónicas y dolor paroxístico durante 30-51 min. Sin embargo la evidencia de la combinación de ambos actualmente es limitada (10,11).
Baclofeno intratecal
Indicado para el tratamiento de la espasticidad severa; el resultado de dos estudios en EM indica insuficiente evidencia para tratar el DNC en estos pacientes (10,11).
Cannabinoides
Evaluados para el tratamiento del dolor, la espasticidad y los trastornos del sueño en EM (14-16). Parecen tener efecto positivo sobre el dolor, pero existe variabilidad de respuesta individual (9-13). Dronabinol 10 mg redujo intensidad del dolor y mejoró calidad de vida en comparación con PCB. Un spray bucal de extracto de cannabis Δ9-tetrahidrocannabinol (Δ9-THC) produjo beneficios con respecto a la intensidad del dolor pero los pacientes sufrieron déficit de memoria a largo plazo. Otra preparación sublingual Δ9-THC y cannabidiol mejoró notablemente el dolor en ensayo clínico, doble ciego cruzado con PCB (17), aunque se informó de gran efecto PCB por lo que no se encontró diferencia estadísticamente significativa.
Tratamiento de otros síndromes comunes en la EM
La neuralgia del trigémino
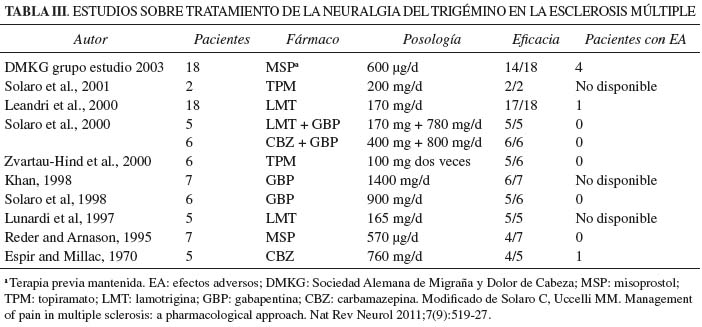
Su prevalencia en pacientes con EM es del 1,9 %-6,3%, produce dolor intenso. LMT y GBP se muestran prometedores pero la mayoría de estudios son de diseño abierto con muestra pequeña y sin comparar con grupo control PCB, por lo que la evidencia disponible es insuficiente para apoyar efectividad de LMT, GBP, topiramato y misoprostol. Las diferentes intervenciones quirúrgicas (rizotomías, descompresiones vasculares de la raíz del trigémino) mostraron resultados impredecibles en los diferentes estudios (10,11).
Otros síndromes en EM
Neuritis óptica, signo de Lhermitte y neuralgia del glosofaríngeo han respondido al tratamiento con CBZ.
Espasmos tónicos dolorosos (PTS)
Son más frecuentes en extremidades inferiores. Aparecen en un 11 % de los pacientes con EM. Se tratan con: baclofeno, BZD y CBM; existen estudios prometedores sobre el uso de GBP y toxina botulínica pero el número limitado de pacientes y el diseño abierto del estudio impiden establecer conclusiones por el momento (10,11) (Tabla III).
Dolor en lesionados medulares (LME)
La lesión de la medula espinal (LME) conduce a discapacidad con pérdida de calidad de vida sin existir una cura satisfactoria, la terapia actual reduce un 20-30 % la intensidad del dolor (18).
Con una incidencia anual de 15-40 pacientes por millón de habitantes, un promedio de edad de 30 años y predominio de sexo masculino, en región cervical-torácica, apareciendo la clínica en los seis primeros meses tras la lesión (19,20), generando altos costes económicos.
Dependiendo del nivel de la LME y su gravedad, se producen una combinación de pérdida sensorial, funciones motoras y autonómicas: paraplejia, tetraplejia, afagia, incontinencia y dolor. El dolor es una complicación importante que disminuye la funcionalidad del paciente, superponiéndose en la mayoría de ocasiones dolor nociceptivo y neuropático (20,21). El DNC aparece en un 65-85 % de estos pacientes, siendo en 1/3 de los casos dolor severo, que además tiende a empeorar al asociarse otros síntomas como fatiga, debilidad y pérdida de memoria (19).
Tratamiento DNC en LME
Tratamiento farmacológico
Sigue siendo la base para el tratamiento del dolor en LME.
- Antiepilépticos: GBP y PGB presentan mejora del DN en LME (evidencia I) (8,18,22,23). LMT es eficaz en reducción del DNC en individuos con LME incompleta (evidencia II). El ácido valproico debe estudiarse ya que mostró cierta tendencia no significativa hacia la mejoría del dolor. El levetiracetam no es más eficaz que el PCB en la reducción del DN (8,20).
- Antidepresivos: no hay evidencia de que trazadona y ADT reduzcan el DNC post-LME más que el PCB, existiendo estudios que dejan resultados contradictorios (23), sin embargo hay evidencia (I) de eficacia en la reducción del DNC post-LME con la amitriptilina pero solo en pacientes deprimidos (8,20).
- Analgésicos: existe evidencia de reducción del DNC al utilizar lidocaína, ketamina, alfentanilo y morfina por vía IV, superando al PCB, pero solo beneficiosos a corto plazo. No existe evidencia en el uso de lidocaína intratecal, pero sí al combinar morfina y clonidina por esta vía (evidencia II). No se han estudiado clonidina oral. El tramadol también es eficaz para reducir el DN post-LME pero la mexiletina no lo es en comparación con PCB. La capsaicina tópica podría ser útil, pero precisa más estudios (20).
- Cannabinoides: existen pruebas contradictorias sobre el uso de THC en la reducción del dolor espástico comparando con PCB en individuos con LME (19,24).
- Medicamentos antiespásticos: el baclofeno intratecal reduce el dolor musculoesquelético asociado con espasticidad, sin embargo, no hubo evidencia sobre la reducción en el DN (20,24), ni sobre dolor musculoesquelético por vía oral (24). Existe evidencia (IV) de que la toxina botulínica reduce el dolor asociado a la espasticidad, precisando mayor investigación en estos pacientes (20).
Estimulación eléctrica medular
No hay ensayos clínicos disponibles sobre el uso de TENS y acupuntura en estos pacientes.
- Estimulación de la columna dorsal: la estimulación de las columnas posteriores de la medula espinal ha demostrado cierta eficacia en la reducción del DNC debido a LME (7). Tres ensayos clínicos aleatorizados (ECA) sugieren que la estimulación eléctrica medular fue más eficaz en el tratamiento del DN crónico que el tratamiento médico convencional en pacientes con LM incompletas; pero se precisan ECA con mayores muestras y más seguimiento temporal (18,25). Recientemente estudios sugieren que la estimulación magnética transcraneal (TMS) puede ser una buena opción terapéutica para DNC post-LME, pero carecemos de estudios a largo plazo (18).
Los procedimientos quirúrgicos tales como la lesión DREZ son muy invasivos y no se recomiendan para el dolor post-LME.
Terapias celulares (cell-based or cell-related therapies)
Tienen como objetivo conseguir analgesia desde diferentes perspectivas: la prevención del daño neuronal debido a inflamación, ciclo celular o regeneración disfuncional; instalar mini-bombas biológicas que usan tejido medular adrenal cromafín, líneas de ingeniería celular o astrocitos y finalmente la regulación del medio interno mediante trasplante de hueso y de células madre mesenquimales de la medula ósea (19). Existen diferentes tipos de terapias celulares:
- Uso de médula suprarrenal primaria o tejido celular cromafín: que producen neuropéptidos y neurotrofinas antinociceptivas. En modelos humanos se obtuvo un 80 % de tasa de respuesta con reducción significativa del dolor y de la demanda de opioides en pacientes con dolor intratable por cáncer. Existen tres limitaciones al uso de tejido medular suprarrenal: a) no está definida la dosis efectiva mínima y parece que la respuesta clínica no depende de dosis; b) es incierto el tiempo de viabilidad del tejido medular donante y su potencia antinociceptiva; y c) la escasez de donantes. Por ello se utilizaron células cromafines bovinas encapsuladas en un polímero semipermeable siendo seguro y pudiendo recuperar el dispositivo sin usar inmunosupresión (19).
- Uso de líneas celulares inmortalizadas y otras líneas de ingeniería celular: se han estudiado dos líneas celulares inmortalizadas (RN33B y línea inmortalizada de células cromafines bovinas) que demostraron significativa reducción del DN al implantarse en espacio subaracnoideo de ratas. Poseen ventaja de suministro ilimitado, pero existe riesgo de tumorigenicidad y no hay método fiable de control de estas células. También se han empleado en modelos animales astrocitos inmortalizados con gen humano de preproencefalina y cepas de virus herpes simple que expresan dicho gen, produciendo disminución del DN y alivio de hiperalgesia térmica y mecánica, existiendo ensayos en humanos en curso en la actualidad (19).
- Uso de células madre: células con capacidad de migración a los sitios lesionados y de diferenciarse en neuronas y astrocitos. La inyección directa de estas células madre mesenquimatosas humanas en ventrículos de ratones con LME generó reducción del DNC de estos. En humanos existen resultados contradictorios en diferentes estudios para la implantación intratecal de estas células en pacientes LME, desde reducción significativa del dolor, a sin existir diferencias significativas con grupo control aportando además efectos adversos (19).
- Uso de medula ósea y trasplante de células madre de medula ósea: en lugar de usar células mesenquimales específicas varios estudios utilizaron trasplante autólogo de medula ósea completa obteniendo, en la mayoría de estos, mejoría significativa sensorial y motora, con pocos efectos adversos; pero siendo estudios con muestras insuficientes para ser significativas (19).
- Uso de otras células: también se realizaron estudios sobre implantación de células olfativas envainadas (OEC) (promueven regeneración axonal y remielinización), células de Schwann, así como tratamiento anti-TNF-α y anti-Nogo-A (desinhibidor de regeneración axonal); en su mayoría fueron probados en modelos animales, obteniendo en los modelos humanos con pequeñas muestras resultados contradictorios, algunos de ellos imposibles de replicar, generando además en ocasiones efectos adversos graves (mielomalacia en injerto de OEC) (19) (Tabla IV).
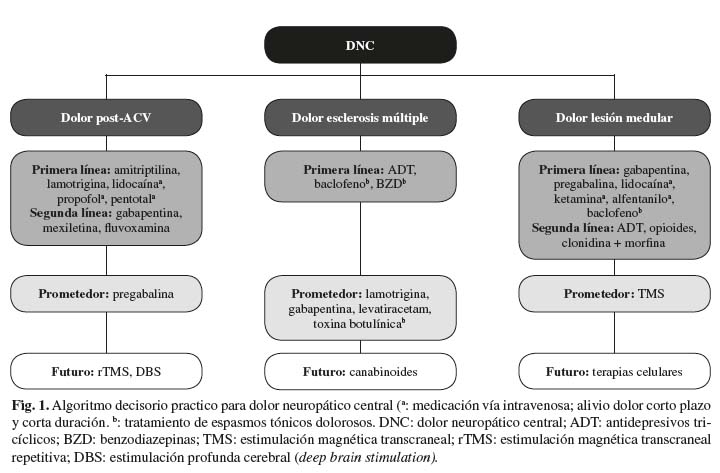
Con todo ello, basándonos en la evidencia científica actual podríamos abordar la terapia analgésica del paciente con DNC mediante el siguiente algoritmo decisorio práctico (Fig.1), así como definir las tendencias terapéuticas prometedoras actuales y futuras en cada una de las etiologías estudiadas.
Discusión
Actualmente no tenemos evidencia científica sólida para poder realizar protocolos estandarizados para el tratamiento del DNC.
El tratamiento actual de CPSP es insatisfactorio y solo existen unos pocos estudios controlados bien diseñados. La amitriptilina y la lamotrigina son los tratamientos eficaces; la estimulación magnética transcraneal repetitiva y la estimulación profunda del cerebro han sido beneficiosas y los estudios con pregabalina parecen prometedores. Muchos otros tipos de fármacos han sido probados en el tratamiento de la CPSP en grupos pequeños de pacientes.
La literatura sobre el tratamiento del dolor en la EM es muy deficiente y no ofrece recomendaciones basadas en rigurosos métodos científicos. Los cannabinoides podrían ser útiles, pero falta por definir un perfil completo de sus efectos adversos (sobre todo a largo plazo), así como realizar ensayos aleatorios comparándolos con los medicamentos tradicionales para demostrar si realmente son superiores a estos e identificar perfil de respondedores a cannabinoides. Los estudios futuros deben investigar sobre los medicamentos que han demostrado ser prometedores en pequeños estudios abiertos como: efectos individuales de LMT, GBP y levetiracetam para DNC; LMT y GBP (individualmente y combinadas) para la neuralgia del trigémino, y de GBP y toxina botulínica para el tratamiento de PTS en pacientes con EM.
Actualmente no existe cura satisfactoria para LME y el pronóstico global es pobre. Muchos de los ensayos clínicos sobre terapia analgésica no discriminan sobre el tipo de dolor que tratan, ni el potencial abuso de opioides de estos pacientes. Se precisa más investigación a largo plazo sobre la estimulación eléctrica medular en estos pacientes, sobre todo la estimulación magnética transcraneal. Las terapias celulares se han convertido en potenciales terapéuticos prometedores tanto en regeneración de la médula espinal como en la mitigación del DN debido a LME, pero la mayoría de ensayos clínicos son animales. La investigación futura debe examinar la respuesta del dolor específico en diferentes subtipos de lesionados medulares (dolor en lugar de lesión vs. dolor por debajo de dicho nivel; evocado vs. dolor espontáneo, así como lesiones completas o incompletas medulares).
Se necesitan más ensayos clínicos aleatorizados controlados con número suficiente de pacientes y características específicas del dolor para comprender la fisiopatología, utilizar instrumentos específicos de evaluación, investigar las nuevas modalidades terapéuticas y para proporcionar evidencia científica que pueda apoyar las recomendaciones para estrategias óptimas de tratamiento que incluyan un enfoque multi-modal, combinando tratamiento farmacológico con terapia física e intervenciones cognitivo-conductuales y psicológicas.
Bibliografía
1. Treede Rd, Jensen TS, Campbell JN, Cruccu G, Dostrovsky JO, Griffin JW, et al. Neuropathic pain: Redefinition and a grading system for clinical and research purposses. Neurology 2008;70:1630-5. [ Links ]
2. Dworkin RH, Backonja M, Rowbotham MC, Allen RR, Argoff CR, Bennett GJ, et al. Advances in neuropathic pain: Diagnosis, mechanisms and treatment recommendations Arch Neurol 2003;60:1524-34. [ Links ]
3. Frese A, Husstedt IW, Ringelstein EB, Evers S. Pharmacologic treatment of central post-stroke pain. Clin J Pain 2006;22(3):252-60. [ Links ]
4. Kumar B, Kalita J, Kumar G, Misra UK. Central post-stroke pain: A review of pathophysiology and treatment. Anesth Analg 2009;108(5):1645-57. [ Links ]
5. Kumar G, Soni CR. Central post-stroke pain: Current evidence. J Neurol Sci 2009;284(1-2):10-7. [ Links ]
6. Hansson P. Post-stroke pain case study: Clinical characteristics, therapeutic options and long-term follow-up. Eur J Neurol 2004;11(Supl.1):22-30. [ Links ]
7. Kim JS. Post-stroke pain. Expert Rev Neurother 2009;9(5):711-21. [ Links ]
8. Selph S, Carson S, Fu R, Thakurta S, Low A, McDonagh M. Drug class review: Neuropathic Pain: Final Update 1 Report (Internet). Portland (OR): Oregon Health & Science University; 2011 Jun. [ Links ]
9. O'Connor AB, Schwid SR, Herrmann DN, Markman JD, Dworkin RH. Pain associated with multiple sclerosis: Systematic review and proposed classification. Pain 2008;137(1):96-111. [ Links ]
10. Solaro C, Uccelli MM. Management of pain in multiple sclerosis: A pharmacological approach. Nat Rev Neurol 2011;7(9):519-27. [ Links ]
11. Solaro C, Uccelli MM. Pharmacological management of pain in multiple sclerosis. Drugs 2010;70(10):1245-54. [ Links ]
12. Milo R, Panitch H. Combination therapy in multiple sclerosis. J Neuroimmunol 2011;231(1-2):23-31. [ Links ]
13. García Merino A, Fernandez O, Moltalban X, de Andres C, Arbizu T. Spanish Neurology Society consensus document on the use of drugs in multiple sclerosis: Escalating therapy. Neurologia 2010;25(6):378-90. [ Links ]
14. Lakhan SE, Rowland M. Whole plant cannabis extracts in the treatment of spasticity in multiple sclerosis: A systematic review. BMC Neurol 2009:4;9:59. [ Links ]
15. Rog DJ, Nurmikko TJ, Friede T, Young CA. Randomized, controlled trial of cannabis-based medicine in central pain in multiple sclerosis. Neurology 2005;65(6):812-9. [ Links ]
16. Zajicek J, Fox P, Sanders H, Wright D, Vickery J, Nunn A, Thompson A; UK MS Research Group. Cannabinoids for treatment of spasticity and other symptoms related to multiple sclerosis (CAMS study): Multicentre randomised placebo-controlled trial. Lancet 2003;362(9395):1517-26. [ Links ]
17. Sastre-Garriga J, Vila C, Clissold S, Montalban X. THC and CBD oromucosal spray (Sativex®) in the management of spasticity associated with multiple sclerosis. Expert Rev Neurother 2011;11(5):627-37. [ Links ]
18. Baastrup C, Finnerup NB. Pharmacological management of neuropathic pain following spinal cord injury. CNS Drugs 2008;22(6):455-75. [ Links ]
19. Leung L. Cellular therapies for treating pain associated with spinal cord injury. J Transl Med 2012;10:37. [ Links ]
20. Teasell RW, Mehta S, Aubut JA, Foulon B, Wolfe DL, Hsieh JT, et al; Spinal Cord Injury Rehabilitation Evidence Research Team. A systematic review of pharmacologic treatments of pain after spinal cord injury. Arch Phys Med Rehabil 2010;91(5):816-31. [ Links ]
21. Bryce TN, Budh CN, Cardenas DD, Dijkers M, Felix ER, Finnerup NB, et al. Pain after spinal cord injury: An evidence-based review for clinical practice and research. Report of the National Institute on Disability and Rehabilitation Research Spinal Cord Injury Measures meeting. J Spinal Cord Med 2007;30(5):421-40. [ Links ]
22. Attal N, Mazaltarine G, Perrouin-Verbe B, Albert T; SOFMER French Society for Physical Medicine and Rehabilitation. Chronic neuropathic pain management in spinal cord injury patients. What is the efficacy of pharmacological treatments with a general mode of administration? (oral, transdermal, intravenous). Ann Phys Rehabil Med 2009;52(2):124-41. [ Links ]
23. Rekand T, Hagen EM, Grønning M. Chronic pain following spinal cord injury. Tidsskr Nor Laegeforen 2012;132(8):974-9. [ Links ]
24. Taricco M, Adone R, Pagliacci C, Telaro E. Intervenciones farmacológicas para la espasticidad después de daño de la médula espinal. La Biblioteca Cochrane Plus 2008 No2. [ Links ]
25. Simpson EL, Duenas A, Holmes MW, Papaioannou D, Chilcott J. Spinal cord stimulation for chronic pain of neuropathic or ischaemic origin: Systematic review and economic evaluation. Health Technol Assess 2009;13(17):1-154. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Rafael Mora Moscoso
Unidad del Dolor
Servicio de Anestesiología, Reanimación y Terapia del Dolor
Complejo Hospitalario Ciudad de Jaén
Avda. del Ejército Español, 10
23007 Jaén
e-mail: r_mora26@hotmail.com
Recibido: 24-03-14.
Aceptado: 15-06-14.