Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de la Sociedad Española del Dolor
versión impresa ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.23 no.3 Madrid may./jun. 2016
ARTÍCULO ESPECIAL
Combinación de opioides
Opioid combination
E. Salvador y L. Aliaga1
Servicio de Anestesiología Hospital Hernán Henríquez. Temuco-Chile. 1Clínica Dolor Hospital Quirón Teknon. Barcelona-España
Dirección para correspondencia
RESUMEN
La premisa básica de una combinación analgésica es que los dos fármacos actúen a través de diferentes mecanismos de acción; de esta manera, la combinación puede resultar una reducción de los efectos adversos relacionados con la dosis. Sin embargo, la utilidad de la administración conjunta de fármacos del mismo grupo farmacológico es un argumento controvertido pero resulta eficaz en algunas enfermedades, como la depresión y la epilepsia. La rápida necesidad de intensificar las dosis de opioides es un reto para los médicos y representa una fase crítica para los pacientes que tienen un mal control del dolor a pesar de recibir progresivamente crecientes dosis de opioides. La administración de pequeñas dosis de un segundo opioide en pacientes con una respuesta desfavorable durante la escalada con el opioide previo se ha encontrado eficaz en un informe preliminar donde se añadieron: morfina oral, fentanilo transdérmico y la metadona oral a fentanilo transdérmico, la morfina oral y morfina bucal, respectivamente. Así, aunque en la práctica clínica múltiples opioides se administran a menudo de forma simultánea por diferentes razones, hay pocos estudios que hayan evaluado este tema específico.
ABSTRACT
The basic premise of an analgesic combination is that the two drugs act through different mechanisms of action; thus, the combination may be a reduction in adverse effects associated with the dose. However, the usefulness of the joint administration of drugs of the same pharmacological group is a controversial argument but is effective in some diseases, such as depression and epilepsy. The rapid need for increased doses of opioids is a challenge for physicians and represents a critical phase for patients who have a poor pain control despite receiving progressively increasing doses of opioids. The administration of small dose of a second opioid in patients with an unfavorable response during the escalation of the previous opioid has been found effective in a preliminary report which were added: oral morphine, transdermal fentanyl and oral methadone transdermal fentanyl oral morphine and oral morphine, respectively. Thus, although in clinical practice multiple opioids are often administered simultaneously for different reasons, few studies have evaluated this specific issue.
Combinación de Opioides
Las respuestas analgésicas a los opioides dependen de una multitud de factores que se caracterizan por una gran variabilidad intra- e interindividual. Durante mucho tiempo ha sido apreciado por los médicos que, en lo que se refiere a tolerabilidad y respuesta al alivio del dolor, los pacientes pueden responder mejor a un μ-opioide que a otro. Dichas respuestas se relacionan con características propias de la droga, del paciente o de ambas. Estos hallazgos sugieren diferencias entre los opioides, indicando una farmacología mucho más compleja de lo que previamente se ha sugerido.
Aunque actualmente los receptores opioides se clasifican como μ, δ y κ, con un cuarto receptor no clasificado relacionado con nociceptina/orfanina FQ, existen trabajos que indican la presencia de múltiples subpoblaciones de receptores opioides mu. Los receptores opioides pertenecen a la gran superfamilia de receptores acoplados a la proteína G. Ellos actúan a través de las proteínas G para inhibir la adenil-ciclasa, aumentar las corrientes de potasio, inhibir la actividad de los canales de calcio, modular la rotación de inositol trifosfato y activar la proteína quinasa mitogeno-activada. Estas acciones culminan en la atenuación de la actividad neuronal mediante la inhibición de la liberación de neurotransmisores y el cambio de la excitabilidad neuronal. Sin embargo, a pesar de las similitudes aparentes, se han observado diferencias farmacológicas entre los opioides μ in vitro e in vivo en modelos preclínicos, lo que implica que todos los opioides μ pueden no estar funcionando a través del mismo mecanismo de acción. Los μ-opioides son los fármacos más comúnmente utilizados con fines analgésicos, y la morfina es el prototipo de esta clase de medicamentos. La mayoría de los genes están compuestos por múltiples exones que deben ser empalmados juntos para generar el mRNA que, a su vez, produce el receptor μ. La variabilidad o mutación de estas secuencias pueden proporcionar la capacidad de un solo gen para generar una amplia gama o proteínas relacionadas. La regulación del splicing o secuencia de empalme es aún más engorrosa, depende de la célula (por ejemplo, la médula espinal u otros sitios) y la localización (por ejemplo, pre- o postsinápticamente).
Para volver aún más complejo el tema, la ocupación del receptor y el efecto del fármaco están directamente relacionados con el número de receptores de repuesto. De acuerdo con la ley de acción de masas, las drogas más potentes modifican relativamente menos mecanismos de receptor-efector para producir un efecto. Se ha sugerido que el grado de tolerancia está inversamente relacionada con la reserva de los receptores opioides de repuesto. Diferentes fármacos pueden producir alivio del dolor equivalente ocupando diferentes proporciones de los receptores disponibles. Como la morfina tiene características de alta ocupación, se considera un agonista de eficacia intrínseca baja, y puede inducir tolerancia más fácilmente que un agonista de alta eficacia. El fentanilo, la metadona y la etomorphina mostraron una mayor reserva de receptores que la morfina, el levorfanol y la meperidina. Varios opioides, incluyendo la metadona, el fentanilo y el sufentanilo han demostrado tener eficacia mucho mayor que la morfina, debido a una reserva mayor de receptores que la morfina. Con un aumento en la intensidad del estímulo, los opioides con una alta eficacia mostraron menos cambio en sus curvas de respuesta a la dosis en comparación con un agonista con baja eficacia (como la morfina), que muestra una mayor reducción en el efecto máximo y el aumento de los requisitos de ocupación. Por lo tanto, la morfina actúa como un agonista completo frente a estímulos de baja intensidad, puede actuar como un agonista parcial a altos niveles de estimulación dolor.
Interacciones funcionales entre analgésicos opioides μ han sido demostradas. Se ha encontrado sinergia entre la metadona y un número de otros opioides μ revelando, a su vez, la tolerancia cruzada incompleta. La combinación de la metadona con la morfina ofrece un número de ventajas potenciales, particularmente desde que se evidenció que estas interacciones parecen estar restringidas a la analgesia, pues no se incrementa la inhibición del tránsito gastrointestinal. No todos los μ-analgésicos han revelado sinergia cuando se administran en combinación. Sólo se han encontrado interacciones aditivas entre metadona y fentanilo o entre la morfina y M6G.
De forma simultánea, se ha demostrado para la morfina utilizada medular y supraespinalmente, la vía de administración que tiene en sí misma un efecto sobre el grado de sinergia, lo que subraya la importancia de las interacciones regionales, ya sea entre los diferentes lugares en el SNC y/o la periferia.
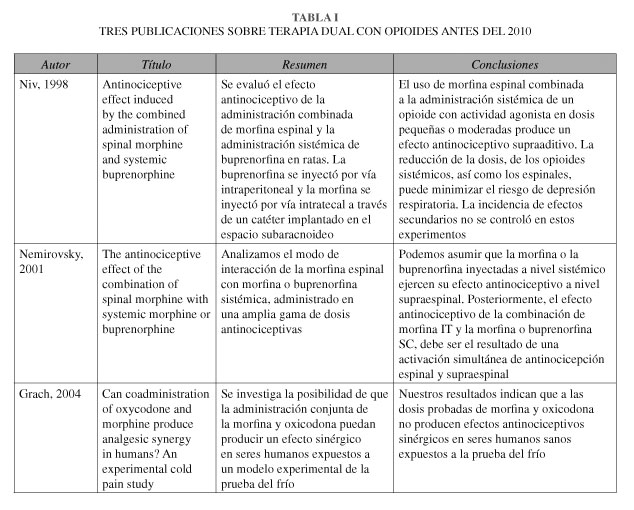
Adicionalmente, se han reportado interacciones entre los diferentes receptores opioides. Los opioides tienen selectividades superpuestas entre los receptores μ, δ, y κ, así como la superposición de patrones de distribución en el sistema nervioso y modulan diferencialmente una amplia gama de funciones fisiológicas. Aunque cada receptor opioide puede mediar su efecto de forma independiente, un creciente cuerpo de evidencia se ha ido acumulando sobre la existencia de interacciones celulares o moleculares entre los diferentes tipos de receptores opioides. Aunque la estimulación de los receptores μ, δ, y κ produce efectos farmacológicos distintos, una posible co-localización en la misma sinapsis puede causar una interacción sustancial entre ellos, o una combinación de efectos sobre diferentes receptores, resultando en un efecto sinérgico. Se han realizado una serie de experimentos para dilucidar las interacciones sinérgicas de opioides co-administrados. Algunos de estos trabajos han sido citados en la Tabla I y II. Así, la morfina y la oxicodona parecen ejercer sus acciones antinociceptivas a través de diferentes clases de receptores opioides. En contraste con la morfina, los efectos antinociceptivos intrínsecos de la oxicodona parecen estar mediados principalmente por receptores κ-putativos. La co-administración de dosis sub-antinociceptivas de oxicodona y morfina produce una marcada sinergia antinociceptiva con efectos secundarios reducidas en el SNC.
Otro ejemplo lo constituye la combinación de morfina espinal y buprenorfina sistémica, ya que estos opioides pueden interactuar en diferentes niveles debido a sus diferencias en la actividad del receptor. Esta combinación produjo un efecto antinociceptivo que era mayor que lo que podría haber sido predicho a partir de curvas de dosis-respuesta individuales.
Con respecto al tramadol en su uso combinado con fentanyl transdérmico, una combinación de un opioide fuerte con un opioide débil para tratar el dolor intenso del cáncer permitió un aumento más gradual de la dosificación analgésica de la que era posible con el uso de fentanilo transdérmico solo. El tramadol es un medicamento analgésico de acción central. En una búsqueda de una técnica de analgesia balanceada eficaz con un componente ahorrador de morfina, se estudiaron las dosis analgésicas eficaces mediana (ED 50) de tramadol, morfina, y su combinación para determinar la naturaleza de su interacción. El estudio concluyó que esta combinación puede ser recomendada para la analgesia posoperatoria.
La combinación de fentanyl y morfina en bombas de PCA (analgesia controlada por el paciente) se ha estudiado tratando de combinar tanto un inicio rápido cuanto una larga duración de acción, atributos, que no están disponibles en los opioides actualmente existentes. Esta mezcla potencialmente puede lograr ambas cualidades.
En cuanto a la combinación de oxicodona/naloxona, los resultados obtenidos del estudio muestran que la combinación de oxicodona-naloxona permite una mayor estabilidad en el mantenimiento de la dosificación, así como mejoras en la calidad de vida, una vez que se encuentre una dosis adecuada para cada paciente.
La oxicodona/naloxona ofrece mejoras significativas en la evaluación de pacientes con síntomas de estreñimiento y mareos. En este mismo trabajo, se encontraron resultados superiores para la fatiga y dolor de cabeza en comparación con tapentadol de liberación prolongada, lo que puede traducirse en un mejor funcionamiento diario del paciente y en su calidad de vida.
Otros resultados sugieren que la interacción entre los opioides no sólo depende de las características del fármaco, sino también del tipo de estímulo nocivo y de las vías antinociceptivas no opioides. Para una combinación dada (en una proporción fija), el tipo de interacción puede cambiar de acuerdo con el nivel de efecto, un hecho que puede ser relevante cuando se trata de introducir combinaciones de fármacos en la práctica clínica.
Conclusiones
Las diferencias entre los efectos farmacológicos de los opioides pueden ser comparados con las diferencias, escuchadas en una pieza de música, que se producen simplemente cambiando el volumen de los diversos instrumentos. La canción sigue siendo la misma y las similitudes en la pieza musical se oyen, pero las diferencias en el sonido también se apreciarán fácilmente. Así, mientras que diferentes opioides mu unen a todos los receptores mu y producen efectos farmacológicos similares, los cambios sutiles en su activación relativa del receptor pueden explicar las diferencias sutiles en su farmacología (Figura 1).
La combinación opioide/opioide es un tema que se encuentra todavía gestando. En la literatura revisada no encontramos datos que nos permitan predecir con exactitud la combinación óptima en un paciente específico, la dosificación, la secuencia o las proporciones equianalgésicas. De igual manera, los datos sobre los efectos adversos, productos de esta terapia, son limitados. Los intentos de trabajos clínicos serios, que se han demostrado en algunos modelos de animales, pueden fallar al intentar replicarlos en los seres humanos debido al amplio número de factores implicados en el procesamiento del dolor. En gran medida, la incertidumbre en torno a los mecanismos y consecuencias de la regulación de los receptores opioides se debe a las limitaciones de los diseños experimentales en muchos de los estudios que han investigado estos eventos. Como bien indica Mercadante, debemos quedarnos con la idea de que los fármacos opioides no son todos iguales y, aunque es posible utilizar estas diferencias en un entorno clínico, aún se deben realizar ensayos clínicos en pacientes con dolor agudo y crónico para determinar si las combinaciones de opioides proporcionan mayor eficacia y tolerabilidad en comparación con cualquier opioide solo. Por el momento, sólo se puede utilizar una recomendación débil para apoyar el tratamiento dual opioide/opioide.
Bibliografía Recomendada
1. Romero A, Miranda HF, Puig MM. Analysis of the opioid-opioid combinations according to the nociceptive stimulus in mice. Pharmacol Res 2010;61(6):511-8. [ Links ]
2. Mercadante S. Opioid combination: Rationale and possible clinical applications. Annals of Palliative Medicine 2013;2(4):189-96. [ Links ]
3. Bolan EA, Tallarida RJ, Pasternak GW. Synergy between mu opioid ligands: Evidence for functional interactions among mu opioid receptor subtypes. J Pharmacol Exp Ther 2002;303(2):557-62. [ Links ]
4. Joppich R, Richards P, Kelen R, Stern W, Zarghooni K, Otto C, et al. Analgesic efficacy and tolerability of intravenous morphine versus combined intravenous morphine and oxycodone in a 2-center, randomized, double-blind, pilot trial of patients with moderate to severe pain after total hip replacement. Clin Ther 2012;34(8):1751-60. [ Links ]
5. Marinangeli F, Ciccozzi A, Aloisio L, Colangeli A, Paladini A, Bajocco C, et al. Improved cancer pain treatment using combined fentanyl-tts and tramadol. Pain Pract 2007; 7(4):307-12. [ Links ]
6. Marcou TA, Marque S, Mazoit JX, Benhamou D. The median effective dose of tramadol and morphine for postoperative patients: A study of interactions. Anesth Analg 2005;100(2):469-74. [ Links ]
7. Friedman Z, Katznelson R, Phillips SR, Zanchetta C, Nistor OI, Eisen LB, et al. A randomized double-blind comparison of a morphine-fentanyl combination vs. morphine alone for patient-controlled analgesia following bowel surgery. Pain Pract 2008;8(4):248-52. [ Links ]
8. Thakur D, Dickerson S, Kumar Bhutani M, Junor R. Impact of prolonged-release oxycodone/naloxone on outcomes affecting patients' daily functioning in comparison with extended-release tapentadol: A systematic review. Clinical Therapeutics 2015;37(1):212-24. [ Links ]
9. Pasternak GW. Preclinical pharmacology and opioid combinations. Pain Med 2012;13 Suppl 1(s1):S4-11. [ Links ]
10. Niv D, Nemirovsky A, Metzner J, Rudick V, Jurna I, Urca G. Antinociceptive effect induced by the combined administration of spinal morphine and systemic buprenorphine. Anesth Analg 1998;87(3):583-6. [ Links ]
11. Nemirovsky A, Chen L, Zelman V, Jurna I. The antinociceptive effect of the combination of spinal morphine with systemic morphine or buprenorphine. Anesth Analg 2001;93(1):197-203. [ Links ]
12. Grach M, Massalha W, Pud D, Adler R, Eisenberg E. Can coadministration of oxycodone and morphine produce analgesic synergy in humans? An experimental cold pain study. Br J Clin Pharmacol 2004;58(3):235-42. [ Links ]
13. Webster L, Richards P, Stern W, Kelen R, MoxDuo Study Group. A double-blind, placebo-controlled study of dual-opioid treatment with the combination of morphine plus oxycodone in patients with acute postoperative pain. J Opioid Manag 2010;6(5):329-40. [ Links ]
14. Richards P, Riff D, Kelen R, Stern W. A phase 3, randomized, double-blind comparison of analgesic efficacy and tolerability of Q8003 vs oxycodone or morphine for moderate-to-severe postoperative pain following bunionectomy surgery. Pain Med 2013;14(8):1230-8. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Eddy Salvador
eddysalvador80@gmail.com
Recibido: 11-05-15.
Aceptado: 10-10-15.