My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Sociedad Española del Dolor
Print version ISSN 1134-8046
Rev. Soc. Esp. Dolor vol.23 n.6 Madrid Nov./Dec. 2016
REVISIÓN MBE
La ketamina en el tratamiento del dolor crónico según medicina basada en la evidencia
Ketamine in the treatment of chronic pain as evidence-based medicine
F. Neira Reina y J. L. Ortega García
Unidad de Gestión de Anestesiología Reanimación y Tratamiento del Dolor. Hospital Universitario Puerto Real. Puerto Real. Cádiz
Dirección para correspondencia
RESUMEN
La ketamina es un antagonista no competitivo de los receptores NMDA y tiene un amplio mecanismo de acción que involucra, además, a los receptores AMPA, kainato, ácido gamma-aminobutírico, opioides, monoaminérgicos, muscarínicos y nicotínicos. Actúa sobre los canales de calcio y sodio voltaje-dependientes, interviene en la síntesis y liberación del óxido nítrico e inhibe la recaptación de serotonina. La interacción con todos estos mecanismos de acción hace que tenga una importante participación sobre mecanismos del dolor, inflamación, neuroprotección y tolerancia de opioides.
En este trabajo se revisan las diferentes vías de administración de la ketamina, su dosificación, las modalidades de administración, la duración del tratamiento, las indicaciones según los niveles de evidencia disponibles y los efectos secundarios; para establecer su eficacia en la terapéutica del dolor crónico y promover un tratamiento más específico, en aquellas patologías en las que se ha demostrado una mayor eficacia.
Se realizó una búsqueda en Trip Database Population Intervention Comparison Outcome (PICO), National Guidelines Clearinghouse, Cochrane Library, Medline, CMA infobase, Health Services/Technology Assessment, New Zealand Guidelines Group y Scottish Intercollegiate Guidelines Network.
La ketamina tiene una gran versatilidad en cuanto a sus vías de administración (intravenosa, intramuscular, subcutánea, sublingual, oral, rectal, nasal, transdérmica, epidural y subaracnoidea), así como modalidades de administración (bolos, infusión continua). No obstante, la vía oral es la más utilizada y preferida para el tratamiento del dolor crónico. Sin embargo, no disponemos de una formulación oral comercializada, lo que dificulta su utilización.
El empleo clínico de la ketamina requiere una cuidadosa selección del paciente y valoración de la relación riesgo/beneficio. Se debe tener presente los antecedentes de abuso de drogas ante el riesgo potencial de abuso del fármaco.
Se dispone de evidencia sobre la eficacia de la ketamina en pacientes con dolor oncológico refractario y en el síndrome doloroso regional complejo (SDRC). Hay evidencia moderada sobre la eficacia de la ketamina intravenosa a dosis bajas, en el SDRC, que no justifica su utilización sistemática en este síndrome.
En el dolor neuropático, la ketamina se ha mostrado especialmente eficaz en el control de la alodinia, hiperalgesia e hiperpatía, pero existen controversias sobre su utilización.
La ketamina oral puede tener un lugar en el tratamiento del dolor crónico de los pacientes refractarios a tratamientos habituales. Se ha mostrado útil como coadyuvante de otros analgésicos, especialmente en pacientes en tratamiento con opioides, permitiendo disminuir la dosis e incrementando el control analgésico de los pacientes con dolor crónico.
Palabras clave: Ketamina, dolor crónico, dolor neuropático, síndrome doloroso regional complejo.
ABSTRACT
Ketamine is a noncompetitive NMDA receptor antagonist and has a large action's mechanism, that involves receptors: AMPA, kainate, gamma-aminobutyric acid, opioids, monoamine, muscarinic and nicotinic. It is acting on voltage-dependent calcium channels, join in the synthesis and release of nitric oxide and inhibits serotonin reuptake. The interaction with these mechanisms of action makes it an important role on mechanisms of pain, inflammation, neuroprotection and opioid tolerance.
In this paper we review the different routes of administration of ketamine, dosage, modes of administration, duration of treatment, indications according to levels of evidence available and side effects to set up its efficacy in the therapy of chronic pain and promote a more specific treatment, in those pathologies where it has shown greater efficacy.
We perform a search in: Trip Database Population Intervention Comparison Outcome (PICO), National Guidelines Clearinghouse, Cochrane Library, Medline, CMA infobase, Health Services/Technology Assessment, New Zealand Guidelines Group and Scottish Intercollegiate Guidelines Network.
Ketamine is very versatile in their routes of administration: intravenous, intramuscular, subcutaneous, sublingual, oral, rectal, nasal, transdermic, epidural and subarachnoid; as well as their ways of administration (bolus, continuous infusion). However, the oral route is the most widely used and preferred for the treatment of chronic pain. However, we do not have an oral formulation marketed, making it difficult to use.
Clinical use of ketamine requires careful patient's selection and assessment of the risk/benefit ratio. Ketamine has a potential risk of drug abuse; therefore, it should checked prior history of drug abuse.
It is available evidence on the efficacy of ketamine in patients with refractory cancer pain and complex regional pain syndrome (CRPS). The use of low-dose intravenous ketamine has moderate evidence in CRPS, that does not justify its routine use in this syndrome.
In neuropathic pain, ketamine has been particularly effective in controlling allodynia, hyperalgesia and hyperpathia, although there is controversy over its use.
Oral ketamine may have a place in the treatment of chronic pain patients refractory to standard treatments. It is shown useful as an adjuvant to other analgesics, especially in patients treated with opioids, allowing reduction of doses and increasing pain relief in patients with chronic pain.
Key words: Ketamine, chronic pain, neuropathic pain, complex regional pain syndrome.
Introducción
Los receptores N-metil-D-aspartato (NMDA) están asociados con los procesos de aprendizaje y memoria, el desarrollo y la plasticidad neural, así como con los estados de dolor agudo y crónico. Intervienen en el inicio y mantenimiento de la sensibilización central, asociada a daño o inflamación de los tejidos periféricos (1-7).
Disponemos de numerosos trabajos que han demostrado el efecto analgésico de los fármacos antagonistas de los receptores de NMDA (8-10). La ketamina es un derivado de la fenilpiperidina, estructuralmente relacionado con la fenciclidina, que tiene una acción antagonista no competitiva de uno de los tres receptores de glutamato: la N-metil D-aspartato (NMDA) (7). Se metaboliza en el hígado por la enzima CYP3A4, CYP2B6 y CYP2C9 a norketamina (a través de N -desmetilación por el citocromo P450), un metabolito activo que se elimina, tras glucuronidación hepática, a través del riñón y la bilis (11).
Menos del 10 % de la ketamina se excreta sin cambios, la mitad en las heces y la otra mitad por vía renal. Tiene una biodisponibilidad intramuscular del 93 %, nasal del 45 %, sublingual del 30 %, vía rectal del 30 % y vía oral del 16-20 % (12-14).
La ketamina fue sintetizada por Stevens y está disponible desde 1962 para su utilización en anestesia. No obstante, se ha utilizado ampliamente en el tratamiento del dolor agudo y crónico por diferentes vías de administración, aunque sin indicación en ficha técnica.
En algunos países, tanto la mezcla racémica como el S-enantiómero están disponibles comercialmente para su utilización clínica. En otros, sólo se comercializa la mezcla racémica. El S-enantiómero tiene una mayor afinidad y selectividad para el receptor NMDA; por vía parenteral es 4 veces más potente que el R-enantiómero y dos veces más potente que la mezcla racémica. A dosis equianalgésicas, el S-enantiómero presenta menos efectos secundarios (14). En este trabajo se revisan las diferentes vías de administración de la ketamina, su dosificación, las modalidades de administración, la duración del tratamiento, las indicaciones según los niveles de evidencia (NE) disponible y los efectos secundarios, para establecer su eficacia en la terapéutica del dolor crónico y abogar por un tratamiento más específico en aquellas entidades nosológicas en las que se ha demostrado mayor eficacia.
Material y Metódos
Los términos que se utilizaron para la búsqueda de la información fueron: "ketamine chronic pain", "ketamine chronic pain children", "oral ketamine chronic pain", "intranasal ketamine children", "ketamine cancer pain", "ketamine fibromyalgia", "ketamine complex regional pain", "ketamine neuropathic pain", "ketamine breakthrough pain", "pain epidural ketamine", "pain intrathecal ketamine", "pain ketamine adjuvant" y "ketamine addiction".
Se realizó una búsqueda en: Trip Database Population Intervention Comparison Outcome (PICO), National Guidelines Clearinghouse, Cochrane Library, Medline, CMA infobase, Health Services/Technology Assessment, New Zealand Guidelines Group y Scottish Intercollegiate Guidelines Network. Se aceptaron guías de práctica clínica con niveles de evidencia, revisiones sistemáticas, estudios metanálisis y ensayos clínicos controlados en el periodo 2012-2016, y referencias cruzadas entre las publicaciones revisadas en español e inglés desde 1990 hasta 2016.
Resultados
De los términos de búsqueda en el periodo 2012-2016, se obtuvieron los siguientes resultados: "ketamine chronic pain": 2 revisiones sistemáticas y 25 ensayos clínicos controlados; "ketamine chronic pain children": 8 revisiones sistemáticas; "oral ketamine chronic pain": 3 ensayos clínicos controlados; "intranasal ketamine children": 6 ensayos clínicos controlados; "ketamine cancer pain": 2 revisiones sistemáticas y 4 ensayos clínicos controlados; "ketamine fibromyalgia": 4 revisiones sistemáticas, 6 guías de práctica clínica y 4 ensayos clínicos controlados; "ketamine complex regional pain": 3 ensayos clínicos controlados; "ketamine neuropathic pain": 11 ensayos clínicos controlados; "ketamine breakthrough pain": 3 ensayos clínicos controlados; "pain epidural ketamine": 14 ensayos clínicos controlados; "pain intrathecal ketamine": 1 ensayo clínico controlado; "pain ketamine adjuvant": 2 revisiones sistemáticas y 3 ensayos clínicos controlados; "ketamine addiction": 4 revisiones sistemáticas y 11 ensayos clínicos controlados.
Mecanismo de acción de la Ketamina
Tiene un efecto antagonista sobre los receptores NMDA, AMPA, kainato y ácido gamma-aminobutírico (14,15).
Interacciona con:
- Los receptores opioides: se une a los receptores mu para aumentar la eficacia de los opioides (12).
- Los receptores monoaminérgicos, muscarínicos y nicotínicos.
- Los canales de calcio y sodio voltaje-dependientes (14,15).
Además, induce la síntesis y liberación del óxido nítrico (12,16), inhibe la recaptación de la serotonina, induce la activación de la liberación de la dopamina, tiene un efecto tipo anestésico local, potencia la inhibición descendente y es capaz de restaurar el equilibrio fisiológico entre la inhibición del dolor y la facilitación.
La ketamina posee un potente efecto antidepresivo que no se mantiene tras la suspensión del tratamiento (14,17). Además, posee efectos antiinflamatorios, antineoplásicos, neuroprotectores y disminuye las citocinas proinflamatorias (TNF-alfa, IL-2) (11,14,17-19).
Se piensa que la reversión de la tolerancia de los opioides es debida a la interacción entre los receptores NMDA, el óxido nítrico y los receptores opioides mu (20,21).
La dosis subanestésica de ketamina disminuye eficazmente el dolor nociceptivo agudo en seres humanos. Este efecto no es antagonizado por la naloxona (21).
La ketamina inhibe la sumación temporal central primaria y la hiperalgesia secundaria, así como la hiperalgesia secundaria mecánica en respuesta a la estimulación nociceptiva repetitiva (7,12).
Compatibilidad
El alfentanilo, el clonazepam, la dexametasona (a dosis bajas), la diamorfina, el haloperidol, la levomepromacina, el midazolam, el sulfato de morfina y la oxicodona son compatibles con la ketamina en suero salino 0,9 % (11).
En cuanto a la asociación de fármacos, se ha comprobado que son compatibles las siguientes asociaciones (11):
- Ketamina + haloperidol + sulfato de morfina.
- Ketamina + midazolam + sulfato de morfina.
No se recomienda asociar la ketamina con lorazepam, barbitúricos ni diazepam, por provocar precipitación (11).
Vías de administración
En el tratamiento del dolor crónico se han utilizado diferentes vías: intravenosa, intramuscular, subcutánea, sublingual, oral, rectal, nasal, transdérmica, epidural y subaracnoidea.
Vía oral
La vía oral se ha convertido en una alternativa válida, siendo la más utilizada y la preferida en tratamientos crónicos (13). La administración oral de la ketamina se asocia con un nivel sérico de norketamina superior al alcanzado con otras vías de administración (13).
La ketamina oral produce pocos efectos secundarios, posiblemente por alcanzar menores niveles plasmáticos (20). La asociación con midazolam no elimina completamente los efectos psicotomiméticos, aunque los minimiza (21).
Se puede administrar una dosis inicial de prueba para evaluar la tolerabilidad y eficacia. El alivio del dolor y los efectos indeseables tolerables varían de menos del 20 al 50 % (11).
El preparado oral suele ser de 100 ml a una concentración de 10 mg/ml. Se prepara utilizando 2 viales de 10 ml (50 mg/ml) y 80 ml de agua. Se puede agregar un saborizante para enmascarar el sabor amargo. Se debe conservar en frigorífico y protegerlo de la luz (11).
La dosis de inicio oscila entre 10-25 mg/6-8 h, o bien 0,2-0,5 mg/kg/8-12 h. Si es necesario se puede aumentar la dosis de 10-25 mg hasta 50-100 mg/6-8 h. La dosis máxima que se ha comunicado es de 200 mg/6 h. Si aparecen efectos psicotomiméticos o somnolencia, se recomienda disminuir la dosis y aumentar la frecuencia de administración (11,12). Algunos centros suspenden la ketamina durante varias semanas una vez alcanzada la analgesia, ya que el efecto analgésico puede persistir durante semanas o meses. Si el dolor recidiva, se puede administrar nuevamente (11). En pediatría, se recomienda una dosis oral de 0,25-1 mg/kg/dosis. Esta dosificación se ha mostrado segura en niños con dolor crónico tras 14 días de tratamiento (16).
Blonk MI y cols. (13), en una revisión sistemática, observaron que alrededor del 90 % de los informes de casos clínicos presentaban resultados positivos con respecto a la eficacia de la ketamina oral, mientras que los ensayos clínicos controlados de series amplias mostraban una eficacia de, aproximadamente, el 25 %. Concluyeron que la evidencia sobre el efecto de la ketamina oral en el tratamiento del dolor crónico es limitada y la calidad de los estudios no es muy alta. La evidencia disponible muestra que los pacientes con dolor crónico obtienen un beneficio limitado con el uso de la ketamina oral.
Vía sublingual
Para disminuir el volumen, que debe ser inferior a 2 ml, se recomienda utilizar la mayor concentración disponible. Se debe comenzar con 10-25 mg sublinguales y no tragarlo durante 2 minutos (Tabla I) (11).
La ketamina sublingual (25 mg) se ha mostrado eficaz en el control del dolor irruptivo, de pacientes oncológicos refractarios al tratamiento con opioides orales e intravenosos (22).
Vía subcutánea
La ketamina subcutánea disminuye significativamente la alodinia y la hiperpatía, aunque se acompaña de efectos secundarios (induración en el lugar de inyección, efectos psicotomiméticos) que, a veces, obliga al cambio frecuente del lugar de administración y/o a suspender el tratamiento (NE II) (14,20,23,24).
Habitualmente se utiliza una dosis de 2,5-25 mg, según los requerimientos. Cuando es necesario incrementar la dosis, se debe realizar de forma progresiva en un 25-30 % (11).
La dosis de ketamina en infusión continua subcutánea es de 0,05-0,5 mg/kg/h (12). Se suele asociar, con frecuencia, a morfina u otros fármacos. Cuando se añade ketamina parenteral a los opiáceos, se suele disminuir la dosis del opiáceo entre un 25-50 %. Si aparece somnolencia, se debe disminuir la dosis del opiáceo. Si se presenta disforia o alucinaciones se debe reducir la dosis de ketamina y de la benzodiacepina prescrita. Cuando la vía de administración subcutánea se cambia a vía oral se recomienda una conversión de 1:1, si han transcurrido pocos días de tratamiento (Tabla II) (25). Sin embargo, si el tratamiento se ha mantenido durante semanas o meses, se debe reducir la dosis subcutánea un 25-50 % al utilizar la vía oral (por ejemplo, 400 mg/24 h de ketamina por vía subcutánea equivaldrían a 150 mg/24 h de ketamina por vía oral) (Tabla I) (11).
Tras la suspensión del tratamiento con ketamina no suelen presentarse fenómenos de abstinencia. Sin embargo, se recomienda una retirada gradual cuando se ha mantenido el tratamiento durante un largo periodo de tiempo. Se ha informado de la presentación de hiperalgesia y alodinia generalizada, tras la interrupción brusca de la ketamina, tras 3 semanas de tratamiento (11).
Vía intravenosa
La dosis recomendada de ketamina en infusión continua intravenosa es de 0,05-0,5 mg/kg/h (12). La dosis intravenosa óptima oscila entre 0,125-0,3 mg/kg/h (20). En pacientes con dolor oncológico, se suele empezar con una dosis de 2,5-5 mg (11). Se titula según necesidad o se administra un bolo de 600 mcg/kg hasta un máximo de 60 mg durante 4 h. En pacientes con edad avanzada, se debe reducir la dosis un 30-50 % y monitorizar la tensión arterial. Si es necesario, se puede repetir diariamente durante un máximo de 5 días. Si no se obtiene mejoría, se puede incrementar la dosis de la siguiente administración un 30 %. La dosificación se ajusta dependiendo de la respuesta y/o aparición de efectos secundarios. Si el dolor recidiva se puede repetir el tratamiento (Tabla I).
Los mejores resultados se obtienen en pacientes jóvenes con una historia de dolor inferior a 5 años, aunque existen casos con buena respuesta a los 12-20 años de evolución (NE II) (20).
La ketamina intravenosa (0,25-0,50 mg/kg) se ha mostrado útil en el tratamiento del dolor neuropático en pacientes oncológicos, con falta de eficacia por parte de los opiáceos. La ketamina mejora la analgesia de la morfina en casos de dolor neuropático refractario. No obstante, se deben tener presentes los efectos indeseables centrales, especialmente a dosis altas, que pueden limitar su utilización (26). Se recomienda la asociación con benzodiacepinas, para minimizar sus efectos secundarios. El isómero S(+) de la ketamina parece tener menos efectos psicotomiméticos (15).
Vía subaracnoidea
La ketamina por vía subaracnoidea es una alternativa en pacientes oncológicos terminales, con dolor refractario al resto de los analgésicos disponibles (27). Cuando la analgesia es insuficiente o se presentan efectos secundarios intolerables, tras la administración subaracnoidea de opioides, bupivacaína y clonidina, se puede añadir la S(+) ketamina sin conservantes por vía subaracnoidea como último recurso, dado que no se dispone de datos de seguridad en humanos (28).
Tras la administración subaracnoidea de ketamina en ratas se ha observado: desmielinización, mielopatía vacuolar subpial y vasculitis linfocitaria focal cerca del orificio de salida del catéter, sin déficit neurológicos ni cambios histológicos (NE IV) (20).
Existen dos informes de casos de necrosis de médula espinal (ME), procedentes de autopsias de pacientes que recibieron infusiones intratecales de ketamina. Hay alguna evidencia que indica que la ketamina S(+)- es menos neurotóxica que la forma racémica (S y R), aunque uno de estos informes era en un paciente que había recibido ketamina (+)-. Por lo tanto, es una vía de administración que se debe evitar. Cuando se administra por vía epidural, se ha asociado a neurotoxicidad si la formulación contiene cloruro de benzetonio como conservante (12).
La ketamina es un irritante, por lo que se debe administrar una solución lo más diluida posible, preferiblemente en suero salino 0,9 %. La dosis de inicio es de 1-2,5 mg/kg/24 h (Tabla I). Si es necesario, se puede incrementar la dosis de 50 a 100 mg/24 h. La dosis máxima que se ha comunicado es de 3,6 g/24 h. Como alternativa, durante un corto periodo de tiempo, se puede iniciar el tratamiento con 100 mg/24 h; si no es efectiva, se puede aumentar a las 24 h a 300 mg/24 h. Si no es eficaz, se puede incrementar hasta 500 mg/24 h. Se debe suspender 3 días después del último ascenso de la dosis. Se ha obtenido respuesta favorable en el 50 % de los pacientes; si es necesario, se puede repetir la administración. Se recomienda prevenir los efectos secundarios con lorazepam, midazolam o haloperidol (11).
Yang y cols.(29) realizaron un estudio doble ciego, cruzado, en 20 pacientes. Un grupo recibió morfina intratecal y otro grupo ketamina y morfina intratecal (Tabla II). Los pacientes estaban diagnosticados de neoplasias primarias: gástrica, pulmón, cuello uterino, páncreas, colon e hígado. La ketamina se administró a una dosis fija y la morfina se titulaba según los requerimientos. Los pacientes fueron tratados hasta conseguir el control eficaz del dolor (valor menor o igual a 3 en una escala de 10) durante 48 horas y, después, se pasaron al otro grupo sin periodo de lavado. No hubo diferencias en el control del dolor entre ambos grupos. Sin embargo, las necesidades de morfina intratecal se redujeron drásticamente en los pacientes con ketamina intratecal.
Indicaciones
Se han creado nuevas expectativas en el tratamiento del dolor crónico con dosis subanestésicas de ketamina (23). En modelos experimentales de dolor crónico, la ketamina disminuye la hiperalgesia mecánica y térmica, así como la alodinia (30).
La efectividad de la ketamina por vía oral y parenteral ha sido estudiada en el dolor disestésico central (NE II), el dolor neuropático en el síndrome de cola de caballo traumático (NE IV), la alodinia y la hiperalgesia (20).
Entre sus indicaciones se han propuesto: dolor neuropático oncológico, neuralgia postherpética, traumatismo crónico, amputación, lesión de la ME, dolor de origen central secundario a accidente cerebrovascular, dolor de miembro fantasma, síndrome de piernas inquietas, dolor crónico orofacial, fibromialgia y dolor postquirúrgico, entre otros (13,23,24,30,31).
En la actualidad, aún no se dispone de estudios de calidad que permitan delimitar con claridad el lugar que ocupa en el tratamiento del dolor crónico. No obstante, hay suficiente evidencia sobre la producción de efectos secundarios significativos, relacionados con el bloqueo del receptor NMDA y sus acciones sobre otros receptores (20).
La ketamina es más eficaz reduciendo síntomas como la alodinia, hiperalgesia e hiperpatía que como un analgésico tradicional (NE) II (20).
Se han realizado ensayos controlados aleatorizados sobre la eficacia de la ketamina en el alivio del dolor crónico (2009-2012) (17). La mayoría de los estudios muestran que la ketamina se asocia con alivio del dolor cuando se administra en infusión intravenosa y/o subcutánea de corta duración. Sólo algunos estudios han estudiado el efecto prolongado de la ketamina tras la infusión. La duración de la infusión determina la duración del efecto analgésico, según las evidencias disponibles.
Dolor central
Se ha estudiado la eficacia de la ketamina en el dolor central disestésico tras lesión de la ME (NE II) y con dolor neuropático, tras traumatismo de la cola de caballo (NE IV). La ketamina disminuye el dolor continuo y el dolor evocado con pocos efectos secundarios. El descenso de la alodinia y la hiperalgesia se consigue con dosis orales de 50 mg, que se pueden aumentar progresivamente hasta 50 mg tres veces al día (20).
T. Sakai y cols. (32) determinaron la utilidad de la ketamina oral a una dosis de 20 mg/12 horas, en un caso de esclerosis múltiple, donde fue efectiva en el tratamiento del dolor neuropático severo y la alodinia.
En una revisión, López Millán y cols. (33) describieron la efectividad de la ketamina en el dolor central, en la disestesia por lesión de la ME (NE II) y en el dolor neuropático por lesión de la cola de caballo (NE IV). La ketamina por vía oral permitió reducir y eliminar del tratamiento los opiáceos y anticonvulsivantes (33).
Síndrome doloroso regional complejo
Se ha descrito el alivio del dolor regional complejo mediante ketamina epidural, en pacientes con dolor refractario a otros tratamientos (NE IV) (20).
Azari y cols. (34), en una revisión sistemática donde evaluaron 3 ensayos clínicos controlados con placebo, aleatorizados, 7 estudios observacionales y 9 estudios de casos control, concluyeron que el nivel de evidencia de la ketamina en el síndrome doloroso regional complejo (SDRC) es 2B, es decir, recomendación débil con pruebas de calidad moderada. Declararon que no hay pruebas suficientes para recomendar el uso rutinario de la ketamina en el tratamiento del SDRC (NE I).
En una revisión de la Cochrane se valoraron las intervenciones en el tratamiento del dolor y la discapacidad en adultos con SDRC. Se evaluaron 3 ensayos clínicos aleatorizados y controlados con placebo y 1 metanálisis. Encontraron evidencias de baja calidad en el tratamiento del SDRC con ketamina intravenosa. Los efectos no se mantenían más de 4-11 semanas tras el tratamiento y se asociaban a efectos secundarios (NE I) (35).
Cossins y cols. (36), en una revisión sistemática sobre 2 ensayos clínicos, encontraron evidencia moderada sobre la eficacia de la ketamina intravenosa a dosis bajas en el SDRC (NE I).
Harden y cols. (37) determinaron que la ketamina se ha valorado para el tratamiento del dolor neuropático y del SDRC, pero la toxicidad, con dosis eficaces, ha sido demasiado elevada (NE I).
Las Guías del Reino Unido evaluaron 1 ensayo clínico de calidad alta y 1 ensayo clínico de calidad baja y consideraron que hay pruebas moderadas para la ketamina intravenosa a dosis bajas (NE I) (38).
Las Guías Holandesas publicadas por Pérez y cols. (39) concluyeron que la evidencia de la ketamina intravenosa para el tratamiento del SDRC tiene un NE III.
A. Goebel (40) consiguió el alivio significativo del dolor en 29 pacientes con SDRC, tras la infusión de ketamina, durante un tiempo máximo de 6 semanas. Sin embargo, no hubo repercusión sobre la capacidad funcional. Encontraron una relación inversa entre la intensidad del dolor y la capacidad funcional (NE II).
Koffler y cols. (41) evaluaron los efectos de la ketamina a dosis anestésicas, en infusión intravenosa durante 5 días, en un estudio prospectivo y abierto. Concluyeron que la infusión intravenosa de ketamina durante 5 días es un tratamiento eficaz en el SDRC I, con disminución significativa en la intensidad del dolor, tras 6 semanas de la suspensión de la infusión. Ningún paciente precisó tratamiento del dolor a los 6 meses de seguimiento, no encontrando efectos adversos a nivel cognitivo.
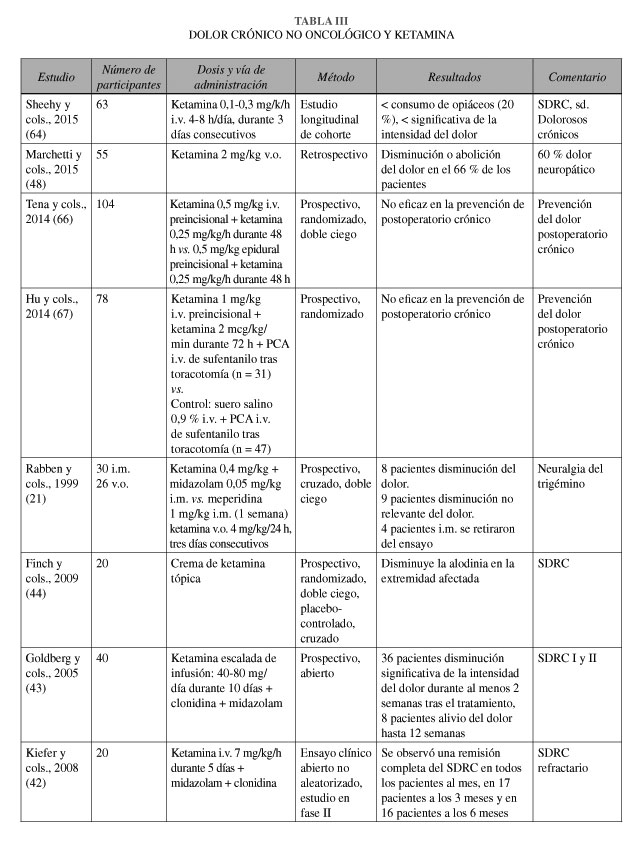
Kiefer y cols. (42) realizaron un ensayo abierto, no aleatorizado, en fase II. Infundieron ketamina intravenosa continua a dosis anestésica durante 5 días en 20 pacientes con SDRC refractario (Tabla III). Todos los pacientes fueron profundamente sedados durante el tratamiento. El estudio mostró una disminución significativa de la intensidad del dolor a la semana de finalizar la infusión intravenosa de ketamina. Se observó una remisión completa del SDRC en todos los pacientes al mes de seguimiento, en 17 pacientes a los 3 meses y en 16 pacientes a los 6 meses. Los pacientes informaron de mejoría funcional, mejor calidad de vida y aumento de la capacidad de trabajar. A los 6 meses sólo 2 pacientes fueron incapaces de trabajar. No hubo complicaciones vitales, pero los pacientes presentaron dificultad para dormir, pesadillas y debilidad muscular que persistió durante semanas tras el tratamiento, además de infecciones nosocomiales.
Goldberg y cols. (43) efectuaron un estudio prospectivo, abierto, sobre 40 pacientes con SDRC I y II, a los que administraron ketamina en perfusión intravenosa durante 4 horas al día, durante 10 días (Tabla III). Consiguieron una disminución significativa del dolor, con mejoría de la capacidad funcional y tendencia a la disminución de la regulación autonómica. 36 de los 40 pacientes obtuvieron alivio del dolor, al menos durante dos semanas tras concluir el tratamiento; 8 pacientes presentaron alivio del dolor durante un máximo de 12 semanas. Se informaron efectos secundarios mínimos.
Correll y cols. (11) hicieron una revisión retrospectiva de 33 pacientes con SDRC, que recibieron ketamina a dosis subanestésicas que titularon hasta alcanzar la dosis máxima tolerada. El 76 % de los pacientes lograron alivio completo del dolor con una sola infusión. Hubo pacientes que recayeron y precisaron una segunda y una tercera infusión. El 83 % de los pacientes lograron un alivio completo del dolor, el 13 % alivio parcial y el 4 % ningún alivio del dolor.
Finch y cols. (44) realizaron un estudio doble ciego, controlado con placebo, cruzado, donde utilizaron ketamina tópica al 10 % en dos ocasiones, con un intervalo de una semana. Concluyeron que la ketamina tópica no disminuye el dolor en pacientes con SDRC, aunque produce disminución de la alodinia (NE II) (Tabla III).
Russo y cols. (45), en un estudio sobre 13 pacientes con SDRC, evaluaron la administración tópica de un compuesto con: ketamina 10 %, pentoxifilina 6 %, clonidina 0,2 % y dimetil sulfóxido 6-10 %. En 9 pacientes obtuvieron un descenso de la intensidad del dolor, 6 pacientes tuvieron beneficios mantenidos durante 2 meses y en 2 pacientes remitió el dolor, uno se encontraba en etapas iniciales de la enfermedad y el otro tenía un diagnóstico parcial de SDRC.
Fibromialgia
Los mecanismos centrales se relacionan con el dolor muscular referido y la sumación temporal de la actividad nociceptiva muscular, que se encuentra facilitada en el síndrome fibromiálgico. En la fibromialgia existe una sensibilización central; los puntos gatillo representan áreas de hiperalgesia secundaria. El alivio de estos síntomas mediante la ketamina indica que hay una disminución de la sensibilización central (NE II) (20). La ketamina disminuye los mecanismos implicados en el dolor referido, la sumación temporal, la intensidad y duración del dolor en puntos gatillo, la hiperalgesia muscular y el dolor muscular en reposo (33,46). Se ha comparado la eficacia de la ketamina con la morfina, lidocaína, naloxona y placebo, aunque ninguno de ellos mostró un beneficio significativo con respecto a los demás (20).
Dolor neuropático
La ketamina produce una disminución significativa de la hiperalgesia y la alodinia, aunque este efecto es menos importante en el dolor continuo crónico. El tratamiento con ketamina es más beneficioso cuando el dolor tiene una duración inferior a 5 años (NE II) (20).
La administración sistémica o espinal de antagonistas del receptor NMDA, en pacientes con dolor neuropático crónico, disminuye el dolor espontáneo y la hiperalgesia (47).
El dolor neuropático y la hiperalgesia relacionada con altas dosis de opioides se relaciona, al menos en parte, con la activación del receptor NMDA. En este caso, teóricamente, la ketamina podría ser una opción lógica. Las exacerbaciones severas de dolor e hiperalgesia, en pacientes tratados con dosis elevadas de morfina intratecal, se pueden controlar con ketamina intravenosa a 10 mg/h, permitiendo la reducción de la dosis de morfina intratecal de forma mantenida, a la vez que se controla la hiperalgesia (NE IV) (20). Marchetti y cols.(48) realizaron un estudio retrospectivo sobre 51 pacientes (el 60 % con dolor neuropático), siendo la dosis media efectiva de 2 mg/kg. La ketamina fue efectiva en el 44 % de los pacientes, con una disminución media de la intensidad del dolor del 67 ± 32 %, parcialmente efectiva en el 20 %, con una media de ahorro de opioides del 63 ± 32 % y fracasó en el 22 %. La mitad de los pacientes presentaron efectos secundarios, aunque sólo 8 pacientes tuvieron que interrumpir el tratamiento. En los pacientes en tratamiento con opioides, la ketamina fue más eficaz y presentó, significativamente, menos efectos adversos (Tabla III).
En una revisión del Grupo de Interés del Dolor Neuropático de la IASP no recomiendan la ketamina para el tratamiento del dolor neuropático (NE I) (49).
Dolor irruptivo
Carr y cols. (50), en un estudio aleatorizado, cruzado, doble ciego, controlado con placebo, estudiaron la eficacia y seguridad de la ketamina intranasal en el dolor irruptivo, en 20 pacientes con dolor crónico, incluyendo pacientes con SDRC. Los pacientes presentaron dolor irruptivo durante la semana previa a la aleatorización. Recibieron tratamiento del dolor irruptivo con ketamina o placebo. Los pacientes tratados con ketamina intranasal presentaron una disminución de la intensidad del dolor irruptivo significativamente mayor que los tratados con placebo (p < 0,0001). El efecto de la ketamina aparecía a los 10 minutos de la administración y tenía una duración máxima de 60 minutos, no precisando rescates suplementarios de los episodios de dolor irruptivo.
Neuralgia orofacial
La ketamina puede ser útil en el tratamiento de la neuralgia del trigémino refractaria a terapias convencionales (NE IV). Por vía intramuscular, puede producir alivio del dolor durante 6-24 horas, posiblemente por la anulación de la sensibilización, persistiendo el efecto analgésico tras su suspensión (20,21).
En algunos pacientes con dolor crónico, la administración de ketamina por la noche disminuye la intensidad del dolor durante el día siguiente (21).
La ketamina ha permitido el control del dolor en un paciente con dolor facial atípico, rebelde a otras terapias (analgésicos menores, anticomiciales, antidepresivos, corticoides, bloqueos del ganglio estrellado, del nervio supraorbitario, morfina subaracnoidea, etc.). El control se consiguió con una dosis inicial de 80 mg/8 horas por vía oral y una dosis de mantenimiento de 40 mg/8 horas (31).
La ketamina se ha utilizado como enjuague bucal en mucositis inducidas por la radiación (11).
Dolor del miembro fantasma
La ketamina aumenta el umbral de dolor y disminuye la hiperpatía, siendo útil en el tratamiento del dolor del miembro fantasma (NE IV) (20,51). Heyes y cols. (52), en un ensayo controlado, aleatorizado en 45 pacientes sometidos a amputación por debajo de la rodilla, que recibieron una infusión de ketamina intravenosa 0,5 mg/kg/h frente a placebo, presentaron ausencia de dolor del miembro fantasma en el 53 % de los pacientes del grupo ketamina y en el 29 % de los pacientes del grupo control, sin llegar a alcanzar significación estadística. La administración perioperatoria de ketamina puede prevenir el dolor del miembro fantasma (53).
Dolor isquémico
El dolor isquémico de la arteriosclerosis presenta características nociceptivas y neuropáticas; suele responder pobremente a los opioides. La ketamina tiene un potente efecto analgésico dosis-dependiente en el dolor isquémico, pero con estrecho margen terapéutico (20).
Neuralgia postherpética
Eide y cols. (54), en un estudio aleatorizado, cruzado, doble ciego, evaluaron la eficacia de la ketamina intravenosa (0,15 mg/kg), la morfina (0,075 mg/kg) o la solución salina, en 8 pacientes con neuralgia postherpética. La sensación anormal al estímulo térmico doloroso fue normalizado por la ketamina en 4 pacientes. La alodinia fue inhibida significativamente por la ketamina y la morfina. Ninguno de los tratamientos tuvo repercusión sobre los umbrales de calor, frío, dolor al calor o sensación táctil (NE II).
Dolor oncológico
En 1999, Lauretti y cols. (55) publicaron dos ensayos clínicos sobre la utilización de ketamina para el tratamiento de pacientes con dolor oncológico (Tabla II). En el primer estudio, 60 pacientes fueron asignados al azar para recibir terapia oral con morfina, nitroglicerina, ketamina o metamizol a intervalos programados (55).
Los pacientes estaban diagnosticados de neoplasias primarias de orofaringe, útero, próstata, tracto digestivo, riñones e hígado. Todos recibieron amitriptilina oral y morfina oral (hasta 80-90 mg/día) para el control del dolor basal. El grupo de ketamina fue el único grupo que presentó control adecuado del dolor de forma mantenida, con dosis bajas de morfina oral.
En el segundo estudio, Lauretti y cols. (56), aleatorizaron 48 pacientes en cuatro grupos de 12 pacientes cada uno, con terapia epidural de: morfina, ketamina, neostigmina, o midazolam (Tabla II). Los pacientes estaban diagnosticados de neoplasia primaria de: orofaringe, pulmón, útero, próstata, tracto digestivo, riñones e hígado. Cada paciente recibió, además, amitriptina oral y morfina epidural. El grupo de ketamina fue el único grupo que precisó sistemáticamente menos dosis de morfina para controlar el dolor, aunque no presentó modificaciones en las evaluaciones del dolor.
Mercadante y cols. (57) publicaron un estudio aleatorizado, doble ciego, cruzado de ketamina, utilizando dos dosis (0,25 y 0,50 mg/kg) y solución salina como control (Tabla II). Los pacientes estaban diagnosticados de neoplasia primaria de: pulmón, útero, recto y vejiga, un caso de cáncer de origen primario desconocido y un paciente con histiocitoma. A 10 pacientes con dolor oncológico se les administró ketamina intravenosa a 0,25 o 0,50 mg/kg o solución salina en una sola dosis. Cada paciente recibió los tres tratamientos con un lavado de 2 días entre los mismos. Observaron mejoría significativa en el control del dolor después de recibir tratamiento con ambas dosis de ketamina, en comparación con la solución salina. No hubo diferencia significativa en las puntuaciones de dolor entre las dosis de ketamina.
Hardy y cols. (58) comunicaron un estudio multicéntrico, doble ciego, aleatorizado, controlado con placebo, de ketamina subcutánea para el tratamiento del dolor oncológico (Tabla II). Los pacientes estaban diagnosticados de cáncer primario de pulmón, próstata, colorrectal, ginecológico, mama, óseo y páncreas. En este estudio, 185 pacientes fueron asignados al azar al grupo ketamina o placebo (suero salino) y 181 pacientes recibieron su terapia asignada.
La ketamina se administró a una dosis de 100 mg/24 horas durante 24 horas. Recibieron dosis crecientes de 300 y 500 mg/24 horas durante 5 días si el dolor no mejoraba. No hubo diferencia significativa en el control del dolor entre los grupos de placebo y ketamina si los pacientes eran capaces de completar los 5 días de tratamiento. Sin embargo, los pacientes del grupo de ketamina abandonaron el tratamiento con mayor frecuencia que el grupo control, debido a los efectos secundarios.
Jackson y cols. (59) realizaron un estudio multicéntrico en cuidados paliativos, utilizando una infusión continua subcutánea de ketamina durante tres días; en el 50 % de los pacientes remitió el dolor durante dos o más semanas (Tabla II).
La ketamina se ha utilizado asociada a la morfina o como una alternativa a los opiáceos potentes, cuando la escalada de dosis ha sido ineficaz o la aparición de efectos secundarios ha sido intolerable. En estos casos, la vía habitual de administración ha sido la oral o la subcutánea en infusión continua (11).
Existe evidencia para la ketamina, como una opción viable, en el tratamiento del dolor oncológico refractario (Tabla II) (12,60).
La ketamina oral a dosis bajas (0,5 mg/kg/8 h) puede ser eficaz en el tratamiento del dolor neuropático refractario en pacientes con neoplasia avanzada (61). La ketamina en infusión durante 3-5 días, en pacientes oncológicos con dolor refractario, consiguió una tasa de respuesta global del 67 % (Tabla II) (62). La ketamina es un coadyuvante analgésico seguro y eficaz en pacientes con dolor severo (Tabla II) (63).
Dolor en pediatría
Dolor no oncológico
Sheehy y cols. (64) realizaron un estudio de cohorte longitudinal en 63 niños y adolescentes (rango 12-17 años), que recibieron una infusión intravenosa de ketamina a una dosis de 0,1-0,3 mg/k/h durante 4-8 horas/día, durante 3 días consecutivos. Los pacientes presentaban dolor por: SDRC 37 % y otros síndromes de dolor crónico 63 %. La intensidad del dolor disminuyó de forma significativa en los pacientes con SDRC, con respecto al resto de los síndromes de dolor crónico. La ketamina permitió reducir la dosis de morfina o fármacos similares en un 20 % (Tabla III).
Dolor oncológico
Disponemos de 5 estudios retrospectivos de ketamina en pacientes pediátricos con dolor oncológico, que incluyen 16 niños tratados con ketamina oral e intravenosa, con pocos efectos secundarios. Los pacientes estaban diagnosticados de leucemia mieloide aguda, síndrome mielodisplásico, osteosarcoma, metástasis mesenquimal maligna gigante, glioblastoma multiforme, neuroblastoma, sarcoma de Ewing, sarcoma de células fusiformes, sarcoma de células sinoviales y tumor de Wilms (12).
Se han publicado varias series de casos, con un número reducido de pacientes en tratamiento con ketamina con resultados prometedores.
Finkel y cols. (65) realizaron una revisión retrospectiva donde se administró ketamina intravenosa, a una dosis de 0,1-1 mg/kg/h, a 8 niños y 11 adolescentes (3-17 años de edad) con dolor oncológico. En el 73 % de los casos se pudo disminuir las necesidades de opioides y tuvieron un mejor control del dolor. No se presentaron náuseas, sedación, alucinaciones, dificultad respiratoria o efectos psicotomiméticos. Se asoció lorazepam a 0,025 mg/kg/12 h, para minimizar los efectos psicotomiméticos de la ketamina.
La administración epidural de ketamina en los niños se asocia a una disminución de los efectos secundarios y del consumo de opioides. Los riesgos de neurotoxicidad no son menos preocupantes que en los adultos. Se ha descrito la presentación de laringospasmo cuando se administra por vía intramuscular a altas dosis. El tratamiento crónico con ketamina puede provocar cistitis reversible (12).
Dolor postoperatorio crónico
La administración de ketamina intravenosa o epidural en el periodo intraoperatorio y postoperatorio inmediato en pacientes intervenidos de toracotomías no se ha mostrado eficaz en la reducción de la incidencia del dolor postoperatorio crónico (Tabla III) (66,67).
Efectos secundarios
La aparición de efectos secundarios se relaciona con la dosis administrada. Se presentan en, aproximadamente, el 40 % de los pacientes cuando se prescribe infusión continua por vía subcutánea y, con menor frecuencia, por vía oral (11).
En 2012, el abuso de la ketamina tenía una prevalencia del 0,8 % en adultos jóvenes, siendo inferior a la presentada en 2002, que fue del 1,2 % (18).
La muerte por toxicidad directa aguda es rara. La ketamina puede alterar numerosas funciones cerebrales, entre ellas la percepción del color, la memoria, la atención, la cognición, el tiempo de reacción, el sentido del tiempo y puede producir adicción psicológica.
Entre las complicaciones de su uso prolongado se encuentran: hepatotoxicidad, hipertensión arterial, taquicardia, hipertensión intracraneal, fenómenos psicotomiméticos (euforia, disfasia, embotamiento afectivo, retraso psicomotor, sueños vívidos, pesadillas, deterioro en la atención, memoria y juicio, alucinaciones visuales y auditivas, imagen corporal alterada y sedación), mareos, diplopía, visión borrosa, nistagmus, vértigo, audición alterada, hipersialorrea, hipertermia, dolor abdominal, anorexia, sensación de embriaguez, trastornos del sueño, sudoración, náuseas, vómitos, eritema y dolor en el lugar de inyección, riesgo de abuso y dependencia, cefalea, sensación de embriaguez, cansancio y confusión.
La administración crónica de ketamina se ha asociado a toxicidad urinaria (disuria, hematuria, cistitis intersticial, hidronefrosis, necrosis papilar, insuficiencia renal), úlcera gástrica y lesión hepática. Se presentan movimientos tónico-clónicos en más del 10 % de los casos (11,12,14,17,18,21,23).
A dosis más altas, los efectos secundarios pueden incluir: delirio, amnesia, alteración de la función motora, ansiedad, ataques de pánico, manía, insomnio e hipertensión arterial (12). El tratamiento frecuente y a largo plazo con ketamina se ha asociado a deterioro de la función cognitiva en pacientes con SDRC (68).
Aunque la ketamina se ha utilizado como tratamiento de la depresión, también se ha asociado con empeoramiento de la misma (12).
Precauciones
Se deben adoptar precauciones en pacientes con antecedentes de trastornos psiquiátricos, epilepsia, glaucoma, hipertensión arterial, insuficiencia cardiaca, cardiopatía isquémica, accidentes cerebrovasculares e insuficiencia hepática grave (11).
Conclusiones
Los antagonistas de los receptores NMDA abren un nuevo horizonte en el tratamiento del dolor neuropático. Disponemos de fármacos como la ketamina; no obstante, aún carece de indicación en el tratamiento del dolor crónico.
La posología para el tratamiento del dolor crónico presenta un amplio margen terapéutico. Falta por determinar la dosis mínima eficaz y la duración óptima del tratamiento en cada entidad nosológica de dolor.
La vía oral es la más difundida en el tratamiento del dolor crónico; se asocia con menor incidencia de efectos secundarios, a pesar de carecer de una formulación oral comercial, lo que dificulta su utilización.
La ketamina oral puede ser útil en el tratamiento del dolor crónico de los pacientes refractarios a tratamientos habituales. Se ha mostrado útil como coadyuvante de otros analgésicos, especialmente en pacientes en tratamiento con opioides, permitiendo disminuir la dosis e incrementando el control analgésico de los pacientes con dolor crónico.
Disponemos de evidencia moderada sobre la eficacia de la ketamina intravenosa a bajas dosis, en el SDRC, que no justifican su utilización sistemática en este síndrome.
En el dolor neuropático, la ketamina se ha mostrado especialmente eficaz en el control de la alodinia, hiperalgesia e hiperpatía, aunque existen controversias sobre su utilización.
La utilización de la ketamina en el tratamiento del dolor crónico en pediatría es prometedora, aunque no se dispone de suficientes estudios de calidad que puedan avalar su utilización.
Hay evidencia sobre la eficacia de la ketamina en pacientes con dolor oncológico refractario.
La utilización de la ketamina a largo plazo adolece de suficientes estudios de calidad que aporten información sobre los efectos secundarios y los niveles de seguridad.
La aparición de los efectos secundarios de la ketamina se relaciona con la dosis administrada. Se recomienda la utilización de dosis bajas de ketamina con el objetivo de reducir los efectos secundarios en los pacientes con dolor crónico. Se recomienda la utilización de benzodiacepinas para minimizar los efectos psicotomiméticos.
Los efectos secundarios limitan la utilización de ketamina en muchos pacientes. Su uso clínico requiere una cuidadosa selección del paciente y la valoración de la relación riesgo/beneficio.
Es importante conocer los antecedentes de abuso de sustancias debido al riesgo potencial de abuso del fármaco.
Se necesitan nuevos ensayos clínicos de calidad que aporten un elevado nivel de evidencia y permitan concretar la indicación más adecuada de la ketamina en el tratamiento del dolor, así como su grado de seguridad por las diferentes vías de administración.
Bibliografía
1. Sorkin LS. Farmacología y fisiología básica del proceso del dolor agudo. En: Wallace MS, Dunn JS, Yaksh TL. Clínicas de Anestesiología de Norteamérica. McGraw-Hill Interamericana, México 1997;2:245-59. [ Links ]
2. Basbaum A. Mecanismos fundamentales: anatomía y fisiología de la nocicepción. En: Kanner R. Secretos del tratamiento de dolor. McGraw-Hill Interamericana, México 1998:9-15. [ Links ]
3. Dzoljic M, Gelb AW. Intravenous anaesthetics: Some cellular sites of action. Eur J Anaesth 1997;14(Suppl):3-7. [ Links ]
4. Lipkowski AW, Maszczynska I. Peptide, N-methyl-D-aspartate and adenosine receptors as analgesic targets. Current Op Anaesth 1996;9:443-8. [ Links ]
5. Sukiennik AW, Kream RM. N-methyl-D-aspartate receptors and pain. Current Op Anaesth 1995;8:445-9. [ Links ]
6. Laird JMA, García de la Rubia P, Cerveró F. Mecanismos neurofisiológicos de la sensibilización central del dolor somático y visceral: papel de los receptores NMDA. Dolor 1995;10:24-7. [ Links ]
7. Morgan CJA, Curran HV. Ketamine use: A review. Addiction 2011;107:27-38. [ Links ]
8. Mitsikostas DD, Sánchez del Río M, Moskowitz MA, Waeber C. Both 5-HT1B and 5-HT1F receptors modulate c-fos expression within rat trigeminal nucleus caudalis. Eur J Pharmacol 1999;369(3):271-7. [ Links ]
9. Woolf CJ, Thompson SW. The induction and maintenance of central sensitization is dependent on N-methyl-D-aspartic acid receptor activation; implications for the treatment of post-injury pain hypersensitivity states. Pain 1991;44:293-9. [ Links ]
10. Raigorodsky G, Urca G. Spinal antinociceptive effects of excitatory amino acid antagonists: Quisqualate modulates the action of N-methyl-D-aspartate. Eur J Pharmacol 1990;182:37-47. [ Links ]
11. Wilcock A, Twycross R. Therapeutic Reviews. Ketamine. Journal of Pain and Symptom Management 2011;41,3:640-9. [ Links ]
12. Bredlau AL, Thakur R, Korones DN, Dworkin RH. Ketamine for pain in adults and children with cancer: A systematic review and Synthesis of the literature. Pain Medicine 2013;14:1506-17. [ Links ]
13. Blonk MI, Koder BG, van den Bemt PMLA, Huygen FJPM. Use of oral ketamine in chronic pain management: A review. European Journal of Pain 2010;14:466-72. [ Links ]
14. Quibell R, Prommer EE, Mihalyo M, Twycross R, Wilcock A. Ketamine. J Pain Symptom Manage 2011;41,3:640-9. [ Links ]
15. Errando CL, Sifre C, Moliner S. Utilización de ketaminpara anestesia subaracnoidea durante hipovolemia. Estudio experimental preliminar en cerdos. Rev Esp Anestesiol Reanim 2004;51:3-11. [ Links ]
16. Bredlau AL. Oral ketamine for children with chronic pain: A pilot phase 1 study. J Pediatr 2013;163(1):194-200. [ Links ]
17. Niesters M, Martini Ch, Dahan A. Ketamine for chronic pain: Risks and benefits. Br J Clin Pharmacol 2014;77(2):357-67. [ Links ]
18. Bokor G, Anderson PD. Ketamine: An update on its abuse. Journal of Pharmacy Practice 2014;27(6):582-6. [ Links ]
19. Liman S, Cheung ChW, Wong KL, Tai W, Qiu Q, Ng KF, et al. Preventive treatment with ketamine attenuates the ischaemia-reperfusion response in a chronic postischaemia pain model. Oxid Med Cell Longev 2015;2015:380403. [ Links ]
20. Hocking G, Cousins MJ. Ketamine in chronic pain management: An evidence-based review. Anesth Analg 2003;97:1730-9. [ Links ]
21. Rabben T, Skjelbred P, Øye I. Prolonged analgesic effect of ketamine, an N-Methyl-D-Aspartate receptor inhibitor, in patients with chronic pain. J Pharmacol Exp Ther 1999;289(2):1060-6. [ Links ]
22. Mercadante S, Arcuri E, Ferrera P, Villari P, Mangione S. Alternative treatments of breakthrough pain in patients receiving spinal analgesics for cancer pain. J Pain Symptom Manage 2005;30(5):485-91. [ Links ]
23. Max MB, Gilron IH. Antidepresivos, relajantes musculares y antagonistas del receptor de N-metil-D-aspartato. En: Loeser JD, Butler SH, Chapman RC, et al. Bonica Terapéutica del Dolor. McGraw-Hill Interamericana. México 2003:2026-46. [ Links ]
24. Biarnes JC, Tornero C, Quevedo L, Moreno JA, Aliaga L. Dolor neuropático bucofacial. Concepto y tratamiento. Dolor 2000;15:115-25. [ Links ]
25. Benitez-Rosario MA, Salinas-Martin A, González-Guillermo T, Feria M. A strategy for conversion from subcutaneous to oral ketamine in cancer pain patients: Effect of a 1:1 ratio. J Pain Symptom Manage 2011;41(6):1098-105. [ Links ]
26. Mercadante S, Arcuri E, Tirelli W, Casuccio A. Analgesic effect of intravenous ketamine in cancer patients on morphine therapy: A randomized, controlled, double-blind, crossover, double-dose study. J Pain Symptom Manage 2000;20,4:246-52. [ Links ]
27. Donck AV, Vranken JH, Puylaert M, Hayek S, Mekhail N, Zundert JV. Intrathecal drug administration in chronic pain syndromes. Pain Practice 2014;14,5:461-76. [ Links ]
28. Vranken JH, Van Der Vegt MH, Kal JE, Kruis MR. Treatment of neuropathic cancer pain with continuous intrathecal administration of S (+)-ketamine. Acta Anaesthesiol Scand 2004;48,2:249-52. [ Links ]
29. Yang CY, Wong CS, Chang JY, Ho ST. Intrathecal ketamine reduces morphine requirements in patients with terminal cancer pain. Can J Anaesth 1996;43(4):379-83. [ Links ]
30. Wiech K, Kiefer R-T, Töpfner S, Preissl H, Braun C, Unertl K, et al. A placebo-controlled randomised crossover trial of the N-methyl-D-aspartic acid receptor antagonist, memantine, in patients with chronic phantom limb pain. Anesth Analg 2004;98:408-13. [ Links ]
31. Cuesta MJ, Bornay B, Vaquero LM. Ketamina oral: alternativa válida en el tratamiento del dolor facial atípico. A propósito de un caso. Rev Soc Esp Dolor 2003;10:188-90. [ Links ]
32. Sakai T, Tomiyasu S, Ono T, Yamada H, Sumikawa K. Multiple Sclerosis with severe pain and allodynia alleviated by oral ketamine. Clin J Pain 2004;20(5):375-6. [ Links ]
33. López-Millán JM, Sánchez-Blanco C. Utilización de ketamina en el tratamiento del dolor agudo y crónico. Rev Soc Esp Dolor 2007;1:45-65. [ Links ]
34. Azari P, Lindsay DR, Briones D, Clarke C, Buchheit T, Pyati S. Efficacy and safety of ketamine in patients with complex regional pain syndrome: A systematic review. CNS Drugs 2012;26(3):215-28. [ Links ]
35. O'Connell NE, Wand BM, McAuley J, Marston L, Moseley GL. Interventions for treating pain and disability in adults with complex regional pain syndrome- an overview of systematic reviews. Cochrane Database Syst Rev 2013;(4). Available from: http://onlinelibrary.wiley.com/doi/10.1002/14651858.CD009416.pub2/abstract. [ Links ]
36. Cossins L, Okell RW, Cameron H, Simpson B, Poole HM, Goebel A. Treatment of complex regional pain syndrome in adults: A systematic review of randomized controlled trials published from June 2000 to February 2012. Eur J Pain 2013;17(2):158-73. [ Links ]
37. Harden RN, Oaklander AL, Burton AW, Perez RS, Richardson K, Swan M, et al. Complex regional pain syndrome: Practical diagnostic and treatment guidelines. 4th edition. Pain Med 2013;14(2):180-229. [ Links ]
38. Goebel A, Barker CH, Turner-Stokes L, et al. Complex Regional pain syndrome in adults: UK guidelines for diagnosis, referral and management in primary and secondary care. London: RCP; 2012. [ Links ]
39. Perez RS, Zollinger PE, Dijkstra PU, Thomassen-Hilgersom IL, Zuurmond WW, Rosenbrand KC, et al. Evidence based guidelines for complex regional pain syndrome type 1. BMC Neurol 2010;10:20. DOI: 10.1186/1471-2377-10-20. [ Links ]
40. Goebel A. Management of adult patients with longstanding complex regional pain syndrome. Pain Manage 2013;3(2):137-46. [ Links ]
41. Koffler SP, Hampstead BM, Irani F, Tinker J, Kiefer RT, Rohr P, et al. The neurocognitive effects of 5 day anesthetic ketamine for the treatment of refractory complex regional pain syndrome. Arch Clin Neuropsychol 2007;22(6):719-29. [ Links ]
42. Kiefer RT, Rohr P, Ploppa A, Dieterich HJ, Grothusen J, Koffler S, et al. Efficacy of ketamine in anesthetic dosage for the treatment of refractory complex regional pain syndrome: An open-label phase II study. Pain Med 2008;9(8):1173-1201. DOI:10.1111/j.1526-4637.2007.00402.x. Epub 2008 Feb 5. [ Links ]
43. Goldberg ME, Domsky R, Scaringe D, Hirsh R, Dotson J, Sharaf I, et al. Multi-day low dose ketamine infusion for the treatment of complex regional pain syndrome. Pain Phys 2005;8(2):175-9. [ Links ]
44. Finch PM, Knudsen L, Drummond PD. Reduction of allodynia in patients with complex regional pain syndrome: A double-blind placebo-controlled trial of topical ketamine. Pain 2009;146(1-2):18-25. [ Links ]
45. Russo MA, Santarelli DM. A novel compound analgesic cream (ketamine, pentoxifylline, clonidin, DSMO) for complex regional pain syndromes patients. Pain Pract 2016;16,1:E14-20. [ Links ]
46. Graven-Nielsen T, Aspegren S, Henriksson KG, Bengtsson M, Sörensen J, Johnson A, et al. Ketamine reduces muscle pain, temporal summation, and referred pain in fibromialgia patients. Pain 2000;85,3:483-91. [ Links ]
47. Sang C N, Booher S, Gilron I, Parada S, Max MB. Dextromethorphan and memantine in painful diabetic neuropathy and postherpetic neuralgia. Efficacy and dose-response trials. Anesthesiology 2002;96:1053-61. [ Links ]
48. Marchetti F, Coutaux A, Bellanger A, Magneux C, Bourgeois P, Mion G. Efficacy and safety of oral ketamine for the relief of intractable chronic pain: A retrospective 5-year study of 51 patients. Eur J Pain 2015;19,7:984-93. [ Links ]
49. Dworkin RH, O'Connor AB, Kent J, Mackey SC, Raja SN, Stacey BR, et al. Interventional management of neuropathic pain: NeuPSIG recommendations. Pain 2013;154(11):2249-61. [ Links ]
50. Carr DB, Goudas LC, Denman WT, Brookoff D, Staats PS, Brennen L, et al. Safety and efficacy of intranasal ketamine for the treatment of breakthrough pain in patients with chronic pain: A randomized, double-blind, placebo-controlled, crossover study. Pain 2004;108(1-2):17-27. [ Links ]
51. Mayo Moldes M, Carregal Raño A, Fernández Rodríguez T. Ketamina en el dolor del miembro fantasma. Rev Soc Esp Dolor 2009;16,8:437-40. [ Links ]
52. Hayes C, Armstrong-Brown A, Burstal R. Perioperative intravenous ketamine infusion for the prevention of persistent post-amputation pain: A randomized, controlled trial. Anaesth Intensive Care 2004;32(3):330-8. [ Links ]
53. Schug SA, Palmer GM, Scott DA, Halliwell R, Trinca J; APM: SE Working Group of the Australian and New Zealand College of Anaesthetists and Faculty of Pain Medicine (2015) Acute Pain Management: Scientific Evidence (4th edition), ANZCA & FPM, Melbourne. [ Links ]
54. Eide PK, Jorum E, Stubhaug A, Bremnes J, Breivik H. Relief of post-herpetic neuralgia with the Nmethyl-D-aspartic acid receptor antagonist ketamine: A double-blind, cross-over comparison with morphine and placebo. Pain 1994;58(3):347-54. [ Links ]
55. Lauretti GR, Lima IC, Reis MP, Prado WA, Pereira NL. Oral ketamine and transdermal nitroglycerin as analgesic adjuvants to oral morphine therapy for cancer pain management. Anesthesiology 1999;90(6):1528-33. [ Links ]
56. Lauretti GR, Gomes JM, Reis MP, Pereira NL. Low doses of epidural ketamine or neostigmine, but not midazolam, improve morphine analgesia in epidural terminal cancer pain therapy. J Clin Anesth 1999;11(8):663-8. [ Links ]
57. Mercadante S, Arcuri E, Tirelli W, Casuccio A. Analgesic effect of intravenous ketamine in cancer patients on morphine therapy: A randomized, controlled, double-blind, crossover, double-dose study. J Pain Symptom Manage 2000;20(4):246-52. [ Links ]
58. Hardy J, Quinn S, Fazekas B, Plummer J, Eckermann S, Agar M, et al. Randomized, double-blind, placebo-controlled study to assess the efficacy and toxicity of subcutaneous ketamine in the management of cancer pain. J Clin Oncol 2012;30(29):3611-7. [ Links ]
59. Jackson K, Ashby M, Howell D, Petersen J, Brumley D, Good P, et al. The effectiveness and adverse effects profile of "burst" ketamine in refractory cancer pain: The VCOG PM 1-00 study. J Palliat Care 2010;26(3):176-83. [ Links ]
60. Lossignol DA, Obiols-Portis M, Body JJ. Successful use of ketamine for intractable cancer pain. Support Care Cancer 2005;13(3):188-93. [ Links ]
61. Kannan TR, Saxena A, Bhatnagar S, Barry A. Oral ketamine as an adjuvant to oral morphine for neuropathic pain in cancer patients. J Pain Symptom Manage 2002;23(1):60-5. [ Links ]
62. Jackson K, Ashby M, Martin P, Pisasale M, Brumley D, Hayes B. "Burst" ketamine for refractory cancer pain: An open-label audit of 39 patients. J Pain Symptom Manage 2001;22(4):834-42. [ Links ]
63. Fitzgibbon EJ, Viola R. Parenteral ketamine as an analgesic adjuvant for severe pain: Development and retrospective audit of a protocol for a palliative care unit. J Palliat Med 2005;8(1):49-57. [ Links ]
64. Sheehy KA, Muller EA, Lippold C, Nouraie M, Finkel JC, Quezado ZMN. Subanesthetic ketamine infusion for the treatment of children and adolescents with chronic pain: A longitudinal study. BMC Pediatrics 2015;15:198. [ Links ]
65. Finkel JC, Pestieau SR, Quezado ZM. Ketamine as an adjuvant for treatment of cancer pain in children and adolescents. J Pain 2007;8(6):515-21. [ Links ]
66. Tena B, Gomar C, Rios J. Perioperativ epidural or intravenous ketamine does not improve the effectiveness of thoracic epidural analgesia for acute and chronic pain after thoracotomy. Clin J Pain 2014;30,6:490-500. [ Links ]
67. Hu J, Liao Q, Zhang F, Tong J, Ouyang W. Chronic postthoracotomy pain and perioperative ketamine infusion. J Pain Palliat Care Pharmacother 2014;28,2:117-21. [ Links ]
68. Kim M, Cho S, Lee JH. The effects of long-term ketamine treatment on cognitive function in complex regional pain syndrome: A preliminary study. Pain Med 2016 Feb 27. Pii:pnv112. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Fernando Neira Reina
banesfer@gmail.com
Recibido: 27-04-16.
Aceptado: 28-04-16.