CONTEXTO
La osteoartritis (OA) es la causa más frecuente de artritis. La OA tiene un impacto directo en la calidad de vida a tal punto de que es el undécimo contribuyente global a la discapacidad en todo el mundo. La carga de la enfermedad en términos de coste es tal que se estima que 4 millones de personas se ven afectadas en España, lo que supone un coste anual de 4378 millones de euros al año, lo que significa el 0,5 % del producto interior bruto 1.
La OA constituye un problema importante de salud pública. En personas mayores de 60 años, el 13 % refiere OA de rodilla sintomática; en personas mayores de 70 años el 27 % presenta signos radiológicos de OA, y en personas mayores de 80 años, el 44 % presenta signos radiológicos y síntomas clínicos 2.
Clásicamente, la OA se consideraba una enfermedad por "uso y desgaste". Sin embargo, los factores metabólicos e inflamatorios son nuevos factores patogénicos. De hecho, algunos autores están redefiniendo la OA como una enfermedad de "inflamación crónica de bajo grado" 3. Por tanto, hay un cambio de paradigma para la OA, de la teoría biomecánica a la inflamatoria 2,3.
La teoría biomecánica establece que la OA es una enfermedad inducida mecánicamente. El cartílago articular se sobrecarga como resultado de una mala alineación, una mala mecánica y la carga o impacto. Esta sobrecarga compromete la estructura de soporte del cartílago, haciendo que se ablande y degrade. Una vez que el cartílago se ablanda, el hueso que se encuentra debajo se endurece y la articulación se rompe. Si la sobrecarga no se modifica, la OA progresará. Una vez que la elasticidad del hueso subcondral desaparece, la destrucción progresiva del cartílago y el hueso conduce a la formación de osteofitos para aumentar el área de superficie, disminuyendo así la carga. Por último, la progresión de la deformidad articular mueve el eje de soporte de peso al compartimento opuesto y continúa la destrucción articular adicional. En esta etapa está indicada la artroplastia total de rodilla, como tratamiento final 4.
La teoría inflamatoria e inmunitaria establece que en el cartílago, las células están expuestas a fuerzas de desgaste dentro de la matriz extracelular (MEC) y en la superficie de la articulación. Como consecuencia, la MEC se destruye, liberando citoquinas inflamatorias como IL-6, IL-8, metaloproteasas minerales de matriz (MMP), factor inhibidor de leucemia (LIF) y oncostatina M (OSM). Estas señales de peligro activan segundos mensajeros, empeorando el entorno inflamatorio. Además, la senescencia del cartílago induce la apoptosis y se potencian las respuestas inflamatorias. Estas células y señales inflamatorias incitan una cascada inflamatoria que sobrepasa la respuesta curativa innata, lo que lleva a un estado catabólico que produce más destrucción del cartílago 4.
La MEC puede ser destruida por inflamación o por mecanismos de apoptosis, que están mediados por respuestas inmunes o inflamatorias 4. En este entorno inflamatorio, al actuar sobre cascadas de señalización bien conocidas, la señalización de células y proteínas podría fomentar respuestas de curación favorables 4. Las células madre mesenquimales reducen la inflamación, combaten la apoptosis (muerte celular), se autorreplican y se diferencian en múltiples tejidos. El plasma rico en plaquetas (PRP) contiene casi 1200 proteínas, incluidos factores de crecimiento y citoquinas antinflamatorias 4. Bloquean la inflamación y estimulan la curación del cartílago 4.
El nuevo paradigma del manejo de la OA de rodilla se basa en tratamientos de señalización celular, basados en componentes celulares y proteicos. Se espera que ambos componentes puedan interactuar con las células madre residentes, las células inflamatorias e inmunes para combatir el entorno inflamatorio de la articulación y regenerar el tejido dañado 4.
Hoy en día no existe cura para la OA. El objetivo del tratamiento a corto plazo es disminuir el dolor y recuperar la calidad de vida y la función de los pacientes, y a largo plazo ralentizar/detener la progresión de la enfermedad 1. Las nuevas opciones de tratamiento para el manejo de la artrosis de rodilla en forma de infiltraciones intrarticulares incluyen al ácido hialurónico (AH), glucocorticoides, analgésicos y terapias complementarias no probadas, como plasma rico en plaquetas (PRP) 5 o incluso ozono 1. Sin embargo, los buenos resultados obtenidos con los fármacos biológicos que combaten la inflamación (como en la artritis reumatoide), basados en un enfoque de tratar solo una diana terapéutica, no se han traducido al manejo de la OA de rodilla 5.
Dado que en el origen de la OA de rodilla están involucradas muchas vías de señalización y mediadores inflamatorios 4, postulamos que un enfoque multidiana sería beneficioso para el tratamiento de la OA de rodilla.
El AH, el PRP y el ozono actúan sobre la modulación de la inflamación a través de diferentes mediadores y vías de señalización 1,4,5, por lo tanto podrían considerarse estas opciones de tratamiento, teniendo en cuenta su perfil multidiana, para el manejo de la OA de rodilla en un futuro próximo.
El objetivo del presente estudio es revisar la fisiopatología de la OA, centrándose principalmente en el mecanismo inflamatorio, las vías de señalización implicadas y las posibles dianas de tratamiento, y postular al AH, al PRP y al ozono como opciones de tratamiento multidiana para el manejo de la artrosis de rodilla.
ESTADO DEL ARTE
Patogenia y diagnóstico de la artrosis
A medida que las personas envejecen, el cartílago de las personas sufre cambios histológicos y se degenera. Como resultado, se forman enzimas catabólicas (MMP1 [metaloproteasas de la matriz], MMP10, MMP13, IL-1α, IL-6, IL-7, IL-8), productos finales de glicación, ROS (especies reactivas de oxígeno), células apoptóticas y necróticas, y la MEC se descompone 6. Las ROS, las citoquinas inflamatorias y las proteínas catabólicas están involucradas en el proceso de envejecimiento del cartílago articular 6.
Para la reparación del cartílago es necesario actuar sobre las células madre mesenquimales (MSC). Normalmente, algunos estímulos como TGF-β (factor de crecimiento transformante β), IGF-1 (factor de crecimiento de insulina 1), la carga mecánica y la hipoxia inducen a los condroblastos a diferenciarse en condrocitos específicos y producir cartílago elástico, cartílago hialino y fibrocartílago 6. Como resultado, se produce cartílago articular y colágeno tipo II, IX y X 6.
La OA se produce por factores de riesgo modificables (obesidad, ocupación, lesión, actividad física, deportes y dieta) y por factores de riesgo no modificables (sexo, edad, genética y hormonas). La OA se presenta como un grupo de signos y síntomas, que incluyen dolor, hinchazón, rigidez articular y debilidad muscular 7.
Según la EULAR (Liga Europea contra el Reumatismo), para el diagnóstico de OA deben estar presentes al menos 3 síntomas y 3 signos clínicos y de laboratorio. Los signos y síntomas clínicos incluyen dolor, rigidez, pérdida de función, crepitación, pérdida del rango de movimiento y agrandamiento óseo. Los signos de laboratorio incluyen VSG (velocidad de sedimentación globular) menor de 40 mm/h, factor reumatoideo menor de 1:40 y líquido sinovial con leucocitos menor de 2000 células/μL 8.
La OA se clasifica en 4 grados según Kellgren y Lawrence (KL): en el grado 1 existe la sospecha de estrechamiento del espacio articular y posible sobrecrecimiento de osteofitos; el grado 2 muestra un posible estrechamiento del espacio articular y osteofitos definidos; el grado 3 representa una esclerosis definitiva y un estrechamiento del mínimo espacio articular y una posible irregularidad ósea; el grado 4 se caracteriza por grandes osteofitos, importante estrechamiento del mínimo espacio articular, mayor esclerosis y cierta irregularidad ósea 8.
El diagnóstico de la OA es clínico y radiológico. Lamentablemente, el inicio de la OA se produce antes de que se realice el diagnóstico radiológico. En esta etapa, la radiografía no es capaz de detectar etapas tempranas de OA. El diagnóstico precoz nos permitirá establecer un tratamiento preventivo para frenar o detener la destrucción del cartílago 9.
Un biomarcador es un marcador cuantificable de un proceso biológico. En la OA, un biomarcador debería comprometer la osteogénesis y la inflamación. Un biomarcador en OA cuantifica los cambios osteogénicos o inflamatorios observados en suero, orina o líquido sinovial; y este cambio, ya sea en crecimiento o degradación de tejido, podría incluso preceder a los cambios radiográficos 9).
Para la artrosis de rodilla, se consideran biomarcadores inflamatorios y no inflamatorios. Los biomarcadores no inflamatorios incluyen biomarcadores metabólicos del colágeno (CTX-I [telopéptido C-terminal], CTX-II), biomarcadores metabólicos distintos del colágeno (proteoglicanos, agrecanasas [condroitín sulfato, queratán sulfato], no agrecanasas [ácido hialurónico, osteocalcina, osteopontina, folastina]. Los biomarcadores inflamatorios se dividen en proinflamatorios y antinflamatorios. Los biomarcadores proinflamatorios incluyen adipoquinas (leptina, adiponectina, visfatina y resistina), interleucinas (IL-1β, IL-6, IL-15, IL-17, IL-18), quimiocinas (TNF-α), proteína C reactiva (PCR), velocidad de sedimentación globular (VSG) y ácido úrico. Los biomarcadores antinflamatorios incluyen citocinas tales como IL-4, IL-7, IL-8, IL-10 e IL-13 9.
La fisiopatología de la OA es muy compleja. En la artrosis de rodilla hay un desequilibrio entre factores anabólicos y catabólicos. Los factores catabólicos incluyen citoquinas inflamatorias (IL-1β, IL-6, IL-15, IL-17, IL-18, TNF-α, LIF [factores inhibidores de la leucemia]) y enzimas proteolíticas (MMP-1, MMP3 y agrecanasas [ADAMTs]). Los factores anabólicos comprenden citoquinas antinflamatorias (IL-4, IL-10) y citoquinas anabólicas (TGF-β, IGF-1, FGF-18 [factor de crecimiento de fibroblastos] y PDGF [factor de crecimiento derivado de plaquetas]) 10. Los factores inflamatorios y catabólicos producen un desequilibrio que lleva a una articulación sana a desarrollar OA de rodilla (Figura 1) 11.
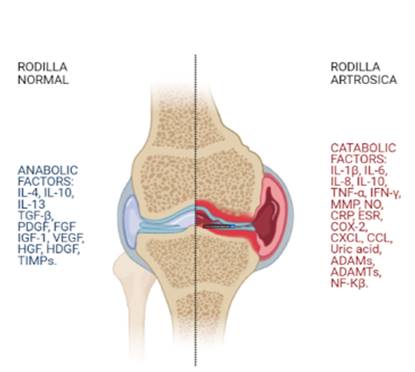
MMP: metaloproteasas minerales de matriz. ADAM: desintegrina y metaloproteasa. ADAMTS: desintegrina y metaloproteasa con motivos de trombospondina. NO: óxido nítrico. TNF-α: factor de necrosis tumoral α. iNOS: óxido nítrico sintasa inducible. COX-2: ciclooxigenasa-2. CXCL: receptor de quimioquinas. CCL: ligando de quimioquinas. CRP: proteína C reactiva. ESR: velocidad de sedimentación globular. TGF-β: factor de crecimiento transformante β. HGF: factor de crecimiento de hepatocitos. VEGF: factor de crecimiento endotelial vascular. EGF: factor de crecimiento endotelial. IGF-1: factor de crecimiento de insulina 1. HDGF: factor de crecimiento derivado de hepatocitos. TIMPS: inhibidor tisular de metaloproteasa. NF-Кβ: factor nuclear Кβ
Fig. 1. La osteoartritis es el resultado de un desequilibrio entre factores anabólicos y catabólicos donde predominan las citoquinas proinflamatorias y las quimioquinas catabólicas sobre las citoquinas antinflamatorias y las quimioquinas anabólicas.
La leptina es una adipoquina con efecto inflamatorio. Un aumento del peso corporal y una expansión del tejido adiposo blanco conducen a un aumento de la carga mecánica; luego, la degradación del cartílago es el resultado final, lo que desencadena el desarrollo de OA. Por otro lado, la leptina derivada del tejido adiposo (sobreproducción en pacientes obesos) está relacionada con la desregulación de los osteoblastos en el tejido óseo subcondral, produciendo desgaste articular y daño por desgarro. Además, la leptina libera citoquinas proinflamatorias derivadas de las células inmunitarias adaptativas e innatas, creando un medio inflamatorio que favorece la destrucción del cartílago y la OA 12.
Además de la leptina, otras adipoquinas, tales como la visfatina, producen ROS y las citoquinas proinflamatorias provocan inflamación y degradación del cartílago 13.
La obesidad y el síndrome metabólico están relacionados con una inflamación crónica de bajo grado, que conduce a lesión articular, dolor y discapacidad. El síndrome metabólico/obesidad libera IL-1β, IL-6, PgE2, TNF-α y adipoquinas. Los factores catabólicos producen sinovitis, esclerosis subcondral y lesión articular 13.
Denoble sostiene que el ácido úrico está relacionado con la degradación de la OA a través del inflamosoma (NLRP3) 14. Las articulaciones OA liberan agentes nucleares que promueven la cristalización del urato. A medida que avanza la OA, la muerte de las células libera ácido úrico. En pacientes hiperuricémicos, el ácido úrico se difunde de la sangre al líquido sinovial en la articulación. Estos mecanismos de difusión o apoptosis producen inflamación subaguda y favorecen la progresión de la OA por activación de la vía del inflamosoma 14. Del mismo modo, Mc Alister afirma que el NLRP3 (inflamosoma) podría activarse a través de la vía NF-Кβ [factor nuclear-Кβ] o mediante caspasas, liberando citoquinas inflamatorias (IL-1β e IL-18), lo que conduce a una inflamación crónica, favoreciendo la progresión de OA 15. Wehmeyer afirma que la OA y la artritis reumatoide (AR) comparten la vía de señalización RANKL [ligando activador del receptor del factor nuclear kappa-β] o NF-Кβ y que el bloquear esa vía sería una opción de tratamiento válida 16.
Pulsatelli afirma que la OA no es solo una enfermedad del cartílago, sino del hueso subcondral y del tejido sinovial 17. Varias vías de señalización actúan sobre los condrocitos, lo que conduce a la alteración del cartílago y la formación de hueso en la OA 16. El bloqueo de esas vías de señalización podría evitar la progresión de la OA 17.
Kennedy afirma que las citoquinas inflamatorias (IL-1β, IL-6, TNF-α) pueden actuar en varias vías de señalización. Pueden liberar ROS y actuar sobre la degradación del cartílago. También pueden actuar sobre las MMP de la matriz que conducen a la degradación del colágeno tipo X. Las citoquinas inflamatorias también pueden actuar sobre el ligando de la membrana RANKL, activando la vía nuclear NF-Кβ, actuando sobre el factor de transcripción SOX-9 (proteína condrogénica) y COX-2 (ciclooxigenasa), degradando el colágeno tipo II 18.
Mobasheri afirma que no solo la patogenia de la OA es compleja, sino que los fenotipos de la OA son variados 19. Hay varios fenotipos en la artrosis (fenotipos óseo, metabólico, subcondral, impulsado por el envejecimiento, impulsado por el cartílago, impulsado por lesiones traumáticas, impulsado por la sinovitis, etc.); el metabolismo está involucrado en varios de ellos, y también comparten vías de señalización similares 19. Al respecto, Berembaum sostiene que el síndrome metabólico libera mediadores inflamatorios a la sangre, que son dañinos para los tejidos articulares e inician o perpetúan este proceso. Una vez que las células artríticas se activan, liberan mediadores inflamatorios en la articulación y la sangre, lo que amplifica la inflamación de bajo grado y acelera otras enfermedades sistémicas crónicas de bajo grado 20. Por tanto, el síndrome metabólico no solo empeora la OA, sino también los traumatismos agudos, el envejecimiento y las enfermedades por cristales, liberando mediadores sistémicos de la inflamación que agravarían enfermedades como el Alzheimer, la arteriosclerosis o el infarto agudo de miocardio 20. Como resumen, la OA se ve afectada por la inflamación crónica de bajo grado como se presenta en el síndrome metabólico (obesidad, resistencia a la insulina, anomalías de los lípidos, hipertensión), y el desarrollo de OA contribuye a la inflamación crónica de bajo grado, a través de los efectos sistémicos de los mediadores inflamatorios derivados de la OA, induciendo y acelerando otras enfermedades crónicas (enfermedad de Alzheimer, accidente cerebrovascular, infarto de miocardio) 20.
La composición corporal alterada, los metabolitos alterados y la inflamación derivada del tejido graso y el tejido sinovial liberan mediadores inflamatorios que empeoran la OA. Los factores dietéticos anormales y el tejido graso disfuncional producen y aumentan las adipoquinas que conducen a un mayor riesgo de desarrollo de OA, debido a la liberación de mediadores de la inflamación (complemento, PCR, citoquinas) 21.
Guisasola y Ortiz demostraron que en el politraumatismo agudo existe una elevación de las citoquinas inflamatorias (IL-1β, IL-6, TNF-α y las proteínas de choque térmico) 22. La perpetuación de una agresión aguda que da lugar a una inflamación crónica puede inducir OA postraumática. Lieberthal afirma que la resolución de la inflamación con bloqueo específico de citoquinas resolvería el problema 23.
Tratamiento según diana única
Dado que no existe cura para la OA, hay muchas dianas terapéuticas en estudio para el tratamiento de la OA 24. El tratamiento estándar en la OA avanzada es la artroplastia de reemplazo total, con una eficiencia del 95 % a los 10 años y del 90 % a los 15 años 1. Sin embargo, este enfoque no está exento de riesgos y complicaciones 1.
Para el manejo de la OA temprana se proponen muchas dianas como opciones terapéuticas. Los objetivos terapéuticos incluyen: a) reguladores de la función mitocondrial, b) nutracéuticos, c) reguladores de la apoptosis, d) inhibidores de iNOS [óxido nítrico sintasa inducible], e) analgésicos y AINE [fármacos antinflamatorios no esteroides], f) inhibidores de MMP, g) bloqueadores de citoquinas proinflamatorias, h) medicamentos a base de hierbas, i) agentes de conservación de la densidad ósea, j) bifosfonatos y k) ranelato de estroncio 24.
Inhibidores de óxido nítrico y antioxidantes
Los inhibidores del óxido nítrico y los antioxidantes son capaces de modular la inflamación, pero no son útiles para el manejo de la OA 25,26.
Nutracéuticos
La curcumina pudo ralentizar la progresión de la OA y disminuir los síntomas de dolor relacionados con la OA en el modelo de ratón postraumático con OA. Desafortunadamente, estos hallazgos aún no fueron corroborados en humanos 27.
Agentes reductores de ácido úrico
La OA, la artritis reumatoide y la gota comparten vías de señalización similares. Desafortunadamente, los medicamentos que disminuyen los niveles de ácido úrico (como el alopurinol o los medicamentos uricosúricos) no disminuyen el riesgo de reemplazo total de rodilla 28.
La colchicina es un fármaco antimitótico y antinflamatorio. En un estudio reciente, la colchicina mostró una reducción de la inflamación y de los biomarcadores del recambio óseo (ambos factores relacionados con la progresión y la gravedad en los pacientes con OA); pero a largo plazo (seguimiento de 16 semanas), la colchicina no fue capaz de reducir los síntomas de OA de rodilla 29.
Terapia biológica
La terapia biológica dirigida a citoquinas o interleucinas específicas (como anakinra, infliximab, etanercept, adalimumab, tocilizumab o denosumab) han demostrado su eficacia en el tratamiento de la artritis reumatoide (AR); lamentablemente, los fármacos biológicos no han demostrado su eficacia en el tratamiento de la OA, no existe un efecto modificador de la enfermedad en la progresión de la OA 20. Los fármacos biológicos se dirigen a los procesos inflamatorios, pero sus excelentes resultados observados en la AR no se han traducido con éxito en la OA 30.
Bloqueando TNF-α
El TNF-α es una citoquina proinflamatoria que se dirige a los condrocitos produciendo pérdida de cartílago 30. Infliximab mostró tolerabilidad inicial en los primeros ensayos exploratorios, pero no fue eficaz en el tratamiento de la artrosis de rodilla 20,30. Etanercept mostró efectividad en el alivio del dolor, pero el efecto duró solo 4 semanas 30. El adalimumab fue seguro y mejoró los síntomas en la OA, pero no ha progresado en el manejo de la OA de rodilla 30.
Tratamiento multidiana
Ejercicio y pérdida de peso
El ejercicio aumenta la IL-10 antinflamatoria en el sitio perisinovial e intrarticular de la rodilla 31. La pérdida de peso disminuye la IL-6 y la leptina y mejora el dolor, la función, la calidad de vida, la fuerza muscular y la resistencia en pacientes con artrosis de rodilla sintomática 32. El ejercicio y la pérdida de peso pueden actuar como un enfoque multimodal ya que disminuyen las citoquinas y adipoquinas inflamatorias (IL-6, leptina) y aumentan las citoquinas antinflamatorias (IL-10) 31,32.
Ácido hialurónico
El ácido hialurónico (AH) es un componente del líquido sinovial y es responsable de su viscoelasticidad. En la OA, la concentración y el peso molecular de AH disminuyen, lo que reduce la protección mecánica de la articulación. La infiltración intrarticular (IA) de AH podría restaurar la elasticidad del líquido sinovial, agregando absorción de impactos, lubricación y protección de la articulación. Además, el AH aumentó la proliferación de condrocitos y disminuyó su apoptosis, desacelerando la destrucción y el estrechamiento progresivo del espacio articular, que está relacionado con la OA, actuando como agente condroprotector. También se han informado en la literatura efectos antinflamatorios y analgésicos del AH 33.
Nichols ha declarado que el AH puede actuar sobre la degradación de la MEC y sobre la inflamación y el dolor 34. Dependiendo del peso molecular, el AH podría actuar sobre diferentes citoquinas de degradación e inflamación 34.
En el estudio de Nichols, el AH de bajo peso molecular (LMW) inhibió la MME (metaloelastasa de macrófagos) y la MMP-10 (metaloproteinasa de matriz), responsables de la degradación de la MEC (34). El AH de bajo peso molecular (LMW) también inhibió CCL-2 (ligando de quimioquinas), CCL-3, CCL-4, CXCL-2 (receptor de quimioquinas), CXCL-9, CXCL-10 e IL-12, responsables de la presentación de inflamación/dolor 34. El AH de alto peso molecular (HMW) inhibió ADAM-17 (desintegrina y metaloproteasa), ADAMTS-4 (desintegrina y metaloproteasa con motivos de trombospondina), ADAMTS-5 y MMP-1, MMP-2, MMP-3, relacionadas con la degradación de la MEC. El AH de alto peso molecular (HMW) también inhibió IL-6, NF-Кβ (factor nuclear), fosfo-Akt (transformador de cepa Ak), fosfo-JNK (cinasa N-terminal c-jun) y TLR-4 (tipo toll-like receptor), citoquinas relacionadas con la presencia de dolor e inflamación. Tanto LMW AH como HMW AH pueden actuar sobre MMP-9 y MMP-13, inhibiendo la degradación de la MEC. LMW AH y HMW AH inhiben IL-1β, IL-8, TNF-α, CCL-5, iNOS (óxido nítrico sintasa inducible) y COX-2 (ciclooxigenasa), responsables de la presentación de dolor e inflamación 34 (Tabla 1).
Tabla I. Perfil multidiana del ácido hialurónico, plasma rico en plaquetas y ozono con efectos de estimulación (↑) e inhibición (↓)
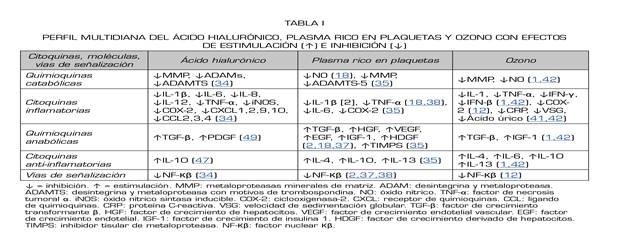
↓ = inhibición. ↑ = estimulación. MMP: metaloproteasas minerales de matriz. ADAM: desintegrina y metaloproteasa. ADAMTS: desintegrina y metaloproteasa con motivos de trombospondina. NO: óxido nítrico. TNF-α: factor de necrosis tumoral α. iNOS: óxido nítrico sintasa inducible. COX-2: ciclooxigenasa-2. CXCL: receptor de quimioquinas. CCL: ligando de quimioquinas. CRP: proteína C-reactiva. VSG: velocidad de sedimentación globular. TGF-β: factor de crecimiento transformante β. HGF: factor de crecimiento de hepatocitos. VEGF: factor de crecimiento endotelial vascular. EGF: factor de crecimiento endotelial. IGF-1: factor de crecimiento de insulina 1. HDGF: factor de crecimiento derivado de hepatocitos. TIMPS: inhibidor tisular de metaloproteasa. NF-Кβ: factor nuclear Кβ.
El AH actúa sobre los efectos sintomáticos (dolor e inflamación) y modificadores de la enfermedad (degradación de la MEC) en la OA, por lo que el AH puede constituir un fármaco multidiana y una opción válida para el tratamiento de la OA de rodilla 34.
Plasma rico en plaquetas (PRP)
El plasma rico en plaquetas es un producto autólogo que mediante centrifugación eleva el nivel de plaquetas varias veces respecto al observado en el suero sanguíneo 30. El PRP lleva varios mediadores que se comunican con las células articulares 30.
Algunos autores afirman que el PRP contiene 300 moléculas o proteínas identificadas por proteómica en los α-gránulos 35,36, mientras que otros sostienen que el PRP contiene casi 800 proteínas 37 e incluso 1200 proteínas, incluidos factores de crecimiento (GF) y anticitoquinas inflamatorias 4. Esos GF y citoquinas pueden bloquear la inflamación y estimular la curación del cartílago 4,30,35,36,37.
Kennedy afirma que el PRP modula la inflamación inhibiendo la IL-1β y el TNF-α. El PRP favorece la proliferación y renovación celular mediante la estimulación de TGF-β (factor de crecimiento transformante β) y HGF (factor de crecimiento de hepatocitos), VEGF (factor de crecimiento endotelial vascular), EGF (factor de crecimiento endotelial), IGF-1 (factor de crecimiento de insulina tipo 1) y PDGF (factor de crecimiento derivado de plaquetas) 18. De hecho, el HGF inhibe el NF-Кβ y disminuye la síntesis de NO (óxido nítrico) 18. Ornetti publicó que el PRP, a través del HGF, inhibe la vía NF-Кβ 37. El PRP a través de IGF-1 también es capaz de inhibir la vía NF-Кβ 37. El HGF limita la respuesta inflamatoria dentro de la membrana sinovial 37. Demange afirmó que el PRP es capaz de atenuar citoquinas proinflamatorias como el NF-Кβ e IL-1 38 (Tabla I).
El PRP puede actuar sobre diferentes citoquinas y vías de señalización, modulando la inflamación y disminuyendo la degradación del cartílago y promoviendo la curación del cartílago 4,30,35,36,37,38. El perfil multidiana del PRP hace que esta terapia sea una alternativa prometedora para el tratamiento de la artrosis de rodilla.
Ozono (O 2 -O 3 )
El ozono (O2-O3) modula la inflamación y el dolor en pacientes con OA de rodilla 41. Además, el efecto anabólico del ozono (O2-O3) podría jugar un papel importante en la modificación de la historia natural de la OA, como se informó recientemente en un caso clínico 39,40.
Recientemente, Fernández-Cuadros y cols. reportaron las propiedades inmunomoduladoras y anabólicas del ozono (O2-O3) mediante la regulación positiva de citoquinas antiinflamatorias (IL-4, IL-10), factores de crecimiento (TGF-β, IGF-1), células madre y la regulación inhibitoria de citoquinas inflamatorias y catabólicas (MMPS, NO [óxido nítrico], PgE2 [prostaglandina E2]) 1,40 (Tabla 1).
Manoto ha declarado que las ROS activan la vía NF-Кβ que conduce a la apoptosis del cartílago. También ha demostrado que el ozono podría bloquear la vía NF-Кβ, disminuyendo las citoquinas inflamatorias tales como IL-1β, IL-6, TNF-α y COX-2, considerando al ozono (O2-O3) como una opción prometedora para el crecimiento del cartílago en pacientes con artrosis de rodilla 12. Fernández-Cuadros ha observado que el ozono intrarticular es capaz de disminuir la PCR, la VSG (velocidad de sedimentación globular) y el ácido úrico, reconocidos como biomarcadores de inflamación en pacientes con OA de rodilla, confirmando que el ozono modula la inflamación 41,42) (Tabla 1).
Por las investigaciones previas, podría esperarse que el ozono (O2-O3) pueda desempeñar un papel en el tratamiento de los pacientes con OA de rodilla 40,43.
RESULTADOS
Este es el primer artículo que revisa el papel de la inflamación como la causa principal en la patogenia de la OA y postula al AH, al PRP y al ozono como posibles opciones de tratamiento debido a su perfil multidiana en la modulación de la inflamación.
La fisiopatología de la OA es muy compleja. Hay muchas vías de señalización involucradas. Las moléculas proteolíticas y los mediadores inflamatorios se ven comprometidos en la progresión inicial de la enfermedad 2. La OA se definía clásicamente como una enfermedad de "sobreuso y desgaste", pero ahora las variables bioquímicas, biomecánicas, metabólicas y genéticas se consideran factores clave para la progresión de la enfermedad 30, por lo que el paradigma ha cambiado de la teoría biomecánica a la teoría inflamatoria 3.
Los objetivos terapéuticos en la OA son: a) ralentizar el ciclo de degradación-inflamación, b) inhibir los mediadores de la inflamación, c) disminuir las quimioquinas catabólicas, y d) estimular las quimioquinas anabólicas 35.
En esta revisión, los medicamentos que tienen un perfil de tratar a una sola diana, incluidas las terapias biológicas (como anakinra [anti IL-1β] o infliximab, etanercept, adalimumab [anti-TNF-α], tocilizumab [anti IL-6] e incluso el denosumab [RANKL-a]), que han demostrado eficacia en el tratamiento de la AR, bloqueando citoquinas inflamatorias específicas, no han demostrado la misma eficacia el tratamiento de la artrosis de rodilla 20.
Para el tratamiento de la artrosis de rodilla, las pautas reconocidas están establecidas por el ACR (Colegio Americano de Reumatología), OARSI (Sociedad Internacional de Investigación en Osteoartritis), EULAR (Liga Europea contra el Reumatismo) y la AAOS (Academia Americana de Cirujanos Ortopédicos) 33. Sin embargo, ninguna de las guías clínicas ha incluido todavía al PRP ni al ozono como opciones de tratamiento 30,33.
En el caso del AH, existe controversia sobre su uso. La AAOS (recomendación del 2013) y la NICE (recomendación del 2014 del Instituto Nacional para la Excelencia en la Salud y la Atención) no respaldan su uso; mientras que la OARSI (recomendación del 2014) y la ACR (recomendación del 2012) no son concluyentes con respecto al uso del AH 30. Solo hay una revisión sistemática que ha declarado que los tratamientos intrarticulares mostraron el mayor efecto en el manejo de la OA de rodilla, incluyendo PRP y al AH con un peso molecular superior a 1500 kDa 44.
En el caso del ozono, un metanálisis actualizado y una revisión publicados por separado por Nori-Zadehh y cols. y Vázquez y cols. han definido al ozono (O2-O3) como una opción válida para el manejo de la OA de rodilla debido a su efectividad en el manejo de dolor 45,46.
En el caso del PRP, tres metanálisis recientes (Chang 2013, Khoshbin 2013, Tietze 2014) han indicado que PRP ofrece mejores resultados en comparación con el AH o los corticosteroides, y el efecto se mantiene durante al menos 6 meses 2. Ornetti y Andía, en dos revisiones recientes, afirman que el PRP tiene un papel en el tratamiento de la OA de rodilla debido a sus propiedades antinflamatorias y regenerativas y los beneficios clínicos han sido confirmados en ensayos controlados aleatorizados y no aleatorizados 36,37.
Zamboni ha declarado que el AH y el PRP pueden promover la regeneración y reducir la inflamación 47. El HMW AH (50-120 kDa) agregado al PRP (infiltrado en combinación) reduce las citoquinas y quimioquinas responsables de la progresión de la OA 48. La combinación de inyecciones intrarticulares de AH y PRP puede disminuir las células relacionadas con el sistema inmunológico y pueden recuperar la degradación del cartílago y pueden reparar los desgarros de menisco 49. Además, se ha demostrado que el AH aumenta la producción de GF si se agrega simultáneamente a la infiltración de PRP, lo que reduce el tiempo necesario para la curación. La combinación de PRP más AH potencia la liberación de TGF-1 y PDGF, favoreciendo el efecto curativo 49.
En esta revisión, el AH, el PRP y el ozono han demostrado tener propiedades antinflamatorias, inmunomoduladoras y regenerativas debido a su perfil multidiana.
Tres recientes metanálisis confirman la utilidad del PRP y el AH en el manejo de la OA. Chevalier y cols., en un metanálisis revisando 42 ensayos clínicos, observaron que el HA es más efectivo que los corticoides en el manejo de la OA (50). Tan y cols., en un metanálisis de 26 estudios randomizados y controlados, observaron que el PRP es más efectivo que el AH en el manejo de la OA, aunque los dos tratamientos mostraron el mismo perfil de seguridad 51. Finalmente, Han y cols., en un metanálisis que incluyó 43 ensayos, observaron que el AH demostró mejores resultados que el PRP en el tratamiento de la OA de rodilla 52.
Por todas las razones expuestas anteriormente, postulamos al AH, al PRP y al ozono como fármacos con un perfil multidiana para el manejo de la OA de rodilla, como se ha observado en esta revisión.
CONCLUSIONES
La OA es una enfermedad de fisiopatología compleja que involucra al cartílago, al hueso subcondral y al tejido sinovial. Nuevos estudios sugieren que en la patogenia de la OA intervienen mecanismos inflamatorios, incluso más que los factores biomecánicos, hasta el punto de que en esta revisión se ha propuesto un cambio de paradigma. La OA no tiene cura definitiva hoy en día. El objetivo del tratamiento es interrumpir el círculo vicioso de inflamación-degradación mediante el bloqueo de vías inflamatorias y catabólicas específicas. La opción de tratar una sola diana que bloquee una única vía de señalización no ha producido resultados significativos en el tratamiento de la OA de rodilla, como se observó en el tratamiento de la artritis reumatoide. Además del ejercicio y la pérdida de peso, el perfil multidiana del ozono, del PRP y del AH ofrecen una alternativa prometedora para el manejo de la OA de rodilla, ya que estas alternativas podrían actuar sobre citoquinas inflamatorias y quimioquinas catabólicas, y podrían estimular quimioquinas anabólicas y citoquinas antiinflamatorias, como se observó en la presente revisión. Las guías clínicas podrían considerar estas opciones terapéuticas para el tratamiento de la artrosis de rodilla, dadas las propiedades biológicas observadas en esta revisión.











 texto en
texto en 


