INTRODUCCIÓN
El síndrome de dolor regional complejo, o SDRC, se caracteriza por la aparición de una constelación de síntomas que incluyen dolor crónico persistente, síntomas autonómicos, sensoriales, motores y tróficos tras un traumatismo, y que no son explicables por el mismo 1. Se produce a causa de una compleja combinación de diferentes factores que se inician en el momento del traumatismo y que consisten en sensibilización del sistema nervioso, disfunción del sistema autónomo y cambios inflamatorios 2.
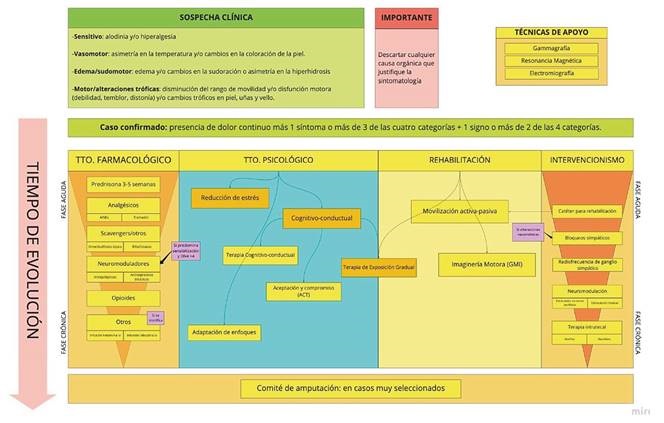
Su diagnóstico es eminentemente clínico y sigue los denominados criterios de Budapest, adoptados en el 2004, que presentan una alta sensibilidad y han mejorado la especificidad frente a los criterios previos 3. Consisten en la descripción de 4 categorías de síntomas y signos:
Sensitivo: alodinia y/o hiperalgesia.
Vasomotor: asimetría en la temperatura y/o cambios en la coloración de la piel.
Edema/sudomotor: edema y/o cambios en la sudoración o asimetría en la hiperhidrosis.
Motor/alteraciones tróficas: disminución del rango de movilidad y/o disfunción motora (debilidad, temblor, distonía) y/o cambios tróficos en piel, uñas y vello.
El diagnóstico de SDRC lo da la presencia de dolor continuo más 1 síntoma o más de 3 de las cuatro categorías, más 1 signo o más de 2 de las 4 categorías, con la exclusión de cualquier otro diagnóstico que justifique la clínica.
Los estudios epidemiológicos determinan una incidencia baja: 5,5 a 26,2 cada 100.000 habitantes 4. Sin embargo, en el entorno de la patología laboral cobra especial relevancia tanto por su alta incidencia ligada a traumatismos accidentales como por los pobres resultados obtenidos en algunos pacientes. Sin duda, es una de las causas de incapacidad laboral frecuente.
En las "Jornadas de Aprendizaje 360° sobre Dolor Regional Complejo", celebradas en noviembre de 2021 en Valencia (http://www.sdrc.es), revisamos cada uno de los aspectos de esta enfermedad. Tenemos el compromiso de compartir nuestro aprendizaje y proponer un abordaje terapéutico.
FISIOPATOLOGÍA
Es necesario conocer la fisiopatología de la enfermedad para comprender de qué manera podemos influir en su evolución.
En la cascada de acontecimientos que se suceden tras el evento traumático, tiene un protagonismo inicial el sistema nervioso periférico (SNP), con la persistencia de la inflamación y la consecuente sensibilización de los receptores nerviosos periféricos. La persistencia del dolor y alodinia puede estar mediada por la liberación de diferentes sustancias neuromediadoras e inflamatorias por parte de los nervios periféricos, lo que se conoce como inflamación neurógena5.
La disfunción del sistema nervioso autónomo (SNA) tiene igualmente una importante participación, no tanto por el daño directo de las fibras simpáticas, sino porque existen unas interconexiones entre el sistema simpático y las fibras Aδ y C responsables del dolor. Existe un incremento en la expresión de los receptores α1 adrenérgicos en el miembro afecto y, con el tiempo, los terminales nociceptivos acaban desarrollando sensibilidad ante las catecolaminas circulantes 2.
Hay asimismo un indudable componente inmunológico en el desarrollo del SDRC, concretamente un incremento de los neuropéptidos, tales como sustancia P y péptido relacionado genéticamente con la calcitonina (CGRP) que provocan la liberación de citoquinas proinflamatorias: IL 1β, IL 6, y factor de crecimiento tumoral (TNF) que, a su vez, potencian la sensibilización periférica a estímulos nocivos 6. Este hecho conlleva un incremento de la permeabilidad tisular y vasodilatación que clínicamente se expresa con edema y calor. También existe evidencia de una autoinmunización en el desarrollo del SDRC. Se cree que se forman autoanticuerpos contra las estructuras nerviosas autonómicas, lo que potencia la inflamación y exacerba los síntomas 7.
En las fases más tardías de la enfermedad, el sistema nervioso central (SNC) es el responsable fundamental del mantenimiento del estatus doloroso puesto que, tras ser receptor de repetidas descargas en las astas dorsales medulares, genera pequeños cambios en su respuesta. La sensibilización a nivel de las sinapsis en esa localización puede conducir a hiperalgesia y alodinia. Se conoce además la capacidad del SNC de realizar cambios plásticos con más facilidad que el SNP. En ese sentido, los cambios somatotópicos en la corteza cerebral son notables: en algunos casos, el área de representación cortical de miembros afectos se reduce, lo que facilita su disfunción motora, reflejos, mal reconocimiento del propio miembro e incluso anulación (neglecting)8
La implicación genética en el SDRC sigue siendo un objeto de investigación. Se cree que puede haber un nexo familiar que determine el desarrollo de la enfermedad, pero no se conoce un patrón familiar hereditario o un genotipo específico asociado al SDRC 9.
Por último, hay cierta evidencia de que algunos estados psicológicos podrían condicionar el desarrollo de la enfermedad, tales como el síndrome de estrés postraumático10. Pero lo que parece más evidente es que el estrés psicológico parece influir en la progresión de la enfermedad. Así, los pacientes con niveles elevados de ansiedad o miedo asociado al dolor muestran una evolución peor, y esto guarda relación con la elevación de catecolaminas asociada a la ansiedad, que conlleva un incremento en la sensibilización de los nociceptores. Asimismo, la catastrofización, definida como una respuesta psicológica exagerada a un estímulo nocivo, puede tener un impacto significativo en el desarrollo del SDRC, ya que conlleva el incremento de la actividad de citoquinas proinflamatorias en respuesta a estímulos dolorosos 2.
Los cambios fisiopatológicos se traducen en síntomas clínicos diferenciados. En su fase inicial, la fisiopatología que domina el cuadro es una reacción inflamatoria postraumática por la activación del sistema inmune, con aparición de enrojecimiento, aumento de coloración y edema. Si el SDRC no mejora en la fase aguda, los síntomas cambian por una serie de modificaciones fisiopatológicas, predominando la sensibilización central nociceptiva y los procesos de reorganización cerebral, mientras que la inflamación se modera. En esta fase, los síntomas predominantes son alteraciones del movimiento, de temperatura corporal, pérdida sensorial, hiperalgesia y desórdenes en la imagen corporal 2. Por ello, es fundamental iniciar los esfuerzos terapéuticos cuando predomina la fase inflamatoria, en las fases más agudas de la enfermedad.
PREVENCIÓN
No existe la prevención primaria del SDRC en sentido estricto. Existen múltiples trabajos acerca de la administración de la vitamina C tras traumatismos o cirugías sobre miembros para prevenir la aparición de SDRC tipo 1 con resultados contradictorios 11-13. En líneas generales, en las diferentes guías de consenso sobre el manejo del SDRC se recomienda el uso de la vitamina C oral, como agente antioxidante, basándose en el concepto de que la inflamación local que se produce en el SDRC genera radicales libres de oxígeno. Actúa inhibiendo las cascadas proinflamatorias mediante la disminución de la peroxidación lipídica, proceso por el cual los radicales libres dañan las células del endotelio vascular, que a su vez genera inflamación y microangiopatía. Proporciona electrones en los espacios intra y extracelular, dejando a los radicales libres sin su electrón desapareado, y por tanto inactivos. Dada la ausencia de efectos secundarios observada a las dosis recomendadas se propone la administración diaria de 500 mg de vitamina C durante 45 días tras los traumatismos de las extremidades superiores e inferiores y tras la cirugía ortopédica 11.
Otras recomendaciones propuestas para prevenir la aparición de SDRC se basan en la vigilancia de los factores de alto riesgo y los signos de alarma.
Factores de riesgo
Ciertas lesiones se asocian a una mayor incidencia de desarrollo de SDRC, principalmente las fracturas de las extremidades superiores, en especial las fracturas antebraquiales. Cuando el SDRC se desarrolla en las extremidades inferiores, las lesiones del tobillo y las lesiones intrarticulares pueden incrementar el riesgo del paciente a desarrollarlo. Independientemente del miembro, las fracturas proximales parecen tener una incidencia más baja de la enfermedad, lo que sugiere que los pacientes con lesiones distales son más susceptibles a desarrollar SDRC. La presencia de enfermedades musculoesqueléticas concurrentes, tales como artritis reumatoide, pueden también incrementar el riesgo. También la fibromialgia tiene una fuerte asociación con el diagnóstico de SDRC (riesgo 2,5 veces superior a los controles). Las lesiones de alta energía, fracturas severas y tiempos prolongados de anestesia general para su tratamiento se asocian positivamente con el desarrollo de la enfermedad (curiosamente la duración del tiempo transcurrido para la cirugía bajo anestesia locorregional no muestra una correlación similar). Parece ser que los pacientes con fracturas tratadas quirúrgicamente podrían ser más susceptibles a desarrollar SDRC 1,14,15.
Es por todas estas observaciones que, ante determinados pacientes (por ejemplo mujeres de edad avanzada con fracturas del miembro superior), debemos establecer estrategias para que estén vigilados de cerca y la frecuencia de revisiones en consulta sea mayor que en aquellos pacientes sin factores de riesgo asociados.
Signos de alarma
Son fundamentalmente dos:
-
Dolor desproporcionado: el dolor intenso (EVA > 5) durante la primera semana tras el traumatismo suele ser el primer síntoma que aparece en el establecimiento del SDRC, inicialmente en la localización del traumatismo sufrido para luego avanzar por la extremidad sin distribución dermatómica específica.
La latencia entre el traumatismo y el diagnóstico temprano de SDRC depende del tiempo normal de recuperación desde la lesión: para una fractura no complicada de radio un tiempo de recuperación de 4 a 6 semanas es, en principio, realista; las fracturas complicadas tardan más tiempo en recuperarse. Después de estos plazos puede diagnosticarse el SDRC (2).
Es importante considerar también los traumatismos que no precisan de tratamiento quirúrgico de inicio (esguinces, luxaciones, etc.) en los que hay que tener la misma actitud en lo que al tratamiento del dolor se refiere, pues no son pocos los casos de SDRC en nuestra práctica diaria en la consulta que son desencadenados por este tipo de traumatismos.
Está en nuestra mano el ser exquisitos con el tratamiento del dolor agudo postoperatorio pero no solo durante el ingreso hospitalario, sino a medio plazo.
-
Estrés postraumático elevado: es fundamental para evitar el desarrollo del SDRC detectar a los pacientes con altos niveles de ansiedad, catastrofismo y estrés postraumático en general, para que cuanto antes sean propuestos para tratamiento psicológico adecuado, dada la relación fisiopatológica que estas condiciones tienen con el desarrollo de dicha enfermedad 2.
Por último, en la prevención tiene enorme importancia la movilización precoz. Existen modelos animales que demuestran que la inmovilización no asociada a lesión de un miembro es, per se, una fuente de dolor neuropático cronificable, no solamente en la zona inmovilizada sino en su región homónima contralateral. No contentos con ese papel deletéreo del quedarse quieto, cada vez se da más peso científico a la hipótesis de que el movimiento es un agente antinflamatorio, y esto le da un papel relevante en una patología como el SDRC que apoya parte de su peso en la perpetuación de patrones inflamatorios neurógenos 16. No mover no es solo no desinflamar, si no que implica cambios estructurales-neuronales.
Es fundamental en el manejo del SDRC desde el mismo momento del diagnóstico descartar cualquier posible causa del mismo que sea reversible y, en el caso de que esta tenga tratamiento quirúrgico, se debe tratar cuanto antes 17.
TRATAMIENTO
El tratamiento debe ser precoz, multimodal y coordinado, con el objetivo fundamental no solo de aliviar el dolor, sino de recuperar funcionalmente el miembro afecto. La pieza angular del tratamiento es la rehabilitación, el resto de las medidas terapéuticas deben ir encaminadas a conseguir una analgesia suficiente para favorecer la rehabilitación, promover la movilidad y disminuir los niveles de ansiedad.
Circuitos de diagnóstico y tratamiento
Si adoptamos una visión general del circuito de un paciente que desarrolla SDRC, podemos ser más eficientes en el diagnóstico y tratamiento del cuadro (Figura 1). Esta visión desde el aire permite dibujar una hoja de ruta que limita las variantes para minimizar errores y pérdidas de un tiempo valioso.
La primera parada en el circuito suele corresponder al médico de atención primaria o al cirujano que realizó la intervención causante y la sigue en consulta, que deben mantenerse alerta por si aparecen signos de alarma. Son indicadores de este estancamiento evolutivo o empeoramiento el dolor persistente de difícil control y los síntomas y signos ya referidos en apartados anteriores. Este profesional debe realizar un diagnóstico diferencial para descartar cualquier otra causa reversible de empeoramiento o complicación (atrapamiento nervioso, fractura no reducida o mal consolidada, etc.).
El primer paso del tratamiento, en cualquier caso, debe ser la rehabilitación para fomentar el movimiento, desensibilizar (o prevenir la sensibilización) el área dolorosa e integrar el miembro afecto en sus actividades cotidianas. La farmacoterapia en el momento agudo, en el que predomina la inflamación y la activación inmunitaria, se debe iniciar entre el primer y tercer mes. Para ello, los pacientes pueden ser tratados conjuntamente con la unidad del dolor que, además, dictará la conveniencia o no de realizar alguna técnica intervencionista. Tal y como se ha descrito anteriormente, el catastrofismo o los niveles altos de ansiedad favorecen una evolución tórpida. Por ello, la incorporación del tratamiento psicológico en el circuito es básico en cualquier fase de la enfermedad.
Engranar este circuito es tarea del equipo multidisciplinar de tratamiento del SDRC y ningún actor es más importante que otro. Corresponde a este grupo facilitar la creación de un flujo de trabajo claro que permita tomar decisiones muy rápidas y ahorrar derivaciones innecesarias, que suelen resultar costosas en tiempo y dinero y abocar al paciente a una evolución desfavorable. En este sentido, apoyamos y promovemos la creación de unidades de tratamiento específico de esta enfermedad en la que cada miembro conozca su papel y el de los demás, obteniendo una visión integral del cuadro, de sus implicaciones en la vida del paciente y de las opciones que se le pueden brindar para apoyarle.
Rehabilitación
Como afirma el grupo de anestesia de la Clínica Mayo, "la rehabilitación es la piedra angular y el tratamiento de primera línea para el SDRC", y añadimos que debe conformar el eje central del tratamiento sobre el que el resto de las disciplinas colaboran para la correcta restauración funcional del paciente 18.
Sabemos que la sintomatología es variable a lo largo del curso del SDRC como resultado de la propia variabilidad de la fisiopatología existente, lo cual imposibilita un enfoque "único para todos" 19. Pese a ello, existe una evidencia creciente del papel que juega el sistema nervioso central en el desarrollo y mantenimiento del mismo. Los cambios en el procesamiento y la organización cortical pueden conducir al desarrollo de síntomas (alteración de la percepción corporal, incongruencias sensoriales y disfunción motora) que se pueden cronificar y ponen en riesgo la restauración funcional del paciente 20. Los avances en neurociencia empiezan a aplicarse con resultados en la clínica, y las técnicas de rehabilitación centradas en la modulación central (terapia en espejo, entrenamiento de discriminación táctil 21, imaginería motora, terapia de exposición gradual al dolor y la realidad virtual) se han mostrado capaces de contrarrestar los cambios plásticos del SNC, el "desuso aprendido" progresivo y la marcada conducta de discapacidad de estos pacientes en sus intentos por evitar el dolor.
Existe consenso en que, para tratar de evitar la cronificación, una intervención terapéutica temprana es fundamental 22, y en que en enfoque debe ser interdisciplinario, sistemático y coordinado. El objetivo ha de ser la restauración funcional, capaz de revertir las alteraciones del sistema nervioso central a largo plazo 23. Se deben incluir componentes de terapia médica y física, psicológica, recreativa y ocupacional 20.
El "reestablecimiento de la funcionalidad" persigue una activación gradual de la corteza sensitivomotora mediante una progresión desde intervenciones suaves hasta el ideal de la rehabilitación completa en todos los aspectos de la vida del paciente 24. El algoritmo terapéutico propone empezar por terapias enfocadas al trabajo del rango articular, la fuerza y la funcionalidad del miembro afecto, facilitando la tolerancia y adhesión del paciente al tratamiento rehabilitador.
Tradicionalmente se ha considerado que la rehabilitación debía realizarse sin rebasar los límites de tolerancia al dolor del paciente, buscando el "rango feliz" (equilibrio entre el estrés de la inactividad prolongada y el reposo en un extremo y el estrés del ejercicio excesivo en el otro) para ayudarlos a lograr un ritmo de vida más funcional y activo 25. En los últimos años, la escuela holandesa del dolor ha propuesto una alternativa: la Pain Exposure Physical Therapy (PEPT) 26, como un enfoque nuevo y prometedor en pacientes con SDRC tipo I. En esta terapia a los pacientes se les instruye sobre que el dolor es una "falsa señal de alarma", se les explica cuáles son los mecanismos del dolor y cuáles las consecuencias derivadas de evitar a toda costa el dolor. Tras ello, se realiza una exposición directa a estímulos dolorosos (por ejemplo, caminar en pacientes con SDRC en miembro inferior) sin medicación analgésica y se les anima a que ignoren su dolor. Esta terapia está guiada por 2 fisioterapeutas durante 5 sesiones que alientan al movimiento con el propósito de que conforme mejore la funcionalidad disminuya el dolor. Ellos registran la actividad con feedback positivos. Asimismo, se les instruye a disminuir la alodinia mediante automasajes y se les anima a que fuercen la extremidad en sus actividades diarias. La llave del éxito del PEPT es la motivación interna y la adherencia. No se puede concluir que esta terapia sea claramente mejor que el abordaje tradicional, pero lo que sí está claro es que hay una gran mejora en los rangos de movimiento.
Desde el ámbito de la rehabilitación, son aspectos decisivos a la hora de abordar el SDRC:
Detectar en qué momento evolutivo se encuentra el proceso para tratar de priorizar en las actuaciones terapéuticas. En las personas con SDRC agudo, es la gravedad del dolor la que determina la limitación funcional, no el miedo. Por el contrario, en las personas con SDRC crónico, la nocividad percibida de la actividad se correlaciona más fuerte con la limitación funcional que el impacto de la intensidad del dolor 27.
Incluir los aspectos psicosociales del paciente en la valoración del proceso. El síndrome no solo es biomédicamente multifacético, sino que también contiene con frecuencia componentes psicosociales, objetivos críticos del tratamiento 28.
Conocer el tipo de residencia del paciente, sus aficiones y motivaciones, su miembro dominante, su profesión, el entorno socio-familiar y laboral, o su nivel de estudios y cultural. Todos estos datos son importantes no solo para tratar de detectar las "yellow flags" que nos orienten hacia posibles factores de cronificación, sino para integrarlos como parte del tratamiento (terapia recreativa y vocacional), de forma que el paciente pueda encontrar satisfacción en actividades recreativas nuevas o previamente perdidas, combata eficazmente la kinesiofobia y promueva un mayor movimiento, restablezca su capacidad y libertad para determinar sus propias elecciones de estilo de vida de ocio, y faciliten un mayor contacto social y su reintroducción a una participación comunitaria estable una vez finalizado el tratamiento.
Contar con los terapeutas ocupacionales (TO) como líderes terapéuticos ideales en el proceso de restauración funcional, ya que están capacitados en los principios biopsicosociales de la enfermedad y son primordiales en la evaluación y el tratamiento funcionales. La función general del TO es guiar al paciente a través de un programa diseñado para minimizar el dolor y la sintomatología acompañante mientras se maximiza el uso funcional de la extremidad 29. De esta forma, tendrán un papel primordial a la hora de intentar controlar el dolor e incluir el movimiento en los estadios más precoces de la enfermedad a través de las terapias de modulación central 30 (activación de córtex premotor y motor primario) como la imaginería motora, la terapia de espejo o las terapias de desensibilización/discriminación táctil, mientras en los estadios crónicos, de menor expectativa evolutiva, su papel predominante estará centrado en la asimilación para la búsqueda de la mayor funcionalidad posible y en su integración en las actividades básicas de la vida diaria y las de tipo recreativo/vocacional.
Usar la fisioterapia en las fases más tempranas para mejorar la funcionalidad mediante el trabajo de control del edema y la normalización postural de los movimientos, para progresar e ir introduciendo de forma gradual el trabajo de mejora de la movilidad, la flexibilidad, la propiocepción y la fuerza a través del ejercicio físico activo o activo-asistido.
Tratamiento farmacológico
En el síndrome de dolor regional complejo, donde hay multitud de mecanismos fisiopatológicos que contribuyen a la génesis del dolor, es difícil obtener evidencia sobre la eficacia aislada de un solo fármaco. De hecho, la mayoría de los estudios en los que se compara un solo fármaco con placebo o con otro fármaco, no muestran resultados concluyentes.
Por otra parte, parece claro que hay que hay que ajustar el tratamiento en base a los mecanismos fisiopatológicos predominantes en cada paciente en función de su estadio evolutivo 31.
Los objetivos iniciales del tratamiento farmacológico deben ir destinados a disminuir la inflamación, el dolor e intentan mejorar la tolerancia a la rehabilitación. Los fármacos que han demostrado con un alto grado de nivel de evidencia una reducción significativa del dolor empleados en estas fases han sido los corticoides25. Sin embargo, debido al uso heterogéneo de criterios diagnósticos, criterios de inclusión y diversidad de dosis utilizadas, no hemos podido obtener unas recomendaciones optimizadas para su uso.
La mayor parte de los estudios muestran pautas de prednisona (fármaco más usado en los estudios randomizados) de 4 semanas de duración, o incluso menores, y empiezan a dosis de 60 mg/día con dosis decrecientes cada 1-3 días hasta llegar al cese a la 4.ª semana 32,33. Las dosis se ajustan en pacientes ancianos, frágiles, diabéticos o hipertensos, con dosis de inicio a 40 mg/día y misma pauta decreciente. Con estas dosis la aparición de efectos secundarios es leve y desparece tras la finalización del tratamiento. Nuestra propuesta es una pauta de prednisona de 5 semanas de duración con las siguientes dosis diarias decrecientes: primera semana 60 mg/día (20-20-20), 2.ª semana 40 mg/día (20-0-20), 3.ª semana 30 mg/día (15-0-15), 4.ª semana 20 mg día (10-0-10), 5.ª semana 10 mg/día, tras la cual se retira el fármaco.
El otro grupo de fármacos para tratar de manera eficaz la inflamación son los antinflamatorios no esteroideos (AINE), que actúan inhibiendo la enzima cicloxigenasa tipos 1 y 2, resultando en una disminución de la producción de prostaglandinas, promotoras de la inflamación. Sin embargo, su uso en este cuadro no ha mostrado ninguna evidencia sobre su eficacia, si bien es cierto que estos estudios fueron realizados con tamaños muestrales pequeños y con resultados poco concluyentes 34,35. La guía británica recomienda su uso temprano en caso de cirugía para pacientes con SDRC o ante una situación donde sospechemos que el paciente puede desarrollar dicho síndrome tras la cirugía, porque la inflamación y el estrés quirúrgico son factores predisponentes para su aparición (Complex regional pain syndrome in adults UK guidelines for diagnosis, referral and management in primary and secondary care, 2018).
El siguiente grupo de fármacos que incluimos durante las fases iniciales son los antioxidantes "free radical scavengers", que actúan disminuyendo los radicales libres y moléculas llamadas especies reactivas de oxígeno, generadas durante la fase inflamatoria y liberadas al espacio extracelular. Estos radicales libres son responsables de destrucción de membranas celulares, alteraciones de DNA, alteraciones de proteínas e inactivación de enzimas, amplificando la inflamación. Dentro de este grupo de fármacos utilizaremos los que han obtenido un nivel de evidencia favorable para su uso, como son el dimetilsulfóxido (DMSO) y la N-acetilcisteina (NAC) 36,37). El DMSO actúa secuestrando e inactivando los radicales OH y desactiva la oxidasa de membrana, disminuyendo así la producción de radicales derivados del superóxido. En España está comercializado como excipiente de otros fármacos, pero no como fármaco único, por lo que su preparación, hasta el momento, debe ser como fórmula magistral. Se aplica 5 veces al día durante el primer mes y luego se reduce a 3 veces al día, hasta un año. La NAC actúa a través del grupo sulfhidrilo libre, que ejercen su efecto sobre los grupos electrofílicos de los radicales oxidantes y también reducen e inactiva a las especies reactivas de oxígeno, provocando un efecto antinflamatorio. Se ha constatado que tiene mayor efecto usado en la forma o fase fría del SDRC 38, a dosis de 600 mg tres veces al día durante 4 meses.
Durante la última década, el tratamiento con bifosfonatos ha ganado peso específico dentro del armamentario farmacológico; el creciente número de metanálisis investigando su rendimiento lo confirma. Varenna y Crotti señalaban algo que se intuía, el papel fundamental del hueso en la patogénesis del SDRC. La eficacia de los bifosfonatos parece ligada a este rol, que se juega fundamentalmente en las etapas más tempranas del desarrollo del cuadro. El hueso puede actuar como fuente de citoquinas inflamatorias tras ser lesionado, directa o indirectamente. Las fibras peptidérgicas que inervan la cortical y médula ósea pueden perpetuar un problema de microvascularización en ese nivel. Las aberraciones en mineralización local, probablemente relacionadas con lo que acabamos de describir, eran tradicionalmente descritas como "patrón moteado" del "síndrome de Südeck" en la radiografía 39. Los bifosfonatos actuarían regulando la inflamación, inhibiendo el crecimiento y la migración celular en la médula ósea y disminuyendo la acidificación del lecho óseo.
En un metanálisis publicado en el 2017 se analiza la eficacia de los bifosfonatos en el tratamiento del síndrome. Se revisaron 4 estudios (n = 181) con las siguientes pautas: alendronato oral 40 mg/día durante 8 semanas, pamidronato 60 mg intravenoso en una sola dosis, clodronato intravenoso 300 mg/día durante 10 días y por último neridronato 100 mg intravenoso en cuatro dosis: los días 1, 4, 7 y 10. En todos ellos hubo un descenso del dolor en la escala analógica visual estadísticamente significativa comparado con el placebo a los 30-40 días. Este alivio se mantuvo a los 2-3 meses. Se reportaron algunos efectos adversos leves, como fiebre durante menos de 3 días, intolerancia gástrica, eritema en el lugar de la punción que se resolvió durante los siguientes 2 días, hipocalcemia subclínica y poliartralgia. No se reportaron efectos secundarios graves 40. Por tanto, se puede concluir que los bifosfonatos reducen el dolor en pacientes con SDRC tipo I. Aquellos pacientes con SDRC que no presentan alteraciones óseas en las pruebas de imagen, que presenten una evolución crónica o una extremidad fría, responden peor a los bifosfonatos 2. Dada la heterogeneidad de las posologías de los diferentes estudios y de los fármacos disponibles en nuestro medio, proponemos la siguiente pauta: alendronato vía oral 70 mg, 1 comprimido semanal durante 8 semanas tomado en ayunas, con agua, y no ingerir alimentos hasta 30 minutos después de su toma.
Tras haber instaurado la terapia en fases iniciales intentando combatir la inflamación y disminuir el dolor con los corticoides, free radical scavengers bifosfonatos y analgésicos comunes, en la fase de aparición de sensibilización periférica y central emplearemos los antiepilépticos, antidepresivos tricíclicos y opioides, si el control del dolor no es adecuado.
Para los síntomas derivados de la sensibilización periférica y central recurriremos al grupo de fármacos recomendados para el manejo del dolor neuropático, en el cual disponemos de fármacos de primera, segunda y tercera línea 41. En los fármacos de primera línea nos encontramos con los antiepiléticos. La mayor parte de los estudios en el SDRC con antiepilépticos se han realizado con gabapentina. Los resultados obtenidos solo han logrado tener un efecto leve en cuanto a la reducción del dolor y mejoría del descanso nocturno en algunos pacientes 42. Otro grupo de fármacos de primera línea son los antidepresivos tricíclicos, que han mostrado una eficacia similar a la gabapentina 43. Actúan inhibiendo la recaptación de la noradrenalina y de la serotonina pero, debido a la actuación sobre receptores alfaadrenergicos, histaminínicos (H1), muscarínicos, N-metilaspartamo y colinérgicos, tienen una elevada presencia de efectos secundarios. Se recomienda su uso con cautela en mayores de 65 años o con insuficiencia cardiaca (puede provocar hipotensión, arritmias, mareos y sedación). En una revisión sistemática publicada recientemente analizan 13 estudios sobre el uso de antidepresivos y antiepilépticos en el SDRC. Consideran que la evidencia es insuficiente para el uso de los gabapentinoides en el dolor asociado a SDRC. Sin embargo, 3 estudios randomizados mostraron que la gabapentina mejoraba significativamente el dolor, mientras que otro estudio se concluía que la amitriptilina es igual de eficaz que la gabapentina. No hay evidencia para la pregabalina 44.
Respecto a los opioides, los estudios que demuestran un claro beneficio de su uso para el tratamiento del SDRC son escasos y antiguos; si a esto añadimos la preocupación actual de su uso en pacientes afectos de dolor crónico por la aparición frecuente de efectos secundarios a largo plazo 45,46 e incluso empeoramiento del cuadro, no parecen tener una indicación muy clara 47. A pesar de esto, la guía británica recomienda el uso precoz de analgésicos que incluyen a la codeína, dihidrocodeína y tramadol en casos de SDRC que requieran cirugía para reducir el dolor relacionado con el trauma y facilitar la rehabilitación precoz (UK guidelines).
La metadona, por su papel de antagonista en el receptor de NMDA 48 y su reducido coste, así como el tramadol por su inhibición de la recaptación de noradrenalina y serotonina implicados en la fisiopatología y generación de dolor en este cuadro, podrían ser fármacos a plantearnos en caso de recurrir al uso de opioides para el manejo de estos pacientes, siempre con titulación adecuada y vigilancia estrecha, así como con un plan de preparación para desescalar y retirar en caso de no eficacia.
Un fármaco que ha cobrado mucho interés en estos últimos años en cuadros de dolor crónico es la naltrexona a dosis bajas. No se conoce exactamente su mecanismo de acción: se cree que modula el sistema inmune, reduce la inflamación y estimula la producción de endorfinas endógenas, pero se considera que tiene unas propiedades únicas que específicamente ayudarían en la fisiopatología del SDRC incluyendo la atenuación de células de la microglía que participan en la transmisión nociceptiva, la reducción de citoquinas proinflamatorias, su función como antagonista del receptor Toll-like 4 (TLR4), así como la estimulación de la producción de endorfinas endógenas 49.
Si pese a toda la farmacología descrita, el dolor persiste y es intenso, siguiendo las recomendaciones de las guías de dolor neuropático nos plantearemos el uso de otros fármacos, como la ketamina, tanto por su efecto en los receptores NMDA, como por su efecto modulador en las vías ascendentes y descendentes nocioceptivas 50.
La ketamina se une no competitivamente a multitud de receptores y a canales iónicos (α amino 3-hidroxy-5 metil-4-isoxazol, receptores propionato, kainite, γ-aminobutíricos, receptores del Calcio, receptores μ), su actividad analgésica puede ser derivada también de la inhibición de la enzima inducible óxido nítrico sintetasa 51. Es metabolizada por CYP3A4, CPYP2B6 y CPY2C9 a norketamina que puede exceder a la ketamina en infusiones prolongadas, contribuyendo a su perfil analgésico 52.
Basándonos en la evidencia actual, para optimizar el tratamiento intravenoso de la ketamina tendríamos en consideración una serie de factores 53:
Mantener la duración de la infusión continua el tiempo suficiente que permitan, a nivel logístico, los hospitales donde se aplique.
Usar dosis de ketamina entre 0,1 y 0,5 mg/kg/h, para evitar dosis excesivas de sedación en la mayoría de los casos. Usar medicación adyuvante como el midazolam para disminuir los efectos psicomiméticos y posiblemente incrementar su efecto analgésico.
Su uso en infusión continua requiere de una monitorización continua y una estrecha vigilancia de la aparición efectos secundarios, tales como una sedación excesiva, alteraciones cardiovasculares y disforia durante y después de la infusión.
Los estudios observacionales, reportes de casos control y ausencia de estudios randomizados sobre la ketamina, le otorgan una evidencia moderada y, por tanto, un grado de recomendación leve en el SDRC. Hay datos limitados sobre las dosis adecuadas y la duración de su efecto analgésico.
Tratamiento psicológico
Bajo el paraguas del término "factores psicológicos" se resguardan, principalmente, tres bloques conceptuales: los aspectos emocionales de la patología (ansiedad, miedo, depresión, catastrofismo, aversión a la incertidumbre e incluso optimismo), los factores cognitivos (atención y expectativas) y el estrés.
Es cierto que el conocimiento sobre la interacción entre ellos todavía tiene luces y sombras, pero el creciente interés en generar un cuerpo de conocimiento estructurado ha permitido esbozar un mapa de la importancia de la psicología (factores cognitivos y emociones), la biología y el contexto (socioeconómico, accesibilidad a tratamiento y apoyo del entorno). El modelo biopsicosocial, que así se llama, pretende integrarlo todo 54,55.
Podemos partir de un esquema de eventos como respuesta a una lesión que dibuja dos caminos posibles ante la experiencia dolorosa que esta desencadena: un camino en el que la baja sensación de miedo (o la ausencia de este) favorece la confrontación y encamina el proceso hacia la recuperación funcional sin percepción de daño, y otro en el que la tendencia al catastrofismo alimenta una sensación de miedo al movimiento (o kinesofobia) y la percepción de este como algo que predispone a agravar la lesión inicial. En este caso, el paciente tiende a estar hipervigilante, manteniendo actitudes y rutinas de evitación del movimiento o pautas de rehabilitación establecidas y, ante una permanente falta de uso de la extremidad afecta, se siente menos capacitado para llevar una vida plena. Esta sensación de invalidez, en última instancia, favorece la depresión y retroalimenta el bucle del dolor percibido 56.
Hay pruebas establecidas de que, ante la activación continuada por estímulos externos, el fenómeno de auto y heterosensibilización periférica incluye modificación de la cantidad y tipo de receptores periféricos. Este tipo de cambios fenotípicos favorece a su vez la sensibilización central y es relevante en ellos el papel del sistema mesolímbico. En función de si predominan mecanismos de supresión cognitiva del dolor o, por el contrario, se activan vías para la amplificación y aprendizaje emocional, aumentarán las probabilidades de que el paciente tome un camino hacia la recuperación e integración funcional o hacia el abandono y percepción de daño 57.
El papel predictivo de los factores psicológicos en el SDRC ha sido estudiado por varios investigadores sin llegar a conclusiones cristalinas, si bien en algunos estudios se ha apuntado a una relación directa entre la ansiedad (y el síndrome de estrés postraumático) y el desarrollo de cuadros más floridos 58-60.
En cualquier caso, existen diversas estrategias de acercamiento terapéutico al síndrome de dolor regional complejo como fenómeno doloroso motivado por un daño inicial, hablando desde el punto de vista psicológico. La base racional y mecánica de aplicación de estas estrategias difiere ligeramente entre ellas y el papel del equipo clínico es el de encontrar el modelo terapéutico, de entre los disponibles, que encaje mejor con el rasgo y estado psicológico del paciente. No todos los equipos clínicos están entrenados para ofrecer todas las terapias psicológicas y no todas las terapias están cubiertas por el Sistema Nacional de Salud o entran dentro de las posibilidades económicas de quien se haga cargo del tratamiento del paciente.
Podemos agrupar en tres bloques las principales terapias psicológicas. En primer lugar, un acercamiento terapéutico basado en los aspectos cognitivos y conductuales del dolor, que puede y suele ser llevada a cabo por equipos entrenados de psicólogos/as y enfermería. En este bloque se encuentra, lógicamente, la llamada terapia cognitivo-conductual, pero también la terapia de aceptación y compromiso (acceptance and commitment therapy) y la de exposición gradual (o graded exposure therapy). En otro bloque hallamos la terapia brindada por psicólogos clínicos entrenados en maniobras de reducción del estrés, como las técnicas basadas en el mindfulness. Por último, el abordaje que los neuropsicólogos pueden realizar enfocados a la adaptación del prisma y enfoque de la enfermedad.
La terapia de exposición gradual a estímulos tiene un largo recorrido en el campo del tratamiento del dolor de pacientes con importante miedo a la recaída y kinesofobia. De Jong y cols. propusieron en 2005, en base a ello, adaptar su aplicación y práctica a pacientes con SDRC de tipo I, demostrando su eficacia a la hora de reducir los niveles de dolor reportado en ciertos grupos de pacientes. La hipótesis sobre la que se sustenta es la de que la exposición gradual a estímulos dolorosos activa circuitos corticales, conciliando el desempeño motor del miembro con el feedback sensitivo. Habitualmente, en su implementación se pasa por una fase de aprendizaje teórico (que sirve para marcar una hoja de ruta al paciente), una serie de tareas de recogida de información sobre el día a día del paciente (como la realización de fotografías en posturas habituales que el paciente concibe como "arriesgadas") y la puesta en marcha de un plan de exposición a rutinas de ejercicio moderado que contengan esos movimientos durante, al menos, 3 meses 61. Para su realización, deberemos tener en cuenta los requerimientos económicos, de espacio y logísticos de la terapia. Sin un plan concreto y realista, no es razonable, por ejemplo, pautar una terapia de exposición gradual al dolor.
Por último, es de capital importancia recalcar que la reducción del dolor puede no ser el principal hito perseguido cuando iniciamos una aproximación psicológica hacia el enfermo. Más bien se debería considerar empezar con terapias que se dirijan a hacer sentir mejor al paciente y ayudarle en su recuperación funcional, siendo, en muchos casos, la reinserción laboral uno de los hitos que agrega varios pequeños hitos y proporciona mejores resultados. Un concepto de valor para el equipo clínico es el de marcar como diana terapéutica el problema concreto intentando evitar acercamientos vagos al problema general: por ejemplo, tratar el estrés de un paciente no estresado consume un valioso tiempo, recursos y moral de equipos y pacientes, condenando el tratamiento general al fracaso.
Así pues, el tratamiento psicológico se reivindica como un pilar terapéutico valioso en el enfoque multidisciplinar del SDRC. Brinda un complemento costo efectivo a la farmacopea de uso habitual cada vez más validado por estudios de investigación básica que evidencian la traducción de la terapia en cambios estructurales y funcionales a nivel del sistema nervioso central de los pacientes. Aplicada como parte de un plan de tratamiento holístico y en etapas tempranas, es definitivamente una faceta del tratamiento que no hay que descuidar.
Tratamiento intervencionista
Son varios los intentos que se han hecho de atajar la progresión del cuadro e intentar que remitan sus síntomas mediante la realización de técnicas más o menos invasivas, indicadas cuando la evolución no es óptima.
Para ello contamos con lo siguientes:
-
1. Bloqueos o radiofrecuencia ganglios simpáticos.
Cuando en la expresión del SDRC existe una evidente disrregulación autonómica de la extremidad afecta, los bloqueos simpáticos pueden ser parte importante del tratamiento. La suelta exagerada de catecolaminas y la hiperrespuesta a las mismas contribuye a perpetuar síntomas y signos, incluyendo el aumento de dolor percibido. En este sentido, se recomiendan los bloqueos con anestésico local (y en ocasiones corticoides) a nivel de la cadena simpática paravertebral: ganglio estrellado o del ganglio simpático torácico T2 en el caso del miembro superior y bloqueo simpático lumbar en miembro inferior. Las guías terapéuticas actuales sobre el SDRC limitan el papel de los bloqueos simpáticos a casos seleccionados refractarios al tratamiento farmacológico y rehabilitador. Cuando un bloqueo simpático con anestésico local resulta eficaz (produce una reducción del dolor > 50 % durante un tiempo mayor a la duración de acción del anestésico local empleado), se debe considerar la realización de bloqueos seriados o técnicas denervativas como la radiofrecuencia 62. La radiofrecuencia sobre estos mismos centros neuronales no ha demostrado ser superior al bloqueo en términos de reducción de dolor y/o síntomas acompañantes 63. Un probable motivo es la relativa desproporción entre el área de lesión térmica que produce la radiofrecuencia y el tamaño de los ganglios a denervar, además, en el caso de la cadena simpática lumbar, la falta de certeza sobre su posicionamiento con respecto a las vértebras lumbares.
Pese a que existe un claro razonamiento etiológico en la realización de los bloqueos simpáticos (reducir la respuesta aberrante autonómica regional), la evidencia científica sobre su eficacia es limitada. La bibliografía le otorga una eficacia analgésica en un tercio de los pacientes 64,65. Sin embargo, la última revisión de la Cochrane no encuentra que el bloqueo simpático con anestesia local sea mejor que el placebo en cuanto a reducción del dolor, o que produzca un alivio analgésico adicional cuando se combina con la rehabilitación 66. Se han definido factores predictivos positivos: asimetría en la temperatura y cambios de coloración 67, y negativos: alodinia e hipoestesia 65.
El uso de la ecografía ha mejorado la precisión del bloqueo de ganglio estrellado, pese a que no suele ser identificable, buscando colocar la punta de la aguja en la zona posterior a la arteria carótida a la altura de C7 (medial a la apófisis transversa de la misma), en vecindad del músculo longus colli, separado de esta arteria en su cara anterior por la fascia prevertebral. Respecto a la radiofrecuencia del ganglio, en un artículo que publicamos recientemente creamos un modelo tridimensional del ganglio que tenía en cuenta las estructuras circundantes, objetivamos que, con la aguja (22 G, con punta activa de 5 mm) y los parámetros tradicionales (90" a 80 °C) solo realizarían una denervación efectiva si se abordara el ganglio en el centro, cualquier desplazamiento de 2 mm en cualquiera de los ejes produciría una denervación insuficiente 68. Por ello, deberíamos rediseñar el procedimiento o bien modificando la aguja o los parámetros, para que sea una técnica más efectiva e igualmente segura.
En el bloqueo de ganglio simpático lumbar de las razones de su efecto limitado podría ser la falta de precisión en su realización bajo control radioscópico, utilizada tradicionalmente, incluso cuando se constata un correcto posicionamiento de la aguja y una buena distribución del contraste. En este sentido, en un estudio preliminar realizado en nuestro centro, pese a una correcta realización de la técnica guiado por fluoroscopia, en un 32 % de los casos (16 de 49) no hubo incremento de temperatura medido por termografía, probablemente debido a una realización subóptima 69. Por ello, consideramos que la termografía como técnica de control intraprocedimental mejoraría la precisión de la técnica y quizá, su potencial beneficio clínico.
-
2. Bloqueos intravenosos regionales.
Durante años, estos bloqueos se realizaron sistemáticamente para el tratamiento del SDRC utilizando diferentes sustancias: guanetidina, lidocaína, bretilium, clonidina, reserpina y droperidol. En una revisión sistemática de alta calidad, determinaron que esta técnica tiene una evidencia nivel 2 de falta de eficacia, por lo que se dejó de hacer 24.
-
3. Otros bloqueos.
Bloqueos somáticos periféricos: la colocación de catéteres en plexos nerviosos para perfusiones mantenidas de anestésicos locales es una opción a considerar cuando en la clínica predomina la rigidez y/o la alodinia/hiperalgesia; con ello se facilita la rehabilitación, promoviendo la movilidad tanto pasiva como activa, y las terapias de desensibilización. En la práctica común, para miembro superior los catéteres se colocan a lo largo del plexo braquial, y en miembro inferior a nivel del ciático habitualmente en hueco poplíteo, pero en ocasiones a nivel más proximal o incluso en otros nervios más implicados en la zona álgica (rodilla-nervio femoral). El plexo braquial es un compartimento ideal para el implante de catéteres de larga evolución, ya que es compartimento perivascular bien definido, y los catéteres se pueden mantener 3 o 4 semanas. García-Vitoria y cols. proponen un abordaje del plexo braquial con entrada infraclavicular y, a través del espacio costo-vertebral, se accede a nivel supraclavicular, dejando la punta de la aguja en el "corner pocket" 70.
Infusiones epidurales: cuando la afectación del miembro inferior es más generalizada, se puede utilizar la vía epidural para la administración de fármacos, aunque funcionalmente sea más limitante. Habitualmente se utilizan anestésicos locales, opioides o clonidina. Rauck y cols. hicieron un trabajo en el que compararon la eficacia de la clonidina epidural comparada con placebo durante una media de 43 días, concluyeron que producía un alivio significativo del dolor, ligera sedación y disminución de la presión arterial. Advertían de la alta tasa de infección (31 %), por lo que recomendaban esterilidad estricta 71.
-
4. Terapias implantables.
-
Neuromodulación. La neuromodulación constituye una modalidad de tratamiento que ofrece la evidencia científica más importante en el tratamiento del SDRC. El implante de electrodos medulares se inició hace más de 50 años 72 y la evolución de los sistemas y de las diferentes programaciones ha permitido mejorar los resultados en diversas patologías 73-76, principalmente en dolores lumbares y en miembros inferiores postquirúrgicos, en los que ha demostrado ser más eficaz que el tratamiento convencional y que la reintervención 77,78, aunque en esta patología (el SDRC) no existen tantas referencias como en el caso anterior. A pesar de los diferentes avances tecnológicos y de las diferentes posibilidades de programar que han mejorado los resultados en otras patologías, en el caso del SDRC la mejor referencia y la mejor modalidad terapéutica en la actualidad continúa siendo la estimulación tónica 79 bien realizando la estimulación a nivel medular (SCS), o bien realizando a la estimulación del ganglio de la raíz dorsal (DRGS) que parece ser superior 80 incluso a los resultados obtenidos por Kemler y cols. en la publicación mencionada. El empleo de este tratamiento no solo ha demostrado su eficacia en la mejoría clínica, sino que también ha demostrado ser más costo-efectivo que los tratamientos convencionales empleados en esta patología 81.
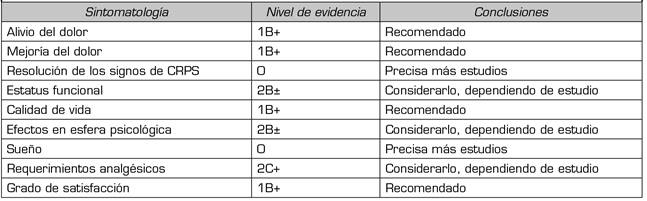
Kemler, en un estudio posterior, comparó los resultados de la estimulación medular con la terapia física (tratamiento que ha demostrado ser el más eficaz), aunque en el seguimiento a los 5 años no se obtienen mejores resultados, empleando la estimulación frente a la terapia física. Sin embargo, a pesar de la disminución de la eficacia de SCS con el tiempo, el 95 % de los pacientes con un implante repetirían el tratamiento para obtener el mismo resultado 82. En una revisión sistemática sobre el empleo de la neuromodulación en este síndrome, la mayor dificultad que aparece es saber la sintomatología específica que mejora en cada paciente individualmente, considerando variables diferentes como: dolor, afectación sensorial, alteraciones motoras, diferencias en la sudoración, afectación vasomotora, alteración del sueño, componentes de función y carga y componente emocional, debido a la sintomatología tan heterogénea de estos pacientes. En esta revisión se concluye, tras analizar 19 estudios entre 1989 y 2005, de los cuales 3 fueron ensayos aleatorizados, que el empleo de la neuromodulación tiene un nivel de evidencia de 1B+ en el alivio del dolor y en la percepción de este según el cuestionario de McGill, que disminuye a un nivel de evidencia 2C+ a los 5 años. El resumen de la evidencia científica se puede ver en la Tabla 1 83. Aunque debido al momento de esta revisión sistemática todos los resultados se han basado en los estudios de Kemler y cols. 79,82, en los últimos años se han realizado un par de trabajos que han apoyado estos resultados de la terapia en el SDRC, uno realizado por Deer y cols. 80 y otro realizado por Canos-Verdecho y cols. 84. El estudio de Deer y cols. es un estudio multicéntrico, aleatorio, que analizaba los resultados a 3 y 12 meses del implante de electrodos para estimulación de ganglio dorsal de la raíz posterior (DRGS) comparando con la estimulación medular tradicional (SCS). El estudio se realizó en 152 enfermos asignados aleatoriamente a DRGS o SCS tradicional en una proporción de 1:1, con 76 pacientes en cada uno de los grupos. Se analizó como primer objetivo la eficacia y la seguridad del sistema; asimismo valoraron la situación de la parestesia y la calidad de vida. Los resultados del estudio evidenciaron una superioridad en este tipo de estimulación frente a la tradicional: casi todos los pacientes obtuvieron una reducción del dolor 50 % y el 70 % obtuvieron una mejoría 80 %. Cuando se analizó la consistencia de la parestesia en la zona de dolor y se comparó con la SCS, se pudo observar que solo el 5 % de los pacientes que recibieron DRGS percibía la parestesia fuera del área del dolor, frente al 39 % de los pacientes que recibieron tratamiento con SCS. Por último, se observó una mejoría en la calidad de vida de los pacientes, siendo una opción segura en ambos casos, sin ninguna complicación mayor a nivel neurológico. En esta modalidad de estimulación, que consideramos estimulación tónica con un objetivo diferente al tradicional, existe otro estudio comparativo en el periodo de prueba, realizándose el implante de electrodos a nivel epidural y a nivel de ganglio. Se implantaron los dos sistemas, realizando un periodo de prueba con ambos con un periodo de lavado de 2 días entre ambos sistemas, y el paciente podía elegir cuál prefería como implante definitivo, realizando una comprobación del EVA 3 veces al día 85. Diez pacientes (83,3 %) prefirieron la estimulación DRGS y tan solo 2 la estimulación SCS. 5 pacientes consideraron los dos tipos de estimulación igual de satisfactorios, aunque al ser preguntados por el tipo de estimulación que querían implantarse 4 eligieron DRGS debido a la mayor precisión de la estimulación. El mayor problema que tiene este tipo de estimulación son las complicaciones relativas a la migración y fractura de los electrodos una vez implantados 86.
Tabla I. Niveles de evidencia científica, dependiendo de la sintomatología del paciente con síndrome de dolor regional complejo
Con respecto a otros tipos de programación, más en concreto en el caso de la alta frecuencia, entendiendo por esta la aplicación de 10 KHz, existe un estudio prospectivo aleatorizado de casos y controles para evaluar la eficacia del tratamiento con SCS y estimulación de la médula espinal de 10 kHz (SCS de 10 kHz) en pacientes diagnosticados de SDRC tipo I (SDRC) con afectación de miembros superiores 84. Los pacientes experimentaron una mejora considerable después de SCS, mejores que los publicados en otros estudios. Los resultados obtenidos con SCS de 10 kHz son semejantes a los obtenidos con la SCS en el inicio del tratamiento, aunque con el paso del tiempo los resultados se igualan entre los dos sistemas o incluso se ve una ligera ventaja en la SCS, aunque la estimulación a 10 Khz aporta la ventaja de la ausencia de parestesia.
El tratamiento con SCS parece claro que es uno de los tratamientos más eficaces en el tratamiento del SDRC, aunque el problema que existe con este tipo de terapia es el desarrollo de la tolerancia a largo plazo o bien que el efecto beneficioso de la terapia disminuya con el tiempo, por lo que los últimos estudios han tratado de ver qué tipo de combinación de parámetros podría ser el más adecuado en este tipo de patología. En un estudio multicéntrico, doble ciego aleatorio y cruzado controlado con placebo se emplearon diferentes frecuencias, 40, 500, 1200 Hz, estimulación en ráfaga y placebo durante un periodo de 10 semanas 87. Se valoró la disminución del dolor mediante el EVA, el cuestionario de dolor de McGill y el porcentaje de mejoría global del paciente de manera que, al finalizar el estudio, el paciente pudiese elegir la programación más adecuada para él. El estudio vuelve a demostrar que la estimulación convencional es eficaz para el tratamiento de este síndrome, aunque los pacien tes eligen el tipo de programación que desean dependiendo de preferencias propias: la falta de parestesia, la latencia en la reprogramación, etc..
Terapia intratecal. Se suele reservar a casos con evolución tórpida, pobre control del dolor y/o fracaso o rechazo de sistemas de neuromodulación. Ha sido menos estudiada que esta última terapia y su uso es menos extendido 25. Tradicionalmente se ha utilizado morfina, bupivacaína 88 como fármacos únicos o en combinación, y clonidina (en pocos casos), consiguiendo alivio analgésico pero sin intervenir en la progresión de la enfermedad. Es reseñable la capacidad demostrada del baclofeno intratecal de promover cierto decremento del dolor y una mejoría de los síntomas distónicos asociados 89, que sugiere que en la compleja etiología del cuadro subyazga algún mecanismo relacionado con el ácido gamma-aminobutírico (GABA) (potente neurotrasmisor central con función inhibidora). El baclofén actúa activando los receptores presinápticos β2 gabaérgicos que inhiben las aferencias sensoriales a las neuronas motoras del asta dorsal, regulando, de esta manera, los síntomas motores asociados al síndrome 90. Se propone, incluso, que el baclofén intratecal, asociado a la estimulación medular, mejore la respuesta a esta terapia 91.
-
-
5. Plasmaféresis.
Como ya hemos mencionado, en el SDRC existe un desequilibrio en el sistema inmune, no solo por la aparición de autoanticuerpos, sino por otros factores como un incremento de la actividad cutánea inmune 92 que se traduce en cambios en el grosor de la epidermis; o un proceso inflamatorio mediado por células T, con mayor actividad de las mismas en esta enfermedad 93. Todo ello convierte al sistema inmune en una posible diana de tratamiento.
En algunos casos seleccionados, refractarios al resto de medidas terapéuticas, es planteable la plasmaféresis, que consiste en un intercambio terapéutico de plasma con la finalidad de depurar la sangres. Se utiliza tratar trastornos inmunológicos y son varios los trabajos que apoyan su uso en el SDRC 94,95, pero siempre en casos desesperados, y nunca como un tratamiento definitivo.
-
6. Amputación: A menudo, pacientes con SDRC describen la extremidad afectada como si no les perteneciera y expresan un deseo hipotético de amputación, esperando paliar el dolor intenso que padecen. Esta reclamación es más prevalente en aquellos pacientes de larga evolución que padecen dolor refractario a múltiples terapias, con gran discapacidad funcional, asociado edema extremo o infecciones frecuentes. Los equipos clínicos implicados con estos pacientes deben evaluar y consensuar esta opción terapéutica irreversibe y drástica.
Si analizamos la experiencia cínica y series de casos no podemos garantizar ni predecir el resultado de una amputación. Los primeros estudios de Deliessen y cols., de 28 pacientes, mostraron síntomas recurrentes de SDRC en todos los casos, y solo dos pacientes pudieron utilizar la prótesis con éxito 96. En el reciente estudio de Jan Geertzen y cols., con 53 pacientes, el 75 % de los participantes experimentó una mejora importante en la movilidad y reducción del dolor, aunque una cuarta parte informó deterioros en la esfera psicológica y confianza en sí mismo después de la amputación 97. El grupo de investigación de Midbari y cols. comparó un grupo de 19 pacientes con SDRC tipo I sometidos a amputación con otro grupo de 19 pacientes de similares características que no fueron amputados, y encontraron que los pacientes amputados experimentaban menos dolor, una mejora en la calidad de vida y una incidencia de dolor de miembro fantasma del 89 %, sin especificar cuándo tuvo lugar la revaluación postamputación 98).
En una revisión específica sobre la calidad de vida de 11 estudios, y una muestra total de 97 pacientes, a pesar de reflejar porcentajes tras la amputación del 85 % síndrome y dolor miembro fantasma, el 32 % dolor del muñón y un 46 % de recurrencia SDRC, concluyen que un 68 % de los paciente amputados han mejorado en su calidad de vida 99. Basándonos en estas pequeñas series, médicos y pacientes pueden considerar la amputación como una opción para mejorar la calidad de vida y aliviar el dolor agonizante e insoportable del SDRC severo y resistente, pero debe reconocerse que la evidencia es limitada y que existen riesgos de agravamiento o recurrencia del SDRC, dolor fantasma y consecuencias impredecibles para la posterior rehabilitación del muñón.
La reciente guía inglesa sobre el manejo de SDRC establece una serie de recomendaciones para abordar esta difícil decisión de la amputación (UK guidelines):
Tanto en los casos en que un cirujano considere la derivación para una amputación, como cuando dicha derivación sea considerada por otras especialidades, se debe valorar por un equipo multidisciplinario que incluya anestesiólogos, psicólogos, psiquiatras, cirujanos y rehabilitadores con experiencia en el manejo del dolor crónico y SDRC. El objetivo es explorar y revaluar de manera apropiada las terapias especializadas para afrontar/controlar y neuromodular el dolor, así como su funcionalidad postamputación. El nivel de amputación se basará en criterios clínicos (dolor, alodinia, infección o necrosis) y anatomo-funcionales para el uso de la prótesis.
En esta toma de decisiones sobre la amputación es vital ponderar los factores psicológicos (expectativas poco realistas, trastornos personalidad y mecanismos de afrontamiento negativos) con otros como la resiliencia del paciente y el apoyo familiar como predictores positivos 100.
Se debe informar y documentar una explicación completa de los riesgos asociados con la amputación, donde se incluyan los posibles problemas que pueden aparecer (desarrollo de dolor en el miembro fantasma, dolor en el muñón, aparición de SDRC en la parte restante de la extremidad, cicatrización problemática o recurrencia de ulceración e infección en el muñón). Los pacientes y sus familias deben ser conscientes de que es poco probable que la amputación resuelva el dolor, que los mismos síntomas de SDRC pueden reaparecer en el muñón o en otra extremidad, y que el uso de prótesis va a implicar un largo trabajo de adaptación tras el cual cabe la posibilidad que no se logre su utilidad funcional.
Recomendaciones para aplicar un tratamiento ajustado al fenotipo del paciente con SDRC
Como ya hemos comentado, es tendencia considerar que el tratamiento debe ajustarse a los síntomas predominantes. Actualmente se cuestiona la existencia de fases, o de tipos de la enfermedad (frío-caliente). Dimova y cols. proponen la asunción de 2 fenotipos clínicos en esta enfermedad: un "fenotipo periférico" en el que predomina el edema, la sudoración y los cambios en color y temperatura, y un "fenotipo central" en el que la clínica predominante incluye alteraciones motoras, alodinia e hipoestesia. Sugieren que los mecanismos fisiopatológicos predominantes que conducen a ellos son la inflamación neurogénica y la reorganización cortical, respectivamente 101. La pertenencia a uno u otro fenotipo no determina la evolución que va a tener el paciente, pero sí orienta sobre la posibilidad de realizar un enfoque terapéutico diferente.
En base a esto, Huygen propuso realizar un acercamiento terapéutico más personalizado, atendiendo a los mecanismos fisiopatológicos que con más probabilidad actúen en cada paciente y en el momento concreto de su enfermedad. Para ello, este autor propone realizar un fenotipado de la enfermedad. Siguiendo estos preceptos y una vez excluidos otros diagnósticos, deberíamos atender a qué mecanismos están presentes para tomar unas u otras medidas:
Neuroplasticidad: está presente en todo paciente con SDRC, por lo que el primer paso del tratamiento será la activación/movilización que, como hemos mencionado, tiene propiedades antinflamatorias, ayuda a reducir el edema y mitiga la sensibilización central y la reorganización cortical.
Inflamación: para modularla propone la administración de fármacos antinflamatorios, corticoides en la fase aguda y bifosfonatos, apelando a su efecto antinflamatorio.
Dolor/disfunción sensorial: se apoya en el uso de analgésicos o coanalgésicos (como la gabapentina).
Alteraciones vasomotoras producidas por una disfunción endotelial: Huygen propone aplicar a los pacientes con sintomatología vasomotora terapia con vasodilatadores (óxido nítrico, tadalafil, baclofen intratecal).
Alteraciones motoras: tratadas con relajantes musculares (clonazepam o toxina botulínica local).
Factores psicológicos: terapia psicológica.
Si la terapia administrada tiene resultados adecuados, se propone seguir con tratamiento conservador, pero si el resultado no es óptimo, eso debería bastar para pasar a tratamiento intervencionista, fundamentalmente bloqueos simpáticos, sin descartar la necesidad de implantar electrodos para estimulación medular o de ganglio de raíz dorsal e incluso la implantación de sistemas para infusión de baclofen intratecal.
Recomendaciones en pacientes con SDRC sometidos a cirugía
Se recomienda la optimización clínica del miembro afecto previa a la cirugía pero sin demorar la misma en exceso, utilizando las armas terapéuticas de las que para ello disponemos en la actualidad (tratamiento farmacológico y tratamiento intervencionista si se requiere), preconizando el uso de la anestesia locorregional siempre que sea posible, así como controlando de forma exquisita el dolor perioperatorio (uso de bloqueos analgésicos continuos con anestésico local a través de la colocación de catéteres en plexo o tronculares).
Protocolo integrado de atención al paciente con SDRC
-
- Fase aguda:
-
- Fase crónica:
Movilización y terapia ocupacional.
Terapia psicológica.
Analgésicos: paracetamol, tramadol.
-
Si predomina:
Si la respuesta a tratamiento no es adecuada: opioides mayores y/o plantear neuroestimulación.
-
Si la evolución es tórpida, refractaria a todos los tratamientos aplicados:
-
En casos desesperados:
CONCLUSIONES
En el abordaje de esta compleja patología en la que intervienen múltiples mecanismos que debemos tratar simultáneamente, es necesaria la coordinación entre servicios para su mayor rendimiento. El primer paso es crear la alerta tras un traumatismo o cirugía con una evolución complicada. Tras ello, conviene descartar otras causas que justifiquen la clínica y, si se confirma el diagnóstico, no debe tardarse en promover la movilización, iniciar un tratamiento farmacológico con corticoides, bifosfonatos y free radical scavengers y atender a cada uno de los mecanismos fisiopatológicos que se desarrollan. La rehabilitación, la farmacoterapia y el tratamiento psicológico son los pilares del tratamiento, pero si la evolución del paciente no es favorable, debemos considerar, desde fases tempranas, las técnicas intervencionistas que hemos descrito.