Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Gerokomos
versión impresa ISSN 1134-928X
Gerokomos vol.25 no.2 Barcelona jun. 2014
https://dx.doi.org/10.4321/S1134-928X2014000200006
COMUNICACIONES
Elaboración de un protocolo para el manejo de la herida quirúrgica en cirugía de cabeza y cuello. Una cura eficaz, efectiva y eficiente en pacientes laringectomizados
Development of a protocol for the management of surgical wound in neck surgery. An effective and efficient treatment in laryngectomized patients
Antonio Rodríguez Valiente1, Teresa Segovia Gómez2, Amaya Roldán Fidalgo3, Mariano Bermejo Martínez4 y José Ramón García Berrocal5
1Otorrinolaringólogo. Servicio de Otorrinolaringología. Hospital Universitario Puerta de Hierro. Majadahonda. Madrid
2Unidad de Heridas Crónicas. Hospital Universitario Puerta de Hierro. Majadahonda. Madrid
3Otorrinolaringólogo. Servicio de Otorrinolaringología. Hospital Universitario Puerta de Hierro. Majadahonda. Madrid
4Unidad de Heridas Crónicas. Hospital Universitario Puerta de Hierro. Majadahonda. Madrid
5Otorrinolaringólogo. Servicio de Otorrinolaringología. Hospital Universitario Puerta de Hierro. Majadahonda. Madrid
Dirección para correspondencia
RESUMEN
Introducción: la curación de las heridas quirúrgicas en los pacientes sometidos a cirugía de cabeza y cuello es un factor esencial en el periodo postoperatorio. Una curación rápida y sin complicaciones mejora el estado general del paciente, limita la estancia hospitalaria y disminuye los costes médicos. En 2005 se introdujo en nuestro centro un protocolo para pacientes sometidos a cirugía de cabeza y cuello, consistente en la preparación de la herida quirúrgica mediante técnica de cura en ambiente húmedo (CAH).
Material y métodos: se analizaron los datos de los pacientes sometidos a laringectomía total y laringectomía horizontal supraglótica entre 1995 y 2005 (grupo 1) y de 2005 a 2011 (grupo 2), con el fin de evaluar la estancia media hospitalaria y la formación de fístulas faringocutáneas antes y después de la introducción del protocolo de cura húmeda.
Resultados: se analizaron 169 pacientes: 131 en el grupo 1 y 38 en el grupo 2. Más del 94% de los pacientes eran varones, con una media de edad de 60 años en el grupo 1 y de 68 años en el grupo 2. La formación de faringostoma fue significativamente mayor en el grupo 1 (42,9% frente a 26,1%), especialmente en pacientes que habían recibido radioterapia previa. La estancia hospitalaria media fue ligeramente superior en los pacientes del grupo 1.
Conclusiones: la reducción de la estancia hospitalaria media y la disminución de la formación de faringostomas es fácilmente atribuible a la utilización del protocolo de CAH, lo que ahorra los costes sanitarios y mejora la calidad de vida del paciente.
Palabras clave: curación de heridas, infección de la herida quirúrgica, disección del cuello, fístula cutánea, hidrocoloides, apósitos oclusivos.
ABSTRACT
Introduction: Surgical wound healing is an essential factor for the head and neck patient in the postoperative period. A short and uncomplicated healing improves overall condition, and limits hospital stay and medical costs. A protocol for patients undergoing head and neck surgery consisting of preparation of the surgical wound as moist wound healing technique was introduced in our department in 2005.
Material and Methods: Data from patients undergoing total laryngectomy and horizontal supraglottic laryngectomy were analyzed, from 1995 to 2005 (group 1), and from 2005 to 2011 (group 2), in order to assess the hospital stay average, and pharyngocutaneous fistula formation before and after the introduction of the protocol of moist wound healing (MWH).
Results: 169 patients were analyzed: 131 from group 1 and 38 from group 2. More than 94% of patients were male, mean age 60 years in group 1 and 68 years in group 2. Pharyngostoma formation was significantly higher in group 1 (42.9% vs 26.1%), especially in patients who had received prior radiotherapy. Hospital stay average was slightly higher in patients from group 1.
Conclusion: Reduction in hospital stay average and decreased formation of pharyngostoma is easily attributable to the use of the protocol of MWH, thus saving healthcare costs and improving the patient quality of life.
Keywords: Wound healing, surgical wound infection, neck dissection, cutaneous fistula, hydrocolloid, occlusive dressings.
Introducción
Una herida quirúrgica es la interrupción de la integridad de la piel en el ámbito de intervención de un profesional sanitario, guardando medidas de asepsia, con objetivos terapéuticos y/o reparadores (1).
Las heridas quirúrgicas cicatrizan por sí mismas rápidamente y sin complicaciones, aunque hay factores locales, y a nivel general, que van a afectar a la cicatrización (Anexo 1) (2). La buena cicatrización de una herida quirúrgica es un factor fundamental para el postoperatorio del paciente. Una cura rápida y sin complicaciones mejora el estado general del paciente, disminuye el dolor, acorta la estancia hospitalaria y ahorra costes sanitarios (2).
Actualmente se puede influir en la cicatrización de las heridas quirúrgicas y prevenir los problemas de infección y cicatrización. La infección de heridas quirúrgicas representa del 15% al 24% de las infecciones nosocomiales (3); su prevalencia en España es del 7,91%, y en la unidad de cuidados intensivos (UCI) se alcanza una prevalencia del 37,12% (4). Se ha estimado que el número de infecciones en heridas quirúrgicas es del 1,4% al 15% en cirugía electiva, y del 30% en cirugía contaminada (5,6).
La importancia de la infección de la herida quirúrgica radica en las complicaciones que pueden surgir, tanto a nivel local (dehiscencia de la sutura, absceso, fístulas, celulitis) como a nivel sistémico (septicemia) (7), lo que produce una elevada morbimortalidad y una prolongación de la estancia hospitalaria. Las infecciones de la herida quirúrgica contribuyen significativamente a la morbimortalidad asociada a los procedimientos quirúrgicos. El 38% de las muertes en pacientes con infecciones de herida quirúrgica son directamente atribuidas a la infección (5).
La estancia de un paciente con una herida quirúrgica infectada se alargará entre 7 y 14 días (8,9), lo que producirá un mayor gasto sanitario. La prolongación de la estancia hospitalaria se considera el dato más objetivo para estimar el coste de la infección nosocomial (9). El coste del tratamiento de las heridas incluye el del apósito y material de cura así como el de los fármacos utilizados, el coste del personal sanitario, el del tratamiento de las complicaciones, incluyendo cirugías reconstructivas, y los costes a largo plazo que producen la incapacitación del paciente para realizar su trabajo, lo que causa una menor productividad (10). Las heridas suponen un coste elevadísimo para la sociedad (11,12). El coste de las úlceras venosas se ha estimado en 3 billones de dólares al año (13), y el coste total por úlceras, de 13 a 15 billones de dólares al año (14). Los costes derivados de las infecciones de las heridas quirúrgicas se estiman en 2000 euros (8). En pacientes ortopédicos, alargar en 8 días la estancia hospitalaria supone un coste de 2646 libras (aprox. 3800 €) (15), con un coste anual aproximado en Europa de entre 1,47 y 19,1 billones de euros (16).
La mayoría de las infecciones de las heridas quirúrgicas se presentan en el curso de 5 a 10 días (5), y entre el 13% y el 61% se manifiestan cuando el paciente ha sido dado de alta (16). Los Centers for Disease Control and Prevention (CDC) establecen 30 días de vigilancia para las heridas quirúrgicas en general y 1 año para las intervenciones protésicas (17).
Especial interés tienen las heridas de los pacientes sometidos a cirugía de cabeza y cuello. Estas heridas están en muchas ocasiones en contacto con la vía digestiva, produciéndose, en caso de dehiscencia de la herida o infección, fístulas que ponen en comunicación la vía digestiva con la piel, imposibilitando la deglución, favoreciendo las complicaciones a nivel local y sistémico, necesitando en algunos casos la realización de colgajos pediculados o a distancia para su tratamiento, y prolongando la estancia hospitalaria. Estas heridas también pueden estar en contacto con la vía aérea, por lo que pueden producirse aspiraciones en el árbol traqueobronquial, neumonías o la necesidad de portar una cánula de traqueostomía que aísle la vía aérea de la digestiva.
La mala cicatrización de una herida cervical puede dejar al descubierto estructuras vitales como son los grandes vasos (yugular y carótida) o estructuras nerviosas. Además de todo esto, es patente la visibilidad que tiene la cara y el cuello, y la repercusión estética que tienen estas heridas. Muchos de estos pacientes son oncológicos y han recibido tratamientos de quimioterapia y radioterapia, hecho que favorece la radiodermitis y el retraso en la cicatrización de la herida quirúrgica (18).
Por todas estas razones es importante, además de una buena técnica quirúrgica, un buen tratamiento de la herida quirúrgica, y este tratamiento comienza en el mismo momento de la cirugía, con una buena preparación del lecho quirúrgico. Es recomendable realizar un buen tratamiento y curas de la herida en el postoperatorio inmediato, previniendo así las posibles complicaciones; y en el caso de que estas se produzcan, las detectaremos precozmente y las trataremos de forma adecuada. Para prevenir la infección nosocomial, se debe: a) mantener una barrera frente a microorganismos; b) prevenir el contacto de la lesión con el sangrado y el exudado; c) reducir los momentos de riesgo de infección (cambios de apósito), y d) utilizar apósitos de cura húmeda.
El objetivo ante una herida quirúrgica es que cicatrice sin complicaciones, y prevenir la infección, optimizando así el coste-efectividad. Es importante una preparación del lecho de la lesión para reducir al mínimo su carga bacteriana, y que esté en condiciones óptimas para una correcta cicatrización (19-22).
Para la cura de la herida se ha utilizado de forma tradicional la cura seca, pero esta presenta una serie de problemas, con una gestión inadecuada del exudado (23,24). Además, retrasa el alta hospitalaria, con lo que los costes son mayores y tiene mayor riesgo de infección (25,26). La cura en ambiente húmedo (CAH) ha demostrado tener una serie de ventajas respecto a la cura seca, incluido una menor estancia hospitalaria y una mayor relación coste-efectividad (25,27-30). En una comparativa entre cura húmeda (tecnología Hydrofiber®) y cura seca (gasas + antiséptico) en quistes pilonidales se ha visto que 10 días menos de baja laboral en la cura húmeda suponen un ahorro aproximado de 425 euros a la Seguridad Social (31). Por todo esto, la tendencia hoy día es a la utilización de la cura húmeda dadas sus ventajas (32-38).
Para la CAH va a ser importante la elección de los apósitos (34,39), que presentan gran eficacia antimicrobiana (40), favorecen la cicatrización (41), permiten un buen manejo del exudado (42), disminuyen el riesgo de infección y complicaciones en las heridas (26), y permiten reducir el número de cambio de apósitos (26). De igual manera, reducen la maceración y las irritaciones, con lo que mejoran los problemas de la piel perilesional (27). Todo esto reduce el dolor en los cambios (26,27) y mejora la calidad de vida del paciente. Se reduce así el tiempo de tratamiento, lo que permite un alta hospitalaria precoz, con la consiguiente mejora del coste-efectividad (26).
También es importante la detección precoz de la infección en una herida quirúrgica. Clásicamente se ha utilizado una serie signos (43). La European Wound Management Association (EWMA), a través del enfoque Delphi (44), ha propuesto una serie de criterios de identificación de infección, tanto diagnósticos como de alerta (Anexo 2).
Objetivos
En 2005 se introdujo en el Hospital Universitario Puerta de Hierro un protocolo para los pacientes sometidos a cirugía de cabeza y cuello (v. Anexo 3), consistente en la preparación de la herida quirúrgica según procedimiento de CAH, ya que hasta el momento se había realizado la cura seca.
En este trabajo se realiza un análisis de los pacientes tratados antes de la instauración del protocolo de cura y después de la instauración de este protocolo.
Se realiza una descripción demográfica del grupo de población estudiado, y se analiza la estancia media hospitalaria (EMH) y la formación de faringostoma en ambos grupos, con el fin de determinar su importancia, identificar los aspectos más relevantes y compararlo con estudios previos.
Material y métodos
Revisión bibliográfica
Se realiza una revisión bibliográfica de todos los artículos publicados relacionados con el tema hasta septiembre de 2012, escritos en castellano y en inglés.
La búsqueda se lleva a cabo introduciendo los siguientes términos MeSH: "Surgical Wound Infection", "Wound Infection", "Wound Healing", "Surgical Wound Dehiscence", "Neck Dissection", "Skin Physiological Processes", "Skin Ulcer", "Skin Care", "Cutaneous Fistula", "Biological Dressings", "Keratolytic Agents", "Bandages", "Occlusive Dressings", "Negative-Pressure Wound Therapy", "Hydrocolloid", "Pressure Ulcer".
Primero se realiza una búsqueda en bases de datos de guías de práctica clínica (National Guideline Clearinghouse, Guidelines Finder NHS, CMA Infobase) y posteriormente en revisiones sistemáticas (Clinical Evidence, The Cochrane Library, DARE) y artículos originales en PubMed.
Población objeto de estudio
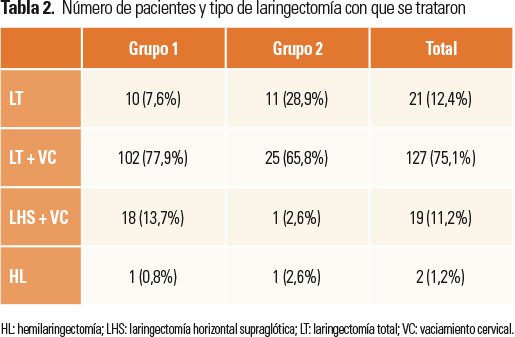
Se analizan las historias clínicas de todos los pacientes tratados en el Hospital Universitario Puerta de Hierro que hayan sido sometidos a laringectomía total (LT), laringectomía horizontal supraglótica (LHS) y hemilaringectomía (HL), con o sin vaciamiento cervical (VC), entre enero de 1995 y septiembre de 2011 (se contabiliza para esta fecha el momento de la intervención quirúrgica). Todas estas cirugías requieren un abordaje cervical, y comunican la vía aérea y digestiva con la piel.
Se excluyen todos aquellos pacientes que fueron sometidos a cirugías distintas a las anteriormente descritas, los que fallecieron antes del alta, y todos aquellos casos en los que no se dispone de los datos que se pretenden estudiar.
Variables del estudio y recogida de datos
Se realiza un estudio de la población, describiendo el número, sexo y edad de los pacientes, el tipo de cirugía realizado, y la aparición de complicaciones y su frecuencia.
Los pacientes se dividen en dos grupos en función de la fecha de comienzo de utilización del protocolo:
• Grupo 1 (G1): tratamiento quirúrgico de enero de 1995 a junio de 2005.
• Grupo 2 (G2): tratamiento quirúrgico de julio de 2005 a septiembre de 2011.
Además de esta variable principal (el grupo) se analiza el haber recibido radioterapia (RT) previa o no, y el haberse realizado o no VC durante la cirugía.
En todos los casos se analiza la EMH y la aparición de faringostoma.
El precio de una cama en la planta de otorrinolaringología en el año 2011 en nuestro centro era de 875 € al día.
Estrategia de análisis
Los datos fueron analizados usando el programa Statistical Package for Social Science (SPSS) versión 15.0. Los resultados se resumen con la media, mediana y la frecuencia absoluta y porcentaje para las variables cualitativas. La hipótesis de normalidad de las distribuciones se evaluó mediante los test de Kolmogorov-Smirnov. Las diferencias entre los dos grupos en variables continuas se compararon con la prueba t de Student y la prueba de Mann-Whitney cuando se rechaza la hipótesis de normalidad. El análisis de datos cualitativos se realizó mediante la prueba de la χ2 corregida y la prueba exacta de Fisher. Las comparaciones eran todas con contrastes bilaterales, con un nivel de significación establecido en valores iguales o inferiores a 0,05.
En este trabajo, debido a la limitación del tamaño muestral, existen errores de tipo II inevitables, es decir que en ocasiones no se encuentran diferencias que en realidad pueden existir. Este tipo de error solamente se corrige aumentando el tamaño de la muestra.
Resultados
Se obtiene un total de 169 pacientes: 131 pertenecientes al G1 y 38 al G2. En ambos grupos más del 94% eran varones, con una media de edad de 60 años en el G1 y 68 años en el G2 (Tabla 1).
La mayor parte de los pacientes habían sido sometidos a LT con VC (75,1%). Al 86,3% de los pacientes se les realizó VC, siendo este porcentaje del 68,4% entre los pacientes del G2 (Tabla 2).
Aunque la mayoría de los pacientes no presentó complicaciones (63,3%), la más frecuente fue el faringostoma (27,2%). El porcentaje de complicaciones fue similar en ambos grupos (Tabla 3).
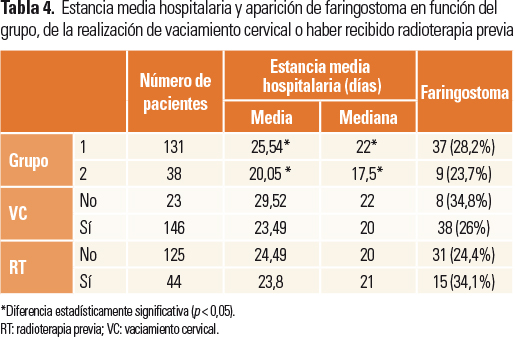
En el G1, la EMH fue de 25,54 días, frente al G2, que fue de unos 20,05 días, siendo esta diferencia estadísticamente significativa. En cuanto a la aparición de faringostoma, fue del 28,2% en el G1 y del 23,7% en el G2, sin llegar a ser estadísticamente significativa (Tabla 4).
Analizando de forma independiente al grupo el haber sido sometido o no a VC, o RT previa, no se encuentran diferencias estadísticamente significativas ni en cuanto a la EMH ni a la aparición de faringostoma (Tabla 4).
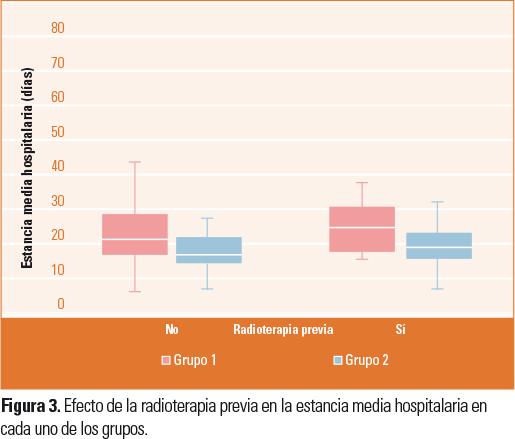
En el G1 solo el 16% de los pacientes recibió RT previa, porcentaje que fue del 60,5% en el G2. La EMH es mayor en el G1 que en el G2. Dentro de cada grupo es mayor en los pacientes que han recibido RT previa, sin que este resultado llegue a ser estadísticamente significativo. La aparición de faringostoma es mayor en el G1, resultado que es estadísticamente significativo en aquellos pacientes que han recibido RT previa (Tabla 5).
Analizando el efecto de VC en cada grupo no se obtiene diferencia estadísticamente significativa ni en cuanto a la EMH ni a la formación de faringostoma (Tabla 6).
Discusión
El desigual número de pacientes en cada grupo se debe al distinto periodo temporal, pero estadísticamente no tiene significación.
En ambos grupos existe una diferencia de edad. Esto puede ser atribuible a que en el G2 un alto porcentaje de pacientes ha recibido tratamiento RT previo a la cirugía.
La aparición de faringostoma en el periodo postoperatorio aumenta claramente la EMH (Fig. 1).
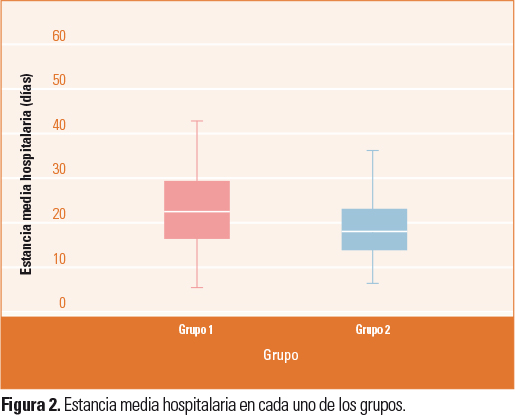
La EMH fue 5 días superior en el G1 que en el G2 (Fig. 2), una diferencia importante debido al ahorro en costes que supone, que sería de 4375 € de media. Y esta diferencia puede ser claramente atribuida a la utilización de CAH, ya que ni la realización de VC ni el recibir RT previa ha demostrado estadísticamente una prolongación en la EMH.
No se puede concluir que la RT previa o la realización de VC favorezcan un incremento de la EMH ni la formación de faringostomas (Fig. 3).
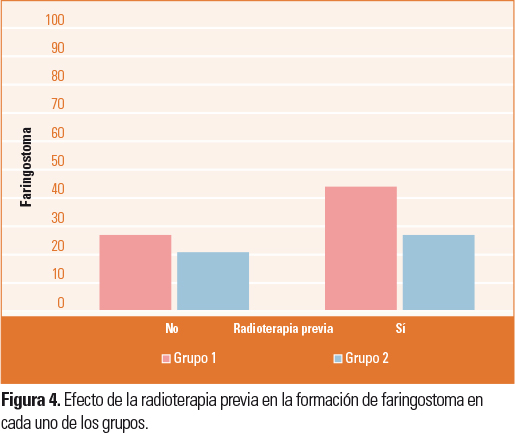
Los pacientes que han recibido RT previa se fistulizan claramente menos en el G2 (26,1%), que en el G1 (42,9%); esta diferencia podría estar justificada por la utilización de CAH en el G2 (Fig. 4).
El que en el G2 un 60,5% de los pacientes recibiera tratamiento RT previo puede estar justificado por la tendencia actual de un tratamiento curativo menos mutilante y la utilización de protocolos de preservación de órgano.
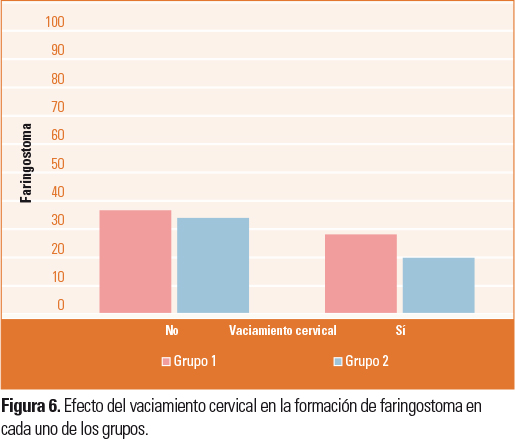
El que se realice VC en el momento de la cirugía no influye en la EMH (Fig. 5) ni en la formación de faringostoma (Fig. 6).
El beneficio de utilizar CAH está claramente demostrado y coincide con los resultados de otros autores (29,30,33,40,45,45-66): los cambios son más confortables para el paciente (28,66-72), necesita menos desbridamientos (70,73) y se consigue un mejor control de la infección y la humedad (47,48), con lo que el alta hospitalaria puede ser más temprana (67,68).
Por todo esto, el coste-efectividad de utilizar la CAH queda probado tanto en nuestro caso como en el de trabajos previos (28,67-70,72,74-79), incluso en el tratamiento de úlceras en las que hay exposición de hueso (80), aunque otros autores no han encontrado diferencias ni en la cicatrización (48,81), ni en el ahorro de costes sanitarios (81-83).
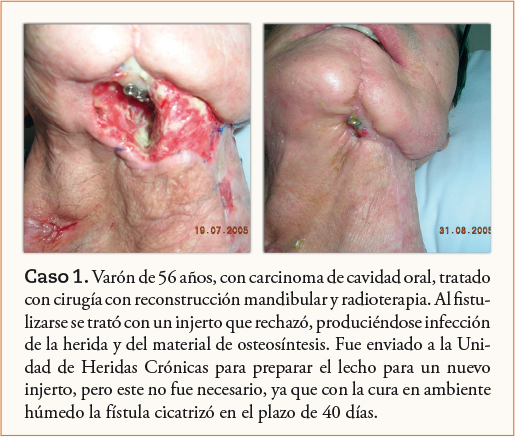
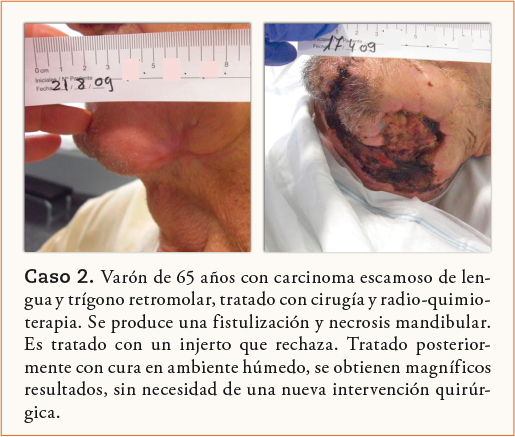
A modo de ejemplo se exponen tres casos (Casos 1, 2 y 3) tratados en la Unidad de Heridas Crónicas. Fue al tratar el caso 1, y ver sus buenos resultados, cuando se inició el protocolo de CAH, protocolo que se inicia en el mismo quirófano, al finalizar la cirugía.
Conclusiones
• La mayoría de los pacientes sometidos a cirugía oncológica laríngea son varones, con una media de edad de 60-68 años.
• La formación de faringostoma es la complicación más frecuente.
• La aparición de faringostoma en el periodo postoperatorio claramente aumenta la estancia media hospitalaria.
• La utilización de la CAH disminuye la estancia media hospitalaria en una media de 5 días, ahorrando de esta forma una media de 4375 €.
• En los pacientes que han recibido RT, la cura en ambiente húmedo disminuye la formación de faringostoma.
• El recibir tratamiento radioterápico previo o la realización de VC no influye en la EMH ni en la formación de faringostoma.
Bibliografía
1. Bryant RA. Acute and chronic wounds. London: Mosby; 1992, pp. 91-104. [ Links ]
2. García Collado F, y cols. Heridas quirúrgicas. En: Arantón Areosa L, y cols. Guía práctica ilustrada: Tratamiento de heridas. Madrid: EDIMSA, Editores Médicos; 2009. pp. 53-4. [ Links ]
3. Haley RW, Culver DH, White JW, Morgan WM, Emori TG. The national nosocomial infection rate. A new need for vital statistics. Am J Epidemiol 1985; 121: 159-67. [ Links ]
4. Sociedad Española de Medicina Preventiva, Salud Pública e Higiene. Grupo de Trabajo EPINE. Evolución de la Prevalencia de las Infecciones Nosocomiales en los Hospitales Españoles. EPINE 1990-1999. En: Vaqué J, Roselló J, editores; 2001. [ Links ]
5. Leaper D, Snyder RJ. Progresando en su práctica: comprender la infección de las heridas y el papel de los biofilms. La compleja cuestión de la infección de las heridas. Documento de: Asociación para el Progreso del Tratamiento de las Heridas (AAWC). 2008. [ Links ]
6. Petherick E, Dalton J, Moore P, Cullum N. Methods for identifying surgical wound infection after discharge from hospital: a systematic review. BMC Infect Dis 2006; 6: 170. [ Links ]
7. García Collado F, et al. Heridas quirúrgicas. En: Arantón Areosa L, y cols. Tratamiento de heridas. Guía práctica ilustrada. Madrid: EDIMSA, Editores Médicos; 2009, p. 55. [ Links ]
8. Leaper DJ, van Goor H, Reilly J, Petrosillo N, Geiss HK, Torres AJ, y cols. Surgical site infection - a European perspective of incidence and economic burden. Int Wound J 2004; 1: 247-73. [ Links ]
9. Peña C, Pujol M, Pallrés R, Corbella X, Vidal T, Tortras N, y cols. Estimation of costs attributable to nosocomial infection: prolongation of hospitalization and calculation of alternative costs. Med Clin (Barc) 1996; 30: 441-4. [ Links ]
10. Hermans M, Bolton L. The influence of dressings on the costs of wound treatment. Dermatol Nurs 1996; 8: 93-100. [ Links ]
11. Metzger S. Clinical and financial advantages of moist wound management. Home Healthc Nurse 2004; 22: 586-90. [ Links ]
12. Reddy M, Kohr R, Queen D, Keast D, Sibbald RG. Practical treatment of wound pain and trauma: a patient-centered approach. An overview. Ostomy Wound Manage 2003; 49: 2-15. [ Links ]
13. Bergan JJ, Schmid-Schönbein GW, Smith PD, Nicolaides AN, Boisseau MR, Eklof B. Chronic venous disease. N Engl J Med 2006; 355: 488-98. [ Links ]
14. Walmsley S. Advances in wound management: executive summary. En: Clinical reports. London: PJB Publications; 2002. [ Links ]
15. Coello R, Glenister H, Fereres J, Bartlett C, Leigh D, Sedgwick J. The cost of infection in surgical patients: a case-control study. J Hosp Infect 1993; 25: 239-50. [ Links ]
16. Iñigo JJ, Bermejo B, Oronoz B, Herrera J, Tarifa A, Pérez F, y cols. Infección de sitio quirúrgico en un servicio de cirugía general. Análisis de cinco años y valoración del índice National Nosocomial Infection Surveillance (NNIS). Cir Esp 2006; 79: 224-30. [ Links ]
17. Horan TC, Gaynes RP, Martone WJ, Jarvis WR, Emori TG. CDC definitions of nosocomial surgical site infections, 1992: a modification of CDC definitions of surgical wound infections. Infect Control Hosp Epidemiol 1992; 13: 606-8. [ Links ]
18. Bryant,R, Nix D. Acute and chronic wounds. Current management concepts. St. Louis: Mosby-Elsevier; 2007, p. 477. [ Links ]
19. Sibbald RG, Williamson D, Orsted HL, Campbell K, Keast D, Krasner D, y cols. Preparing the wound bed--debridement, bacterial balance, and moisture balance. Ostomy Wound Manage 2000; 46: 14-22, 24-8, 30-5; quiz 36-7. [ Links ]
20. Bowler PG. The 10(5) bacterial growth guideline: reassessing its clinical relevance in wound healing. Ostomy Wound Manage 2003; 49: 44-53. [ Links ]
21. Vowden K, Vowden P. Understanding exudate management and the role of exudate in the healing process. Br J Community Nurs 2003; 8: 4-13. [ Links ]
22. Fletcher J. Managing wound exudate. Nurs Times 2003; 99: 51-2. [ Links ]
23. Jones VJ. The use of gauze. Will it ever change? Int Wound J 2006; 3: 79-86. [ Links ]
24. Hermans MH. Clinical benefits of a hydrocolloid dressing in closed surgical wounds. J ET Nurs 1993; 20: 68-72. [ Links ]
25. Foster L, Moore P. The application of a cellulose-based fibre dressing in surgical wounds. J Wound Care 1997; 6: 469-73. [ Links ]
26. Ravenscroft MJ, Harker J, Buch KA. A prospective, randomised, controlled trial comparing wound dressings used in hip and knee surgery AQUACEL and Tegaderm versus Cutiplast. Ann R Coll Surg Engl 2006; 88: 18-22. [ Links ]
27. Harle S, Korhonen A, Kettunen J, Seitsalo S. A randomised clinical trial of two different wound dressing materials for hip replacement patients. J Orthopaedic Nurs 2005; 9: 205-10. [ Links ]
28. Moore PJ, Foster L. Cost benefits of two dressings in the management of surgical wounds. Br J Nurs 2000; 9: 1128-32. [ Links ]
29. Attwood AI. Calcium alginate dressing accelerates split skin graft donor site healing. Br J Plast Surg 1989; 42: 373-9. [ Links ]
30. Barnett SE, Varley SJ. The effects of calcium alginate on wound healing. Ann R Coll Surg Engl 1987; 69: 153-5. [ Links ]
31. Llovera JM. Evaluación de un apósito con Tecnología Hydrofiber® versus cura tradicional en el tratamiento de quistes sacros. Congreso de la European Wound Management Association; 2005. Stuttgart, Alemania. [ Links ]
32. Baxter H. How a discipline came of age: a history of wound care. J Wound Care 2002; 11: 383-92. [ Links ]
33. Walker M, Hobot JA, Newman GR, Bowler PG. Scanning electron microscopic examination of bacterial immobilisation in a carboxymethyl cellulose (AQUACEL) and alginate dressings. Biomaterials 2003; 24: 883-90. [ Links ]
34. Soldevilla Agreda JJ et al. Atención integral de las heridas crónicas. GNEAUPP. Madrid: Spanish Publishers Associates; 2004. [ Links ]
35. Agren M. The cytocompatibility of hydrocolloid dressings. J Wound Care 1997; 6: 272-4. [ Links ]
36. Alper JC, Tibbetts LL, Sarazen AA Jr. The in vitro response of fibroblasts to the fluid that accumulates under a vapor-permeable membrane. J Invest Dermatol 1985; 84: 513-5. [ Links ]
37. Sayag J, Meaume S, Bohbot S. Healing properties of calcium alginate dressings. J Wound Care 1996; 5: 357-62. [ Links ]
38. Bolton LL, Monte K, Pirone LA. Moisture and healing: beyond the jargon. Ostomy Wound Manage 2000; 46: 51-64. [ Links ]
39. Aerts A, Nevelsteen D, Renard F. Soins de plaies. Paris: De Boeck & Lacier; 1998, p. 73. [ Links ]
40. Jones SA, Bowler PG, Walker M, Parsons D. Controlling wound bioburden with a novel silver-containing Hydrofiber® dressing. Wound Repair Regen 2004; 12: 288-94. [ Links ]
41. Jurczak F, Dugré T, Johnstone A, Offori T, Vujovic Z, Hollander D, y cols. Randomised clinical trial of Hydrofiber dressing with silver versus povidone-iodine gauze in the management of open surgical and traumatic wounds. Int Wound J 2007; 4: 66-76. [ Links ]
42. Robinson BJ. The use of hidrofibre dressing in wound management. J Wound Care 2000; 9: 32-4. [ Links ]
43. Segovia Gómez T, et al. Heridas e infección. En: Arantón Areosa L, y cols. Guía práctica ilustrada: Tratamiento de heridas. Madrid: EDIMSA, Editores Médicos; 2009, p. 84. [ Links ]
44. European Wound Management Association (EWMA). Position Document: Identifying criteria for wound infection. London: MEP LTD; 2005. [ Links ]
45. Bowler PG, Jones SA, Walker M, Parsons D. Microbicidal properties of a silver-containing hydrofiber dressing against a variety of burn wound pathogens. J Burn Care Rehabil 2004; 25: 192-6. [ Links ]
46. Foster L, Moore P, Clark S. A comparison of hydrofibre and alginate dressings on open acute surgical wounds. J Wound Care 2000; 9: 442-5. [ Links ]
47. Bethell E. Why gauze dressings should not be the first choice to manage most acute surgical cavity wounds. J Wound Care 2003; 12: 237-9. [ Links ]
48. Cohn SM, Lopez PP, Brown M, Namias N, Jackowski J, Li P, y cols. Open surgical wounds: how does Aquacel compare with wet-to-dry gauze? J Wound Care 2004; 13: 10-2. [ Links ]
49. Caruso DM, Foster KN, Hermans MH, Rick C. Aquacel Ag in the management of partial-thickness burns: results of a clinical trial. J Burn Care Rehabil 2004; 25: 89-97. [ Links ]
50. Tachi M, Hirabayashi S, Yonehara Y, Suzuki Y, Bowler P. Development of an experimental model of infected skin ulcer. Int Wound J 2004; 1: 49-55. [ Links ]
51. Tachi M, Hirabayashi S, Yonehara Y, Suzuki Y, Bowler P. Comparison of bacteria-retaining ability of absorbent wound dressings. Int Wound J 2004; 1: 177-81. [ Links ]
52. O'Neill MA, Vine GJ, Beezer AE, Bishop AH, Hadgraft J, Labetoulle C, y cols. Antimicrobial properties of silver-containing wound dressings: a microcalorimetric study. Int J Pharm 2003; 263: 61-8. [ Links ]
53. Dyson M, Young S, Pendle CL, Webster DF, Lang SM. Comparison of the effects of moist and dry conditions on dermal repair. J Invest Dermatol 1988; 91: 434-9. [ Links ]
54. Eaglstein WH. Occlusive dressings. J Dermatol Surg Oncol 1993; 19: 716-20. [ Links ]
55. Porter JM. A comparative investigation of re-epithelialisation of split skin graft donor areas after application of hydrocolloid and alginate dressings. Br J Plast Surg 1991; 44: 333-7. [ Links ]
56. Sirvio LM, Grussing DM. The effect of gas permeability of film dressings on wound environment and healing. J Invest Dermatol 1989; 93: 528-31. [ Links ]
57. Wigger-Alberti W, Kuhlmann M, Ekanayake S, Wilhelm D. Using a novel wound model to investigate the healing properties of products for superficial wounds. J Wound Care 2009; 18: 123-8, 131. [ Links ]
58. Gollins S, Gaffney C, Slade S, Swindell R. RCT on gentian violet versus a hydrogel dressing for radiotherapy-induced moist skin desquamation. J Wound Care 2008; 17: 268-70, 272, 274-5. [ Links ]
59. Khatri KA, Bhawan J, Bhatty RS, Garcia V. Comparison of the open technique with a new wound dressing, H2460, in the healing of an acute wound after laser skin resurfacing. J Cosmet Laser Ther 2007; 9: 173-80. [ Links ]
60. Münter KC, Beele H, Russell L, Crespi A, Gröchenig E, Basse P, y cols. Effect of a sustained silver-releasing dressing on ulcers with delayed healing: the CONTOP study. J Wound Care 2006; 15: 199-206. [ Links ]
61. Bouza C, Saz Z, Muñoz A, Amate JM. Efficacy of advanced dressings in the treatment of pressure ulcers: a systematic review. J Wound Care 2005; 14: 193-9. [ Links ]
62. Goetze S, Ziemer M, Kaatz M, Lipman RD, Elsner P. Treatment of superficial surgical wounds after removal of seborrheic keratoses: a single-blinded randomized-controlled clinical study. Dermatol Surg 2006; 32: 661-8. [ Links ]
63. Tan PW, Ho WC, Song C. The use of Urgotul in the treatment of partial thickness burns and split-thickness skin graft donor sites: a prospective control study. Int Wound J 2009; 6: 295-300. [ Links ]
64. Hoekstra MJ, Hermans MH, Richters CD, Dutrieux RP. A histological comparison of acute inflammatory responses with a hydrofibre or tulle gauze dressing. J Wound Care 2002; 11: 113-7. [ Links ]
65. White R. New developments in the use of dressings on surgical wounds. Br J Nurs 2001; 10: S70. [ Links ]
66. Chang KW, Alsagoff S, Ong KT, Sim PH. Pressure ulcers--randomised controlled trial comparing hydrocolloid and saline gauze dressings. Med J Malaysia 1998; 53: 428-31. [ Links ]
67. Wood RA, Hughes LE. Silicone foam sponge for pilonidal sinus: a new technique for dressing open granulating wounds. Br Med J 1975; 4: 131-3. [ Links ]
68. Wood RA, Williams RH, Hughes LE. Foam elastomer dressing in the management of open granulating wounds: experience with 250 patients. Br J Surg 1977; 64: 554-7. [ Links ]
69. Macfie J, McMahon MJ. The management of the open perineal wound using a foam elastomer dressing: a prospective clinical trial. Br J Surg 1980; 67: 85-9. [ Links ]
70. Mulder GD. Cost-effective managed care: gel versus wet-to-dry for debridement. Ostomy Wound Manage 1995; 41: 68-70, 72, 74 passim. [ Links ]
71. Barnea Y, Amir A, Leshem D, Zaretski A, Weiss J, Shafir R, y cols. Clinical comparative study of aquacel and paraffin gauze dressing for split-skin donor site treatment. Ann Plast Surg 2004; 53: 132-6. [ Links ]
72. Heyneman A, Beele H, Vanderwee K, Defloor T. A systematic review of the use of hydrocolloids in the treatment of pressure ulcers. J Clin Nurs 2008; 17: 1164-73. [ Links ]
73. Matzen S, Peschardt A, Alsbjørn B. A new amorphous hydrocolloid for the treatment of pressure sores: a randomised controlled study. Scand J Plast Reconstr Surg Hand Surg 1999; 33: 13-5. [ Links ]
74. Harding K, Cutting K, Price P. The cost-effectiveness of wound management protocols of care. Br J Nurs 2000; 9: S6, S8, S10 passim. [ Links ]
75. Walker AJ, Shouler PJ, Leicester RJ. Comparison between Eusol and Silastic foam dressing in the postoperative management of pilonidal sinus. J R Coll Surg Edinb 1991; 36: 105-6. [ Links ]
76. Culyer AJ, MacFie J, Wagstaff A. Cost-effectiveness of foam elastomer and gauze dressings in the management of open perineal wounds. Soc Sci Med 1983; 17: 1047-53. [ Links ]
77. Fonder MA, Lazarus GS, Cowan DA, Aronson-Cook B, Kohli AR, Mamelak AJ. Treating the chronic wound: A practical approach to the care of nonhealing wounds and wound care dressings. J Am Acad Dermatol 2008; 58: 185-206. [ Links ]
78. Muangman P, Muangman S, Opasanon S, Keorochana K, Chuntrasakul C. Benefit of hydrocolloid SSD dressing in the outpatient management of partial thickness burns. J Med Assoc Thai 2009; 92: 1300-5. [ Links ]
79. Thomas S. Hydrocolloid dressings in the management of acute wounds: a review of the literature. Int Wound J 2008; 5: 602-13. [ Links ]
80. von Lindern JJ, Niederhagen B, Appel T, Bergé S. Treatment of soft tissue defects with exposed bone in the head and face region with alginates and hydrocolloid dressings. J Oral Maxillofac Surg 2002; 60: 1126-30. [ Links ]
81. Ubbink DT, Vermeulen H, Goossens A, Kelner RB, Schreuder SM, Lubbers MJ. Occlusive vs gauze dressings for local wound care in surgical patients: a randomized clinical trial. Arch Surg 2008; 143: 950-5. [ Links ]
82. Xakellis GC, Chrischilles EA. Hydrocolloid versus saline-gauze dressings in treating pressure ulcers: a cost-effectiveness analysis. Arch Phys Med Rehabil 1992; 73: 463-9. [ Links ]
83. Shinohara T, Yamashita Y, Satoh K, Mikami K, Yamauchi Y, Hoshino S, y cols. Prospective evaluation of occlusive hydrocolloid dressing versus conventional gauze dressing regarding the healing effect after abdominal operations: randomized controlled trial. Asian J Surg 2008; 31: 1-5. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Antonio Rodríguez Valiente
c/ Joaquín Rodrigo 2
28222 Majadahonda (Madrid)
Tel.: 629 73 66 19
E-mail: arova777@gmail.com