INTRODUCCIÓN
La diabetes es una de las enfermedades crónicas no transmisibles más comunes, así como un fenómeno epidemiológico cada vez más recurrente en muchas naciones1. Una de las complicaciones de la enfermedad es el pie diabético, que se entiende como el conjunto de síndromes en los que existe neuropatía, isquemia e infección; provocan alteraciones tisulares o úlceras secundarias a microtraumatismos2.
Se calcula que el pie diabético ocurre en el 20% de los pacientes con diabetes3; su riesgo aumenta con la edad y es siete veces mayor en las personas con más de 65 años4. Además de la edad, existen otros factores que se han asociado al desarrollo de pie diabético, como los polimorfismos. Este factor es considerado como un marcador para predecir una patología o una complicación, ya que observa las variaciones naturales en la secuencia del ácido desoxirribonucleico (ADN), por medio del cual se manifiestan las diferencias entre los individuos5.
Por otro lado, está la asociación de los polimorfismos de un solo nucleótido (SNP por sus siglas en inglés de Single Nucleotide Polymorphism) como marcadores genéticos. Se ha estimado que es posible detectar, en la secuencia genética, diferencias de nucleótidos entre individuos no emparentados. Estas variaciones en la secuencia de ADN pueden seguirse de una generación a la siguiente, por lo que la identificación de los SNP constituye el tipo más abundante y útil para la construcción de mapas genéticos6.
Debido a esto, la investigación de polimorfismos asociados a pie diabético ha ido cobrando más importancia, ya que se espera tener una serie de marcadores genéticos con base en los polimorfismos para identificar tempranamente el riesgo de desarrollar pie diabético en la población con diabetes. En el caso particular, se ha demostrado que en las personas que viven con diabetes, la presencia de un SNP puede alterar el proceso de cicatrización, causar afectaciones a nivel vascular o, por el contrario, actuar como factor protector de la aparición del pie diabético7.
Tomando en cuenta el aporte a nuestra ciencia, esta revisión permite parte de la aplicación de la intervención del libro Nursing Intervention Care (NIC) llamado “Identificación de riesgos: genético”, el cual trata de determinar los posibles riesgos genéticos mediante la investigación de opciones de pruebas de diagnóstico que confirmen o predigan la presencia de una alteración genética asociada a una enfermedad8.
Así mismo, los artículos relacionados con los polimorfismos son un tema que va en creciente aumento de información, por lo que se observa como un área de oportunidad en la elaboración de una revisión encaminada a conjuntar artículos que relacionen estas variables, abriendo el panorama para la comprobación y estudio de nuevos polimorfismos asociados con el desarrollo de pie diabético en diferentes poblaciones del mundo.
A partir de lo anterior se plantea el objetivo de la presente revisión integrativa: sistematizar la asociación de los polimorfismos genéticos como riesgo para el desarrollo de pie diabético a través de la producción científica indexada.
METODOLOGÍA
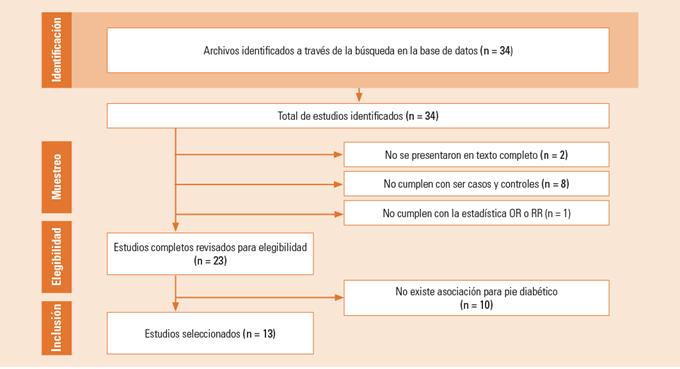
Se realizó una búsqueda bibliográfica, de septiembre a diciembre de 2018, de los estudios, con el propósito de identificar artículos sobre polimorfismo asociados con el desarrollo de pie diabético. La búsqueda se realizó en las bases de datos infromatizados PubMed (9), Scopus (1), CONRICYT (2) y WOS (1). Los descriptores controlados principales y empleados en combinación fueron tres conceptos "polymorphism" AND "diabetic foot" OR "foot ulcer diabetic". Se incluyeron artículos a texto completo en inglés y español con diseño de casos y controles, no mayor de 10 años de antigüedad y evaluado cuantitativamente mediante odds ratio o riesgo relativo. Se excluyeron estudios publicados solo en forma de resumen, casos clínicos, sin grupo control o que incluyeron participantes menores de edad.
Como parte de las estrategias de búsqueda se evaluó la calidad de los artículos con la plataforma FLC 2.0, se realizó una lectura crítica y generó fichas para dar respuesta a la pregunta de investigación. Finalmente, se consideraron aquellos artículos con calidad media o alta.
Los pasos que se siguieron para la selección de los artículos fueron, primeramente, leer el título y el resumen con el fin identificar la pregunta de la investigación y los criterios de inclusión; si se cumplió el primer paso, se procedió con el segundo, que fue la lectura meticulosa de los artículos completos por tres investigadores. Finalmente, se extrajo la información para dar respuesta a la pregunta de investigación. De cada artículo se consideró: primer autor, fecha de publicación, número de participantes, procedencia de la población, diseño del estudio, criterios de inclusión y exclusión, polimorfismo analizado, carácter observado y estimaciones de los desenlaces estudiados (odds ratio [OR], riesgo relativo [RR]). La revisión arrojó como resultado 34 artículos relacionados con el tema; 13 cumplieron con los criterios de elegibilidad para su análisis crítico. En la figura 1 se presenta el proceso con base al modelo PRIISMA.
RESULTADOS
Se distinguen nueve polimorfismos asociados con la aparición de pie diabético y cuatro que contribuyen a evitar la aparición de la complicación. En la tabla 1 se presentan los polimorfismos asociados con el pie diabético.
Tabla 1. Polimorfismos asociados con la susceptibilidad a pie diabético.
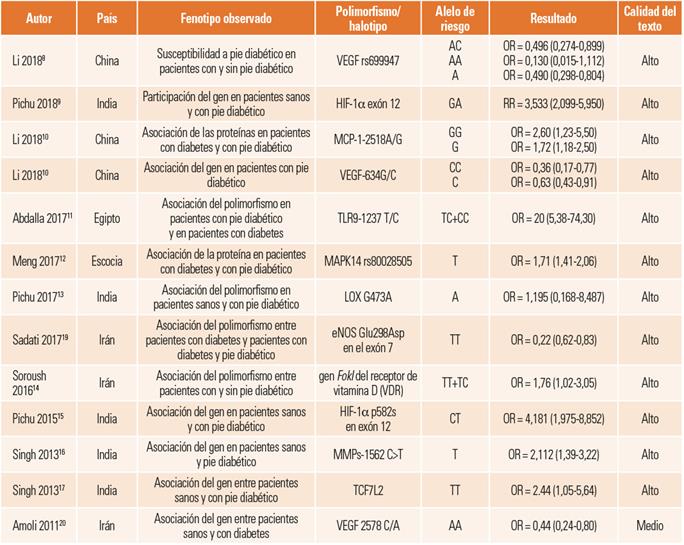
eNOS: sintasa de óxido nítrico endotelial; HIF: factor inducible por hipoxia; LOX: lisil oxidasa; MAPK: proteína quinasas activadas por mitógenos; MCP: proteína quimiotáctica de monocitos; MMP: metaloproteinasas de la matriz extracelular; TCFL2: factor 7 de transcripción like 2; TLR: receptores tipo Toll; VEGF: factor de crecimiento endotelial vascular.
Polimorfismos asociados con la aparición de pie diabético
Factor inducible por hipoxia 1α (HIF-1α)
El objetivo del estudio de Pichu et al. 9) fue determinar la asociación del polimorfismo HIF-1 α en personas con y sin pie diabético. El estudio se realizó en población adulta de un hospital de la India. La muestra fue de 529 individuos; 185 con diabetes, 199 con pie diabético y 145 como grupo control sin la enfermedad. Entre los criterios de inclusión está tener pie diabético de grado tres o cuatro; como exclusión, participantes con pie diabético y tratamiento con insulina; se emparejaron los otros grupos mediante edad, sexo e índice de masa corporal. Los hallazgos del estudio señalan asociación del polimorfismo HIF-1 α en el alelo GA, RR = 3,533 (2,099-5,950) en comparación entre el grupo de pie diabético vs. grupo control.
Proteína quimiotáctica de monocitos (MCP-1-2518A/G)
El estudio de Li10 tuvo como objetivo determinar la asociación del polimorfismo MCP-1-2518A/G en personas con diabetes (n = 108) y pie diabético (n = 121) de un hospital de China. Criterios de inclusión: adultos con diagnóstico de diabetes y con la única complicación de pie diabético; se excluyeron personas con enfermedades inmunitarias, enfermedades cerebrovasculares y otras enfermedades graves. La población fue emparejada a través de la edad y el sexo. Se encontró asociación en los alelos GG, OR = 2,60 (1,23-5,50) y G, OR = 1,72 (1,18-2,50) para susceptibilidad para pie diabético, teniendo el alelo G una frecuencia de aparición del 64,88%.
Receptores tipo toll 9 (TLR9-1237 T/C)
El estudio de Abdalla et al.11 evaluó la asociación del polimorfismo TLR91237 T/C en personas con diabetes tipo 2 y con pie diabético. Participaron 90 sujetos de Egipto, divididos en tres grupos: el primero, con diabetes (n = 30), el segundo con pie diabético (n = 30) y el tercero, sano (n = 30). Criterios de inclusión: vivir con diabetes, tratamiento con insulina y fumadores, no especifica grado de pie diabético; los criterios de exclusión para el segundo grupo fueron: padecer algún evento cerebrovascular, insuficiencia renal o estar en terapia de reemplazo renal. Se encontró asociación del polimorfismo TLR9-1237 T/C con la presencia de pie diabético en el alelo TC+CC, OR = 20 (5,8-74,30) en comparación con el grupo control, con una frecuencia del alelo del 50% para este grupo.
Proteína quinasas activadas por mitógenos (MAPK14RS80028505)
Meng et al.12 tuvieron en su estudio el objetivo de identificar variantes genéticas para desarrollar una condición de pie diabético ante la presencia de neuropatía periférica, basada en una cohorte diabética escocesa. Participaron 699 casos con pie diabético y 2.695 controles con diabetes (tipos 1 o 2). Criterios de inclusión para los casos fueron aquellos participantes que hayan tenido o tienen una úlcera de pie y haber dado positivo en la prueba de monofilamento; en el grupo control se consideró no tener úlcera en el pie y salir positivo en la prueba de monofilamento. Se encontró asociación del gen MAPK14 rs80028505 con la presencia de pie diabético en el alelo T, OR = 1,71 (1,41-2,06) para la población escocesa.
Lisil oxidasa (LOX G473A)
Pichu et al.13 exploraron la participación del polimorfismo LOX G473A en el pie diabético de la población del sur de la India. La muestra estuvo formada por 906 casos: 305 con diabetes de tipo 2, 301 con pie diabético y 300 controles sanos. Los criterios de inclusión para el grupo control fueron no tener antecedentes de diagnóstico de diabetes mellitus, HbA1c inferior al 5,6% y sin antecedentes familiares de diabetes mellitus en familiares de segundo grado. Se halló asociación del gen LOX G473A en el alelo A, OR =1,195 (0,168-8,487) en comparación con el grupo control, con una frecuencia de presencia del alelo A para el grupo de pie diabético del 41,69%.
Foki del receptor de vitamina (VDR)
En el estudio de Soroush et al.14, el objetivo fue examinar la asociación entre el polimorfismo del gen FokI del receptor de vitamina (VDR) y el pie diabético en población iraní. Una muestra de 105 personas con pie diabético para el grupo de casos y 107 con diabetes, pero sin la complicación para el grupo control. Criterios de exclusión para ambos grupos fue tener diabetes de tipo 1, estar embarazada, tabaquismo en los últimos 2 años y haber ingerido suplementos antioxidantes en los 3 meses anteriores a la fecha de inicio del estudio. Se encontró asociación entre la variante funcional del gen FokI del receptor de vitamina D (VDR), OR = 1,76 (1,02-3,05) y la presencia de pie diabético en comparación con el grupo de control.
Factor inducible por hipoxia-1α P582S
Pichu et al.15 se plantearon evidenciar la expresión del HIF-1α p582s en la presencia de pie diabético, en una muestra de 66 controles sanos, 79 casos con diabetes y 79 casos con diabetes y úlcera. Criterios de inclusión: antecedentes de diagnóstico de diabetes mellitus, HbA1c inferior al 5,6% y sin antecedentes familiares de diabetes mellitus en familiares de segundo grado. Los hallazgos del estudio señalan asociación del HIF-1α p582s en el exón 12 en el alelo CT con una frecuencia del 50,63% y una OR = 4,181(1,975-8,852) entre el grupo de casos con pie diabético vs. control de pacientes sanos.
Metaloproteinasas de la matriz extracelular-1562C>T (MMPS-1562C>T)
Singh et al.16, en su estudio, se plantearon evidenciar la asociación entre el polimorfismo de un solo nucleótido (SNP-1562C>T) (rs3918242) en la región promotora del gen MMP-9 en personas de la India con las úlceras del pie diabético. La muestra fue de 149 personas con diabetes, 110 casos con pie diabético y 267 controles sanos. Los criterios de inclusión para el grupo control fueron, niveles de glucosa en ayunas o posprandial controlados, y sin la presencia de alguna enfermedad inflamatoria o crónica. El estudio arrojó una asociación entre la presencia de pie diabético y el polimorfismo MMPs-1562C>T OR = 2,44 (1,055,64) en el alelo T con una frecuencia del 24,1%.
Factor 7 de transcripción Like 2 RS7903146 C/T (TCFL2RS7903146 C/T)
En su estudio, Singh et al.17 examinaron el papel del gen TCFL2 rs7903146 (C/T) en personas con deterioro de la cicatrización de heridas en personas con DM2. La muestra estuvo formada por 322 personas con DM2, 120 con pie diabético y 308 controles sanos. Se incluyó en el estudio a personas con DM2 y neuropatía vascular o heridas traumáticas. Se excluyó a personas con trastornos comórbidos como la disfunción tiroidea y que no pertenecieran al norte de la India. Se encontró asociación del gen en el alelo TT con el grupo de pie diabético OR = 2,44 (1,05-5,64), con una frecuencia del alelo TT del 10,8%.
Polimorfismos protectores con la presencia de pie diabético
Factor de crecimiento endotelial vascular RS699947 (VEGFRS699947)
Li et al.18, en su estudio, se plantearon determinar la asociación de polimorfismos del gen del factor de crecimiento endotelial vascular (VEGF) con la susceptibilidad a la úlcera del pie diabético en población china. La muestra estuvo formada por 88 personas con diabetes, 97 con pie diabético y 103 sanas emparejadas por sexo y edad. Criterio de inclusión para los casos: diagnóstico médico de diabetes, y se evaluó para el grupo con pie diabético la úlcera; los controles se sometieron a un examen físico y se detectó la no presencia de historias de pie diabético o enfermedades relacionadas. Se encontró asociación negativa del gen VEGF rs699947 en el alelo AC, OR = 0,496 (0,274-0,899) con una frecuencia del 28,87%, AA, OR = 0,130 (0,015-1,112) con una frecuencia del 1,03% y A, OR = 0,490 (0,298-0,804) con una frecuencia del 15,46%.
Factor de crecimiento endotelial vascular-634G/C (VEGF-634G/C)
Li10 determinó la asociación entre el factor de crecimiento endotelial vascular (VEGF-634G/C) en personas con diabetes (n = 108) y pie diabético (n = 121) en un hospital de China. Incluyó a personas con diagnóstico de diabetes y con pie diabético; se excluyó a participantes con enfermedades inmunitarias, enfermedades cerebrovasculares y otras enfermedades graves. La población fue emparejada por edad y sexo. Se encontró asociación negativa del gen VEGF-634G/C en el genotipo CC, OR = 0,36 (0,17-0,77) con una frecuencia del 23,97% y el alelo C, OR = 0,63 (0,43-0,91) con una frecuencia del 47,93%.
Sintasa de óxido nítrico endotelial GLU298ASP (ENOS GLU298ASP)
En el estudio de Sadati et al.19, el objetivo fue examinar la asociación entre el polimorfismo eNOS Glu298Asp y el pie diabético en una muestra de 123 personas con diabetes y pie diabético activo, y 134 para el grupo control, que incluyó pacientes con diabetes, pero sin antecedentes de pie diabético. Los criterios de inclusión fueron pacientes entre los 30 y los 65 años y cuya diabetes había estado presente durante al menos 5 años; como exclusión, datos de tabaquismo, embarazo y suplementación de vitaminas con efectos antioxidantes conocidos durante los últimos 3 meses. Se encontró asociación del gen con el alelo TT, OR = 0,22 (0,83-0,62), con una frecuencia del 15,7%.
Factor de crecimiento endotelial vascular 2578 C/A (VEGF 2578 C/A)
Para Amoli et al.20, el objetivo de su estudio fue asociar el VEGF 2578 C/A con la úlcera del pie diabético, en una muestra de 247 personas con pie diabético, 241 sin pie diabético y 98 controles sanos. No se especifican criterios de inclusión y exclusión. Los resultados arrojan asociación del VEGF 2578 C/A en el alelo AA, OR = 0,44 (0,24-0,80), con una frecuencia del alelo del 15,7%.
DISCUSIÓN
En función de los hallazgos encontrados, se observaron 13 polimorfismos distintos que se asocian a la susceptibilidad, gravedad, pronóstico o evitan la presencia del pie diabético en diferentes poblaciones de Europa (Escocia), Asia (China, India e Irán) y África (Egipto). Los estudios reportaron 8.132 participantes, con una media de 626; todos los estudios fueron de casos y controles, y solo un estudio tuvo más de 3.000 participantes, lo que explica que la media sea elevada para los estudios descritos.
La reproducibilidad de los polimorfismos es escasa, con excepción del VEGF en sus variantes rs699947, -634G/C, 2578 C/A y 2578 C/A18,10,20) y del polimorfismo HIF-1α p582s y HIF-1α9,15. A partir de estos hallazgos se deduce que es una complicación que está en proceso de investigación, lo que posiblemente representa un factor de riesgo relevante de prevención para la aparición de pie diabético.
Los resultados del estudio fueron difíciles de interpretar, dado que los criterios de inclusión, el tamaño de muestra y los resultados de la asociación de los polimorfismos fueron diversos. Con relación a los criterios de exclusión, los más comunes fueron el tratamiento con insulina, la presencia de enfermedades cerebrovasculares, la terapia de reemplazo renal, el embarazo, tabaquismo y disfunción de la glándula tiroides. Por el contrario, en el estudio de Amoli y colaboradores no se especificaron los criterios12.
De acuerdo con los resultados encontrados, vale la pena hacer un análisis en algunas medidas terapéuticas para prevenir el pie diabético por parte del profesional de salud:
1. Cuantificación del riesgo.
Se encontraron rangos de OR de 0,130 a 20,0 y un RR de 3,533. Dependiendo del polimorfismo analizado, se reflejan factores de riesgo y protectores para la complicación de pie diabético. Si bien existen otros factores independientes de los genéticos que contribuyen a su aparición, estos complementan el riesgo para la presencia del mismo, encontrándose factores conductuales y biomarcadores que, como menciona Rebbek al conjugar estos tres factores (genéticos, conductuales y biomarcadores) aumenta el riesgo en la aparición del pie diabético21.
2. Mejor entendimiento de los procesos etiológicos y fisiopatológico.
La presencia de estos polimorfismos permite identificar cómo influye la expresión de los genes en la presencia de la complicación; por ejemplo, fisiológicamente se encontró el papel de VEGF, que entre sus características está promover el crecimiento de células nuevas y la cicatrización de heridas22. Así pues, la eNOS tiene el papel esencial para la manutención del tono vascular basal. Este tono es, en parte, mediado por la síntesis del óxido nítrico, un compuesto vasoactivo que participa en la regulación del flujo sanguíneo en los diversos lechos vasculares, por lo que a falta del flujo sanguíneo y la generación de nuevos vasos sanguíneos en el pie se vuelve un factor importante para la aparición de esta complicación. En este estudio se plantea como un factor protector23.
También en este estudio se identificó al polimorfismo HIF-1α, que fisiológicamente transcribe y regula la respuesta celular a la hipoxia y actúa como regulador de la homeostasis del oxígeno24; en consecuencia, difícilmente lleva a una falta de oxigenación en el pie, por lo que hay un riesgo de necrosis. Igualmente se identificó el MCP-1 que recluta monocitos, leucocitos y otras células inflamatorias en respuesta a un estímulo inflamatorio, está asociado con enfermedad cardiovascular y se encuentra elevado en las personas con diabetes de tipo 2; por tanto, la disminución de esta proteína es considerado un factor de riesgo25.
Los TLR9 son receptores que reconocen patrones importantes en la mediación de la inflamación y la inmunidad y están más presentes en pacientes con obesidad y diabetes26; igualmente, se observó como factor de riesgo a la MAPK14, implicada principalmente en el crecimiento, supervivencia y diferenciación celular, por lo que el déficit del TLR y del MAPK tiene un papel fundamental en la aparición del pie diabético. En el estudio se observó el alelo del polimorfismo en bajos porcentajes, lo que explicaría el riesgo confirmado27.
Con relación a LOX, se considera esencial para el desarrollo cardiovascular; su disminución afecta al proceso de cicatrización en las heridas28, mientras que las MMP están implicadas en situaciones donde hay daño epitelial, endotelial y se requiera el proceso de cicatrización, ya que las células endoteliales de los capilares segregadas por células endoteliales vasculares migran hacia el lecho de la herida isquémica generando tejido de granulación29. Entre los hallazgos del estudio se observó la frecuencia de los alelos en los pacientes con pie diabético, por lo que el riesgo para la complicación está en relación con los resultados de estos autores.
3. Implicación en farmacogenética.
En la actualidad existe una variedad para tratar el crecimiento del tejido en las úlceras del pie asociados o no a la diabetes, siendo característico el tratamiento que ayuda en el cierre de la herida, como la terapia de presión negativa, el uso de Heberprot-p, así como fármacos con VEGF y ozonoterapia, entre otros30 31-32; sin embargo, hasta el momento, el proceso de investigación de la aplicación de la farmacogenética se ve disminuida debido a la poca evidencia actual sobre los factores genéticos relacionados con el pie diabético.
4. Participación de enfermería en la genética.
En definitiva, la revisión integrativa con esta temática da paso a adentrarse en la rama especializada de enfermería genética, como señala la Nursing Intervention Care (NIC), llamada “Identificación de riesgos: genético”, lo cual permite al profesional de enfermería con posgrado determinar el posible riesgo genético derivado de cualquier proceso patológico8; en consecuencia, el avance en la enfermería genética abre nuevos horizontes en un campo de acción prioritario para la salud pública en esta era. Por consiguiente, enfermería tendrá un papel relevante para identificar polimorfismos, como primer paso en el diseño de intervenciones preventivas o en la participación de mejoras en la práctica de enfermería en su función de consejero genético.
CONCLUSIONES
El resultado de la investigación señala 13 polimorfismos asociados con la presencia de pie diabético: cuatro se identifican como factor protector y nueve como factor de riesgo. El polimorfismo que más se ha estudiado en sus diversas variables es el VEGF.
Por otra parte, no se encontró ningún estudio que se haya elaborado en el continente americano y australiano. Esta situación hace necesarios estudios que permitan identificar la presencia de estos u otros polimorfismos en un mayor número de personas, de distintas edades, razas y áreas geográficas, lo que posiblemente permitirá mejorar o aumentar el conocimiento actualmente disponible.
Finalmente, la estructura genética de la persona que vive con diabetes está asociada con la susceptibilidad al origen de pie diabético, así como en su gravedad y evolución. En función de los hallazgos encontrados, el conocimiento generado podrá ser empleado durante la práctica clínica para objetivar y cuantificar el riesgo, generar nuevo conocimiento que contribuya a comprender el proceso etiológico y fisiopatológico y crear tratamientos más efectivos basados en la farmacogenética. En consecuencia, esta situación permitirá la participación del profesional de enfermería en la identificación de los factores de riesgo genéticos.