INTRODUCCIÓN
En el año 2002, el Grupo Nacional para el Estudio y Asesoramiento en Úlceras por Presión y Heridas Crónicas (GNEAUPP) elaboró la primera edición sobre recomendaciones de antisépticos en heridas crónicas1, documento que fue elemento clave para apoyarnos en nuestra práctica asistencial diaria. Han pasado ya 20 años desde aquella edición y este artículo, síntesis del documento técnico n.º VIII del GNEAUPP, pretende continuar la labor realizada por aquel entonces actualizando algunos detalles y añadiendo nuevas herramientas terapéuticas para prevenir o luchar frente a uno de los factores más importantes que impiden que cicatrice una herida: los problemas relacionados con los microorganismos, clásicamente la infección y, ahora, también el impacto de los biofilms.
En este artículo se habla sobre antimicrobianos en heridas crónicas, incluyendo a los que basan su mecanismo de acción en una acción química o bioquímica, es decir, los antisépticos, pero también se tratan algunos aspectos de los antibióticos que se continúan usando en la práctica clínica y, como mínimo, siguen siendo objeto de debate y controversia, como, por ejemplo, los antibióticos tópicos y, más actualmente, otros agentes con potenciales propiedades antibiofilm. No se incluyen otros productos con capacidad antimicrobiana en los que su mecanismo de acción sería físico o electrocéutico.
Hoy en día existen diversos factores que han propiciado que existan microorganismos cada vez más resistentes a los antibióticos actuales, y el descubrimiento de nuevas generaciones de antibióticos es costoso y difícil, por eso a nivel mundial se realizan campañas de uso racional de los antibióticos. Uno de los problemas de esta estrategia es que, a menudo, se observan recomendaciones sobre el uso de antisépticos, que pueden ser unos buenos aliados para evitar el uso de antibióticos en heridas o mediante su uso concomitante para luchar contra los microorganismos.
A pesar de tener los antisépticos muy a mano y de uso muy extendido en nuestra práctica clínica, hay un déficit de estudios de calidad sobre su eficacia o estándares de laboratorio/resultados que permitan obtener conclusiones en igualdad de condiciones, puesto que se comparan diversos antisépticos en diferentes concentraciones y situaciones. También existen intereses comerciales con la intención de situar unos productos por encima de otros, algunas veces sin contar con evidencia que lo sustente.
METODOLOGÍA DE ELABORACIÓN DEL ARTÍCULO
Para la elaboración de este artículo se creó un grupo de trabajo de profesionales de entre los miembros del Comité Consultivo y Director del GNEAUPP, compuesto por profesionales clínicos, investigadores y docentes con amplia experiencia y conocimiento en el manejo de las heridas crónicas.
La estructura para la búsqueda y selección de las fuentes para establecer las recomendaciones fueron generadas por el grupo de trabajo. Además, se asume el sistema propio del GNEAUPP de gradación de la evidencia y las recomendaciones que se generó para la elaboración del documento “Qué no hacer en las heridas crónicas”2 y adaptándolo a este artículo. Dicho sistema clasifica la fuerza de la recomendación como se indica a continuación:
Alta: recomendación de usar o desestimar su uso avalada por evidencias procedentes de estudios científicos (revisiones sistemáticas, ensayos clínicos o estudios prospectivos) de forma consistente. La mayoría de los expertos estaría de acuerdo con esta recomendación. Se considera muy poco probable que se puedan generar nuevas evidencias que cambien esta recomendación.
Moderada: recomendación de usar o desestimar su uso avalada por algunas evidencias procedentes de estudios científicos (revisiones sistemáticas, ensayos clínicos o estudios prospectivos), aunque algunos estudios hacen matizaciones. La mayoría de los expertos estaría de acuerdo en esta recomendación. Se considera posible que se puedan generar nuevas evidencias que cambien esta recomendación.
Baja: recomendación de usar o desestimar su uso avalada por algunas evidencias procedentes de estudios científicos (revisiones sistemáticas, ensayos clínicos o estudios prospectivos), aunque no totalmente concluyentes, ya que hay evidencias discrepantes. Puede existir discrepancia entre los expertos respecto a esta recomendación. Se considera probable que nuevos estudios puedan generar evidencias que modifiquen esta recomendación.
Se intentará ofrecer una pincelada sobre las recomendaciones de uso de antibióticos y antisépticos, algunos de los cuales aún no están plenamente implantados en España, pero que las últimas guías de consenso recomiendan, y también recomendaciones que desaconsejan el uso de algunos antisépticos que sí tienen su uso muy extendido en España.
ESTADO ACTUAL DEL CONOCIMIENTO
Sobre la microbiología de la herida
La piel es un órgano en el que se encuentran numerosos microorganismos, que en conjunto se denominan microbiota de la piel (anteriormente se usaba el termino flora de la piel). La mayoría son bacterias no patógenas, y pueden incluir a las de tipo comensal (se alimentan en la piel, pero no la dañan) o mutualistas (se alimentan y ofrecen algún beneficio)3.
Microbiológicamente, la superficie externa de la piel de un adulto está colonizada por un pequeño número de microorganismos “cultivables”. Estos se pueden detectar regularmente cuando se analiza la piel, y representan una población que habitualmente se denomina microflora residente, flora normal o microbiota indígena. En cualquier localización y a lo largo de la vida de un individuo, la flora normal es relativamente estable, tanto en términos de composición como de cantidad.
Además de la flora normal, la piel también da soporte a otros microorganismos que se encuentran “libres” en su superficie. Estos forman la denominada flora transitoria y no son residentes perpetuos de la piel. El rol que esta flora transitoria juega en la infección y la resistencia a la colonización que ejerce la piel todavía no se conocen bien, aunque es altamente probable que influencien en el ciclo de vida de las infecciones.
Cuando se produce una herida, la piel pierde la integridad y permite la entrada de microorganismos al interior del organismo, que pueden proliferar y crecer a expensas del tejido muerto o desvitalizado presente. El tejido subyacente queda expuesto y esto aumenta significativamente el riesgo de infección.
Desde la perspectiva clásica, basada en el cultivo bacteriano en placa con agar, las bacterias que se encuentran con mayor frecuencia son Staphylococcus aureus, incluyendo las multirresistentes, otras que también se asocian son Pseudomonas aeruginosa, Escherichia coli, Acinetobacter spp. y estafilococos coagulasa negativos, entre otros.
Los métodos de cultivo, generalmente resultan en una vasta subestimación de flora bacteriana, tanto en términos cualitativos como cuantitativos. Por lo que es necesario un entendimiento más preciso de la densidad y diversidad de las bacterias en diferentes regiones de la piel, junto con un conocimiento más profundo del rol que determinados microorganismos tienen en la infección.
Tradicionalmente, en el cuidado de las heridas se ha trasladado nuestro conocimiento de las heridas agudas a las heridas crónicas, sin pararnos a pensar si estas lesiones se comportaban igual o de manera diferente en la clínica. Así, se puede aceptar que en todas las heridas crónicas hay presencia de bacterias, al igual que en la piel sana, pero eso no supone que todas las heridas estén infectadas.
Desde el punto de vista “clásico” de la microbiología, aparecen en escena nuevos términos relacionados con el estado bacteriano y su posterior tratamiento, como carga bacteriana, carga necrótica, equilibrio bacteriano, elevada carga bacteriana, colonización crítica, etc., que se suman a los clásicos términos de contaminación, colonización e infección. Así, los términos clásicos y vistos de una manera estática se convierten en un concepto dinámico, denominado, por algunos autores, el “continuum de la infección”, en el que, en función de las variables críticas que afectan a la herida: cantidad de tejido necrótico, número de microorganismos, virulencia bacteriana y respuesta inmune de la persona, podemos tener heridas que van a poder pasar de contaminación a infección o viceversa. Este concepto de “continuum de la infección” (fig. 1) ha sido revisado y actualizado por el International Wound Infection Institute (IWII)4.
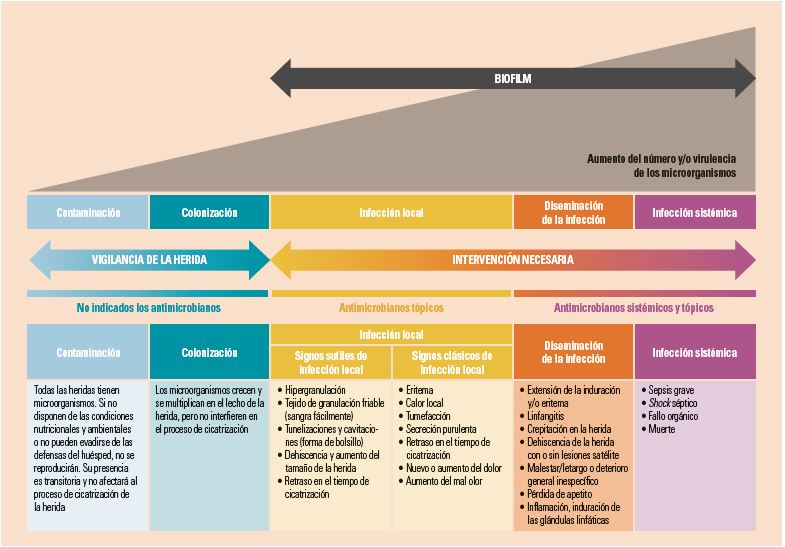
Traducido y adaptado del International Wound Infection Institute4.
Figura 1. Continuum de la infección en heridas, signos y síntomas de infección asociados e intervenciones sobre uso de antimicrobianos en función del estado de la herida.
Generalmente, las diferentes situaciones respecto a la microbiología de las heridas se definen como sigue:
Contaminación: cuando hay presencia de microorganismos en la superficie de la lesión, pero estos no están adheridos a ella, no se reproducen y no se objetiva ninguna respuesta del huésped. Se asume que todas las heridas están contaminadas.
Colonización: las bacterias presentes en la lesión están fijadas al lecho, se reproducen, pero no causan respuesta en el huésped. Se asume que todas las heridas crónicas están colonizadas.
Infección: las bacterias que se estaban multiplicando en el lecho, penetran el tejido sano y causan daño y reacción de defensa en el huésped.
Así, determinar la microbiología de la herida es algo complejo, con muchos elementos por desarrollar. Además, el diagnóstico de infección es clínico a partir de los signos y síntomas de esta, pero en muchas ocasiones se visualizan lesiones que no presentan reacción o respuesta en el huésped y, sin embargo, presentan un retraso en su cicatrización, haciendo pensar que pudiera haber un problema relacionado con la cantidad de microorganismos presentes. A este concepto se le denominó “colonización crítica”5. Este concepto se hizo “fuerte” al enunciar el mencionado “continuum de la infección”. No obstante, el último consenso del IWII de 20164 recomienda dejar de utilizar este término por su imprecisión y dificultad de diagnóstico, además de cuadrar de manera plausible con el moderno concepto de “biofilm bacteriano”.
Recientemente, y ante esta complejidad que se presenta, un grupo internacional de expertos en este tema ha desarrollado y validado un instrumento para la ayuda en el diagnóstico clínico de infección local en las heridas. Este instrumento recibe el nombre de TILI (Therapeutic Index for Local Infection)6,7.
No obstante, los signos clásicos para determinar una infección no son suficientes en el caso de las heridas crónicas y se han modificado para ayudar a los clínicos a tomar decisiones. Así, se incluyen como posibles signos, además de los clásicos, el aumento del exudado con inflamación persistente, el retraso en la cicatrización, el tejido de granulación decolorado o friable (que sangra fácilmente), las tunelizaciones o bolsillos en la base de la lesión y/o el mal olor.
Ante esta complejidad, la experiencia y la formación en este campo juega un rol muy importante para evaluar la infección. La introducción del paradigma del biofilm, además, ha venido a complicar un poco más esta área.
Podríamos definir un biofilm como: “un ecosistema microbiano organizado, conformado por una o varias especies de microorganismos asociados a una superficie viva o inerte, con características funcionales y estructurales complejas”. Este tipo de conformación microbiana ocurre cuando las células planctónicas se adhieren a una superficie o sustrato, formando una comunidad, que se caracteriza por la excreción de una matriz extracelular adhesiva protectora8.
Se ha observado que dichas comunidades están presentes en las heridas crónicas (hasta el 80% de ellas pueden tener biofilms)9 y su organización y estructura hace que tengamos que aproximarnos a su identificación y abordaje desde una perspectiva diferente.
Para enlazar el paradigma clásico de infección con el paradigma del biofilm, hay que recordar que todas las heridas abiertas se considera que están contaminadas. Consecuentemente, a medida que en la lesión aparece tejido desvitalizado, el lecho de la herida favorece la proliferación. A medida que la carga bacteriana (bioburden) se incrementa, las demandas sobre el sistema inmunitario del huésped también aumentan. Como respuesta, si la carga bacteriana de la herida no es suprimida por las defensas del huésped, entonces esta continuará aumentando. El incremento en la cantidad de bacterias en la herida aumentará el riesgo de infección clínica, que ocurrirá, a no ser que se utilicen medidas apropiadas como el desbridamiento del tejido desvitalizado y la administración de antimicrobianos tópicos/sistémicos.
Cuando se establece el criterio de infección en la clínica, lo habitual es solicitar un diagnóstico microbiológico del germen o gérmenes que están produciendo esta situación. Normalmente suele existir confusión en los métodos de toma de muestra para que estos se obtengan correctamente. Está generalmente aceptado que es inapropiado tomar muestras de todas las heridas, pero la consistencia en la práctica es muy variable. En general, la toma de muestras de una herida solo estaría recomendada si la herida está fallando en su evolución, se deteriora, aumenta de tamaño, está siendo evaluada para ver si tiene microorganismos resistentes a los antibióticos, y está clínicamente infectada y no ha respondido a la terapia empírica antimicrobiana.
Los métodos tradicionales de toma de muestras son la toma de muestras con hisopo o escobillón, la aspiración de tejido (normalmente conocida como punción-aspiración) y la biopsia. Con la teoría del biofilm, una de las técnicas de recogida de muestras para estudio que se presenta como válida sería el desbridamiento radical mediante bisturí, tijera o cureta3.
Para realizar el abordaje de los biofilms en las heridas es necesaria la limpieza y el desbridamiento de la herida y la aplicación de antimicrobianos tópicos e incluso antibióticos sistémicos en función del estado microbiológico de la lesión11,12,13.
Antimicrobianos (desinfectantes, antisépticos y antibióticos)
Un antimicrobiano4 es una substancia que actúa directamente sobre un microorganismo con la finalidad de destruirlo o dificultar el desarrollo de nuevas colonias. El concepto incluye a los desinfectantes, los antisépticos y los antibióticos.
A pesar de que se conoce que un desinfectante1,4 es un producto químico que se aplica sobre superficies o materiales inanimados o inertes con la finalidad de eliminar microorganismos, se sigue utilizando en el lenguaje sanitario y coloquial cuando se utiliza en la piel de los pacientes14.
El producto no selectivo que se aplica sobre los tejidos vivos con el fin de eliminar o inhibir la multiplicación de los microorganismos es lo que se conoce como antiséptico1,4. Puede producir toxicidad en las células humanas y difícilmente genera resistencias (aunque en la literatura se han reseñado algunas).
Los antibióticos son pequeñas moléculas naturales o sintéticas con la capacidad de destruir o inhibir el crecimiento bacteriano. Son selectivos sobre las células bacterianas y no influyen en las humanas, por lo que tienen una baja o nula toxicidad. La resistencia a los antibióticos es un problema de salud a nivel mundial4.
Como profesionales sanitarios, debemos conocer cuál es el mejor uso de los antimicrobianos en función del estado del paciente. Este conocimiento se empieza a adquirir en los estudios de grado en la universidad. Así, la mayoría de centros que imparten ciencias de la salud en España, incluyen en sus contenidos la antisepsia y los antisépticos15. A pesar de ello, es necesario seguir formándose sobre el uso de los antimicrobianos a lo largo de la carrera profesional, para mantenerse actualizado.
Antibióticos
En las heridas infectadas, sobre todo en aquellas en las que se observa una diseminación de la infección (p. ej., celulitis) o infecciones de tejidos profundos (abscesos u osteomielitis) son necesarios antibióticos por vía sistémica14. Normalmente se utilizan antibióticos de forma empírica o específica en función de si se ha realizado un cultivo para determinar el agente causante. El tratamiento suele durar entre 7 y 14 días, a pesar de que puede ser mayor ante la existencia de osteomielitis (de 4 a 6 semanas), por eso debe adecuarse el tratamiento a las condiciones del paciente.
No se recomienda el uso de antibióticos por vía tópica de forma empírica para el tratamiento de la infección en heridas, ya que no existe evidencia sobre su eficacia16. Además de las posibles resistencias que pueden ocasionar, pueden causar efectos adversos en la piel como irritación de la piel perilesional, erupción cutánea, eccema o afectar negativamente en el proceso de cicatrización de la herida. Algunos antibióticos tópicos (ácido fusídico, mupirocina o neomicina) han demostrado su eficacia en el tratamiento de infecciones superficiales de la piel, como el impétigo o la foliculitis, pero para las heridas infectadas que lo requieran, es necesario un tratamiento antibiótico sistémico. El metronidazol puede ayudar a reducir el olor de la herida16,17, pero su eficacia presenta un nivel de evidencia bajo. Por supuesto, cuando se aplican antibióticos sobre heridas deben aplicarse en el formato adecuado para la vía tópica, evitando utilizar otras formulaciones del producto indicadas para otras vías de administración, porque además de no producir el efecto deseado pueden producir resistencias cruzadas2.
La eficacia del uso de un antibiótico empírico en una herida infectada puede estar afectada por las condiciones del paciente que presenta una úlcera isquémica o un biofilm compuesto por la unión de diferentes microorganismos18.
Para prevenir la infección debe evitarse el uso de antibióticos en heridas que no presentan signos de infección. Se debe realizar un seguimiento de la evolución de la herida para detectar los primeros signos de deterioro e intervenir precozmente, en cuyo caso el primer producto que debemos tener presente son los antisépticos19.
Existen recomendaciones sobre antibióticos que deberían evitarse por la falta de evidencia de su eficacia o por los efectos adversos que pueden producir. Entendemos que estas recomendaciones pueden chocar frontalmente con algunas prácticas muy extendidas hoy en día, pero consideramos necesario discutir dichas prácticas en beneficio de la seguridad/ beneficio del paciente.
No se recomienda el uso de la sulfadiazina argéntica como tratamiento de primera elección en quemaduras de segundo grado superficial2 por su citotoxicidad, la recomendación de no usar antibióticos tópicos por vía tópica de forma empírica en heridas, los efectos secundarios derivados de su absorción y la formación de una capa de complejos difícilmente solubles entre la crema y las proteínas de la herida, aspecto que dificulta su valoración20.
Tampoco existe evidencia del uso de la sulfadiazina argéntica en quemaduras en comparación con antisépticos que contienen plata. Estos últimos sí que parece que mejoran el número de personas que se curan en un período de seguimiento de 21-28 días y pueden reducir unos 3 días de media el tiempo de curación en comparación con la sulfadiazina21.
Antisépticos
A pesar de que existen estrategias a nivel mundial de recomendación del uso de los antibióticos para evitar la resistencia que desarrollan los microorganismos22, se han obviado del gran papel que pueden tener los antisépticos en la prevención y tratamiento de infecciones19.
Los antisépticos no deben utilizarse de forma rutinaria en la limpieza de las heridas crónicas2, pues pueden producir citotoxicidad si no se utilizan adecuadamente. La limpieza debe realizarse con suero fisiológico o agua potable, a no ser que sea necesario controlar la carga bacteriana de la herida.
Ante la aparición de los primeros signos de infección debe considerarse el uso de los antisépticos como primera línea de tratamiento, junto con el desbridamiento de la herida. Tan importante es conocer cuándo deben usarse los antisépticos como cuándo deben dejar de utilizarse. El criterio debe basarse en la valoración de la herida y en su revaluación en períodos de 1-2 semanas. Algunos expertos coinciden en que los antisépticos deberían utilizarse en un período de entre 2 y 6 semanas, a excepción de algunos casos de alto riesgo de infección en los que puede alargarse su aplicación, como en las úlceras del pie diabético19. Existe evidencia de certeza baja, según una revisión Cochrane, en la que el uso de un apósito con antimicrobiano en lugar de uno sin él aumentó el número de úlceras de pie diabético que cicatrizaron a medio plazo23.
En general no existen antisépticos ‘buenos' o ‘malos', sino los que se utilizan correcta o incorrectamente, según sus indicaciones, en la concentración adecuada y con la prescripción de la duración de su tratamiento19.
Los antisépticos están indicados para usarse de forma preventiva o terapéutica en el tratamiento de heridas con los siguientes objetivos20: prevención de la infección en heridas agudas con sospecha de alta carga bacteriana, como una herida traumática o una mordedura; prevención de la infección de la herida quirúrgica; descontaminación de heridas colonizadas por microorganismos multirresistentes; tratamiento de heridas que presentan signos de infección, y preparación para el desbridamiento de la herida.
El nitrofural, que muchos profesionales lo confunden con un antibiótico y que se aplica como un producto ‘comodín' en quemaduras, erosiones y úlceras, no cumple los requisitos de ser un antiséptico eficaz, ni existen datos convincentes que demuestren su eficacia, además del riesgo de toxicidad que comporta, por lo que se desaconseja su uso20.
Los compuestos orgánicos de mercurio o el agua oxigenada se consideran obsoletos.
En este artículo vamos a intentar describir las propiedades de los antisépticos más importantes y su eficacia, tanto en piel sana, con herida, así como frente al biofilm, cuyo resumen puede encontrarse en la tabla 1.
Tabla 1. Resumen de las recomendaciones para la práctica clínica.

SARM: Staphylococcus aureus resistente a la meticilina.
Alcohol
Destruye la membrana celular disminuyendo su tensión superficial, y así desnaturaliza sus proteínas. Tiene un amplio espectro de actuación antimicrobiano frente a bacterias grampositivas, gramnegativas, micobacterias, hongos y virus, aunque no es efectivo frente a esporas24,25.
Existen diferentes presentaciones y graduaciones, aunque se recomiendan concentraciones de entre el 60-90%, porque se ha demostrado su mayor eficacia. El alcohol es uno de los antisépticos que más se combina junto con otros para potenciar su actividad (como la povidona yodada o la clorhexidina), y se ha mostrado muy eficaz en la reducción de microorganismos en las manos en las personas que utilizan soluciones de lavado de manos que lo incluyen en su composición24,26. Se utiliza en piel sana para técnicas invasivas de bajo riesgo. No debe aplicarse en heridas ni mucosas, pues es un producto irritante1,24. No tiene acción por si solo frente al biofilm.
Clorhexidina
El efecto antimicrobiano de la clorhexidina depende de su concentración: en concentraciones bajas inhibe las enzimas asociadas a las membranas de las bacterias ocasionando pérdida del material celular; en altas concentraciones produce una desnaturalización de los componentes citoplasmáticos14. Es eficaz frente bacterias grampositivas, gramnegativas, hongos y virus encapsulados (como el virus de la inmunodeficiencia humana, y los virus de las hepatitis B y C), con peor actividad hacia los no encapsulados (como el virus de la hepatitis A) y sin actividad frente a esporas25,26.
Existen diferentes presentaciones (líquido, gel) y concentraciones (varían del 0,05 al 4%), que se utilizan en función de la situación clínica. A pesar de disminuir la carga bacteriana, no existe evidencia de la eficacia del baño prequirúrgico con clorhexidina al 4% en la disminución de la infección de la herida quirúrgica en comparación con agua y jabón27.
En la campaña Infección Quirúrgica Zero28 se recomendó el uso de clorhexidina alcohólica al 2% en la antisepsia prequirúrgica para la prevención de la infección de la herida quirúrgica, en la línea de la Organización Mundial de la Salud (OMS) y la European Wound Management Association (EWMA)29,30. La guía del American College of Surgeons and Surgical Infection Society recomienda el uso de clorhexidina o povidona alcohólica, aunque en caso de no poder aplicarla en solución alcohólica, recomienda el uso de clorhexidina acuosa en detrimento de la povidona31. Se recomienda para el lavado de manos quirúrgico (solución jabonosa al 2 o al 4 o al 1% con solución alcohólica) y procedimientos invasivos como punción venosa o inserción de catéter vascular (concentraciones al 0,5 y al 2% en base alcohólica)24.
Existen algunos estudios in vitro que muestran que la eficacia de la clorhexidina disminuye en función del grado de madurez del biofilm (menos eficacia cuanto más maduro es el biofilm), aunque su eficacia puede aumentar si se combina con otros compuestos como surfactantes32,33,34. Hay poca evidencia de su eficacia en heridas crónicas.
No se recomienda su aplicación en cirugía oftalmológica ni neuroquirúrgica24.
Hipoclorito sódico/ácido hipocloroso20
Producido por una estabilización del NaOCl/HOCl, ya que la solución acuosa de cloruro de sodio se convierte electroquímicamente para su producción, llamándose también agua electrolizada, en concentraciones del 0,004% de cada producto. El ión OCl- se forma durante la fagocitosis a través de la mediación enzimática y presenta un mecanismo bactericida fisiológico. Se presenta en forma de solución.
In vitro y en ambiente acuoso, sin proteínas o sangre, es altamente efectivo frente bacterias vegetativas, esporas bacterianas, hongos Aspergillus, ovocitos de Cryptosporidium y virus encapsulados. Se puede asumir que la materia orgánica reduce su efectividad, aspecto que puede contrarrestarse irrigando diversas veces.
En humanos, el uso de hipoclorito muestra una disminución de la carga bacteriana en infecciones producidas por S. aureus resistente a la meticilina (SARM) en la piel y la base del cráneo, de SARM, P. aeruginosa y E. coli en úlceras del pie diabético. Fue un buen adyuvante en el tratamiento de infecciones necrosantes de tejidos blandos, osteítis y osteomielitis.
La irrigación dos veces al día durante 9-12 días en pacientes con peritonitis evitó el crecimiento bacteriano a los 3-7 días después de la finalización del tratamiento35. Las complicaciones postoperatorias, incluida la infección de la herida quirúrgica, se redujeron en pacientes con peritonitis sin síntomas de intolerancia19,36.
En heridas crónicas infectadas, la irrigación con hipoclorito es bien tolerada por los pacientes37, incluso en combinación con la terapia de presión negativa19,38.
Existe evidencia débil sobre la eficacia del hipoclorito en la reducción del tiempo de cicatrización (media de 2 días) sobre las quemaduras en comparación con la sulfadiazina argéntica21.
Octenidina20
La octenidina se encuentra disponible en formato solución o gel al 0,05-0,1%, y a veces se asocia con fenoxietanol para potenciar su efecto. Es efectiva frente a bacterias grampositivas y gramnegativas, incluidos SARM, Chlamydia, Mycoplasma y hongos39.
In vitro se ha observado que estimula la fagocitosis y los factores de crecimiento, aspectos que pueden favorecer la cicatrización de la herida.
Se ha mostrado efectiva en la reducción de la carga bacteriana en heridas. Su formato en gel es muy adecuado para la antisepsia de pacientes con quemaduras. En un estudio se mostró más efectiva en la disminución del dolor experimentado por los pacientes en comparación con la sulfadiazina argéntica40.
Se desaconseja su uso en cavidades, así como los lavados peritoneales, su aplicación en cartílago hialino y en estructuras del sistema nervioso central.
Ha demostrado ser muy eficaz in vitro frente al biofilm de P. aeruginosa y S. aureus.
Plata
La plata iónica se considera antimicrobiana en un ambiente acuoso (no en una herida seca), pues ataca a tres componentes celulares: las membranas, los orgánulos citoplasmáticos y al ADN, por lo que las resistencias son poco frecuentes41. Es eficaz frente a bacterias grampositivas y gramnegativas42.
Suele ser uno de los productos que más se combina con apósitos de cura en ambiente húmedo, como los apósitos de alginato, hidrofibra de hidrocoloide o espumas de poliuretano, lo que permite liberar los iones de plata progresivamente en función del exudado de la herida. La eficacia de la plata puede verse afectada por la presencia de aniones, proteínas, sulfuros, iones de cloruro y fosfatos. También es necesario lograr concentraciones de plata de 5 a 50 µg/ml (ppm) para lograr la eliminación de los microorganismos en las heridas14. Las diferentes concentraciones de plata en los apósitos es una de las principales limitaciones que dificulta comparar los estudios20,43. Una revisión Cochrane en heridas tumorales mostró una evidencia débil de que un apósito de espuma con plata puede ser efectivo en la reducción del mal olor44.
En una revisión Cochrane sobre eficacia de antibióticos y antisépticos en úlceras de etiología venosa no se encontraron diferencias entre la eficacia del uso de los apósitos con plata frente a los apósitos sin plata, de sulfadiazina argéntica frente a placebo/cura estándar, ni entre diferentes marcas de apósitos con plata45.
En personas con quemaduras, no hay evidencia de que se curen más pacientes con antisépticos con plata frente a la sulfadiazina argéntica, aunque sí que reducen el tiempo de curación, de media 3,3 días. También existe el formato de plata nanocristalina, que en otra revisión Cochrane mostró evidencia moderada en la reducción media (3,5 días) del tiempo de curación en personas con quemaduras en relación con la gasa vaselinada21.
En el laboratorio14 se encontró que para eliminar el biofilm bacteriano fueron necesarias de 10 a 100 veces más de concentración de plata que para eliminar las bacterias planctónicas de la piel. Mostró efectividad frente a biofilm con P. aeruginosa y S. aureus, dos de las bacterias más presentes en las infecciones nosocomiales.
Polihexanida
La polihexanida (polyhexamethylene biguanide [PHMB]) es un antiséptico que inició su uso como desinfectante. Existe en formato para su aplicación en fomento de heridas al 0,02, 0,04 o 0,1% y en gel y apósitos al 0,1%. En combinación con la betaina (undecylenamicopropyl betaine) su efecto antimicrobiano se potencia. Es eficaz frente a bacterias grampositivas, gramnegativas14, hongos, parásitos y algunos virus46. Es efectiva frente a SARM, enterococo vancomicina resistente y de elección en infecciones producidas por las especies de Acanthamoeba. En las úlceras encontramos unos niveles de pH elevados, que disminuyen el efecto de la povidona yodada, aunque mejoran el de la PHMB, como se ha observado en infecciones producidas por S. aureus y P. aeruginosa20.
Se recomienda su uso en heridas traumáticas y en úlceras infectadas, así como en personas con quemaduras de segundo grado superficial, debido a su potencial efecto analgésico20. Su uso en cavidades tiene las mismas restricciones que la octenidina, pues su fuerte unión a los tejidos hace que se deban tener precauciones hasta que aparezcan más estudios que demuestren su seguridad20.
Existe evidencia moderada sobre la disminución del dolor en paciente con una úlcera por presión con el uso de la PHMB en apósito frente a su uso mediante torunda47.
Una revisión sistemática realizada por To et al.48 encontró que el uso de PHMB favorece la curación de úlceras que no evolucionan, disminuye la carga bacteriana y alivia el dolor relacionado con la herida.
Está contraindicada durante los 4 primeros meses de embarazo por la posibilidad de producir una reacción alérgica. Durante los siguientes meses debe calibrarse el riesgo/beneficio de su uso en la paciente.
La PHMB es efectiva frente al biofilm producido por S. aureus14.
Yodóforos
El antiséptico más utilizado de esta familia es el formato solución de polivinilpirrolidona (povidona) yodada acuosa, en concentraciones que varían del 2 al 10%, aunque también está en base alcohólica, gel y tul de malla hidrófila. Asimismo existe el cadexómero yodado en formato apósito, gránulos y pasta, en concentración al 0,9%, que absorbe el exudado, favorece el desbridamiento autolítico y se libera gradualmente en el lecho de la herida, disminuyendo su posible citotoxicidad14,41.
Es efectivo frente a bacterias grampositivas, gramnegativas, SARM, hongos, virus, protozoos y esporas. Actúa desnaturalizando las proteínas del microorganismo y oxida los nucleótidos de la membrana celular14,49. En personas sin afectación de la tiroides no se recomienda su uso durante más de 7 días a causa del riesgo de disfunción tiroidal20.
La guía del American College of Surgeons and Surgical Infection Society recomienda el uso de povidona o clorhexidina, ambas con base alcohólica, siempre que no exista contraindicación, para la prevención de la infección de la herida quirúrgica31.
En una revisión Cochrane sobre el uso de antibióticos y antisépticos en úlceras de etiología venosa45 se curaron más pacientes a los que se aplicó cadexómero respecto a los que recibieron cuidados estándar durante 12 semanas, aunque estas diferencias no se encontraron cuando se comparó con personas que se curaron con apósito hidrocoloide, gasa de parafina, dextranómero y apósitos con plata. No se detectaron diferencias en la tasa de curación de úlceras con el uso de povidona frente a apósitos de cura en ambiente húmedo en función del exudado de la herida.
En una revisión sistemática realizada por Woo et al.50, encontraron que el uso de cadexómero reducía el nivel de exudado, esfacelo, pus, carga bacteriana e infección de heridas crónicas en comparación con los cuidados habituales.
Su uso en cavidades debe hacerse con precaución, pues si se utiliza con frecuencia debe analizarse la función tiroidal en pacientes con bocio o alguna patología tiroidal conocida20.
Está contraindicado el uso de cadexómero yodado en personas con tiroiditis de Hashimoto, embarazadas, lactantes y edad inferior a 12 años20,51.
In vitro, la povidona yodada ha mostrado efectividad frente al crecimiento de biofilms de Staphylococcus epidermidis, S. aureus y una combinación de SARM y Candida albicans49. El cadexómero yodado también ha mostrado, en investigación animal, su eficacia frente a biofilms de S. aureus y P. aeruginosa20.
Agentes ‘antibiofilm'
Ante la facilidad con que se regenera el biofilm, algunos compuestos han mostrado in vitro que pueden ser unos aliados perfectos para retrasar o evitar esta regeneración. Productos como la lactoferrina52,53, el xylitol54 o el ácido etilendiaminotetraacético (EDTA)55, que combinados con apósitos de cura en ambiente húmedo y otros compuestos, como la plata, pueden ser una buena alianza para eliminar y evitar la regeneración del biofilm.
RECOMENDACIONES PARA LOS INVESTIGADORES
El campo de los antimicrobianos, a pesar de ser muy utilizado y accesible, incluso por parte de la población general, muestra una falta de evidencias consistentes en algunos aspectos. Por estos motivos animamos a investigar en:
Existen prácticas de la aplicación y uso de los antimicrobianos muy extendidas y arraigadas en la práctica clínica que no disponen de ninguna base científica. Investigar sobre estas intervenciones les otorgará la fortaleza necesaria para recomendarlas o desaconsejarlas en la práctica clínica.
Pocos estudios comparan la efectividad de los antimicrobianos entre sí en igualdad de condiciones. Es necesario la realización de estudios en los que se compare la eficacia entre distintos antimicrobianos para realizar recomendaciones en un sentido u otro.
El cambio de paradigma en el diagnóstico de infección de las heridas crónicas hace que el diagnóstico microbiológico tradicional sea insuficiente. Es necesario desarrollar algún método diagnóstico que se convierta en el gold standard para el diagnóstico de infecciones producidas por biofilm, tanto para detectarla como para identificar qué microorganismos son los responsables.
La mayoría de los estudios sobre la eficacia/efectividad de los productos antimicrobianos frente al biofilm se han realizado in vitro. Deberían realizarse estudios en la clínica para demostrar esta efectividad.














