Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Revista Española de Salud Pública
versión On-line ISSN 2173-9110versión impresa ISSN 1135-5727
Rev. Esp. Salud Publica vol.74 no.4 Madrid jul./ago. 2000
EFECTIVIDAD Y DURACIÓN DE LA INMUNIDAD DE LA VACUNA FRENTE AL MENINGOCOCO SEROGRUPO A Y C
Luis García Comas (1), Rosa Ramírez Fernández (1), Rosario Castañeda López (1), Juan Carlos Sanz Moreno (1), Julio Vázquez Moreno (2), Mª Dolores Lasheras Carbajo (1), Dolores Barranco Ordoñez (1), Jesús Ruiz Contreras (3), y José Jover Ibarra (1).
(1) Dirección General de Salud Pública. Consejería de Sanidad. Comunidad de Madrid.
(2) Centro Nacional de Microbiología. Instituto de Salud Carlos III. Ministerio de Sanidad y Consumo.
(3) Hospital 12 de Octubre. Servicio de Pediatría. Madrid.
| RESUMEN FUNDAMENTO: La Comunidad de Madrid detectó a partir de 1995 un incremento del número de casos de enfermedad meningocócica por serogrupo C. En 1997 se realizó una campaña de inmunización masiva sobre la población de 18 meses a 19 años. El objetivo de este estudio es conocer la respuesta inmunitaria producida por la vacuna y su relación con la edad. MÉTODOS: Se seleccionó una muestra de 1.003 niños vacunados durante la campaña. Se extrajo una muestra de sangre antes de la vacunación y tras uno, seis (solo <5a) y doce meses. Para valorar la respuesta inmune se midieron niveles de anticuerpos bactericidas y totales. RESULTADOS: La prevalencia de seroconversión medida por anticuerpos bactericidas es 89,6%. La respuesta es baja en menores de 3 años (34,8%), aumenta con la edad y a partir de los 7 años supera el 90%. A los 6 meses, la prevalencia de niveles protectores en menores de 5 años desciende notablemente (31,3%). Al año, la prevalencia desciende notablemente, especialmente en menores de 7 años. La proporción de individuos con respuesta de anticuerpos totales al mes supera el 90% y se mantiene elevada al año en todos los grupos edad (97,5%). CONCLUSIONES: La respuesta medida mediante anticuerpos totales entra en contradicción con la respuesta clínica a la vacunación y la medida mediante anticuerpos bactericidas infraestima la protección si se compara con los resultados de efectividad vacunal, por lo que es necesario buscar indicadores biológicos que se correlacionen de manera adecuada con la respuesta clínica tras la vacunación. Palabras clave: Vacuna antimeningocócica. Meningococcal polysaccharide vaccine. Humoral immune response | ABSTRACT Effectivity and Duration of the Immunity of the Serogroup A and C Meningococcal Vaccine BACKGROUND: In 1995 the Community of Madrid detected an increase in the number of cases of meningococcal disease caused by serogroup C. In 1997 a mass vaccination campaign was carried out in relation to the population between 18 months and 19 years of age. The purpose of this study is to ascertain the immune response produced by the vaccine and its relationship to the age of the subjects. METHODS: A sample group of 1,003 children vaccinated during the campaign was selected. A blood sample was extracted prior to vaccination and after one, six (only <5a) and twelve months had transpired. In order to assess the immune response, the levels of bactericidal and total antibodies were measured. RESULTS: The prevalence of seroconversion measured by bactericidal antibodies is 89.6%. The response is low in children under 3 (34.8%), increases with age and, from 7 years on, surpasses the 90% mark. After 6 months, the prevalence of protective levels in children under 5 years of age drops noticeably (31.3%). After one year, the prevalence drops significantly, particularly in children under 7 years of age. The proportion of individuals with total antibody response after one month is over 90%, and remains high after one year in all of the age groups (97.5%). CONCLUSIONS: The response measured by means of total antibodies contradicts the clinical response to the vaccination and the measurement by means of bactericidal antibodies underestimates the protection if it is compared with the results of vaccinal efficacy, for which reason, we need to search for biological indicators that would correlate adequately with the clinical response following immunisation. Key Words: Meningococcal vaccine. Meningococcal polysaccharide vaccine. Humoral immune response |
INTRODUCCION
La Comunidad de Madrid detectó a partir de 1995 un incremento paulatino y sostenido del número de casos de enfermedad meningocócica por serogrupo C. La tasa de incidencia para dicho serogrupo se multiplicó por 7,5 al comparar el período 1991-1995 con 1996 y por 3,2 al comparar el primer semestre de 1996 con el mismo período de tiempo de 19971. En líneas generales, la situación se caracterizó por un aumento de la incidencia en grupos de edad en los que la vacuna era eficaz, por una alta letalidad, por una amplia distribución geográfica que impidió intervenciones dirigidas a colectivos definidos y por el cambio en la cepa circulante por una nueva cepa de serogrupo C (2b:P1.2,5). Ante esta situación, la Consejería de Sanidad y Servicios Sociales de la Comunidad de Madrid decidió iniciar, en colaboración con otras Instituciones (Insalud y Ayuntamientos), una campaña de vacunación. La población diana de dicha campaña fue la comprendida entre 18 meses y 19 años de edad y se llevó a cabo entre el 22 de septiembre y el 14 de noviembre de 1997.
La vacuna de polisacárido capsular frente al meningococo serogrupo A y C se ha utilizado de forma extensa en el control de brotes epidémicos de enfermedad meningocócica del serogrupo C y en intervenciones poblacionales masivas, tanto en España como en otros países2-7. De estas experiencias se han obtenido resultados desiguales en relación a la eficacia de la seroconversión por edades y en la duración de la inmunidad, especialmente en el grupo de menores de 5 años8-11, no existiendo resultados concluyentes en la relación entre nivel de anticuerpos y protección clínica. Sin embargo, la información disponible apunta a que el grado de protección clínica es superior a lo que estrictamente reflejaría el nivel de anticuerpos12.
Por las razones señaladas con anterioridad, se consideró de especial interés la realización de una serie de estudios que aportasen los elementos necesarios para evaluar la medida adoptada a nivel poblacional, entre ellos el presente estudio, cuyo objetivo es conocer la respuesta inmunitaria de la vacuna frente a meningococo de serogrupo C y su relación con la edad en la población de 18 meses a 19 años de edad. El estudio se llevó a cabo con la aprobación del Comité de Ética de la Comunidad de Madrid.
MATERIAL Y MÉTODOS
Se ha seleccionado una muestra de individuos residentes en la Comunidad de Madrid entre 18 meses y 19 años de edad y que habían aceptado previamente ser vacunados con la vacuna antimeningocócica A+C. La muestra se obtuvo previo consentimiento informado de cada uno de los participantes o persona responsable. Han participado 28 centros educativos, tanto públicos como privados, seleccionados de manera oportunista en base al tamaño del centro escolar, a las características de la población cubierta y al área sanitaria de localización. También han participado en la captación de niños menores de 5 años los pediatras de 4 Centros de Salud del Insalud. El tamaño muestral se ha determinado en base a la prevalencia de seroconversión medida mediante títulos de anticuerpos bactericidas descrita en la literatura científica (del 50% para el grupo de 18 meses a 4 años de edad, del 60% para 5 a 9 años y del 85% para mayores de 9 años) con un intervalo de confianza del 95%, un error del 5%. La muestra se ha estratificado dentro de cada grupo por edad y sexo. Se excluyeron del estudio todos los niños que presentaban patologías o condiciones que afectaban a la respuesta inmune: inmunodeficiencias congénitas, infección por VIH, tratamientos inmunosupresores administrados en los últimos 3 meses, tratamiento con esteroides orales o parenterales, de más de una semana de duración, a dosis iguales o mayores a 2 mg/kg/día o 20 mg/día de prednisona durante los últimos tres meses y síndrome nefrótico activo. También se excluyeron a los niños que habían recibido vacuna antimeningocócica A+C previamente a la campaña, los que no residían en la Comunidad de Madrid y los que, por alguna razón, no fuera posible obtener la muestra postvacunal.
La pauta de vacunación fue idéntica a la de la población que no participó en el estudio y ha consistido en una dosis única de 0,5 ml de vacuna reconstituida antimeningocócica A+C, utilizando indistintamente en la vacunación la vacuna Mencevax AC (Laboratorio SmithKline Beechan) y la vacuna antimeningocócica A+C (Laboratorio Pasteur- Merieux MSD).
Se recogió información sobre variables que pueden condicionar la seroconversión o que están en relación con un mayor riesgo de infección, pero que no son motivo de exclusión del estudio (tamaño de la familia, número de miembros en la familia que superan los 20 años, pertenencia a colectivo del individuo seleccionado).
Para evaluar la respuesta inmune se obtuvo una muestra de sangre previa a la vacunación en el mismo acto de la vacunación, una segunda muestra al mes de la vacunación (28 días + 2 días), una tercera a los 6 meses + 7 días (sólo en menores de 5 a ños) y una cuarta al año + 7 días. La extracción se ha realizado de forma indolora mediante la aplicación de crema anestésica tópica EMLA (Laboratorio Astra), cubierta con esparadrapo oclusivo en el sitio de la inyección, al menos una hora antes de la extracción. El suero se ha procesado en el Laboratorio de Referencia de Meningococos del Centro Nacional de Microbiología. En el estudio se utiliza el Ensayo Bactericida, que determina el nivel de anticuerpos bactericidas y posteriormente el ELISA para determinación de anticuerpos totales antipolisacárido C. Se consideraron niveles protectores los título mayor o igual a 1:8 en el ensayo bactericida y una concentración mayor o igual a 2 ug/ml de anticuerpos totales por enzimoinmunoensayo13,14. La seroconversión se ha medido al mes de la vacunación y se ha definido como el incremento en 4 veces del título de anticuerpos bactericidas (o de la concentración de anticuerpos en el caso de anticuerpos totales) en relación al título de la muestra prevacunal o la conversión a positivo de un suero previamente negativo. En ambas técnicas se han usando como sueros control, sueros suministrados por el Center for Disease Control (CDC) de Atlanta, en los que ha establecido previamente, la actividad bactericida y la concentración de anticuerpos totales.
Se ha estimado la tasa de permanencia en el estudio (proporción de personas que se mantienen en el estudio y acuden para que se les realice las diferentes extracciones programadas). Se ha calculado la prevalencia y el IC 95% de anticuerpos bactericidas y totales antes de la vacunación, la prevalencia de seroconversión al mes y la prevalencia de individuos que mantienen niveles protectores de anticuerpos a lo largo del seguimiento entre aquéllos que seroconvirtieron al mes. Se ha estimado la prevalencia global y por grupos de edad y se han comparado los valores obtenidos mediante la prueba de Ji cuadrado.
RESULTADOS
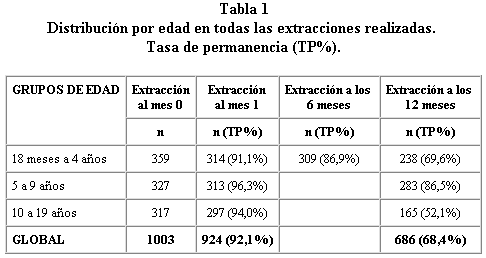
El tamaño final de la muestra fue de 1.003 personas. El 52% eran varones y el 48% mujeres. La tabla 1 incluye la distribución de la muestra por edad en las diferentes extracciones. La tasa de permanencia fue del 92,1% al mes de la vacunación, del 86,9% en los menores de 5 años a los 6 meses y del 68,4% al año de la vacunación (tabla 1). La tasa de permanencia más elevada se ha observado en el grupo de edad de 5 a 9 años, en todas las extracciones previstas en el estudio.
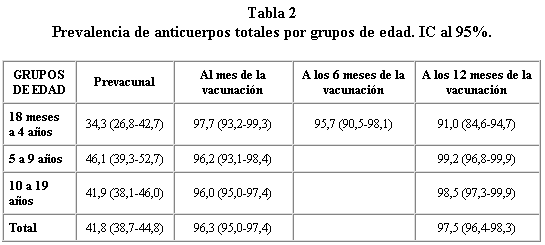
En la muestra prevacunal se observa que el 41,8% de la población comprendida entre 18 meses y 19 años de edad muestran anticuerpos totales frente a Neisseria; no apareciendo ningún patrón específico por edad (tabla 2). Al mes de la vacunación se produce un incremento significativo en la prevalencia de anticuerpos totales frente a Neisseria en todos los grupos etarios. Este aumento se mantiene al año de realizada la vacunación, independientemente de la edad de los participantes en el estudio (tabla 2).
Los anticuerpos bactericidas muestran un patrón distinto al de los anticuerpos totales (tabla 3), observándose, en líneas generales, diferencias importantes en la prevalencia con la edad. En la muestra prevacunal el 7,2% de la población entre 18 meses y 19 años de edad presentan anticuerpos bactericidas frente a Neisseria. La prevalencia de anticuerpos es más elevada en el grupo de edad de 10 a 19 años. En este grupo de edad se ha detectado en el 10,3% anticuerpos bactericidas, siendo este valor del 1,6% en el grupo de edad de 18 meses a 4 años.

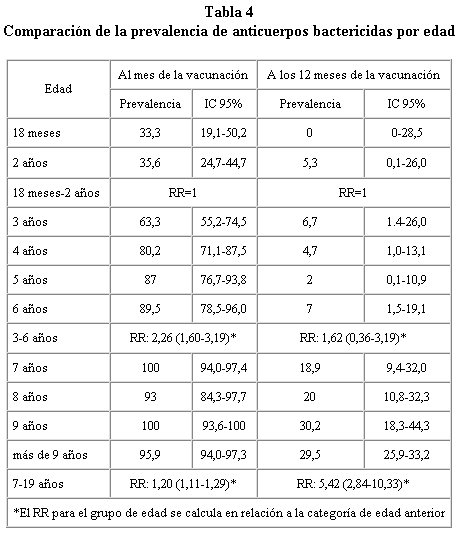
La prevalencia de seroconversión medida mediante títulos de anticuerpos bactericidas ha sido del 89,6% para el conjunto de la población estudiada al mes de la vacunación. La tasa de seroconversión se va incrementando con la edad, siendo del 56,7% para el grupo de edad de 18 meses a 4 años y superando el 90% en el resto de grupos de edad. La prevalencia de anticuerpos bactericidas a los 12 meses de la vacunación es baja en todos los grupos de edad y especialmente en los menores de 4 años. Sin embargo las cifras de prevalencia de anticuerpos se mantienen más elevadas que en la muestra prevacunal. En la tabla 4 se incluyen la prevalencias de anticuerpos bactericidas año a año de edad. En esta tabla se observa que la seroconversión aumenta con la edad. Este aumento se observa hasta los 7 años y a partir de este momento no se evidencian variaciones destacables.
DISCUSIÓN
Durante el estudio la participación de la población fue buena y se consiguió una tasa global de permanencia del 92,1% en la extracción al mes de la vacunación, del 86,9% en los menores de 5 años a los 6 meses de la vacunación y del 68,4% a los 12 meses de la vacunación. Las personas mayores de 10 años son las que tienen la tasa de permanencia más baja y esto se debe a que en este grupo es en el que se producen más pérdidas por cambio de domicilio y por cambio en el centro de enseñanza.
Una proporción importante de la población (7,2%) presenta anticuerpos bactericidas frente a Neisseria en la muestra prevacunal. La prevalencia de anticuerpos bactericidas se incrementa con la edad, detectándose anticuerpos únicamente en el 1,6% de los niños menores de 5 años y en el 10,3% en los mayores de 10 años. Esta prevalencia está indicando la proporción de personas que han tenido contacto previo con alguna especie de Neisseria (patógena o saprófita) en la comunidad. Este patrón, caracterizado por el incremento de la prevalencia de anticuerpos bactericidas con la edad, concuerda con lo observado por algunos autores en portadores nasofaríngeos en diferentes comunidades y/o países15,16 y con algunos estudios sobre respuesta inmune tras la administración de una dosis de vacuna17.
La eficacia de la seroconversión (medida por los títulos de anticuerpos bactericidas a los 28 días de la vacunación) ha sido del 89,6% y es parecida a la descrita por otros estudios10,17, aunque en nuestro caso al tener un tamaño muestral más elevado obtenemos una menor variabilidad de la medida.
En el grupo de edad de 18 meses a 4 años de edad han seroconvertido el 56,7% (IC: 53,4-64,9). Estas cifras son semejantes a las publicadas por otros estudios que obtienen seroconversiones próximas al 50%. La respuesta inmune a la administración de la vacuna meningocócica de polisacárido capsular desciende con la edad, siendo la tasa de seroconversión en los niños de 18 meses y 2 años de edad de 33,3 y 35,6% respectivamente.
En el grupo de edad de 5 años a 9 años han seroconvertido el 94,0% (IC: 89,7-96,5). En este grupo se observa una mejor respuesta en los niños de más edad, obteniéndose seroconversiones superiores al 90% en los mayores de 7 años. A partir de los 7 años de edad la respuesta a la vacuna no sufre modificaciones al aumentar la edad.
En el grupo de 10 a 19 años se producen tasas de seroconversión elevadas en todas las edades, siendo para el conjunto del grupo del 95,8% (IC 94,0-97,3). Estas cifras coinciden con las obtenidas por otros autores10, que ya habían constatado la buena respuesta tras la vacunación en niños mayores y adultos jóvenes.
Al año de la vacunación se aprecia una protección escasa en todas las edades y especialmente en menores de 7 año. Sin embargo la proporción de individuos que mantienen niveles protectores de anticuerpos bactericidas es superior a la detectada antes de la vacunación.
Cuando se utiliza como indicador de protección los anticuerpos totales llama especialmente la atención, como aspectos diferenciadores frente a los anticuerpos bactericidas: el que se produzca un patrón de protección independiente de la edad y que al año de la vacunación no se observen descensos en la proporción de personas protegidas. Posiblemente estas diferencias se deban a que la técnica ELISA detecta anticuerpos de baja avidez que no es capaz de detectar el ensayo bactericida. No existen estudios sobre la influencia de estos anticuerpos de baja avidez sobre la protección frente a la enfermedad meningocócica.
El uso como indicador de protección de los anticuerpos bactericidas probablemente sea más adecuado que la concentración de anticuerpos totales, ya que la influencia de la edad en la adquisición de niveles protectores de anticuerpos bactericidas es compatible con la relación entre la efectividad de la vacuna y la edad. Dicha relación puede explicarse por el proceso de maduración del sistema inmunitario. Sin embargo, es evidente, al comparar con los datos obtenidos por la efectividad vacunal que la protección medida por anticuerpos bactericidas infraestima la protección real.
Los indicadores utilizados, habitualmente para medir la protección de esta vacuna de polisacárido capsular, no parecen ser los adecuados. En el caso de los anticuerpos totales porque sus resultados entran en contradicción con la respuesta clínica de los individuos a la vacunación y en los anticuerpos bactericidas por infraestimar la protección real de la vacuna; debiéndose realizar un mayor esfuerzo en la búsqueda de indicadores biológicos que se correlacionen de manera adecuada con la respuesta clínica tras la vacunación.
BIBLIOGRAFÍA
1. Boletín Epidemiológico de la Comunidad de Madrid. Informe: La Enfermedad Meningocócica en la Comunidad de Madrid. 1997. Vol 5, núm 4, abril 1997 [ Links ]
2. Boletín epidemiológico de la Comunidad Autónoma de Galicia.
3. Informe de la Comunidad Autónoma de Cantabria
4. Walen CM, Hockin JC, Ryan A, Ashton F. The chaging epidemiology of invasivemeningococcal disease in Canada, 1985 throuhg 1992. Emergence of a virulent clone of Neisseria meningitidis. JAMA 1995;273:390-394. [ Links ]
5. Mundord RS, Risi BJ, Antezana E, Feldman RA. Epidemic disease due to serogroup C Neisseria meningitidis in Sao Paulo Brazil. J Infect Dis 1974; 129:568-571. [ Links ]
6. Kriz P, Vlckova J, Bobak M. Targeted vaccination with meningococcal polysaccharide vaccine in one district of the Czech Republic. Epidemiol Infect 1995; 115:411-418. [ Links ]
7. Jackson LA, Schuchat A, Reeves MW, Wenger JD. Serogroup C meningococcal Outbreaks in the United States. An Emerging Threat. JAMA 1995;273:383-389. [ Links ]
8. Mitchell L., Ochnio J., Glover C., Lee A., Ho M., and Bell A. Analysis of Meningococcal Serogroup C-specific Antibody Levels in British Columbian Children and Adolescents. J Infec Dis 1996, 173:1009-13. [ Links ]
9. Nieminen T., Kayhty H. and Kantelf A.. Circulating Antibody Secreting Cells and Humoral Antibody Response after Parenteral Inmunization with a Meningococcal Polysaccharide Vaccine. Scand J Infect Dis 1996, 28:53-58. [ Links ]
10. King W. et al. Total and funtional antibody response to a quadrivalent meningococcal polysaccharide vaccine among children. Pediatrics 1996; 128:196-202. [ Links ]
11. Lieberman J. et al. Safety and Immunogenicity of a Serogroups A/C Neisseria meningitidis Oligosaccharide- Protein Conjugate Vaccine in young Children. JAMA 1996; 275:1499-1503. [ Links ]
12. De Wals P, Dionne M, Douville-Fradet M, Boulianne N, et al. Impact of a mass inmunization campaign serogroup C meningococcus in the Province of Quebec, Canada. Bull WHO 1996; 74(4): 407-11. [ Links ]
13. Maslanka SE, Gheesling LL, Libutti D et al. Standardization and multilaboratory comparasion of Neisseria meningitidis serogroup A and C serum bacterial assays. Clin Diagn Lab Immunol 1997; 4. [ Links ]
14. Gheesling LL, Carlone GM, Pais L et al. Multicenter comparison of Neisseria meningitidis serogroup C anti-capsular poly saccharide antibody levels measured by a standardized enzyme-linked immunosorbent assay. J Clin Microbiol 1994, 32 (6):1475-1482. [ Links ]
15. González Enríquez J, García Comas L, Alcaide Jiménez JF, Sáenz Calvo A y Conde Olasategui J. Eficacia de la vacuna meningocócica de polisacárido capsular del grupo C. Rev Esp Salud Pública 1997; 71: 103-126. [ Links ]
16. Goddscheneider I, Gotschlich EC, Artenstein MS. Human inmunity to the meningococcus. I the role of humoral antibodies. J Exp Med 1969; 129:1307-1326. [ Links ]
17. Apicella MA. Neisseria meningitidis. En Mandell GL, Douglas RG, Bennett JE(eds). Principles and practice of Infectious Diseases. 4? Ed. New York: Churchill Livingstone; 1995. [ Links ]














