Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Revista Española de Salud Pública
versión On-line ISSN 2173-9110versión impresa ISSN 1135-5727
Rev. Esp. Salud Publica vol.79 no.2 Madrid mar./abr. 2005
COLABORACIÓN ESPECIAL
CAMBIO CLIMÁTICO EN ESPAÑA Y RIESGO DE ENFERMEDADES
INFECCIOSAS Y PARASITARIAS TRANSMITIDAS POR ARTRÓPODOS
Y ROEDORES
Rogelio López-Vélez (1), Ricardo Molina Moreno (2)
(1) Unidad de Medicina Tropical. Servicio de Enfermedades Infecciosas. Hospital Ramón y Cajal. Madrid.
(2) Unidad de Entomología Médica, Servicio de Parasitología, Centro Nacional de Microbiología. Instituto de Salud Carlos III. Majadahonda, Madrid.
|
RESUMEN Por la proximidad con el continente africano, siendo lugar de tránsito obligado de aves migratorias y personas, y por las condiciones climáticas, cercanas a las de zonas donde hay transmisión de enfermedades vectoriales, España es un país en el que este tipo de enfermedades podrían verse potenciadas por el cambio climático. El posible riesgo vendría por extensión geográfica de vectores ya establecidos o por la importación e instalación de vectores sub-tropicales adaptados a sobrevivir en climas menos cálidos y más secos. Hipotéticamente, las enfermedades vectoriales susceptibles de ser influidas por el cambio climático en España serían aquellas transmitidas por dípteros como dengue, encefalitis del Nilo occidental, fiebre del valle del Rift, malaria y leishmaniosis; las transmitidas por garrapatas como la fiebre de Congo Crimea, encefalitis por garrapata, enfermedad de Lyme, fiebre botonosa y fiebre recurrente endémica; y las transmitidas por roedores. Pero la mayor y más factible amenaza sería la instauración del mosquito Aedes albopictus, que sería capaz de transmitir enfermedades virales como la del Nilo occidental o el dengue. Pero para el establecimiento de auténticas áreas de endemia se necesitaría la conjunción de otros factores, tales como el aflujo masivo y simultáneo de reservorios animales o humanos y el deterioro de las condiciones socio-sanitarias y de los servicios de Salud Pública. Palabras clave: Cambio climático. Clima. Enfermedades infecciosas y parasitarias. Vector. Control vectorial. España. |
ABSTRACT Climate Change in Spain and Risk of Infectious and Parasitic Diseases Transmitted by Arthropods and Rodents Due to Spain's being located near Africa, being a stopping-off point for migrating birds and individuals and due to its climate conditions, nearing those of areas where there are vector-borne diseases, this is a country where this type of diseases could taken on greater importance due to the climate change. The possible risk would result from the geographical spread of already established vectors or due to subtropical vectors adapted to surviving in cooler, dried climates being imported and taking up residence. Hypothetically, the vector-borne diseases subject to be influenced by the climate change in Spain would be those transmitted by dipterans, such as dengue fever, West Nile encephalitis, Rift Valley fever, malaria and leishmaniasis; tick-transmitted diseases, such as Crimean-Congo hemorrhagic fever, tick-borne encephalitis, Lyme disease, spotted fever and endemic relapsing fever; and rodent-transmitted diseases. But the greatest, most viable threat would be the Aedes albopictus mosquito, which would be capable of transmitting viral diseases such as West Nile encephalitis or dengue fever, taking up residence. But, for actual areas of endemia being established, a combination of other factors, such as the massive, simultaneous influx of animal or human reservoirs and the deterioration of the social healthcare conditions and of the Public Health services. Key words: Climate change. Communicable diseases. Vector control. Spain. |
Correspondencia:
Rogelio López-Vélez.
Medicina Tropical. Enfermedades Infecciosas.
Hospital Ramón y Cajal. Carretera de Colmenar Km 9,1.
28034 Madrid.
Correo electrónico: rlopezvelez.hrc@salud.madrid.org
INTRODUCCIÓN
La emergencia o reemergencia de la mayor parte de enfermedades infecciosas está condicionada por cambios evolutivos y medioambientales que pueden afectar a una gran variedad de factores intrínsecos y extrínsecos. Entre los primeros se encuentra todo lo concerniente a la interacción entre el patógeno y su vector, su hospedador intermediario y su reservorio (infección, virulencia, inmunidad y transmisibilidad). Entre los segundos se agrupan todos los factores que modulan las relaciones del patógeno, vector y hospedador/es con las condiciones medioambientales (clima, condiciones meteorológicas, hábitats, ecosistemas, urbanización, contaminación).
Los cambios climáticos en concreto parecen influir sobre la distribución temporal y espacial así como sobre la dinámica estacional e interanual de patógenos, vectores, hospedadores y reservorios. El fenómeno de «El Niño/oscilación austral» (ENOA) es el ejemplo más conocido de variabilidad climática natural y se asocia a un aumento del riesgo epidemiológico de ciertas enfermedades transmitidas por mosquitos, sobre todo de la malaria. Se ha observado que durante el fenómeno de El Niño aumentan en un 30% los casos de malaria en Venezuela y Colombia, los casos se multiplican por cuatro en Sri Lanka y aparecen en el norte de Pakistán. Se han registrado incrementos de casos de dengue en las islas del Pacífico, sureste de Asia y Sudamérica. También aumentan los casos de encefalitis del valle de Murray y enfermedad por el virus del río Ross en Australia, así como los casos de fiebre del Valle del Rift en África del este1,2. La incidencia de leishmaniosis visceral aumentó en un 39% y 33% en 1989 y 1995 respectivamente tras las oscilaciones climáticas de El Niño en el estado de Bahía (Brasil)3. Muy ilustrativo es lo que ocurrió en California durante el verano de 1984: coincidiendo con un exceso de lluvias y de un invierno más cálido durante los meses de enero-febrero, al que siguió una sequía y altas temperaturas (que alcanzaron los 30ºC) en julio se produjo un brote de encefalitis de San Luis asociado a una proliferación de mosquitos del género Culex4 (este tipo de climas, con inviernos lluviosos y cálidos, seguidos de veranos calurosos y secos se asemejan a las predicciones de cambio en España). Y más recientemente, la introducción por aves migratorias de la encefalitis del Nilo Occidental (West Nile) en Nueva York y su posterior diseminación a gran parte de EE.UU. nos demuestra cómo enfermedades inesperadas pueden emerger.
SUSCEPTIBILIDAD AL CLIMA ACTUAL. CAPACIDAD VECTORIAL:
EFECTOS DE LA TEMPERATURA, PLUVIOSIDAD Y OTROS FACTORES
Cambios de temperatura, precipitaciones o humedad afectan a la biología y ecología de los vectores, así como a la de los hospedadores intermediarios o la de los reservorios naturales 5. Además, las formas de asentamiento humano también podrían influir: el dengue es una enfermedad básicamente urbana y tendrá mayor incidencia en las comunidades muy urbanizadas con un sistema deficiente de eliminación de aguas residuales y desechos sólidos. Clásicamente, una de las expresiones matemáticas más utilizadas, inicialmente por los malariologos, para cuantificar la capacidad vectorial C de un artrópodo se ha definido como sigue:
![]()
donde m es la densidad del artrópodo vector por humano, a la tasa diaria de picaduras sobre un hospedador vertebrado multiplicado por la probabilidad de que ese vertebrado sea un humano, p la tasa de supervivencia diaria de un vector y n el periodo latente del patógeno en el artrópodo vector (incubación extrínseca).
Efectos de la temperatura
La temperatura es un factor crítico del que depende tanto la densidad vectorial como la capacidad vectorial: aumenta o disminuye la supervivencia del vector, condiciona la tasa de crecimiento de la población de vectores, cambia la susceptibilidad del vector a los patógenos, modifica el período de incubación extrínseca del patógeno en el vector y cambia la actividad y el patrón de la transmisión estacional.
Al aumentar la temperatura del agua, las larvas de los mosquitos tardan menos tiempo en madurar y, en consecuencia, se aumenta el número de crías durante la estación de transmisión. Se acorta el período de metamorfosis huevo-adulto, reduciéndose el tamaño de las larvas y generándose adultos en un tiempo más corto, pero estos son más pequeños, por lo que las hembras tienen que tomar sangre con más frecuencia para llegar a poner huevos, lo que resulta en un aumento de la tasa de inoculación. El período de incubación extrínseco (tiempo que tarda el artrópodo desde que se infecta hasta que es infectante) guarda una relación directa con la temperatura: a mayor temperatura el tiempo es menor.
Muy probablemente, el efecto del cambio climático sobre las enfermedades transmitidas por artrópodos se observará al variarse los límites de temperatura de transmisibilidad: 14-18ºC como límite inferior y 35-40ºC como superior. Un mínimo aumento del límite inferior podría dar lugar a la transmisión de enfermedades, mientras que un incremento del superior podría suprimirlo (por encima de los 34ºC se acorta sustancialmente la vida del mosquito). Sin embargo, en torno a los 30-32ºC la capacidad vectorial puede modificarse sustancialmente, ya que pequeños incrementos de temperatura acortan el período de incubación extrínseca, aumentándose la transmisibilidad.
El clima influye de forma decisiva sobre la fenología de una gran parte de artrópodos que incluso entran en letargo (diapausa) en la estación desfavorable, comportamiento este muy generalizado en las especies de la región Paleártica. El periodo de actividad estacional de muchas especies puede ampliarse cuanto más se prolonguen las condiciones climáticas favorables.
Efectos de la pluviosidad
Un aumento de las precipitaciones podría aumentar el número y la calidad de los criaderos de vectores y la densidad de vegetación que proporcionaría ecosistemas donde posarse, donde mejor vivir al abrigo y con más alimento los roedores hospedadores intermediarios. Las inundaciones, por el contrario, eliminarían el hábitat de vectores y vertebrados, pero obligarían a los vertebrados a un contacto mas estrecho con los humanos. Las sequías en lugares húmedos enlentecerían los cursos de los ríos, creándose remansos que también aumentarían los sitios de cría y propiciarían a una mayor deshidratación del vector, lo que le obligaría a alimentarse más frecuentemente, en otras palabras, a aumentar el número de picaduras.
Otros factores
La urbanización incrementa la densidad de hospedadores humanos susceptibles, con peores condiciones de higiene en los países pobres, lo que aumenta la tasa de transmisibilidad para el mismo número de vectores. Además, el desarrollo urbano en los extrarradios cercanos a zonas rurales o boscosas puede dar lugar a un aumento de contacto entre el hombre, vectores y reservorios selváticos. La deforestación permite la entrada de humanos en el bosque y reconvierte la superficie en terreno agrícola, lo que aumenta el número de posibles criaderos de vectores y el contacto del hombre con reservorios y vectores. Los planes de irrigación y abastecimiento de aguas incrementan la superficie acuática y previenen inundaciones y sequías, lo que también aumenta los criaderos de vectores. Los planes de intensificación agrícola aumentan la erosión del terreno, la superficie de agua y reducen la biodiversidad, con lo que se pueden reducir los predadores de vectores y aumentar los lugares de cría vectorial. La contaminación química por fertilizantes, pesticidas, herbicidas y residuos industriales pueden disminuir el sistema inmune humano, haciéndolos más susceptibles a las infecciones. El incremento del comercio internacional puede acarrear la importación de vectores desde lugares remotos. Los movimientos de poblaciones por razones de turismo, trabajo o inmigración traen la importación de enfermedades desde zonas endémicas.
IMPACTOS DE LAS VARIACIONES CLIMÁTICAS EN LAS
ENFERMEDADES TRANSMITIDAS POR VECTORES
Enfermedades transmitidas por dípteros
Malaria
La transmisión natural de esta enfermedad se realiza mediante la picadura de hembras de mosquitos del género Anopheles. De las más de 3.000 especies de mosquitos distribuidos por todo el mundo (sobre todo por zonas templadas y tropicales), 400 son anofelinos, 70 transmiten la malaria y sólo unas 40 son de importancia médica: Anopheles gambiae y Anopheles funestus son los principales vectores en África tropical. Estos insectos sufren una metamorfosis completa, pasando por cuatro estadios bien marcados: huevo, larva, pupa y adulto; los 3 primeros acuáticos y el último aéreo. La duración de esta metamorfosis varía según la temperatura ambiental, desde siete días a 31ºC hasta veinte días a 20ºC. Los machos viven tan sólo unos pocos días, y al no alimentarse de sangre no juegan ningún papel en la transmisión de la enfermedad, salvo la de fecundar a las hembras, que lo hacen inmediatamente después de que ellas eclosionen. Las hembras son fecundadas una sola vez, guardando el esperma en un reservorio interno para próximas fecundaciones. La primera puesta de huevos suele ocurrir al 4º-5º día de vida del mosquito y las puestas sucesivas serán cada 2-3 días y coincidiendo con la picadura en busca de sangre (que se denomina en entomología «concordancia gonotrófica». Una vez que el mosquito es infectado, permanece infectante durante toda su vida, precisándose unos diez días para el desarrollo de Plasmodium falciparum en el mismo (período de incubación extrínseca), por lo que una hembra ha de sobrevivir al menos durante cuatro o cinco ciclos gonotróficos para poder transmitir el paludismo (es decir, al menos durante 10-12 días). La longevidad de la hembra del mosquito en condiciones favorables es de unas cuatro semanas en África, aunque algunas especies de zonas templadas sobreviven hasta seis meses, al entrar en letargo invernal. La mayoría pica al anochecer, sobre todo desde las 20 a las 03 horas y los más eficaces en la transmisión son aquellos que tienen hábitos antropofílicos (pican sólo a humanos), endofágicos y endofílicos (lo hacen dentro de las viviendas). Las picaduras disminuyen notablemente si la humedad relativa es inferior al 52%. La temperatura óptima para el desarrollo del mosquito es de 20-27ºC y de 22-30ºC para el parásito (22ºC para Plasmodium malariae, 25ºC para Plasmodium vivax y 30ºC para P. falciparum). No hay transmisión en altitudes superiores a los 3.000 metros ni en temperaturas mantenidas inferiores a 15ºC, ya que la esquizogonia se paraliza (para P. vivax si desciende por debajo de 16ºC y para P. falciparum por debajo de 19ºC). Tampoco hay transmisión si la temperatura supera de forma mantenida los 38ºC.
Se denomina «índice esporozoítico» a la proporción de anofelinos hembras infectados en una zona determinada (es decir, el porcentaje que tiene esporozoitos en sus glándulas salivares), y que en África tropical es del 2-5%, mientras que en otras áreas maláricas es del 0,2-2%.
En malariología, se denomina malaria indígena o autóctona cuando se adquiere por la picadura de un mosquito infectado en un país donde existe malaria. Se denomina malaria introducida cuando se adquiere en un país donde no hay malaria, por mosquitos locales que se han infectado desde un enfermo con malaria importada. Malaria inducida es la transmitida por sangre u órganos. Se denomina malaria de aeropuerto (o más generalmente de odisea) cuando se adquiere en un país donde no hay malaria, por mosquitos infectados transportados desde zonas endémicas en los equipajes o en aviones, barcos, autobuses, contenedores..., de la que se han descrito 75 casos en Europa en el período 1997-20006.
Malaria en Europa
En el pasado la malaria se transmitía por toda Europa, llegando tan al norte como a Inglaterra, Escocia, Dinamarca, sur de Noruega, sur de Suecia, Finlandia y provincias Bálticas de Rusia. En estas latitudes los inviernos llegan a -20ºC, y la transmisión dependía de lo cálido que fueran los veranos (limitándose a la isoterma de 15ºC en julio). Pero a partir de mediados del siglo XIX la malaria desaparece del norte de Europa y declina en el centro (como ejemplo: los últimos brotes en Paris ocurrieron durante 1865, cuando la construcción de los grandes bulevares), para desaparecer después de la I Guerra Mundial. En el sur de Europa permaneció muy prevalerte (debido a la pobreza y falta de desarrollo) hasta pasada la II Guerra Mundial, cuando se instauró un programa eficaz de control vectorial (con el advenimiento revolucionario del DDT), hasta que en 1961 la erradicación se había producido en la mayoría de los países.
En los años 90 se produjeron brotes en nuevos estados del sur de la antigua Unión Soviética, con transmisión local a partir de casos importados por las tropas desde Afganistán. En la actualidad, sólo se transmite (exclusivamente P.vivax) de manera estacional y en focos muy concretos de Armenia, Azerbaiyán, Federación Rusa, Turkmenistán, Uzbekistán y en la zona asiática de Turquía.
Ocasionalmente, se describe algún caso autóctono en Europa, sin transmisión secundaria, pero preocupante como para la vecina Italia, donde se han registrado casos de transmisión local de P. vivax y donde la densidad anofelina ha crecido espectacularmente en zonas tales como Toscana y Calabria7.
Malaria en España
Las fiebres tercianas benignas por P. vivax, y en menor grado las tercianas malignas por P. falciparum y las cuartanas por P. malariae, eran endémicas en España hasta hace relativamente poco tiempo. El último caso de paludismo autóctono se registró en mayo de 1961 y en 1964 fue expedido el certificado oficial de erradicación. Desde entonces, todos los casos declarados han sido importados, a excepción de los inducidos por transfusiones o por intercambio de jeringuillas en adictos a drogas por vía parenteral o de los paludismos de aeropuerto, aunque recientemente se ha descrito un posible caso autóctono por P. ovale adquirido en Alcalá de Henares (Madrid), aunque no se puede descartar que sea de aeropuerto por la proximidad del aeródromo de Torrejón de Ardoz8.
El único vector potencial aún presente en España es Anopheles atroparvus cuyas poblaciones permanecen ampliamente distribuidas por extensas áreas. Afortunadamente es refractario a las cepas tropicales de P. falciparum, lo que limita la transmisión autóctona a partir de casos adquiridos en África subsahariana9. Anopheles labranchiae, el otro vector implicado en la transmisión del paludismo, desapareció del sureste de la península en los años 70. Cada año se declaran en nuestro país más de 400 casos de malaria, sin que esto haya determinado, hasta la fecha, la reintroducción de la enfermedad a pesar del incremento de turistas e inmigrantes potencialmente infectados.
El potencial malariogénico de España es muy bajo y el restablecimiento de la enfermedad es muy improbable a no ser que las condiciones sociales y económicas se deterioraran drástica y rápidamente. La posible transmisión local quedaría circunscrita a un número muy reducido de personas y tendría un carácter esporádico. Además, los parásitos que con más probabilidad podrían producir estos casos serían las formas benignas por P. vivax / P. ovale, ya que puede desarrollarse a temperaturas más bajas y en los vectores peninsulares.
Las predicciones más cuidadosas para el año 2050 no reflejan a la Península Ibérica como escenario de transmisión palúdica, pero sí a lo largo de toda la costa marroquí10. No obstante, cabría la posibilidad de que vectores africanos susceptibles a cepas de Plasmodium tropicales pudieran invadir la parte sur la península Ibérica11, aunque también se reduciría la exposición al aumentar la vida bajo el aire acondicionado12.
Virus transmitidos por mosquitos
Se han identificado más de 520 de estos virus, de los que un centenar son patógenos para el hombre. Los más importantes son los que producen fiebres hemorrágicas o encefalitis. Se denominan arbovirus (arthropod-borne-virus) a aquellos transmitidos por la picadura de artrópodos, fundamentalmente por mosquitos de los géneros Aedes y Culex.
Aedes aegypti, vector de la fiebre amarilla y del dengue en los trópicos, parece haber desaparecido de Europa y en la actualidad no se encuentra por encima de 35º latitud Norte. Por el contrario, ha irrumpido en este continente Aedes albopictus, vector del dengue (los 4 serotipos) y fiebre amarilla, originario del sudeste asiático y subcontinente indio (y vector potencial de otros virus como encefalitis japonesa, encefalitis equina del este, fiebre de Ross, La Crosse, Chikungunya, fiebre del valle del Rift y West Nile. También es un buen vector de Dirofilaria immitis y Dirofilaria repens. En teoría sobrevive hasta latitudes tan al norte como 42ºN (casi las 2/3 partes inferiores de la península Ibérica), pero como es capaz de entrar en diapausa, cuando las condiciones climáticas le son muy desfavorables, el factor limitante real sería la isoterma de -5ºC de enero lo que posibilitaría su establecimiento hasta el sur de Suecia. Por otro lado, se alimenta tanto en entornos urbanos como rurales, de sangre de mamíferos y aves como de humanos, lo que le convierte en un excelente vector puente entre ciclos selváticos y urbanos y entre animales y humanos. Una vez infectado por dengue puede pasar este virus verticalmente (transováricamente) a sus larvas. En los años 80 se introdujo en América con un cargamento de ruedas usadas desde Japón. En Europa se detectó por primera vez en 1979 en Albania al parecer procedente de China, llegó a Italia desde USA en 1990 y en la década del año 2000 apareció en Francia, Bélgica, Montenegro, Suiza y Hungría, y lo que se temía se ha hecho realidad pues se acaba de detectar su presencia en España13.
1. Dengue
El virus del dengue es un flavivirus, del que existen 4 serotipos, y que produce un abanico clínico que comprende desde infecciones asintomáticas hasta cuadros hemorrágicos potencialmente letales. Cada año se producen entre 250.000-500.000 casos de formas graves (dengue-hemorrágico y dengue-shock) que acarrean una mortalidad del 1-5% y que alcanza hasta el 40% sin tratamiento. No existe una vacuna eficaz contra esta enfermedad.
Es una enfermedad de ámbito urbano, con epidemias explosivas que alcanzan hasta el 70-80% de la población. La transmisión se realiza por la picadura del mosquito A. aegypti y en menor grado de A. albopictus y tiene lugar entre los paralelos 30ºN y 20ºS. Desde los años 50 se ha observando un resurgir evidente en el sureste de Asia, y desde los años 70 en el continente americano.
El período de incubación extrínseco en el mosquito es de 12 días a 30ºC, pero si la temperatura se eleva a 32-35ºC este período se reduce a tan solo 7 días. A 30ºC, un ser humano con dengue debe infectar a 6 mosquitos para que se produzca un caso secundario, mientras que a 32-35ºC tan solo necesita infectar a 2 mosquitos para que esto se produzca, es decir, se multiplica por 3 veces la capacidad vectorial del mosquito14.
Dengue en Europa
En el pasado hubo dengue en Europa. La primera epidemia documentada serológicamente (de manera retrospectiva) fue en Grecia durante los años 1927-1928, con más de 1 millón de infectados y de los que más de 1000 fallecieron de dengue hemorrágico. Después de la segunda guerra mundial la transmisión de dengue cesó en Europa, probablemente como consecuencia de las campañas de erradicación de la malaria con DDT.
En la actualidad no hay transmisión documentada de dengue en Europa, pero se teme lo peor, ya que A. albopictus se encuentra bien implantado en Albania e Italia y, como se ha mencionado con anterioridad, se ha detectado su presencia en Bélgica, Francia, Montenegro, Suiza, Hungría y España.
Dengue en España
Desde el siglo XVII se han descrito epidemias que bien podrían haber sido de dengue, incluyendo la desatada en Cádiz y Sevilla desde 1784 hasta 178815. A mediados del mes de junio de 1801 la reina de España sufrió un cuadro de presunto dengue hemorrágico, y durante el siglo XIX se produjeron epidemias en Canarias, Cádiz y otros puntos del Mediterráneo asociadas a casos importados por mar.
No hay casos documentados de transmisión local de dengue, pero el riesgo parece evidente, ya que en España se dan unas características apropiadas para la transmisión: temperaturas altas en verano y grandes núcleos urbanos en los que las ventanas se mantienen abiertas y el uso de aire acondicionado es infrecuente, con gran actividad en las calles y parques (ideal para el contacto con el vector). Aunque en la actualidad A. aegypti, uno de los vectores más importantes de esta enfermedad, parece haber desaparecido hace décadas de España, se acaba de confirmar la presencia de A. albopictus, el segundo vector en importancia, en Cataluña (Sant Cugat del Vallès). Las condiciones climáticas idóneas para el desarrollo de este mosquito son: más de 500 mm3 de precipitaciones anuales, más de 60 días de lluvia al año, temperatura media del mes frío superior a 0ºC, temperatura media del mes cálido superior a 20ºC y temperatura media anual superior a 11ºC. Las zonas supuestamente más adecuadas climáticamente para el desarrollo de este vector en España serían Galicia, toda la cornisa del Cantábrico, región subpirenaica, Cataluña, delta del Ebro, cuenca del Tajo, cuenca del Guadiana y desembocadura del Guadalquivir16.
2. Encefalitis virales. Virus del Nilo occidental
Representan un amplio grupo de enfermedades virales (encefalitis de San Luis, encefalitis equina del este y del oeste, encefalitis equina venezolana, del Nilo occidental...) que se transmiten por las picaduras de distintas especies de mosquitos, sobre todo del género Culex (C. quinquefasciatus, C. pipiens...) y de garrapatas, donde las aves constituyen el principal reservorio de la enfermedad. La transmisión no es posible en isotermas inferiores a 20ºC en verano. Producen un cuadro de meningitis o meningoencefalitis que puede dejar secuelas neurológicas permanentes. Aunque primordialmente circula entre aves, también pueden resultar infectadas muchas especies de mamíferos así como anfibios y reptiles.
Se han detectado brotes asociados a cambios climáticos de encefalitis de San Luis en California durante 1984 y de encefalitis equina venezolana en Venezuela y Colombia durante 1995. El virus del Nilo occidental es endémico en África y lo más llamativo ha sido el importante brote acontecido en Nueva York en 1999, con diseminación explosiva posterior a 44 Estados y a 6 provincias canadienses en tan solo cinco años, transmitido por mosquitos del género Culex a partir de aves migratorias infectadas.
Encefalitis virales en Europa
Se han registrado brotes epidémicos del Nilo occidental en el Mediterráneo oriental, en la Camarga francesa en los años 60 y en los alrededores de Bucarest (Rumania) en 1996. Durante los meses de agosto-septiembre de 2003 se detectó un pequeño brote en la comarca francesa del Var (donde hubo un brote de encéfalo-mielitis equina en el 2000) que afectó a dos humanos (que por cierto, estuvieron de vacaciones en el levante español) y a tres equinos. Durante este brote se estudiaron en España unos 80 líquidos cefalorraquídeos de pacientes con meningitis y más de 900 lotes de mosquitos sin encontrar ninguno positivo. También se han descrito otros brotes en Italia, República Checa, sur de Rusia y Georgia. En el verano de 2004 ha aparecido otro brote reducido en el Algarbe (Portugal) que parece haber afectado a dos turistas irlandeses, aunque este brote aún está pendiente de confirmación.
Encefalitis virales en España
La cuenca del Mediterráneo y el sur de la península ibérica en particular, que acogen a las aves migratorias procedentes de África, constituyen áreas de alto riesgo para la transmisión. Estudios de seroprevalencia realizados en España entre los años 1960-1980 demostraron la presencia de anticuerpos en la sangre de los habitantes de Valencia, Galicia, Coto de Doñana y delta del Ebro, lo que significa que el virus circuló en nuestro país por entonces17. El impacto actual que este virus pudiera tener en la salud de los españoles se desconoce, ya que no se investiga de forma rutinaria en los casos de meningitis virales. La asociación con el cambio climático no ha sido establecida, pero es de suponer que un aumento de la temperatura produciría un aumento vectorial y se incrementaría, por tanto, el riesgo de transmisión, lo que desencadenaría casos de meningitis y encefalitis víricas en las poblaciones de áreas de riesgo del territorio español.
3. Fiebre amarilla
Enfermedad encuadrada dentro de las fiebres virales hemorrágicas y que tiene una mortalidad >40%. Afortunadamente se dispone de una vacuna eficaz para prevenirla. Endémica en el continente africano y en la amazonía suramericana y transmitida por la picadura del mosquito A. aegypti.
Fiebre amarilla en Europa y en España
España, con sus colonias de ultramar, era especialmente vulnerable a esta enfermedad, registrándose brotes epidémicos asociados a casos importados por mar: en 1856 se produjeron más de 50.000 muertes en Barcelona, Cádiz, Cartagena y Jerez (ese mismo año fallecieron 18.000 personas en Lisboa y se produjeron otros muchos casos en ciudades portuarias del norte de Italia y del sur de Francia)18. Aedes aegypti desapareció del Mediterráneo después de la II Guerra Mundial, muy probablemente a consecuencia indirecta de los programas de erradicación de la malaria, y desde entonces no existe riesgo de esta enfermedad.
Leishmaniosis
La leishmaniosis reemergió en Europa en la década de los 60, una vez finalizados los programas de control que culminaron con la erradicación del paludismo. Enfermedad parasitaria producida por Leishmania infantum en España, endémica en nuestro país y transmitida desde los perros a los humanos por dípteros del genero Phlebotomus (P. perniciosus y P. ariasi). Da lugar a formas clínicas cutáneas y a formas viscerales graves.
Aumentos de la temperatura podrían acortar la maduración parasitaria dentro del vector (incrementándose el riesgo de transmisión), reducir el periodo de letargo invernal de los vectores, con el consiguiente aumento en el número de generaciones anuales, y cambiar su distribución geográfica, desplazándose las especies más peligrosas hacia la zona norte de la península, actualmente libre de la enfermedad.
Es altamente probable que la distribución de la leishmaniosis en el continente europeo se amplíe hacia el norte, como consecuencia del calentamiento global del clima, a partir de los límites de distribución actuales de la enfermedad. Por otro lado, existe también un alto riesgo de que la leishmaniosis cutánea antroponótica causada por Leishmania tropica, en la actualidad solo presente en el norte de África y Oriente Medio, pueda emerger en cualquier momento por el sur de Europa.
Enfermedades transmitidas por garrapatas
Las garrapatas sufren una metamorfosis desde la fase de huevo que incluye tres estadios de desarrollo que chupan sangre (larvas, ninfas y adultos). Sin embargo, son las ninfas las que contribuyen en mayor medida a la transmisión de enfermedades a los humanos desde los reservorios animales. Son muchas las enfermedades y de variada gravedad: borreliosis (fiebre recurrente endémica, enfermedad de Lyme), rickettsiosis (fiebre botonosa, fiebres maculadas), babesiosis, anaplasmosis, ehrlichiosis, tularemia y viriasis (encefalitis por picadura de garrapata o centroeuropea, enfermedad de Congo-Crimea, fiebre de Kyasanur...).
En España, las enfermedades más importantes son la fiebre botonosa y la borreliosis de Lyme y las garrapatas mas difundidas son Rhipicephalus sanguineus, la «garrapata común del perro» implicada en la transmisión de la Fiebre Botonosa Mediterránea e Ixodes ricinus implicada en la transmisión de la enfermedad de Lyme.
La vida media de una garrapata puede exceder los 3 años, dependiendo de las condiciones climáticas. Los tres estadios del vector pueden estar infectados y lo más peligroso, pueden transmitir la infección a sus crías por vía transovárica.
Pueden sobrevivir a temperaturas de hasta -7ºC, recuperando la actividad vital a los 4-5ºC. Son muy sensibles a mínimos cambios de temperatura, como lo demuestra que tan sólo una isoterma de 2ºC condicione la transmisión en África del sur y este. La disminución de la humedad reduce notablemente la viabilidad de los huevos. Un leve cambio climático podría aumentar la población de garrapatas, extender el período estacional de transmisión y desplazarse la distribución hacia zonas más septentrionales19. Afortunadamente, para ciertas enfermedades como la encefalitis trasmitida por garrapatas, el cambio climático proyectado mantendría aún más alejados los focos de de esta enfermedad en España.
Ixodes ricinus (en la Cornisa Cantábrica, la sierra de Cameros en La Rioja y algunas poblaciones aisladas en Guadarrama y norte de Cáceres) es muy sensible al calentamiento climático, y los modelos proyectan que la especie seguramente desaparecería del país aunque podrían quedar poblaciones relictas en las zonas más frías de Asturias y Cantabria. Rhipicephalus. sanguineus no depende directamente del clima, sino de la existencia de urbanizaciones y tipos de construcciones periurbanas-rurales que favorecen su desarrollo y colonización. Es de temer que las garrapatas africanas (Hyalomma marginatum, Hyalomma anatolicum) puedan invadirnos y podrían estar implicadas en la transmisión de la fiebre viral hemorrágica de Congo-Crimea.
Encefalitis. Enfermedad de Lyme. Rickettsiosis
La incidencia de encefalitis por garrapata en Suecia se ha incrementado sustancialmente desde mediados de 1980, y los límites de la extensión de las garrapatas I. ricinus se han extendido más al norte, debido a un aumento de la temperatura20. El aumento de temperatura podría dar lugar a que garrapatas importadas se adaptaran al nuevo clima y transmitieran enfermedades. Desde los años 90 se han establecido garrapatas de la especie R. sanguineus en el sur de Suiza, habiéndose demostrado que están infectadas por rickettsias causantes de fiebre botonosa mediterránea y fiebre Q21.
Enfermedades transmitidas por roedores
Los roedores pueden abrigar a otros vectores como garrapatas y pulgas (Xenopsylla cheopis, Ctenocephalides felis ....) que transmiten la peste y el tifus murino. Además, pueden ser hospedadores intermediarios o reservorios de varias enfermedades como leptospirosis, fiebres virales hemorrágicas (Junin, Machupo, Guaranito, Sabia, Lassa), hantavirosis, himenolepiais....Tanto la población de roedores silvestres como la posibilidad de contacto entre roedor- humano en las zonas urbanas están muy influenciados por los cambios ambientales. Tras años de sequía que podrían disminuir el número de predadores naturales de roedores, vendrían lluvias que aumentarían el alimento disponible (semillas, nueces, insectos) y terminaría en un aumento de la población de roedores.
Hantavirus
En el sur de EE.UU. se desató una epidemia muy grave de hantavirosis humana a principios de los años 90, asociada a un incremento inusual (de hasta 10 veces) de la población de roedores reservorio natural de hantavirus (Peromyscus sp). La causa fue el cambio climático antes descrito22. En España se han detectado hantavirus en zorros y en roedores y en sueros de humanos.
VULNERABILIDAD. ENFERMEDADES VECTORIALES SUSCEPTIBLES
DE SER INFLUIDAS POR EL CAMBIO CLIMÁTICO EN ESPAÑA
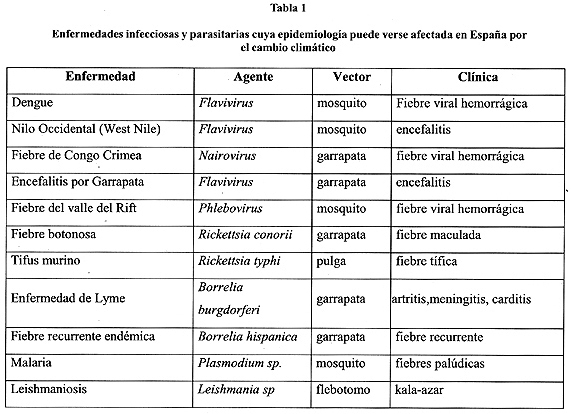
Por la proximidad con el continente africano, siendo lugar de tránsito obligado de aves migratorias y personas, y por las condiciones climáticas, cercanas a las de zonas donde hay transmisión de enfermedades vectoriales, España es un país en el que estas enfermedades podrían verse potenciadas por el cambio climático. Pero para el establecimiento de auténticas áreas de endemia se necesitaría la conjunción de otros factores, tales como el aflujo masivo y simultáneo de reservorios animales o humanos y el deterioro de las condiciones socio-sanitarias y de los servicios de Salud Pública. Hipotéticamente las enfermedades vectoriales susceptibles de ser influidas por el cambio climático y emerger o reemerger en España se muestran en la tabla 1.
Europa se ha recalentado unos 0,8ºC en los últimos 100 años, pero no de forma uniforme, ya que el mayor incremento se ha producido en los inviernos y en el norte del continente. De continuar esta tendencia es posible que la elevada mortalidad vectorial durante los inviernos disminuya. Respecto a las precipitaciones es más difícil la predicción, aunque probablemente los inviernos serán más húmedos y los veranos más secos. Si el sur fuera más seco, disminuirían los humedales y con ellos los criaderos de mosquitos; sin embrago, aparecerían otros lugares de cría, al aumentar las aguas estancadas que quedarían al secarse el lecho de las corrientes o los depósitos de agua utilizados por los horticultores para conservar el agua de lluvia. Las predicciones de cambio en España apuntan hacia unos inviernos más lluviosos y calidos, seguidos de veranos calurosos y secos, condiciones climáticas favorables para el establecimiento y proliferación vectorial. El posible riesgo vendría por la importación e instalación de vectores tropicales y subtropicales adaptados a sobrevivir en climas menos cálidos y más secos (como es el ejemplo de A. albopictus).
CONSIDERACIONES FINALES
El reconocimiento del riesgo a nivel oficial es fundamental. Hay que estar vigilantes al problema y no desdeñar el riesgo, aconsejándose la colección de datos climáticos y de estadísticas de enfermedades infecciosas, con el objeto de poder instaurar precozmente, en casos de alerta, campañas adecuadas de Salud Pública que disminuyan la vulnerabilidad de la población a las enfermedades infecciosas, mediante estrategias de vacunación, control de vectores y tratamiento de las aguas23,24.
La repercusión fundamental de la reintroducción o diseminación de las enfermedades transmitidas por vectores sería en el sector del Turismo. Un aumento de estas enfermedades en las zonas de turismo podría disuadir al viajero de elegir tales destinos, con las repercusiones que esto acarrearía. Los sectores Agricultura y Forestal se correlacionan muy estrechamente con el hábitat y ecosistema de cría de vectores.
Aparte de las observaciones asociadas a las oscilaciones periódicas naturales, hasta ahora no se ha podido probar de manera fehaciente que el leve cambio climático experimentado en las últimas décadas haya aumentado el riesgo global de transmisión de las enfermedades transmitidas por artrópodos, pero sí que hay suficiente evidencia científica para sospecharlo. Las predicciones matemáticas realizadas auguran un aumento del riesgo siempre y cuando el cambio climático continúe produciéndose, algo que para casi todos parece evidente. Sin embargo, algunos expertos se han mostrado escépticos acerca de estas predicciones, ya que la historia natural de las enfermedades transmitidas por artrópodos es compleja, interfiriendo otros factores además del clima, lo que hace huir del análisis simplista.
Además del cambio climático muchos otros son los factores que pueden influenciar en la epidemiología de las enfermedades vectoriales: composición atmosférica, urbanización, desarrollo económico y social, comercio internacional, migraciones humanas, desarrollo industrial, uso de la tierra-regadíos-desarrollo agrícola25. El resurgir reciente de muchas de estas enfermedades en el mundo podría más bien atribuirse a cambios políticos, económicos y de actividad humana más que a cambios climáticos. Por tanto, el clima, por si solo no sería un requisito suficiente para la instauración de focos endémicos en España. Se necesitaría un número suficiente de individuos simultáneamente infectados para constituir un reservorio de la infección. Los inmigrantes semiinmunes pueden albergar parásitos durante muchos meses de forma paucisintomática, pudiendo ser reservorios eficaces de enfermedades. Aunque el incremento del turismo e inmigración de zonas endémicas puedan importar casos, éstos no serían lo suficiente en número como para iniciar una epidemia, pudiendo, a lo más, originar focos muy locales de transmisión autolimitada y casos de infecciones de aeropuerto24.
Como se ha mencionado, no existe una evidencia inequívoca de que el cambio climático acontecido hasta la fecha haya modificado sustancialmente la epidemiología de las enfermedades infecciosas transmitidas por vectores. La colección de datos de forma prospectiva y la investigación de manera precoz en el triángulo de interacción «cambio climático-vectores-población» tendría el beneficio de la creación de un banco de datos que sería de extrema utilidad. Estos sistemas deberían incluir, además, variables como cambios demográficos, económicos y ambientales, pues los cambios en la epidemiología de las enfermedades infecciosas más puede deberse a estos últimos factores más que al cambio climático en sí. Se deberían realizar estudios de prevalencia de ciertas enfermedades, como las flaviviriasis, mediante estudios de seroprevalencia en las poblaciones de riesgo. Además, se deberían estudiar las poblaciones de vectores para la detección precoz de nuevas especies y para la determinación de la dispersión geográfica de las poblaciones de especies foráneas recientemente detectadas (como es el caso de A. albopictus). Estos estudios deberían ser lo suficientemente eficientes y exactos para detectar mínimos cambios en la salud. Desafortunadamente, los sistemas actuales de monitorización vectorial no responden a estas premisas. En esencia, la detección del cambio pasa por la detección de microorganismos patógenos: -en los vectores (virus del dengue o de la encefalitis del Nilo Occidental en mosquitos); -en los reservorios naturales (roedores, aves o équidos) y; -en los humanos (tanto de habitantes asintomáticos de áreas de riesgo como de pacientes ingresados con patologías compatibles, mediante análisis de sangres, sueros, líquidos cefalorraquídeos...etc.).
En España no existe una legislación específica adaptada a las necesidades actuales para el control vectorial. Además de los programas de control de mosquitos en España han de aplicarse las regulaciones de inspección, certificación y cuarentena de los productos de comercio procedentes de zonas endémicas que puedan transportar vectores, tales como ruedas usadas o plantas exóticas como el bambú de la suerte. Muy sucintamente, las implicaciones para las políticas las podríamos resumir en:-Fomentar y desarrollar los Programas de Vigilancia y Control de las Enfermedades de Transmisión Vectorial, con una financiación suficiente y estable. -Que estos programas estén a su vez coordinados con otros programas de vigilancia a nivel nacional-. Aunar la investigación entre los distintos grupos de investigación que trabajen en campos diferentes pertenezcan a las distintas áreas, tales como veterinaria, epidemiología, entomología, zoología y medicina. -Dotar de forma adecuada a los laboratorios de referencia y a los laboratorios asistenciales de los hospitales para el diagnóstico seguro de las enfermedades vectoriales. -Difundir el conocimiento existente mediante cursos de formación específicos en las Universidades españolas.
Las principales líneas de investigación deberían centrarse en: -Diseño de modelos que correlacionen los parámetros climáticos con la incidencia de enfermedades infecciosas (más que modelos basados en áreas y poblaciones de riesgo). -Diseño de modelos de validación entre los datos climáticos pasados y los presentes con la frecuencia de enfermedades infecciosas transmitidas por vectores. -Realización de muestreos de poblaciones, vectores y reservorios. -Estudios de cambios en la distribución o alteración en la frecuencia de transmisión de las enfermedades más susceptibles de ser influenciadas: dengue y otros flavivirus, malaria, leishmaniosis, rickettsiosis... Desarrollo de nuevas pruebas de diagnóstico rápido.
En relación con esto una primera iniciativa europea está empezando a dar sus primeros pasos. El Sexto Programa Marco, auspiciado por la Unión Europea, incluye entre sus temas de investigación prioritarios las enfermedades emergentes y en particular con sus relaciones con el «Cambio Global y Ecosistemas». Tras el llamamiento realizado por la Comisión Europea de Investigación en este sentido, en el que se solicitaban expresiones de interés, se ha aceptado en 2004 una propuesta sobre Enfermedades Emergentes en un Medioambiente Europeo Cambiante (red EDEN). Esta red de excelencia está integrada por un consorcio de investigadores europeos pertenecientes a 33 países, entre los que se encuentra España, cuya finalidad es anticiparse a los efectos que los cambios medioambientales puedan ejercer sobre la salud pública en Europa, coordinando las investigaciones pertinentes en un marco científico común agrupado en estas 5 áreas principales: Paisajes, Biotopos y Hábitats; Bionómica de Vectores y Parásitos y competencia; Salud Pública y actividades Humanas; Reservorios Animales; e Integración y manejo de bases de datos. El espíritu de esta red en los próximos 5 años será identificar, evaluar y catalogar los ecosistemas y condiciones medioambientales europeos ligados al cambio global que puedan influir en la distribución espacial y temporal así como en las dinámicas de los agentes patógenos. Para ello se desarrollarán modelos predictivos de emergencia y dispersión que incluyan prevención global y regional, sistemas de alerta temprana, vigilancia, monitorización de herramientas y descripción de escenarios. Las enfermedades seleccionadas para estas investigaciones son encefalitis del Nilo occidental, enfermedad de Lyme, encefalitis transmitidas por garrapatas, fiebre del valle del Rift, Dengue, Malaria y leishmaniosis.
AGRADECIMIENTOS
Al Profesor Agustín Estrada-Peña (Departamento de Parasitología. Facultad de Veterinaria. Miguel Servet 177. 50013-Zaragoza) por sus comentarios referentes a las enfermedades transmitidas por garrapatas.
BIBLIOGRAFIA
1. Kovats RS. El Niño and human health. Bull World Health Organ 2000;78:1127-35. [ Links ]
2. Kovats RS, Bouma MJ, Hajat S, Worrall E, Haines A. El Nino and health. Lancet 2003;362:1481-9. [ Links ]
3. Franke CR, Ziller M, Staubach C, Latif M. Impact of the Niño/Southern oscilation on visceral leishmaiasis, Brazil. Emerg Infect Dis 2002;8:914-917. [ Links ]
4. Monath TP, Tsai TF. St. Louis encephalitis: lessons from the last decade. Am J Trop Med Hyg 1987;37(Suppl):40S-59S. [ Links ]
5. Githeko AK, Lindsay SW, Confalonieri UE, Patz JA. Climate change and vector-borne diseases: a regional analysis. Bull World Health Organization 2000;78:1136-1147. [ Links ]
6. Mouchet J. Airport malaria: a rare disease still poorly understood. Euro Surveill 2000;5:75-76. [ Links ]
7. Baldari M, Tamburro A, Sabatinelli G, Romi R, Severini C, Cuccagna G, Fiorilli G, Allegri MP, Buriani C, Toti M. Malaria in Maremma, Italy. Lancet. 1998;351:1246-7. [ Links ]
8. Cuadros J, Calvente MJ, Benito A, Arevalo J, Calero MA, Segura J, Rubio JM. Plasmodium ovale malaria acquired in central Spain. Emerg Infect Dis 2002;8:1506-8. [ Links ]
9. Ramsdale CD, Coluzzi M. Studies on the infectivity of tropical African strains of Plasmodium falciparum to some southern European vectors of malaria. Parassitologia 1975;17:39-48. [ Links ]
10. Rodgers DJ, Randolph SE. The global spread of malaria in a future, warmer world. Science 2000;289:1763-1765. [ Links ]
11. López-Vélez R, García Camacho A. Malaria, África y viajes: un triángulo de riesgo. Rev Clin Esp 1998;198:494-5. [ Links ]
12. Reiter P. Climate change and mosquito-borne disease. Environ Health Pespect 2001;109 (suppl 1):141-161. [ Links ]
13. Aranda C, Roiz D, Eritja R. Comunicación personal; 2004. [ Links ]
14. Rogers DJ, Packer MJ. Vector-borne diseases, models and global climate change. Lancet 1993;342:1282-1284. [ Links ]
15. Rigau Perez JG. The early use of break-bone fever (quebranta Huesos, 1771) and dengue (1801) in Spanish. Am J Trop Med Hyg 1998; 59:272-274. [ Links ]
16. Eritja R, Lucientes J, Molina R, Roiz D, Escosa R, Ruiz S. Worldwide invasion of vector mosquitoes: Present European distribution and challenges for Spain. Biol Invasions 2005;7:87-97 [ Links ]
17. Lozano A, Filipe AR. Anticuerpos a virus West Nile y otros flavivirus transmitidos por artrópodos en la población del Delta del Ebro. Rev Esp Salud Publica 1998;72:245-250. [ Links ]
18. Eager JM. Yellow fever in France, Italy, Great Briatain and Austria and bibliography of yellow fever in Europe. Yellow Fever Institute Bulletin 1902;8:25-35. [ Links ]
19. Randolph S. Tick-borne encephalitis in Europe. Lancet 2001;358:1731-2. [ Links ]
20. Lindaren E, Gustafson R. Tick-borne encephalitis in Sweden and climate change. Lancet 2001;358:16-18. [ Links ]
21. Bernasconi MV, Casati S, Péter O, Piffaretti JV. Rhipicephalus ticks infected with Rickettsia and Coxiella in Southern Switzerland (Canton Ticino). Infection, Genetis and Evolution 2002;2:111-120. [ Links ]
22. Wenzel RP. A new hantavirus infection in North America. N Engl J Med 1994;330:1004-1005. [ Links ]
23. McCarthy M. Uncertain impact of global warming on disease. Lancet 2001; 357:1183. [ Links ]
24. Hunter PR. Climate change and waterborne and vector-borne disease. Appl Microbiol 2003;94:37S-46S. [ Links ]
25. Sutherst RW. Global change and human vulnerability to vector-borbe diseases. Clin Microbiol Rev 2004;17:136-173. [ Links ]