Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Salud Pública
versión On-line ISSN 2173-9110versión impresa ISSN 1135-5727
Rev. Esp. Salud Publica vol.82 no.5 Madrid sep./oct. 2008
Legibilidad gramatical de los prospectos de los medicamentos de más consumo y facturación en España en 2005
Grammatical readability of the package leaflets of the medicinal products most widely consumed and generating the highest expense in Spain during 2005
Inés Mª Barrio-Cantalejo (1). Pablo Simón-Lorda (2) Joan Carles March Cerdá (2), Mª Ángeles Prieto Rodríguez (2)
(1) Distrito Sanitario Atención Primaria. Granada.
(2) Escuela Andaluza de Salud Pública.Granada.
Conflictos de interés. Ningún autor tiene conflictos de interés en la realización de este estudio ni tiene vínculo comercial ni de ningún tipo con los Laboratorios fabricantes de las especialidades analizadas.
Dirección para correspondencia
RESUMEN
Fundamento. Los fabricantes de medicamentos tienen el deber de proporcionar a los consumidores información correcta sobre su uso. Esta información está recogida en el prospecto que, según la normativa vigente, debe ser legible y comprensible para el paciente. El objetivo de este estudio es analizar la legibilidad lingüística gramatical de los prospectos de medicamentos mediante la aplicación de la fórmula de Flesch.
Métodos. Se seleccionan las 30 medicamentos más consumidos y los 30 que más gasto han generado durante el año 2005 en España. Siguiendo las recomendaciones de la literatura, se han considerado legibles aquellos documentos cuyo Índice de Flesch fuese ≥ 10. Se ha calculado la legibilidad gramatical a través del Índice de Flesch accesible en el programa Microsoft Office 2000.
Resultados. Sólo 5 documentos alcanzan un índice de Flesch aceptable (= 10) y 18 tienen una puntuación de 0. La mitad de los valores si sitúan por debajo de 2; 25% de los valores tienen valor 0 y 25% tiene valores de 6 ó más.
Conclusiones. Los datos obtenidos revelan una baja legibilidad lingüística y gramatical de los prospectos analizados. La sintaxis empleada al redactarlos tiende a usar frases y palabras largas, lo que incumple claramente las indicaciones de la normativa vigente.
Palabras clave: Legibilidad. Comprensión. Farmacia.
ABSTRACT
Background. The manufacturers of medicinal products are responsible for providing consumers proper information on the use of such products. This information is set out in the package leaflets which, according to current legislation, must be easy for patients to read and understand. The purpose of this study is to analyse the linguistic/grammatical readability of the package leaflets of medicinal products through application of the Flesch formula.
Methods. The 30 medicinal products most widely consumed and the 30 which generated the highest expenditure during 2005 in Spain were selected. In line with the recommendations of the relevant literature, documents with a Flesch Index value of ≥ 10 were considered readable. The grammatical readability was calculated by using the Flesch Index accessible through the Microsoft Office 2000 programme.
Results. Only 5 documents obtained an acceptable Flesch Index score (= 10), while 18 scored 0. Half of the values were under 2; 25% were 0 and 25% scored 6 or more.
Conclusions. The data obtained reveal a low level of linguistic and grammatical readability in the package leaflets analysed. The syntax used on drafting the texts tends to use long words.
Key words: Readability. Comprehension. Pharmacy.
Introducción
Los medicamentos, como cualquier otro producto consumible, deben respetar el derecho de los consumidores y usuarios a una información adecuada sobre su uso1. Para los fabricantes de medicamentos esto significa la obligación de redactar prospectos con una adecuada legibilidad. Así, la Ley 29/20062 de Garantías y uso racional de medicamentos y productos sanitarios y la Directiva 92/27/CEE3, que regula el etiquetado y el prospecto de los medicamentos de uso humano, establecen que este documento debe ser legible y comprensible para el paciente, reduciendo al mínimo los términos de naturaleza técnica. Con más detalle, la Circular 2/20004, modificada por la 1/20025, había recogido las recomendaciones para que la información de los prospectos sea legible teniendo en cuenta el tamaño y tipo de letra, color de la impresión, sintaxis, uso del braille y tipo de papel. Además, en relación a la sintaxis, recomendaba que se eviten frases excesivamente largas y oraciones subordinadas y que se utilicen comas, puntos y aparte, guiones y puntos. Con el objeto de facilitar la aplicación de esta Circular, el 9 de mayo de 2001 se constituyó en Madrid, en la Agencia Española de Medicamentos, el Comité de Lectura de Prospectos de los Medicamentos6, en colaboración de la Asociación Española de Derecho Farmacéutico. El citado Comité vio consumados sus objetivos en junio de 2007 con la publicación su Informe Final La redacción del prospecto; recomendaciones para mejorar su comprensión7. Con el mismo fin de mejorar la legibilidad de los prospectos de los medicamentos, la Agencia Europea de Evaluación de Medicamentos (EMEA) redactó en 2006, de acuerdo con la Directiva 2001/83/CE8 –modificada por la Directiva 2004/27/CE9- una guía para mejorar la legibilidad de los prospectos10. Finalmente, la publicación en Junio de 2007 de las plantillas de evaluación y seguimiento del grupo QRD (Quality Review of Documents) de la EMEA11 y en octubre del mismo año del Real Decreto 1345/2007 sobre la autorización, registro y dispensación de los medicamentos de uso humano12, dan muestra del profundo interés que ha cobrado en el último tiempo la mejora de la legibilidad de los prospectos. Este último ha venido seguido por la publicación de los criterios de adecuación al decreto13, exigiendo un test de legibilidad con el fin de asegurar la adecuada interpretación del prospecto por los pacientes o usuarios destinatarios del medicamento.
La investigación sobre legibilidad de los materiales escritos dirigidos a los pacientes tiene un largo recorrido en la lengua inglesa, y algo menor en lengua castellana14.
Según Aliende, la legibilidad es el conjunto de características de los textos que favorecen o dificultan una comunicación más o menos eficaz entre ellos y los lectores15. Cada característica determina un tipo de legibilidad: tipográfica, psicológica, conceptual, estructural, pragmática y lingüística han sido las más estudiadas. Además, la legibilidad lingüística puede abordarse desde dos perspectivas: si analiza la construcción de un mensaje (tamaño de las palabras, frases, construcciones gramaticales, etc.), se llama legibilidad lingüística gramatical. Si se interesa, más bien, por los aspectos semánticos del texto (significado de las palabras), se denomina legibilidad lingüística semántica.
Aunque los requisitos recogidos en la Circular 2/2000, antes mencionada, hacen referencia a todas las formas de legibilidad, el trabajo que se presenta a continuación se centra básicamente en el análisis de la legibilidad lingüística gramatical. El análisis de este tipo de legibilidad ha motivado la aparición de la mayor parte de las técnicas o fórmulas de medición, desarrolladas, sobre todo, en lengua inglesa. Entre éstas destacan la fórmula de Flesch, la escala de Fry, la de Flesch-Kincaid, el SMOG, el Raygor y el Gunnig Fog Test. De todas estas fórmulas de legibilidad la más utilizada de todas es la de Flesch.
En el ámbito de la salud, la preocupación por la legibilidad lingüística gramatical de los textos escritos que se entregan a los pacientes se ha desarrollado fundamentalmente en relación con dos tipos de documentos: los formularios de consentimiento informado, tanto de investigación16,17 como de procedimientos asistenciales18,19 y los materiales de educación para la salud20,21. Poco a poco se han ido añadiendo otros temas, como la legibilidad de los informes clínicos de urgencias22, de los prospectos de los medicamentos23,24, o de la información sanitaria dirigida a pacientes y usuarios contenida en la web25,26.
Prácticamente de todas las fórmulas de legibilidad existe una versión informatizada. En todas ellas subyace la idea de que la legibilidad depende de la largura de las palabras y las frases, y del número de oraciones que componen un texto. Así, cuanto más largas sean las palabras y las frases, más difícil será de leer un texto, esto es, menor será su legibilidad.
El objetivo principal de este trabajo ha sido analizar la legibilidad gramatical de los prospectos de medicamentos mediante la aplicación de la fórmula de Flesch.
Material y métodos
Se han seleccionado los 30 medicamentos más consumidos por número de envases vendidos, y los 30 que han generado mayor gasto en España durante el año 2005. En la tabla 1 se encuentra un análisis general de las dos listas con el nombre comercial, laboratorio, principio activo, número de envases vendidos y la facturación, utilizando para ello los datos facilitados por la Agencia Española de Medicamentos y Productos Sanitarios a solicitud de los autores de este trabajo, con fecha de junio de 2007. La selección de esta muestra de conveniencia, sin ser representativa, se justifica por el interés práctico de evaluar los prospectos de aquellos medicamentos que más se consumen o más gasto generan a los ciudadanos españoles. Hay 5 especialidades farmacéuticas que aparecen en las dos listas. Por este motivo, se presentan a continuación datos los datos correspondientes a 55 especialidades.

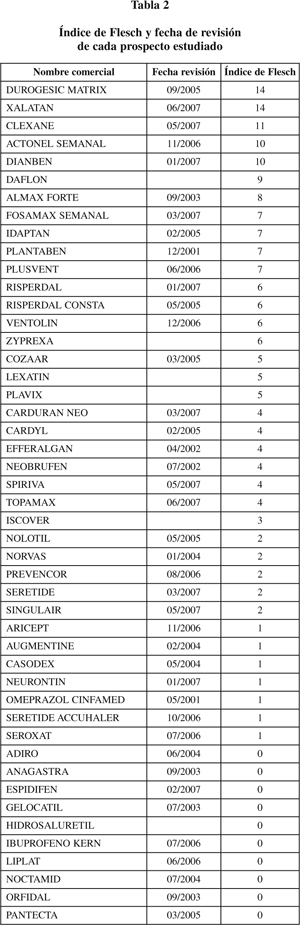
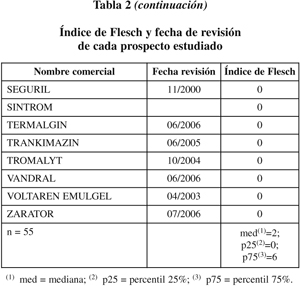
Se ha medido la legibilidad gramatical de los prospectos aplicando el Índice de Flesch, contenido en la utilidad Estadísticas de legibilidad del programa Microsoft Office 2000 y validado por Barrio & Simón en 200327. Éstos establecen que un Índice de Flesch inferior a 10 revela una legibilidad claramente insuficiente.
La obtención de prospectos se realizó en marzo de 2007 de dos maneras: 50 fueron accesibles en formato pdf en la Web de la Agencia del Medicamento y Productos Sanitarios y 5 en formato papel en una oficina de Farmacia. Seguidamente se procedió a la preparación de los texto tal y como Barrio & Simón recomiendan.
De cada uno se suprimieron los datos de composición del medicamento y de titularidad del laboratorio, que, con abundantes signos de puntuación, siglas y números, podían distorsionar los resultados. Sobre cada texto se calculó el índice de Flesch.
Resultados
La tabla recoge las puntuaciones de Flesch de cada prospecto estudiado. Sólo 5 documentos alcanzan un índice de Flesch aceptable (= 10) y 18 tienen una puntuación de 0, la peor posible, puesto que la fórmula de Flesch aplicada por Microsoft no arroja valores negativos. La mitad de los valores si sitúan por debajo de 2, 25% de los valores tienen valor 0 y 25% tiene valores de 6 ó más. Dado el limitado número de casos estudiados y la distribución no paramétrica de sus valores, no se ha aplicado ningún test de comparación de medias. La media del Índice de Flesch de los prospectos hasta el año 2006 es de 2,61 (desviación estándar: 3,48) y de los revisados en 2007, 5,42 (desviación estándar: 4,34).
Discusión
Los datos revelan una baja legibilidad gramatical de los 55 prospectos analizados, lo que indica que la sintaxis empleada tiende a usar frases y palabras largas. Esto incumple claramente las recomendaciones oficiales sobre la redacción de prospectos. Estos resultados coinciden con otros estudios que concluyen con que la muchos prospectos están redactados con tal complejidad que requieren habilidades lectoras poco presentes en el ciudadano28. Lo más importante es que, como consecuencia inmediata, muy probablemente, estos prospectos serán poco o difícilmente entendidos por el ciudadano medio.
Estos resultados son consistentes con los datos revelados por los muchos estudios dedicados a analizar los materiales escritos dirigidos a los pacientes, tanto en lengua inglesa29,30 como castellana –menos abundantes31. Estos estudios revelan que, aunque estos documentos se escriben para ser leídos y entendidos por los pacientes, utilizan un lenguaje demasiado técnico y distante de las necesidades reales de sus destinatarios. Como ya han dicho otros autores, escribir fácil, es difícil32.
Como dato positivo hay que apuntar que los prospectos más recientemente elaborados presentan un mejor Índice de legibilidad que los más antiguos. Esto puede ser una clara consecuencia de la creciente insistencia de las distintas instancias nacionales o europeas en que se respeten las recomendaciones que mejoran la legibilidad de los textos escritos.
El estudio tiene ciertas limitaciones que sería recomendable abordar en futuras investigaciones, como es la conveniencia de analizar la legibilidad de los textos dirigidos a pacientes no sólo en sus aspectos gramaticales, sino en otros aspectos de la legibilidad de gran relevancia para los pacientes, como son el semántico y los diferentes elementos de la legibilidad tipográfica. De hecho, lo ideal sería poder realizar un estudio de la legibilidad utilizando ensayos diagnósticos, tal y como establece la Circular 2/2000.
En cualquier caso, todo lo que permita avanzar en la promoción de un consumo informado de los medicamentos por parte de los ciudadanos, será, sin duda, de gran beneficio y utilidad para éstos.
Agradecimientos
A la Farmacia Santa María (Granada) por la ayuda en la obtención de los prospectos.
Bibliografía
1. Boletín Oficial del Estado. Ley 26/1984, de 19 de julio, General para la defensa de los consumidores y usuarios. BOE núms. 175 y 176, de 24-07-1984. [ Links ]
2. Boletín Oficial del Estado. Ley 29/2006, de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios. BOE núm. 178, de 27-07-2006. [ Links ]
3. Diario Oficial de las Comunidades Europeas. Directiva 92/27/CEE del Consejo, de 31 de marzo de 1992, Relativa al etiquetado y al Prospecto de los medicamentos de uso humano. DOUE núm. 113, de 30-04-1992. [ Links ]
4. Agencia Española del Medicamento. Circular 2/2000, de 2 de marzo de 2000, Directriz de legibilidad de material de acondicionamiento y prospecto. Disponible en: http://www.agemed.es/actividad/documentos/circulares/home.htm [ Links ]
5. Agencia Española del Medicamento. Circular 1/2002. Modificación de la Circular 2/2000, de 15 de julio de 2002, por la que se establece la Directriz de legibilidad de material de acondicionamiento y prospectos. Disponible en: http://www.agemed.es/actividad/documentos/circulares/home.htm [ Links ]
6. Actualidad en Derecho Sanitario, Nº 72, mayo 2001. Disponible en: www.actualderechosanitario.com. 10.05.2001 [ Links ]
7. AAVV. La redacción del prospecto: recomendaciones para mejorar su comprensión. Madrid: ASEDEF; 2007. [ Links ]
8. Diario Oficial de las Comunidades Europeas. Directive 2001/83/EC, de 6 de noviembre de 2001, Community code relating to medicinal products for human use. DOUE núm L-311-67, de 28-11-2001. [ Links ]
9. Diario Oficial de las Comunidades Europeas. Directive 2004/27/EC, de 31 de marzo de 2004, Amending Directive 2001/83/EC on the Community code relating to medicinal products for human use. DOUE núm L-136, de 30-04-2004. [ Links ]
10. European Commission. Guideline on the readability of the label and package leaflet of medicinal products for human use. Brussel: European Commision; 2006. [ Links ]
11. EMEA/QRD. Convention to be followed for the EMEA-QRD templates and the PIM data exchange standard (DES) Version 7. Brussel: EMEA/QRD, 2007. Disponible en: http://www.emea.europa.eu/ htms/human/qrd/qrdreference.htm [ Links ]
12. Boletín Oficial del Estado. Real Decreto 1345/2007, de 11 de octubre de 2007, por el que se regula el procedimiento de autorización, registro y condiciones de dispensación de los medicamentos de uso humano fabricados industrialmente. BOE núm 267, de 07-11-2007. [ Links ]
13. Dirección de la Agencia Española de Medicamentos y Productos sanitarios. Criterios de adecuación al RD 1345/2007 en relación con Las consultas a pacientes o usuarios (test de legibilidad), ficha técnica, prospecto paciente y etiquetado. Madrid: Agencia Española de Medicamentos y Productos Sanitarios; 2008. Disponible en: http://www.agemed.es/actividad/documentos/infointeres/docs/adecuacion_rd1345-julio08.pdf [ Links ]
14. Simón Lorda P, Barrio Cantalejo IM, Concheiro Carro L. Legibilidad de los formularios escritos de consentimiento informado. Med Clin (Barc). 1996;107:524-9. [ Links ]
15. Alliende González F. La legibilidad de los textos. Santiago de Chile: Andrés Bello, 1994; p. 24. [ Links ]
16. Mader TJ, Playe SJ. Emergency Medicine Research Consent Form Readability Assessment. Ann Emerg Med. 1997;29:534-9. [ Links ]
17. Montgomery JE, Sneyd JR, Consent to Clinical trials in anaesthesia. Anaesthesia. 1998; 53:227-30. [ Links ]
18. Brown H, Ramchandani M, Gillow JT, Tsaloumas MD. Are patient information leaflets contributing to informed consent for cataract surgery? J Med Ethics. 2004; 30(2):218-220. [ Links ]
19. Casajús Perez G, Manas Segura A, Guardia Mila N. Readability of informed consent forms. Enferm Clin. 2005;15(1):3-7. [ Links ]
20. Cutilli CC. Do your patients understand? How to write effective healthcare information. Orthopaedic Nursing. 2006;25(1):39-48. [ Links ]
21. Molina L. Readability of education materials and informed consent forms for women seeking surgical sterilization. Intern J Gynecol Obstet. 2001;73:177-8. [ Links ]
22. Jolly BT, Scott JL, Feied CF, Sanford SM: Functional Illiteracy Among Emergency Department Patients: A Preliminary Study. Ann Emerg Med. 1993; 22(3):573-8. [ Links ]
23. Bernardini C, Ambrogi V, Perioli L, Tiralti MC, Fardella G. Comprehensibility of the package leaflets of all medicinal products for human use: a questionnaire survey about the use of symbols and pictogram. Pharmacol Res. 2000; 41: 679-88. [ Links ]
24. Bradley B, Singleton M, Po LW. Readability of patient information leaflets on-over-the-counter (OTC) medicines. J Clin Pharm Therap. 1994;19:7-15. [ Links ]
25. Croft DR, Peterson MW. An evaluation of the quality and contents of asthma education on the world wide web. Chest. 2002;121(4):1301. [ Links ]
26. Berland GK, Elliott MN, Morales LS, Algazy JI, Kravitz RL, Broder Ms et al. Health Information on the Internet: Accesibility, quality and readability in English and Spanish. JAMA. 2001; 285 (20): 2612-21. [ Links ]
27. Barrio Cantalejo IM, Simón Lorda P. Medición de la legibilidad de textos escritos: Correlación entre método manual de Flesch y métodos informáticos. Aten Primaria. 2003;31(2):104-8 [ Links ]
28. Mirón Canelo JA, Alonso Sardón M, Sáenz González MC. Estimar la comprensión de los prospectos de los medicamentos. Aten Farmacéutica. 2000;2:358-63. [ Links ]
29. Payne S, Large S, Jarrett N,Turner P.Written information given to patients and families by palliative care units: a national survey. Lancet. 2000; 355: 1792. [ Links ]
30. Molina L. Readability of education materials and informed consent forms for women seeking surgical sterilization. Intern J Gynecol Obstet. 2001;73:177-8. [ Links ]
31. Herrero A, Reyes A, García F, Serrano E. Documentos de consentimiento informado en atención primaria. Revista de Calidad Asistencial. 2002;17(1):325-30. [ Links ]
32. Smith T. Information for patients: Writing simple English is difficult, even for doctors. BMJ. 1992;305:1242. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Inés Mª Barrio Cantalejo
C/ Doctor Azpitarte, 4-4ª planta
18014 Granada
imbarrioc@gmail.com















