Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Salud Pública
versión On-line ISSN 2173-9110versión impresa ISSN 1135-5727
Rev. Esp. Salud Publica vol.83 no.5 Madrid sep./oct. 2009
Evolución del sarampión, rubeola y parotiditis desde la III Encuesta de serovigilancia de la Comunidad de Madrid 1999-2000 (III ESVCM)
Evolution of Measles, Rubella and Mumps from the Third Seroepidemiological Survey in the Autonomous Region of Madrid, Spain
Juan Carlos Sanz Moreno (1,2), Luis García Comas (3), Rosa Ramírez Fernández (4), Belén Ramos Blázquez (1) y María Ordobás Gavín (3)
(1) Laboratorio Regional de Salud Pública de la Comunidad de Madrid.
(2) CIBER en Epidemiología y Salud Pública, CIBERESP.
(3) Servicio Epidemiología. Comunidad de Madrid.
(4) Subdirección General de Salud Pública. Ministerio de Sanidad y Política Social.
Dirección para correspondencia
RESUMEN
En el presente trabajo se han revisado los resultados de seroprevalencia frente a sarampión, rubéola y parotiditis obtenidos en la III Encuesta de Serovigilancia de la Comunidad de Madrid (III ESVCM) realizada en 1999-2000 y la posterior evolución de estas tres enfermedades en esta región.
En la III ESVCM la prevalencia de anticuerpos frente a sarampión, rubéola y parotiditis fue respectivamente >90%, >95% y <90%. Pese a los buenos resultados obtenidos para rubéola y sarampión, en los años 2005 y 2006 surgieron en Madrid dos importantes brotes de estas enfermedades. El brote de rubéola de 2005 (460 casos) afectó especialmente a población inmigrante de ambos sexos (procedentes mayoritariamente de América Central y del Sur) y varones adultos españoles. El brote de sarampión de 2006 (174 casos) fue importado, una elevada proporción de casos eran adultos, la mayoría de los pacientes no estaban vacunados y no se observaron diferencias por del sexo. En la Comunidad de Madrid la circulación del virus de la parotiditis ha continuado desde 1999 hasta la actualidad y se han detectado ondas epidémicas en los periodos 2000-2001 y 2006-2007. Durante el período 2006-2007 una importante proporción de los casos presentaron antecedentes de vacunación.
Cada una de estas tres enfermedades presenta características propias. Sin embargo, las tres muestran en común el cambio en la edad de aparición con una frecuencia cada vez mayor de casos entre adultos jóvenes.
Palabras clave: Sarampión. Rubeola. Parotiditis. Seroprevalencia. Brotes epidémicos.
ABSTRACT
In this study results against measles, rubella and mumps obtained in the III Sero-epidemiological Survey of the Autonomous Region of Madrid, performed in 1999-2000, were related to the posterior evolution of these diseases in this Region.
The prevalence of antibodies against measles, rubella and mumps was >90%, >95% and <90 %, respectively. Despite of the good results obtained for rubella and measles, in 2005 and 2006 two important outbreaks of these diseases occurred in Madrid. The rubella outbreak in 2005 (450 cases) affected especially to immigrants of both sexes (mainly from Central and South America) and Spanish adults males. The 2006 measles outbreak (174 cases) was imported, a high proportion of cases were adults and most of the patients were unvaccinated. No differences according to sex were observed. In Madrid mumps virus circulation has continued from 1999 to present. Two epidemic waves in the periods 2000-2001 and 2006-2007 have been detected. During 2006-2007, an important proportion of cases showed antecedents of vaccination.
Each one of these three diseases has typical characteristics. However, the three has in common the change in the age of apparition, with a growing frequency of cases among young adults.
Key words: Measles. Rubella. Mumps. Seroprevalence. Outbreaks.
Introducción
En el año 2003 la OMS elaboró el plan estratégico para la eliminación del sarampión y el control del síndrome de rubéola congénita en la Región Europea. Este plan establece la interrupción de la transmisión del sarampión indígena y la reducción de la incidencia del síndrome de rubéola congénita (SRC) a menos de 1 caso por 100.000 nacidos vivos1-3 para el año 2010. Recientemente se ha incorporado la eliminación de la rubéola endémica como un nuevo objetivo a nivel nacional4. Algunas comunidades autónomas (CCAA) han instaurado un programa propio y específico de eliminación de la rubéola5 y lanzado planes autonómicos de eliminación de la parotiditis6. Sin embargo, a pesar de los logros evidentes en el control de estas infecciones, en los últimos años se han originado en países desarrollados (incluyendo a España) diversos brotes de sarampión, rubéola y parotiditis. Aunque los motivos de reaparición de estas tres enfermedades son complejos, existen ciertos aspectos (no necesariamente comunes) que pueden ayudar a explicar la re-emergencia de cada una de ellas.
Las encuestas de serovigilancia aportan datos referidos a un entorno poblacional concreto en un momento determinado, sobre la prevalencia de anticuerpos frente a ciertas enfermedades infecciosas. En lo referente a las enfermedades vacunables como sarampión, rubéola y parotiditis, existen estimaciones sobre los niveles de seroprevalencia que pueden otorgar inmunidad de grupo7. A partir de estas encuestas se realizan previsiones para el futuro. No obstante, estas previsiones pueden alterarse por cambios ecológicos, motivados por factores como los movimientos poblacionales, las modificaciones en la composición de algunas vacunas y las variaciones antigénicas de los agentes infecciosos.
En el presente trabajo se han revisado los resultados de seroprevalencia frente a sarampión, rubéola y parotiditis obtenidos en la III Encuesta de Serovigilancia de la Comunidad de Madrid realizada en 1999-2000 (III ESVCM)8 y la posterior evolución de estas tres enfermedades en esta región.
Sarampión
La inmunización sistemática con la vacuna triple vírica (VTV) frente a sarampión, rubéola y parotiditis fue introducida en la Comunidad de Madrid en 1981 con una dosis a los 12-15 meses. En 1996 se añadió una segunda dosis a los 11 años9. Se ha estimado que se precisa al menos una cobertura vacunal del 80% para impedir la expansión del sarampión10. Esta cobertura está superada en nuestro medio11,12. En la III ESVCM, la prevalencia de anticuerpos frente a sarampión superó el 90% en todos los grupos de edad (tabla 1). La mayor proporción de sujetos susceptibles se observó en dos grupos de edad: el de 2-5 años (9,5%) seguido del de 16-20 (4,6%)8. En 1999 la segunda dosis de VTV se había adelantado en la Comunidad de Madrid a los cuatro años13 por lo que se estimó que muy previsiblemente se elevaría la protección de los niños a partir de esta edad. El siguiente grupo con más individuos susceptibles correspondía a sujetos no vacunados y nacidos cuando la circulación del virus salvaje había comenzado a declinar (en la actualidad en torno a los 26-30 años). Estas tasas de seronegatividad frente a sarampión cumplían los requerimientos de la OMS14 para la eliminación de la enfermedad (con valores inferiores al 5% en los niños mayores de 10 años, inferiores al 10% en los niños de 5 a 9 años, e inferiores al 15% en los menores de 5 años).
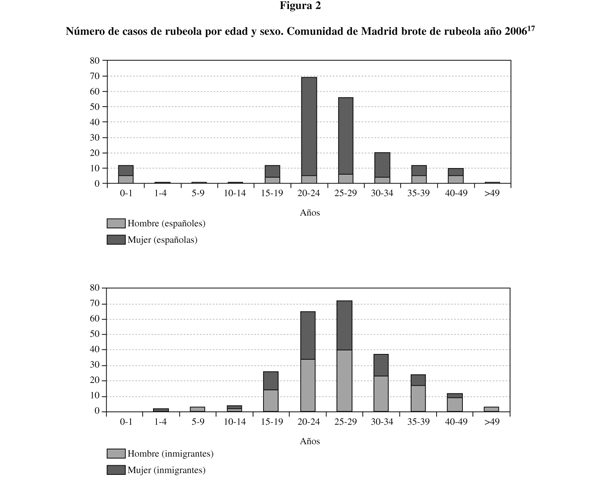
Dado que el nivel global de susceptibilidad al sarampión se consideraba dentro de los estándares establecidos15 y que la circulación del virus había descendido en la Comunidad de Madrid desde 199816, no parecía existir un riesgo alarmante para el sarampión. Sin embargo, en 2006 se produjo en Madrid un brote de grandes dimensiones, con 174 casos (2,92 por 100.000 habitantes)17. La mayoría de las personas afectadas no estaban vacunadas (90,8%). Las personas no inmunizadas presentan, en relación con las vacunadas, un riesgo 200 veces mayor de padecer sarampión18. No obstante, es posible la aparición de casos en sujetos vacunados19, especialmente en los que recibieron una sola dosis20. Estos casos se incrementan en función de la edad21-23. En el brote no se observaron diferencias según sexo (figura 1). A diferencia de otros brotes epidémicos recientes registrados en otras CCAA, que afectaron mayoritariamente a niños menores de 15 meses24,25, una elevada proporción de casos del brote de Madrid de 2006 eran adultos (el 47,4% eran individuos de 20-34 años)17. El perfil de casos y brotes de sarampión en España muestra un predominio en personas menores de 15 meses y adultas jóvenes26. En otros países occidentales se ha detectado también un incremento de la incidencia de sarampión entre jóvenes27,28. Entre los años 1993 y 2001 más de un tercio de los brotes registrados en Estados Unidos se produjeron de manera predominante en población adulta29. Durante 2006 se detectaron otros brotes de sarampión prácticamente por todo el continente Europeo (Grecia30, Ucrania31, Alemania32, Polonia33, Bielorrusia34, Italia35, Reino Unido36, Suecia y Dinamarca37). En muchos de estos brotes la infección se propagó fundamentalmente entre personas adultas. Sin embargo, cuando el virus alcanza a colectivos de niños no vacunados (menores de 15 meses en nuestro entorno) se alcanzan tasas de ataque extremadamente elevadas31.
En países desarrollados, tras la eliminación de la transmisión endémica, muchos brotes pueden tener su origen a partir de casos importados38. No obstante, dado que en todo el mundo la vacunación frente a sarampión ha estado más extendida que la de rubéola, los cambios poblacionales derivados del fenómeno de la inmigración, una vez iniciados estos brotes, no parecen tener tanta importancia en su mantenimiento. Se ha sugerido que las personas inmigrantes pueden representar un grupo de riesgo para el sarampión26. En principio, este riesgo sería aplicable a personas recién llegadas de zonas con alta endemia (África y Asia) que pudieran estar infectadas en el momento de entrar en nuestro país. Sin embargo, la mayor parte de los casos importados en Europa durante 2006 y 2007 provenían de otros países europeos20. Aunque el origen del brote de Madrid en 2006 fue importado (el caso índice procedía del Reino Unido), la mayoría de los afectados eran españoles (84,6%)17. El hecho de que la proporción de casos entre inmigrantes fuera muy similar a la de individuos extranjeros empadronados en nuestra región39 sugiere que los primeros no presentan un riesgo muy superior para contraer la enfermedad. Pese al marcado descenso de la incidencia mundial de sarampión alcanzado en los últimos años40,41, el incremento de viajes internacionales (se estima que al año transitan por el aeropuerto de Barajas más de 50 millones de pasajeros42), hace que continúe el peligro de introducción en nuestro país de cepas importadas. En el brote de Madrid en 2006 el 2,9% de los casos contrajeron la infección en el entorno del aeropuerto17.
El sarampión es una infección con una elevadísima capacidad de transmisión. Su número reproductivo básico, que indica cuántos casos secundarios pueden generarse a partir del caso índice en una población susceptible, puede llegar a ser superior a 1540. Por ello, aún consiguiendo eliminar la transmisión endémica de sarampión, es posible la aparición de brotes entre grupos de individuos inmunológicamente desprotegidos. Un problema que puede interferir en el control del sarampión radica en la posibilidad de difusión en el ámbito sanitario43-46. Es importante señalar que en el brote de Madrid de 2006 en el 9,2% de los casos la transmisión del virus fue nosocomial17. Esta forma de extensión de la infección44-46 y la ocurrencia de casos entre profesionales asistenciales24,36,43,47,48 han sido documentadas en otros brotes. En situación de brote y debido a sus mayores probabilidades de exposición, el riesgo relativo de enfermar de los trabajadores sanitarios resulta entre 7 y 45 veces superior al de la población general adulta49. Este riesgo se potencia por el incumplimiento de las medidas básicas de autoprotección, como son el lavado de las manos, el uso de mascarilla y el aislamiento respiratorio de los casos sospechosos50. Por todo ello, se recomienda la vacunación de los trabajadores sanitarios que carezcan de inmunidad específica48,50-53. Estas personas deberían tener acreditada la vacunación con dos dosis31. Su inmunoprotección, aparte de los evidentes beneficios a nivel individual, es imprescindible para evitar que, tras el contacto con una persona enferma, surjan nuevas cadenas de casos secundarios en el ámbito asistencial.
Rubeóla
En la III ESVCM la prevalencia de anticuerpos frente a rubéola superó el 95% en todos los grupos de edad (tabla 2)8. Estos resultados situaban a nuestra región como una zona de bajo riesgo para rubéola54. A partir de los 6 años la prevalencia fue más elevada en el sexo femenino. Esta diferencia resultó significativa en el grupo de 16-20 años (en la actualidad 26-30 años: 98,7% en mujeres versus 93,1% en varones)8. La mayor seroprevalencia en mujeres, descrita también en otras encuestas de serovigilancia llevadas a cabo en nuestro país12,55, es consecuencia de las campañas de inmunización selectiva de niñas adolescentes realizadas a finales de los años setenta del pasado siglo. Estas campañas tenían como finalidad reducir el riesgo de SRC. Algunos datos específicos en mujeres en edad fértil aportan cifras de prevalencia aún más elevadas próximas al 99%5,56. Sin embargó, la seroprevalencia resulta más baja en las poblaciones de origen inmigrante57.
El grado de protección frente a rubéola varía entre diferentes países dependiendo del tipo de vacunación (generalizada o no) y nivel previo de circulación natural del virus58. En algunas naciones hasta hace poco tiempo se ha vacunado frente a sarampión pero no frente a rubéola59. En Latinoamérica la susceptibilidad a rubéola entre adultos en la década de los 90 era elevada60. En Europa, los países del Este y las Repúblicas ex-Soviéticas acumulan la mayoría de los casos61. Se han publicado datos de prevalencia que oscilan entre el 68,5% en Nigeria62 y el 97,7% en Irlanda63, pasando por cifras intermedias como el 76% en Sri Lanka64; el 77,5% en la Federación Rusa65 y el 89% de Brasil66.
En los últimos años en la Comunidad de Madrid se ha producido un brusco cambio demográfico (el porcentaje de extranjeros empadronados ha pasado de un 2,6% en 1999 a un 15,4% en 2007)39. El continente Americano (América del Sur y Central) es el principal lugar de origen de estas personas39. Como resultado de este importante flujo inmigratorio puede propiciarse que, por un efecto de "dilución poblacional", se registre un incremento de la susceptibilidad general frente a la rubéola. Estos cambios pueden favorecer la aparición de brotes con características comunes.
Entre febrero y marzo de 2003 se produjo un brote de rubéola en Madrid, con 19 casos en mujeres de origen latinoamericano en edad fértil67 (14 casos confirmados por laboratorio)68. En el primer semestre de 2005 tuvo lugar el mayor brote de rubéola registrado en España en los últimos años (460 casos)69,70, que afectó especialmente a población de 15 a 39 años (88,4%). La mayoría de los pacientes (56,2%) eran inmigrantes de ambos sexos (procedentes principalmente de América Central y del Sur) y varones adultos españoles (81,5% de los casos en población autóctona) (figura 2). Este brote alcanzó una incidencia de 8,04 casos por 100.000 habitantes (16,8 veces superior a la incidencia anual media entre 1998 y 2004)69. A finales de ese mismo año se detectó en Cataluña otro brote, aunque de menores dimensiones (8 casos), entre personas originarias de Brasil71. Un riesgo de estos brotes es que pueden preceder a la aparición de agregaciones de casos de SRC meses después72-73. En el último cuatrimestre de 2005 se registraron en la Comunidad de Madrid 3 casos de SRC (algo que no ocurría desde el año 2000)74. En la Comunidad de Madrid la tendencia creciente de casos de rubéola entre inmigrantes es continua desde 2001 hasta la actualidad75. En conjunto han predominado los casos entre varones y menos del 10% se ha dado en menores de 15 meses75. En resumen, se puede considerar que los grupos más vulnerables a la rubéola están constituidos por personas inmigrantes (Latinoamérica) y varones jóvenes74-76. Como en el caso de sarampión, es preciso que los profesionales sanitarios estén adecuadamente protegidos. Los casos de rubéola en menores de 15 meses parecen ser menos frecuentes que los de sarampión.
Parotiditis
En la III ESVCM la prevalencia de anticuerpos frente a parotiditis no alcanzó el 90% en ningún grupo de edad (tabla 3). La cifra más baja se observó en el grupo de 2-5 años. En comparación con el sarampión y la rubéola, otros estudios también han detectado una menor seroprevalencia a parotiditis12,55, especialmente en niños pequeños12,77. Esta baja prevalencia en niños se atribuyó al empleo de la cepa vacunal Rubini (administrada en Madrid entre noviembre de 1996 y mayo de 1999).
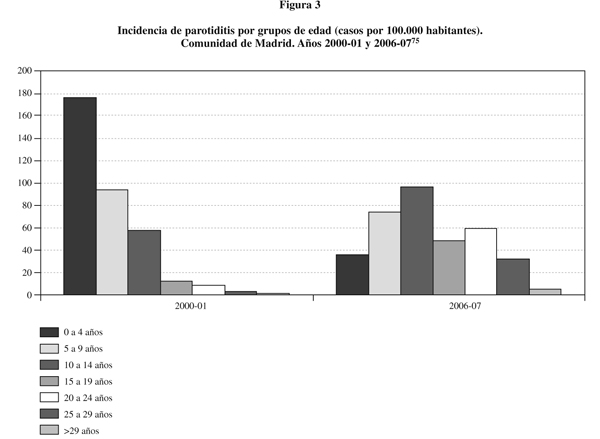
En España el número de casos de parotiditis es muy superior al de sarampión y rubéola. En los últimos años se han detectado picos de mayor incidencia en 2000 y en 2006-200770,78. En la Comunidad de Madrid también se ha observado la aparición de ondas epidémicas en los periodos 2000-2001 y 2006-200775. La reemergencia de esta enfermedad se ha relacionado, en parte, con el uso de la vacuna Rubini78,79 durante la década de los años noventa. En nuestro país se han administrado diferentes cepas vacunales de parotiditis. En 1992 se retiró la cepa Urabe por sus mayores efectos secundarios. A partir de entonces se utilizaron las cepas Rubini y Jeryl Lynn. Entre las ventajas de la cepa Rubini se postuló que evitaba la sensibilización a proteínas aviarias80. Esta cepa se considera menos inmunógena81 y menos eficaz82 que otras como Jeryl Lynn. Ésta proporciona niveles significativamente más elevados de anticuerpos83 y a partir de 1999 se empleó sistemáticamente en la Comunidad de Madrid. Sin embargo, tampoco parece garantizar una total protección84,85. La eficacia estimada de esta cepa en los ensayos clínicos controlados pre-comercialización era del 95%, mientras que en los estudios de efectividad post-licencia osciló entre 62%-85%86,87. Durante 2005 y 2006 el 77% de los casos de parotiditis en España ocurrieron en mayores de 15 años, y el 46% entre 15 y 24 años (correspondientes a cohortes no vacunadas, vacunadas con una sola dosis o vacunadas con la cepa Rubini)78. La figura 3 muestra la incidencia de parotiditis por grupos de edad (casos por 100.000 habitantes) en la Comunidad de Madrid durante los años 2000-01 y 2006-07. Durante el periodo 2006-2007 una importante proporción de los casos presentaron antecedentes de vacunación (67,8% [42,8% con dos dosis])75. El mayor número de casos (52,5%) se dio en las cohortes de nacidos entre 1996-1999 (22,6%; 8-11 años en 2007) y 1980-1988 (29,9%; 19-24 años en 2007). Según el calendario vacunal del momento, estas personas habrían recibido al menos una dosis de Jeryl Lynn75.
Para explicar el incremento de parotiditis se han postulado factores tales como la posibilidad de aparición de casos subclínicos que facilitan la transmisión de la infección y la pérdida de inmunidad a lo largo del tiempo88. Entre los casos registrados en la Comunidad de Madrid durante el periodo 2006-2007 se ha observado un incremento de la incidencia en función del tiempo transcurrido desde la administración de la segunda dosis75. De forma similar a lo que ocurre con rubéola y sarampión, los casos y brotes de parotiditis son cada vez más frecuentes en adultos jóvenes75,89,90. Este cambio de tendencia en la edad también se ha observado en otros países88,91-93. Sin embargo la inmigración no parece constituir un factor especialmente predisponente, al contrario de lo que sucede con la rubéola75. A diferencia de otras enfermedades víricas, la inmunidad frente al virus de parotiditis puede no ser completa y son posibles las reinfecciones94. Se ha comprobado que los anticuerpos neutralizantes frente a una determinada cepa no necesariamente protegen frente a genotipos heterólogos95. Entre 1996 y 2007 circularon en España 6 genotipos distintos. El genotipo H1, que fue el predominante durante la onda epidémica de 2000-2001, ha sido reemplazado en 2006-2007 por el G1. No obstante, para aclarar la posible variabilidad de la eficacia vacunal en función del genotipo mayoritario en un determinado momento y lugar se requiere la realización de estudios específicos.
Se considera que el diagnóstico de laboratorio es necesario aún en el contexto de un brote de parotiditis. Sin embargo, se estima que sólo el 10% de los casos sospechosos llegan a confirmarse96. Los antecedentes de vacunación representan un problema para el diagnóstico serológico convencional de parotiditis (detección de IgM específica). Una elevada proporción de los casos en individuos previamente vacunados muestran resultados negativos de IgM junto con títulos muy elevados de IgG97,98. Este patrón serológico, con títulos elevados de IgG de alta avidez es característico de una respuesta inmune secundaria y sugiere un fallo vacunal secundario100. Dado que la detección de IgM puede infraestimar la incidencia real de parotiditis, es necesario recurrir a otras alternativas como son la amplificación de ARN vírico por RT-PCR o la titulación de IgG específica78. En la Comunidad de Madrid se ha introducido una nueva categoría de clasificación de caso75 basada en puntos de corte de IgG respecto a la población general97,98. Según esta estrategia, que sólo es aplicable en situaciones epidémicas o brotes, un 33,6% de los casos sospechosos de parotiditis en el período 2006-2007 fueron confirmados, mientras que un 19,4% se consideraron probables75.
El mantenimiento de una circulación estable del virus, la elevada incidencia de la enfermedad, los cambios en la edad de presentación, la aparición de un elevado número de casos en personas vacunadas y las dificultades de confirmación diagnóstica, hacen que la parotiditis continúe siendo un problema en nuestro medio.
Conclusiones
Estas tres enfermedades, aunque muestran características epidemiológicas comunes (ya no se pueden seguir considerando exclusivamente enfermedades propias de la infancia), presentan a su vez rasgos distintivos de cada una de ellas.
La cobertura vacunal con VTV en nuestro medio es muy alta. En los casos del sarampión y la rubéola esta excelente cobertura se asocia con una elevada seroprevalencia y con la interrupción de la circulación autóctona de estos virus. No obstante continúa el riesgo de brotes epidémicos a partir de casos importados. Estos casos pueden proceder de países con alta endemia, pero también pueden importarse desde naciones desarrolladas con brotes puntualmente activos. Los grupos de mayor riesgo en brotes de sarampión incluyen, junto a los niños menores de 15 meses (todavía no vacunados), a personas adultas jóvenes. En estos brotes existe la posibilidad de transmisión nosocomial a partir de trabajadores sanitarios desprotegidos. En el caso de la rubéola los adultos jóvenes (en especial varones e inmigrantes de ambos sexos) también constituyen un sector poblacional de riesgo.
En lo referente a la parotiditis, la menor eficacia de la vacuna hace que la seroprevalencia resulte subóptima, que la circulación del virus continúe y que la incidencia de esta infección sea muy superior a la del sarampión o la rubéola. En esta enfermedad la presencia de anticuerpos específicos no implica una absoluta inmunoprotección. Además estos anticuerpos pueden interferir en la confirmación serológica de algunos casos, dando lugar a problemas de infradiagnóstico.
Bibliografía
1. Hanon FX, Spika John J, Wassilak Steven S, Emiroglu N. WHO European Region's strategy for elimination of measles and congenital rubella infection. Euro Surveill. 2003; 8: 129-38. [ Links ]
2. World Health Organization. Strategic plan for measles and congenital rubella infection in the European Region of WHO. Copenhagen: WHO Regional Office For Europe; 2003. Disponible en: http://www.euro.who.int/document/e81567.pdf. [ Links ]
3. World Health Organization. Eliminating measles and rubella and preventing congenital rubella infection. WHO European Region strategic plan 2005-2010. Copenhagen: WHO Regional Office For Europe; 2005 Disponible en: http://www.euro.who.int/document/E87772.pdf [ Links ]
4. Martínez de Aragón MV, Peña-Rey I, Cortés García M, Suárez Rodríguez B. Protocolo de vigilancia de la Rubéola y del síndrome de Rubéola congénita en la fase de eliminación. Madrid: Centro Nacional de Epidemiología; 2008. Disponible en: http://www.isciii.es/htdocs/centros/epidemiologia/pdf/Protocoloeliminacionrubeola.pdf [ Links ]
5. Domínguez A, Torner N, Martínez A, Costa J, Plans P, Ciruela P, et al. Rubella elimination programme strengthened through measles elimination programme in Catalonia. Vaccine. 2006; 24: 1433-7. [ Links ]
6. Generalitat de Catalunya. Departament de Salut. Guia per a l´eminació de la parotiditis a Catalunya. Bases cientifiques i programa. Quaderns de salut pública. No 20. Disponible em: http://www.gencat.net/salut/depsan/units/sanitat/pdf/gparo.pdf [ Links ]
7. Anderson RM, May RM. Immunisation and herd immunity. Lancet. 1990; 335: 641-5. [ Links ]
8. III Encuesta de Serovigilancia de la Comunidad de Madrid. Bol Epidemiol Comunidad Madrid 2002; 8: 3-41. Disponible en: http://www.madrid.org/cs/Satellite?blobtable=MungoBlobs&blobcol=urldata&blobkey=id&blobheadervalue1=filename%3Dmayo2002.pdf&blobwhere=1119142927576&blobheadername1=Content-Disposition&ssbinary=true&blobheader=application%2Fpdf [ Links ]
9. Nuevo Calendario vacunal. Bol Epidemiol Comunidad de Madrid. 1996; 19: 25-7. [ Links ]
10. Rosenthal J, Raymond D, Morita J, McCauley M, Diaz P, David F, et al. African-American children are at risk of a measles outbreak in an inner-city community of Chicago, 2000. Am J Prev Med. 2002; 23: 195-9. [ Links ]
11. Plan de Eliminación del Sarampión en la CM. Documento Técnico de Salud Pública num 73. Madrid: Instituto de Salud Pública de la CM; 2002. Disponible en: http://www.madrid.org/sanidad/salud/publicaciones/pdf_DT/DT73.pdf [ Links ]
12. Amela C, Pachón I, de Ory F. Evaluation of the measles, mumps and rubella immunisation programme in Spain by using a sero-epidemiological survey. Eur J Epidemiol. 2003; 18: 71-9. [ Links ]
13. Calendario vacunal 1999. Bol Epidemiol Comunidad de Madrid. 1999; 4: 50-9. [ Links ]
14. World Health Organization. Measles. A strategic framework for the elimination of measles in the European Region. The Expanded Programme on Immunization in the European Region of WHO. Copenhagen: World Health Organization; 1999. [ Links ]
15. de Melker H, Pebody RG, Edmunds WJ, Lévy-Bruhl D, Valle M, Rota MC, et al. The seroepidemiology of measles in Western Europe. Epidemiol Infect. 2001; 126: 249-59. [ Links ]
16. González M, Castañeda R, Ramírez R, Rodríguez SF, García-Comas L, Sanz JC, et al. Sarampión: situación actual en la Comunidad de Madrid. Rev Ped Aten Primaria. 2002; 5: 47-62. [ Links ]
17. García Comas L, Ordobás Gavín M, Rodero Garduño L, Gutiérrez Rodríguez A, García Fernández C, Sanz Moreno JC et al. Brote de sarampión en la Comunidad de Madrid. Año 2006. Bol Epidemiol Sem. 2007; 15: 1-12. [ Links ]
18. van den Hof S, Conyn-van Spaendonck MA, van Steenbergen JE. Measles epidemic in the Netherlands, 1999-2000. J Infect Dis. 2002; 186: 1483-6. [ Links ]
19. Aurangzeb B, Nisar YB, Hazir T, Burki F, Hassan M. Clinical outcome in children hospitalized with complicated measles. J Coll Physicians Surg Pak. 2005; 15: 547-51. [ Links ]
20. Muscat M, Bang H, Wohlfahrt J, Glismann S, Mølbak K; EUVAC.NET Group. Measles in Europe: an epidemiological assessment. Lancet. 2009; 373: 383-9. [ Links ]
21. Oliveira SA, Siqueira MM, Camacho LA, Castro-Silva R, Bruno BF, Cohen BJ. Use of RT-PCR on oral fluid samples to assist the identification of measles cases during an outbreak. Epidemiol Infect. 2003; 130: 101-6. [ Links ]
22. Sharma MK, Bhatia V, Swami HM. Outbreak of measles amongst vaccinated children in a slum of Chandigarh. Indian J Med Sci. 2004; 58: 47-53. [ Links ]
23. Lee KY, Lee HS, Hur JK, Kang JH, Lee BC. The changing epidemiology of hospitalized pediatric patients in three measles outbreaks. J Infect. 2007; 54: 167-72. [ Links ]
24. Perucha M, Ramalle-Gómara E, Lezaun ME, Blanco A, Quiñones C, Blasco M, et al. A measles outbreak in children under 15 months of age in La Rioja, Spain, 2005-2006. Euro Surveill. 2006;11: 267-70. [ Links ]
25. Domínguez A, Torner N, Barrabeig I, Rovira A, Rius C, Cayla J, et al. Large outbreak of measles in a community with high vaccination coverage: implications for the vaccination schedule. Clin Infect Dis. 2008; 47: 1143-9. [ Links ]
26. Peña-Rey I, Martínez de Aragón MV, Mosquera MM, de Ory F, Echevarría JE. Measles Elimination Plan Working Group in Spain. Measles risk groups in Spain: Implications for the European measles-elimination target. 1: Vaccine. 2009 Jun 19;27(30):3927-34. [ Links ]
27. Ehresmann KR, Crouch N, Henry PM, Hunt JM, Habedank TL, Bowman R, et al. An outbreak of measles among unvaccinated young adults and measles seroprevalence study: implications for measles outbreak control in adult populations. J Infect Dis. 2004; 189, Supl 1: S104-7. [ Links ]
28. Zandotti C, Jeantet D, Lambert F, Waku-Kouomou D, Wild F, Freymuth F, et al. Re-emergence of measles among young adults in Marseilles, France. Eur J Epidemiol. 2004; 19: 891-3. [ Links ]
29. Yip FY, Papania MJ, Redd SB. Measles outbreak epidemiology in the United States, 1993-2001. J Infect Dis. 2004; 189, Supl 1: S54-60. [ Links ]
30. Georgakopoulou T, Grylli C, Kalamara E, Katerelos P, Spala G, Panagiotopoulos T. Current measles outbreak in Greece. Euro Surveill. 2006; 11: E060223.2. [ Links ]
31. Spika JS, Aidyralieva C, Mukharskaya L, Kostyuchenko NN, Mulders M, Lipskaya G, et al. Measles outbreak in the Ukraine, 2005-2006. Euro Surveill. 2006; 11: E060309.1. [ Links ]
32. van Treeck U. Measles outbreak in Germany: over 1000 cases now reported in Nordrhein Westfalen. Euro Surveill. 2006;11: E060511.1. [ Links ]
33. Stefanoff P, Czarkowski MP. Unexpected rise in measles incidence in Poland in 2006 may be related to Ukrainian outbreak. Euro Surveill. 2006; 11: E060629.3. [ Links ]
34. Samoilovich EO, Yermalovich MA, Semeiko GV, Svirchevskaya EI, Rimzha MI, Titov LP. Outbreak of measles in Belarus, January-June 2006. Euro Surveill. 2006; 11: E060727.3. [ Links ]
35. Boncompagni G, Incandela L, Bechini A, Giannini D, Cellini C, Trezzi M, et al. Measles outbreak in Grosseto, central Italy, 2006. Euro Surveill 2006; 11: E060803.4. [ Links ]
36. English PM, Lang N, Raleigh A, Carroll K, Nicholls M. Measles outbreak in Surrey. BMJ 2006; 333: 1021-2. [ Links ]
37. Muscat M, Christiansen AH, Persson K, Plesner AM, Bottiger BE, Glismann S, et al. Measles outbreak in the Oresund region of Denmark and Sweden. Euro Surveill 2006; 11: E060330.4. [ Links ]
38. Papania MJ, Seward JF, Redd SB, Lievano F, Harpaz R, Wharton ME. Epidemiology of measles in the United States, 1997-2001. J Infect Dis. 2004; 189, Supl 1: S61-8. [ Links ]
39. Desván. Banco de datos estructurales. Madrid: Instituto de Estadística de la Comunidad de Madrid. http://infomadrid/desvan/desvan/desvan.html [ Links ]
40. Rima BK, Duprex WP. Morbilliviruses and human disease. J Pathol. 2006; 208: 199-214. [ Links ]
41. WHO 2008. Immunization surveillance, assessment and monitoring. Copenaghem: WHO; 2008. Measles. Disponible en: http://www.who.int/immunization_monitoring/diseases/measles/en/index.html [ Links ]
42. AENA. Estadísticas de los Aeropuertos. Madrid: Aena; Disponible en: http://www.aena.es/csee/Satellite?pagename=Estadisticas/Home [ Links ]
43. Mendelson GM, Roth CE, Wreghitt TG, Brown NM, Ziegler E, Lever AM. Nosocomial transmission of measles to healthcare workers. Time for a national screening and immunization policy for NHS staff? J Hosp Infect. 2000; 44: 154-5. [ Links ]
44. Blake KV, Nguyen OT, Capon AG. Nosocomial transmission of measles in western Sydney. Med J Aust. 2001; 175: 442. [ Links ]
45. Nakano T, Ihara T, Kamiya H. Measles outbreak among non-immunized children in a Japanese hospital. Scand J Infect Dis. 2002; 34: 426-9. [ Links ]
46. Marshall TM, Hlatswayo D, Schoub B. Nosocomial outbreaksa potential threat to the elimination of measles? J Infect Dis. 2003; 187, Supl 1: S97-101. [ Links ]
47. Rooney JA, Milton DJ, Hackler RL, Harris JH, Reynolds D, Tanner M, et al. The largest outbreak of measles in the United States during 1999: imported measles and pockets of susceptibility. J Infect Dis. 2004; 189, Supl 1: S78-80. [ Links ]
48. Peña-Rey I, Martínez de Aragón MV, Castellanos T, Alcalde E, Salamanca L y Grupo de Responsables Autonómicos del Plan de Eliminación del Sarampión y Responsables de los Laboratorios de Referencia del Ámbito Nacional. Informe anual del Plan Nacional de Eliminación del Sarampión. España 2007. Madrid: Centro Nacional De Epidemiología; 2007. Disponible en: http://www.isciii.es/htdocs/centros/epidemiologia/pdf/PLANELIMINACIONSARAMPION2007.pdf [ Links ]
49. Steingart KR, Thomas AR, Dykewicz CA, Redd SC. Transmission of measles virus in healthcare settings during a communitywide outbreak. Infect Control Hosp Epidemiol. 1999; 20: 115-9. [ Links ]
50. Sepkowitz KA. Occupationally acquired infections in health care workers. Part I. Ann Intern Med. 1996; 125: 826-34. [ Links ]
51. Krause PJ, Gross PA, Barrett TL, Dellinger EP, Martone WJ, McGowan JE Jr, et al. Quality standard for assurance of measles immunity among health care workers.Infectious Diseases Society of America. Clin Infect Dis. 1994; 18: 431-6. [ Links ]
52. Zimmerman RK, Middleton DB. Vaccines for persons at high risk due to medical conditions, occupation, environment, or lifestyle, 2005. J Fam Pract 2005; 54, Supl 1: S27-36. [ Links ]
53. Ministerio de Sanidad y Consumo. Vacunación en Adultos Recomendaciones año 2004. Madrid: Ministerio de Sanidad y Consumo; 2004. Disponible en: http://www.msc.es/ciudadanos/proteccionSalud/vacunaciones/docs/recoVacunasAdultos.pdf [ Links ]
54. Nardone A, Tischer A, Andrews N, Backhouse J, Theeten H, Gatcheva N, et al. Comparison of rubella seroepidemiology in 17 countries: progress towards international disease control targets. Bull World Health Organ. 2008; 86: 118-25. [ Links ]
55. Domínguez A, Plans P, Costa J, Torner N, Cardeñosa N, Batalla J, et al. Seroprevalence of measles, rubella, and mumps antibodies in Catalonia, Spain: results of a cross-sectional study. Eur J Clin Microbiol Infect Dis. 2006; 25: 310-7. [ Links ]
56. Gutiérrez N, Sánchez J, Muñoz S, Tarin R, Delgado N, Saenz MC, et al. Seroprevalencia de anticuerpos frente a Treponema pallidum, Toxoplasma gondii, virus de la rubeola, virus de la hepatitis B y C y VIH en mujeres gestantes. Enferm Infecc Microbiol Clin. 2004; 22: 512-16. [ Links ]
57. Garrido E, Alvarez MJ, Gómez J, Martín S, Kloppe P, Hernando T. Seroprevalencia de anticuerpos antirubeola en mujeres inmigrantes en edad fértil en 2 centros de salud en Madrid. Vacunas. 2004; 5: 75-8. [ Links ]
58. Sanz JC, de Ory F. Rubéola: el nuevo escenario de una vieja enfermedad. Enferm Infecc Microbiol Clin. 2006; 24: 36-44. [ Links ]
59. WHO. Immunization surveillance, assessment and monitoring. Rubella. WHO; 2008. Disponible en: http://www.who.int/immunization_monitoring/diseases/rubella/en/index.html [ Links ]
60. Cutts FT, Robertson SE, Diaz-Ortega JL, Samuel R. Control of rubella and congenital rubella syndrome (CRS) in developing countries, Part 1: Burden of disease from CRS. Bull World Health Organ. 1997; 75: 55-68. [ Links ]
61. Spika JS, Wassilak S, Pebody R, Lipskaya G, Deshevoi S, Guris D, Emiroglu N. Measles and rubella in the World Health Organization European region: diversity creates challenges. J Infect Dis. 2003 May 15; 187 Suppl 1:S191-7. [ Links ]
62. Bamgboye AE, Afolabi KA, Esumeh FI, Enweani IB. Prevalence of rubella antibody in pregnant women in Ibadan, Nigeria. West Afr J Med. 2004; 23: 245-8. [ Links ]
63. Knowles SJ, Grundy K, Cahill I, Cafferkey MT. Susceptibility to infectious rash illness in pregnant women from diverse geographical regions. Commun Dis Public Health. 2004; 7: 344-8. [ Links ]
64. Palihawadana P, Wickremasinghe AR, Perera J. Seroprevalence of rubella antibodies among pregnant females in Sri Lanka. Southeast Asian J Trop Med Public Health. 2003; 34: 398-404. [ Links ]
65. Odland JO, Sergejeva IV, Ivaneev MD, Jensen IP, Stray-Pedersen B. Seropositivity of cytomegalovirus, parvovirus and rubella in pregnant women and recurrent aborters in Leningrad County, Russia. Acta Obstet Gynecol Scand. 2001; 80: 1025-9. [ Links ]
66. Reiche EM, Morimoto HK, Farias GN, Hisatsugu KR, Geller L, Gomes AC, et al. Prevalence of American trypanosomiasis, syphilis, toxoplasmosis, rubella, hepatitis B, hepatitis C, human immunodeficiency virus infection, assayed through serological tests among pregnant patients, from 1996 to 1998, at the Regional University Hospital Norte do Paraná. Rev Soc Bras Med Trop. 2000; 33: 519-27. [ Links ]
67. Lemos C, Ramírez R, Ordobás M, Guibert D, Sanz JC, García L, et al. New features of rubella in Spain: the evidence of an outbreak. Euro Surveill. 2004; 9: 9-11. [ Links ]
68. Sanz JC, Lemos C, Herrera D, Ramírez-Fernández R. Brote de rubéola en población inmigrante de origen latinoamericano. Enferm Infecc Microbiol Clin. 2004; 22: 197. [ Links ]
69. Ramírez R, García-Comas L, Ordobas M, Sanz JC, Barranco D. Brote de rubéola en la Comunidad de Madrid. En: Campins Martí M, Moraga Llop FA editores. Vacunas. 2006. Barcelona: Prous Science; 2006: 37-49. [ Links ]
70. WHO. Spain reported cases. WHO; 2008. Disponible en: http://www.who.int/immunization_monitoring/en/globalsummary/timeseries/TSincidenceByCountry.cfm?C=ESP [ Links ]
71. Torner N, Valerio L, Costa J, Parrón I, Domínguez A. Rubella outbreak in young adults of Brazilian origin in a Barcelona suburb, October-December 2005. Euro Surveill; 11: E060223.3. Disponible en: http://www.eurosurveillance.org/ew/2006/060223.asp [ Links ]
72. Panagiotopoulos T, Antoniadou I, Valassi-Adam E. Increase in congenital rubella occurrence after immunisation in Greece: retrospective survey and systematic review. BMJ 1999; 319: 1462-7. [ Links ]
73. Salleras L. Riesgo de rubéola congénita en los hijos de mujeres inmigrantes en España. Vacunas. 2004; 5: 73-4. [ Links ]
74. Morbilidad por Enfermedades de Declaración Obligatoria en la Comunidad de Madrid año 2005. Bol Epidemiol Comunidad de Madrid. 2006; 6: 3-67. [ Links ]
75. Sarampión, rubéola y parotiditis. Comunidad de Madrid, 2007. Bol Epidemiol Comunidad de Madrid. 2008; 11: 4-37. [ Links ]
76. Carnicer-Pont D, Peña-Rey I, de Aragón VM, de Ory F, Dominguez A, Torner N, et al. Regional Surveillance Network. Eliminating congenital rubella syndrome in Spain: does massive immigration have any influence? Eur J Public Health. 2008; 18: 688-90. [ Links ]
77. Nardone A, Pebody RG, van den Hof S, Levy-Bruhl D, Plesner AM, Rota MC, et al. E. Sero-epidemiology of mumps in western Europe. Epidemiol Infect. 2003; 131: 691-701. [ Links ]
78. Centro Nacional de Epidemiología. Situación de la parotiditis en España. Actualización 2008 Madrid: Centro Nacional de Epidemiología; 2008. Disponible en: http://www.isciii.es/htdocs/centros/epidemiologia/pdf/Informe_Parotiditis_CNE_junio_2008.pdf [ Links ]
79. Pons C, Pelayo T, Pachón I, Galmes A, González L, Sánchez C, et al. Two outbreaks of mumps in children vaccinated with the Rubini strain in Spain indicate low vaccine efficacy. Eurosurv. 2000; 5: 80-84. [ Links ]
80. Gluck R, Hoskins JM, Wegmann A, Just M, Germanier R. Rubini, a new live attenuated mumps vaccine virus strain for human diploid cells. Dev Biol Stand. 1986; 65: 29-35. [ Links ]
81. Cruz Rojo C, Rodríguez Iglesias M, Olvera J, Álvarez Girón M. Study of the immune response engendered by differents combined measles, mumps and rubella (MMR) vaccines in an area of Andalusia (Spain). Vaccine. 2003; 22: 280-6. [ Links ]
82. Richard JL, Zwahlen M, Feuz M, Matter HC; Swiss Sentinel Surveillance Network. Comparison of the effectiveness of two mumps vaccines during an outbreak in Switzerland in 1999 and 2000: a case-cohort study. Eur J Epidemiol. 2003; 18: 569-77. [ Links ]
83. Crovari P, Grabutti G, Giammanco G, Dentico P, Moiraghi AR, Poncio F, et al. The Cooperative Group for the Study of MMR vaccines. Reactogenicity and immunogenicity of a new combined Measles-Mups-Rubella vaccine: results of a multicentre trial. Vaccine. 2000;18: 2796-2803. [ Links ]
84. De los Ríos Martín R, García Marín N, Sanz Moreno JC, Ballester Orcal E. Parotiditis en un área urbana de la Comunidad de Madrid. Estado vacunal, diagnóstico y medidas de intervención. Aten Primaria. 2001; 28:10-16. [ Links ]
85. Montes M, Cilla G, Artieda J, Vicente D, Basterretxea M. Mumps outbreak in vaccinated children in Gipuzkoa (Basque Country), Spain. Epidemiol Infect. 2002; 129: 551-6. [ Links ]
86. Hviid A, Rubin S, Mühlemann K. Mumps. Lancet. 2008; 371: 932-44. [ Links ]
87. Cohen C, White JM, Savage EJ, Glynn JR, Choi Y, Andrews N, et al. Vaccine effectiveness estimates, 2004-2005 mumps outbreak, England. Emerg Infect Dis. 2007 Jan; 13: 12-7. [ Links ]
88. Centers for Disease Control and Prevention (CDC). Update: multistate outbreak of mumpsUnited States, January 1-May 2, 2006. MMWR Morb Mortal Wkly Rep. 2006; 55: 559-63. [ Links ]
89. Rodríguez-Framil M, Campos-Franco J, Alende-Sixto R, González-Quintela A. Infección por el virus de la parotiditis en adultos. Enferm Infecc Microbiol Clin 2006; 24: 469-70. [ Links ]
90. Sanz JC, de Ory F, Fernández M, Herranz N, Méndez N, Ramírez R. Evolución de los casos de parotiditis confirmados serológicamente en la Comunidad de Madrid durante un periodo de siete años (2000-2006). Med Clin (Barc). 2008; 130: 292-4. [ Links ]
91. Schmid D, Pichler AM, Wallenko H, Holzmann H, Popow-Kraupp T, Allerberger F. Mumps outbreak affecting adolescents and young adults in Austria, 2006: update. Euro Surveill. 2006; 11: E060706.2. [ Links ]
92. Watson-Creed G, Saunders A, Scott J, Lowe L, Pettipas J, Hatchette TF. Two successive outbreaks of mumps in Nova Scotia among vaccinated adolescents and young adults. CMAJ. 2006; 175: 483-8. [ Links ]
93. Centers for Disease Control and Prevention (CDC). Mumps epidemicUnited kingdom, 2004-2005. MMWR Morb Mortal Wkly Rep. 2006; 55: 173-5. [ Links ]
94. Crowley B, Afzal MA. Mumps virus reinfection-clinical findings and serological vagaries. Commun Dis Public Health. 2002; 5: 311-3. [ Links ]
95. Nojd J, Tecle T, Samuelsson A, Orvell C. Mumps virus neutralizing antibodies do not protect against reinfection with a heterologous mumps virus genotype. Vaccine. 2001; 19: 1727-31. [ Links ]
96. Echevarría JE, Castellanos A, Sanz JC, Pérez C, Palacios G, Martínez de Aragón MV, et al. Circulation of mumps virus genotypes in Spain from 1996 to 2007. J Clin Microbiol. En prensa. [ Links ]
97. Gupta RK, Best J, MacMahon E. Mumps and the UK epidemic 2005. BMJ. 2005; 330: 1132-5. [ Links ]
98. Sanz JC., Fernández M, Sagües MJ, Ramírez R. Diagnóstico de laboratorio de parotiditis en la era postvacunal: nuevas estrategias. Enferm Infecc Microbiol Clin. 2003; 21: 383-4. [ Links ]
99. Sanz JC, Mosquera MM, Echevarria JE, Fernández M, Herranz N, Palacios G, et al. Sensitivity and specificity of immunoglobulin G titer for the diagnosis of mumps virus in infected patients depending on vaccination status. APMIS. 2006; 114: 788-94. [ Links ]
100. Sanz-Moreno JC, Limia-Sánchez A, García-Comas L, Mosquera-Gutiérrez MM, Echevarria-Mayo JE, Castellanos-Nadal A, et al. Detection of secondary mumps vaccine failure by means of avidity testing for specific immunoglobulin G. Vaccine. 2005; 23: 4921-5. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Juan Carlos Sanz.
Laboratorio Regional de Salud Pública.
Consejería de Sanidad. Comunidad de Madrid.
C/ General Oráa 15
28006 Madrid.
Teléfono 91 745 22 84.
Fax 91 411 22 96
Correo electrónico: juan.sanz@salud.madrid.org