My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Española de Salud Pública
On-line version ISSN 2173-9110Print version ISSN 1135-5727
Rev. Esp. Salud Publica vol.84 n.1 Madrid Jan./Feb. 2010
Comparación de los métodos actuales de cribado prenatal del síndrome de down
Comparison of Current Methods of Prenatal Screening for Down Syndrome
Cindy Hörmansdörfer (1), Alejandro Corral (2), Alexander Scharf (3), Bernhard Vaske (4), Peter Hillemanns (1) y Peter Schmidt (1)
(1) Departamento de Obstetricia y Ginecología Universidad de Medicina de Hannover.
(2) Departamento de Obstetricia y Ginecología. Hospital Evangélico de Oberhausen.
(3) Departamento de Obstetricia y Ginecología Universidad de Heidelberg.
(4) Departamento de Biometría y Estadística Médica. Universidad de Medicina de Hannover.
Dirección para correspondencia
RESUMEN
Fundamento: En España se ofrece a todas las mujeres gestantes a partir de los 35 años un examen genético a través de un diagnóstico invasivo (indicación por edad materna (IPEM)) para detectar casos fetales de trisomía 21. En la última década se elaboraron cinco distintos programas de cálculo de riesgo utilizando el «cribado del primer trimestre». El objetivo de este estudio es comparar los resultados de los diferentes métodos de screening para detectar el mejor procedimiento en la actualidad.
Métodos: Desde el 31.08.1999 hasta el 24.05.2007 se realizaron 7.736 screenings del primer trimestre completos, incluyendo el estado de salud del feto, en tres centros de medicina prenatal en las ciudades de Hannover, Peine y Wolfenbüttel en Alemania, de los cuales se analizaron en este estudio retrospectivamente 6.508 casos de datos. Se determinó la edad materna y se efectuaron cálculos de riesgo con los programas PIA, PRC, JOY, AFS y AFS-3D.
Resultados: La IPEM alcanzó una sensibilidad de 57,50%, detectando 23 de 40 casos de trisomía, y una tasa de falsos positivos de 21,60%. En comparación, todos los programas obtuvieron mejores resultados alcanzando una sensibilidad entre 90,00% (AFS) y 92,50% (PIA, PRC, JOY, AFS-3D) y una tasa de falsos positivos entre 2,64% (AFS-3D) y 7,87% (PIA). La diferencia fue de alta significancia (p<0,0001).
Conclusiones: La IPEM es obsoleta e inadecuada en comparación a los programas de cálculo de riesgo, de los cuales todos demostraron rendimientos que se encuentran dentro del rango de publicaciones internacionales comparables. Entre estos programas JOY, AFS y AFS-3D obtuvieron los mejores resultados.
Palabras Claves: Aneuploidía. Síndrome de Down. Cribado del primer trimestre. Trisomía 21. Edad materna.
ABSTRACT
Background: In Spain all pregnant women aged 35 years and older are offered genetic examination through invasive testing in order to detect fetal trisomy 21 cases (maternal age indication (MAI)). In the last decade five distinct software programs utilizing the «first trimester screening (FTS)» were developed. The objective of this study is to compare the test performance of the different screening methods in order to detect the best current approach.
Methods: 7.736 complete first trimester screenings, including the fetal outcome, were realized between 31.08.1999 and 24.05.2007 in three prenatal health centres in Hannover, Peine, and Wolfenbüttel in Germany. Out of these 6.508 cases were analyzed retrospectively in this study. Maternal age was determined and risk calculation with the software programs PIA, PRC, JOY, AFS and AFS-3D was executed.
Results: The MAI reached a sensitivity of 57.50%, detecting only 23 out of 40 trisomy 21 cases, and a false positive rate of 21.60%. In comparison, all risk calculation programs obtained superior results, attaining a sensitivity between 90.00% (AFS) and 92.50% (PIA, PRC, JOY, AFS-3D) and a false positive rate between 2.64% (AFS-3D) and 7.87% (PIA). The difference was highly significant (p<0.0001)
Conclusions: The MAI is obsolete and inadequate in comparison with the risk calculation software, out of which all obtained test performances within the range of comparable international publications. Among these programs, JOY, AFS, and AFS-3D obtained the best results.
Key words: Aneuploidy. Down syndrome. First Trimester pregnancy. Trisomy 21. Maternal age.
Introducción
El síndrome de Down (trisomía 21), con una incidencia de aproximadamente de 1 por cada 600 nacimientos, tiene la mayor relevancia entre las aberraciones cromosómicas numéricas1. Como el riesgo aumenta con la edad materna, en España se ofrece a todas las mujeres gestantes a partir de los 35 años un examen genético a través de un diagnóstico invasivo (amniocentesis o biopsia corial). Este procedimiento, llamado «indicación por edad materna (IPEM)», se creó en los años setenta, cuando solo el 5% de los embarazos se encontraban en este grupo de riesgo elevado. Sin embargo, en Europa, el porcentaje ha aumentado actualmente al 17,5%2, lo que significa que se ofrece una punción a una gestante de cada seis. Debido a su baja tasa de detección de aproximadamente 50% de trisomías2 y los altos riesgos de la punción, como aborto, infección, hemorragia etc, este modo operativo es cada vez más cuestionable.
En los años noventa, Nicolaides y colaboradores desarrollaron un nuevo método de screening conocido como «screening del primer trimestre», el cual está actualmente establecido mundialmente3. Por medio de este procedimiento se alcanzan tasas de detección del síndrome de Down de hasta un 90% 4. Dentro de este concepto el riesgo estadístico de fondo5 está basado en la edad materna y la edad de gestación y se modifica según la medida sonográfica de la traslucencia nucal fetal (TN), y los valores de concentración de la fracción ß libre de gonadotropina coriónica humana (ß-hCG libre) y la proteína plasmática A asociada al embarazo (PAPP-A) en la sangre materna6.
En los últimos años se elaboraron una serie de diferentes ofertas comerciales de programas de computación: «PIA Fetal Database (PIA)», «JOY (JOY)», «Prenatal Risk Calculation (PRC)», «Screening del Primer Trimestre Avanzado (AFS)» y «Screening del Primer Trimestre Avanzado Tridimensional (AFS-3D)» para medir el riesgo de síndrome de Down en relación a las medidas de TN y bioquímica. Estos métodos se diferencian en una serie de aspectos, como el método matemático usado, los cuales se recopilan en la tabla 1. Tomando en cuenta la gran cantidad de innovaciones que se introdujeron rápidamente en los últimos años, la pregunta clave del personal médico y pacientes es: ¿cuál es actualmente el mejor método para el cribado (screening) del síndrome de Down?
El objetivo de este estudio es comparar los resultados de los diferentes métodos de screening para detectar el mejor procedimiento en la actualidad.
Sujetos y métodos
Este trabajo analiza como se comportan los distintos programas de computación y el screening basado en la edad materna (>35 años) en una gran base de datos.
Base de datos: Las mujeres examinadas se presentaron por iniciativa propia, basadas en recomendaciones médicas, información mediática y/o consejo privado, en tres centros de medicina prenatal: Universidad de Medicina de Hannover, Instituto de diagnóstico prenatal y genética humana, Peine y Consultorio Doctores Schmidt, Wolfenbüttel. Desde el 31.08.1999 hasta el 24.05.2007 se realizaron 7.736 screenings del primer trimestre completos incluyendo el estado de salud del feto. Se excluyeron los casos con concentraciones desconocidas en UI/L de los parámetros bioquímicos PAPP-A y ß-hCG libre, así como los casos con otras aneuploidías que no fuesen trisomía 21. Resultó un total de 6.508 casos para el análisis, distribuidos entre Hannover (n=2.640), Peine (n=3.604) y Wolfenbüttel (n=264). El estado de salud del feto se determinó a través de un examen genético mediante una amniocentesis o una biopsia corial, o bien a través de un examen clínico detallado neonatal por parte de un pediatra especialista. En todos los casos se conocían las edades maternas y el tiempo de gestación, las medidas de TN y las concentraciones de PAPP-A y ß-hCG libre en Múltiples de Mediana (Multiples of Median, MoM), así como en UI/L. Esta información fue necesaria para poder realizar el cálculo de riesgo con todos los programas. Todas las medidas fueron realizadas por médicos certificados por la Fundación de Medicina Fetal (Fetal Medical Foundation, FMF). Los análisis bioquímicos se realizaron en el Instituto de diagnóstico prenatal y genética humana, Peine, laboratorio calificado y certificado por la FMF.
Cálculo de riesgos: Se efectuaron los cálculos de riesgo con los programas PIA (GE-ViewPoint, GE Medical Systems, Wessling, Alemania), PRC (Versión 1.0.61, gmt/ nexus, Frankfurt/Main, Alemania), JOY (Versión 2.1, PET-software, Wolfenbüttel. Alemania), AFS (www.firsttrimester.net, Versión 1.2.65, Institute for Prenatal Health GmbH, Wolfenbüttel, Alemania) y AFS-3D (software experimental, PET-software, Wolfenbüttel, Alemania). El cálculo para el riesgo individual (llamado riesgo ajustado) en PIA, JOY, AFS y AFS-3D se basa en el concepto del cociente de probabilidad de Palomaki y Haddow7. El programa PRC se basa, a diferencia de los anteriores, en el teorema de probabilidades de Bayes8. En relación a la influencia de la TN, los programas PIA, JOY y AFS se basan en los estudios de Snijders9, PRC utiliza datos propios de la FMF-Alemania (FMF-Deutschland)10 y AFS-3D se basa en datos propios de un estudio multicéntrico en Alemania11. La influencia de los parámetros bioquímicos PAPP-A y ß-hCG libre se calcula en PIA según Spencer6, en JOY según Wald y Hackshaw12, en PRC según los datos de FMF-Alemania10 y en AFS-3D según los datos de un estudio multi-céntrico en Alemania11. En PIA, JOY, AFS y AFS-3D se ingresaron los parámetros bioquímicos en MoM6, 12, al contrario de PRC, en donde se ingresaron en Grados de Extremos (Degrees of Extremeness, DoE)10, 13. Mediante las respectivas estimaciones de riesgo individualizadas generadas se procede a decidir a favor o en contra de un diagnóstico invasivo ulterior14. Como umbral de decisión (cut-off) se tomó en PIA y JOY un riesgo ajustado de 1:300 14. Para PRC se tomó un cut-off de 1:23010. Para el AFS se definió un tope de 63,3, lo que es equivalente a un riesgo de 1:30015. Para el AFS-3D no se han determinado valores de cut-off definitivos, ya que este programa está todavía en investigación11. En este trabajo provisionalmente se ha escogido un tope de 1:60. El análisis estadístico se realizó con ayuda del programa de computación Analyse-it for Microsoft Excel (versión 1.73, Analyse-it Software Ltd, Leeds, Gran Bretaña). El procesamiento estadístico fue validado por el Instituto de Biometría y Estadística Médica de la Facultad de Medicina de la Universidad de Hannover.
Resultados
Colectivo de estudio. En el colectivo de estudio con 6.508 mujeres gestantes la edad materna estuvo entre 16 y 46 años. La media aritmética de la edad fue de 31,14 años. Hubo una sobrerepresentación del 4,46% del grupo de riesgo sobre los 35 años en comparación a la población general de gestantes en Alemania (17,50%). Se encontraron en el colectivo 40 casos de trisomía 21, que estaban distribuidos en los grupos de edad del modo siguiente: «menor a 25 años»(n=3), «entre 25 y 29 años»(n=8), «entre 30 y 34 años»(n=6), «entre 35 y 39 años»(n=19) y «40 años y mayores»(n=4). Consecuentemente 17 de los casos de síndrome de Down se encontraron en mujeres menores a los 35 años y 23 en mujeres mayores a los 35 años (figura 1).
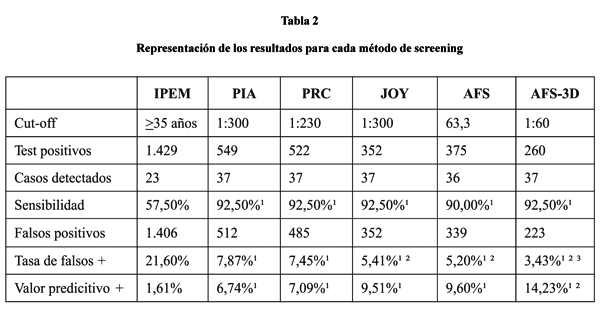
Indicación por edad materna. Con el screening según la IPEM 1.429 de los 6.508 embarazos obtuvieron un resultado positivo (tasa de test positivos = 21,96%), de los cuales 1.407 resultaron falsos positivos (tasa de falsos positivos = 21,60%), ya que los niños eran genéticamente sanos. A la misma vez se detectaron sólo 23 de 40 casos de trisomía (sensibilidad = 57,50%), ignorando una gran parte de trisomías en el colectivo de estudio. Por ello, el valor predictivo positivo alcanzó apenas una tasa de 1,61%. Los resultados están ilustrados en tabla 2.
Programas de cálculo de riesgo. Los programas de computación examinados detectaron correctamente entre 36 y 37 de los 40 casos de trisomía 21, alcanzando una sensibilidad entre 90,00% (AFS) y 92,50% (PIA, PRC, JOY, AFS-3D). La tasa de falsos positivos fue entre 2,64% (AFS-3D) y 7,87% (PIA). Esto implica que para detectar 36 ó 37 casos de trisomía se tendrían que examinar invasivamente de 223 (AFS-3D) a 512 (PIA) embarazos sanos. Consecuentemente el valor predictivo positivo alcanzó entre 6,74% (PIA) y 14,23% (AFS-3D). Los resultados de los análisis se resumen en la tabla 2.
Casos no detectados. En el colectivo hubo dos casos de trisomía 21 que no fueron detectados por ningún método, y un caso que solo fue detectado por AFS. En estos tres casos la edad materna fue menor de 35 años. La TN estuvo solo levemente elevada en dos casos (2,0 y 2,4 mm) y normal en el tercero (1,2 mm). La fracción libre del ß-hCG se encontraba en todos los tres casos dentro del rango normal (1,05, 1,10 y 1,22 MoM). Dos casos mostraron una reducción significativa de PAPP-A (0,56 y 0,63 MoM), pero aún así en combinación con los otros valores medidos ésta no fue suficientemente fuerte para generar un resultado positivo. La Tabla 3 resume todos los valores medidos.
Discusión
En este análisis hubo una sobrerepresentación del 4,46% de las mujeres mayores de 35 años. Esto indica un colectivo no seleccionado, sin embargo debe entenderse que se presentan más mujeres de alto riesgo en centros de diagnóstico prenatal a los que se esperarían en la población normal. Por otro lado también se presentan más mujeres de riesgo en centros universitarios que en centros periféricos o consultorios externos. Esto puede explicar el alto porcentaje de aneuploidías (0,6%, equivalente a uno entre 163 embarazos) en el colectivo estudiado.
En nuestro trabajo se observa muy claramente que el cribado invasivo basado en la IPEM obtiene peores resultados. En este estudio uno de cada 5 embarazos resultó test positivo y de ellos el 98,4% (1.406 de 1.429) fueron falsos positivos. Así, si hubiésemos ofrecido en nuestros centros de estudio a cada una de las 1.429 pacientes un examen invasivo, habríamos detectado solo 23 casos de trisomía. Asimismo se habrían tenido que considerar las siguientes consecuencias negativas: 1. Por un lado cada punción implica una carga innecesaria económico-sanitaria, incluyendo gastos de personal, salas de atención médica, laboratorios y atención médica y/o psicológica en caso de complicaciones. 2. En cada uno de esos casos podemos asumir una considerable carga psicológica en los padres, que resulta de la noticia si el embarazo es de alto riesgo, del proceso de la punción, de la espera del resultado y de la pregunta del procedimiento si se confirma el síndrome de Down en el niño16. 3. Con el diagnóstico invasivo existe el riesgo de complicaciones generales como infección, contracciones prematuras o hemorragia. Sin embargo la complicación más grave es la de un aborto iatrógeno que se da entre 0,06% y 0,50% de las punciones. Esto nos presenta un gran problema ético: en nuestro colectivo, estadísticamente, se habrían perdido las vidas de hasta 7 niños genéticamente sanos por un diagnóstico no indicado por razones médicas 17, 18.
Todos los programas analizados en este estudio alcanzaron una tasa mínima de detección (sensibilidad) de 90,00% y una tasa máxima de falsos positivos de 7,87%, valores que se encuentran dentro del rango en publicaciones internacionales del screening del primer trimestre19. Esto confirma que cualquier programa de cálculo del primer trimestre es superior a la IPEM. La diferencia es de alta significación estadística (p<0,0001). Sin embargo, nuestro estudio también muestra que hay considerables diferencias de calidad de rendimiento entre los diferentes programas. Entre ellos, PIA y PRC obtuvieron los menores resultados y JOY, AFS y AFS-3D los mejores. Se observa que PRC obtuvo levemente mejores resultados que PIA con 27 casos falsos positivos menos. No obstante, hay que señalar que su buen rendimiento se debe a un ajuste del cut-off en PRC20, 21. Si PRC tuviera como PIA un cut-off de 1:300 habría llegado a un total de 598 casos falsos positivos, 86 casos más que PIA. JOY, AFS y AFS-3D obtuvieron los mejores resultados, pero el primero fue retirado del mercado y el tercero todavía está en estado de investigación. Esto lleva nuestra atención al programa AFS. Aunque AFS solo detectó 36 casos de trisomía, un caso menos que PRC o PIA, hay que tener en cuenta que obtuvo una reducción significante de casos falsos positivos: 146 menos en comparación con PRC y 173 con PIA. A la misma vez hay que recalcar que AFS brinda un cálculo simultáneo de trisomías 21, 18 y 13. No se pudo apreciar completamente su rendimiento en este estudio porque se excluyeron los casos de trisomía 13 y 18 del análisis. En cambio, PIA y PRC ofrecen algoritmos adicionales para calcular los riesgos de trisomías 13 y 18. Esto significa que la tasa de falsos positivos probablemente aumentaría en estos dos programas si se ofrece un cálculo de riesgo completo, que incluye las tres aneuploidías22. En ese caso AFS presentaría un rendimiento superior en comparación a PIA y PRC. Sin embargo, se debe prestar especial atención al nuevo concepto AFS-3D. Con tan solo 260 fetos falsos positivos se alcanza un enorme valor predictivo positivo de 14,23%, lo que significa que en uno de cada siete embarazos con resultado positivo se confirma el síndrome de Down. Esto indica un rendimiento superior a otros métodos, como anteriormente fue descrito en un estudio piloto11. No obstante, hay que agregar que la base de datos de este análisis incluye casos que sirvieron para desarrollar el algoritmo de AFS-3D, lo que puede haber influido en los resultados obtenidos. Por eso recomendamos investigar el rendimiento de AFS-3D con un colectivo independiente en un gran estudio prospectivo.
Se puede concluir que el uso del examen invasivo basado en la IPEM está obsoleto en vista a los cambios demográficos actuales y los avances científicos. Debido a las complicaciones asociadas y consecuencias psicológicas y económico-sanitarias es apremiante revisar los protocolos de atención prenatal en España. Se podría evaluar si sería mejor ofrecer en cambio el análisis con los programas de cálculo de riesgo, de los cuales todos consiguieron en el presente estudio valores que se encuentran dentro del rango de publicaciones internacionales comparables.
Bibliografía
1. Shuttleworth GE. Mongolian imbecility. Br Med J. 1909; 2: 661-5. [ Links ]
2. Sancken U. Mütterliches Alter und Prävalenz numerischer Chromosomen-Anomalien: Bedeutung für Patientenaufklärung und Einsatz von Screening-Verfahren. Frauenarzt. 2003; 44(6): 652-6. [ Links ]
3. Nicolaides KH, Azar G, Byrne D, Mansur C, Marks K. Fetal nuchal translucency: ultrasound screening for chromosomal defects in first trimester of pregnancy. Br Med J. 1992; 304: 867-89. [ Links ]
4. Nicolaides KH, Spencer K, Avgidou K, Faiola S, Falcon O. Multicenter study of first-trimester screening for trisomy 21 in 75 821 pregnancies: results and estimation of the potential impact of individual risk-orientated two-stage first trimester screening. Ultrasound Obstet Gynecol. 2005; 25(3): 221-6. [ Links ]
5. Snijders RJM, Sundberg K, Holzgreve W, Henry G, Nicolaides KH. Maternal age and gestation-specific risk for trisomy 21. Ultrasound Obstet Gynecol. 1999; 14: 167-70. [ Links ]
6. Spencer K, Souter V, Tul N, Snijders RJM, Nicolaides KH. A Screening program for trisomy 21 at 10-14 weeks using fetal nuchal translucency, maternal serum free ß-human chorionic gonadotropin and pregnancy-associated plasma protein-A. Ultrasound Obstet Gynecol. 1999; 13: 231-7. [ Links ]
7. Palomaki GE, Haddow JE. Maternal serum alpha-fetoprotein, age, and Down syndrome risk. Am J Obstet Gynecol. 1987; 156(2): 460-3. [ Links ]
8. Schetinin V, Fieldsend JE, Partridge D, Coats TJ, Krzanowski WJ, Everson RM, et al. Confident interpretation of Bayesian decision tree ensembles for clinical applications. IEEE Trans Inf Technol Biomed. 2007; 11(3): 312-9. [ Links ]
9. Snijders RJM , Noble P, Sebire N, Souka A, Nicolaides KH. UK multicentre project on assessment of risk of trisomy 21 by maternal age and fetal nuchal translucency thickness at 10-14 weeks of gestation. Lancet. 1998; 351: 343-6. [ Links ]
10. Merz E, Thode C, Alkier A, Eiben B, Hackelöer BJ, Hansmann M, et al. A new approach to calculating the risk of chromosomal abnormalities with first-trimester screening data. Ultraschall Med. 2008; 29(6): 639-45. [ Links ]
11. Schmidt P, Hörmansdörfer C, Maul H, Hertel H, Hillemanns P, Scharf A. Dreidimensionale Scatterplotanalyse zur Risikoeinschätzung für fetale Aneuploidien - Eine Weiterentwicklung des Ersttrimester Screenings. Z Geburtsh Neonatol. 2008; 212: 127-35. [ Links ]
12. Wald NJ, Hackshaw AK. Combining ultrasound and biochemistry in first-trimester screening for Down's syndrome. Prenat Diagn. 1997; 17: 821. [ Links ]
13. Schmidt P, Hörmansdörfer C, Staboulidou I, Hillemanns P, Scharf A. Using 'Degree of Extremeness' instead of 'Multiples of Median' in first trimester risk assessment for Down syndrome - An improved method or just a gimmick in face of political motivations? Arch Gynecol Obstet. 2008; 278(2): 119-24. [ Links ]
14. Bindra R, Heath V, Liao A, Spencer K, Nicolaides KH. One-stop clinic for assessment of risk for trisomy 21 at 11-14 weeks: a prospective study of 15 030 pregnancies. Ultrasound Obstet Gynecol. 2002; 20(3): 219-25. [ Links ]
15. Schmidt P, Rom J, Maul H, Vaske B, Hillemanns P, Scharf A. Advanced First Trimester Screening (AFS): an improved test strategy for the individual risk assessment of fetal aneuploidies and malformations. Arch Gynecol Obstet. 2007; 276 (2): 159-66. [ Links ]
16. Bieniakiewicz I, Brunk J, Lammers C, Gembruch U, Kowalcek I. Die aktuelle Beanspruchung werdender Eltern vor und nach pränataler Diagnostik in Abhängigkeit von der Untersuchungsindikation. Geburtsh Frauenheilk. 2006; 66: 566-74. [ Links ]
17. Seeds WJ. Diagnostic mid trimester amniocentesis: how safe? Am J Obstet Gynecol. 2004; 191(2): 607-15. [ Links ]
18. Eddleman KA, Malone FD, Sullivan L, Dukes K, Berkowitz RL, Kharbutli Y, et al. Pregnancy loss rates after midtrimester amniocentesis. Obstet Gynecol. 2006; 108(5): 1067-72. [ Links ]
19. Schmidt P, Hörmansdörfer C, Staboulidou I, Seydel J, Vaske B, Brocker K, et al. Gesundheitsökonomische Aspekte des Downsyndrom-Screenings: Vergleich zweier Risikokalkulationsprogramme mit den derzeitigen Bestimmungen der Mutterschaftsrichtlinien in Deutschland. Geburtsh Frauenheilk. 2008; 68: 69-76. [ Links ]
20. Hörmansdörfer C, Scharf A, Golatta M, Vaske B, Hillemanns P, Schmidt P. Preliminary analysis of the Prenatal Risk Calculation (PRC) software. Arch Gynecol Obstet. 2009;279(4): 511-5. [ Links ]
21. Hörmansdörfer C, Scharf A, Golatta M, Vaske B, Corral A, Hillemanns P, et al. Comparison of Prenatal Risk Calculation and PIA Fetal Database software in first-trimester screening for fetal aneuploidy. Ultrasound Obstet Gynaecol. 2009; 33(2):147-51. [ Links ]
22. Hörmansdörfer C, Schmidt P, Hillemanns P, Scharf A. Die pränatale Detektion der Trisomien 13, 18 und 21: Vergleich des Advanced First Trimester Screenings (AFS)® mit dem Ersttrimesterscreening nach Nicolaides. Z Geburtsh Neonatol. 2007; 211(6): 243-9. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Cindy Hörmansdörfer, MPH
Gartenstr. 23
26122 Oldenburg
ALEMANIA
cinsanchez@hotmail.com