Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Salud Pública
versión On-line ISSN 2173-9110versión impresa ISSN 1135-5727
Rev. Esp. Salud Publica vol.88 no.1 Madrid ene./feb. 2014
https://dx.doi.org/10.4321/S1135-57272014000100004
REVISIÓN SISTEMÁTICA Y METANÁLISIS
Bloqueo dual del sistema renina-angiotensina frente a la monoterapia: revisión sistemática y metaanálisis acumulativo de ensayos clínicos y estudios observacionales
Risks of Dual Blockade of the Renin-Angiotensin System Compared with Monotherapy: A Systematic Review and Cumulative Meta-analysis of Randomized Trials and Observational Studies
Ferrán Catalá-López, Diego Macías Saint-Gerons, César de la Fuente Honrubia y Gloria Martín-Serrano
División de Farmacoepidemiología y Farmacovigilancia. Departamento de Medicamentos de Uso Humano. Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Madrid. España
Financiación: ninguna.
Las opiniones expresadas en este trabajo son responsabilidad de los autores, por lo que no reflejan necesariamente el punto de vista de los organismos en los que trabajan.
Dirección para correspondencia
RESUMEN
Fundamentos: Trabajos previos han sugerido que el bloqueo dual con inhibidores del sistema renina-angiotensina (SRA) estaría asociado a un incremento de efectos adversos comparado con la monoterapia. Se reexamina la seguridad del doble bloqueo del SRA, especialmente en pacientes de riesgo y se explora la estabilidad de la evidencia acumulada a lo largo de los años.
Método: Revisión sistemática con metaanálisis de efectos aleatorios. Se revisaron 15 metaanálisis publicados anteriormente como punto de partida. Se realizó una búsqueda en PubMed/Medline de estudios observacionales y de ensayos clínicos controlados recientes. Las variables dependientes estudiadas fueron: mortalidad (general y cardiovascular), hiperpotasemia, hipotensión, insuficiencia renal, accidente cerebrovascular y la retirada del tratamiento por efectos adversos. Se calcularon los riesgos relativos (RR) y su intervalo de confianza (IC95%)
Resultados: El bloqueo dual del SRA no se asoció con una reducción del RR de la mortalidad general (RR:1,00; IC95%: 0,96-1,05; 21 estudios), ni de la mortalidad cardiovascular (RR:1,01; 0,94-1,09; 13 estudios) ni del riesgo de accidente cerebrovascular (RR:1,02; 0,94-1,11; 11 estudios) en comparación con la monoterapia. El bloqueo dual se asoció a un riesgo aumentado de hiperpotasemia (RR:1,58; 1,37-1,81; 34 estudios), hipotensión (RR:1,66; 1,41-1,95; 25 estudios), daño renal (1,52; 1,28-1,81; 29 estudios) y retirada del tratamiento por efectos adversos (RR:1,26; 1,22-1,30; 37 estudios). Los resultados fueron consistentes en las cohortes de pacientes con diabetes mellitus, enfermedad renal o insuficiencia cardiaca.
Conclusiones: El bloqueo dual del SRA vs monoterapia incrementa los riesgos de hiperpotasemia, hipotensión, insuficiencia renal e interrupción del tratamiento por efectos adversos. Además no ofrece beneficios adicionales por reducción de la mortalidad general, mortalidad cardiovascular o accidente cerebrovascular. Estos hallazgos son consistentes a lo largo del tiempo.
Palabras clave: Hipertensión arterial. Enfermedad renal crónica. Efectos adversos. Sistema renina-angiotensina. Medicina basada en la evidencia. Metaanálisis. Revisión. Terapia farmacológica, combinación.
ABSTRACT
Background: Previous work has suggested that dual blockade using inhibitors of the renin-angiotensin system (RAS) would be associated with an increase in side effects compared to monotherapy. We reexamined the safety of dual RAS blockade, especially in patients at risk, and explored the stability of the evidence accumulated over the years.
Method: Systematic review with random-effects meta-analyses. We reviewed 15 previously published meta-analyses as the starting point. PubMed/Medline was searched for recent evidence from both observational and randomized controlled trials. Outcomes measures were: mortality (overall and cardiovascular), hyperkalemia, hypotension, renal failure, stroke, and treatment withdrawal due to adverse effects. We calculated relative risks (RR) and confidence intervals (95% CI)
Results:Dual RAS blockade was not associated with reduced relative risk (RR) overall mortality (RR:1.00, 0.96-1.05; 21 studies), cardiovascular mortality (RR:1.01, 0.94-1.09; 13 studies) or stroke (RR:1.02; 0.94-1.11; 11 studies) compared to monotherapy. Dual blockade was associated with an increased risk of hyperkalemia (RR:1.58, 1.37-1.81; 34 studies), hypotension (RR:1.66; 1.41-1.95; 25 studies), renal failure (RR:1.52;1.28-1.81; 29 studies) and treatment discontinuation due to adverse events (RR:1.26;1.22-1.30; 37 studies). These results were consistent in cohorts of patients with diabetes mellitus, kidney disease or heart failure.
Conclusions: Dual RAS blockade increased (vs monotherapy) the risks of hyperkalemia, hypotension, renal failure and treatment discontinuation. Dual RAS blockade did not offer additional benefit in reducing overall mortality, cardiovascular mortality or stroke. These findings are consistent over time.
Key words: Hypertension. Kidney failure, chronic. Adverse effects. Renin-angiotensin system. Evidence-Based Medicine. Meta-analysis. Review. Drug therapy. Drug Therapy, Combination.
Introducción
En la última década se han llevado a cabo importantes ensayos clínicos aleatorizados y controlados con el objetivo de determinar los efectos de las diversas estrategias antihipertensivas, más allá de controlar o reducir las cifras de presión arterial1. Una de las opciones terapéuticas que ha suscitado especial interés es el bloqueo dual (o doble bloqueo) del sistema renina-angiotensina (SRA) en el abordaje clínico de la hipertensión y de otras enfermedades cardiovasculares. El bloqueo dual del SRA consiste en interferir simultáneamente con inhibidores de la enzima de conversión de la angiotensina (IECA), antagonistas de los receptores de la angiotensina II (ARA-II) o inhibidores directos de la renina.
Se ha propuesto como hipótesis que la acción combinada de medicamentos para el bloqueo dual del SRA pudiese mejorar los resultados obtenidos con cada uno de los medicamentos por separado (monoterapia) en la prevención cardiovascular y/o renal de los pacientes con un perfil de riesgo cardiometabólico elevado2. Sin embargo, ya en el ensayo The ONgoing Telmisartan Alone and in combination with Ramipril Global Endpoint Trial (ONTARGET) se observó que el tratamiento mediante bloqueo dual con IECA y ARA-II no parecía ofrecer ningún beneficio adicional en la reducción de la morbimortalidad cardiovascular de los pacientes con elevado riesgo cardiovascular respecto a la monoterapia3. Del mismo modo, el ensayo Aliskiren Trial in Type 2 Diabetes Using Cardiovascular and Renal Disease Endpoints (ALTITUDE) se interrumpió prematuramente debido a que la terapia dual tampoco mostró un claro beneficio clínico en las personas diabéticas que recibían un inhibidor directo de la renina (aliskireno) además del tratamiento con IECA o ARA-II, mientras que se produjeron mayores complicaciones y efectos adversos4. En enero de 2013 se publicó una revisión sistemática y metaanálisis de ensayos clínicos sobre el efecto del bloqueo dual del SRA en pacientes con diverso perfil de riesgo cardiovascular5. Los autores indicaban que representaba el estudio más completo de la literatura que evaluaba la seguridad del bloqueo dual del SRA. Sin embargo, no fue el primer metaanálisis en examinar el efecto de la terapia dual6-9. Otras revisiones también han evaluado los efectos del bloqueo dual del SRA en grupos de pacientes más específicos, como son aquellos que tienen insuficiencia cardiaca10, enfermedad renal crónica11 o diabetes mellitus12. Por otro lado, recientemente se han seguido publicando nuevos ensayos clínicos (incluyendo reanálisis de estudios previos)13-16 o estudios observacionales que, en ocasiones, presentaban resultados contradictorios17,18.
El objetivo de este trabajo es examinar la seguridad del doble bloqueo del SRA en comparación con la monoterapia, especialmente en personas con diabetes mellitus, enfermedad renal o insuficiencia cardiaca, y explorar la estabilidad de la evidencia acumulada a lo largo de los años considerando la procedente de ensayos clínicos y estudios observacionales.
Material y métodos
Diseño. Revisión sistemática y metaanálisis de ensayos clínicos y estudios observacionales
Búsqueda de la literatura. En una primera fase, como punto de partida de este trabajo, se buscaron y revisaron los metaanálisis publicados hasta noviembre de 2013. En una segunda fase, también se realizó una búsqueda en PubMed/Medline para actualizar los trabajos identificados con nuevos ensayos clínicos, pero incorporando además la evidencia de origen observacional. Para la búsqueda específica se utilizaron los siguientes términos distribuidos en 3 bloques:
a) tratamiento farmacológico ("renin-angiotensin system", renin-angiotensin-aldosterone system", "angiotensin-converting enzyme inhibitor," "angiotensin receptor blocker," "renin inhibitor," or "direct renin inhibitor", "benazepril", "captopril", "enalapril", "cilazapril", "delapril", "fosinopril", "imidapril", "lisinopril", "moexipril", "perindopril", "quinapril", "ramipril", "spirapril", "temocapril", "trandolapril", "zofenopril", "candesartan", "irbesartan", "losartan", "telmisartan", "valsartan", "olmesartan", "eprosartan", "azilsartan", "aliskiren").
b) diseño de los estudios ("systematic review and meta-analysis" OR "randomized controlled trial", "cohort", "case-control").
c) combinación del tratamiento ("dual blockade", "dual therapy", "combination therapy", "combined", "addition", "added"). La lista completa de términos utilizados se presenta en los anexos 1 y 2.
Selección de estudios. De los metaanálisis identificados se seleccionaron los ensayos clínicos aleatorizados y controlados (con un diseño que incluyera grupos paralelos) con al menos comparaciones de la terapia dual del SRA [(IECA, ARA-II, o inhibidores directos de la renina (aliskireno)] respecto a monoterapia, con datos disponibles sobre la seguridad y que presentaran un tamaño muestral de al menos 30 pacientes. A partir de una búsqueda actualizada, se incluyeron nuevos ensayos clínicos o reanálisis de estos (no disponibles en los metaanálisis previos), además de incorporar también publicaciones de estudios observacionales epidemiológicos (cohorte o caso-control anidado) que incluyeran alguna de las variables de interés. Las variables de seguridad consideradas fueron: mortalidad, mortalidad cardiovascular, hiperpotasemia, hipotensión, daño renal, accidente cerebrovascular y la retirada del tratamiento (por efectos adversos). Se utilizaron las definiciones propuestas en cada uno de los estudios identificados.
Extracción de la información. Dos investigadores identificaron los estudios potencialmente elegibles que cumplieran con los criterios de inclusión. Un tercer investigador realizó la extracción de la información de los documentos fuente en hojas de recogida de datos diseñadas ad hoc (disponibles mediante solicitud a los autores). Se extrajeron las características de los estudios individuales y se representaron en tablas de evidencia.
Síntesis de la evidencia y análisis estadístico. En la síntesis cuantitativa de la evidencia se utilizó un enfoque en dos etapas: en la primera se utilizaron conjuntamente los datos procedentes de ensayos clínicos y de estudios observacionales. En la segunda se incluyeron solamente datos de ensayos clínicos, lo que permitió una evaluación de la contribución adicional de la evidencia de los estudios observacionales.
Para cada una de las variables de seguridad (mortalidad, mortalidad cardiovascular, hiperpotasemia, hipotensión, daño renal, accidente cerebrovascular, retirada del tratamiento) se calcularon los riesgos relativos (RR) junto con los intervalos de confianza del 95% (IC95%). Para ello, se llevaron a cabo metaanálisis utilizando modelos de efectos aleatorios ponderando por el inverso de la varianza (DerSimonian y Laird)19. El estadístico I2 se utilizó para analizar heterogeneidad20. Para explorar fuentes de heterogeneidad se definieron subgrupos a partir del tipo de terapia dual (por ejemplo que entre los medicamentos inhibidores del SRA se incluyera o no aliskireno) y poblaciones de alto riesgo (por ejemplo personas con diabetes mellitus, enfermedad renal e insuficiencia cardiaca). Se llevaron a cabo metaanálisis acumulativos para explorar cambios en el cuerpo de evidencia a lo largo del tiempo21.
Todos los análisis se realizaron con el programa Stata 12 (StataCorp LP, College Station, TX, EE UU).
Resultados
La búsqueda bibliográfica permitió identificar 15 metaanálisis previos (anexo 3), de los cuales se extrajeron 39 estudios individuales. Tras actualizar las búsquedas con el objetivo de identificar nuevos estudios publicados, un total de 50 trabajos se incluyeron en los análisis (figura 1, tabla 1). Las características de los estudios y de los pacientes se presentan en la tabla 2.
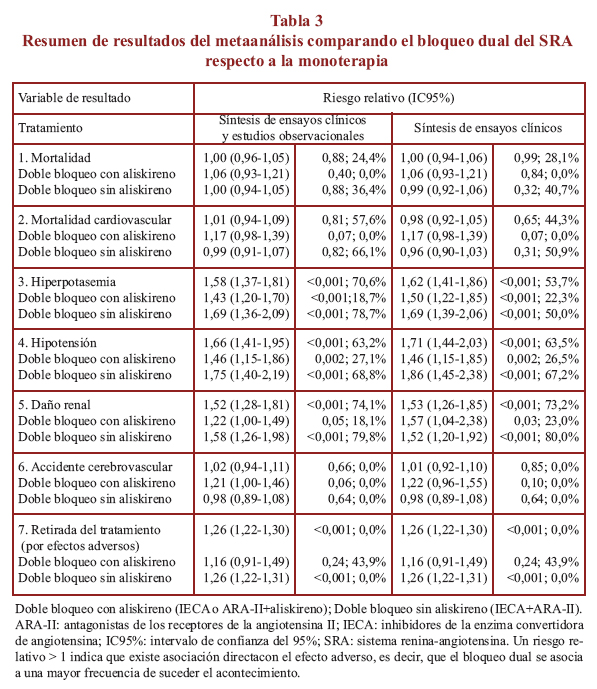
En las tablas 3 y 4 se presentan los principales resultados de los metaanálisis.
a) Mortalidad. Se identificaron 21 estudios (104.538 pacientes) que presentaron datos de mortalidad. El bloqueo dual del SRA no se asoció con una reducción de la mortalidad total en comparación con la monoterapia (RR=1,00; IC95%: 0,96-1,05) (tabla 3), con independencia de la estrategia de combinación utilizada (con o sin aliskireno). Los análisis de subgrupos no identificaron diferencias significativas en el riesgo de mortalidad en pacientes con diabetes, enfermedad renal o insuficiencia cardiaca (tabla 4).
b) Mortalidad cardiovascular. Se identificaron 13 trabajos (97.717 pacientes). No se observó una reducción de la mortalidad cardiovascular con la terapia dual en comparación con la monoterapia (RR=1,01; IC95%: 0,94-1,09) (tabla 3), si bien se observó una tendencia a un incremento de riesgo del 17% cuando se incluía tratamiento con aliskireno (RR=1,17; IC95%: 0,98-1,39; P=0,07). No se identificaron cambios entre los diferentes subgrupos de pacientes de riesgo (tabla 4).
c) Hiperpotasemia. Se identificaron 34 estudios (140.094 pacientes). El bloqueo dual se asoció a un incremento de riesgo de hiperpotasemia (RR=1,58; IC95%:1,37-1,81), con independencia de la estrategia de combinación utilizada (con o sin aliskireno). Los resultados fueron consistentes en los diferentes subgrupos de pacientes de riesgo (tabla 4).
d) Hipotensión. Veinticinco estudios (100.268 pacientes) permitieron observar un incremento del riesgo de hipotensión asociado a la terapia dual en comparación con la monoterapia (RR=1,66; IC95%: 1,41-1,95). Estos hallazgos fueron consistentes en los diferentes análisis de subgrupos (tablas 3 y 4).
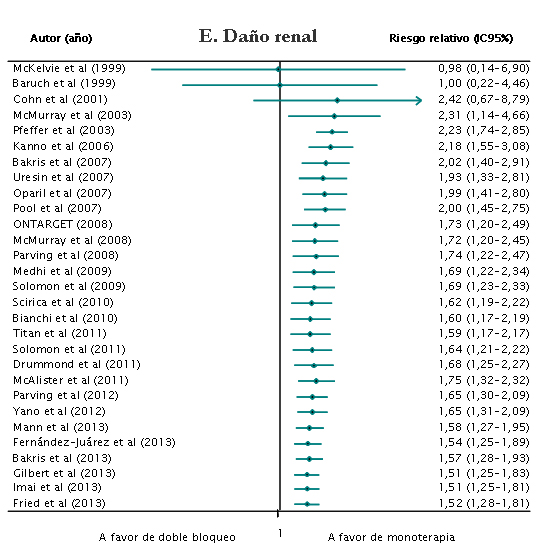
e) Daño renal. Veintinueve trabajos (128.929 pacientes) presentaron información sobre el riesgo de daño renal. El doble bloqueo se asoció a un aumento del riesgo de daño renal en comparación con la monoterapia (RR=1,52; IC95%: 1,28-1,81) (Tabla 3). Los resultados fueron consistentes en los diferentes subgrupos de pacientes de riesgo (tabla 4).
F) Accidente cerebrovascular. Se identificaron 11 estudios (57.317 pacientes). El bloqueo dual no se asoció con una reducción del riesgo de accidente cerebrovascular (RR=1,02; IC95%: 0,94-1,11) (tabla 3). Sin embargo, la terapia dual con aliskireno se asoció a un incremento potencial del riesgo de accidente cerebrovascular en comparación con la monoterapia (RR=1,21; IC95%: 1,00-1,46). No se identificaron diferencias significativas en los subgrupos de pacientes con diabetes, enfermedad renal o insuficiencia cardiaca (tabla 4).
g) Retirada del tratamiento (por efectos adversos). En 37 estudios (68.606 pacientes) la terapia dual se asoció a un incremento en la retirada del tratamiento por efectos adversos (RR=1,26; IC95%: 1,22-1,30).
Estas diferencias no fueron estadísticamente significativas en el subgrupo que consideraba la terapia dual con aliskireno (RR=1,16; IC95%: 0,91-1,49; p=0,24) (tabla 3). El riesgo de retirada del tratamiento fue consistente en las diferentes cohortes de pacientes con diabetes, enfermedad renal o insuficiencia cardiaca (tabla 4).
Metaanálisis acumulativos. La figura 2 presenta diversos metaanálisis acumulativos por año de publicación del estudio. Los primeros efectos estadísticamente significativos se observaron en los años 2001 (hipotensión y retirada del tratamiento por efectos adversos), 2003 (daño renal) y 2007 (hiperpotasemia). Aunque los estudios posteriores han aumentado la precisión de la estimación puntual, no se ha producido ningún cambio sustancial en la dirección o la magnitud del efecto del tratamiento a lo largo del tiempo.





Citas a los metaanálisis previos. Se identificaron 15 metaanálisis publicados entre 2005 y 2013 sobre los efectos del doble bloqueo del SRA con IECA, ARA-II o aliskireno. En la tabla 5 se presenta un resumen de sus principales características y hallazgos.
Discusión
En este trabajo se ha revisado la evidencia publicada sobre la seguridad de la terapia dual con inhibidores del SRA, procedente tanto de ensayos clínicos como de estudios observacionales. Los resultados obtenidos a partir de la síntesis cuantitativa con metaanálisis sugieren que el bloqueo dual del SRA no ofreció ningún beneficio adicional (respecto a la monoterapia) en la reducción de la mortalidad general, la mortalidad cardiovascular o el accidente cerebrovascular. En cambio, la terapia dual incrementó los riesgos de hiperpotasemia, hipotensión, insuficiencia renal y la interrupción del tratamiento por efectos adversos. En términos generales, se observó que estos hallazgos son consistentes en las cohortes de pacientes con diabetes mellitus, enfermedad renal o insuficiencia cardiaca y en la mayoría de casos los efectos se mantienen de forma estable durante más de una década. Cabría mencionar que los resultados del incremento de riesgos asociado a la terapia dual estarían en consonancia con los obtenidos en trabajos previos utilizando criterios de análisis más restrictivos5,10-13, así como con los resultados de estudios que no fueron incluidos en la revisión por no cumplir los criterios de inclusión22. En concreto, los resultados del ensayo The Aliskiren Trial on Acute Heart Failure Outcomes (ASTRONAUT)22 mostraron que el inhibidor directo de la renina, aliskireno, añadido a la terapia antihipertensiva estándar (por ejemplo aproximadamente el 85% de los 1.639 pacientes recibía bloqueantes del SRA como IECA o ARA-II) no mejoró la mortalidad cardiovascular después del alta ni los reingresos en pacientes hospitalizados por insuficiencia cardiaca, mientras que se asoció con un incremento del 37% en el riesgo de insuficiencia renal, un aumento del 36% en el riesgo de hipotensión y un aumento del 19% en el riesgo de hiperpotasemia. Por otro lado, recientemente se han publicado los resultados del ensayo The Combination Angiotensin Receptor Blocker and Angiotensin-Converting Enzyme Inhibitor for Treatment of Diabetic Nephropathy (VA NEPHRON-D)16 en el que se estudiaba en 1.448 pacientes diabéticos el efecto sobre la progresión de la enfermedad renal de la combinación de ARA-II e IECA (losartán y lisinopril) en comparación con ARA-II en monoterapia. Este ensayo tuvo que finalizar prematuramente debido a un mayor número de lesiones renales e hiperpotasemia en los pacientes con nefropatía diabética tratados con terapia dual16. Existen al menos 3 estudios23-25 que están actualmente en curso y que se espera que generen datos adicionales: Long-term Impact of RAS Inhibition on Cardiorenal Outcomes (LIRICO)23, Preventing ESRD in Overt Nephropathy of Type 2 Diabetes (VALID)24 y Efficacy and Safety of Aliskiren and Aliskiren/Enalapril Combination on Morbi-mortality in Patients With Chronic Heart Failure (ATMOSPHERE)25. LIRICO es un ensayo pragmático que evalúa el efecto cardiovascular y renal de la terapia dual con IECA y ARA-II respecto a la monoterapia en pacientes con albuminuria y al menos un factor de riesgo cardiovascular. El ensayo VALID tiene como objetivo evaluar el efecto del bloqueo dual con IECA (benazepril) y ARA-II (valsartán) sobre la progresión de enfermedad renal terminal en pacientes de alto riesgo con nefropatía diabética. ATMOSPHERE es un ensayo clínico que evalúa el efecto del bloqueo dual con aliskireno e IECA (enalapril) sobre la mortalidad cardiovascular y hospitalización por insuficiencia cardiaca.
Algunos estudios y metaanálisis previos en pacientes con insuficiencia cardiaca han mostrado que la combinación de dos bloqueadores del SRA puede reducir el riesgo de hospitalizaciones por insuficiencia cardiaca, pero no se han observado beneficios consistentes en la reducción de la mortalidad general, cardiovascular o en el riesgo de hospitalizaciones por otras causas5,9. Concretamente, los principales datos sobre el bloqueo dual del SRA en pacientes con insuficiencia cardiaca proviene de diversos ensayos clínicos entre los que destacan: Candesartan in Heart failure: Assessment of Reduction in Mortality and morbidity - Added (CHARM-Added)26, Valsartan Heart Failure Trial (Val-HeFT)27,28 y Valsartan in Acute Myocardial Infarction Trial (VALIANT)29. CHARM-Added ha sido el único ensayo en el que se ha observado una disminución de la mortalidad cardiovascular (reducción absoluta del riesgo del 3,6%) y de las hospitalizaciones por insuficiencia cardiaca (reducción absoluta del riesgo del 3,8%) con la terapia dual (candesartán junto a IECA) respecto a la monoterapia. Sin embargo, la mortalidad general no fue diferente entre los distintos grupos. Igualmente, en el ensayo Val-HeFT27,28 se observó una disminución de las hospitalizaciones por insuficiencia cardiaca (reducción absoluta del riesgo del 4,4%), aunque la mortalidad general y la mortalidad cardiovascular fueron similares en los grupos de bloqueo dual (93% pacientes con valsartán e IECA) y monoterapia. Mientras que en el ensayo VALIANT29 la combinación de ARA-II (valsartán) e IECA (captopril) aumentó la ocurrencia de efectos adversos sin mejorar la supervivencia.
Por otro lado, un estudio reciente11 ha sugerido que la terapia dual podría tener efectos beneficiosos a corto plazo, como la reducción de la proteinuria en pacientes con enfermedad renal. Sin embargo, este hallazgo sería contrario a los resultados obtenidos en grandes estudios que valoran acontecimientos renales3,4,21,30. Algunas guías de práctica clínica (como es el caso de las guías europeas 2013 sobre el manejo de la hipertensión arterial y diabetes31,32) desaconsejan el uso de la combinación de dos inhibidores del RAS. La ficha técnica de algunos medicamentos no recomienda el uso concomitante de IECA y ARA-II y en los casos individualmente definidos se recomienda seguir estrechamente la función renal y las concentraciones sanguíneas de potasio33,34. En 2012, como consecuencia de los resultados del ensayo ALTITUDE, se contraindicó el bloqueo dual del SRA conjuntamente con aliskireno e IECA/ARA-II en pacientes diabéticos o con insuficiencia renal moderada-grave y se desaconsejó su uso en el resto de pacientes35. Más recientemente, teniendo en cuenta la información que se ha generado en los últimos años, la Agencia Europea de Medicamentos ha anunciado el inicio de una revisión de los riesgos del bloqueo dual del SRA en el tratamiento de la hipertensión y la insuficiencia cardiaca congestiva36.
El SRA es importante en la regulación de la presión arterial. La inhibición del SRA produciría incrementos en la secreción de renina y, por lo tanto, de la actividad de la renina plasmática. Algunos estudios han sugerido que valores altos de actividad de renina plasmática se han asociado con mayor incidencia de infarto de miocardio, peor pronóstico de la insuficiencia cardíaca y aumento de la mortalidad cardiovascular, así como empeoramiento de la función renal37,38. La aparición de efectos adversos asociados al bloqueo dual del SRA podría suceder en pacientes susceptibles, como por ejemplo aquellos con depleción de volumen y/o sodio ocasionada por un tratamiento intensivo con diuréticos o por una dieta restrictiva en sal, entre otras posibles causas38,39. En pacientes cuyo tono vascular y función renal dependen más de la actividad del SRA (por ejemplo personas con insuficiencia cardiaca congestiva o enfermedad renal subyacente) el tratamiento con medicamentos que afectan al SRA también se ha asociado con hipotensión o, raramente, con fallo renal agudo33.
Cabe señalar algunas consideraciones en relación a este trabajo. Como en toda evaluación, las inferencias que puedan hacerse de los resultados presentados dependen de la elección de las fuentes de información y de los modelos empleados para combinar los diferentes estudios. En este sentido, los autores decidieron a priori incluir la evidencia de los estudios observacionales además de la procedente de ensayos clínicos, asumiendo que un estudio observacional de gran tamaño puede facilitar información relevante a pesar de que ello pudiera introducir cierta heterogeneidad a los resultados. Sin embargo, en este trabajo, la dirección y la magnitud de los riesgos asociados al bloqueo dual del SRA fueron consistentes cuando el análisis se restringió a ECA solos. Por otro lado, se decidió emplear el modelo de efectos aleatorios con el objetivo de poder generalizar los resultados a poblaciones más amplias y heterogéneas siendo conscientes que los estudios seleccionados no necesariamente presentaban características idénticas. Como en cualquier revisión, este análisis no está exento de una posible falta de identificación de algún estudio, si bien esto se ha intentado reducir utilizando criterios de inclusión predefinidos, y una búsqueda lo más amplia posible. Por último, no es infrecuente encontrar cierto grado de variabilidad en relación a la forma en la que se describen los efectos adversos y riesgos en las publicaciones (en ocasiones de baja calidad)40-42, lo cual, añadido al reducido número de estudios identificados en algunos subgrupos, podría haber dificultado algunas estimaciones del efecto de los tratamientos.
Concluyendo, en comparación con la monoterapia, el bloqueo dual del SRA no parece ofrecer ningún beneficio adicional en la reducción de la mortalidad general, la mortalidad cardiovascular o accidente cerebrovascular, pero incrementó los riesgos de hiperpotasemia, hipotensión, insuficiencia renal y la interrupción del tratamiento por efectos adversos. Estos hallazgos son consistentes a lo largo del tiempo. El uso de la terapia dual del SRA, por tanto, parece desaconsejable y en los casos individualmente definidos en los que el clínico decida iniciar el tratamiento, se debería monitorizar y seguir estrechamente la función renal, las concentraciones plasmáticas de potasio y las cifras de presión arterial.


Bibliografía
1. Ritter JM. Angiotensin converting enzyme inhibitors and angiotensin receptor blockers in hypertension. BMJ. 2011;342:d1673. [ Links ]
2. Menard J, Campbell DJ, Azizi M, Gonzales MF. Synergistic effects of ACE inhibition and Ang II antagonism on blood pressure, cardiac weight, and rennin in spontaneously hypertensive rats. Circulation. 1997;96:3072-78. [ Links ]
3. Yusuf S, Teo KK, Pogue J, Dyal L, Copland I, Schumacher H, et al. Telmisartan, ramipril, or both in patients at high risk for vascular events. N Engl J Med. 2008;358:1547-59. [ Links ]
4. Parving HH, Brenner BM, McMurray JJ, de Zeeuw D, Haffner SM, Solomon SD, et al. Cardiorenal end points in a trial of aliskiren for type 2 diabetes. N Engl J Med. 2012;367:2204-13. [ Links ]
5. Makani H, Bangalore S, Desouza KA, Shah A, Messerli FH. Efficacy and safety of dual blockade of the renin-angiotensin system: meta-analysis of randomised trials. BMJ. 2013;346:f360. [ Links ]
6. Doulton TW, He FJ, MacGregor GA. Systematic review of combined angiotensin-converting enzyme inhibition and angiotensin receptor blockade in hypertension. Hypertension. 2005;45:880-6. [ Links ]
7. Phillips CO, Kashani A, Ko DK, Francis G, Krumholz HM. Adverse effects of combination angiotensin II receptor blockers plus angiotensin-converting enzyme inhibitors for left ventricular dysfunction: a quantitative review of data from randomized clinical trials. Arch Intern Med. 2007;167:1930-6. [ Links ]
8. Kunz R, Friedrich C, Wolbers M, Mann JF. Meta-analysis: effect of monotherapy and combination therapy with inhibitors of the renin angiotensin system on proteinuria in renal disease. Ann Intern Med. 2008;148:30-48. [ Links ]
9. Kuenzli A, Bucher HC, Anand I, Arutiunov G, Kum LC, McKelvie R, et al. Meta-analysis of combined therapy with angiotensin receptor antagonists versus ACE inhibitors alone in patients with heart failure. PLoS One. 2010;5:e9946. [ Links ]
10. Harel Z, Gilbert C, Wald R, Bell C, Perl J, Juurlink D, et al. The effect of combination treatment with aliskiren and blockers of the renin-angiotensin system on hyperkalaemia and acute kidney injury: systematic review and meta-analysis. BMJ. 2012;344:e42. [ Links ]
11. Susantitaphong P, Sewaralthahab K, Balk EM, Eiam-ong S, Madias NE, Jaber BL. Efficacy and safety of combined vs. single renin-angiotensin-aldosterone system blockade in chronic kidney disease: a meta-analysis. Am J Hypertens. 2013;26:424-41. [ Links ]
12. Catalá-López F, Macías Saint-Gerons D. Diabetes Mellitus and Risks of Dual Blockade of the Renin-angiotensin-aldosterone System. Rev Esp Cardiol. 2013;66:412-5. [ Links ]
13. Bakris GL, Oparil S, Purkayastha D, Yadao AM, Alessi T, Sowers JR. Randomized study of antihypertensive efficacy and safety of combination aliskiren/valsartan vs valsartan monotherapy in hypertensive participants with type 2 diabetesmellitus. J Clin Hypertens (Greenwich). 2013;15:92-100. [ Links ]
14. Fernández Juárez G, Luño J, Barrio V, de Vinuesa SG, Praga M, Goicoechea M, et al. Effect of dual blockade of the renin-angiotensin system on the progression of type 2 diabetic nephropathy: a randomized trial. Am J Kidney Dis. 2013;61:211-8. [ Links ]
15. Mann JF, Anderson C, Gao P, Gerstein HC, Boehm M, Rydén L, et al. Dual inhibition of the renin-angiotensin system in high-risk diabetes and risk for stroke and other outcomes: results of the ONTARGET trial. J Hypertens. 2013;31:414-21. [ Links ]
16. Fried LF, Emanuele N, Zhang JH, Brophy M, Conner TA, Duckworth W, et al. Combined Angiotensin inhibition for the treatment of diabetic nephropathy. N Engl J Med. 2013;369:1892-903. [ Links ]
17. McAlister FA, Zhang J, Tonelli M, Klarenbach S, Manns BJ, Hemmelgarn BR; Alberta Kidney Disease Network. The safety of combining angiotensin-converting-enzyme inhibitors with angiotensin-receptor blockers in elderly patients: a population-based longitudinal analysis. CMAJ. 2011;183:655-62. [ Links ]
18. Gilbert CJ, Gomes T, Mamdani MM, Hellings C, Yao Z, Garg AX, et al. No increase in adverse events during aliskiren use among Ontario patients receiving angiotensin-converting enzyme inhibitors or angiotensin receptor blockers. Can J Cardiol. 2013;29:586-91. [ Links ]
19. DerSimonian R, Laird N. Meta-analysis in clinical trials. Control Clin Trials. 1986;7:177-88. [ Links ]
20. Higgins JP, Thompson SG, Deeks JJ, Altman DG. Measuring inconsistency in meta-analyses. BMJ. 2003;327:557-60. [ Links ]
21. Lau J, Antman EM, Jimenez-Silva J, Kupelnick B, Mosteller F, Chalmers TC. Cumulative meta-analysis of therapeutic trials for myocardial infarction. N Engl J Med. 1992;327:248-54. [ Links ]
22. Gheorghiade M, Böhm M, Greene SJ, Fonarow GC, Lewis EF, Zannad F, et al. Effect of aliskiren on postdischarge mortality and heart failure readmissions among patients hospitalized for heart failure: the ASTRONAUT randomized trial. JAMA. 2013;309:1125-35. [ Links ]
23. Maione A, Nicolucci A, Craig JC, Tognoni G, Moschetta A, Palasciano G, et al. Protocol of the Long-term Impact of RAS Inhibition on Cardiorenal Outcomes (LIRICO) randomized trial. J Nephrol. 2007;20:646-55. [ Links ]
24. Mario Negri Institute for Pharmacological Research. Preventing ESRD in Overt Nephropathy of Type 2 Diabetes (VALID, NCT00494715). Disponible en: http://clinicaltrials.gov/ct2/show/NCT00494715?term=VALID+trial&rank=1. [ Links ]
25. Krum H, Massie B, Abraham WT, Dickstein K, Kober L, McMurray JJ, et al. Direct renin inhibition in addition to or as an alternative toangiotensin converting enzyme inhibition in patients with chronic systolic heart failure: rationale and design of the Aliskiren Trial to Minimize OutcomeS in Patients with HEart failuRE (ATMOSPHERE) study. Eur J Heart Fail. 2011;13:107-14. [ Links ]
26. McMurray JJ, Ostergren J, Swedberg K, Granger CB, Held P, Michelson EL, et al. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function taking angiotensin-converting-enzyme inhibitors: the CHARM-Added trial. Lancet. 2003;362:767-71. [ Links ]
27. Cohn JN, Tognoni G; Valsartan Heart Failure Trial Investigators. A randomized trial of the angiotensin-receptor blocker valsartan in chronic heart failure. N Engl J Med. 200;345:1667-75. [ Links ]
28. Lesogor A, Cohn JN, Latini R, Tognoni G, Krum H, Massie B, et al. Interaction between baseline and early worsening of renal function and efficacy of renin-angiotensin-aldosterone system blockade in patients with heart failure: insights from the Val-HeFT study. Eur J Heart Fail. 2013 Jun 19. [ Links ]
29. Pfeffer MA, McMurray JJ, Velazquez EJ, Rouleau JL, Køber L, Maggioni AP, et al. Valsartan, captopril, or both in myocardial infarction complicated by heart failure, left ventricular dysfunction, or both. N Engl J Med. 2003;349:1893-906. [ Links ]
30. Imai E, Haneda M, Yamasaki T, Kobayashi F, Harada A, Ito S, et al. Effects of dual blockade of the renin-angiotensin system on renal and cardiovascular outcomes in type 2 diabetes with overt nephropathy and hypertension in the ORIENT: a post-hoc analysis (ORIENT-Hypertension). Hypertens Res. 2013 Sep 12. [ Links ]
31. Mancia G, Fagard R, Narkiewicz K, Redón J, Zanchetti A, Böhm M, et al. 2013 ESH/ESC Guidelines for the management of arterial hypertension: the Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). J Hypertens. 2013;31:1281-357. [ Links ]
32. Authors/Task Force Members, Rydén L, Grant PJ, Anker SD, Berne C, Cosentino F, et al. ESC Guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD: The Task Force on diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and developed in collaboration with the European Association for the Study of Diabetes (EASD). Eur Heart J. 2013 Aug 30. (Epub ahead of print) [ Links ]
33. Agencia Europea de Medicamentos. Ficha técnica de Micardis® (telmisartán) Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000209/WC500027641.pdf. [ Links ]
34. Agencia Española de Medicamentos y Productos Sanitarios. Ficha técnica de Renitec® (enalapril) Disponible en: http://www.aemps.gob.es/cima/especialidad.do?metodo=verFichaWordPdf&codigo=57773&formato=pdf&formulario=FICHAS&file=ficha.pdf. [ Links ]
35. Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Nota informativa MUH (FV), 03/2012. Aliskireno (Rasilez®, Riprazo®, Rasilez HTC®): conclusiones de la re-evaluación del balance beneficio riesgo. Madrid, febrero de 2012. Disponible en: http://www.aemps.gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2012/NI-MUH_03-2012.htm. [ Links ]
36. Agencia Europea de Medicamentos. Review started of combined use of renin-angiotensin system (RAS)-acting agents. Londres, mayo de 2013. Disponible en http://www.emea.europa.eu/docs/en_GB/document_library/Referrals_document/Renin-angiotensin_system_(RAS)-acting_agents/Procedure_started/WC500143500.pdf. [ Links ]
37. Morales-Olivas FJ, Estañ L. La actividad de la renina plasmática. Papel de la inhibición directa de la renina. Rev Esp Cardiol. 2011;Suppl 11(D):3-7. [ Links ]
38. Sealey JE, Alderman MH, Furberg CD, Laragh JH. Renin-angiotensin system blockers may create more risk than reward for sodium-depleted cardiovascular patients with high plasma renin levels. Am J Hypertens. 2013;26:727-38. [ Links ]
39. Laragh JH, Sealey JE. Sodium depletion in patients in clinical trials may account for the increased cardiovascular risk of dual blockade of the renin-angiotensin system. BMJ. 2013;346:f1685. [ Links ]
40. Bagul NB, Kirkham JJ. The reporting of harms in randomized controlled trials of hypertension using the CONSORT criteria for harm reporting. Clin Exp Hypertens. 2012;34:548-54. [ Links ]
41. Haidich AB, Birtsou C, Dardavessis T, Tirodimos I, Arvanitidou M. The quality of safety reporting in trials is still suboptimal: survey of major general medical journals. J Clin Epidemiol. 2011;64:124-35. [ Links ]
42. Ioannidis JP, Evans SJ, Gøtzsche PC, O'Neill RT, Altman DG, Schulz K, et al. Better reporting of harms in randomized trials: an extension of the CONSORT statement. Ann Intern Med. 2004;141:781-8. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Ferrán Catalá-López
División de Farmacoepidemiología y Farmacovigilancia
Agencia Española de Medicamentos y Productos Sanitarios (AEMPS)
Parque Empresarial "Las Mercedes"
C/ Campezo, 1 - Edificio 8, 1a planta
28022 Madrid
Correo electrónico: ferran_catala@hotmail.com