Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista Española de Salud Pública
versión On-line ISSN 2173-9110versión impresa ISSN 1135-5727
Rev. Esp. Salud Publica vol.88 no.1 Madrid ene./feb. 2014
https://dx.doi.org/10.4321/S1135-57272014000100005
REVISIÓN SISTEMÁTICA Y METANÁLISIS
Evaluación de técnicas inmunológicas in vitro para el diagnóstico de alergias: metanálisis 2000-2012 (*)
Evaluation of Techniques in vitro Immune to the Diagnosis of Allergy: Meta-analysis 2000-2012
John Fredy Cuervo-Perez (1), Julián Camilo Arango (1) y Jaiberth Antonio Cardona-Arias (2,3)
(1) Escuela de Microbiología Universidad de Antioquia. Grupo de investigación de alergología clínica y experimental. Universidad de Antioquia. Medellín. Colombia.
(2) Facultad Medicina. Universidad Cooperativa de Colombia.
(3) Grupo de Investigación Salud y Sostenibilidad, Escuela de Microbiología. Universidad de Antioquia. Medellín. Colombia
(*) El estudio fue financiado con recursos de la Universidad de Antioquia.
Ninguno de los autores declara conflicto de intereses para la publicación del manuscrito.
Dirección para correspondencia
RESUMEN
Fundamentos: Las alergias presentan elevada prevalencia, afectan a todos los grupos etarios, generan impactos negativos sobre los sistemas de salud, educativo y económico. Se desconoce la utilidad diagnóstica de las pruebas de tamización. El objetivo del estudio fue evaluar la validez, el desempeño, la seguridad y la efectividad diagnóstica de las técnicas inmunológicas in vitro para alergias
Métodos: Revisión sistemática con metaanálisis. Se aplicó una estrategia de búsqueda de estudios en Pubmed, Sciencedirect y Wiley con los términos de búsqueda activation basophil test, lymphocyte transformation test, especific IgE immunoassay. Período estudiado: 2000-2012. Se determinó la reproducibilidad de la selección, extracción y evaluación de la calidad de los artículos. Se calculó sensibilidad, especificidad, cocientes de probabilidad, valores predictivos, proporción de resultados falsos, exactitud, razón de odds, índice J de Youden y curva ROC con los software Meta-DiSc(es) y Epidat 3.0
Resultados: Se incluyeron 18 estudios con 3.520 individuos, 58% enfermos y 42% sanos. La activación de basófilos presentó sensibilidad del 78% (IC95%:74-81), especificidad 95% (IC95%:83-100), cociente de probabilidad positivo 9,9 (IC95%:6,8-14,4) y negativo de 0,20 (IC95%:0,13-0,30), OR diagnóstica de 70,8 (IC95:40,2-124,8) y un área bajo la curva de 0,97. En la inmunoglobulina E específica la sensibilidad fue 72% (IC95%:69-75), especificidad 90% (IC95%:88-92), cociente de probabilidad positivo 12,9 (IC95%:4,0-41,6) negativo 0,32 (IC95%:0,23-0,43), OR diagnóstica 41,6 (IC95%:11,6-148,9) y área bajo la curva 0,87
Conclusión: Se evidenció que la activación de basófilos y la IgE específica son pruebas útiles en el diagnóstico de alergias.
Palabras claves: Diagnóstico. Alergia. Test inmunológicos.
ABSTRACT
Background: Allergies have high prevalence, affecting all age groups, generate negative impacts on health, educational and economic systems, and they are unknown the diagnostic utility of screening tests. The objective of the study was to evaluate the validity, performance, safety and diagnostic efficiency of in vitro immunological techniques for allergies, 2000-2012
Methods: Systematic review with meta-analysis. We applied a search strategy studies in PubMed, Sciencedirect and Wiley, with search terms activation basophil test, lymphocyte transformation test, especific IgE immunoassay. We determined the reproducibility of the selection, extraction and quality assessment of articles. We calculated sensitivity, specificity, likelihood ratios, predictive values, proportion of false, accuracy, odds ratio, Youden index J and ROC curve in Meta-DiSc(es) and Epidat 3.0. software
Results: We included 18 studies with 3520 individuals, 58% patients and 42% healthy. Activation of basophils showed sensitivity of 78% (95% CI :74-81), specificity 95% (95% CI: 83-100), positive likelihood ratio 9.9 (95% CI: 6.8 to 14.4) and negative of 0.20 (95% CI = 0.13 to 0.30) a diagnostic OR 70.8 (IC95: 40.2 to 124.8) and area under the curve of 0.97. In specific immunoglobulin E sensitivity was 72% (95% CI: 69-75), specificity 90% (95% CI : 88-92), positive likelihood ratio 12.9 (95% CI = 4.0 to 41.6) negative 0.32 (95% CI:0.23-0.43), diagnostic OR 41.6 (95% CI :11.6 to 148.9) and area under the curve 0.87
Conclusion: We showed that activation of basophils and specific IgE are useful tests for diagnosing allergies.
Key words: Diagnosis. Immunologic tests.Allergy and immunology.
Introducción
El sistema inmune tiene la capacidad de diferenciar moléculas extrañas de un patógeno de otras que siendo igualmente extrañas no generan una amenaza para la salud, estas últimas generalmente se derivan de plantas, animales y del ambiente y constituyen potenciales alérgenos. En la mayoría de las personas el contacto con sustancias alergenas no genera una respuesta inmune. Sin embargo, en algunas circunstancias, moléculas inocuas pueden desencadenar una respuesta inmunitaria en determinados individuos, originando lo que se conoce como enfermedad alérgica1-2.
Las alergias se producen por la entrada de antígenos por la piel o las mucosas del trato gastrointestinal y respiratorio, los cuales son captados por las células presentadoras de antígeno (Ag) que estimulan a los linfocitos Th2 a secretar citoquinas para activar a los linfocitos B y producir Inmunoglobulina E (IgE) específica contra el Ag. La IgE se fija a receptores ubicados en la membrana celular de los mastocitos, basófilos y eosinófilos, generando la sensibilización al alérgeno. Cuando el individuo se expone al Ag, éste se une a la IgE de las células sensibilizadas lo que conduce a una desgranulación celular y a la liberación de mediadores vasoactivos e inflamatorios como histaminas, factores quimiotácticos, leucotrienos y factores activadores de plaquetas que causan los signos de las alergias, como vasodilatación, aumento de la permeabilidad capilar, hipersecreción glandular, espasmo de músculo liso e infiltración tisular de eosinófilos y otras células inflamatorias responsables de la sintomatología1,2. Estos mecanismos explican las manifestaciones clínicas de enfermedades como rinitis, conjuntivitis, asma, urticaria, dermatitis atópica, alergias físicas y alergias a alimentos, fármacos y picaduras de insectos3.
Aunado a lo anterior, las alergias presentan un origen genético, algunos autores afirman que si ambos progenitores son alérgicos existe una probabilidad del 50% de tener un hijo alérgico y cuando solo lo es uno de ellos la probabilidad disminuye al 30%4-5.
La importancia de las enfermedades alérgicas radica en que son procesos muy frecuentes, que afectan en especial a niños y personas jóvenes en las fases de sus vidas en las que la producción laboral o académica es más intensa e interfieren de forma significativa en las actividades cotidianas. Además, en algunos casos más del 60% de los pacientes admite tener algún tipo de limitación en actividades físicas y laborales. Con elevada frecuencia presentan alteraciones en el sueño cuando el paciente padece enfermedades como la rinitis o asma, lo que conduce a que el 40% de estos individuos sufran somnolencia diurna, afectando a su rendimiento académico y laboral. La Organización Mundial de la Salud (OMS) estima que el 1% de los recursos sanitarios en el ámbito mundial se invierten en el asma y que en algunos países el tratamiento de dicha enfermedad asciende a 150 millones de euros al año y sus gastos indirectos, como incapacidades médico-laborales, superan los 300 millones de euros anuales. De forma adicional, estudios de la OMS dan cuenta de que muchos individuos que padecen enfermedades alérgicas tienen sus proyectos de vida condicionados al padecimiento de su enfermedad, como encontrar limitaciones al elegir su carrera profesional6.
Sumado a las consecuencias citadas, se debe explicitar que las enfermedades alérgicas mediadas por IgE constituyen una de las enfermedades más prevalentes en todo el mundo. Se estima que el 20% de la población mundial sufre alguna enfermedad mediada por la IgE. La OMS ha indicado que las enfermedades alérgicas se encuentran entre las seis enfermedades más frecuentes en el ámbito mundial. Particularmente en el asma, se ha documentado que más del 50% de los casos en adultos y más del 80% en niños son de origen alérgico estando afectada entre el 5% y el 15% de la población infantil mundial7.
Las técnicas in vitro para el diagnóstico de alergias han permitido un gran avance en su correcto diagnóstico al proporcionar mediciones más exactas de la actividad de la IgE y las células efectoras en los procesos alérgicos, lo cual ha mejorado la calidad analítica y ha servido para monitorizar al paciente y permitir un mejor tratamiento. Estas pruebas incluyen la determinación de IgE específica, la activación de basófilos y la linfoproliferación8.
A pesar de la disponibilidad y ventajas de las pruebas in vitro, en la actualidad no son muy utilizadas debido a diversas causas como los costos, falta de estandarización y, en especial, por la gran divergencia en validez y desempeño diagnóstico que se ha reportado en estudios previos, con valores de sensibilidad y especificidad entre 50% y 90%. Adicional a esto, la mayoría de los estudios que han evaluado estas técnicas sólo aluden a los valores de validez diagnóstica (sensibilidad y especificidad) obviando otros parámetros de gran relevancia en la evaluación de pruebas, como los valores predictivos, los cuales se relacionan con la prevalencia de la enfermedad, la razón de verosimilitud que determina la interacción entre la sensibilidad y la especificidad, la eficiencia de la prueba que define la proporción de pacientes correctamente diagnosticados y la proporción de resultados falsos, tanto positivos como negativos9-10.
Los aspectos anteriores justifican la realización de una revisión sistemática de artículos que abordan este tópico. Además, se debe precisar que la elección de esta modalidad de investigación radica en que presenta múltiples ventajas, como el poseer una metodología científica claramente explícita para la identificación, selección y elaboración de estudios sintetizando sus resultados, eliminar los sesgos de las revisiones narrativas, brindar información amplia, exacta y resumida que puede ser asimilada con rapidez y facilidad por los profesionales de la salud, permitir plantear nuevas hipótesis, detectar áreas en las que la evidencia científica es escasa, comparar los resultados de diferentes estudios para establecer la generalización de sus hallazgos y su consistencia así como reducir el tiempo entre los descubrimientos y la implementación de las estrategias terapéuticas y diagnósticas para las distintas enfermedades11-13.
El objetivo de esta investigación fue evaluar la validez, el desempeño, la seguridad y la efectividad diagnóstica de las técnicas inmunológicas in vitro para el estudio de alergias entre los años 2000 y 2012.
Material y Métodos
Tipo de estudio: Revisión sistemática de la literatura con metaanálisis.
Identificación, tamización, elección e inclusión de los estudios: Con el fin de garantizar la exhaustividad de la revisión, se realizó una búsqueda por sensibilidad de los artículos originales de investigaciones publicadas en las bases de datos ScienceDirect, Wiley y Medline (Pubmed). La búsqueda por sensibilidad, es decir, sin circunscribirla a Descriptores de Ciencias de la Salud (DeCS ) o a las cabeceras del Medical Subject Headings (MeSH), permitió la obtención de un mayor número de estudios frente a la búsqueda por especificidad. Se utilizaron los siguientes términos: activation basophil test, lymphocyte transformation test, especific IgE immunoassay y sus equivalentes en español y portugués. Previamente a la delimitación de estas tres pruebas, se realizó una búsqueda con términos más amplios, como "diagnóstico in vitro de alergias", "pruebas in vitro para detección de alergias" e "identificación in vitro de alergias", con el fin de identificar las pruebas empleadas en el ámbito internacional, concluyendo que los tres test incluidos son los más frecuentes en investigación clínica.
Se aplicaron los siguientes criterios de inclusión: i) artículos con los términos de búsqueda en título y resumen, ii) publicados entre el 2000 y el 2012, iii) observacionales o longitudinales, iv) donde se reportaran sensibilidad o especificidad de las pruebas de diagnóstico in vitro para alergias y v) que especificaran el protocolo de ejecución de las técnicas diagnósticas. Se excluyeron los artículos que cumpliesen los siguientes criterios: i) donde la población o muestra evaluada fuesen personas sin diagnóstico previo de algún tipo de alergia, ii) estudios que no contribuyeran al logro del objetivo general de esta revisión, como artículos en los que se abordaran otras anormalidades de la IgE y iii) publicaciones con problemas de validez interna por los estadísticos empleados para el análisis y mal control de sesgos de selección e información. Para determinar la calidad de los estudios elegibles e incluidos se emplearon los criterios de la guía Quality Assessment of Diagnostic Accuracy Studies (QUADAS)14,15.
Recolección de la información: Se desarrolló por tres investigadores de forma independiente para garantizar la reproducibilidad de la búsqueda y selección de los artículos. Las discrepancias se resolvieron por consenso.
En la extracción de la información de los estudios incluidos se aplicó un manual que contenía las variables a extraer de cada uno, lo que fue diligenciado de forma independiente por cada investigador en dos ocasiones diferentes con una diferencia de 2 semanas para garantizar la reproducibilidad intra e interobservador de la extracción de la información. Para las variables lugar de estudio, técnica empleada, número de sujetos estudiados, número de positivos y de negativos o controles y tipo de alergia se obtuvo un índice kappa mayor a 0,95 y para la variable edad los coeficientes de correlación intraclase entre investigadores presentaron un valor de 0,98.
Análisis de la información. Para la evaluación de la validez de las pruebas se determinó la sensibilidad, la especificidad y las razones de verosimilitud o coeficientes de probabilidad (CP). El desempeño se estimó a partir de los valores predictivos y la proporción de resultados falsos, la exactitud con el porcentaje de pacientes correctamente diagnosticados y la razón de odds diagnóstica (ORD). La seguridad de la prueba se estudió con el Índice J de Youden. Para todos los resultados se calcularon sus respectivos intervalos de confianza del 95%16.
Se realizaron curvas ROC (Receiver Operating Characteristic) con base en los valores de sensibilidad y especificidad y se calculó el área bajo la curva de las pruebas, estableciendo en su interpretación las siguientes categorías: i) mala para valores menores a 0,6; ii) regular entre 0,60 y 0,74; iii) bueno entre 0,75 y 0,89; iv) muy bueno entre 0,90 y 0,95 y v) excelente a partir de 0,96.
En la interpretación del Índice J de Youden se tomó como base el hecho de que cuanto más se acerque a 1,0 mayor sería la calidad del resultado obtenido al realizar la prueba en un paciente, mientras que para la ORD se precisó que valores 1 o cercanos a 1 indicarían que la prueba no tenía capacidad para discriminar sujetos sanos y enfermos. Los valores más altos se tomaron como indicadores de mayor utilidad diagnóstica. Los cocientes de probabilidad se interpretaron con base en las siguientes categorías: i) excelente ayuda en el diagnóstico: CP- <0,1 y CP+ >10, ii) buena ayuda diagnóstica o de importancia clínica: CP- entre 0,1-0,2 y CP+ 5-10, iii) poca ayuda al clínico: CP- entre 0,21 y 0,5 CP+ entre 2 y 5, y iv) la prueba no presenta capacidad discriminante para CP- entre 0,51 y 1 o CP+ entre 1 y 216.
Los datos relacionados con los falsos positivos y negativos fueron almacenados y analizados en una base de datos en el software Meta-analysis of studies of evaluations of Diagnostic and Screening tests Meta-DiSc (es). En éste se empleó el método de aglomeración con el estadístico Prueba Q (chi2) de DerSimonian-Laird (REM), se agregó 0,5 a las celdas con cero, se calcularon los intervalos de confianza del 95% con corrección por sobredispersión, en las curvas ROC el área bajo la curva se calculó con la constante del modelo de Moses y el método de estimación del modelo fue con mínimos cuadrados no ponderados. Se determinó la heterogeneidad u homogeneidad de los metaanálisis de cada parámetro de la evaluación diagnóstica a través del estadístico Q de Cochran, que sigue una distribución chi2 y para el análisis de sensibilidad de estableció el porcentaje de peso de cada estudio individual sobre el resultado global del CP+, CP- y ORD. Además, en el software se realizaron los forest plot para la sensibilidad, especificidad, CP+, CP- y ORD de las pruebas identificadas, como resultado total del metaanálisis para evidenciar efectos individuales y efecto global con sus respectivos intervalos de confianza17. Se debe precisar que el Meta-DiSc(es) no presenta los resultados relacionados con los valores predictivos, la proporción de resultados falsos, el porcentaje de pacientes correctamente diagnosticados ni el índice J de Youden, por lo que estos parámetros, con sus respectivos intervalos de confianza, fueron calculados con la versión 3.0 del programa para análisis epidemiológico de datos tabulados de la Organización Panamericana de la Salud (EPIDAT), tanto para los estudios individuales como para el resultado global de las pruebas analizadas.
En todos los análisis se tomó un nivel de significación estadística de 0,05.
Resultados
Se identificaron 127.064 artículos con todas las fuentes y estrategias de búsqueda empleadas, a partir de la eliminación de duplicados se tamizaron 104.192 manuscritos. Tras la aplicación de los criterios de inclusión y exclusión y el análisis de las investigaciones elegibles, se incluyeron 18 estudios (figura 1). Después de excluir los que no presentaban datos de validez o desempeño diagnóstico o que abordaban otras anormalidades de la IgE, se aplicó la guía QUADAS a 18 estudios. Todos ellos obtuvieron una buena o aceptable calidad metodológica (los artículos evaluados cumplían entre 10 y 12 item de los 14 puntos de la guía) y fueron incluidos en el análisis. No se realizó meta-análisis por subgrupos de estudios en función de su calidad metodológica.
Las 18 investigaciones incluyeron un total de 3.520 individuos con un 57,6% de personas alérgicas y 42,4% de personas sanas. 14 las investigaciones estaban realizadas en Europa, con diferentes tipos de alergia, en personas con un rango de edad entre 1 y 85 años, a las que se les evaluó los marcadores de membrana CD63 de los basófilos activados. Se debe precisar que el estudio de Eberlin22 incluyó dos grupos, uno con marcadores CD203c y otro CD63 mientras que el estudio de Ocmant30 aplicó al mismo grupo cuatro pruebas diferentes que comprendían los marcadores CD63 y CD203 para personas alérgicas a maní y huevo. Un estudio evaluó la linfoproliferación, lo que representó el 0,5% de la población incluida, cuatro la IgE específica con el 68,0% de individuos y los demás artículos empleaban la prueba de activación de basófilos, que dio resultado positivo en el 31,5% de la población de estudio (tabla 1). Los estudios con la prueba de activación de basófilos incluyeron a 1.108 individuos (700 personas alérgicas y 408 sanas), en la linfoproliferación fueron 7 alérgicos y 11 sanos, mientras que en la IgE específica fueron 1.322 alérgicos y 1.072 sanos.
El tipo de estudio en todas las investigaciones incluidas correspondieron a evaluaciones diagnósticas. El criterio de clasificación en sanos y enfermos en los estudios que emplearon pruebas cutáneas fue la presencia de pápulas cutáneas con diámetro mayor a 3mm después de 15 minutos como marcador de un proceso alérgico. En las que emplearon IgE específica fue la presencia de concentraciones mayores a 0,35UIL y en los que emplearon como estándar de referencia el diagnóstico clínico se evaluó la presencia de exantema maculopapular, urticaria y angiodema.
En la tabla 2 se presenta la descripción de los valores para la evaluación diagnóstica, sumado al porcentaje del peso que presenta cada estudio individual en el valor global del CP+, el CP- y la ORD. En esta se observó que el estudio de Sturm et al20 con alergeno de avispas presentó el mayor peso en los resultados del CP+, mientras que para el CP- fue el de Sanz M et al19 (tabla 2).
El estudio de Tsuge I et al.31 fue el único que empleó el estudio de linfoproliferación, y halló una sensibilidad de 100% (IC95:93-100), especificidad de 91% (IC95:69-100), CP+ 11 (IC95%:2-71) e Índice J de Younden 0,91(IC95%:0,74-1,08).
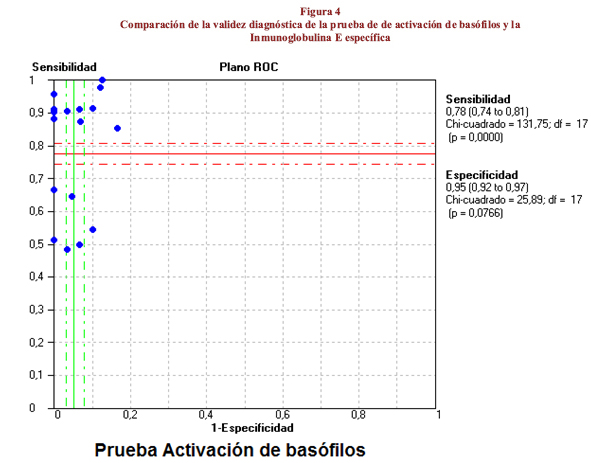
En la evaluación de la validez diagnóstica de la prueba de activación de basófilos se halló una sensibilidad global de 78% (IC95%:74%-81%) con un rango de 48%-100%. Una especificidad de 95% (IC95%:83-100), CP+ de 9,9 (IC95%:6,8-14,4), CP- 0,20 (IC95%:0,13-0,30) y una ORD de 70,8 (IC95:40,2-124,8). En comparación con el resultado global, en la sensibilidad se hallaron tres estudios con resultados estadísticamente menores y dos mayores, lo que puso de manifiesto la heterogeneidad de los resultados de los estudios individuales (p=0,000), al igual que en el CP- donde tres estudios presentaron resultados mayores al global y el análisis de heterogeneidad fue estadísticamente significativo (Q de Cochran=139,26; p= 0,000). En los demás parámetros los hallazgos de los estudios individuales y el global fueron estadísticamente iguales con valores de p> 0,05 en el análisis de heterogeneidad (figura 2).
En la determinación de inmunoglobulina E específica, la sensibilidad global fue 72% (IC95%:69-75), la especificidad 90% (IC95%:88-92), el CP+ 12,9 (IC95%:4,0-41,6), el CP- 0,32 (IC95%:0,23-0,43), la ORD 41,6 (IC95%:11,6-148,9) y se observó heterogeneidad en todos los parámetros evaluados (figura 3).
En la tabla 3 se presentan los valores predictivos, la proporción de resultados falsos, el índice J de Youden y la eficiencia de la prueba de activación de basófilos, la linfoproliferación y la IgE específica. Se observó que la activación de basófilos fue estadísticamente mayor en el valor predictivo positivo, la IgE específica fue mayor en la proporción de falsos positivos, mientras que los demás parámetros fueron estadísticamente iguales en las pruebas analizadas.
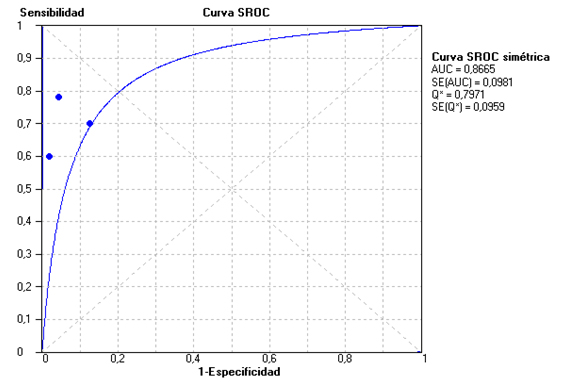
Al comparar las prueba de activación de basófilos frente a la IgE específica se halló una mayor área bajo la curva para la primera (0,97) frente a la segunda (0,87), evidenciando una mejor validez diagnóstica (figura 4).


Discusión
En el diagnóstico de alergias, las pruebas inmunológicas in vitro más empleadas son la linfoproliferación, la activación de basófilos y la IgE específica. Con respecto a dichas técnicas, un número creciente de estudios ha demostrado que la cuantificación por citometría de flujo de la activación in vitro de basófilos puede ser una herramienta válida y fiable para medir las respuestas alérgicas en pacientes. Debido a que la técnica de activación de basófilos acopla procesos semejantes a los que suceden in vivo, como lo es la fijación de antígenos a la IgE de los receptores FcεRI y FcγRII de la superficie de los basófilos. Cuando existe contacto de un basófilo sensibilizado con un alérgeno específico que se une a la IgE, los basófilos secretan una amplia variedad de mediadores bioactivos y generan la expresión de marcadores de activación en su membrana como CD63 y CD203c que tras la activación celular se expresan en la membrana citoplasmática, lo cual permite su medición mediante citometría de flujo utilizando anticuerpos monoclonales específicos Anti CD63 y CD203c marcados con fluorocromos. Los mejores resultados de esta técnica se han visto cuando se hace diagnóstico de alergias a medicamentos36-38.
La técnica de la IgE específica y los métodos in vivo tienen un papel muy relevante en el diagnóstico de los procesos alérgicos y son los más empleados. Los anticuerpos IgE tienen un papel fundamental en las reacciones alérgicas a través de la unión con sus receptores de alta afinidad (FcεRI y FcγRII) presentes en mastocitos, basófilos y eosinófilos. Tras la unión de la IgE con el alérgeno para la que es específica, dichos mediadores producen vasodilatación y broncoconstricción en los órganos diana1-2.
Desde el punto de vista inmunológico, las pruebas de activación de basófilos e IgE específica deberían generar resultados similares en la tamización de alergias, debido al rol de la IgE en ambas. En la primera la IgE se fija a la superficie del basófilos permitiendo la reacción con antígenos específicos y en la segunda la IgE se fija al antígeno implantado en una matriz donde se realizara la prueba de identificación39-42.
Con base en el número de estudios, la técnica más empleada en la tamización y diagnóstico de alergias es la activación de basófilos. Sin embargo, al considerar el número de individuos, es la IgE específica y la técnica con menor uso (en número de estudios e individuos incluidos) es la linfoproliferación. Esto podría atribuirse al hecho de que esta técnica presenta una estandarización compleja y existe poco conocimiento sobre la concentración de antígenos necesaria en cada prueba, lo que puede generar que no se dé una reacción celular adecuada o que concentraciones elevadas de los antígenos generen muerte de las células de la prueba. No están claros los tiempos de incubación ni la modelación in vitro de los procesos de regulación celular, y la prueba presenta un alto costo. Estos factores han restringido su uso a laboratorios de alto nivel, especialmente de investigación43-44.
Junto con lo anterior, es oportuno aclarar que las pruebas in vitro tienen como fin identificar el alérgeno responsable de los síntomas y determinar el mecanismo inmunológico de la reacción alérgica. Dependiendo de la fracción sanguínea que se analice, se pueden clasificar en serológicos y celulares. Los primeros tienen como finalidad identificar y cuantificar anticuerpos contra alérgenos específicos y medir la presencia de mediadores de reacción alérgica como la histamina y la triptasa. Las técnicas celulares utilizan células efectoras de la reacción alérgica que son aisladas en sangre periférica del paciente, siendo más empleados los linfocitos y basófilos.
La prueba de transformación de linfocitos mide específicamente la proliferación de los linfocitos T de memoria en presencia de un antígeno específico y la expresión de marcadores en su superficie, mientras que la prueba de activación de basófilos mide la expresión de marcadores de activación ante un alérgeno para el cual están sensibilizados44-45.
Por otra parte, es oportuno precisar que en el diagnóstico de alergias las pruebas epicutáneas y la provocación con alimentos o medicamentos son ampliamente usadas46, particularmente la provocación puede desarrollarse con la administración de la sustancia por ingestión, inhalación o inyecciones subcutáneas, intramusculares o intravenosas. Estos métodos son buenos en cuanto al diagnóstico pero presentan grandes inconvenientes con las reacciones adversas que pueden presentar los pacientes, como diarrea, vómitos y mareos, entre otros47.
En la evaluación de la validez, desempeño, seguridad y eficiencia diagnóstica de la prueba de activación de basófilos y la IgE específica se halló una sensibilidad mayor de 70%, especificidad superior a 90%, CP+ de 10 o más, CP- inferior a 0,3; ORD mayor a 40 y pacientes correctamente diagnosticados mayor al 83%. Estos resultados evidencian que ambas pruebas son de gran utilidad clínica y diagnóstica en la medida que discriminan de forma correcta a las personas de las sanas y enfermas. Aunque se debe precisar que en la activación de basófilos fue estadísticamente mayor el valor predictivo positivo, en la IgE específica la proporción de falsos positivos y, en términos globales, la activación de basófilos presentó una mayor área bajo la curva frente a la IgE específica, lo que sugiere su mayor validez diagnóstica16.
Es pertinente precisar que la sensibilidad y la especificidad permiten dimensionar la validez de una prueba y son descriptores diagnósticos per se (inherentes a la prueba, independientemente de la prevalencia de la enfermedad en la población a la cual se aplica). No obstante, su utilidad clínica es limitada dado que frente a un paciente se requiere resolver dudas en sentido contrario al de la probabilidad a priori, es decir, se busca conocer la probabilidad de que el paciente esté enfermo dado que el resultado de la prueba fue positivo o que esté sano dado que el resultado diagnóstico fue negativo. En este sentido, resultan de mayor utilidad clínica los valores predictivos positivo y negativo, los cuales presentan la limitación de ser dependientes de la prevalencia de la enfermedad en la población de personas de similares características al individuo consultante48.
Frente a las limitaciones de la sensibilidad, especificidad y valores predictivos, el cálculo y aplicación de cocientes de probabilidad (razones de verosimilitud o likelihood ratios) constituye una herramienta de gran utilidad clínica en la medida que ayudan a cuantificar la probabilidad pre-prueba de ocurrencia de un diagnóstico. Cada resultado posible de una prueba posee un CP a partir del cual es posible estimar cuánto aumenta o disminuye la probabilidad pre-prueba, permitiendo al clínico descartar un diagnóstico, confirmarlo o continuar su investigación mediante la solicitud de nuevos exámenes49.
A pesar de las consideraciones anteriores, la mayoría de estudios sobre pruebas diagnósticas en inmunología son incompletas, ya que sólo aluden a los aspectos de validez (sensibilidad y especificidad) y obstan los parámetros de desempeño, seguridad y eficiencia diagnóstica, lo que sustenta la necesidad de ampliar el estudio de dichas pruebas entre los clínicos, académicos e investigadores para poder orientar el tratamiento de las alergias de forma idónea.
En la investigación y praxis clínico-epidemiológica no existen pruebas diagnósticas ideales que contribuyan a una correcta clasificación de la totalidad de pacientes. En el caso específico de las alergias, los principales factores que sustentan este hecho son el intervalo de tiempo transcurrido entre la sensibilización del paciente y la realización de las pruebas diagnósticas que puede generar falsos negativos y las reacciones cruzadas que derivan en falsos positivos cuando hay sensibilización de los individuos a amonios cuaternarios con estructura similar a algunos antígenos50.
Aunado a la utilidad diagnóstica hallada para la activación de basófilos y la IgE específica, se debe explicitar que estas presentan otras características que evidencian su relevancia en la tamización, como presentar buena disponibilidad, seguridad, bajo costo y aceptabilidad cultural, identificar individuos para los cuales el fácil brindar tratamiento y que no pueden pasar inadvertidos por su impacto en la salud individual y colectiva51.
Se debe aclarar que una prueba parte del planteamiento de una probabilidad pre-prueba cuya precisión depende de la clínica, por ello cobra importancia el conocimiento teórico, la experiencia clínica y la evaluación del paciente para recolectar información que optimice el rendimiento de la prueba diagnóstica bajo estudio. Además, en el marco de la medicina basada en la evidencia, en la actualidad se dispone de múltiples herramientas para analizar críticamente diferentes grados de evidencia que orientan la toma de decisiones en diversas áreas, inclusive la evaluación de pruebas diagnósticas52-54.
Cabe aclarar que este estudio presenta varias limitaciones relacionadas con la heterogeneidad de las investigaciones individuales, tanto en los valores de sensibilidad y especificidad como en el tipo de población y alergia estudiada. Además, en los estudios en que la identificación de los enfermos fue bajo criterios clínicos, las categorías diagnósticas no se describen de forma detallada, y en el caso de la determinación de la IgE específica no se explicitan aspectos relacionados con la técnica de medición, lo que en conjunto puede afectar el grado de inferencia de los resultados del metaanálisis. En esta revisión sistemática se observó que la mayor parte de los artículos provienen de Europa, esto puede atribuirse a tres factores: i) en este continente se encuentran los centros de estudios más importantes sobre alergias, entre ellos la Academia Europea de Alergología e Inmunología Clínica (EAACI), considerada la asociación médica mas grande en el estudio de las alergias en el mundo, la cual cuenta con medios de difusión específicos del área como las revista Allergy, Pediatric allergy and inmunology, Clinical and translational allergy, la Federación Europea de Alergias (EFA) entre otras organizaciones ii) en Europa se documentan las mayores cifras de ocurrencia de la enfermedad, en la actualidad cerca de 113 millones de ciudadanos en Europa sufren rinitis alérgica y unos 68 millones de asma alérgico, iii) se estima que en Europa, a pesar de contar con buenos programas para el manejo de las alergias, existe un 45% de pacientes alérgicos no diagnosticados, lo que motiva la realización de estudios en este tópico, buscando disminuir el sub-registro, y iv) existen amplias divergencias en los criterios y pruebas diagnósticas lo que sustenta la necesidad de este tipo de investigaciones55.
En conclusión, el estudio evidenció que la activación de basófilos y la IgE específica son pruebas útiles en el diagnóstico de alergias. Además, generó información de gran relevancia para los clínicos, académicos e investigadores interesados en la temática.
Resulta determinante reunir, evaluar y sistematizar los estudios disponibles sobre la validez, el desempeño, la seguridad y la efectividad de las pruebas diagnósticas disponibles para alergias, con el fin de esclarecer su utilidad, mejorar y aumentar su uso y por conexidad, orientar su selección o utilización para generar evidencia que sustente las decisiones clínicas y epidemiológicas.
La revisión incluyó personas en un amplio rango etario y con diversos tipos de alergias, corroborando el mejoramiento en la validez externa que se obtiene con esta modalidad de investigación, en la medida que los hallazgos de validez, desempeño, seguridad, eficiencia y utilidad diagnóstica no están circunscritos a un único grupo etario o tipo de alergia.
El metaanálisis presentó múltiples ventajas frente a los estudios individuales entre los cuales se destacan i) la evaluación de la utilidad diagnóstica completa con lo que superaron los hallazgos de los estudios individuales que sólo refieren los valores de sensibilidad y especificidad, ii) la generación de un resultado global de utilidad diagnóstica que permite superar las divergencias en los estudios individuales, iii) el aumento de la validez interna y externa de las conclusiones al utilizar métodos estadísticos más robustos y una población con mayor grado de generalización frente a los estudios individuales, iv) generación de información sin sesgos potenciales de selección y de extracción de datos, válida y reproducible, v) mayor grado de evidencia y menor costos que otros estudios lo suficientemente grandes para llegar al mismo nivel de significación estadística56.
Bibliografía
1. Palomo I, Ferreira A, Rosemblatt M, Sepúlveda C, Vergara U. Células y órganos del sistema inmune. En: Palomo I, Pereira Jaime, Koening C. editores. Fundamentos de inmunología básica y clínica. Santiago de Chile: Editorial Universidad de Talca; 2002. p. 53-86. [ Links ]
2. Holgate S, Church M, Broide D, Martinez F. Allergy. Londres: Elsevier; 2012; 4. p. 1-32. [ Links ]
3. Romero G. Pereira Q, Zini R, Canteros G. Reacciones de hipersensibilidad. Rev Posgrado de la VIa Cátedra de Medicina. 2007; 167:11-6. [ Links ]
4. Cardona R, Serrano C. Aspectos básicos de las reacciones de hipersensibilidad y alergia: Alergia abordaje clínico diagnóstico y tratamiento. México DF: Editorial Médica Panamericana. 2010. p. 3-27. [ Links ]
5. Kindt T, Goldsby R, Osborne B. Reacciones de hipersensibilidad: Inmunología de kuby. 6 a ed. California: Mc Graw Hill; 2007; 6. p. 371-400. [ Links ]
6. Zubeldia J, Baeza L, Jáuregui R, Senet C. Importancia actual de las enfermedades alérgicas: Libro de las enfermedades alérgicas fundación BBVA. España: Fundación BBVA; 2012.p.41-47. [ Links ]
7. Méndez I, Huerta J, Bellanti J, Ovilla R, Escobar A. Epidemiologia de las enfermedades alérgicas: Alergía enfermedad multisistémica fundamentos básicos y clínicos. 1a .ed. México: Editorial Médica Panamericana; 2008.p.7-18. [ Links ]
8. Holgate S, Church M, Broide D, Martinez F. Allergy. Londres: Elsevier; 2012; 4. p. 129-146. [ Links ]
9. Cox L, Williams B, Sicherer S, Oppenheimer J, Sher J, Hamilton R, et al. Pearls and pitfalls of allergy diagnostic testing: report from the American College of Allergy, Asthma and Immunology/American Academy of Allergy, Asthma and Immunology Specific IgE Test Task Force. Ann allergy asthma inmuhno 2008; 101(6):580-92. [ Links ]
10. Malbran A, Rey G, Galassi N, Yeyati E. El laboratorio en el diagnóstico de alergias. Disponible en http://www.alergia.org.ar/profesionales/emc/prodaai2008/laboratorio_diagnostico_alergia.pdf. [ Links ]
11. Ortiz.Z. Qué son las revisiones sistemáticas. Centro de investigaciones epidemiológicas. 2005. Disponible en. http://www.epidemiologia.anm.edu.ar/pdf/publicaciones_cie/2005/Que_son_revisiones_sistematicas_2005.pdf. [ Links ]
12. Manterola C. Revisión sistemática de la literatura síntesis de la evidencia. Rev méd Clín Las Condes.2009; 20(6):897-903. [ Links ]
13. Letelier M. Revisiones sistemáticas y metaanálisis: ¿son la mejor evidencia? Rev Med Chile. 2005; 133(2):246-9. [ Links ]
14. Whiting P, Rutjes AW, Reitsma JB, Bossuyt PM, Kleijnen J. The development of QUADAS: a tool for the quality assessment of studies of diagnostic accuracy included in systematic reviews. BMC Med Res Methodol. 2003; 3: 25. [ Links ]
15. Zamora J, Abraira J. Análisis de la calidad de los estudios de evaluación de pruebas diagnósticas. Nefrología. 2008; 28(2):42-5. [ Links ]
16. Universidad de Granada. Valoración de pruebas diagnósticas. Disponible en: www.ugr.es/~bioest/medicina/Pruebas_Diagnosticas.xls. [ Links ]
17. Zamora J, Abraira V, Muriel A, Khan K, Coomarasamy A. Meta-DiSc: a software for meta-analysis of test accuracy data. BMC Med Res Methodol. 2006; 6:31. [ Links ]
18. Apostolou E, Deckert K, Puy R, Sandrini A, De León M, Douglass J, et al. Anaphylaxis to Gelofusine confirmed by in vitro basophil activation test: a case series. Anaesthesia. 2006; 61(3):264-8. [ Links ]
19. Sanz M, García M, Tabar A, Anda M, García B, Barber D, et al. Basophil Activation Test and specific IgE measurements using a panel of recombinant natural rubber latex allergens to determine the latex allergen sensitization profile in children. Pediatr Allergy Immunol. 2006; 17: 148-56. [ Links ]
20. Sturm G, Böhm E, Trummer M, Weiglhofer I, Heinemann A, Aberer W. The CD63 basophil activation test in Hymenoptera venom allergy:a prospective study. Allergy 2004; 59: 1110-7. [ Links ]
21. Rubio A, Bourrier, Vivinus T, Saggio B, Albertini M, Bernard A,. Benefit of the basophil activation test in deciding when to reintroduce cow's milk in allergic children. Allergy. 2011; 66:92-100. [ Links ]
22.Eberlein B, Varga R, Mempel1 M, Darsow U, Behrendt H, Ring J. Comparison of basophil activation tests using CD63 or CD203c expression in patients with insect venom allergy. Allergy 2006; 61: 1084-5. [ Links ]
23. Sanz M, Gamboa P, Antépara I, Uasuf C, Vila L, Garcia C, et al. Flow cytometric basophil activation test by detection of CD63 expression in patients immediate-type reactions to betalactam antibiotics. Clin Exp allergy.2002; 32(2):277-86. [ Links ]
24.Frezzolini A, Cadoni S, Pita O. Usefulness of the CD63 basophil activation test in detecting Anisakis hypersensitivity in patients with chronic urticaria: diagnosis and follow-up. Clin Exp Dermatol. 2010;35(7):765-70. [ Links ]
25. Pâris A, Demoly P, Persi L, Lebel B, DPharma, Bousquet J, et al. in vitro diagnosis of cypress pollen allergy by using cytofluorimetric analysis of basophils (Basotest). J Allergy Clin Immunol.2000; 105(2):339-45. [ Links ]
26. Monnereta G, Benoitb Y, Debarda A, Gutowskia M, Topenotb I, Bienvenua J. Monitoring of Basophil Activation Using CD63 and CCR3 in Allergy to Muscle Relaxant Drugs. Clin Immunol.2002; 102(2):192-9. [ Links ]
27. Eberlein B, Krischan L, Darsow U, Ollert M, Ring J. Double positivity to bee and wasp venom: Improved diagnostic procedure by recombinant allergen-based IgE testing and basophil activation test including data about cross-reactive carbohydrate determinants. J Allergy Clin Immunol. 2012; 130(1); 155-61. [ Links ]
28. Sanz M, García M, Caballero M, Dieguez I, Gamboa P. Test de activación de basófilos en el diagnóstico de alergia a medicamentos. An. Sis.Sanit. Navar. 2003; 26 (2): 39-47. [ Links ]
29. Wolanczyk A, Gogolewski G, Liebhart J, Gomulka K, Litwa M, Panaszek B. A New Variant of the Basophil Activation Test for Allergen-Induced Basophil CD63 Upregulation. The Effect of Cetirizine. J InvestigAllergolClinImmunol. 2009; 19(6): 465-73. [ Links ]
30. Ocmant A, Mulier S, Hanssens L, Goldman M, Casimir G, Mascart F, et al. Basophil activation tests for the diagnosis of food allergy in children. Clin Exp Allergy. 2009; 39(8): 1234-45. [ Links ]
31. Tsuge I, Okumura A, Kondo Y, Itomi S, Kakami M, Kawamura M, et al . Allergen-specific T-cell Response in Patients with Phenytoin Hypersensitivity; Simultaneous Analysis of Proliferation and Cytokine Production by Carboxyfluorescein Succinimidyl Ester (CFSE) Dilution Assay. Allergol Int. 2007;56(2):149-55. [ Links ]
32. Dang, T, Mimi T, Choo S, Licciardi P, Koplin J, Martin P, et al. Increasing the accuracy of peanut allergy diagnosis by using Ara h 2. J Allergy Clin Immunol 2012; 129(4):1056-63. [ Links ]
33. Corey J, Mamikoglu B, Akbar I, Houser S, Gungor A. ImmunoCAP and HY-TEC enzyme immunoassays in the detection of allergen-specific IgE compared with serial skin end-point titration by receiver operating characteristic analysis. Otolaryngol Head Neck Surg.2000; 122(1): 64-70. [ Links ]
34. Petersen A, Gudmann P, Milvang P, Mørkebergb R, Bøgestrandb S, Linnebergc A, et al. Performance evaluation of a specific IgE assay developed for the ADVIA centaur immunoassay system. Clin Biochem.2004; 37(10):882-92. [ Links ]
35. Biagini R, Krieg E, Pinkerton L, Hamilton R. Receiver Operating Characteristics Analyses of Food and Drug Administration-Cleared Serological Assays for Natural Rubber Latex-Specific Immunoglobulin E Antibody. Clin Diagn Lab Immunol. 2001;8(6) 1145-9. [ Links ]
36. Valovirta E. Libro de EFA sobre Alergias Respiratorias. Aumentar la conciencia y aliviar la carga. Italia: officine Grafiche Francesco Giannini & Figli s.p.A. 2011. [ Links ]
37. Ebo D, Bridts C, Hagendorens M, Aerts N,Clerck L, Stevens W. Basophil activation test by flow cytometry: present and future applications in allergology. Cytometry B Clin Cytom. 2008;74(4):201-10. [ Links ]
38. Chirumbolo S. Use of basophil activation test in the investigation of adverse effects to vaccines. Hum Vaccin.2011;7(8): 878-80. [ Links ]
39. Galassi N, Riera N, Rey G, Bracco M, Malbran A. Urticaria crónica evolución clínica, prueba del suero antólogo, recuento y activación de basófilos. Medicina (Buenos Aires) 2003; 63(1):15-20. [ Links ]
40. Mayorga C, Sanz M, Gamboa P, Garcia B, Garcia J, Labrador M et al. in vitro Diagnosis of Immediate Allergic Reactions to Drug An Update. J Investig Allergol Clin Immunol. 2010; 20(2): 103-9. [ Links ]
41. Jing L, Bardina L, Shreffler W, Andreae D, Ge Y, Wang J, et al. Development of a novel peptide microarray for large-scale epitope mapping of food allergens. J Allergy Clin Immunol. 2009; 124(2):315-22. [ Links ]
42. Shyur S, Jan R, Wester J, Chang P, Jung lu Y, Yao Wang J. Determination of multiple allergen-specific IgE by microfluidic immunoassay cartridge in clinical settings. Pedriatic Allergy Immunol. 2010; 21(4):623-33. [ Links ]
43. Kenny Y, Jacqueline S. Kwong, Jacqueline S. Sabet E, Mendoza G, Platts-Mills; T Ryan. The Benefits of Specific Immunoglobulin E Testing in the Primary Care Setting. Am J Manag Care. 2011; 17(S17):447-59. [ Links ]
44. Kastylevsky G, Vial T, Descotes J. Drug allergy diagnosis in humans possibilities and pitfalls. Toxicology.2001 158; 1-10. [ Links ]
45. Zubeldia J, Baeza L, Jáuregui R, Senet C. Análisis de sangre para el estudio de alergias: Libro de las enfermedades alérgicas fundación BBVA. 1a. ed. Madrid: Fundación BBVA; 2012.p.371-8. [ Links ]
46. Chivato T. Estudio alergológico in vitro. Guía rápida para residentes de alergología. Madrid. Luzan 5 ediciones. 2009. p. 47-55. [ Links ]
47. Méndez I, Huerta J, Bellanti J, Ovilla R, Escobar A. Apoyos diagnósticos de las alergias: Alergia enfermedad multisistémica fundamentos básicos y clínicos. 1a .ed. México DF: Panamericana; 2008.p. 375-82. [ Links ]
48. Zubeldia J, Baeza L, Jáuregui R, Senet C .Pruebas de provocación con alimentos y medicamentos: Libro de las enfermedades alérgicas fundación BBVA. España: Fundación BBVA; 2012. p. 379-85. [ Links ]
49. Cerda J, Cifuentes L. Uso de tests diagnósticos en la práctica clínica (Parte 1): Análisis de las propiedades de un test diagnóstico. Rev. chil. infectol. (online). 2010;27(3):205-8. [ Links ]
50. Cifuentes L, Cerda J. Uso de tests diagnósticos en la práctica clínica. Aplicación clínica y utilidad de un test diagnóstico. Rev. Chil. Infectol (online). 2010; 27(4):316-9. [ Links ]
51. Ebo G, Leysen J, Mayorga C, Rozieres A; Knol E; Terreehorst I. The in vitro diagnosis of drug allergy status and perspectives. Allergy. 2011; 66: 1275-86. [ Links ]
52. Alonso E, Zapatero L Martinez M. Educación del paciente alérgico prevención de riesgos y tratamiento. Disponible en: http://www.aeped.es/sites/default/files/documentos/8-educacion-alergico.pdf. [ Links ]
53. Guyatt G, Drummond R Meade M, Cook D. Users's Guides to the Medical Literature. Essentials of Evidence-Based Clinical Practice. 2 a .ed. Nueva York: McGraw Hill Professional. 2002. [ Links ]
54. Vera C, Letelier L M, Carvajal J. Guía para el análisis crítico de estudios que evalúan exámenes diagnósticos. Rev Chil Obstet Ginecol. 2005; 70: 196-202. [ Links ]
55. Valenzuela L, Cifuentes L. Validez de estudios de tests diagnósticos. Rev Méd Chile 2008; 136: 401-4. [ Links ]
56. Marin F; Meca J, López J. El metaanálisis en el ámbito de las Ciencias de la Salud una metodología imprescindible para la eficiente acumulación del conocimiento. Fisioterapia. 2009; 31(3):107-14. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Jaiberth Antonio Cardona Arias
Calle 67 Número 53 - 108, Bloque 5, oficina 103
Medellín, Colombia
Correo electrónico: jaiberthcardona@gmail.com