INTRODUCCIÓN
El cáncer colorrectal (CCR) es la tercera neoplasia maligna más frecuentes en el mundo y la cuarta en mortalidad si consideramos ambos sexos. En hombres es el segundo tumor con 746.298 (10,0%) del total, al igual que en las mujeres con 614.304 (9,2%) casos encontrándose diferencias geográficas y por sexos en cuanto a incidencia y mortalidad, siendo más frecuente en regiones desarrolladas y en hombres. España ocupa una situación intermedia dentro de la región europea, con 19.261 nuevos casos en hombres (43,9 ASRi) y 12.979 en mujeres (24,1 ASRi) estimados para el 2012. En mortalidad, para el mismo periodo, se estimaron 8.742 casos en hombres (37 tasa de incidencia estandarizada por edad ó ASRi) y 5.958 en mujeres (8,4 ASRi). Para los próximos 5 o 10 años se ha estimado un incremento tanto de incidencia como de mortalidad por esta causa1.
El cribado de CCR ha demostrado ser una estrategia coste-efectiva para reducir la mortalidad y la incidencia a largo plazo independientemente del método utilizado, sangre oculta en heces (SOH), colonoscopia o sigmoidoscopia2,3. En el caso del cribado con SOH la evidencia disponible muestra una reducción de la mortalidad por esta causa de hasta el 14%4,5,6,7 siendo el método más extendido a pesar de demostrarse disminuciones mayores con la colonoscopia y sigmoidoscopia8,9) según refleja una revisión global de métodos de cribado publicada en recientemente10.
En España el método utilizado desde el comienzo de los programas de cribado es la detección de SOH, siguiendo las recomendaciones europeas incorporadas en la Estrategia Nacional del Cáncer, ratificada en 200912. Los programas son poblacionales y están integrados en una Red de Cribados que permiten la estandarización y las evaluaciones según criterios establecidos13 y acordes con la Guía Europea14. En 2014, el Ministerio de Sanidad incorporó en la Cartera Básica de Servicios el cribado poblacional de CCR dirigido a mujeres y hombres de 50 a 69 años de edad, que no presentan riesgo genético o familiar detectado, mediante la detección de SOH bienal y colonoscopia como prueba de confirmación diagnóstica, teniendo como objetivo cubrir a toda la población diana estatal en 202515.
Algunos programas empezaron utilizando como test de cribado la detección de SOH basada en resina de guayaco (SOHg). Estos programas se cambiaron al test inmunoquímico (FIT) al evidenciarse una mayor aceptación de la población y mejora en las tasas de detección16,17. Recientemente un meta-análisis mostró también mayores tasas de sensibilidad y especificidad para el FIT18.
La participación en los programas es un factor clave para determinar su impacto a medio y largo plazo19,20. Existe evidencia de que factores como la edad, el sexo y las desigualdades socioeconómicas influyen en la participación y la detección de lesiones21.
El objetivo del estudio fue describir y comparar los resultados de seis programas en cuanto a lesiones detectadas tanto por programa, participación, sexo, edad,tipo de test y comunidad autónoma.
SUJETOS Y MÉTODOS
Diseño. Este estudio forma parte del proyecto CRIBEA. Se trata de un estudio retrospectivo de una cohorte de hombres y mujeres de 50 a 74 años invitados a participar en alguno de los 6 Programas de Cribado de España: Comunidad Valenciana, Murcia, Cataluña, Cantabria, País Vasco y Canarias. Se tuvieron en cuenta las características de todos los programas y los test utilizados (figura 1).
Periodo de estudio. Las invitaciones a participar se cursaron entre 2005 y 2012. Todos los participantes completaron al menos una ronda de cribado. No se incluyeron datos del período 2000 a 2004 por dificultades para realizar la recogida y estandarizar las variables.
Se elaboró un protocolo conjunto de variables sobre características personales, características organizativas y de resultados. Las fuentes utilizadas fueron los datos propios de los programas y búsqueda activa en resultados no disponibles. Para obtener una base de datos común se vincularon los datos de todos los programas. La información para el estudio fue anonimizada, siendo aprobado el proyecto por los comités de ética regionales.
Variables. Comunidad autónoma, año de invitación, sexo y edad en el momento de la invitación, tipo de invitación (primera invitación/sucesiva), participación (inicial primera invitación/inicial sucesiva invitación/sucesivo), tipo de test utilizado (SOHg), FIT cualitativo y FIT cuantitativo, resultado del test utilizado (positivo/negativo), colonoscopia realizada en cribado positivo, número de adenomas avanzados (AA) detectados (≥3 adenomas y/o al menos 1≥10mm y/o componente velloso y/o displasia de alto grado) y cánceres colorectales invasivos detectados (CCR) (≥pT1). Se consideró neoplasia avanzada a la suma de AA y CCR (NA).
En el momento de la invitación se excluyó a personas con CCR previo al cribado, colonoscopia previa en los últimos 5 años y personas con enfermedades graves. Se consideraron invitaciones válidas las que no habían sido devueltas por correo por dirección desconocida y participantes a las personas que, teniendo una invitación válida, habían realizado la prueba de cribado con resultado válido (negativo/positivo).
No se incluyó como variable la estrategia específica de invitación de cada programa.
Se definió participación en la colonoscopia la tasa de colonoscopias realizadas en los casos positivos y con un resultado definitivo en cuanto a detección de lesiones. En todos los casos se registró la lesión más severa.
Las tasas de detección se expresaron en personas con AA/CCR/NA x 1.000 participantes.
No se analizaron los estadíos del CCR por haberse utilizado diferentes nomenclaturas y clasificaciones en los programas. Se excluyó el análisis de las complicaciones de las colonoscopias por ser objeto de otro estudio.
No se analizaron otras características individuales, como el nivel socioeconómico, al no disponerse de asignación de quintiles de privación en todas las regiones.
Los resultados se agruparon en tres frupos de edad: menores de 55 años, entre 55 y 64 y mayores de 65 años). Se construyó un índice de participación para establecer comparaciones (<40%; 40-60% y >60%).
En el análisis univariado se compararon las tasas de detección de lesiones (AA, CCR y NA) con la tasa y el tipo de participación, sexo, grupo de edad y tipo de test de cribado. En el análisis de regresión logística se calcularon las odds ratio (OR) de la detección de cada tipo de lesión para cada categoría del resto de variables y ajustando por todas ellas. Se analizaron las tendencias temporales por sexo y grupos de edad de ≤60 y >60 años.
Se utilizó el programa SPSS vs 22 y R para Windows.
RESULTADOS
En la tabla 1 figuran los principales indicadores por comunidades autónomas, correspondiendo la tasa más alta de participación al País Vasco (66,6%) seguido de Murcia (52,5%). Se observaron también diferencias en la tasa de detección de neoplasia avanzada y cáncer, correspondiendo a Murcia la más alta de adenoma avanzado por mil participantes (33,6‰) y la más baja a Cantabria (16,3‰). En la tabla 2 se presentan los resultados de la variabilidad encontrada en cuanto a tasas de detección que resultaron ser superiores en tasas de participación superiores al 60% en AA y CCR (25,4‰; IC 95% 24,9-25,9) y 3,6‰; IC 95% 3,4-3,8) respectivamente. La tasa de detección también fue superior en Inicial Primera invitación para ambas lesiones (22,2‰ IC95%: 21,9-22,6 y 3,3‰ IC95% 3,2-3,4). Se observó en hombres una tasa para NA del 34,6‰ (IC95%:34,1-35,0) y en mujeres de 12,9‰ (IC95%: 12,6-13,2), así como mayor tasa de detección de NA en personas de más de 65 años (28,7‰; IC95%:22,5-23,1).
Tabla 1 Indicadores por Programas de cribado 2005-2012
| Comunidad autónoma | Invitaciones válidas | Participantes | Participación | Positivos | Positividad (%) | Colonoscopias | Cumplimentación colonoscopias % | TD AA (‰) | TD CCR (‰) | TD NA (‰) |
|---|---|---|---|---|---|---|---|---|---|---|
| Canarias | 105.347 | 40.824 | 38,8 | 2.339 | 5,7 | 2.233 | 95,5 | 18,6 | 5,2 | 23,8 |
| Cantabria | 129.045 | 45.964 | 35,6 | 3.220 | 7,0 | 2.016 | 62,6 | 16,3 | 3,1 | 19,4 |
| Catalunya | 614.758 | 221.215 | 36,0 | 10.769 | 4,9 | 9.477 | 88,0 | 15,6 | 2,7 | 18,3 |
| Valencia | 540.590 | 242.302 | 44,8 | 10.158 | 4,2 | 8.830 | 86,9 | 12,7 | 2,4 | 15,1 |
| Murcia | 156.526 | 82.237 | 52,5 | 8.800 | 10,7 | 7.844 | 89,1 | 33,6 | 2,3 | 35,8 |
| País Vasco | 449.453 | 299.377 | 66,6 | 19.632 | 6,6 | 18.330 | 93,4 | 25,4 | 3,6 | 29,0 |
| Total | 1.995.719 | 931.919 | 46,7 | 54.918 | 5,9 | 48.730 | 88,7 | 19,8 | 3,0 | 22,8 |
*Invitaciones válidas: personas invitadas cuya carta no ha sido devuelta por domicilio desconocido. **TD AA: tasa detección adenomas avanzados x 1000 participantes; TD CCR: tasa detección cáncer colorrectal x 1000 participantes; TD NA: tasa detección neoplasia avanzada x 1000 participantes.
Tabla 2 Variabilidad de las tasas de detección de lesiones según participación, sexo, edad y tipo de test

*TD AA: tasa detección adenomas avanzados x 1000 participantes; TD CCR: tasa detección cáncer colorrectal x 1000 participantes; TD NA: tasa detección neoplasia avanzada x 1000 participantes
El test cuantitativo detectó el 23,8‰ (IC 95% 23,5-24,1) de AA y cáncer sobre SOHg y el FIT cualitativo el 3,4‰ (IC95%: 3,2-3,5).
En el análisis multivariante ajustado por edad y sexo (tabla 3) se observó cómo la participación de 40-60% aumentaba en OR: 1,33 (IC95%: 1,28-1,38) la tasa de detección de AA, disminuyendo la de CCR (OR:0,86;IC95%: 0,78-0,95) a diferencia de la participación superior al 60% tuvo una OR:1,02;IC95%:0,92-1,12).
Tabla 3 Análisis multivariante para determinar factores relacionados con las tasas de detección

*OR=Odds Ratio; IC= Intervalo de Confianza; ROC: Característica Operativa del Receptor
El tipo de kit resultó ser el factor que más determinó la probabilidad de detectar AA, con un OR:6,44;IC95% 5,69-7,29 al utilizar FIT cualitativo y una OR:9,86;IC95% 8,94-10,87 con FIT cuantitativo sobre SOHg.
En la tabla 3 y la figura 2 se observa que en todos los periodos los hombres presentaron tasas de detección de NA del 27,3‰ (IC95%: 21,3-33,2) en 2009 y del 33‰ (IC95%: 32,0-34,1) en 2012, respecto a mujeres que presentaron para el mismo periodo el 6,1‰ (IC 95% 2,3-9,9) en 2009 y el 14,2‰ (IC 95% 13,6-14,9) en 2012. En ambos casos se observaron incrementos significativos y tendencias superiores a partir del uso de FIT en 2010.
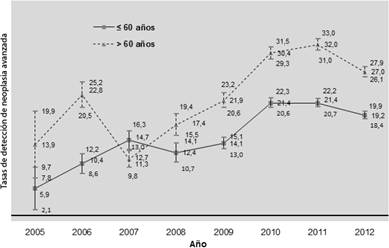
En el caso de la edad (figura 3) se observó que las personas mayores de 60 años presentaron también una probabilidad de tener NA del 21,9‰ (IC95%: 20,6-23,2) y del14,1‰ (IC95%: 13,0-15,1) en 2009 que se mantuvo en todos los periodos, si bien en el 2007 se observó una disminución puntual. Las tendencias resultaron también significativas.
DISCUSIÓN
La tasa de participación mostró una relación positiva en el caso de la detección de NA, aunque no parece que un aumento a partir de 60% influya de forma significativa en las tasas de detección. Este efecto puede ser debido a que la mayor participación se produce también con el test inmunoquímico, que detecta mayor número de adenomas avanzados. No obstante, el impacto en la reducción de la morbimortalidad a nivel poblacional pareció estar relacionado con una mayor participación, por lo que es necesario seguir impulsando la participación tanto inicial como en sucesivas rondas garantizando la adherencia a los programas de cribado11.
Las diferencias en la detección de lesiones de más del doble en hombres que en mujeres tanto en AA como en CCR se correspondió con lo encontrado en la mayoría de los programas22,23. Otro factor determinante de la detección de lesiones fue la edad, encontrándose mayor porcentaje de lesiones avanzadas según aumentaba24. Estos resultados fueron especialmente relevantes en las primeras rondas, cuyas tasas de detección resultaron mayores y disminuyeron en las sucesivas debido a la detección y extirpación precoz de adenomas avanzados.
Tal cómo se observó en otros programas poblacionales, existió variabilidad en la utilización de las pruebas de cribado, que fueron progresivamente cambiando a FIT cuantitativo, siendo el test utilizado más frecuentemente, acorde con la evidencia disponible de mayor tasa de detección de NA y la posibilidad de elegir el punto de corte, adecuándolo a la capacidad de realizar las colonoscopias de confirmación10. En nuestro contexto se utilizan puntos de corte diferentes en el caso del test inmunoquímico cuantitativo, debido a que si bien las marcas proponen 100ng Hb/ml buffer, lo que no resulta equivalente en los test, tal como se demostró en el estudio realizado en el País Vasco que comparaba los test utilizados en España25.
Tampoco la edad de cribado fue homogénea en el tiempo, si bien la cartera básica de servicios define que esté entre los 50 y 69 años.
Sería importante unificar las unidades de medida y el número de muestras para poder comparar de forma pormenorizada los resultados en los casos de FIT, dado que se apreciaron diferencias estadísticamente significativas en las tasas de detección que podrían corresponder a concentraciones diferentes de hemoglobina por el uso de diferentes marcas comerciales26. Este factor ha sido estudiado por la red de programas de cribado con el fin de mejorar la comparabilidad de los resultados.
En nuestro estudio se mostró una tasa de detección de AA prácticamente 10 veces superior con FIT cuantitativo que con guayaco, si bien la tasa de CCR es el doble, ocupando una posición intermedia el uso del FIT cualitativo. La migración a FIT, adoptada por los programas pioneros (Cataluña y Valencia) y el comienzo de los demás con FIT está de acuerdo a la revisión realizada por Tinmouth et al.27, que recomiendan su uso en programas por su mayor impacto. Hay que tener en cuenta que uno de los programas (Murcia) utiliza FIT cuantitativo con 2 muestras, obteniendo una tasa mayor de detección de lesiones.
De acuerdo al estudio de Zorzi et al28 en Italia, a medio plazo el uso de FIT podría reducir la mortalidad específica por CCR en hasta un 22% con una sola muestra, punto de corte 20µg/g heces de forma bienal. Así mismo, tanto con FIT como con guayaco se evidencia una probable disminución de la incidencia a largo plazo debido a la extirpación de lesiones precancerosas (AA)29,30.
En nuestro estudio se registró una tasa de detección de lesiones avanzadas inferior en participantes sucesivos tanto en AA como en CCR, que mostraría el efecto “protector” de los cribados anteriores en cuanto a especificidad de la prueba (31) .
Es decir, no solamente el test de cribado es un factor determinante en la detección de lesiones, sino el seguir participando en el cribado y realizarse la colonoscopia en caso de resultado positivo, ya que las lesiones evolucionan en un periodo largo de tiempo, lo que permite extirpar las avanzadas para impedir su progresión y CCR en estadios precoces.
La principal fortaleza de este estudio es la capacidad de analizar los datos de seis programas poblacionales en España, con diferencias metodológías y tasa de participación. Ello permite comparar el efecto de estas diferencias en la detección de lesiones. Además se han sentado las bases de colaboración y comparación, lo que permite establecer recomendaciones para mejorar la cobertura, la participación y la calidad del proceso y los resultados. Esto puede servir de guía para los programas que se están implantando.