INTRODUCCIÓN
La aparición de la epidemia por virus Zika (VZ) en América en 2015 y las complicaciones con las que se ha relacionado, especialmente la microcefalia y el Síndrome de Guillain-Barré (SGB), han constituido un nuevo tipo de amenaza de salud pública dentro de las enfermedades transmitidas por vectores y ha puesto en evidencia que una enfermedad que apenas había producido un brote y dos decenas de casos esporádicos en seis décadas desde su identificación, puede convertirse en un riesgo de salud pública global al encontrar las condiciones medioambientales y de presencia de vector adecuadas1.
En febrero de 2015, Brasil declaró un brote en los estados del noreste del país caracterizado por exantema cutáneo que posteriormente fue identificado como enfermedad por VZ y supuso la primera detección de transmisión autóctona de este virus en América2,3,4. Un año después, en febrero de 2016, el agrupamiento de casos de microcefalia y trastornos neurológicos en Brasil y su posible asociación con este virus llevó a la Directora General de la Organización Mundial de la Salud (OMS) a declarar esta situación como una Emergencia de Salud Pública de Importancia Internacional (ESPII)5. La asociación entre el VZ y las malformaciones congénitas y los síndromes neurológicos fue confirmada posteriormente6,7.
Este virus fue identificado por primera vez en 1947 en un mono rhesus del bosque Zika, en Uganda, y un año después detectado en un mosquito Aedes africanus procedente del mismo lugar8,9. En 1952 se describieron los primeros casos humanos en Uganda y Tanzania mediante la presencia de anticuerpos neutralizantes al VZ en suero9; y posteriormente, entre las décadas de los años 60 y 80, varios estudios demostraron una exposición humana generalizada al virus y su circulación desde Uganda hacia África Occidental y Asia Ecuatorial10,11,12.
En 2007 se registró por primera vez enfermedad por VZ en humanos fuera de África y Asia en forma de un brote de gran magnitud en la Isla de Yap (Micronesia)13. Hasta entonces, sólo se habían documentado 14 casos humanos de infección por este virus y no se habían notificado brotes14. Unos años después, entre el 2013 y 2014 se produjeron brotes en 4 archipiélagos del Pacífico15,16, y a raíz del que se había producido en la Polinesia Francesa, se describió por primera vez la posible asociación entre el VZ y las complicaciones neurológicas y autoinmunes graves, como el Síndrome de Guillain-Barré17,18,19. Los vectores implicados en la transmisión del virus en estos brotes descritos fueron Ae. aegypti y Ae. polynesiensis18.
Para interpretar las relaciones genéticas entre cepas del virus geográficamente distintas, en 2012 se realizaron análisis filogenéticos que revelaron la existencia de dos linajes principales del virus: el africano y el asiático11. Los análisis filogenéticos realizados en las zonas afectadas en 2015 y 2016 han permitido identificar que tanto las cepas de los brotes de América como las de los casos notificados en zonas del continente africano (Cabo Verde), Asia y Oceanía pertenecen al linaje asiático11,20,21,22.
DESCRIPCIÓN DE LA EPIDEMIA EN LA REGIÓN DE LAS AMÉRICAS
La Región de las Américas experimentó una epidemia explosiva de enfermedad por VZ entre mediados de 2015 y mediados de 2016, pero el virus fue detectado por primera vez en territorio americano en la Isla de Pascua, Chile, en febrero de 2014 coincidiendo con los brotes ocurridos en la Polinesia Francesa, Nueva Caledonia y otras islas del Pacífico23.
A partir de julio de 2015 comenzaron a declararse alteraciones neurológicas (de forma especial el Síndrome de Guillain-Barré) asociadas a esta infección en los estados afectados del noroeste de Brasil, y en octubre del mismo año comenzó a observarse un aumento en el número de casos de microcefalia entre los recién nacidos24,25. En julio se declaró también el primer brote de enfermedad por VZ en Cabo Verde, y Colombia confirmó la detección de varios casos en diferentes zonas del país26,27. Durante los meses siguientes, otros 6 países de América Latina confirmaron casos autóctonos de enfermedad por VZ28, en noviembre Brasil declaró el aumento de casos de microcefalia como Emergencia de Salud Pública Nacional29 y unos meses más tarde, en febrero de 2016, fue declarado como ESPII por la Directora General de la OMS.
En junio de 2016 la OMS lanzó el Plan de respuesta estratégico del Zika, centrado en la detección, la prevención y el tratamiento de las complicaciones médicas causadas por la infección por este virus30. Otro pilar importante fue el de la investigación y desarrollo de herramientas de control de mosquitos, test diagnósticos y vacunas. En este sentido, rápidamente se publicó el perfil requerido para la elaboración de vacunas óptimas contra el VZ, en cuyo desarrollo se involucraron más de 30 entidades31. De las 40 vacunas candidatas que entraron en proceso en enero de 2017, actualmente 11 han alcanzado la fase I y dos han comenzado la fase II de ensayo clínico 32. Además, en los meses siguientes al lanzamiento del plan de respuesta, se intensificó la actividad para el control de vectores en los países afectados y se ampliaron las herramientas, implementando nuevas técnicas como el uso de mosquitos Aedes infectados por Wolbachia, mosquitos genéticamente modificados y trampas para vigilancia33.
El 18 de noviembre de 2016, durante la quinta reunión del Comité de Emergencias del Reglamento Sanitario Internacional, una vez dilucidada la asociación entre la infección por VZ y el riesgo de padecer trastornos neurológicos y microcefalia y ante la disminución de casos de infección y alteraciones relacionadas, se acordó que el VZ y sus consecuencias ya no representaban una ESPII, aunque su abordaje seguía siendo un reto para la salud pública que requería un programa de trabajo sostenido con recursos específicos34.
Según los últimos datos disponibles, publicados por la OMS el 4 de enero de 2018 en toda América se notificaron desde 2015 hasta esa fecha 583.451 casos sospechosos, 223.477 confirmados de enfermedad por VZ y 3.720 casos confirmados de síndrome congénito asociado a la infección por este virus35. Solamente en Brasil se notificaron 231.725 casos sospechosos y 137.288 confirmados de infección, y según los datos del último boletín epidemiológico de del Ministerio de Brasil a 10 de enero de 2018, había 3.071 casos confirmados de síndrome congénito asociado a la infección por el VZ36.
Otro motivo de preocupación surgido durante la epidemia en América ha sido la transmisión sexual, que fue documentada por primera vez en 200837, pero que debido a la relación entre el VZ y los efectos sobre el feto ha tenido durante esta alerta una especial relevancia. Se han creado modelos matemáticos para explicar el papel de esta vía de transmisión en la dinámica de la epidemia considerando que ésta podría estar altamente infraestimada38,39,40.
Según la última clasificación de la OMS (del 10 de marzo de 2017) y a fecha de la última actualización, el 21 diciembre de 2017, desde 2015 se ha documentado transmisión vectorial en 89 países, territorios o áreas subnacionales (figura 1): 40 de ellos clasificados como categoría 1, es decir con introducción o reintroducción documentada del virus y actualmente con evidencia de transmisión activa. Otros 34 como categoría 2, con circulación del virus antes de 2015 y que no se encuentran en fase de reintroducción, pero sin evidencia de interrupción y por último 15 se clasificaron como categoría 3, siendo áreas con transmisión interrumpida, pero con posibilidad de transmisión en el futuro. En 63 países, territorios o áreas subnacionales se ha identificado la presencia establecida del vector competente, pero sin evidencia documentada de transmisión.

Fuente: ECDC.
Figura 1 Mapa de categorías de distribución de los países según tipo de transmisión del VZ a 19/12/17
Según la OMS, la evaluación global del riesgo no ha cambiado y se recomienda la vigilancia activa en los países y territorios donde el mosquito Ae. aegypti está establecido41,42. No obstante, tras la epidemia de 2016, la transmisión del VZ ha disminuido notablemente en la región de las Américas, lo cual ha supuesto una reducción significativa del nivel de exposición en comparación con el período de máxima incidencia, producido en la primera mitad del mismo año43.
ALTERACIONES ASOCIADAS A LA INFECCIÓN POR VZ
Desde que Brasil declaró la emergencia nacional y la OMS declaró la ESPII, se han realizado numerosos estudios para evaluar la asociación del virus Zika con alteraciones congénitas y trastornos neurológicos. En 2016 se publicó un estudio de casos y controles llevado a cabo durante la epidemia de 2013-2014 en la Polinesia Francesa que demuestra la relación entre la infección por el VZ y el Síndrome de Guillain Barré (SGB)44. En diciembre de 2017, se publicó el informe definitivo del estudio de casos y controles llevado a cabo en Brasil desde enero de 2016, en el que se evaluaron las causas potenciales de la microcefalia, incluyendo la infección congénita por VZ, las vacunas durante el embarazo y los larvicidas (también señalados como posibles factores asociados)45. Como resultado se observó una fuerte asociación entre la infección congénita por VZ y la microcefalia, teniendo en cuenta todos los posibles factores confusores, y la ausencia de evidencia de asociación con vacunas y larvicidas. Sin embargo, aún quedan lagunas en el conocimiento de este fenómeno, como señala otro artículo publicado en junio de 2017, basado en la vigilancia de la microcefalia y la infección por VZ en embarazadas en Brasil46. Este estudio, pone de manifiesto el desconocimiento de las razones que puedan explicar la marcada variación en la frecuencia de la microcefalia asociada a la infección que se observó en las diferentes regiones del país y en distintos momentos durante el periodo de la epidemia por Zika. Este hecho fue también señalado en la revisión sistemática realizada por el WHO Zika Causality Working Group publicada en enero de 2017, en la que se señala que la evidencia disponible no prueba qué otros factores ambientales o individuales puedan interaccionar con el virus y por tanto explicar las diferencias geográficas detectadas en los “cluster” de microcefalia y SGB6. Como conclusión se estableció que la explicación más probable que aporta la evidencia disponible respecto a la microcefalia, el SGB, y los brotes de infección por Zika, es que la infección por el virus del Zika durante el embarazo es una causa de alteración cerebral congénita (incluyendo la microcefalia) y que además esta infección es un desencadenante del SGB. Sin embargo, queda por determinar si el Zika puede ser suficiente para causar anomalías cerebrales congénitas o SGB. Añadiendo que tampoco se reconoce, a partir de la evidencia disponible, si la presencia del virus del dengue juega algún papel, ya que es portado por las mismas especies de mosquito y ha circulado en muchos países durante el mismo periodo que el VZ6.
Varios expertos han apuntado a que si el virus es capaz de causar alteraciones graves como microcefalia, es probable que cause problemas neurológicos adicionales que se manifestarán en el desarrollo del niño. Según un estudio publicado por el CDC, muchas de las alteraciones identificadas inicialmente, permanecen a los 2 años del nacimiento, lo cual supone una dificultad para alcanzar el desarrollo apropiado para la edad y es indicativo de la importancia del seguimiento y apoyo necesario a largo plazo47.
Recientemente se ha publicado un artículo que apoya la hipótesis de que el riesgo de presentar alteraciones incluyendo la microcefalia se produce durante todo el embarazo48. No obstante se ha descrito que la probabilidad de presentar alteraciones neurológicas u oculares es mayor cuanto más temprana es la infección durante el embarazo, siendo el primer trimestre el de mayor riesgo49.
Además, respecto al SGB, un estudio llevado a cabo en Colombia ha reafirmado el papel del virus en su desarrollo, presentando una mediana de aparición de 7 días desde el inicio de los síntomas de enfermedad por VZ hasta el desarrollo del síndrome50.
Por último, en relación con el papel de la vía de transmisión sexual, otro estudio recientemente publicado ha demostrado que la presencia del ARN del virus en semen puede durar desde el inicio de los síntomas hasta más de 6 meses después, aunque la eliminación del virus infeccioso parece estar presente sólo en las primeras semanas desde el inicio de los síntomas. Se han descrito también algunos factores involucrados en una eliminación más lenta del virus como la edad avanzada, una menor frecuencia de eyaculación y la presencia de ciertos síntomas en la presentación inicial de la infección51.
SITUACIÓN EN EUROPA
Desde que se inició la epidemia, los casos confirmados de infección por VZ se han notificado al Centro Europeo para el Control y Prevención de Enfermedades (ECDC) a través del European Surveillance System (TESSy). Así, desde la semana 26 de 2015 y hasta junio de 2018, se han notificado 2.370 casos de 21 países de la Unión Europea, siendo los que más casos han declarado Francia (50%), España (15%) y el Reino Unido (9%). La práctica totalidad de los casos (97,6%) se asociaron a viajes y menos de un uno por ciento fueron adquiridos localmente por transmisión vertical o sexual. Hasta la fecha no se ha documentado ningún caso de transmisión autóctona por vectores en ningún país europeo. El 80% de los casos habían adquirido la infección en América, la mayoría en países del Caribe y el 43% de los casos notificados vivían en Europa en áreas donde Ae. albopictus está presente. El 60% de los casos notificados en Europa fueron mujeres y el grupo de edad con mayor número fue el de 25 a 34 años 52. Se han notificado 138 casos de infección por VZ en embarazadas (5,9%), siendo los países que más casos detectaron España (37%), Francia (25%) y Países Bajos (18%) 53.
Debido a la disminución en la intensidad de la transmisión del virus en las zonas afectadas tras la epidemia de 2016, el número de casos de enfermedad por VZ asociado a viajes se ha ido reduciendo también desde este año en Europa (2.075 en 2016, 190 en 2017 y 17 en los primeros 6 meses de 2018, aunque estos últimos datos son todavía provisionales)53,54.
SITUACIÓN EN ESPAÑA
En España la vigilancia de la enfermedad y la infección congénita por VZ comenzó en febrero de 2016 y se han recogido notificaciones retrospectivas desde diciembre de 2015. Desde entonces hasta junio de 2018 (datos provisionales para este año), las 17 comunidades autónomas (CCAA) han notificado un total de 517 casos de enfermedad e infección congénita por VZ a través de la Red Nacional de Vigilancia Epidemiológica, de los cuales 358 (69,3%) han sido clasificados como confirmados y 159 como probables (datos proporcionados por el Centro Nacional de Epidemiología). Catorce casos correspondieron a 2015, 407 a 2016, 92 a 2017 y 4 hasta junio de 2018. En cuanto a la adquisición de la infección, 510 fueron importados y 7 adquiridos localmente: 2 por transmisión sexual y 5 vertical (2 de ellos interrupciones voluntarias del embarazo y 3 recién nacidos con infección por VZ). El 64,7% fueron mujeres y la mediana de edad fue de 34 años (p25-75: 27-42 años). En más de la mitad de los casos se trataba de mujeres en edad fértil (15-49 años). De los casos importados en que se conoce el lugar de adquisición (n=492), todos fueron en zonas asociadas a la transmisión del virus, la mayor parte en América Latina como se observa en la tabla 1. Cabe destacar que los casos importados durante el primer periodo (2015-2016) procedían en su gran mayoría de República Dominicana y Colombia mientras que en el año siguiente los países de origen más frecuentes fueron Cuba y Ecuador. Esta variación refleja la evolución de la epidemia en el continente Americano.
Tabla 1 Casos importados notificados en España a la RENAVE en 2016 y 2017

Elaboración propia con datos de la RENAVE procedentes del Centro Nacional de Epidemiología.
Desde 2015, se ha seguido a 86 mujeres embarazadas. De ellas, una ha dado a luz a un neonato con infección congénita por VZ y en otros cuatro casos, en los que hubo una interrupción voluntaria del embarazo, se detectaron fetos con constancia de alteraciones neurológicas, en dos de los cuales se confirmó infección por VZ.
EVALUACIÓN DEL RIESGO PARA ESPAÑA
Desde que se inició la alerta, desde el Centro de Coordinación de Alertas y Emergencias Sanitarias del Ministerio de Sanidad, Consumo y Bienestar Social hemos realizado numerosas evaluaciones de riesgo, que incluyeron recomendaciones referentes tanto a la prevención de la enfermedad, especialmente dirigida a los viajeros a zonas de riesgo, como a la detección y seguimiento de los casos en España55.
Cuando evaluamos el riesgo que este virus puede tener para la población española, en primer lugar hay que considerar el riesgo de introducción del VZ en España y posteriormente el riesgo de que se produzca transmisión en nuestro país una vez introducido. Además, hay que tener en cuenta el impacto que los casos de infección tendrían en nuestro entorno. El principal riesgo de introducción del virus en España estaría asociado con la llegada de viajeros infectados en periodo virémico procedentes de áreas con circulación del virus. Algunos datos que nos pueden poner en contexto este riesgo serían los siguientes: en 2014 la población residente en España realizó 11.782.715 viajes al extranjero de los que 764.018 fueron a América Latina56. Durante 2014 visitaron nuestro país un total de 64.938.945 turistas extranjeros, de los que 1.698.969 eran originarios de América Latina. De estos, 440.781 procedían de Brasil, 323.247 de México y 158.567 de Venezuela, algunos de los países con transmisión autóctona del virus57.
La probabilidad de que se produzca una transmisión en España una vez introducido el virus depende de la presencia del vector competente en el entorno y de que esté en periodo de actividad, de la presencia de población susceptible a la infección, la coincidencia en el espacio y en el tiempo de un caso importado virémico con el vector y la posibilidad de que el virus encuentre las condiciones favorables para su transmisión.
Aedes aegypti se detectó en 2017 de forma puntual en España en una zona muy localizada de la isla de Fuerteventura, pero las investigaciones posteriores no han evidenciado el establecimiento de este vector en la isla. Sin embargo, sí hay una amplia zona de España, que abarca fundamentalmente toda el área mediterránea, con presencia de Ae. albopictus (ver figura 2). Aunque la competencia de éste último en comparación con Ae. aegypti por el momento se ha demostrado baja, no se puede descartar la posibilidad de que el virus se adapte a nuevos vectores58. Según los datos aportados por el ECDC, el 43% de los casos notificados desde 2015 en Europa se han detectado en áreas donde Ae. albopictus está establecido y hasta la fecha no se ha producido ningún caso autóctono de transmisión vectorial, lo que corrobora la baja competencia de este vector para transmitir la enfermedad. A nivel global, tampoco se ha identificado ninguna zona con transmisión vectorial en la que el único vector presente fuera Ae. albopictus41.
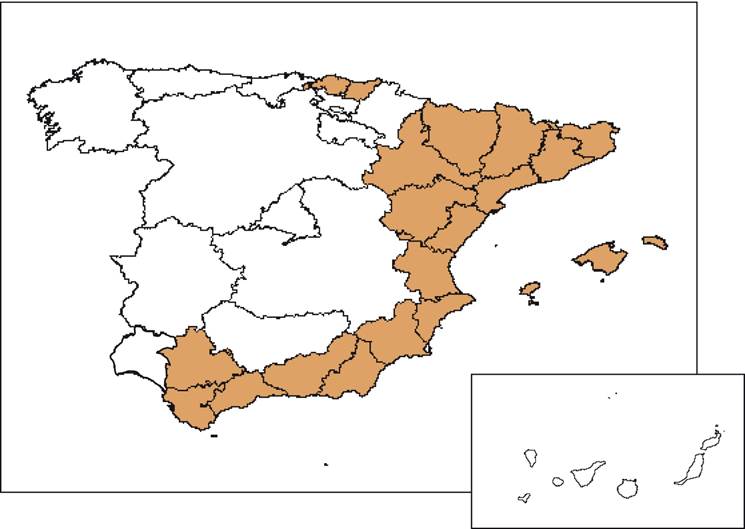
Fuente: elaboración propia a partir del Plan Nacional de Preparación y Respuesta frente a enfermedades transmitidas por vectores y del proyecto “Vigilancia entomológica en aeropuertos y puertos frente a vectores importados de enfermedades infecciosas exóticas, y vigilancia de potenciales vectores autóctonos de dichas enfermedades”. Información disponible hasta diciembre de 2017.
Figura 2 Provincias con presencia de Ae. albopictus en España (2017)
Del total de turistas extranjeros, un alto porcentaje visitó CCAA en las que Ae. albopictus está establecido, como Cataluña (25.9%), Baleares (17,5%), Comunidad Valenciana (9,6%) o Murcia (1,2%)59.
Por otro lado, hay que tener en cuenta que el turismo interno en España también es elevado, con un total de 139.614.605 desplazamientos muchos de ellos realizados durante los meses de verano, entre la costa mediterránea y el resto de comunidades56.
Así, la costa mediterránea, principal zona en la que se ha identificado Ae. albopictus, es un destino de preferencia, tanto para el turismo interno como extranjero, especialmente durante los meses de verano, que son los de máxima actividad vectorial, por lo que la población susceptible en áreas de riesgo aumenta notablemente durante este periodo.
Por todo ello, aunque existe un importante intercambio de mercancías y viajeros con los países de riesgo, y la población española se considera susceptible a la infección, el riesgo de producción de casos autóctonos por transmisión vectorial o brotes de enfermedad por VZ en nuestro país y en general en el continente europeo se considera muy bajo.
Respecto al impacto potencial de la infección por VZ en España, la principal preocupación en términos de impacto grave sobre la salud de la población es la asociación entre la infección por VZ y los casos de microcefalia en fetos y recién nacidos, así como la aparición de otras complicaciones neurológicas. No obstante, nuestro país tiene la capacidad necesaria para realizar una detección precoz de estos casos e implementar las medidas adecuadas para reducir el posible impacto.
EVOLUCIÓN DE LA EPIDEMIA EN AMÉRICA Y FACTORES DETERMINANTES
Como se ha descrito anteriormente, la epidemia de Zika en las Américas comenzó a finales de 2015, alcanzando el pico máximo en los primeros meses de 2016 para posteriormente descender hasta niveles mínimos en 2017. Este comportamiento sigue el modelo predicho en 2016 por Ferguson et al. en el que ilustraron las dinámicas de transmisión de la epidemia y las posibles olas de transmisión posteriores60. En este modelo se predijo una duración de la epidemia de 3 años con oscilaciones estacionales, y un retraso en la reaparición de la enfermedad de alrededor de 10 años. La explicación de este comportamiento viene determinada por la introducción de una enfermedad infecciosa en una población susceptible, que a medida que se va infectando genera una inmunidad de grupo que consigue un número de reproducción inferior a 1, lo que supone el fin de la epidemia. La reaparición se produciría años más tarde cuando las nuevas cohortes de nacimiento y la llegada de poblaciones no expuestas previamente al virus generaran una masa de susceptibles suficiente para que el número de reproducción superase el 1.
Este comportamiento en el que una amplia población de susceptibles es afectada por la enfermedad ha sido corroborado por los estudios realizados en la isla de Yap y la Polinesia Francesa, en los que se ha demostrado una seroprevalencia muy elevada de más del 50% de la población13,44,61. El hecho de que no se hubiera detectado previamente podría explicarse por tratarse de poblaciones pequeñas en las que el número de efectos adversos fue muy bajo como para que se pudiera identificar inicialmente.
Por otro lado, también se ha planteado en numerosos estudios la cuestión de por qué durante la epidemia de Zika en América, especialmente en Brasil, se observó una transmisión mucho mayor que en brotes previos. Para explicar este fenómeno se han planteado varias hipótesis 62. Por un lado, el efecto de los factores climatológicos derivados del fenómeno de El Niño producido durante 2015 y 2016, que habrían extendido el rango geográfico del mosquito, el aumento de los criaderos de mosquitos durante las inundaciones y las interacciones mosquito-humano durante los periodos de sequía62. Por otro lado, se ha señalado al desarrollo y urbanización de ciertas zonas como favorecedores de esta proliferación de Ae.aegypti y Ae.albopictus63. Además, también se ha considerado una posible evolución viral y la presencia de diferencias genéticas en las poblaciones de Ae. aegypti como factores a tener en cuenta. Por último, se ha identificado la posibilidad de que la interacción inmunológica del Zika con otros flavivirus facilitaría la diseminación y la patogénesis, hipótesis cuya plausibilidad se ha demostrado en estudios in vitro64. El virus del dengue ha circulado por el centro y el sur de América desde que reemergió hace 30 años en la región, por lo que la interacción puede haber contribuido al brote reciente de enfermedad grave por VZ62. Además se ha señalado que la posible interacción con el dengue e intensificación de la enfermedad podría suponer un acortamiento en el tiempo hasta el resurgimiento de la epidemia y el aumento de la transmisión endémica a largo plazo60,65.
En cuanto al impacto que tuvo el brote a nivel global, es necesario considerar que una ESPII se define en el Reglamento Sanitario Internacional de 2005 como “un evento extraordinario que, de conformidad con el presente Reglamento, se ha determinado que constituye un riesgo para la salud pública de otros Estados a causa de la propagación internacional de una enfermedad, y podría exigir una respuesta internacional coordinada”. La declaración de una ESPII por tanto, supone una respuesta global de salud pública cuyos principios generales son comunes a todas las ESPII, basándose principalmente en el desarrollo de políticas sanitarias, actividades de comunicación, vigilancia activa y actividades de control para las que se disponen recursos específicos. Además en estas situaciones se promueven las actividades de investigación, especialmente cuando existe escasa evidencia respecto al agente causante de la emergencia. A diferencia de otras ESPII declaradas a raíz de eventos anteriores, esta última fue considerada como tal ante la falta de evidencia respecto al alarmante aumento del número de casos de microcefalia y otras alteraciones neurológicas coincidentes con los brotes de enfermedad por VZ66. Esto supuso una movilización de recursos tanto a nivel nacional como internacional para poder dilucidar esta posible asociación y frenar el aumento de casos de microcefalia y alteraciones neurológicas. Cabe señalar que la celebración de un evento internacional, como los Juegos Olímpicos de Río de Janeiro en 2016, supuso una mayor visibilidad y por tanto sensibilización de la población, por lo que también podría haber actuado como factor determinante en la declaración de la ESPII. A diferencia de otras emergencias, ésta se consideró finalizada como tal no por el fin del brote, sino por la situación de endemia en la región y la evidencia creciente al respecto que hizo que la OMS considerase que debía ser un reto abordado con una estrategia y recursos a largo plazo.
ACTIVACIÓN DE LA VIGILANCIA EPIDEMIOLÓGICA Y ACTUACIONES LLEVADAS A CABO EN ESPAÑA
Una de las primeras actuaciones desde salud pública a raíz del brote en América y de la declaración de la alerta, fue el desarrollo de protocolos específicos para la vigilancia, el control y manejo de los casos de enfermedad e infección congénita por VZ, lo que permitió de forma rápida poner en marcha una vigilancia homogénea de esta enfermedad en todo el país67. Los protocolos se consensuaron en la Ponencia de Vigilancia y en febrero de 2016 comenzó la declaración de casos, algunos de forma retrospectiva, a la Red Nacional de Vigilancia Epidemiológica, gestionada por el Centro Nacional de Epidemiología. Según la información facilitada por el ECDC, España es el segundo país de Europa con mayor número de notificaciones, lo que, sin lugar a dudas, además de deberse a las importantes conexiones que tenemos con América Central y del Sur, demuestra la existencia de una red de vigilancia bien consolidada con una capacidad rápida de reacción ante situaciones epidémicas de relevancia. En el mismo sentido, hay que destacar la rápida respuesta de los laboratorios, tanto del Centro Nacional de Microbiología (ISCIII) como de los laboratorios de las CCAA, lo que permitió hacer frente a la demanda de diagnóstico y vigilancia ante una nueva enfermedad de forma coordinada y efectiva en todo el país.
Durante el periodo de 2016 y 2017 las CCAA con más notificaciones de casos de infección por Zika fueron en primer lugar Cataluña (208 casos), seguida de Madrid (122 casos). El resto de comunidades declararon menos de 25 casos cada una. Ceuta y Melilla fueron las únicas que no registraron ningún caso (figura 3).

Fuente: elaboración propia con datos de la RENAVE procedentes del Centro Nacional de Epidemiología
Figura 3 Casos de enfermedad por virus Zika declarados por Comunidad Autónoma hasta diciembre de 2017
Según los datos del Instituto Nacional de Estadística, de la Encuesta de turismo de residentes, las CCAA cuyos residentes realizaron más viajes durante 2015, 2016 y 2017 fueron en primer lugar la Comunidad de Madrid seguida por Cataluña y Andalucía (media de los viajes acumulados durante el 2015, 2016 y 2017 de 32.308.511 Madrid, 27.003.308 Cataluña y 26.293.573 Andalucía)68. Estos datos, aunque recogen también información sobre viajes interiores, no parecen coherentes con la distribución de casos notificados por las CCAA. Las diferencias observadas en la notificación en relación con el número de viajeros, y el importante número de casos notificados en Cataluña en relación a otras CCAA se debe probablemente a la mayor sensibilización de los profesionales sanitarios de esta comunidad debido a la presencia desde el año de 2004 de Ae. albopictus y a la puesta en marcha desde hace varios años de protocolos para la vigilancia y control de arbovirosis transmitidas por mosquitos, que han favorecido la implicación de los profesionales y la coordinación desde salud pública de las actuaciones dirigidas a la prevención y control de este tipo de infecciones. Posiblemente, estos datos también apuntan a que se ha podido producir una infradetección y notificación de casos en otras Comunidades Autónomas. Hay que tener en cuenta además, que la enfermedad por VZ presenta una sintomatología generalmente leve y poco específica que puede pasar desapercibida o diagnosticarse como otras patologías virales.
En Europa, según los datos de Eurostat, los países de procedencia de mayor número de pasajeros aéreos registrados durante los últimos años fueron en primer lugar el Reino Unido seguido de Francia y España69, lo cual coincide con los países que más casos de enfermedad por Zika notificaron al ECDC.
La alerta producida por el VZ, ha supuesto sin duda un importante impulso para que desde las CCAA se iniciase o intensificasen las actividades de vigilancia entomológica, especialmente las dirigidas a la detección de Ae. albopictus. Esta vigilancia se enmarca en el Plan Nacional de Preparación y Respuesta frente a Enfermedades Transmitidas por Vectores que se puso en marcha en abril de 2016, y que recoge como uno de los elementos clave la vigilancia entomológica de este vector y su gestión para prevenir y controlar su presencia. En el marco de este Plan, la mayoría de las CCAA han puesto en marcha sistemas de vigilancia entomológica en sus territorios e informan anualmente al Ministerio de Sanidad, Consumo y Bienestar Social de los resultados de esta monitorización con lo que es posible disponer de un seguimiento actualizado de la presencia y extensión del vector en España, que puede además ser consultado en la página Web del Ministerio70. Para impulsar esta vigilancia, desde este Ministerio se puso en marcha en 2008, y se continúa desde entonces, el proyecto “Vigilancia entomológica en aeropuertos y puertos frente a vectores importados de enfermedades infecciosas exóticas, y vigilancia de potenciales vectores autóctonos de dichas enfermedades” que tiene entre sus objetivos la vigilancia de potenciales vectores autóctonos de dichas enfermedades con especial atención a la expansión de Ae. albopictus. Los resultados de esta vigilancia entomológica, disponibles en la página Web del Ministerio, indican que la especie Ae. albopictus está ya extendida a siete CCAA y se encuentra en clara expansión por la cuenca mediterránea, gracias a unas características bióticas que le permiten vivir estrechamente ligado a zonas urbanas residenciales.
Otra de las actividades a resaltar ha sido la colaboración desde la Salud Pública con las Sociedades Científicas. Tanto en el contexto del Plan de Preparación como en la respuesta ante la alerta producida por Zika se ha considerado clave la colaboración desde la administración sanitaria con las sociedades científicas para, por un lado elaborar guías y protocolos consensuados que facilitasen el diagnóstico y manejo de los casos, y por otro para garantizar la difusión de estas guías a los profesionales asistenciales, que son quienes finalmente van a garantizar la detección y el diagnóstico oportuno de los casos. Fruto de esta colaboración se han publicado guías de manejo en atención primaria y especializada y un procedimiento de manejo de la infección por VZ durante el embarazo y en recién nacidos71,72,73.
Se ha colaborado también con la Organización Nacional de Trasplantes y los responsables de la donación de semen y sangre en la elaboración de recomendaciones, que han estado sujetas a permanente revisión y valoración del riesgo por el impacto de esta infección debido a sus diferentes vías de transmisión74. Respecto a la trasmisión sexual, en España se notificaron 2 casos durante 2016 transmitidos localmente. Señalar en este sentido que aunque el primer caso de trasmisión sexual registrado tuvo lugar en Estados Unidos en 2008, no ha sido hasta el brote en las Américas cuando se ha prestado atención a este mecanismo de transmisión y se han documentado un elevado número de casos. Además, esta transmisión se ha demostrado en pacientes ya asintomáticos en el momento de contacto sexual75, siendo el mecanismo más frecuente la transmisión de hombre a mujer76, aunque no exclusiva77,78. Varios estudios han sugerido una larga persistencia del virus en el tracto genital, tanto masculino como femenino, lo que ha llevado a recomendar medidas de prevención durante un periodo prolongado tras la infección79.
Por último, y como punto clave en la respuesta a una situación de alerta o emergencia sanitaria, se deben señalar las actividades de comunicación y recomendaciones a la población. Debido a la magnitud del brote que se produjo en América del sur y central y al numeroso intercambio de viajeros entre nuestro país y las zonas afectadas, una constante en el seguimiento de la alerta ha sido la información a los viajeros que se dirigían a áreas afectadas y las recomendaciones para su vuelta, tanto a nivel de los Centros de Vacunación Internacional como manteniendo actualizada en la Web del Ministerio de Sanidad, Servicios Sociales e Igualdad la información sobre las recomendaciones a seguir. En esta Web se ha incluido información sobre la enfermedad dirigida tanto al público como a los profesionales sanitarios responsables de la asistencia a los posibles casos.
La situación vivida con el VZ ha puesto una vez más de manifiesto el impacto que las enfermedades transmitidas por vectores pueden suponer para la salud de una población y el reto que plantean a los sistemas de vigilancia y a la salud pública80, ya que exigen un trabajo conjunto entre diferentes instituciones y un abordaje común para poder hacerles frente. Por eso, y aunque la epidemia por VZ no ha tenido un gran impacto en la salud de la población en nuestro país, sí que ha supuesto una toma de conciencia de la importancia de la coordinación en la lucha frente a estas enfermedades y de la necesidad de trabajar desde el marco de “Una sola Salud” que incluya a todos los actores responsables de la prevención y el control de las enfermedades transmitidas por vectores.














