INTRODUCCIÓN
Streptococcus pneumoniae (S. pneumoniae) puede causar enfermedades invasivas y no invasivas. Bajo la denominación de enfermedad neumocócica invasiva (ENI) se incluyen aquellas infecciones que se localizan en tejidos, órganos y fluidos que normalmente son estériles (sangre, líquido cefalorraquídeo, líquido pleural, etc.) y que se asocian con procesos clínicos generalmente severos (bacteriemia-septicemia, meningitis, empiema, neumonía bacteriémica, etc.). Los polisacáridos de la cápsula son el factor principal de virulencia, identificándose más de 90 serotipos diferentes en función de aquéllos1.
La incidencia de ENI varía ampliamente de unos países a otros. En 2005, la Organización Mundial de la Salud estimó que 1,6 millones de muertes estaban causadas por este agente2. Las tasas de incidencia más elevadas se presentan en las edades extremas de la vida3.
En España, la ENI es una entidad de reciente incorporación al Sistema de Vigilancia Nacional. Según los datos de la Red Nacional de Vigilancia Epidemiológica (RENAVE) aportados por 8 comunidades autónomas (CCAA), se observa una reducción en el número de casos declarados desde 2007 hasta 2013; mientras que a partir de este año y hasta 2015, existe una tendencia ligeramente ascendente, situándose la incidencia de ENI de 2015 en 2,82 casos por 100.000 habitantes. Respecto a los grupos de edad, durante el mismo periodo, proporcionalmente se observa una disminución de los casos entre los de menor edad (< 9 años) a la par que han aumentado entre los de edad > 45 años4.
La prevención de ENI se basa exclusivamente en la utilización de vacunas. Se dispone de dos tipos de vacunas en función de la conjugación o no con proteínas transportadoras, diferenciándose entre vacunas conjugadas y polisacáridas simples4,5,6 (tabla 1). La efectividad de las vacunas conjugadas se ha mostrado mayor que la de las vacunas polisacáridas, tanto en la prevención de ENI como en la prevención de cuadros clínicos no invasivos (otitis, neumonía sin bacteriemia, etc.), además de la protección comunitaria por generar inmunidad a nivel de las mucosas, propiedad no alcanzable con las vacunas polisacáridas6.
Tabla 1 Características de las vacunas frente a S. pneumoniae polisacáridas y conjugadas
| VACUNAS POLISACÁRIDAS | VACUNAS CONJUGADAS |
|---|---|
| Respuesta inmunológica tipo T independiente (no mediadas por células T) | Respuesta inmunológica tipo T dependiente (mediadas por células T) |
| Respuesta de corta duración, anticuerpos de escasa afinidad | Respuesta de larga duración, anticuerpos de alta afinidad |
| No proporciona inmunidad en mucosa | Proporciona inmunidad en mucosa |
| No genera protección comunitaria | Genera protección comunitaria |
| Poco inmunógena en menores de 2 años | Inmunógena a partir de las 6 semanas de vida |
| Fenómeno de hiporrespuesta inmunológica tras vacunación repetida | Ausencia de fenómeno de hiporrespuesta inmunológica tras vacunación repetida |
La vacuna neumocócica polisacárida 23 valente (VNP23) incluye los serotipos 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F y 33F7, y se comercializa en España desde su autorización en 1999.
La primera vacuna neumocócica conjugada comercializada en España fue la heptavalente (VNC7) -autorizada en el año 2000 y no comercializada actualmente que incluía los serotipos más comunes en los años 90 (serotipos 4, 6B, 9V, 14, 18C, 19F y 23F).
Desde 2009, existen dos nuevas vacunas conjugadas comercializadas en nuestro país. La vacuna neumocócica conjugada decavalente (VNC10), que añade a los serotipos cubiertos por la VNC7 los serotipos 1, 5 y 7F, y la vacuna neumocócica conjugada de 13 valencias (VNC13) que, además, contiene los serotipos 3, 6A y 19A8.
En España, la Comunidad de Madrid fue la primera que incluyó la vacuna neumocócica conjugada en el calendario de vacunación infantil (VNC7 en noviembre de 2006 y VNC13 entre junio de 2010 y julio de 2012)9. En el año 2015, el Consejo Interterritorial del Sistema Nacional de Salud (CISNS) aprobó un nuevo calendario de vacunación infantil en el que se incluía la vacuna neumocócica conjugada10. En Andalucía, la vacuna VNC13 se introdujo en el calendario sistemático en diciembre de 201610. Además de la vacunación sistemática, la vacunación frente a neumococo se ha recomendado en grupos de riesgo. El CISNS6 recomienda la vacunación con VNP23 en grupos de riesgo desde 2001 y en personas ≥65 años desde 2004, aunque algunas CCAA comenzaron a vacunar a partir del 2000, a los mayores de 60 o 65 años y a grupos de riesgo. Desde que la VNC13 amplió sus indicaciones en ficha técnica (inicialmente se autorizó en niños pequeños; en 2011, en población de más de 50 años; en 2012, en la población de entre los 6 y los 18 años; y en 2013, entre 19 y 50 años), varias CCAA han realizado recomendaciones sobre la utilización de esta vacuna, que ha ido adaptándose conforme se ampliaba la información sobre las nuevas indicaciones en ficha técnica.
Respecto a la distribución de los serotipos cubiertos por la vacuna en población adulta con ENI y la inclusión de los mismos en las vacunas comercializadas actualmente (cobertura de vacunación), según el estudio ODIN en el que participaron 9 hospitales españoles, los serotipos incluidos en la vacuna VNC13 representan el 63,2% de los episodios de ENI en población inmunocompetente y el 45% en población inmunodeprimida11 durante el periodo 2010-2013. Por otro lado, el porcentaje de serotipos aislados en episodios de ENI incluidos en la vacuna VNP23 oscila entre el 62% y el 73,8%5.
Según el Boletín Epidemiológico de la Comunidad de Madrid9, los serotipos 8 y 3 han sido los más frecuentemente aislados (a pesar de que el serotipo 3 está incluido en la VCN13), con una letalidad del 3,8 y 17,4%, respectivamente; asimismo, los serotipos que más han aumentado han sido el 8 y el 22F, al igual que en Europa9.
La penicilina ha sido el tratamiento de elección de la infección neumocócica durante el último medio siglo pero, en las últimas décadas, se ha observado en todo el mundo una resistencia creciente de S. pneumoniae a este antibiótico, según el informe del European Antimicrobial Resistance Surveillance Network (EARS-Net)12. En España, el 95-98% de las cepas invasivas son sensibles a la penicilina y el 99% son sensibles a la cefotaxima13.
Tanto los indicios de aumento de resistencia antimicrobiana a penicilina como el aumento de serotipos no vacunales justifican la vigilancia microbiológica de las cepas responsables de los episodios de ENI, así como la caracterización epidemiológica de la población afectada. Con todo ello, se aporta información útil para la toma de decisiones en términos de salud pública. Por tanto, el objetivo de este estudio fue caracterizar los episodios de ENI así como describir la sensibilidad antimicrobiana y distribución de los serotipos (vacunales y no vacunales) de cepas de S. pneumoniae aisladas en hemocultivos de pacientes atendidos en el Hospital Costa del Sol entre septiembre de 2012 y enero de 2017.
MATERIAL Y MÉTODOS
Estudio descriptivo retrospectivo a partir de una serie de casos, en el que la unidad de análisis fueron las cepas de S. pneumoniae aisladas en hemocultivos de pacientes atendidos en el área asistencial del Hospital Costa del Sol entre septiembre de 2012 y enero de 2017.
El Hospital Costa del Sol es un hospital de nivel II que cuenta con 372 camas14 y que atiende a una población de referencia de 462.598 habitantes.
Las variables a estudio fueron: edad, sexo, fallecimiento, tabaquismo, infección por VIH, diagnóstico clínico (neumonía bacteriémica, meningitis bacteriémica y bacteriemia sin neumonía/meningitis), serotipo y perfil de sensibilidad antimicrobiana.
La fuente de información utilizada fue el programa de gestión clínica “Doctor”.
La identificación de S. pneumoniae se realizó mediante metodología estándar (ɑ-hemólisis en agar sangre y sensibilidad a optoquina). La confirmación de la identificación y el serotipado se realizó mediante la reacción de Quellung en el Laboratorio de Referencia de Neumococos (Centro Nacional de Microbiología; Instituto de Salud Carlos III, Majadahonda).
La sensibilidad a penicilina, eritromicina y levofloxacino se determinó mediante tiras de gradiente de concentración antibiótica, siguiendo las recomendaciones y criterios del Clinical and Laboratory Standards Institute (CLSI)15.
El análisis estadístico se llevó a cabo mediante el software SPSS (SPSS, version 15,0; SPSS, Chicago Illinois, USA). En el análisis descriptivo, las variables cualitativas se presentaron como frecuencias absolutas y porcentaje, y las variables cuantitativas, como media y desviación típica. El análisis bivariante atendió a la comparación de variables cualitativas (Test de Chi-cuadrado) fijando el nivel de confianza en un 95%. Se calcularon los oportunos valores p.
Aspectos éticos. La realización de este estudio obtuvo el visto bueno del Comité de Ética de Investigación de la Agencia Sanitaria Costa del Sol. Se ha mantenido la confidencialidad y el secreto estadístico, según la Ley Orgánica 15/1999, de 13 de diciembre, de Protección de Datos de Carácter Personal.
RESULTADOS
Durante el periodo de estudio, se aislaron un total de 76 cepas de S. pneumoniae, de las cuales, 5 fueron no tipables.
Los serotipos más prevalentes fueron el 8 (11,8%), 3 (9,2%), 9N (7,9%), 6C (7,9%), 22F (6,6%), 11A (5,3%) y 14 (5,3%). La tabla 2 muestra la distribución de serotipos y su relación con las vacunas neumocócicas. Los porcentajes de cepas cubiertas por VNC10, VNC13 y VNP23 fueron, respectivamente, 19,7%; 33,8% y 66.2%.
Tabla 2 Distribución de la frecuencia de serotipos de S. pneumoniae aislados y su inclusión (o no) en las vacunas comercializadas actualmente en España (cobertura vacunal)
| Serotipo | Cepas (n) | Cepas (%) | Cobertura vacunal |
|---|---|---|---|
| 8 | 9 | 11,8 | VNP23V |
| 3 | 7 | 9,2 | VNP23V ,VNC13V |
| 9N | 6 | 7,9 | VNP23V |
| 6C | 6 | 7,9 | No vacunal |
| 22F | 5 | 6,6 | VNP23V |
| 11A | 4 | 5,3 | VNP23V |
| 14 | 4 | 5,3 | VNP23V, VNC10V, VNC13V |
| 19A | 3 | 3,9 | VNP23V, VNC13V |
| 33F | 3 | 3,9 | VNP23V |
| 7F | 3 | 3,9 | VNC10V, VNC13V |
| 23A | 3 | 3,9 | No vacunal |
| 1 | 2 | 2,6 | VNP23V, VNC10V, VNC13V |
| 24F | 2 | 2,6 | No vacunal |
| 9V | 2 | 2,6 | VNC10V, VNC13V |
| 4 | 1 | 1,3 | VNC10V, VNC13V |
| 10A | 1 | 1,3 | VNP23V |
| 12F | 1 | 1,3 | VNP23V |
| 15B | 1 | 1,3 | VNP23V |
| 16F | 1 | 1,3 | No vacunal |
| 21 | 1 | 1,3 | No vacunal |
| 35B | 1 | 1,3 | No vacunal |
| 6B | 1 | 1,3 | VNC10V, VNC13V |
| 15A | 1 | 1,3 | No vacunal |
| 15B | 1 | 1,3 | VNP23V |
| 23B | 1 | 1,3 | No vacunal |
| 23F | 1 | 1,3 | VNC10V, VNC13V |
| No tipables | 5 | 6,6 | - |
| Total | 76 | 100 | - |
Las cepas analizadas correspondían a 47 varones y 29 mujeres con edades comprendidas entre 0 y 92 años (61±22,6). En la tabla 3 se muestra la distribución de los serotipos según 3 franjas etarias: 6 cepas correspondían a menores de 15 años, 21 a pacientes de entre 16 y 55 años, y 49 a mayores de 56 años.
Tabla 3 Distribución de la frecuencia de serotipos de S. pneumoniae aislados y su inclusión (o no) en las vacunas comercializadas actualmente en España (cobertura vacunal)
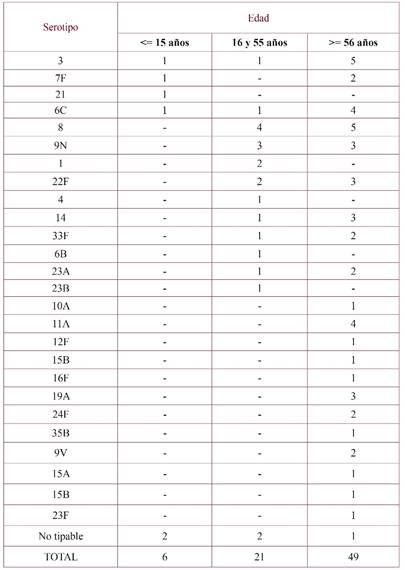
El 77,3% de las cepas fueron causantes de episodios de ENI con diagnóstico clínico de neumonía bacteriémica. La mayoría de estos episodios afectaron a pacientes mayores de 56 años, seguidos del grupo etario de entre 16 y 55 años y, por último, de los menores de 15 años (n=40, n=16, n=3, respectivamente; p<0,05).
El 17,3% de las cepas se relacionaron con el diagnóstico clínico de meningitis con bacteriemia. Este diagnóstico fue asignado a 9 pacientes mayores de 56 años, a 3 pacientes de entre 16 y 55 años y a un menor de 15 años. En la tabla 4 se muestra la distribución de los serotipos en función del diagnóstico.
La prevalencia de ser fumador osciló en función del cuadro clínico, siendo del 50% en neumonía bacteriémica y del 22,2% en meningitis/bacteriemia (p<0,05).
Entre los pacientes incluidos en este estudio, 4 estaban infectados por VIH. Todos ellos sufrieron neumonía bacteriémica. Los serotipos detectados en pacientes con infección VIH fueron el 8, 11A, 9V y 15A.
Doce de los 76 pacientes fallecieron (tasa de letalidad global del 15,8%); ninguno con antecedente de infección por VIH. De aquéllos, 8 sufrieron neumonías con bacteriemia (tasa de letalidad por neumonía del 14%) causadas por los serotipos 3, 8, 11A, 15B, 19A, 22F y 33F -una cepa no fue serotipada-; y 4 meningitis con bacteriemia (tasa de letalidad por meningitis del 33,3%) causadas por el serotipo 6C (en dos casos) y 19A -una cepa no fue serotipada-.
Según el criterio del CLSI 2016 (tabla 5), 2 cepas (2,6%) fueron no sensibles a penicilina (tabla 6). Estas cepas pertenecían a los serotipos 11A y 14. Se obtuvieron 23 cepas no sensibles a eritromicina (30,3%). La distribución de los serotipos entre las cepas no sensibles a eritromicina fue 33F, 6C y 23A con un 13,4%; 11A y 14 con un 8,7%; 7F, 8, 10A, 19A, 6B y 23F con un 4,3%. Tres cepas no sensibles a eritromicina fueron no tipables. Se detectaron 3 cepas (3,9%) no sensibles a levofloxacino, correspondientes a los serotipos 8, 9N y 14.
Tabla 5 Sensibilidad a antimicrobianos de S. pneumoniae: Puntos de corte según Clinical and Laboratory Standards Institute (CLSI), 2016
| CLSI 2016 | S | I | R |
|---|---|---|---|
| Penicilina parenteral (no meningitis) | <=2 | 4 | >=8 |
| Penicilina parenteral (meningitis) | <=0.06 | - | >=0.12 |
| Eritromicina | <=0.25 | 0.5 | >=1 |
| Levofloxacino | <=2 | 4 | >=8 |
S= sensible; I= intermedio; R= resistente
DISCUSIÓN
En nuestro estudio, los serotipos cubiertos por VNC13 representaron más de un tercio (33,8%) de las cepas aisladas en los pacientes diagnosticados de ENI. En un estudio realizado en población adulta del área de referencia del Hospital La Princesa de Madrid en 2012, cuando el uso de VNC13 aún era precoz16, la proporción de cepas con serotipos incluidos en VNC13 de pacientes con ENI fue mayor que en nuestro estudio(49%). No obstante, en 2015 esta cifra se redujo al 15,2% en la Comunidad de Madrid, incluyendo a pacientes de todas las edades (también niños vacunados)9. Este drástico descenso probablemente se debió, entre otras causas, a la inclusión, entre 2010 y 2012, de la vacuna VNC13 en el calendario infantil de vacunación sistemática en esta CCAA. Una hipótesis que explicaría el mayor porcentaje hallado en nuestro estudio, sería que la introducción de esta vacuna en el calendario infantil de vacunación sistemática de Andalucía no se produjo hasta finales de 2016. Aunque esta hipótesis no puede ser contrastada (no se dispone de datos sobre cobertura vacunal antineumocócica conjugada en población infantil hasta su introducción en el calendario), de ser cierta, cabría esperar un descenso de los serotipos incluidos en VNC13 en los próximos años. Por otro lado, el porcentaje de serotipos incluidos en la vacuna VNP23 de nuestro estudio (66,2%) se halla entre los valores publicados por otros autores5.
Los casos de ENI se presentan con mayor frecuencia entre los menores de 2 años y en los mayores de 65 años12. En nuestro estudio, la mayoría de las casos (64,5%) pertenecían a la franja etaria de mayor edad (>56 años), siendo menor la proporción de casos en menores de 15 años (8%). Es reseñable, además, que en los casos menores de 2 años cuyas cepas fueron tipadas, los serotipos responsables fueron el 6C y el 21, ambos no vacunales.
Los cinco serotipos más frecuentes en nuestro estudio fueron, en orden descendente, el 8, 3, 6C, 9N, y 22F. De ellos, el serotipo 6C no está incluido en ninguna de las vacunas comercializadas, el resto están incluidos en la VNP23 y sólo el 3 está cubierto por la VNC13. Los serotipos 8 y 3 también han sido descritos entre los más frecuentes en otros estudios en España9. El serotipo 3 se ha mantenido constante durante las últimas décadas en nuestro país17. Este serotipo, descrito como de alta capacidad invasiva18, es muy común en pacientes de edad avanzada, en los que se asocia con elevada letalidad8,19. El incremento de los serotipos no vacunales en la ENI (fenómeno de reemplazo), podría llegar a ser preocupante. En nuestro estudio, una quinta parte de las cepas aisladas se correspondían con serotipos no vacunales, y entre los más frecuentes, ya se ha mencionado al serotipo 6C, que se aisló en dos pacientes que sufrieron meningitis con bacteriemia y fallecieron. Otras publicaciones han descrito un ascenso del serotipo 22F entre las cepas aisladas20,21, relacionado con fenómenos de reemplazo tras la introducción de las vacunas conjugadas. Los resultados de nuestro estudio concuerdan con el ascenso de este serotipo, englobándose entre los cinco serotipos más frecuente de las cepas tipadas.
A pesar de los logros alcanzados en su prevención, la infección por S. pneumoniae sigue representando una importante causa de morbilidad y mortalidad. En España, la incidencia de ENI entre CCAA muestra disparidades, siendo de 8 casos por 100.000 en Cataluña en 201422, de 10,4 en Galicia en 201223, de 9,8 en Navarra en 201424, de 7,7 en la Comunidad Valenciana en 201225, de 4,5 en Castilla y León en 201426 y de 2,7 en Andalucía en 201227. En nuestro estudio, la incidencia anual osciló entre 2,2 y 4,7 por 100.000 habitantes en los años 2014 y 2016, respectivamente.
A nivel europeo, en el año 2014 las presentaciones clínicas más frecuentes fueron la bacteriemia (57%), seguida de la neumonía (23%) y la meningitis (14%). En nuestro hospital, la presentación clínica más frecuente fue neumonía bacteriémica.
Están descritos algunos factores de riesgo para la adquisición de ENI como son: abuso de alcohol, exposición al humo de tabaco, insuficiencia cardiaca, infección previa por virus de la gripe, diabetes mellitus, asma, asplenia y estados de inmunodepresión (incluida la infección por VIH)28. En nuestro estudio, la mitad de los pacientes con neumonía bacteriémica eran fumadores, asociándose el ser fumador con el desarrollo de este cuadro clínico.
La tasa de letalidad en Europa en 2012 osciló según países entre 4% y 29%12. En nuestro caso, la letalidad fue del 15,8%, aproximándose a la media europea en 2014 (15%)29. En otros estudios encontraron una elevada letalidad en los pacientes con sepsis (28,1%)12, hecho que no se ha confirmado en nuestro trabajo. La letalidad fue mayor en el grupo de más de 56 años (11,8%), no registrándose exitus en menores de 15 años. Este hallazgo es concordante con la literatura, donde se describe una mayor letalidad asociada a grupos de mayor edad8. Aunque estos datos se basan en un número limitado de casos, hay que destacar que una tercera parte de los pacientes con meningitis falleció.
En lo relativo a los datos de sensibilidad antibiótica de S. pneumoniae disponibles en la literatura, las diferencias están motivadas por el uso de diferentes guías para medir los puntos de corte para las respectivas CMIs (CLSI o EUCAST). En el ámbito europeo, la frecuencia de la sensibilidad reducida a la penicilina fue del 11% y a la eritromicina del 14% en el año 2014(12). En nuestro hospital, considerando los criterios CLSI, la sensibilidad reducida a penicilina fue menor (2,7%) y a eritromicina fue mayor (30,3%). Los serotipos más frecuentes entre las cepas no sensibles a eritromicina fueron 33F, 6C, 23A. En cuanto a levofloxacino, se obtuvo un porcentaje de resistencia del 1,3%, similar al resto de España30. Los serotipos pertenecientes a las cepas resistentes a levofloxacino fueron 8, 9N y 14. En la Comunidad de Madrid se ha informado un elevado porcentaje de resistencia a levofloxacino, asociado con la aparición de un clon perteneciente al serotipo 8 que afectaba con frecuencia a pacientes con infección por VIH31.
Pese a las limitaciones derivadas del reducido número de cepas estudiadas, los resultados de este estudio muestran que los serotipos más frecuentes entre los pacientes con ENI atendidos en nuestro estudio no están cubiertos por las vacunas conjugadas, aunque sí por la VNP23 (en su mayor parte).
Estos datos pueden proporcionar una información muy relevante a nivel local. En relación con otras series de nuestro país9, hay un elevado porcentaje de cepas pertenecientes al serotipo 6C, no cubierto por ninguna vacuna. Este serotipo también ha resultado frecuente en Galicia23. En los próximos años, tras la introducción de vacunas conjugadas en el calendario de vacunación infantil y, teniendo presente su capacidad para generar inmunidad de grupo, es posible que se produzcan fenómenos de reemplazo de serotipos y variaciones en la resistencia antibiótica. Estos cambios podrían ser preocupantes, por lo que es necesario mantener la vigilancia de esta enfermedad para valorar su tendencia y las características epidemiológicas y microbiológicas de las cepas aisladas.
















