INTRODUCCIÓN
El envejecimiento de la población constituye en la actualidad una realidad demográfica que implica una mayor incidencia de patologías crónicas, como la demencia y su predecesor clínico, el deterioro cognitivo leve (DCL)1, 2.
Durante el proceso de envejecimiento natural se ven afectadas, progresivamente, la atención, la función ejecutiva y la memoria. Esta pérdida de funciones conlleva una mayor dependencia en el desempeño de actividades básicas de la vida diaria (ABVD), situación que se agrava en aquellas personas con DCL que sufren, además, una evolución más rápida, y que las convierte en dependientes a edades más tempranas3. Como consecuencia de la dependencia, se ve aumentado el estrés emocional y se incrementa la presencia de síntomas ansiosos y depresivos, que empobrecen la calidad de vida de estos sujetos 4,5. El incremento de población con DCL, asociado a la carga económica y los recursos de asistencia sanitaria que derivan de su cuidado, han convertido este problema en un importante desafío de salud6.
Entre las diversas demencias de origen degenerativo, la enfermedad de Alzheimer (EA) es la más frecuente y supone alrededor del 75% de todas ellas7. Su prevalencia en la población española mayor de 65 años oscila entre el 5,5% y el 6,8%8, y representa la tercera causa de años de vida ajustados por discapacidad (AVAD)9. Las tasas de conversión anuales de MCI a demencia varían entre 5% y 20%, dependiendo del muestra estudiada y la duración del seguimiento10. Los tratamientos farmacológicos utilizados hasta la actualidad han mostrado un balance beneficio-riesgo desfavorable en la reducción de la progresión de DCL a EA11,12,13. No obstante, varios fármacos con mecanismos de acción diferentes se encuentran en fase experimental14,15.
El envejecimiento es un proceso multifactorial donde están implicados diversos mecanismos fisiopatológicos que trabajan de manera interrelacionada como la limpieza celular16, los telóremos, la funcionalidad de las mitocondrias17, el daño del ADN y su reparación18, los procesos inflamatorios y la respuesta ante el estrés19, la senescencia y la epigenética20.
El ejercicio físico y la dieta modulan sustratos comunes de neuroplasticidad (señalización neurotrófica, neurogénesis, inflamación, respuesta al estrés y defensa antioxidante) en el cerebro, mientras que el compromiso cognitivo mejora la reserva cognitiva y cerebral21. Recientes meta-análisis han mostrado que el ejercicio físico puede ayudar a preservar, o incluso mejorar, la función cognitiva en adultos sanos22,23. Se ha observado también mediante pruebas de imagen que el ejercicio físico produce un incremento de volumen en la masa prefrontal y la parte anterior del hipocampo24,25, y además mejora la neurogénesis y angiogénesis26. A su vez, se conoce que el ejercicio físico reduce los factores de riesgo de enfermedad cardiovascular (ECV)15,27. Con respecto a la dieta, se ha observado que algunos patrones dietéticos28,29 podrían tener un efecto neuroprotector30.
Por otra parte, estudios llevados a cabo en población mayor de 65 años con DCL han mostrado que hasta el 35% de dicha población podría recuperar una cognición normal a través de una intervención temprana y adecuada sobre factores modificables como la dieta, el ejercicio físico, o a través de intervenciones multidominio6,31,32,33. Es por ello que se plantean diferentes formas de abordar la prevención del envejecimiento.
Este conocimiento, junto con la "laguna terapéutica" existente en la actualidad, refleja la necesidad de abordar el manejo del paciente con DCL desde otra perspectiva diferente a la predominante en la actualidad.
La Organización Mundial de la Salud (OMS), en su Global action plan on the public health response to dementia recomienda, entre otras medidas, seguir una dieta saludable y equilibrada e incrementar la práctica de actividad física, con el objeto de reducir el riesgo de demencia. Respecto a la alimentación, no se ha concretado si el papel protector de una dieta equilibrada es atribuible a un alimento o grupo de alimentos, a un patrón dietético, o si es precisa la suplementación con un determinado micronutriente. En cuanto a la actividad física, sigue existiendo controversia acerca del tipo, duración o intensidad que es necesario llevar a cabo para evitar la aparición y/o reducir el riesgo de demencia.
En el presente trabajo se sintetizó y analizó la evidencia científica disponible acerca del efecto que las intervenciones sobre el ejercicio físico y la dieta en sujetos mayores de 45 años con DCL tienen sobre su evolución a EA, a través de test diagnósticos para evaluar la función cognitiva como medida de resultado.
MATERIAL Y MÉTODOS
Se realizó una revisión sistemática de ensayos clínicos aleatorizados (ECA), revisiones sistemáticas y meta-análisis que evaluaran la efectividad de una intervención sobre el ejercicio físico y/o dieta en la progresión de DCL a EA en sujetos diagnosticados de esta enfermedad.
Las fuentes bibliográficas consultadas fueron Medline (Pubmed) y The Cochrane Library. Para establecer la estrategia de búsqueda y los criterios de inclusión se utilizó como documento de apoyo la guía Cochrane Hand book for Systematic Reviews of Interventions34. En la tabla 1 se recogen las estrategias de búsqueda utilizadas en Medline y The Cochrane Library.
Para la posterior selección de los artículos obtenidos en el proceso de búsqueda se tuvieron en cuenta los criterios que se exponen a continuación.
Criterios de inclusión. Los límites que se establecieron para la recuperación de los artículos fueron relativos al idioma, en inglés o español, y a la fecha de publicación, habiéndose seleccionado los artículos con fecha comprendida entre enero de 2008 y mayo de 2019. Los diseños de los artículos seleccionados fueron ECA, revisiones sistemáticas y meta-análisis. Se incluyeron únicamente aquéllos cuyo principal objetivo fuera evaluar la efectividad de una intervención sobre el ejercicio físico y/o la dieta en sujetos mayores de 45 años, con DCL y sin diagnóstico de EA que informaran, al menos, de una medida de la función cognitiva global como medida de resultado primaria utilizada para calcular el tamaño del efecto y, de manera secundaria, del rendimiento en los dominios de la memoria y la función o atención ejecutiva a través de otros test cognitivos.
Criterios de exclusión. Se excluyeron los artículos que no cumplían con los criterios de inclusión descritos (estudios de cohorte prospectivos o retrospectivos, informes de casos, resúmenes de congresos o los no escritos en inglés). Se excluyeron aquellos cuya población de estudio presentara deterioro cognitivo secundario a una lesión cerebral traumática o una lesión ocupante de espacio u otras enfermedades referentes a la salud mental, como trastorno depresivo, trastorno ansioso-depresivo, o enfermedades degenerativas como la enfermedad de Parkinson. Se excluyeron también aquellos estudios cuya metodología no fuera explícita, no describieran la población sujeto de estudio, así como los que no expresaran con claridad el programa y la población.
La selección de los artículos de interés se realizó de manera independiente por dos investigadoras, extrayendo la siguiente información: población de estudio, tamaño de la muestra y edad de los sujetos al inicio del estudio, tipo de intervención, medida de la efectividad, principales resultados, y nivel de la calidad del estudio.
La calidad de la evidencia científica de los artículos seleccionados se clasificó siguiendo los criterios utilizados por la Agency for Health care Research and Quality (AHRQ)35. Este sistema de clasificación y evaluación sistematizada consta de cuatro grados de calidad de la evidencia y cuatro grados de fuerza de recomendación, basados principalmente en el tipo de estudio evaluado, diseño, metodología y aleatorización del mismo. Posteriormente, se utilizaron las pautas PRISMA36 para analizar la presente revisión (anexo I).
RESULTADOS
La figura 1 muestra el procedimiento de selección de los 42 artículos incluidos en la presente revisión, que fueron 31 ECA, tres revisiones sistemáticas y ocho meta-análisis. Sus principales características se recogen y comparan en las tablas 2 y 3. En el material suplementario (anexo II) se presentan los artículos excluidos y el motivo de exclusión.
Tabla 2 (continuación). Estrategias de búsqueda aplicadas en las fuentes de información seleccionadas

Tabla 2 (continuación). Estrategias de búsqueda aplicadas en las fuentes de información seleccionadas

Tabla 2 (continuación). Estrategias de búsqueda aplicadas en las fuentes de información seleccionadas

Tabla 2 (continuación). Estrategias de búsqueda aplicadas en las fuentes de información seleccionadas

Tabla 2 (continuación). Estrategias de búsqueda aplicadas en las fuentes de información seleccionadas

Tabla 2 (continuación). Estrategias de búsqueda aplicadas en las fuentes de información seleccionadas

Tabla 2 (continuación). Estrategias de búsqueda aplicadas en las fuentes de información seleccionadas

Tabla 2 (continuación). Estrategias de búsqueda aplicadas en las fuentes de información seleccionadas

Tabla 2 (continuación). Estrategias de búsqueda aplicadas en las fuentes de información seleccionadas

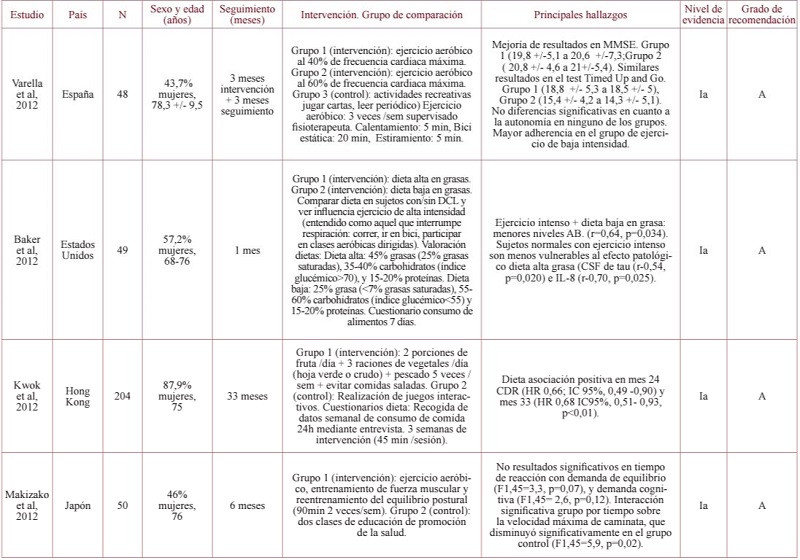
Intervenciones sobre el ejercicio físico. Los 18 ECA que valoraron el efecto de una intervención sobre el ejercicio físico en la evolución del DCL a EA mostraron heterogeneidad en cuanto a su diseño y metodología. El periodo de intervención varió entre un mes y 10 años37,38, y la duración de la intervención se encontró entre 30 y 90 minutos, con una rutina de dos a cinco veces por semana. Las poblaciones que recibían las intervenciones presentaron una media de edad entre 60 y 92 años, y en gran parte de los casos se trataba de sujetos institucionalizados.
En cuanto al tipo de ejercicio realizado, en ocho ECA39-46, dos meta-análisis47,48 y dos revisiones sistemáticas a partir de ECA49,50 se trataba de una intervención con ejercicio aeróbico, mientras que en otros siete ECA38,51-56, un meta-análisis57 y una revisión sistemática basada en ECA58, la intervención consistía en un ejercicio de resistencia. Uno de los meta-análisis incluido en la revisión, basado en estudios de cohorte, no especificaba el tipo de ejercicio realizado59. En tres ECA se comparaban ambos tipos de ejercicio60,61,62.
Los ECA en los que se realizó una intervención con ejercicio aeróbico que presentaron resultados positivos fueron seis39,41,43-46, mientras que en dos no se encontró asociación positiva40,42. El trabajo de Anderson-Hanley et al de 201846 reportó una mejoría en la función ejecutiva y en la memoria verbal tras tres meses de intervención consistente en un ejercicio aeróbico con requerimiento cardiovascular que a su vez, requería concentración (p=0,01). Los trabajos de Wang et al de 201843 y de Bae et al de 201944, encontraron mejoría en la función de la memoria así como en la velocidad de procesamiento y en el trabajo visoespacial (p=0,001 y p=0,024, respectivamente.
Dos trabajos no hallaron una asociación significativa entre la realización de ejercicio físico de intensidad moderada-alta y la progresión de DCL. En el trabajo de Lamb et al de 201842 no se observó ningún beneficio clínicamente significativo ni en la función cognitiva (p=0,237), ni en la calidad de vida relacionada con la salud de los sujetos o con la carga del cuidador (p=0,644), evaluada esta última mediante la escala de carga de Zarit63. Por otro lado, en el grupo del trabajo de Makizako et al de 201240 tampoco se obtuvieron resultados significativos (p=0,12).
Los ECA cuya intervención consistía en la realización de ejercicio anaeróbico o de resistencia y cuyos resultados mostraron asociación positiva fueron siete38,46,51,52,53,55,56. En dos de ellos el grupo estudiado estaba formado únicamente por mujeres52,55 y la intervención se basaba en ejercicio de resistencia de alta intensidad, aunque los grupos control variaban. Por otro lado, no se encontró asociación positiva en dos de ellos52,60. En el trabajo realizado por Kuster et al de 201656, no hubo mejoras en la cognición global tras el entrenamiento físico ni cognitivo (p=0,08). Sí que se apreció que aquellos sujetos que pertenecían al grupo de intervención cognitiva que reconocían previamente tener un estilo de vida más activo, presentaron mejoría en el rendimiento de la memoria, pero no para la atención ni funciones ejecutivas (p<0,001). El trabajo de Lam et al de 201454, en el que se propuso como intervención realizar Tai Chi como ejercicio de resistencia que precisa de concentración, los resultados no fueron significativos (p=0,44). Dos de los trabajos analizados38,51 encontraron mejoría en la función cognitiva global y en la funcionalidad, así como en la memoria ejecutiva (Van de Rest et al, 2014, p=0,04 y Choi et al, 2018, p<0,001).
Los resultados de dos meta-análisis47,48 y una revisión sistemática50, cuya intervención consistía en ejercicio aeróbico, mostraron una disminución del riesgo de evolución de DCL a demencia a través de una mejora en la función global (Wang et al de 2014 (p=0,003), Blondell et al de 2014 (p=0,00)). Sin embargo, la revisión sistemática del trabajo de Lipardo et al de 201749, no encontró una mejora de la función ejecutiva ni la memoria (p=0,13). Aquellos trabajos en los que se estudió la influencia del ejercicio de resistencia encontraron resultados distintos. En la revisión sistemática llevada a cabo por Li et al de 201858 mejoró la función cognitiva y la función ejecutiva (p<0,05), pero no la atención ni la memoria (p>0,05). Por otro lado, el meta-análisis de Zhang et al de 201957 presentó únicamente mejoría en la función visoespacial (p<0,001) y no en el resto de funciones (funciones cognitivas globales (p=0,06), memoria (p=0,11), función ejecutiva (p=0,74), fluidez verbal (p=0,45) y depresión (p=0,89)). El meta-análisis a partir de estudios de cohorte llevado a cabo por Guure et al de 201759 afirmó que el ejercicio físico realizado dos veces a la semana tiene un papel protector frente al desarrollo de deterioro cognitivo (OR 0,67; IC95%, 0,55, -0,78) y EA (OR 0,62, IC95%, 0,49-0,75, p<0,05).
En los ECA cuya intervención comparaba ejercicio aeróbico versus anaeróbico se observaron resultados distintos. El trabajo de Nagamatsu et al de 201260 encontró que el ejercicio de resistencia mejoraba la memoria asociativa (p=0,03), sin embargo el ejercicio aeróbico influía en la mejora de la función física (p=0,03). Por otro lado, el trabajo llevado a cabo por Barnes et al de 201361 partía de sujetos sedentarios donde se estudió cómo influía el ejercicio aeróbico versus anaeróbico, realizado durante 60 minutos con una frecuencia de tres días a la semana. Sus resultados mostraron mostró mejoría de la función cognitiva global (p<0,001) pero no hubo diferencias entre los dos grupos. En el trabajo de Iuliano et al. de 201562 se llevó a cabo un ECA bajo la hipótesis inicial de que la realización de los distintos tipos de ejercicio influía de manera distinta en la cognición. El ejercicio aeróbico cardiovascular mejoró la atención y la función ejecutiva (p<0,05), mientras que el ejercicio de resistencia provocó mejoras en el aprendizaje (p<0,05).
Intervenciones sobre la dieta. En cuanto a la dieta, los artículos que se incluyeron en la revisión fueron cuatro ECA64,65,66,67 y cuatro meta-análisis68,69,70,71. En todos ellos se realizaron diferentes intervenciones dietéticas, ya fuera con alimentos concretos o con suplementos alimenticios. Todos los ECA incluidos mostraron una asociación estadísticamente significativa entre la intervención realizada y la disminución del riesgo de DCL64,65,66,67.
El consumo de fruta y pescado fue objeto de estudio en el ECA llevado a cabo por Kwok et al de 201264. Se observó que los sujetos cuya intervención consistía en consumir 5 piezas diarias de fruta y pescado de manera regular, presentaron una tendencia de menos deterioro cognitivo y además mantuvieron el hábito de consumo durante los dos años de la intervención (p<0,01). Igualmente, el consumo de pescado y de los distintos ácidos grasos omega-3, en concreto de ácido docosahexaenoico (DHA), fue motivo de intervención en varios ECA65,66 así como dos meta-análisis69,71. El trabajo de Rondanelli et al de 201265 comparó el consumo de una cápsula enriquecida con DHA, melatonina y triptófano con placebo durante tres meses, obteniendo mejora de la cognición global (p<0,01). El trabajo de Bo et al de 201766 mostró mejoría en la velocidad de percepción y memoria de trabajo (p<0,01) en el grupo en el que se suplementó con ácidos grasos omega-3 (480 mg/día de DHA y 720 mg/día de ácido eicosapentaenoico (EPA) comparado con el grupo control al que se administró cápsulas placebo con aceite de oliva. Con respecto a los meta-análisis, el trabajo de Yu et al de 201669, con una media de intervención entre 2,1 y 21 años, mostró que el consumo de una porción a la semana de pescado se asociaba a un menor riesgo de demencia y de EA (p= 0,042, p=0,003 respectivamente), así como la suplementación con 0,1 gr/día de DHA (demencia, p=0,001 y EA, p=0,001). Sin embargo, los resultados no fueron significativos cuando se evaluó la intervención con otros ácidos grasos omega-3, como el ácido alfa-linolénico (ALA) o EPA. En el meta-análisis perteneciente a Zeng et al de 201771 no hubo asociación entre el consumo de pescado y la disminución de riesgo de EA (p=0,06) ni DCL (p=0,788), ni con el consumo de EPA (p=0.,431) ni DHA (p=0,043) cuyos trabajos presentaban entre uno y 14 años de seguimiento.
Los dos meta-análisis restantes incluidos estudiaron el efecto de la DM. El trabajo de Singh et al de 201468, cuyo seguimiento comprendía entre 2,2 y 8 años, encontró que los sujetos con una alta adherencia a la DM presentaban un 33% menos de riesgo de evolución de DCL a demencia que el grupo control (p<0,0001). Por otra parte, el trabajo de Wu et al de 201770 mostró que una mayor adherencia a este tipo de dieta se asociaba con un menor riesgo de desarrollar trastornos cognitivos, concretamente DCL (p=0,001) y EA (p<0,000). Este último meta-análisis incluía trabajos con un periodo de intervención comprendido entre 2,2 y 12 años de seguimiento.
Intervenciones multidominio. En nueve de los ECA revisados33,37,72-78 se estudió el efecto de una intervención multidominio sobre el progreso de DCL. En todos ellos, la intervención consistía en una actuación combinada sobre el ejercicio físico y sobre la dieta, en este último caso modificando los hábitos alimentarios o bien proporcionando suplementos dietéticos. Además, algunas de estas intervenciones incluían ejercicios de estimulación cognitiva33,72-77. En cualquier caso, todos excepto uno33 presentaron un efecto protector sobre la progresión de DCL a demencia. El trabajo de Andrieu et al de 201733, en el que durante tres años se realizó una intervención multidominio consistente en ejercicio físico, entrenamiento cognitivo, educación nutricional y suplementos con ácidos grasos omega-3 (800 mg DHA y 225 mg EPA diarios) comparado con placebo, no mostró asociación entre la intervención y la progresión a DCL en ninguno de los grupos. Por otra parte, dos ECA estudiaron cómo influía la combinación de ejercicio físico que implicase alta concentración o atención y ejercicios de estimulación cognitiva. En el trabajo de Fiatarone Singh et al de 201472, se aplicó una intervención con una duración de 18 meses. Esta consistió en la combinación de ejercicio de resistencia durante 75 minutos, con una frecuencia de dos días por semana, con ejercicios de estimulación cognitiva mediante juegos de ordenador. Se comparó con el grupo control en el que realizaron unos ejercicios de estimulación cognitiva, consistentes en ver 5 videos y realizar un cuestionario, además de realizar ejercicios que no aumentaran la frecuencia cardiaca, o mejoraran la capacidad aeróbica o el equilibrio; ejercicios estiramiento en posición de sedestación y de calestenia. El estudio mostró que en el grupo de intervención multidominio mejoraba la función cognitiva global (p=0,04). El trabajo de Straubmeier et al de 201775, cuya intervención combinada de ejercicio aeróbico junto con ejercicios de estimulación cognitiva, llevados a cabo durante 40 minutos y con una frecuencia de 5 días por semana, durante seis meses, mostró mejoría en la función global (p=0,012). En este caso, el grupo control estaba formado por sujetos con DCL institucionalizados en una residencia en los que no se realizó ninguna intervención. Otros trabajos revisados optaron por combinar ejercicio físico y dieta. El trabajo de Baker et al de 201237, en el que se estudió la influencia de una dieta alta o baja en grasas y la práctica de ejercicio intenso aeróbico durante un mes de duración, mostró que en los sujetos con DCL que llevaban una dieta baja en grasas y realizaban ejercicio intenso disminuían los niveles sanguíneos de beta amiloide, un péptido presente en las placas seniles que se encuentran a nivel cerebral en sujetos con EA (p=0,034). El trabajo de Köbe et al de 201674, con una duración de seis meses, comparó el grupo de intervención (suplementación de 2,2 gr/día de ácidos grasos omega-3, junto a ejercicio aeróbico 45 minutos, dos veces por semana, y ejercicios de estimulación cognitiva) con el grupo control (ejercicio anaeróbico asociado a los suplementos). Mostró un aumento de la materia gris en la corteza frontal, parietal y cingulada (áreas asociadas con la EA), medidas mediante RMN (p=0,010) en aquellos sujetos que realizaron ejercicio aeróbico más ejercicios de estimulación cognitiva más suplementación con omega -3. Además, los análisis mostraron una disminución de los niveles de homocisteína (p=0,010). El trabajo de Blumenthal et al de 201978 aplicó, durante seis meses, una intervención diferente a cuatro grupos: el primer grupo realizaba ejercicio aeróbico intenso 3 veces por semana; en el segundo se introducía la dieta DASH (Dietary Approaches to Stop Hypertension), específica para prevenir la hipertensión arterial; en el tercer grupo se aplicaba una intervención multidominio sobre el ejercicio físico y la dieta; por último, el grupo control recibía únicamente consejo dietético. Los resultados más notables se obtuvieron en el grupo multidominio, en el que se observó una mejoría en la función ejecutiva (p=0,012).
Por otra parte, en el trabajo de Ng et al de 201776, con una intervención de cuatro meses de duración, se comparó un grupo en el que se realizaba una suplementación con hierro, folato, vitamina B6 y B12, calcio y vitamina D con un grupo en el que, además, se realizaba ejercicio físico de intensidad moderada, durante 90 minutos y dos días a la semana. En el grupo que únicamente recibió la intervención dietética se encontró una mejora estadísticamente significativa en la memoria inmediata (p=0,028) y en la memoria retardada (p=0,024). El grupo que recibió la intervención multidominio mostró mejores resultados, tanto para cognición global (p=0,016) como para el lenguaje (p=0,023) y la construcción visoespacial (p=0,010). El trabajo de Ngandu et al de 201573, mostró un efecto que continuó siendo positivo a los dos años de la intervención (p=0,030) en el grupo de intervención y que obtuvo una mejoría de un 25% en los resultados. El grupo multidominio consistió en la asociación de ejercicio de resistencia (1-3 veces a la semana), ejercicio aeróbico (2-5 veces a la semana), entrenamiento cognitivo (6 sesiones clases aplicadas en ABVD y 4 sesiones ordenador) y una dieta baja en grasas comparado con el grupo control en el que se les daba unos documentos con consejos generales de salud. Finalmente, en el trabajo de Desouto et al de 201877, cuya intervención multidominio se llevó a cabo durante tres años, los grupos de intervención realizaron una actividad física moderada o vigorosa (MET>3), que podía consistir tanto en actividades aeróbicas como en tareas domésticas como en actividades de jardinería, junto con suplementos de ácidos grasos omega-3. Fueron comparados con un grupo control, al que se le daba placebo. Los resultados mostraron que el grupo multidominio presentaba una mejoría cognitiva global (p=0,048).
DISCUSIÓN
Las personas con DCL presentan un periodo de tiempo durante el que mantienen la independencia en sus ABVD. En esta etapa, se ofrece la posibilidad de intervenir sobre factores modificables como el ejercicio físico y la dieta mejorando su pronóstico47,48,49,58,59. La mayor parte de los estudios incluidos en esta revisión sistemática indican que el ejercicio físico mejora la función cognitiva global en sujetos con DCL. Existe evidencia a favor de un ejercicio programado, de una intensidad moderada o alta, y llevado a cabo en varias sesiones a lo largo de la semana, permitiendo la continuidad. Sin embargo, la comparación del efecto del ejercicio aeróbico frente al de resistencia sobre el DCL arroja resultados poco clarificadores. La OMS recomienda que los adultos de 65 años en adelante dediquen 150 minutos semanales a realizar actividades físicas moderadas aeróbicas, o algún tipo de actividad física vigorosa aeróbica durante 75 minutos, o una combinación equivalente de actividades moderadas y vigorosas79. Los resultados hallados en la presente revisión están, por tanto, en consonancia con las recomendaciones actuales de la OMS, pero plantean la necesidad de conocer, mediante futuros estudios de intervención, cuáles son las diferencias, si es que las hay, en el efecto que los diferentes tipos de ejercicio físico tienen sobre la progresión de DCL a demencia.
Existe una sólida base científica que apoya el beneficio del ejercicio físico para el cerebro6,31,80. En primer lugar, el ejercicio físico tiene un efecto antidepresivo por medio de la liberación a nivel cerebral de sustancias como endorfinas y neurotransmisores, como la serotonina, la dopamina y la noradrenalina. En segundo lugar, los beneficios neurocognitivos están relacionados con la presencia de una sustancia conocida como el factor neurotrófico derivado del cerebro. Este modulador aumenta la sustancia blanca del hipocampo, la plasticidad sináptica y modula la actividad inflamatoria. En este sentido, el ECA realizado por Nagamatsu et al de 201260, cuya intervención estuvo basada en ejercicio de resistencia, mostró un aumento de materia gris en estas mismas áreas. A nivel molecular, el ejercicio físico regular reduce la inflamación y la actividad oxidativa del cerebro mediante la inducción de enzimas antioxidantes. Además, modula la actividad de las enzimas encargadas de degradar el beta amiloide, como la neprilisima y la enzima degradadora de la insulina81. Varios de los trabajos incluidos en esta revisión en los que se aplicaba una intervención sobre el ejercicio físico, mostraron cambios en los niveles de sustancias que indicaban una actividad antiinflamatoria o antioxidante cerebral, con el consiguiente efecto positivo para la función cognitiva37,46,74.
El ejercicio físico se ha relacionado, además, con una disminución de la incidencia de obesidad e hipertensión arterial, así como de los niveles de colesterol y glucosa en sangre, considerados como factores de riesgo de ECV, pero también de la EA15,27,31,82. En este sentido, Blumenthal et al. hallaron en su ECA de 201978 un menor riesgo de ECV en el grupo de intervención con ejercicio aeróbico. La práctica de actividad física en grupo promueve la creación lazos de amistad personal que contribuyen a la interacción y apoyo social, y a la realización de actividades de ocio, con los consecuentes beneficios a nivel psicológico. En una línea similar, el trabajo de Kuster et al de 201683 encontró que un estilo de vida activo junto con ejercicios de estimulación cognitiva mejoraban la función cognitiva global. Varios de los estudios analizados en el presente trabajo concluyen que realizar periódicamente un ejercicio físico que requiera concentración, en combinación con tareas funcionales comprendidas en las ABVD, ejerce un efecto positivo para la cognición y, por tanto, modula la evolución del DCL a demencia49,73,84.
Actualmente se está estudiando la relación entre la microbiota, microoganismos del intestino humano, y la neuroinflamación. Se ha descrito que la alteración de estos organismos, conocida como disbiosis, puede producir un estado de inflamación crónica de manera que se liberan una serie de endotoxinas que promueven la permeabilidad de la pared intestinal y aumentan circulación periférica de citocinas proinflamatorias. Éstas atraviesan la barrera hematoencefálica causando daño en la microglia y disminuyendo la eliminación de proteínas anómalas amiloides implicadas en la patogénesis del DCL85,86. Se ha observado que un 60% de la variación en el microbioma intestinal es atribuible a la dieta87, además se ha observado que la DM aumenta el porcentaje de ciertas especies presentes en la microbiota intestinal beneficiosas para la protección neuronal88,89.
En cuanto a la dieta se refiere, los trabajos encontrados muestran, que la adherencia a una dieta con alto contenido de frutas y verduras, pescado, nueces y aceite de oliva, es decir, rica en ácidos grasos omega-3 (ALA, DHA y EPA), antioxidantes y polifenoles, disminuye el riesgo de evolución de DCL a demencia. Este patrón dietético se concreta en la DM, que reduce la presencia de factores de riesgo de ECV como de enfermedades neurodegenerativas6,28,31,70,72,73. La dieta DASH, en ocasiones indicada como tratamiento no farmacológico para la hipertensión arterial90 y basada en una elevada ingesta de frutas, verduras, nueces y productos integrales, también se ha hallado como objeto de intervención. Difiere de la DM en el aumento del consumo de productos lácteos bajos en grasa, la disminución del sodio en la dieta y en que no recomienda el consumo de alcohol. Ha mostrado una mejoría en la función cognitiva y más lento deterioro cognitivo en adultos sanos91,92. Cuando los sujetos presentan DCL, sólo ha mostrado beneficio cuando la intervención es combinada junto con ejercicio físico aeróbico78. La evidencia sugiere que la DM y la dieta DASH pueden proporcionar neuroprotección contra la degeneración, siendo la evidencia hallada más consistente a favor de la DM, al disponer de un mayor número de estudios.
Es necesario, no obstante, ampliar la investigación en este sentido, pues los periodos de intervención son cortos y además, en pocos trabajos se evalúa la adherencia a la dieta o suplementación posterior a la intervención. En general la mayoría de alimentos per se incluyen los micronutrientes necesarios y, en cualquier caso, no es necesario suplementar con ningún agente93,94. Crear conciencia debería ser una necesidad imperante y, a su vez, instruir a la población en la modificación en hábitos alimentarios. Asegurar la ingesta de alimentos ricos en nutrientes como frutas, verduras, hortalizas, legumbres y derivados, frutos secos, semillas, cereales integrales y grasas de calidad como el aceite de oliva virgen extra o el aguacate que formen parte de su alimentación habitual y puedan obtenerse de manera sencilla, aportaría un beneficio a nivel cognitivo y de salud metabólica en general.
Por otra parte, en esta revisión se incluyeron diferentes intervenciones combinadas sobre el ejercicio físico y la dieta. Este tipo de intervenciones, que cada vez concentran mayor interés, presentaron los resultados más favorecedores, en comparación con los estudios en los que la intervención se basaba en un único objetivo, al reducir significativamente la progresión de DCL a demencia y aumentar la funcionalidad de los sujetos33,72,73,75,76,78.
Se ha observado un posible efecto beneficioso cuando se realiza intervención combinada de ejercicio físico y estimulación cognitiva en comparación con una única intervención47,49,72,74,75. Estos datos van en concordancia con los encontrados en dos meta-análisis. Uno de ellos llevado a cabo en adultos sanos se encontró un beneficio en la función cognitiva global así como en áreas más específicas como la capacidad visuoespacial, la memoria, la función cognitiva y la atención con respecto al grupo control95. Otro meta-análisis realizado en sujetos con DCL y/o demencia también se encontró un beneficio en la función cognitiva global pero no en áreas más específicas84.
Además, se observó que la supervisión de la intervención y el seguimiento por parte de una persona ajena al entorno del sujeto aporta beneficios en la función cognitiva, la motivación y la adherencia, tanto en relación a la realización de los ejercicios pautados como a una pauta dietética concreta. También se ha observado que individualizar la modificación de los factores de riesgo en cada sujeto, marcando objetivos concretos, y realizar intervenciones en las que se realice un contacto cara a cara, como las llevadas a cabo en las residencias de tercera edad, mejoran la adherencia a estos hábitos y estimulan las interacciones sociales96.
Estudios previos sugieren que aquellos sujetos con más riesgo de enfermedad son los más beneficiados de la intervenciones multidominio97, lo que sería interesante, de confirmarse en futuras investigaciones, en el diseño de intervenciones de este tipo.
En cualquier caso, las intervenciones basadas en aspectos cognitivos-conductuales como el realizar ejercicio conjuntamente con otros sujetos, interactuar y relacionarse, o que el ejercicio exija concentración, aportan un beneficio adicional a nivel de salud mental. Por último, es destacable que algunos de los estudios revisados plantean como objetivo final de la intervención el compromiso de adquirir y mantener hábitos saludables33,96,98. De ello se extrae que la duración de las intervenciones parece jugar un papel más importante que la intensidad de las mismas.
La demencia se ha reconocido como un problema de salud pública global. En este sentido, existe un compromiso a nivel mundial para desarrollar un plan de acción coordinado99 que identifique brechas y oportunidades de prevención y control de la enfermedad. Los fármacos utilizados para la demencia han mostrado una efectividad marginal, presentando únicamente beneficios durante los dos primeros años de tratamiento, y en su contra efectos adversos derivados de su efecto anticolinérgico, que incluyen la pérdida de peso, la debilidad y el síncope, especialmente perjudiciales en la frágil población anciana11. A su vez, parece que el futuro va en vías de combinar intervenciones farmacológicas y no farmacológicas, y de evaluar si su efecto conjunto tiene un mayor valor terapéutico que los tratamientos individuales aplicados de forma aislada75,78. Se debería valorar, en futuros estudios, el beneficio en el funcionamiento diario del paciente, así como en su calidad de vida, y los síntomas neuropsiquiátricos medidos a través de escalas validadas. Además, valorar la fragilidad de los pacientes debería convertirse en el primer paso del diseño de una intervención, para identificar a los sujetos con un mayor riesgo.
La principal fortaleza de esta revisión radica en que está centrada en un tema que, a pesar de ser ampliamente conocido y estudiado, ofrece la posibilidad de analizar las similitudes y diferencias entre los distintos estudios comparando las medidas de resultado utilizadas en cada uno de ellos, los efectos observados al aplicar diferentes tipos de intervenciones, la población y el tiempo llevado a cabo.
Además, en todos los casos analizados se observa una relación coherente entre las intervenciones realizadas y las hipótesis planteadas, basadas en la bibliografía existente. No obstante, la presente revisión también presenta algunas limitaciones. En primer lugar, la bibliografía utilizada muestra ausencia de homogeneidad en la evaluación de las medidas antropométricas, así como en la recogida de información de ejercicio físico, los distintos test de diagnóstico de DCL y los patrones de consumo de la dieta. A pesar de que todos los trabajos utilizaron informes individuales para obtener la información, la categorización de estas variables no fue homogénea, lo que podría comprometer la comparabilidad de los resultados. Además, las variables resultado fueron objetivadas mediante el aumento o disminución de puntos a través de estos test diagnósticos, por lo que a pesar de que el diagnóstico de DCL fuese homogéneo, según las guías clínicas actuales, la variabilidad de los resultados en cuanto a mejoría o no ha sido propia de cada trabajo, por lo que la interpretación de resultados y, por tanto, la elaboración de recomendaciones, debería hacerse con cautela. Por otra parte, la mayoría de los estudios utilizaron el cuestionario Mini mental state examination (MMSE) como medida de la función cognitiva global. Este test no es útil como una medida de resultado, ya que la sensibilidad al cambio con el tiempo es baja para evaluar el efecto de las intervenciones por lo que es preciso encontrar una medida de resultado más apropiada para utilizar en futuros estudios100.
A modo de conclusiones, señalar que el DCL es una enfermedad sin tratamiento farmacológico efectivo en el momento actual. Es una patología de larga evolución hasta la aparición de síntomas, que limitan las ABVD, por lo que llevar a cabo una prevención basada en intervenciones tempranas debería ser un objetivo prioritario de la salud pública. Urge la necesidad de abordar el problema del envejecimiento, y a su vez tratar a las personas, desde un punto de vista holístico, en el cual no sólo el manejo terapéutico sea un objetivo, sino que también las intervenciones sobre actividades diarias, como el ejercicio físico, la dieta, la estimulación y la interacción con iguales, sean de similar importancia, dando lugar a una menor fragilidad y un envejecimiento saludable de la población. A pesar de la variabilidad de medidas realizadas, las intervenciones basadas en el ejercicio físico y la dieta han mostrado efecto positivo sobre la evolución de deterioro cognitivo leve a demencia. Concretamente, realizar un ejercicio programado, de una intensidad moderada o alta, y llevado a cabo en varias sesiones (3-5 días) a lo largo de la semana, mejora la función cognitiva global. Todo ello se ve potenciado cuando se asocia con intervenciones basadas en aspectos cognitivos-conductuales como el realizar ejercicio conjuntamente con otros sujetos, interactuar y relacionarse, o que el ejercicio exija concentración, aportando un beneficio adicional a nivel de salud mental. En cuanto a la dieta, un patrón dietético que comprenda un alto contenido de frutas y verduras, pescado, nueces y aceite de oliva, es decir, rica en ácidos grasos omega-3 (ALA, DHA y EPA), antioxidantes y polifenoles como es la dieta Mediterránea o la dieta DASH, brinda neuroprotección contra la degeneración cerebral. En este sentido, las intervenciones multidominio permiten aumentar la adherencia de los sujetos a la modificación de hábitos, así como prolongar en el tiempo su aplicación y, consecuentemente, su efecto protector sobre la función cognitiva. Es por ello que existe la necesidad de llevar a cabo futuros ECA con un diseño de varios brazos, una evaluación de seguimiento a largo plazo para investigar la superioridad de unas intervenciones sobre otras, además de realizar unas evaluaciones neuropsicológicas extensas para obtener más información sobre los beneficios de los efectos para los diferentes dominios cognitivos, así como incluir medidas de neuroimagen y marcadores moleculares como medidas de resultado.