Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Cuadernos de Medicina Forense
versión On-line ISSN 1988-611Xversión impresa ISSN 1135-7606
Cuad. med. forense vol.21 no.3-4 Málaga jul./dic. 2015
Estudio histopatológico de la evolución temporal de las lesiones
Histopathological study of progression in the injuries
E. Cabrerizo Medina1, H. Villanueva de la Torre2, M. Salguero Villadiego3
1Servicio de Patología Forense. IML. Granada
2Servicio de Patología Forense. IML. Málaga
3Servicio de Histopatología. INT y CCFF. Sevilla
Dirección para correspondencia
RESUMEN
En este trabajo se describen los pasos sucesivos que se observan en el proceso de inflamación y reparación de las lesiones con el objeto de poder identificar, en el estudio histopatológico, el estadio en que se encuentran. Los pasos que se siguen en este proceso son los mismos en todos los órganos, a excepción del sistema nervioso. Intentamos que la descripción de las características microscópicas tenga un sentido práctico y pueda ser aplicada y utilizada en el diagnóstico de la data de las lesiones. Las fotos microscópicas que se han elegido se corresponden con el proceso reparativo de los infartos agudos de miocardio con la finalidad de que mantengan una secuencia lógica; sin embargo, mantienen las mismas características histopatológicas que las que pueden apreciarse en la piel o en cualquier otro órgano.
Palabras clave: Data de la lesiones. Histopatología forense.
ABSTRACT
We describe the successive steps observed in the inflammatory and reparative process of injuries. The aim of this article is to describe the histopathological characteristics of succesive stages in a lesion appreciated in autopsy. The evolutive process of the inflammatory and reparative events are practically identical in all organs with the exception of nervous system due to its absence of connective tissue. We try a clear histopathological description and easy to apply in the microscopical observation of a injury with the purpose of to facilitate the correct diagnosis. The microscopical figures has been chosen of the reparative process in acute myocardial infarcts and maintain the same histopathological characteristics than in the skin or other organs.
Key words: Data of injuries. Forensic histopathology.
Introducción
En el campo de la patología forense, una de las cuestiones principales y más complejas de resolver es determinar si una lesión ha sido producida en vida o si por el contrario se produjo una vez sobrevenida la muerte. En el caso de que se haya confirmado su origen vital, poder establecer el momento en que se ha producido el daño, cuál ha sido el tiempo de supervivencia y, si se ha encontrado más de una lesión, determinar si tienen la misma data o no, son claves en la investigación médico legal. En la práctica común, el estudio microscópico es esencial e imprescindible1.
Si atendemos a las conclusiones de la innumerable bibliografía al respecto, lo primero que nos llama la atención es la cautela con que se participa de los resultados tras cada estudio realizado, y es que son tantos los factores y las variables que intervienen en estos procesos que no pueden realizarse aseveraciones basadas únicamente en un solo criterio, sino que hemos de tratar de reunir los máximos posibles y correlacionarlos entre ellos, sobre todo teniendo en cuenta que muchas de las investigaciones en las que se han basado han sido realizadas en animales1-3.
La evolución de la curación de un tejido dañado es la base para la determinación de la data de las lesiones. En patología forense son la piel y el corazón los órganos en los que con más frecuencia debemos establecer la posible data y el momento en que se encuentra el proceso inflamatorio y reparativo. El estudio microscópico de la vitalidad de las lesiones y su progresión no es más que el estudio del inicio y de la progresión del proceso inflamatorio y reparativo. Hace muchísimos años que se intenta establecer el inicio de las reacciones vitales antes de que aparezca el infiltrado inflamatorio, momento este en que ya no son necesarias otras técnicas para hacer el diagnóstico. Para ello se han utilizado técnicas bioquímicas, histoquímicas, histoenzimáticas, inmunohistoquímicas y de hibridación in situ con el fin de poder detectar el inicio de la respuesta inflamatoria en la zona lesionada. Los resultados a día de hoy no son concluyentes y no es posible determinar con certeza el origen vital y la evolución de una lesión basándonos en estas técnicas.
Es muy importante tener en cuenta dos conceptos esenciales a la hora de abordar este tema:
- Todos los tejidos del organismo, exceptuando el sistema nervioso, se inflaman y reparan de la misma forma siguiendo las mismas pautas. La evolución es similar para todos los tejidos, aunque por las características específicas de cada uno de ellos la duración de cada fase será distinta en virtud de estas características. Hay que recordar que la trama de tejido conjuntivo de los órganos es esencial en el proceso inflamatorio y reparativo, y que el sistema nervioso central carece de este armazón conectivo.
- Si un tejido no se inflama, no se repara, y son dos procesos que caminan juntos en el tiempo, aunque desde el punto de vista de su estudio se aborden de forma separada.
Aspectos histopatológicos generales en el estudio de la data de las lesiones en los tejidos
Como se ha señalado anteriormente, no podemos hablar de cronología de la lesión sin establecer previamente los cambios histológicos propios de la inflamación4. La inflamación es la reacción defensiva de un tejido vascularizado ante un ataque patógeno5. Se caracteriza por la aparición de mediadores inflamatorios y el desplazamiento de líquido y células desde la sangre hasta el tejido extravascular3. Esta respuesta localiza y elimina células alteradas, partículas extrañas, microorganismos y antígenos, y a su vez pone en marcha los procesos de reparación. La inflamación aguda es la respuesta inicial e inmediata a una lesión, destinada a suministrar leucocitos y proteínas plasmáticas al foco inflamatorio, y se caracteriza por dos fenómenos, uno vascular y otro celular6,7.
Cambios vasculares
En un primer momento se produce una vasoconstricción transitoria y posteriormente una vasodilatación de las arteriolas, lo que aumenta el riego sanguíneo en el lecho lesionado8. A continuación tiene lugar un aumento de la permeabilidad de la microvasculatura que produce una alteración de las presiones y la salida de agua y iones a los tejidos extravasculares (edema). Esto favorece el aumento de la concentración de elementos formes en la sangre, que se hace mas viscosa y enlentece su flujo. Todos estos cambios se manifiestan al microscopio como la visualización de un gran número de pequeños vasos dilatados repletos de eritrocitos en su interior, lo que se conoce como estasis. La estasis a su vez favorece el contacto de un gran número de leucocitos, principalmente neutrófilos, con la pared del endotelio vascular, un proceso conocido como marginación.
El aumento de la permeabilidad vascular es la principal y más especifica característica del inicio de la inflamación, y gracias a ella se produce la salida de líquido de edema y células inflamatorias. Este es el primer signo histológico de relevancia.
Este aumento de la permeabilidad se produce por:
- Formación de aberturas entre las células endoteliales de las vénulas inducidas por la histamina, la bradicinina, los leucotrienos y otros mediadores químicos (respuesta transitoria inmediata de 15-30' de duración).
- Retracción de células endoteliales por mediación de citocinas como el factor de necrosis tumoral (TNF) y la interleucina 1 (IL-1) (comienza a las 4-6 horas del estímulo y se mantiene hasta 24 horas o más).
- Creación de canales en las células endoteliales formados por vesículas y vacuolas conectadas entre sí.
- Lesión endotelial directa en vénulas, capilares y arteriolas (respuesta mantenida inmediata, que se inicia inmediatamente tras la lesión y persiste durante varias horas o días).
Fenómenos celulares
El aumento de la permeabilidad propicia que los leucocitos se acumulen en la periferia del vaso (marginación), rueden sobre la superficie endotelial (rodamiento) y, posteriormente, mediante el concurso de moléculas endoteliales de adhesión, se adhieran a dicha superficie antes de deslizarse entre las células y atravesar la membrana basal hacia el espacio extravascular (diapédesis). La diapédesis tiene lugar principalmente en las vénulas poscapilares de la circulación sistémica. Tras su salida del territorio vascular, los leucocitos migran a la zona lesionada siguiendo un gradiente químico producido por los mediadores inflamatorios que se generan en dicha zona lesionada. Este proceso se denomina quimiotaxis. Cualquier tipo de leucocito puede abandonar el torrente sanguíneo, aunque, como se ha señalado, los neutrófilos son los más precoces. Los leucocitos activados se encargan de la destrucción de los microorganismos y las células necróticas a través de la fagocitosis, la acción de las enzimas lisosómicas y la generación de combustión oxidativa. Tras un periodo que oscila entre 24 y 72 horas, los polimorfonucleares neutrófilos mueren por apoptosis y aparecen los macrófagos y los linfocitos, que tienen una vida media mayor y son capaces de permanecer más tiempo en el foco de la inflamación6.
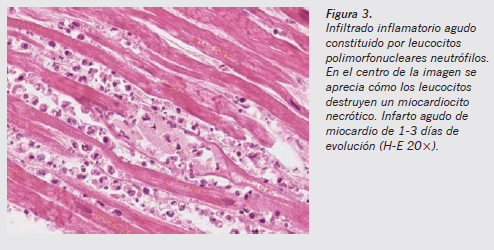
Queda claro que donde primero hay que buscar la presencia de los leucocitos es en torno a las vénulas poscapilares (Figuras 1 y 2). Es un criterio unánime que la infiltración tisular por polimorfonucleares es el signo histológico de relevancia más precoz. De forma sencilla, mediante tinción de hematoxilina-eosina (H-E) podemos observar al microscopio la marginación de los granulocitos en la íntima del vaso, así como su presencia fuera del territorio vascular en los márgenes de la herida2. Sin embargo, este consenso desaparece cuando se trata de delimitar los tiempos en que aparece el infiltrado inflamatorio. Como criterio diagnóstico, Janssen estableció que al menos deben visualizarse tres o cuatro polimorfonucleares fuera del vaso por campo microscópico de gran aumento en dos cortes distintos del tejido estudiado para considerar que se ha iniciado el proceso inflamatorio. Para otros autores, sin embargo, es suficiente la sola presencia de estas células en el espacio extravascular (criterio con el que estamos de acuerdo). La presencia de los leucocitos rápidamente se hace evidente y se sitúan en el tejido conjuntivo intersticial (Figura 3).
Si atendemos a los numerosos esquemas orientativos que se han elaborado para describir de forma cronológica los cambios histológicos en los procesos de reparación de los tejidos, principalmente referidos a las heridas incisas, dependiendo de qué estudio se analice la precocidad de la reacción leucocitaria oscilara entre los 10 minutos y las 24 horas (Tabla 1).
Es necesario reseñar que los tiempos de aparición de los leucocitos están extraordinariamente retardados en las quemaduras. La lesión endotelial que se produce por el calor y el frío en los vasos próximos a la zona quemada no permite que la adhesión y la diapédesis se produzcan en los tiempos en los que aparecen estas células en lesiones de etiología distinta.
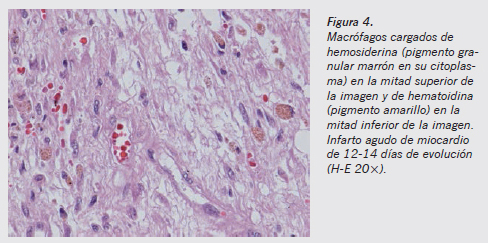
El tiempo de aparición de los macrófagos en la zona lesionada es más constante y está más definido que su desaparición. Sabemos que comienzan a estar presentes aproximadamente a los 3 días de evolución de la lesión11. Sin embargo, es muy difícil establecer cuánto tiempo permanecen en el foco inflamatorio, y de la misma manera que es fácil establecer cuándo llegan, es muy difícil establecer cuánto tiempo permanecen y cuánto ha pasado si hemos dejado de verlos. El tiempo de permanencia va a depender mucho, en las personas sanas sin patología previa, del tipo de lesión que se produzca y de la extensión de la misma. Los macrófagos pueden estar cargados de restos celulares, lípidos (lipófagos), hemosiderina o hematoidina (Figuras 4 y 5).
Angiogénesis: formación del tejido de granulación
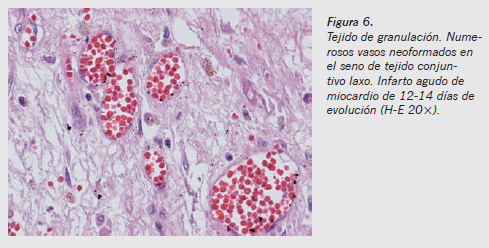
Una vez retirado el tejido necrótico, desde los bordes de la zona lesionada se produce la proliferación de fibroblastos y de yemas vasculares, constituyendo el denominado tejido de granulación. Es perfectamente distinguible en el estudio microscópico (Figura 6) y va a sentar el lecho sobre el cual se producirá la cicatriz reparativa. Estas yemas se observan a partir del sexto día y de manera más evidente entre el octavo y el décimo. Los mediadores y estimuladores de este proceso son los factores de crecimiento y las proteínas de la matriz extracelular.
El factor de crecimiento endotelial vascular (VEGF) es el factor de crecimiento más importante en la angiogénesis y la formación del tejido de granulación, aunque intervienen también otros factores como bFGF, PDGF y TGF-β, importantes en la maduración y la remodelación de los nuevos vasos6,7. A medida que pasan los días va aumentando la densidad de tejido conjuntivo laxo y disminuyendo el número de luces vasculares (Figura 7).
Fibrosis: formación de la cicatriz
Los nuevos vasos, el aumento de su permeabilidad capilar y la fibrina permitirán la llegada de proteínas plasmáticas, como el fibrinógeno, que favorece la migración y la proliferación de fibroblastos, que es la célula básica del tejido conjuntivo y forma parte del tejido de granulación que se forma para la curación de la herida. También las células madre mesenquimales de la adventicia de vénulas y venas, los pericitos y las células endoteliales aportan células nuevas para este proceso de curación de las heridas12.
Los fibroblastos, en principio, tienen actividad fagocítica, pero sobre todo sintetizadora de los componentes de la matriz extracelular. Inicialmente, entre el cuarto y el sexto día presentan un citoplasma muy abundante y una mayor basofilia, porque aumentan la síntesis de proteínas y ello implica un aumento del retículo endoplásmico rugoso. Secretan y depositan los componentes de la matriz extracelular (colágeno, proteoglicanos, elastina, reticulina, tenascina...). En un primer momento abundan las fibras de reticulina12 y fibronectina, que va a ser básica para la adhesión de los fibroblastos a esta matriz, pero la síntesis pasa a ser fundamentalmente de fibras de colágeno. El colágeno dará la resistencia al tejido conjuntivo neoformado13. La síntesis es máxima entre los días 5 y 15, y se mantiene durante semanas; las fibras de colágeno se visualizan en este momento como fibras onduladas y fusiformes13. La mayor resistencia de este tejido de cicatrización se debe no sólo a la producción del colágeno, sino también a las modificaciones de su estructura que se van creando tras finalizar su producción. En la síntesis de colágeno intervienen también factores de crecimiento como el PDGF, el FGF y el TGF-β, así como las citocinas IL-1 e IL-4.
Finalmente el tejido se remodela (proceso que puede durar semanas, meses e incluso años). Los fibroblastos ya maduros toman una morfología fusiforme, aumentan las uniones entre las fibras de colágeno, la colagenasa elimina el exceso de este, los capilares comienzan a desaparecer y disminuye la celularidad.
La maduración de este tejido nuevo requiere además la degradación de la matriz extracelular a través de metaloproteinasas, que son enzimas producidas por células inflamatorias, fibroblastos y células epiteliales. Una vez realizada su función, son inhibidas por inhibidores tisulares específicos (TIMP)7.
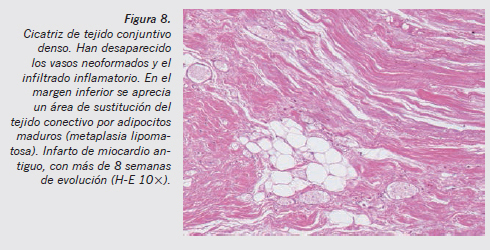
Desde el punto de vista histopatológico, se aprecia cómo van desapareciendo de forma progresiva los vasos neoformados y las células inflamatorias, quedando una extensa zona de tejido conjuntivo denso (Figuras 7 y 8). En el momento en que se termina de completar la cicatrización, es totalmente imposible saber la data de la lesión, que puede ser de meses o años.
Tinciones
Histoquímica
La tinción clave para la visualización de los hallazgos histológicos dependientes de la inflamación es la H-E. Para una mejor diferenciación de los constituyentes del tejido conjuntivo pueden utilizarse otras tinciones, como la de Van Gieson para las fibras elásticas o el tricrómico de Masson para revelar el colágeno14.
Inmunohistoquímica
Estos métodos siguen sin estar contrastados en patología forense, entre otras razones por la variabilidad de las circunstancias de la muerte, de la etiología de las lesiones y del tiempo que pasa desde que se produce la muerte hasta que se recogen las muestras y se fijan en formol para su posterior estudio histopatológico.
Son muy numerosos los anticuerpos empleados y ensayados, y poco determinantes a la hora de apoyarse en ellos para realizar un diagnóstico.
En los estudios dirigidos a determinar la data de las lesiones, los anticuerpos que se utilizan están relacionados con los mediadores del proceso inflamatorio y reparativo, así como con los componentes de la matriz extracelular, las proteínas de adhesión, los mediadores de la inflamación, la duración de la dinámica celular y los factores de crecimiento que estimulan los procesos histológicos antes descritos2,6,7.
En la Tabla 2 se recogen y resumen algunas de las tinciones inmunohistoquímicas empleadas.
Inflamación crónica
Todo lo que hemos descrito anteriormente se observa en el estudio histopatológico de casos en los que no se producen complicaciones en el proceso inflamatorio/reparativo. Si estas complicaciones aparecen y el proceso reparativo se ralentiza, aparece la inflamación crónica. En esta situación, coinciden por un lado un infiltrado inflamatorio linfoplasmocitario y, por otro, la génesis de tejido conjuntivo (fibrosis). Es muy importante tener en cuenta que, en el momento en que tenemos un cuadro inflamatorio crónico, no podremos en ningún caso determinar la data de la lesión.
Procesos que alteran la curación y la reparación de las lesiones
Como decíamos, en la inflamación crónica los tiempos que más o menos se estiman en el proceso de inflamación y reparación se han descrito para personas sanas. Son muy numerosas las circunstancias que modifican el proceso de reparación de las lesiones.
La edad, la desnutrición, la diabetes, el tratamiento con corticoides u otros inmunosupresores, por ejemplo en casos de pacientes receptores de trasplantes o con enfermedades autoinmunes, los tratamientos quimioterápicos para el cáncer, el sida y las neoplasias en estadio metastático, influyen en un marcado enlentecimiento de la inflamación y la reparación de las lesiones. En nuestra experiencia, este enlentecimiento también se hace patente en personas con tratamientos anticoagulantes debido a que el aumento de la hemorragia en una lesión causa un retardo en el proceso reparativo.
Actitud a seguir en el estudio histopatológico
Es de gran importancia tener siempre presente que no se puede ser tajante en los intervalos de tiempo a la hora de datar una lesión determinada. Está claro que los pasos se siguen siempre de la misma forma, pero los tiempos de duración pueden cambiar. No obstante, casi siempre será posible determinar en un cadáver qué lesión se produjo antes y en que estadio reparativo se encuentra.
La tinción H-E es la más útil para el diagnóstico, aunque otras técnicas nos ayuden. Sin embargo, no hay que olvidar que, para establecer cualquier tipo de conclusión, el tejido debe estar bien conservado. La autólisis es el mayor de los enemigos en histopatología forense, y si un tejido no permite una observación clara de sus estructuras y sus componentes celulares, hay que evitar cualquier diagnóstico.
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Janssen W. Vital reactions. En: Forensic histopathology. Berlín: Springer; 1984. p. 54-97. [ Links ]
2. Dettmeyer RB. Vitality, injury age, determination of skin wound age and fracture age. En: Histopathology. Fundamentals and perspectives. Berlín: Springer-Verlag; 2011. p. 191-209. [ Links ]
3. Villanueva E, Hernández Cueto C. Técnicas histoquímicas enzimáticas. En: Gisbert Calabuig JA. Medicina Legal y Toxicología. 6a ed. Barcelona: Masson; 2004. p. 351-9. [ Links ]
4. Umani Ronchi G, Bolino G, Grande A, Marinelli E. Introduzione allo studio della lesivita. En: Patología forense. Milán: Giuffre editore; 1994. p. 1-72. [ Links ]
5. Murphy HS. Inflamation. En: Rubin´s pathology. 5th ed. Baltimore: Lippincott Williams & Wilkins; 2008. p. 18-35. [ Links ]
6. Gómez Pascual A, Martínez Sánchez MC, Villar Rodríguez JL. Histopathologic study of vital lesions e inflamation: nomenclature, general characteristics and morphological patterns. En: Blanco Pampín J, Salguero Villadiego M, editores. Practical manual of forensic histopathology. Nueva York: Nova Biomedical; 2012. p. 137-71. [ Links ]
7. Kumar V, Abbas AK, Aster JC. Inflamación y reparación. En: Patología estructural y funcional. Robbins. Madrid: Elsevier; 2015. [ Links ]
8. Stevens A, Lowe J. Piel y mamas. En: Histología humana. 3a ed. Madrid: Elsevier Mosby; 2007. p. 373-94. [ Links ]
9. Sauko P, Knight B. The pathology of wounds. Dating. En: Knight´s Forensic pathology. 3rd ed. London: Arnold; 2004. p. 136-73. [ Links ]
10. Betz P. Histological and enzyme histochemical parameters for the age estimation of human skindwound. Int J Leg Med. 1994;107:60-8. [ Links ]
11. Stevens A, Lowe J. Respuestas tisulares a la lesión. En: Anatomía Patológica. 2a ed. Madrid: Harcourt Mosby; 2001. p. 35-59. [ Links ]
12. Ross MH, Pawlina W. Tejido conjuntivo. En: Histología. 5a ed. Madrid: Médica Panamericana; 2007. p. 160-91. [ Links ]
13. Morales ML. El estudio del proceso inflamatorio en las lesiones traumáticas. Segundo Curso de Patología Forense, Universidad del País Vasco; 2002. p. 97-119. [ Links ]
14. Kanik A, Min L, Urmacherc D. Normal skin. En: Histology for pathologists. Baltimore: Lippincott Williams & Wilkins; 2012. p. 3-29. [ Links ]
15. Gellner W, Madea B. Demands on scientific studies: vitality of wounds and wound age estimation. Forensis Sci Int. 2007;165:150-4. [ Links ]
16. Kondo T. Timing of skin wound. Legal Medicine. 2007;9:109-14. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Manuel Salguero Villadiego
E-mail: manuel.salguero@justicia.es
Fecha de recepción: 25.SEPT.2015
Fecha de aceptación: 20.NOV.2015