Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Anales del Sistema Sanitario de Navarra
versión impresa ISSN 1137-6627
Anales Sis San Navarra vol.26 no.3 Pamplona dic. 2003
ARTÍCULO ORIGINALES
Complicaciones clínicas en una serie de pacientes con anticuerpos
anticardiolipina
Clinical complications in a series of patients with anticardiolipin
antibodies
Pujol A.1, Alegría E.1, González J.1, Ngare Ch.1, Pérez J.1, Páramo J.A.1,2
| RESUMEN Se han analizado las complicaciones clínicas determinadas con métodos objetivos en 68 pacientes de la Clínica Universitaria de Navarra con sospecha clínica de síndrome antifospolípido (SAF) y presencia de anticuerpos anticardiolipina (ACA). Se consideraron para el estudio, pacientes con título de IgG superior a 23 GPL. La patología más prevalente fue la trombosis: trombosis venosas (42,6%) y arteriales (22%). Otras complicaciones fueron abortos (23,8% de las 42 mujeres) y trombocitopenia (12,1%). En cuanto a la localización de la trombosis venosa, el predominio correspondió a extremidades inferiores (51,7%), seguida de tromboflebitis superficial (27,5%) y tromboembolismo pulmonar (20,6%). Entre las complicaciones arteriales, las más frecuentes fueron enfermedad cerebrovascular (86,6%) y la cardiopatía isquémica (13,4%). No existió correlación entre la presencia de títulos elevados de ACA y la prevalencia o severidad de las manifestaciones clínicas. En la serie de 68 pacientes con ACA IgG >23 GPL se aprecia un elevado porcentaje de trombosis venosas y arteriales detectadas con métodos objetivos. La presencia de ACA constituye un factor de riesgo protrombótico. Palabras clave. Síndrome antifosfolípido. Anticuerpos anticardiolipina. Trombosis venosa. Trombosis arterial. Anticoagulante lúpico. | ABSTRACT An analysis was made of clinical complications, determined with objective methods, in 68 patients at the University Clinic of Navarra with the clinical suspicion of antiphospholipid syndrome (APS) and presence of anticardiolipin antibodies (ACA). Patients with IgG higher than 23 GPL were considered for the study. The most prevalent pathology was thrombosis: venous thrombosis (42.6%) and arterial thrombosis (22%). Other complications were abortions (23.8% of the 42 women) and thrombocytopenia (12.1%). With respect to the localisation of venous thrombosis, predominance corresponded to lower extremities (51.7%), followed by superficial thrombophlebitis (27.5%) and pulmonary thromboembolism (20.6%). Among the arterial complications, the most frequent were cerebrovascular disease (86.6 %) and coronary disease (13.4%). There was no correlation between the presence of high values of ACA and the prevalence or severity of clinical manifestations. In the series of patients with ACA IgG>23 GPL, we appreciated a high percentage of venous and arterial thrombosis detected with objective methods. The presence of ACA constitutes a prothrombotic risk factor. Key words. Antiphospolipid syndrome. Anticardiolipin antibodies. Venous thrombosis. Arterial thrombosis. Lupus anticoagulant. |
| 1. Facultad de Medicina. Clínica Universitaria de Navarra. Pamplona. 2. Servicio de Hematología. Clínica Universitaria de Navarra. Pamplona. Aceptado para su publicación el 17 de junio de 2003 | Correspondencia José A. Páramo Servicio de Hematología Clínica Universitaria Avda. Pío XII, 36 31008 Pamplona japaramo@unav.es |
INTRODUCCIÓN
Los anticuerpos antifosfolípidos (AFL) son una familia heterogénea de autoanticuerpos que incluyen, entre otros, anticoagulante lúpico (AL) y anticuerpos anticardiolipina (ACA)1. Los AL se comportan como inhibidores adquiridos de la coagulación, prolongando in vitro las pruebas de coagulación dependientes de fosfolípidos2. Los ACA se determinan con técnicas de enzimoinmunoanálisis (ELISA), empleando cardiolipina y otros fosfolípidos aniónicos3. Los AFL, a pesar de su nombre, no reconocen fosfolípidos, sino proteínas plasmáticas, fundamentalmente la b2-glicoproteína I (b2-GP-1), y la protrombina. La mayoría de los ACA precisan el concurso de b2-GP1 para reaccionar con la cardiolipina4. El interés clínico de los AFL deriva de su relación con trombosis venosas y arteriales, encuadradas en el síndrome antifosfolípido (SAF), también denominado síndrome trombótico mediado por anticuerpos y síndrome de Hughes, del que se han descrito dos formas: primario, sin evidencia de enfermedad de base, y secundario, principalmente en el contexto del lupus eritematoso sistémico2,5-7. Los criterios para diagnosticar un SAF incluyen: a) historia clínica de 1 ó más episodios de trombosis o historia de abortos de repetición, y b) evidencia analítica de AL o presencia de ACA de tipo IgG o IgM8. Aproximadamente 1/3 de los pacientes con AFL presentan episodios trombóticos venosos y/o arteriales. Si bien la asociación parece clara para los pacientes con AL (hasta un 40% pueden desarrollar trombosis), no todos los estudios encuentran correlación entre positividad para ACA y presencia de trombosis9.
En este trabajo se describen las complicaciones clínicas (trombóticas y no trombóticas), detectadas con métodos objetivos de diagnóstico, en una serie de pacientes de un solo centro sanitario con títulos elevados de ACA y se discuten posibles mecanismos patogénicos.
PACIENTES Y MÉTODOS
Para la elaboración del estudio se seleccionaron durante el período 1999-2001 pacientes de la Clínica Universitaria de Navarra, que presentaran positividad para ACA mediante ELISA, con niveles de IgG en suero superiores a 23 GPL. La determinación de ACA se realizó mediante ELISA y el punto de corte se estableció en base a los títulos considerados como positivos en el kit de referencia. No se incluyeron pacientes con títulos positivos de IgM, por haberse detectado únicamente dos casos en el período de inclusión del estudio, número insuficiente para obtener resultados concluyentes.
El número total de pacientes incluidos fue de 68. Se eligieron pacientes consecutivos en los que se determinó ACA por sospecha clínica de SAF procedentes los servicios de Medicina Interna, Ginecología, Hematología y Neurología. La recogida de datos se realizó a partir de las historias clínicas de los pacientes, obteniéndose las siguientes variables: demográficas (edad y sexo) y clínicas (presencia de trombosis venosa, tromboembolismo pulmonar, trombosis arteriales o abortos de repetición).
El diagnóstico de trombosis se estableció siempre que se hubiera realizado una prueba diagnóstica objetiva: Doppler en el caso de trombosis venosa profunda (TVP), gammagrafía pulmonar en tromboembolismo pulmonar (TEP), electrocardiograma (ECG) y enzimas cardíacos en cardiopatía isquémica y tomografía axial computarizada (TAC) en accidente cerebrovascular (ACV).
Variables analíticas. Recuento de plaquetas. Se consideró trombocitopenia cuando el recuento de plaquetas fue <150.000/mm3. Se determinó el ACA circulante tipo IgG, mediante técnica de enzimoinmunoanálisis (ELISA), con el kit de detección de anticardiolipina (cardiolipina IgG, DiasorinR), expresándose el resultado como GPL. Se estableció un punto de corte de 23 GPL según las indicaciones del kit de referencia. Se determinó AL con el test de veneno de víbora Russel (VVRD), considerando positivos las razones superiores a 1,310.
Análisis estadístico
Se realizó el análisis estadístico descriptivo de los datos obtenidos calculando, entre las variables cuantitativas (edad, título de ACA y trombocitopenia), la media, rango y desviación estándar, empleando el programa informático SPSS. Se definieron nuevas variables a partir de los anteriores valores: títulos inferiores o superiores de ACA a 35 GPL, subgrupos por edad y presencia o no de trombocitopenia Se realizaron tablas de contingencia para establecer asociaciones entre algunas variables, aplicando la prueba de c2 y el test de Fisher. Se consideraron significativas asociaciones con valores de p<0,05.
RESULTADOS
Se realizó un análisis a partir de historias clínicas de 68 pacientes de la Clínica Universitaria con sospecha de SAF que presentaban positividad para ACA IgG (>23 GPL). De los 68 pacientes, 42 (61,8%) fueron mujeres y 26 (38,2%) varones. La edad media de la población estudiada era de 58±15 años (rango 25-88 años), con una distribución por grupos de edad y sexo que se muestra en la figura 1. El grupo de edades mayoritario fue de 40 a 49 años con 18 pacientes (26,5%).
El valor medio de ACA presente en los sujetos fue de 39,1±13,6 GPL (rango 25-105). En 17 pacientes (25%) se detectó además la presencia de AL positivo.
Se detectaron complicaciones relacionadas con el SAF (trombosis, abortos o trombocitopenia) en el 95,5% de la serie analizada. Todos los casos de trombosis fueron confirmados con métodos objetivos.
Afectación venosa
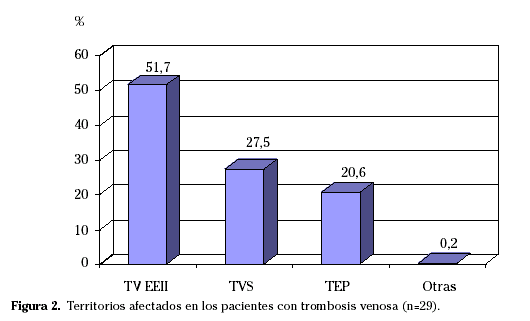
Existieron complicaciones venosas en 29 pacientes (42,6%). La patología observada con mayor frecuencia (Fig. 2) fue la TVP en extremidades inferiores (EEII), apareciendo en 15 sujetos (51,7%), afectando fundamentalmente a los territorios ilíaco-femoral, poplíteo y safena (en algunos casos, de forma aislada, coexistían con trombosis venosas en vena cava inferior, axilar y basílica). Se diagnosticaron tromboflebitis superficiales (TVS) en 8 casos (27,5%) y TEP en 6 casos (20,6%).
Afectación arterial
Quince pacientes (22%) presentaron fenómenos trombóticos o tromboembólicos arteriales (Fig. 3), que se distribuyeron en:
– Enfermedad cerebrovascular. Fue la patología arterial más frecuente, estando presente en 13 pacientes (86,6%), de los cuales 11 correspondieron a ACV (3 fueron ataques isquémicos transitorios o TIA), y 2 a isquemia multifocal.
– Cardiopatía isquémica. Dos pacientes (13,4%) presentaron historia de isquemia miocárdica aguda con necrosis (infarto agudo de miocardio) confirmada mediante ECG y enzimas cardíacos.
Complicaciones obstétricas
En 10 de las mujeres incluidas en el estudio (23,8% de la población femenina) se produjeron complicaciones obstétricas, todas ellas en forma de abortos no explicados o pérdidas fetales en el primer trimestre de la gestación.
Trombocitopenia
En cuanto al recuento de plaquetas, éste se pudo conocer en un 85,3% de los sujetos (n=58), ya que en el 14,7% restante no figuraba el dato en la historia clínica. Se detectaron recuentos inferiores a 150.000/mm3 en el 12,1% de los casos.
Mediante el uso de tablas de contingencia y la prueba de c2, se estudió la existencia de relación entre los niveles de ACA y la afectación clínica. La tasa de complicaciones trombóticas no mostró diferencias significativas entre los pacientes con títulos de ACA>35 GPL (47,6% venosas y 21,4% arteriales), que en aquellos con títulos <35 GPL (34,6% venosas y 23% arteriales) (Tabla 1).
En cuanto a los pacientes que presentaron de forma simultánea AL y ACA (n=17) se objetivó la presencia de trombosis en 7 casos (41%): 5 de origen venoso y 2 de origen arterial (Tabla 2).
DISCUSIÓN
El SAF representa el prototipo de los estados de hipercoagulabilidad adquiridos1. En una serie reciente incluyendo pacientes con SAF, 59% tenían TV, 28% trombosis arteriales y 13 % trombosis mixtas11. Mientras que la positividad para AL se ha asociado de forma convincente con una mayor prevalencia de episodios trombóticos, los resultados en cuanto a la asociación de ACA y complicaciones trombóticas son más controvertidos2,9. Ello se debe, en gran medida, a que la mayoría de las series publicadas muestran gran heterogeneidad en términos de diseño, criterios de inclusión, condiciones clínicas asociadas, pruebas de laboratorio empleadas, isotipos concretos y puntos de corte para los que se considera la prueba como positiva.
En este estudio se han analizado, a partir de historias clínicas, las manifestaciones clínicas demostradas con métodos objetivos en una serie de 68 pacientes, de un único centro sanitario, con sospecha clínica de SAF y positividad para ACA (>23GPL), con distribución por edad y sexos similar a la encontrada en la literatura. La patología más prevalente fue la trombosis, afectando a los territorios venosos (43%) y arterial (22%). La asociación de trombosis venosa con la presencia de AFL ha sido demostrada en diversos estudios en los cuales se observó una prevalencia entre el 17 y 55%, fundamentalmente en relación con la presencia de AL, mientras que los ACA positivos constituirían un factor protrombótico menos potente12. Existen algunas discrepancias en la literatura en relación a la predisposición a la trombosis relacionada con los ACA. Así, mientras en algunas series se correlaciona la presencia de estos anticuerpos con la recurrencia de trombosis12-14, en otras que estudiaron sujetos asintomáticos con ACA seguidos durante 10 años, se observó que el 50% desarrollaron manifestaciones clínicas sugestivas de SAF15. Otros estudios sugieren que sólo una minoría de pacientes con títulos elevados de ACA presentan un SAF16.
En la serie analizada, al igual que en otros estudios de casos-controles, prospectivos y metaanálisis, el principal territorio afectado fue el sistema venoso profundo de las EEII, con una incidencia asimismo importante de tromboflebitis superficial y TEP1,9. Es importante señalar que la presencia de ACA puede ser un importante factor de riesgo para recurrencia de tromboembolismo venoso. En un estudio en pacientes con un primer episodio de TV se observó recurrencia en el 30% de pacientes con positividad para ACA17.
La afectación trombótica del lecho arterial fue menos frecuente, estando presente en el 22% de los pacientes, representada principalmente por el ACV isquémico y en segundo lugar por la cardiopatía isquémica. La asociación de ACA y ACV ha sido descrita previamente18-20. En un estudio se demostró que títulos de ACA >40 GPL se asociaban con un incremento del riesgo de recurrencia y mayor mortalidad21. La incidencia de cardiopatía isquémica (13%) fue, sin embargo, algo inferior a la reportada en otras series22-24.
La prevalencia de complicaciones trombóticas fue similar para títulos de ACA superiores o inferiores a 35 GPL, eligiéndose este punto de corte sobre la base de estudios previos que habían encontrado asociación entre títulos elevados de ACA (rango 33-40 GPL) y trombosis21. Sin embargo, nuestros datos en la línea de otros autores25 sugieren que la asociación con trombosis sería independiente del título de anticuerpos. En una amplia revisión de estudios prospectivos, caso-control y transversales incluyendo 4.184 pacientes y 3.151 controles sólo se observó relación entre ACA IgG a títulos elevados y algunos tipos de trombosis; concretamente, sólo se observó asociación significativa con ACV e infarto de miocardio, pero no con TV, mientras que el tipo IgM no se asoció con trombosis9. Sin embargo, es dudoso que la expresión cuantitativa de ACA sea de interés en la práctica clínica, dada la diferente metodología empleada en los distintos laboratorios y la heterogeneidad observada en sujetos con títulos moderados o altos. Para solucionar estos problemas, se ha establecido recientemente un protocolo de consenso para la detección analítica de ACA, que podría permitir en el futuro la armonización de los resultados26.
La incidencia de complicaciones obstétricas en el total de mujeres analizadas fue 23,8%, similar a la de otras series27,28. Nuestros resultados indican que la presencia de ACA confiere un riesgo adicional durante el embarazo.
Finalmente, se constató trombocitopenia en el 12,1%, algo inferior a la detectada en otras series, donde se describen rangos de 20-70%. La mayoría de los casos de trombocitopenia relacionada con el SAF son de mecanismo inmune y raramente se asocian con complicaciones hemorrágicas, habiéndose observado anticuerpos antiglicoproteína de membrana plaquetar en hasta un 70% de los casos29.
En cuanto a los mecanismos de trombosis relacionados con ACA se ha sugerido la activación endotelial y daño oxidativo celular e interferencia con mecanismos antitrombóticos dependientes de fosfolípidos y con los mecanismos de apoptosis celular30.
El estudio realizado presenta algunas limitaciones. En primer lugar no permite realizar un seguimiento temporal para demostrar si la positividad por ACA constituye un epifenómeno o es realmente un factor causal. Si bien el número de pacientes incluidos no es muy elevado, otras series que analizaron parámetros clínicos y biológicos en relación con el SAF, presentaban poblaciones de tamaño similar.
Concluimos que un título de ACA IgG >23 GPL en pacientes con sospecha clínica de SAF se asocia con una elevada prevalencia de trombosis venosas y arteriales, por lo que constituye un potente factor de riesgo protrombótico.
Agradecimientos
Al Dr. A. Sánchez-Ibarrola por proporcionar las historias clínicas de los pacientes ACA positivos con las que se ha llevado a cabo el estudio.
BIBLIOGRAFÍA
1. Levine JS, Branch W, Rauch J. The antiphospholipid syndrome. N Engl J Med 2002; 346: 752-763. [ Links ]
2. Hughes GRV. Thrombosis, abortion, cerebral disease and the lupus anticoagulant. Br Med J 1983; 287: 1088-1089. [ Links ]
3. Deguchi H, Fernández JA, Hackeng TM, Banka CL, Griffin JH. Cardiolipin is a normal component of human plasma lipoproteins. Proc Natl Acad Sci 2000; 97: 1743-1748 [ Links ]
4. McNeil HP, Simpson RJ, Chesterman CN, Krilis SA. Antiphospholipid antibodies are directed against a complex antigen that includes a lipid binding inhibitor of coagulation: B2-glycoprotein I (apolipoprotein H). Proc Natl Acad Sci 1990; 87: 4120-4124. [ Links ]
5. Greaves M. Antiphospholipid antibodies and thrombosis. Lancet 1999; 353:1348-1353. [ Links ]
6. Asherson RA, Khamashta MA, Ordi-Ros J, Derksen RH, Machin SJ, Barquinero J et al. The primary antiphospholipid syndrome: major clinical and serological features. Medicine (Baltimore) 1989; 68: 366-374. [ Links ]
7. Arnout J. Antiphospholipid Syndrome : Diagnostic aspects of lupus anticoagulants. Thromb Haemost 2001, 86: 83-91. [ Links ]
8. Wilson WA, Gharavi AE, Koike T, Lockshin MD, Brandh DW, Piette JC et al. International consensus statement on preliminary classification criteria for definite antiphospholipid syndrome: report of an international workshop. Arthritis Rheum 1999; 42: 1309-1311. [ Links ]
9. Galli M, Luciani D, Bertolini G, Barbui T. Lupus anticoagulants are stronger risk factors for thrombosis than anticardiolipin antibodies in the antiphospholipid syndrome: a systematic review. Blood 2003; 101: 1827-1832. [ Links ]
10. Páramo JA. Diagnóstico de los estados de hipercoagulabilidad. Rev Clin Esp 2001; 201: 40-42. [ Links ]
11. Provenzale JM, Ortel TL, Allen NB. Systemic thrombosis in patients with antiphospholipid antibodies: lesion distribution and imaging findings. Am J Roentgenol 1998; 170: 285-290 [ Links ]
12. Ginsburg KS, Liang MH, Newcomer L, Goldhaber SZ, Schur PH, Hennekens CH et al. Anticardiolipin antibodies and the risk for ischemic stroke and venous thrombosis. Ann Intern Med 1992; 117: 997-1002. [ Links ]
13. Ginsberg JS, Wells PS, Brill-Edwards P, Donovan D, Moffatt K, Jonhston M et al. Antiphospholipid antibodies and venous thromboembolism. Blood 1995; 86: 3685-3691. [ Links ]
14. Finazzi G, Brancaccio V, Moia M, Ciavarella N, Mazzucconi MG, Schinco PC et al. Natural history and risk factors for thrombosis in 360 patients with antiphospholipid antibodies: a four year prospective study from the Italian Registry. Am J Med 1996; 100: 530-536. [ Links ]
15. Shah NM, Khamastha MA, Atsumi T, Hughes GR. Outcome of patients with anticardiolipin antibodies: a 10 year follow-up of 52 patients. Lupus 1998; 7: 3-6. [ Links ]
16. Vaidya S, Sellers R, Guglinzza K, Daller J, Fish JC. Therapy in ESRD patients with antiphospholipid antibody syndrome. Transplant Proc 2001; 33: 1257-1258. [ Links ]
17. Shulman S, Svenungsson E, Granqvist S. Anticardiolipin antibodies predict early recurrence of thromboembolism and death among patients with venous thromboembolism following anticoagulant therapy. Duration of Anticoagulation Study Group. Am J Med 1998; 104: 332-338. [ Links ]
18. Kushner MJ. Prospective study of anticardiolipin antibodies in stroke. Stroke 1990; 21: 295-298. [ Links ]
19. The Antiphospholipid Antibodies in Stroke Study (APASS) Group. Anticardiolipin antibodies are an independent risk factor for first ischemic stroke. Neurology 1993; 43: 2069-2073. [ Links ]
20. Levine SR, Brey RL, Sawaya KL, Salovich-Palm L, Kokkinos J, Bostrzema B et al. Recurrent stroke and thrombo-occlusive events in the antiphospholipid syndrome. Ann Neurol 1995; 38: 119-124. [ Links ]
21. Levine SR, Salowich-Palm L, Sawaya KL, Perry M, Spencer HJ, Winkler HJ et al. IgG anticardiolipin antibody titer >40GPL and the risk of subsequent thrombo-occlusive events and death. A prospective cohort study. Stroke 1997; 28: 1660-1666. [ Links ]
22. Vaarala O, Manttari M, Manninnen V, Tenkanen L, Puurunen M, Aho K et al. Anticardiolipin antibodies and risk of myocardial infarction in a prospective cohort of middle-aged men. Circulation 1995; 91: 23-27. [ Links ]
23. Zuckerman E, Toubi E, Shiran A, Sabo E, Shmuel Z, Golan TD et al. Anticardiolipin antibodies and acute myocardial infarction in non-systemic lupus erythematous patients: a controlled prospective study. Am J Med 1996; 171: 381-386. [ Links ]
24. Bili A, Moss AJ, Francis CW, Zareba W, Watelet LFM, Sanz I. Anticardiolipin antibodies and recurrent coronary events. A prospective study of 1150 patients. Circulation 2000; 1253-1263. [ Links ]
25. Thurim S, Rand JH, Wu XX, Weinberger J, Horowitz DR, Goldman ME et al. Elevated anticardiolipiin antibody titer is a strong risk factor in a multiethnic population independent of isotype or degree of positivity. Stroke 1999; 30: 1561-1656. [ Links ]
26. Tincani A, Allegri F, San Marco M, Cinquini M, Taglietti M, Ballestrieri G et al. Anticardiolipin antibody assay: a methodological analysis for a better consensus in routine determinations. Thromb Haemost 2001; 86: 575-583. [ Links ]
27. Magy N, Gil H, Racadot E, Dupond JL. Valeur relative des différents anticorps antiphospholipides détectés dans un service de mçedecine interne: étude rétrospective chez 124 patients. Rev Med Int 2002; 23: 696-702. [ Links ]
28. Forguharson RG, Quenby S, Creaves M. Antiphospholipid syndrome in pregnancy: a randomised, controlled trial of treatment. Obstet Gynecol 2002; 100: 408-413. [ Links ]
29. Lipp E, Von-Felten AM, Sax H, Muller D, Berchtold P. Antibodies against platelet glycoproteins and antiphospholipid antibodies in autoimmune thrombocytopenia. Eur J Haematol 1998; 60: 283-288. [ Links ]
30. Rand JH. The antiphospholipid syndrome. Annu Rev Med 2003; 54: 409-424. [ Links ]