Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Anales del Sistema Sanitario de Navarra
versión impresa ISSN 1137-6627
Anales Sis San Navarra vol.27 supl.1 Pamplona 2004
Tratamiento médico de los hemangiomas
Medical treatment of haemangiomas
P. Lloret
|
resumen En el tratamiento de los hemangiomas, existen dos actitudes claramente diferentes, la actitud expectante y la actitud terapéutica médica o quirúrgica. La actitud expectante podría indicarse en hemangiomas pequeños, lejos de zonas con posible daño funcional, y con un lento crecimiento, aunque debe considerarse que después de llegar a su máxima involución, alrededor de un 25% de los hemangiomas presentan una deformidad significativa. Deben ser sometidos a tratamiento aquellos hemangiomas que obstruyan el eje visual, la vía aérea, el canal auditivo, (con alteración de funciones como la visión, respiración, deglución, y funciones intestinal o urinaria), aquellos con crecimiento rápido que produzcan o puedan producir una destrucción tisular o desfiguración importante, lesiones ulceradas, y lesiones con gran extensión cutánea o con afectación visceral que puedan desembocar en insuficiencia cardíaca congestiva, o alteraciones hematológicas. Los corticosteroides sistémicos son el tratamiento de elección a dosis inicial de 2 a 3 mg/kg/día de prednisona o prednisolona, administrada una vez al día, por la mañana. Lo más frecuente es conseguir una detención del crecimiento, mientras que la disminución de tamaño se observa en menos de la mitad de los casos. La administración intralesional de corticoides a intervalos de entre 4 y 8 semanas es un tratamiento efectivo que consigue evitar los efectos adversos de los corticoides sistémicos. La indicación del interferón por los efectos adversos neurológicos está limitada a lesiones con riesgo vital o funcional severo que no respondan a corticoides. Otro grupo de tratamiento son los citotóxicos: bleomicina intralesional, vincristina, ciclofosfamida y la pingiangmicina. Palabras clave. Hemangioma. Médico. Expectante. Regresión. |
ABSTRACT There are two clearly differentiated attitudes in the treatment of haemangiomas: the expectant attitude and the therapeutic, medical or surgical attitude. The expectant attitude can be appropriate in cases of small haemangiomas, far from areas of possible functional damage, and with a slow rate of growth; however, it must be remembered that after reaching their maximum involution, about 25% of haemangiomas show a significant deformity. Treatment should be applied to those haemangiomas that obstruct the visual axis, the airway, the auditory channel, (with alteration of functions such as vision, breathing, swallowing and urinary or intestinal functions); to those of rapid growth that produce or might produce tissue destruction or significant disfiguration, ulcerated lesions, and lesions with a great cutaneous extension or visceral affection, which can lead to congestive cardiac insufficiency, or haematological alterations. The recommended treatment is systemic corticosteroids, with an initial dose of 2 to 3 mg/kg/day of prednisone or prednisolone, administered once a day in the morning. The most frequent result is that growth is arrested, while a reduction in size is observed in less than half the cases. Intralesional administration of corticosteroids at intervals of between 4 and 8 weeks is an effective treatment that manages to avoid the adverse effects of systemic corticosteroids. Because of its adverse neurological effects, interferon is only recommended for lesions with a vital or severe functional risk that do not respond to corticosteroids. Cytotoxic drugs are another treatment group: intralesional bleomycin, vincristine, cyclophosphamide and pingiangmycin. Key words. Haemangioma. Medical. Expectant. Regression.
|
| Área de Hemangiomas y Malformaciones Vasculares. Departamento de Dermatología. Clínica Universitaria. Universidad de Navarra. Pamplona. | Correspondencia: Pedro Lloret Luna Departamento de Dermatología Clínica Universitaria Apdo. 4209 31080 Pamplona Tfno. 948 255400 Fax: 948 296500 e-mail: plloret@unav.es |
INTRODUCCIÓN
Existen varios aspectos controvertidos en el manejo de los hemangiomas. Se trata de una patología con una escasa incidencia, de evolución variable, difícilmente predecible, y sobre la que faltan estudios randomizados de grupos homogéneos que evalúen las distintas actitudes terapéuticas. La Academia Americana de Dermatología estableció en 1997 una guía para el manejo de esta patología que persigue cinco objetivos principales:
1) Prevenir o tratar complicaciones con compromiso orgánico o vital.
2) Prevenir una dismorfia permanente.
3) Minimizar el impacto psicosocial al paciente y a la familia.
4) Evitar procedimientos agresivos y potencialmente causantes de cicatrices.
5) Prevenir o tratar la ulceración para minimizar las cicatrices, las infecciones y el dolor.
Por lo general, no hay dudas en cuanto a tratar los llamados hemangiomas alarmantes, (los que implican una amenaza para la vida o para la función de los órganos próximos), que suponen aproximadamente el 10-20% del total de los hemangiomas. Por otro lado existen hemangiomas que no representan a priori una amenaza, y en estos casos surgen dudas sobre cuál es la actitud más adecuada. Aquellos que defienden un manejo agresivo postulan que con ello se minimizan los riesgos, mientras que quienes apuestan por un manejo conservador consideran que se consiguen mejores resultados cosméticos ya que la mayoría de hemangiomas son de curso autolimitado. Podemos hablar entonces de dos actitudes claramente diferentes, la actitud expectante y la actitud terapéutica médica o quirúrgica1.
ACTITUD EXPECTANTE
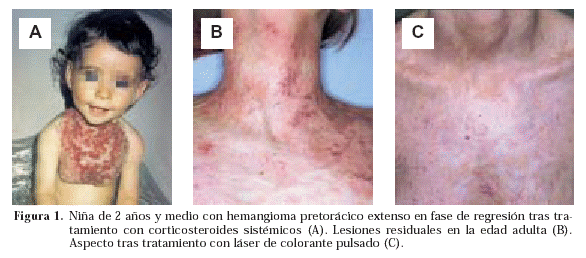
Lister y Camb publicaron en Lancet en 1938 un artículo sobre la evolución natural de los hemangiomas y defendieron el principio de Watchful waiting (espera vigilada)2. Los detractores de esta actitud sostienen que, después de llegar a su máxima involución, alrededor de un 25% de los hemangiomas presentan una deformidad significativa. Esta actitud podría indicarse en hemangiomas pequeños, localizados lejos de zonas con posible daño funcional, y con una velocidad de crecimiento lenta. Además de evaluar al paciente, debe prestarse una atención especial a los padres, que como es lógico, presentan un alto grado de ansiedad, son objeto de informaciones contradictorias procedentes de ámbitos sanitarios y no sanitarios, y hay constancia de que experimentan una cierta insatisfacción respecto al médico responsable1. Se recomienda evaluar con frecuencia al paciente y documentar el tamaño de la lesión para conocer la velocidad de crecimiento Se deben explicar las ventajas e inconvenientes de cada tratamiento y su idoneidad e informar de la posibilidad de autoinvolución, adjuntando imágenes de casos similares si procede (Fig. 1).
ACTITUD TERAPÉUTICA
Algunos autores dividen los tratamientos en: no específicos (cirugía, crioterapia), antiangiogénicos (corticoides, interferon) y antiproliferativos (quimioterapia, radioterapia)3. Deben ser sometidos a tratamiento aquellos hemangiomas que obstruyan el eje visual, la vía aérea, el canal auditivo y la región ano-genital (con alteración de la función visual, respiratoria, deglutoria, intestinal o urinaria); aquellos con crecimiento rápido que produzcan o puedan producir una destrucción tisular o desfiguración importante, así como lesiones cutáneas muy diseminadas o con afectación visceral que puedan desembocar en insuficiencia cardiaca congestiva, hemorragia grave o trastornos de la coagulación3. El impacto psicológico de la lesión en el paciente y en los familiares también debe ser considerado. Cualquier actitud terapéutica debe ir precedida de un consentimiento informado4. El tratamiento debe ser precoz, ya que presentan un rápido crecimiento en las primeras semanas de vida.
Corticosteroides
Corticosteroides sistémicos
Los corticosteroides son para muchos autores el tratamiento de elección en hemangiomas potencialmente problemáticos y constituyen el tratamiento en monoterapia más efectivo en hemangiomas comunes5. Su efecto fue descubierto de forma accidental hace más de 30 años en un niño con trombocitopenia que tras el tratamiento experimentó una involución rápida del hemangioma que presentaba6.
El mecanismo de acción no es bien conocido, aunque se piensa que ocurre una inhibición de la angiogénesis7, un incremento de mastocitos y citocinas8, un aumento de la vasoconstricción y una interferencia hormonal1,8. Un estudio de Hasan y col9 investiga los efectos in vitro de varios corticoides en un modelo de hemangioma, encontrando que ni el factor de crecimiento endotelial vascular (VEGF) ni el factor 2 de crecimiento de fibroblastos (FGF-2) juegan un papel vital en la inhibición del crecimiento capilar inducida por corticoide. Todos los corticosteroides indujeron un marcado descenso en la transcripción del gen de interleucina (IL)-6, citocina de actividad proangiogénica. Zweifach y col demostraron que los corticosteroides aumentan la sensibilidad a sustancias vasoconstrictoras en la microcirculación y de esta manera impiden la proliferación endotelial10. Existe un mecanismo hormonal implicado en la respuesta a corticoterapia, ya que los pacientes que responden presentan niveles elevados de estradiol sérico y receptores de estradiol aumentados en el hemangioma11. Parece que los corticosteroides se unen a receptores esteroideos en los hemangiomas en fase proliferativa y así inhiben la unión del 17-beta estradiol.
Las indicaciones de los corticosteroides son superponibles a las comentadas en el apartado Actitud terapéutica. Son especialmente útiles en el manejo de los hemangiomas subglóticos, perioculares y orbitarios. No obstante, cabe resaltar que el tipo de corticosteroide, su dosis, y la frecuencia de administración consideradas óptimas son empíricas y carecen de una contrastada base científica9. Se recomienda una dosis inicial de 2 a 3 mg/kg/día de prednisona o prednisolona, administrada una vez al día, por la mañana. La dosis más efectiva parece ser de 3 mg/kg/día, aunque se indican dosis aún más elevadas en casos graves, por ejemplo aquellos con compromiso de la vía aérea. Algunos estudios aconsejan 5 mg/kg/día, aunque es posible que la mejor respuesta se deba al tamaño y a la fase de inicio del tratamiento más que a la dosis12. El grupo de Williams establece un algoritmo de manejo de estas lesiones y recomienda iniciar el tratamiento con 4 mg/kg/día y evaluar al paciente pasada una semana, si la lesión ha respondido mantienen el tratamiento dos semanas. A las tres semanas del inicio del tratamiento comienzan una reducción de dosis durante 4 a 8 semanas13. Este grupo establece una visita cada 4 semanas en todo paciente en tratamiento con corticosteroides sistémicos, o antes si existen complicaciones. Un mes después de la suspensión del tratamiento se reevalúa al paciente; si existe proliferación retoman el fármaco a 3-4 mg/kg/día, evalúan al paciente a la semana, y si existe mejoría se realiza un descenso de dosis en las siguientes 4 semanas13. Algunos autores han descrito pautas de 2 mg de betametasona oral en un lactante de un mes de edad, administradas dos días seguidos cada semana, durante doce semanas14. No hay evidencias claras de que la vía endovenosa resulte más efectiva que la oral, aunque puede indicarse ante el inicio de síntomas de fallo cardiaco, obstrucción de vías aéreas superiores o de síndrome de Kasabach-Merrit. La dosis debe ser reducida progresivamente para evitar la aparición de insuficiencia suprarrenal, y se recomienda suspender el tratamiento antes del año de vida15.
Una reciente revisión sistemática de las series de más de 5 pacientes publicadas hasta la fecha, establece que la respuesta al tratamiento, entendida como disminución o cese en el crecimiento, ocurre en torno al 84% de los casos y la tasa de rebote es del 36%5. Según algunas series, el 30% de los pacientes responden de forma drástica, un 40% muestra algún grado de respuesta, y un 30% no responden en absoluto16. Así pues, lo más frecuente es conseguir una detención del crecimiento, mientras que la disminución de tamaño se observa en menos de la mitad de los casos. Si el tratamiento es efectivo, la respuesta aparece en las 2-3 primeras semanas, en caso negativo debe pautarse un descenso progresivo de la dosis. En el primer caso la dosis debe mantenerse como mínimo un mes o incluso aumentarse, según algunos autores, mientras que otros recomiendan una disminución hasta la dosis mínima eficaz 17, con evaluación estrecha para evitar un efecto rebote18. El tratamiento debe mantenerse hasta conseguir la involución total del hemangioma, que suele ocurrir pasados 8 a 10 meses. En algunos centros se pautan periodos de descanso de 2-4 semanas tras 4-6 semanas de tratamiento17. La tasa de respuesta es mayor si el hemangioma se encuentra en la fase proliferativa en el momento del tratamiento, observándose ausencia o menor respuesta si se comienza más tarde. Un estudio reciente establece que las concentraciones de VEGF séricas determinadas a través de ELISA se correlacionan con la fase de crecimiento de los hemangiomas y puede ayudar a predecir la respuesta al tratamiento19. Otras veces la falta de efecto puede ser debida a una inadecuada absorción o bien a una dosis insuficiente. No obstante, es difícil determinar la evaluación del efecto de los corticosteroides, ya que no se puede determinar si la regresión es debida al efecto terapéutico o es espontánea1.
Los efectos secundarios de los corticosteroides en general suelen ser temporales. Se ha descrito aparición de rasgos cushingoides (71%), cambios de personalidad (29%), molestias gastrointestinales (21%) que pueden mejorar con la toma de ranitidina, infección fúngica oral o perineal (6%), y alteraciones del sueño17, entre otros. Se han descrito efectos más limitantes, aunque menos frecuentes, como osteoporosis, otitis media, miopatía esteroidea transitoria15, neumonía, sepsis17 e hipertensión20. Puede ocurrir disminución de peso (42%) y un retraso transitorio del crecimiento general (35%) y del crecimiento del perímetro cefálico, que cesan al suspender el tratamiento en más de un 90% de los casos. Existe una pauta a días alternos que disminuye la probabilidad de retraso del crecimiento, facies cushingoide e inmunosupresión, pero que es menos efectiva, por lo que no es recomendable en el momento inicial del tratamiento21. Por otro lado, en algunos recién nacidos prematuros con problemas pulmonares a los que se administraron corticosteroides sistémicos han sido descritas alteraciones neurológicas1. Debe evitarse la administración de vacunas con virus vivos atenuados durante el tratamiento. Ante la posibilidad de inmunosupresión se recomienda administrar inmunoglobulina de varicela en las 72 primeras horas tras la exposición al virus, para evitar la infección diseminada1 y explicar a los familiares la situación de supresión inmunológica13.
Corticosteroides intralesionales
La administración intralesional de corticosteroides es un tratamiento efectivo que consigue evitar los efectos adversos de los corticoides sistémicos. Están indicados en hemangiomas cutáneos bien localizados, fundamentalmente en pabellón auricular, punta nasal, mejillas, párpados y labios. Williams y col establecen un algoritmo para el tratamiento de hemangiomas y recomiendan el uso de corticosteroides intralesionales en lesiones subcutáneas proliferantes faciales, en áreas con déficit funcional potencial y en pacientes que hayan recibido corticoides sistémicos y estén en fase de disminución de dosis13. Por ejemplo, la afectación periorbitaria puede afectar al desarrollo de la visión binocular en pocos días o semanas, mientras que la administración de este tratamiento consigue reducir las alteraciones visuales.
Respecto a la dosis y el tipo de corticosteroide, encontramos referencias variables, aunque parece evidente que la combinación de fármacos es más efectiva que la monoterapia. Algunos autores recomiendan mezclar triamcinolona (40 mg/ml) con fosfato sódico de betametasona (6 mg/ml). En lesiones de gran tamaño, se recomienda combinar inicialmente 80 mg de triamcinolona y 16 mg de betametasona, asociando la rápida acción de la betametasona con la acción prolongada de la triamcinolona. Otros recomiendan utilizar 6 mg de fosfato sódico de betametasona y acetato de betametasona a partes iguales. Como alternativa se encuentra el fosfato sódico de betametasona (4 mg/ml), o el acetónido de triamcinolona (10-20 mg/ml)1. Se recomienda utilizar agujas finas, de tamaño 27-30G, aspirar tras la punción, realizar múltiples inyecciones de 0,1 ml, y aplicar compresión digital para evitar hematomas. El tratamiento puede repetirse a intervalos de entre 4 y 8 semanas, con un total de 3-4 sesiones, o bien hasta que regrese el hemangioma. Azzolini y col22 han utilizado 1-10 mg de triamcinolona semanalmente hasta reducirse un tercio del volumen y después a semanas alternas hasta un máximo de 100 mg de dosis acumulada, con mejoría clínica en los 115 pacientes estudiados.
La respuesta clínica se observa en los primeros tres días, inicialmente en forma de blanqueamiento y después como regresión de la masa. En una serie publicada por Kushner, aproximadamente un 84% de los pacientes mostraron una respuesta moderada (20%) o marcada (64%) tras el tratamiento, y la tasa de ambliopía y estrabismo se redujo en un 16% en hemangiomas periorbitarios23.
Las complicaciones son muy poco frecuentes. El grupo de Azzolini describe efectos sistémicos como por ejemplo detención del crecimiento en un 8,8% de los pacientes, y efectos adversos locales como hipertricosis localizada, equimosis y atrofia cutánea reversible, en un 7,9%22. Puede ocurrir también tumefacción local inmediata, que desaparece en 24-48 horas, hematomas, necrosis24 e hipopigmentación palpebral. Complicaciones serias como la oclusión de la arteria central de la retina permanente o parcial ocurren muy raramente y se deben a inyecciones a presiones superiores a la presión sistólica o bien a un flujo retrógrado de las partículas del corticoide en suspensión25. Por este motivo, hay autores que no recomiendan su uso en hemangiomas periorbitarios, y restringen su indicación para hemangiomas de la mitad inferior facial, el tronco y las extremidades16.
Corticosteroides tópicos
Se ha utilizado clobetasol tópico en pequeñas series, con buena respuesta y ausencia de efectos adversos, pero con resultados inferiores a los encontrados con corticosteroides intralesionales, y sin mejoría en la anisometropía26. Por esta razón no se puede considerar una alternativa al tratamiento intralesional. También es útil la aplicación tópica de valerato de betametasona27.
Interferon alfa
Los distintos tipos de interferon (IFN) fueron los primeros reguladores antiangiogénicos endógenos identificados. En el tratamiento de los hemangiomas se han usado con éxito el IFN alfa 2 y posteriormente el beta 2, apreciando que detienen el crecimiento y favorecen la disminución de tamaño, incluso con mayor potencia que los corticoides. La primera referencia de tratamiento de hemangiomas con IFN data de 1989 y se describe en un niño con una hemangiomatosis pulmonar28. También se ha demostrado su eficacia en hemangiomatosis difusas y angiomas en penacho complicados con el fenómeno de Kasabach-Merritt, en combinación con otros tratamientos29.
Inicialmente era un tratamiento indicado en hemangiomas de gran tamaño, compromiso funcional o riesgo vital (como obstrucción de vía aérea o coagulopatía de consumo), pero la gravedad de los efectos adversos neurológicos limitan su indicación a lesiones con riesgo vital o funcional severo que no respondan a corticosteroides29.
Greinwald y col recomiendan aumentos de dosis graduales de un millón de unidades cada mes, hasta alcanzar una dosis de 3 MU/m2/día29. Se administra de forma subcutánea a una dosis diaria de 1 a 3 MU por m2 de superficie corporal, aunque hay autores que describen un efecto similar con dosis de 3 MU/m2 diarias que con 2 MU/m2 administradas a días alternos30. En niños con área de superficie corporal menor a 0,6 m2 (generalmente menores de 2 años), se recomienda administrar una dosis de 100.000 U/Kg31. La duración media del tratamiento es de 2 a 6 meses, y la eficacia descrita varía entre un 30 y un 70%30-32. Greinwald y col, en una serie de 24 pacientes con hemangiomas masivos o con compromiso vital, describen respuesta completa en un 42% de los pacientes, moderada (50-80% de eficacia) en un 16% de los casos, intermedia (20-40 % de respuesta) en un 26% y ausencia de respuesta en un 16%29. La tasa de respuesta parece superior en hemangiomas de la mejilla o parótida29,33, aunque otros autores no lo confirman34. El tratamiento también parece más efectivo al ser iniciado a una edad temprana29, probablemente porque se consigue mayor efecto en la fase proliferativa, de forma similar a lo que ocurre con los corticosteroides. El cese del tratamiento no debe ser brusco, para evitar un fenómeno de rebote35. La ausencia de respuesta puede deberse al desarrollo de anticuerpos neutralizantes como ocurre en otras patologías en las que se administra este tratamiento29.
Los efectos secundarios en pacientes con hemangiomas incluyen, fiebre en el contexto de un cuadro gripal que puede ser revertido con paracetamol, aumento de las enzimas hepáticas, insuficiencia renal, supresión medular y toxicidad neurológica significativa en un 10% de los pacientes tratados. Se ha descrito un cuadro de diplegia espástica en un 20% de pacientes tratados con IFN alfa 2a y en un 5% con alfa 2b32. En una serie de 26 niños, se describe este efecto adverso en 5, con alteraciones permanentes en 3 de ellos36. De los que presentaron déficits permanentes, dos habían sido tratados desde el primer mes de edad hasta los 9 meses y los hallazgos aparecieron a los 17 meses de edad, mientras que el tercero había recibido un tratamiento durante 21 meses antes de aparecer sus síntomas. De forma significativa, los pacientes que desarrollaron problemas neurológicos en la serie de Greinwald y col29 habían comenzado el tratamiento con IFN alfa 2a a una edad más temprana (4,7 meses) que los que no presentaron síntomas de este tipo (11,1 meses). La gravedad de este efecto secundario hace que se limite su indicación a pacientes con hemangiomas con compromiso vital o funcional severo refractarios a corticoides, en los cuales se realizarán exámenes neurológicos regulares para descartar la aparición de neurotoxicidad. La naltrexona, un antagonista opioide de larga duración, ha sido usado en algunos pacientes para tratar los efectos adversos neuropsiquiátricos derivados del tratamiento con IFN37.
Citotóxicos
Aunque los citotóxicos tradicionalmente son usados en enfermedades malignas, en ocasiones se administran en enfermedades biológicamente benignas con complicaciones potencialmente graves, como algunos hemangiomas.
Bleomicina
La bleomicina intralesional ha sido usada con éxito en una serie de 14 hemangiomas, observándose una fibrosis y resolución espontánea de las lesiones tras 2 ó 3 tratamientos con 2 mg de bleomicina separados 30 días38. También resulta eficaz en hemangiomas dolorosos y en hemangiomas ulcerados39. Además de su efecto citotóxico la bleomicina induce una esclerosis local de las células endoteliales, por lo que también es efectiva en una malformación linfática, el higroma quístico40.
Vincristina
La vincristina es efectiva en hemangiomas grandes con pronóstico severo y en tumores vasculares asociados al fenómeno de Kasabach-Merritt. A dosis bajas actúa como inhibidor de la angiogénesis en tumores de modelos murinos. Se administra semanalmente, de forma intravenosa a través de un catéter central, por su poder cáustico, a dosis de 0,05 mg/kg en niños de menos de 10 kg y a 1,5 mg/m2 en aquellos que superen este peso1,41.
Ciclofosfamida
De igual forma que la vincristina, la ciclofosfamida a dosis bajas también actúa como inhibidor de la angiogénesis en tumores de modelos murinos. Se ha descrito efectiva en linfangiomas cervicales42 y en un lactante de 15 semanas con múltiples hemangiomas cutáneos, afectación hepática e insuficiencia cardíaca congestiva refractaria a corticoides, en el que se obtuvo respuesta tras 2 ciclos de ciclofosfamida separados por 10 días43.
Pingiangmicina
Es un antibiótico producido por Streptomyces pingyangensisn, químicamente similar a la bleomicina, con efecto antiangiogénico, que altera el endotelio y tiene una acción esclerosante44. Su uso está extendido en Oriente para el tratamiento de varias neoplasias y ha sido administrado con éxito en hemangiomas infantiles comunes en diferentes series, bien en monoterapia45, o combinado con cirugía46, o con morruato sódico y dexametasona47.
Otros tratamientos entre la medicina y la cirugía
Compresión neumática intermitente y continua
El mecanismo de acción es desconocido, pero es un procedimiento efectivo en hemangiomas localizados en las extremidades. Es aplicable tanto a hemangiomas en fase proliferativa como involutiva48, utilizándose aparatos de presión intermitente (neumática) y continua (bandas elásticas49 y bandas autoadhesivas50). Algunos detractores consideran que es difícil atribuir a la compresión la mejoría clínica de las lesiones tratadas, y que debe considerarse la posibilidad de la involución natural51.
Crioterapia
En Europa existe más experiencia que en Estados Unidos con la crioterapia para el tratamiento de los hemangiomas. No obstante, es una técnica poco extendida para este fin. Se ha descrito una variante con un dispositivo que funciona a -32ºC y también un método de crioterapia de contacto precoz que utiliza un aplicador con temperatura constante que proporciona buenos resultados cosméticos52. Esta última opción se ha mostrado igualmente efectiva frente al láser de colorante pulsado en hemangiomas superficiales y más efectivo en los profundos o mixtos53. Sus detractores argumentan que faltan estudios comparativos con otras formas de tratamiento o con la ausencia de tratamiento1. Entre los efectos adversos está el hecho de ser un procedimiento doloroso, así como la atrofia cutánea, formación de cicatrices y cambios de pigmentación, con frecuencia persistentes54.
Radioterapia
Fue muy utilizada en hemangiomas y malformaciones vasculares hasta principios de la década de los 60, con resultados estéticamente poco aceptables y complicaciones a largo plazo55. Entre las posibles indicaciones se encuentra el fenómeno de Kasabach-Merritt, la presencia de múltiples hemangiomas con afectación visceral17, o bien lesiones con compromiso vital u orgánico que no hayan respondido a otros tratamientos médicos y/o quirúrgicos56. Aunque parece ser un procedimiento efectivo (en torno a un 50% de las lesiones radiadas pueden regresar), tiene el inconveniente asociado de favorecer un efecto carcinogénico cutáneo57. Se han descrito otras técnicas, como el implante de gránulos de oro radiactivos, con más efectividad que la radioterapia convencional en una pequeña serie de hemangiomas de laringe58. Por otro lado, la radioterapia en hemangiomas periorbitarios conllevaba un potencial riesgo de complicaciones oculares, hoy en día subsanadas con técnicas más modernas59.
Implantación de metales intralesionales
La implantación de agujas de cobre ha sido descrita en la literatura oriental60, e igualmente en otorrinolaringología61 han sido utilizadas semillas de magnesio intralesionales en hemangiomas, con buenos resultados. Su mecanismo de acción se basa en un daño tisular oxidativo no específico.
Embolización
La indicación más frecuente son los hemangiomas hepáticos. En ocasiones puede ser un tratamiento de segunda línea en hemangiomas alarmantes, tras los corticoides sistémicos y el IFN, de forma aislada o asociada a tratamiento médico o quirúrgico17. Su eficacia real en hemangiomas superficiales extensos aún está por dilucidar, mientras que en hemangiomas hepáticos con insuficiencia cardiaca asociada mejoran el rendimiento cardíaco62. Se ha descrito una respuesta favorable a la embolización con N-butil-2-cianoacrilato, combinada con corticoides sistémicos, en un hemangioma cutáneo asociado a paraparesia (síndrome de Cobb63). La embolización debe ser realizada sólo por equipos habituados a esta técnica, ya que en los neonatos y lactantes las arteriografías selectivas son difíciles de realizar y los vasos, pequeños y estrechos, tienen tendencia al espasmo arterial y a la trombosis16. Las complicaciones incluyen accidentes cerebrales vasculares, embolización distal en otros órganos64 y necrosis cutánea17.
Escleroterapia
Este procedimiento se realiza con un agente esclerosante, en muchas ocasiones alcohol etílico (etanol), tetradecilsulfato sódico o Ethibloc. Resulta una técnica preferible a la embolización, ya que no es preciso realizar una arteriografía y las complicaciones tipo accidentes vasculares cerebrales son poco probables17. Como efectos adversos se han descrito necrosis cutánea y parálisis nerviosa periférica65. Recientemente se ha utilizado con éxito la escleroterapia con solución de oleato de monoetanolamina en un hemangioma en la cara de lenta involución66, y con suero hipertónico salino al 30% en cuatro pacientes con hemangiomas en el glande, que presentaron una regresión completa67.
Situaciones especiales
Hemangiomas ulcerados
La ulceración ocurre en el 10% de los hemangiomas y constituye la complicación más frecuente. Generalmente ocurre en lugares expuestos a traumatismos, y tiene lugar durante la fase de proliferación, por lo que no debe interpretarse como un signo de involución. Se asocia a dolor importante, sangrado, sobreinfección secundaria y cicatriz residual.
La aplicación de apósitos de poliuretano puede ayudar al cierre de estas úlceras, ejerciendo de barrera entre el ambiente y la lesión, y disminuyendo el dolor. En algunas localizaciones como el periné, estos apósitos presentan una baja adherencia, por lo que puede ser de utilidad aplicar una crema con efecto barrera o bien una gasa vaselinada1. Por otro lado, hay escasos estudios controlados que valoren la eficacia de tratamientos habituales de los hemangiomas, como los corticoides y el IFN, en las ulceraciones. En una revisión reciente, se administraron corticoides sistémicos a 21 pacientes con hemangiomas ulcerados, sin apreciar mejoría en 5 de ellos68, que curiosamente cicatrizaron tras tratamiento con IFN alfa-2-a sin efectos neurológicos adversos.
El láser de colorante pulsado parece conseguir un excelente índice de curación de la ulceración y además se asocia a una mejoría del dolor.
Se pueden utilizar varios antibióticos tópicos para prevenir o tratar la infección, como por ejemplo mupirocina, bacitracina y metronidazol. También se recomienda el uso de antibióticos sistémicos de forma empírica previo al resultado del antibiograma.
La aplicación tópica de lidocaína conduce a un alivio temporal del dolor, aunque debe informarse sobre los riesgos de su sobredosis. Se pueden asociar analgésicos orales como paracetamol, sólo o en combinación con codeína, hasta que comience la curación1.
Tratamiento del fenómeno de Kasabach-Merritt
Los pacientes con este fenómeno presentan en realidad tumores vasculares tipo hemangioendotelioma kaposiforme y angioma en penacho, y no hemangiomas clásicos69. Está justificada una actitud terapéutica agresiva debido a la alta mortalidad asociada a este fenómeno. Como primera elección se suelen utilizar corticosteroides sistémicos e IFN. La respuesta es variable, por lo que algunos estudios recomiendan tratamiento con citostáticos como vincristina y ciclofosfamida70, y posible complementación con pentoxifilina71, ácido aminocaproico y ácido tranexámico. También la combinación de varios tratamientos incluyendo factor estimulante de colonias de granulocitos y macrófagos72, embolización, y exéresis quirúrgica deben ser considerados. Si lo anterior no es suficiente, puede indicarse la radioterapia.
Perspectivas futuras
Recientemente Martínez y col73 han utilizado imiquimod al 5% en dos pacientes de 7 y 4 meses afectos de hemangioma infantil común, obteniendo regresión completa sin efectos secundarios. La aplicación de imiquimod libera citocinas endógenas como el IFN alfa, que pueden explicar este efecto.
También anecdóticamente, en un hemangioma ulcerado refractario a otros tratamientos se apreció un buen resultado con la aplicación tópica de factor de crecimiento derivado de las plaquetas, acción a priori paradójica por el efecto proangiogénico de esta citocina74.
La terapia fotodinámica con Verteporfin® actúa induciendo una coagulación mediada por luz, y ha sido empleada con éxito en hemangiomas coroideos refractarios a otros tratamientos75 sin encontrarse efectos adversos; por tanto, parece lógico pensar que este tratamiento podría tener resultados satisfactorios en hemangiomas cutáneos. Aunque resulte curioso, estudios recientes demuestran que las bayas comestibles suprimen la angiogénesis y la expresión de VEGF en hemangiomas76. El Oxi4503 es otro novedoso agente con acción frente a tumores vasculares como el hemangioendotelioma, que podría tener un papel en los hemangiomas en el futuro.
Finalmente, el cidofovir, un potente antiviral comercializado para el tratamiento de la retinitis por citomegalovirus en pacientes con SIDA, ha demostrado su eficacia en un modelo murino de angiomatosis77.
BIBLIOGRAFÍA
1. Bruckner AL, Frieden IJ. Hemangiomas of infancy. J Am Acad Dermatol 2003; 48: 477-493. [ Links ]
2. Lister WA, Camb MD. The natural history of strawberry nevi. Lancet 1938; 1429- 1434. [ Links ]
3. Gampper TJ, Morgan RF. Vascular anomalies: hemangiomas. Plast Reconstr Surg 2002; 110: 572-585. [ Links ]
4. Avery JK. Exercise best judgement to avoid suits. J Ark Med Soc 2000; 96: 440-441. [ Links ]
5. Bennet ML, Fleischer AB, Chamlin SL, Frieden IJ. Oral corticosteroid use is effective for cutaneous hemangiomas: An evidence-based evaluation. Arch Dermatol 2001; 137: 1208-1213. [ Links ]
6. Fost NC, Esterly NB. Successful treatment of juvenile hemangiomas with prednisone. J Pediatr 1968; 72: 351-357. [ Links ]
7. Folkman J. Toward a new understanding of vascular proliferative disease in children. Pediatrics 1984; 74: 850-856. [ Links ]
8. Hasan Q, Tan ST, Gush J, Peters SG, Davis PF. Steroid therapy of a proliferating hemangioma: histochemical and molecular changes. Pediatrics 2000; 105: 117-120. [ Links ]
9. Hasan Q, Tan ST, Xu B, Davis PF. Effects of five commonly used glucocorticoids on hemangioma in vitro. Clin Exp Pharmacol Physiol 2003; 30: 140-144. [ Links ]
10. Zweifach BW, Shou Black M. The influence of the adrenal cortex on the behavior of terminal vascular beds. Ann NY Acad Sci 1953; 56: 626-633. [ Links ]
11. Sasaki GH, Pang CY, Wittliff JL. Pathogenesis and treatment of infant strawberry hemangiomas: clinical and in vitro studies of hormonal effects. Plast Reconstr Surg 1984; 73: 359-368. [ Links ]
12. Akyuz C, Yaris N, Kutluk MT, Buyukpamukcu M. Management of cutaneous hemangiomas: a retrospective analysis of 1.109 cases and comparison of conventional dose prednisolone with high dose methylprednisolone therapy. Pediatr Hematol Oncol 2001; 18: 47-55. [ Links ]
13. Williams EF, Stanislaw P, Dupree M, Mourtzikos K, Mihm M, Shannon L. Hemangiomas in infants and children: An algorithm for intervention. Arch Facial Plast Surg 2000; 2: 103-111. [ Links ]
14. Verma K, Verma KK. Infantile periocular haemangioma treated with two days in a week betamethasone oral mini pulse therapy. Indian J Pediatr 2001; 68: 355-356. [ Links ]
15. Boon LM, Mac Donald DM, Mulliken JB. Complications of systemic corticosteroid therapy for problematic hemangioma. Plast Reconstr Surg 1999; 104: 1616-1623. [ Links ]
16. Enjolras O, Riché MC, Merland JJ, Escanda JP. Management of alarming hemangiomas in infancy. A review of 25 cases. Pediatrics 1990; 85: 491-498. [ Links ]
17. Dinehart SM, Kincannon J, Geronemus R. Hemangiomas: Evaluation and treatment. Dermatol Surg 2001; 27: 475-485. [ Links ]
18. Fernández-Vozmediano J, Nieto I. Terapéutica de los angiomas. En: Curso de actualización en Dermatología para médicos internos y residentes. Madrid. Fundación salud y comunicación 1996. [ Links ]
19. Hu Q, Lin X, Shang Q, Dong J, Qi Z, Wang W. The determination and significance of VEGF in the serum of hemangioma patients. Zhonghua Zheng Xing Wai Ke Za Zhi 2002; 18: 98-100. [ Links ]
20. Thedenat B, Leaute-Labreze C, Boralevi F, Roul S, Labbe L, Marlier V et al. Surveillance tensionnelle des nourrisons traites par corticotherapie generale pour un hemangioma. Ann Dermatol Venereol 2002; 129: 183-185. [ Links ]
21. Hyams JS, Carey DE. Corticosteroids and growth. J Pediatr 1980; 113: 249-253. [ Links ]
22. Azzolini A, Nouvenne R. Nuove prospettive nella terapia degli angiomi immaturi dell´infanzia: 115 lesione trátate con infiltración intralesionali di triamcinolone acetonide. Ateneo Parmense (Acta Biomed) 1970; (Supl): 41-51. [ Links ]
23. Kushner BJ. The treatment of periorbital infantile hemangioma with intralesional corticosteroid. Plast Reconstr Surg 1985; 76: 517-524. [ Links ]
24. Sutula FC, Glover AT. Eyelid necrosis following intralesional corticosteroid injection for capillary hemangioma. Ophtalmic Surg 1987; 18: 103-105. [ Links ]
25. Shorr N, Seiff SR. Central retina artery oclusion associated with periocular corticosteroid injection for juvenile hemangioma. Ophtalmic Surg 1986; 17: 229-231. [ Links ]
26. Elsas FJ, Lewis AR. Topical treatment of perioocular capillary hemangioma. J Pediatr Ophtalmol Strabismus 1993; 30: 4-7. [ Links ]
27. Weber G. The treatment of cavernous haemangioma with topical betamethasone 17 valerate. Br J Dermatol 1973; 89: 649-651. [ Links ]
28. White CW, Sondheimer HM, Croach EC, Wilson H, Fan LL. Treatment of pulmonary hemangiomatosis with recombinant interferon alfa 2 a. N Engl J Med 1989; 320: 1197-1200. [ Links ]
29. Greinwald JH, Burke DK, Bonthius DJ, Bauman NM, Smith RJH. An update on the treatment of hemangiomas in children with interferon alfa 2 a. Arch Otolaryngol Head Nech Surg 1999; 125: 21-27. [ Links ]
30. Rampini E, Rampini P, Occella C, Bleidl D. Interferon alpha 2b for treatment of complex cutaneous hemangiomas of infancy: a reduced dosage schedule. Br J Dermatol 2000; 142: 189-191. [ Links ]
31. Garmendia G, Miranda N, Borroso S, Longchong M, Martínez E, Ferrero J et al. Regresión of infancy hemangiomas with recombinant IFN-alpha 2b. J Interferon Cytokine Res 2001; 21: 31-38. [ Links ]
32. Dubois J, Hershon L, Carmant L, Belanger S, Leclerc JM, David M. Toxicity profile of interferon alfa 2 b in children: a prospective evaluation. J Pediatr 1999; 135: 782-785. [ Links ]
33. MacArthur CJ, Senders CW, Katz J. The use of interferon alfa 2a for life threatening hemangiomas. Arch Otolaryngol Head Neck Surg 1995; 121: 690-693. [ Links ]
34. Blei F, Isakoff M, Deb G. The response of parotid hemangiomas to the use of systemic interferon alfa 2a or steroids. Arch Otolaryngol Head Neck Surg 1997; 123: 841-844. [ Links ]
35. Anger J, Carneiro RG, Pinus J, Ernesto JM, Faiwichow G. The rebound effect in the treatment of complex hemangioma with interferon alpha 2 A. Rev Paul Med 1998; 116: 1826-1828. [ Links ]
36. Barlow CF, Priebe CJ, Mulliken JB, Barnes PD, Mac Donald D, Folkman J et al. Spastic diplegia as a complication of interferon alfa 2 a treatment of hemangiomas of infancy. J Pediatr 1998; 132: 527-530. [ Links ]
37. Valentine AD, Meyers CA, Talpaz M. Treatment of neurotoxic side effects of interferon alfa with naltrexone. Cancer Invest 1995; 13: 561-566. [ Links ]
38. Sarihan H, Mocan H, Yildiz K, Abes M, Akyazici R. A new treatment with bleomycin for complicated cutaneous hemangioma in children. Eur J Pediatr Surg 1997; 7: 158-162. [ Links ]
39. Kullendorf CM. Efficacy of bleomycin treatment for symptomatic hemangiomas in children. Pediatr Surg Int 1997; 12: 526-528. [ Links ]
40. Oxford A, Barker A, Thonell S et al. Bleomycin therapy for cystic hygroma. J Pediatr Surg 1995; 30: 1282-1287. [ Links ]
41. Tozon N, Sersa G, Cemazar M. Electrochemotherapy: potentiation of local antitumor effectiveness of cisplatin in dogs and cats. Anticancer Res 2001; 21: 2483-2488. [ Links ]
42. Turner C, Gross S. Treatment of recurrent suprahyoid cervicofacial lymphangioma with intravenous cyclophosphamide. Am J Pediatr Hematol Oncol 1994; 16: 325-328. [ Links ]
43. Hurvitz SA, Hurvitz CH, Sloninsky L, Sanford MC. Successful treatment with cyclophosphamide of life threatening diffuse hemangiomatosis involving the liver. J Pediatr Hematol Oncol 2000; 22: 527-532. [ Links ]
44. Gao Q, wang C, Wen Y, Li L, Zhang J, He Z, Yang Z. An experimental study on effects of pingyangmycin on vessels. Hua Xi Kou Qiang Yi Xue Za Zhi 2001; 19: 184-187. [ Links ]
45. Wu L, Sun G. Treatment of hemangioma with an angiogenesis inhibitor pingyangmycin. Ind Pediatr 2000; 37: 636-639. [ Links ]
46. Zhong G, Ma Q, Shao Z. Inner hemangioma ligation and pingyangmycin injection in hemangioma (with 30 cases report). Zhongzhua Zheng Xing Wai Ke Za Zhi 2000; 16: 133-135. [ Links ]
47. Shou B, Meng Z, Yang Z, Zhang Z, Xu J. Effects of pinyangmycin, dexamethasone and sodium morrhuate injection on treatment of cavernous hemangioma in maxillofacial regions. Hua Xi Kou Qiang Yi Xue Za Zhi 2000; 18: 40-47. [ Links ]
48. Miller SH, Smith RL, Schochat SJ. Compression treatment of hemangiomas. Plast Reconstr Surg 1976; 58: 573-579. [ Links ]
49. Kaplan M, Paller As. Clinical Pearl: use of self-adhesive, compressive wraps in the treatment of limb hemangiomas. J Am Acad Dermatol 1995; 32: 117-118. [ Links ]
50. More AM. Pressure in the treatment of giant hemangioma with purpura. Case report and observations. Plast Reconstr Surg 1964; 34: 606. [ Links ]
51. Zvulunov A, Metzker A. Hemangiomas and vascular malformations. Unapproved treatments. Clin Dermatol 2002; 20: 660-667. [ Links ]
52. Reischle S, Schuller-Petrovic S. Treatment of capillary hemangiomas of early childhood with a new method of cryosurgery. J Am Acad Dermatol 2000; 42: 809-813. [ Links ]
53. Michel S, Wlotzke U, Hohenleutner U, Landthaler M. Laser und kryotherapie der Sauglingshamangiome in direkten Vergleich. Hautarzt 1998; 49: 192-196. [ Links ]
54. Esterly NB. Hemangiomas. En: Harper J, Oranje A, Prose N, editors. Textbook of pediatric dermatology. Oxford: Blackwell Science, 2000: 997-1016. [ Links ]
55. Fox H. Congenital abnormalities. En: Fox H, Storrs RS, editors. Diseases of the skin in infancy and childhood. New York: Appleton & Co, 1930: pp.1-13. [ Links ]
56. Ogino I, Torikai K, Kobayasi S, Aida N, Hata M, Kigasowa H. Radiation therapy for life- or function-threatening infant hemangioma. Radiology 2001; 218: 834-839. [ Links ]
57. Li F, Cassady JR, Barnett E. Cancer mortality following irradiation in infancy for hemangiomas. Radiology 1974; 113: 177-178. [ Links ]
58. Benjamin B. Treatment of infantile subglottic hemangioma with radioactive gold grain. Ann Otol Rhinol Laryngol 1978; 87: 18-21. [ Links ]
59. Mierzwa ML, Barrett WL, Gluckman JL. Radiation therapy for recurrent orbital hemangioma. Head Neck 2003; 25: 412-415. [ Links ]
60. Wang D. Retained copper needles for the treatment of cavernous hemangioma. Zhonghua Zheng Xing Shao Shan Wai Ke Za Zhi 1993; 9: 321-396. [ Links ]
61. Staindl O. Treatment of hemangiomas of the face with magnesium seeds. Arch Otorhinolaryngol 1989; 246: 213-217. [ Links ]
62. Brunelle FO, Chaumont P, Teillac D, Manach Y, Lallemand D. Facial vascular malformations in children. Conventional and digital, diagnostic and therapeutic angiography. Pediatr Radiol 1988; 18: 377-382. [ Links ]
63. Soeda A, Sakai N, Iihara K, Nagata I. Cobb syndrome in an infant; treatment with endovascular embolization and corticosteroid therapy: case report. Neurosurgery 2003; 52: 711-715. [ Links ]
64. Tonner PH, Scholz J. Possible lung embolism following embolization of a hemangioma with fibrin glue. Anaesthesist 1994; 43: 614-617. [ Links ]
65. Winter H, Drager E, Sterry W. Sclerotherapy for treatment of hemangiomas. Dermatol Surg 2000; 26: 105-108. [ Links ]
66. Matsumoto K, Nakanishi H, Koizumi Y, Seike T, Kanda I, Kubo Y. Sclerotherapy of hemangioma with late involution. Dermatol Surg 2003; 29: 668-671. [ Links ]
67. Hemal AK, Aron M, Wadhwa SN. Intralesional sclerotherapy in the management of hemangiomas of the glans penis. J Urol 1998; 159: 415-417. [ Links ]
68. Kim HJ, Colombo M, Frieden IJ. Ulcerated hemangiomas: clinical characteristics and response to therapy. J Am Acad Dermatol 2001, 962-972. [ Links ]
69. Sarkar M, Mulliken JB, Kozakewich HPW, Robertson RL, Burrows PE. Thrombocytopenic coagulopathy (Kasabach-Merritt phenomenon) is associated with Kaposiform hemangioendothelioma and not with common infantile hemangioma. Plast Reconstr Surg 1977; 100: 1377-1386. [ Links ]
70. Perez-Payarols J, Pardo-Masferrer J, Gomez-Bellvert C. Treatment of life-threatening infantile hemangiomas with vincristine. N Engl J Med 1995; 333: 69. [ Links ]
71. De Prost Y, Teillac D, Bodemer C, Enjolras O, Nihoul-Fekete C, De Prost D. Successful treatment of Kasabach-Merritt syndrome with pentoxifylline. J Am Acad Dermatol 1991; 25: 854-855. [ Links ]
72. Illum N, Karlsmark T, Svejgaard E, Ullman S, Yssing M. Ulcerated haemangioma successfully treated with interferon alfa-2b and topical granulocyte-macrophage colony-stimulating factor. Dermatology 1995; 191: 315-317. [ Links ]
73. Martinez MI, Sánchez-Carpintero I, North PE, Mihm MC Jr. Infantile hemangioma: Clinical resolution with 5% imiquimod cream. Arch dermatol 2002; 138: 881-884. [ Links ]
74. Sugarman JL, Mauro TM, Frieden IJ. Treatment of an ulcerated hemangioma with recombinant platelet-derived growth factor. Arch Dermatol 2002; 138: 314-316. [ Links ]
75. Jurklies B, Anastassiou G, Ortmans S, Schuler A, Schilling H, Schmidt-Erfurth U et al. Photodynamic therapy using verteporfin in circumscribed choroidal haemangioma. Br J Ophtalmol 2003; 87: 84-89. [ Links ]
76. Atalay M, Gordillo G, Roy S, Rovin B, Bagchi D, Bagchi M et al. Anti-angiogenic property of edible berry in a model of hemangioma. FEBS Lett 2003; 544: 252-257. [ Links ]
77. Liekens S, Andrei, G, Vandeputte M, De Clercq E, Neyts J. Potent inhibition of hemangioma formation in rats by the acyclic nucleoside phosphonate analogue cidofovir. Cancer Res 1998; 58: 2562-2567. [ Links ]