Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Anales del Sistema Sanitario de Navarra
versión impresa ISSN 1137-6627
Anales Sis San Navarra vol.27 supl.1 Pamplona 2004
Láser y luz pulsada intensa en el tratamiento de hemangiomas infantiles y
malformaciones vasculares
Laser and intense pulsed light in the treatment of infantile haemangiomas
and vascular malformations
I. Sánchez-Carpintero1, M.C. Mihm2, M. Waner3
|
RESUMEN El uso de las indicaciones del láser en el manejo de las malformaciones vasculares y los hemangiomas infantiles se fundamenta en la teoría de la fototermolisis selectiva, siendo la oxihemoglobina el cromóforo diana sobre el cual actúa la luz del láser, evitándose así el daño a tejidos vecinos. El láser de colorante pulsado es el más utilizado y es, actualmente, el tratamiento de elección en las malformaciones capilares (mancha en vino de Oporto). La respuesta obtenida es variable, alcanzándose un aclaramiento sustancial del color de la lesión, tras varias sesiones. La aplicación en edades tempranas parece mejorar los resultados. Las malformaciones venosas, especialmente las localizadas en la mucosa, responden mejor al láser de Nd:YAG; las malformaciones linfáticas al láser de CO2. Las malformaciones arteriovenosas raramente responden. El uso del láser de colorante pulsado en la fase proliferativa de los hemangiomas es controvertido, excepto si existe ulceración. En estos casos se obtiene una reepitelización rápida tras su empleo. En la fase involutiva, los pacientes con lesiones residuales vasculares pueden beneficiarse de otros láseres como KTP o Nd:YAG. Si presentan superficie atrófica y cicatrices mejoran con láser de CO2 o Er:YAG. Están emergiendo nuevas modalidades como la terapia fotodinámica cuya eficacia y seguridad, tanto en el tratamiento de los hemangiomas como de las malformaciones vasculares, está aún por confirmar. |
ABSTRACT The use of the indications of the laser in treating vascular malformations and infantile haemangiomas is based on the theory of selective photothermolysis, in which the oxyhaemoglobin is the target chromophore on which the light of the laser acts, thus avoiding damage to neighbouring tissues. The pulsed dye laser is the most employed and at present is the treatment of choice in capillary malformations (port-wine stains). A variable response is obtained, with a substantial clearing of the colour of the lesion after several sessions. Application at early ages seems to improve the results. Venous malformations, especially those localised in the mucosa, respond better to the Nd:YAG laser; lymphatic malformations to the CO2 laser. Arteriovenous malformations rarely respond. Use of the pulsed dye laser in the phase of proliferation of the haemangiomas is subject to controversy, except where there is ulceration. A rapid re-epithelialization is obtained in these cases following its use. In the involution phase, patients with residual vascular lesions can benefit from other lasers such as KTP or Nd:YAG. If they show an atrophic surface and scars these complications improve with the CO2 laser or Er:YAG. New treatment modalities are emerging, such as photodynamic therapy, whose efficacy and safety, both in the treatment of haemangiomas and vascular malformations, have yet to be confirmed. Key words. Pulsed dye laser. Port-wine stain. Haemangioma. Nd:YAG laser. Vascular malformation.
|
| 1. Área de Hemangiomas y Malformaciones Vasculares. Dpto. Dermatología, Clínica Universitaria. Universidad de Navarra. Pamplona. 2. Dermatopathologist. Massachussetts General Hospital. Bostonm Massachusetts. USA. 3. Vascular Anomalies Center of Excellence. Arkansas Childrens Hospital. Little Rock, | Correspondencia: |
INTRODUCCIÓN
Para comprender y aplicar correctamente un determinado láser debe conocerse bien su fundamento teórico y dominar ciertos conceptos básicos como la interacción láser-tejido (teoría de la termolisis selectiva, concepto de relajación térmica y el significado de los distintos cromóforos, como la oxihemoglobina y la melanina)1, así como diferentes conceptos relacionados con las propiedades de la luz láser (luz monocromática, coherencia espacial, energía y enfocabilidad), modos de emisión de láser (continuo, seudocontinuo o pulsado) y las consecuencias derivadas de la modificación de parámetros como la longitud de onda empleada, la fluencia o densidad de energía, el tamaño del haz de luz y la duración del pulso2. La modificación y correcta combinación de estos parámetros permitirá realizar un tratamiento eficaz, minimizando a su vez la incidencia de efectos secundarios indeseables y obteniéndose el máximo beneficio terapéutico. Otro aspecto importante es el conocimiento de los sistemas de refrigeración acoplados a la mayoría de los láseres, cuya función principal es la de reducir el riesgo de daño epidérmico. En el caso concreto de las lesiones vasculares el cromóforo diana es la oxihemoglobina, molécula que tiene picos de absorción de energía lumínica a distintas longitudes de onda: 418 nm, 543 nm y 577 nm. El pico de absorción máxima se sitúa a los 418 nm pero a esta longitud de onda el láser penetra poco y además la competencia con la melanina es muy alta. Por tanto, aunque alrededor de 577 la absorción sea menor, la penetrabilidad aumenta (a mayor longitud de onda mayor penetrancia en los tejidos) y también disminuye mucho la competencia con la melanina, evitándose así efectos secundarios indeseables como la aparición de hipopigmentación. Actualmente, los láseres comercializados, para adaptarse a la teoría de la fototermolisis selectiva, tienen una longitud de onda que oscila entre 585 y 600 nm, de tal forma que, sin perder la afinidad por la oxihemoglobina, permiten alcanzar una profundidad mayor.
Se presentan en este trabajo el empleo de láser en los hemangiomas y en las malformaciones vasculares según la clasificación de la Sociedad Internacional para el Estudio de las Anomalías Vasculares (ISSVA). El uso del láser en hemangiomas no esta todavía bien definido, variando los criterios de uso entre los diferentes autores. En relación con las malformaciones vasculares expondremos todas ellas a excepción de las malformaciones arterio-venosas, ya que tienen una escasa o nula respuesta terapéutica a esta modalidad.
HEMANGIOMAS INFANTILES
Consideraciones generales
De todos los modelos comercializados el láser más frecuentemente empleado para las lesiones vasculares en la edad infantil es el láser de colorante pulsado3. Este láser se diseñó inicialmente para el tratamiento de la mancha en vino de Oporto, extendiéndose posteriormente su uso a otras enfermedades vasculares, como los hemangiomas infantiles. Los buenos resultados obtenidos en la edad infantil en la mancha en vino de Oporto han contribuido a extender cada vez más su uso, ya que es un procedimiento seguro, con pocos efectos secundarios3. La luz emitida por el láser de colorante pulsado es una luz amarilla de 585, 590, 595 ó 600 nm, según los diferentes modelos disponibles en el mercado, en pulsos de duración variable, de entre 450 ms y 1,5 ms. La oxihemoglobina presente en el interior de los eritrocitos de los vasos absorbe la luz a esta determinada longitud de onda, convirtiéndose en energía térmica que calienta y destruye los glóbulos rojos y por difusión hace estallar la pared de los capilares sanguíneos. Este último efecto se traduce clínicamente por la presencia de púrpura inmediata tras el tratamiento, que tiene una duración aproximada de entre 10 y 14 días. Debido a la afinidad de la oxihemoglobina y a la aplicación de un pulso lo suficientemente corto para producir daño exclusivamente en los vasos sanguíneos, según la teoría de la fototermolisis selectiva, las estructuras vecinas quedan indemnes, evitándose así el riesgo de cicatrización anómala ulterior.
Los criterios de utilización del láser en hemangiomas infantiles no están bien definidos hoy en día. Este problema se debe, en parte, al hecho de intentar aplicar los mismos parámetros que se usan en el tratamiento de la mancha en vino de Oporto. Al tratarse de entidades completamente diferentes, con un comportamiento biológico distinto, ni la frecuencia de administración de láser ni la densidad de energía empleada ha de ser la misma. Hacen falta estudios clínicos que definan los parámetros de tratamiento más eficaces para los hemangiomas. Otra limitación del láser de colorante en el tratamiento de los hemangiomas es su baja penetrabilidad, ya que no alcanza más de 1mm de profundidad. En este sentido, en un intento de paliar este problema, algunos autores han empleado o recomendado el uso de otros láseres como el láser de argón, capaz de penetrar más. Sin embargo el riesgo de efectos secundarios, como por ejemplo el desarrollo de cicatrices o cambios en la textura de la piel, son también más altos4. La administración de otro tipo de láser como el láser de Nd:YAG aunque también penetra más en la piel, se acompaña de una alta tasa de efectos secundarios5,6.
Fase proliferativa
El uso del láser durante la fase proliferativa es una de las cuestiones más controvertidas. Se ha planteado si el láser de colorante pulsado aplicado de forma muy precoz sobre un hemangioma que empieza a desarrollarse (durante las primeras semanas de vida) es capaz de evitar la progresión de la lesión y por tanto abortar de alguna forma la fase proliferativa. Algunos autores han encontrado resultados alentadores, apreciando una detención del crecimiento7,8. Este hecho se ha observado más frecuentemente en hemangiomas superficiales de pequeño tamaño7,9; sin embargo dichas series son limitadas, con un número insuficiente de pacientes y sobre todo no se comparan con un grupo control. Debido a la historia natural de estos tumores, que tienden a la involución espontánea, los estudios randomizados doble ciego con grupo control son esenciales a la hora de establecer cualquier conclusión o recomendación. Tampoco se conocen bien los efectos del láser en aquellos hemangiomas superficiales que aún no han desarrollado el componente profundo, aunque parece que éste no se evita a pesar de su administración temprana3,10. Finalmente, en un estudio randomizado realizado en pacientes con hemangiomas no complicados, en niños con edad comprendida entre 1 y 14 semanas, se ha demostrado que no hay diferencias al año de vida entre el grupo tratado y el grupo control11. Es más, los pacientes tratados tienen una incidencia superior a desarrollar atrofia de la piel e hipopigmentación residual respecto al grupo no tratado. A la luz de estos resultados y a la espera de otros estudios, se puede concluir que los pacientes subsidiarios de tratamiento con láser de colorante pulsado durante esta fase deben ser cuidadosamente seleccionados en el primer año de vida, debiendo explicarse a los familiares las limitaciones y la variabilidad en la respuesta observada.
Otro aspecto que debe tenerse en cuenta a la hora de decidir la administración de láser es el tipo de hemangioma. Los hemangiomas focales tienen una incidencia menor de complicaciones, mientras que los hemangiomas segmentales tienen un mayor riesgo de desarrollar ulceración especialmente si se administra el tratamiento durante los primeros meses de vida, independientemente de la densidad de energía utilizada. En nuestra experiencia, el uso del láser de colorante pulsado en hemangiomas tratados a partir de los 7-8 meses de edad, consigue aclarar el color y mejorar la textura de la piel. La fluencia utilizada ha de ser lo suficientemente alta como para que se produzca púrpura inmediata. Habitualmente ésta se observa con fluencias de 10J/cm2. Los sistemas de enfriamiento son eficaces a la hora de proteger adecuadamente la piel en estos casos y evitan además efectos indeseables, permitiéndonos la administración de fluencias altas12.
La experiencia con otros láseres en la fase proliferativa es más limitada. El láser de Nd:YAG tiene un riesgo mayor que el láser de colorante pulsado en producir efectos secundarios. En una serie, aplicando este láser a una potencia de 50 w y con un tiempo de exposición de 1 s, se observó la presencia de cicatrices superficiales en todos los casos6. En otro estudio más reciente, sin embargo, aplicando una potencia de entre 35-45 w y una duración de pulso entre 2 y 10 s, y asociado a un sistema de enfriamiento de la epidermis (colocación de cubitos de hielo) antes, durante y después del procedimiento, no se detectaron cicatrices en ningún paciente tratado13. Algunos autores utilizan el láser KTP o Nd:YAG administrándolo de forma intralesional a través de una fibra óptica colocada previamente en el interior de la lesión14,15. Esta técnica es eficaz y consigue reducir el tamaño del hemangioma después de varias sesiones14,16. Sin embargo, la presencia de efectos secundarios como lesiones de nervios periféricos o necrosis cutánea y ulceraciones (20%)15,16, hace desaconsejable en nuestra opinión su empleo. Por otra parte el desarrollo de fibrosis, efecto muy frecuentemente observado después de este tratamiento, puede dificultar la cirugía en los casos en la que ésta sea necesaria.
Fase involutiva
En esta fase existen menos controversias y el uso del láser está más aceptado en general. Durante la fase de involución la aplicación de láser de colorante pulsado puede eliminar parte del componente superficial, mejorando notablemente el aspecto externo3. El componente profundo sin embargo no responde debido a la limitada penetrabilidad del láser3. Los estudios realizados en hemangiomas en fase involutiva son también difíciles de llevar a cabo debido a la enorme variabilidad en su duración, no ya entre diferentes pacientes con hemangiomas, sino entre hemangiomas presentes en el mismo individuo.
Una vez que el hemangioma ha alcanzado la involución, se pueden tratar las telangiectasias residuales y la atrofia cutánea. Los vasos de drenaje del hemangioma habitualmente disminuyen de tamaño al cabo de los años pero en ocasiones persisten. En estos casos, la administración de láseres con mayor penetrabilidad y con capacidad de eliminar vasos de mayor calibre como el láser Nd:YAG o equipos que permitan aplicar fluencias más altas con pulsos más largos como el láser de KTP, pueden ser útiles17. En relación con cicatrices secundarias a ulceración previa, presencia de atrofia de la piel o alteraciones en la textura cutánea los láseres más eficaces son aquellos usados en técnicas de rejuvenecimiento facial como el láser de CO2, Nd:YAG o Erb:YAG.
Hemangiomas ulcerados
La ulceración es la complicación más frecuente de los hemangiomas, apareciendo entre un 5% y un 13% de los casos18,19. Cuando aparece lo hace siempre durante la fase proliferativa, y su curación va seguida de forma invariable al desarrollo de una cicatriz. El problema más acuciante es el tratamiento del dolor de estos niños, que puede prolongarse durante meses. Por otra parte, localizaciones como la mucosa labial o genital, áreas frecuentes de aparición de hemangiomas, se ulceran con frecuencia, interfiriendo con funciones básicas como la alimentación.
La administración de láser de colorante pulsado en hemangiomas ulcerados constituye una de las principales opciones terapéuticas, gracias a los buenos resultados que se obtienen20,21. Se desconoce el mecanismo mediante el cual se consigue una rápida reepitelización de las úlceras, a veces después de una sola sesión, si bien lo habitual es que se necesiten 2 ó 3. Los que mejor responden son los hemangiomas ulcerados de la región perineal y labio. El dolor suele desaparecer también rápidamente, a los pocos días del primer tratamiento21. Los intervalos de aplicación del láser son variables, situándose en torno a las dos semanas21, y la densidad de energía también varía entre 6,5 y 8,5 J/cm220-24. En una serie de 22 pacientes tratados se observó mejoría en el 50%, 4 pacientes no experimentaron cambios, uno empeoró y en 6 se perdió el seguimiento23. Paradójicamente, la administración de láser durante los primeros meses de vida, en hemangiomas segmentales, puede inducir el desarrollo de ulceraciones.
Modalidades futuras
La ausencia de un modelo animal de hemangiomas dificulta que los avances en el tratamiento de estas lesiones ocurran al ritmo deseado. Recientemente, en un modelo murino en el que se indujo el desarrollo de angiosarcomas, se ha estudiado el efecto de otra modalidad terapéutica que requiere del uso de láseres o fuentes de luz: la terapia fotodinámica25. Este procedimiento requiere de la administración de una sustancia fotosensibilizante, habitualmente un derivado de la porfirina, previamente a la exposición de la radiación. Tras la captación selectiva de estas sustancias por las células tumorales o células endoteliales anómalas, y posterior exposición a la radiación lumínica, se induce una reacción fotoquímica con la generación de radicales libres citotóxicos que destruyen el tumor o la malformación vascular. Aunque se tratan de tumores diferentes, existen ciertas similitudes clínicas e histológicas entre el modelo de angiosarcoma utilizado y el hemangioma infantil, hecho que permite inferir los resultados obtenidos a estos últimos. El empleo de terapia fotodinámica en este modelo murino ha resultado ser un tratamiento eficaz. La administración intravenosa de benzoporfirina, previamente a la exposición de un láser de diodo de 690 nm, se tradujo en la eliminación completa de los angiosarcomas de una forma fluencia-dependiente25. Actualmente estamos estudiando si esta modalidad terapéutica es realmente eficaz en humanos, tanto en hemangiomas infantiles como en otras lesiones vasculares como la mancha en vino de Oporto.
MALFORMACIONES VASCULARES
Malformaciones capilares
Usamos el término mancha en vino de Oporto para designar a esta malformación vascular, por ser el más empleado en la literatura anglosajona. Siguiendo la nomenclatura de la ISSVA se debería denominar más correctamente malformación vascular capilar.
La mancha en vino de Oporto está siempre presente desde el momento del nacimiento. Durante los primeros días el diagnóstico puede ser complejo y debe diferenciarse de un posible traumatismo sufrido durante el parto, de la mancha salmón, de hemangiomas congénitos, etc. Antes de iniciar el tratamiento se debe tener certeza del diagnóstico pues como ha sido mencionado anteriormente, si tratamos un hemangioma segmental con láser podemos inducir una ulceración. Aunque existen controversias acerca del momento más apropiado para iniciar la aplicación del láser, en general, se admite que debe ser lo más precoz posible26. Aquellos pacientes que reciban tratamiento temprano obtendrán un mayor beneficio del láser ya que en edades tempranas la piel es más fina y los vasos sanguíneos tienen un calibre más pequeño. Así, se cree que el número de sesiones requeridas en niños es menor, como consecuencia de haber una respuesta más rápida26. Sin embargo otros autores no han encontrado una respuesta mejor en este grupo de edad tratado precozmente. Independientemente de la controversia creada acerca de si el tratamiento precoz consigue mejor o iguales resultados, el hecho bien constatado de las repercusiones psicológicas observadas de forma más clara durante la infancia hace aconsejable un tratamiento temprano. En nuestra práctica comenzamos el tratamiento en torno a los 3 meses de edad.
Uno de los inconvenientes del tratamiento temprano es la necesidad de utilizar, en la mayoría de los casos, anestesia general (sedación) ya que el procedimiento es doloroso y provoca angustia y ansiedad. La introducción de diferentes sistemas de enfriamiento de la superficie cutánea, como la aplicación dinámica de criógeno pulverizado (tetrafluoroetano), previamente a la irradiación con láser, o la aplicación constante de aire frío27, puede evitar en algunos casos la anestesia. Otra ventaja que permiten estos sistemas de enfriamiento es la utilización de energías más altas, minimizando al mismo tiempo el riesgo de daño epidérmico28. De todas formas, en la edad infantil, a pesar de estos nuevos sistemas de enfriamiento, la anestesia sigue siendo necesaria en la mayoría de los casos, especialmente cuando las lesiones se localizan en áreas más sensibles como el labio, región periocular o cuando se tratan lesiones extensas. La decisión final sobre el uso de anestesia deberá tomarse conjuntamente entre la familia y el médico.
Los efectos secundarios más frecuentemente descritos tras la aplicación del láser de colorante pulsado son la aparición de ampollas y costras, hiperpigmentación, hipopigmentación, desarrollo de cicatrices atróficas o hipertróficas e infecciones. Las ampollas y costras se observan a las pocas horas del tratamiento y raramente dejan cicatrices residuales tras su resolución. El efecto secundario más frecuente, según una serie amplia, es la hiperpigmentación, complicación que suele resolverse de forma espontánea en 6-12 meses29. La aparición de cicatrices atróficas o hipertróficas es siempre motivo de preocupación dado su posible carácter permanente, especialmente de estas últimas. La incidencia varía según las distintas series, habiéndose descrito hasta en un 5% de los casos29. El mecanismo de aparición es desconocido. Se ha sugerido que depende más del número de tratamientos que de una susceptibilidad personal. En este sentido la realización de un test de prueba no es útil para descartar su aparición.
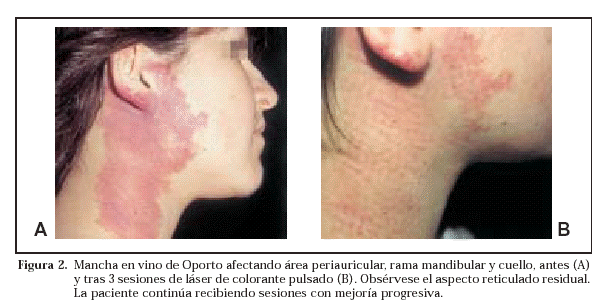
El láser de colorante pulsado es por tanto el gold standard para el tratamiento de la mancha en vino de Oporto, de modo particular en niños, ya que la incidencia de cicatrices es muy baja3. Sin embargo, a pesar de los significantes avances alcanzados en este campo durante los últimos 20 años, este tratamiento aún no es el ideal. En general, se precisan de 4 a 8 sesiones para obtener respuestas satisfactorias y raramente se consigue eliminar por completo la malformación (Figs. 1 y 2).
Además, hasta un tercio de los pacientes no responden a pesar de administrarse múltiples sesiones. Uno de los factores que pueden contribuir a esta ausencia de respuesta puede ser la limitada penetrabilidad del láser en el tejido (0,5 a 1mm), que impide tratar vasos localizados a mayor profundidad30.
Se han estudiado diferentes factores para tratar de dilucidar qué pacientes van a responder de una manera más efectiva. Así por ejemplo, la localización de las lesiones y el color de las mismas condicionan, según diferentes series, el grado de respuesta. Concretamente, lesiones situadas en V2 responden peor que las que afectan V1 ó V331; la cara y cuello responde claramente mejor que lesiones situadas en el resto de la superficie anatómica32. Respecto al color algunos autores obtienen mejores respuestas en lesiones rosadas33 y otros en lesiones rojizas34; y otros no encuentran diferencias32. Parece claro que uno de los factores que influyen en el grado de respuesta alcanzado se debe a la profundidad a la que se encuentren los vasos. Así, en un estudio histológico realizado antes de la aplicación del láser, en un grupo de 22 pacientes con mancha en vino de Oporto, se ha observado una respuesta más eficaz en aquellos pacientes cuyos vasos se encuentran localizados más superficialmente en la dermis35. Se han ensayado otros métodos objetivos para predecir la respuesta de un individuo, como por ejemplo el examen de la piel afecta mediante epiluminiscencia. La presencia de un velo grisáceo indicaría, según este estudio, la presencia de vasos situados a mayor profundidad36. Otros métodos son la espectrofotometría de reflectancia37, el uso de ecografía de alta resolución38 o el uso conjunto de dermatoscopia con videomicroscopía39.
Los parámetros del láser de colorante pulsado utilizados varían entre las diferentes series dificultando de esta forma los estudios comparativos. En líneas generales los parámetros más utilizados varían entre los siguientes valores: diámetro del haz del láser (5-10 mm), longitud de onda (585-600 nm), densidad de energía o fluencia (7-15 J/cm2) y duración del pulso (450 µm-1500 ms). En un estudio reciente, la aplicación de 595 nm, 1,5 ms de duración de pulso y fluencias entre 11-12 J/cm2, usando un sistema dinámico de enfriamiento cutáneo, muestra buenos resultados observándose en un 63% de los pacientes un aclaramiento mayor del 75% de la lesión, tras 4 sesiones40. Otros autores observan un blanqueamiento de la lesiones en más de un 75% en el 20% de los pacientes después de 3,3 sesiones de media, usando fluencias entre 6 y 15 J/cm2, con una duración de pulso de 1,5 ms41. Algunos de los parámetros que pueden mejorar los resultados finales son la utilización de pulsos de duración largos (1,5 ms)42, longitudes de onda más altas (600 nm)43 o fluencia altas40. Otros autores observan que el uso de una longitud de onda de 585 nm es más eficaz que los tratamientos realizados a 595 nm44. También se han observado buenos resultados en casos resistentes administrando un doble pase en la misma zona, usando primero una longitud de onda y una duración de pulso de 590-600 nm y 1,5 ms, respectivamente, y después un segundo pase para eliminar los vasos más superficiales a 585 nm y 450 ms45. En otro estudio experimental en esta misma línea, realizado sobre piel sana, observan que el solapamiento de impulsos se asocia a una mayor penetrabilidad, sin que se asocie una mayor incidencia de daño de otras estructuras como la epidermis46.
Otro aspecto que debe tenerse en cuenta es la posibilidad de recidiva o de empeoramiento de la mancha en vino de Oporto una vez concluido el tratamiento, hecho que puede verse hasta en un 15% de los casos47,48. Para aquellos pacientes que después de varias sesiones ya no se detecte una respuesta clínica evidente es aconsejable de todas formas realizar periódicamente una sesión, con una frecuencia anual por ejemplo, para evitar la progresión de la enfermedad, ya que las manchas en vino de Oporto tienden por su comportamiento natural a oscurecerse con el tiempo y a engrosar la piel, adoptando una superficie en empedrado con formación de nódulos más o menos prominentes. Aunque no está demostrado, cabría pensar que la aplicación de láser en estos casos evitaría la progresión. Sin embargo, la aplicación de láser en edades tempranas no parece que evite el desarrollo de hipertrofia de tejidos blandos como se ve en ocasiones en la mucosa labial de estos pacientes.
En pacientes con lesiones hipertróficas el tratamiento quirúrgico puede estar indicado y ser más efectivo que el láser de colorante pulsado, si bien otros modelos como el láser de CO2 o Nd:YAG son también eficaces49.
El uso de otros láseres diferentes al láser de colorante pulsado ha ido extendiéndose lentamente en los últimos años. Concretamente se ha usado el láser de Nd:YAG (1.064 nm)50 y el láser de KTP (532 nm). En relación con este último, en una serie de 30 pacientes tratados, se ha observado una mejoría con aclaramiento de la lesión superior al 25% en 16 pacientes y mayor del 50% en 5 de ellos. Las fluencias empleadas con mejores resultados se situaban entre 18 y 24 J/cm2, con duraciones del pulso de 9-14 ms51. Aunque este láser es mejor tolerado por los pacientes y raramente se produce púrpura, tiene el inconveniente de producir mayor incidencia de complicaciones como la presencia de cicatrices o alteraciones en la pigmentación51. En conclusión puede afirmarse que el láser de colorante pulsado sigue siendo el tratamiento de elección y no ha sido superado hasta la fecha por ningún otro modelo.
Otras consideraciones que deben tenerse en cuenta, al margen de la respuesta terapéutica, es la seguridad en la utilización de los diferentes equipos. En aquellos casos en los que se tenga que aplicar impactos en los párpados se deberá colocar previamente un protector ocular. Otro aspecto importante para aquellos pacientes cuyo procedimiento se realice bajo anestesia general es la utilización de bajas concentraciones de O2. Si se inicia una ignición, por ejemplo tras la quemadura de un folículo piloso, ésta se podría propagar rápidamente por toda la vía área52.
Malformaciones venosas
El tratamiento de las malformaciones venosas combina frecuentemente la administración de diferentes tipos de láser, escleroterapia y cirugía. La utilización de un procedimiento aisladamente o la combinación de varios depende de numerosos factores como la profundidad de la lesión, extensión y localización anatómica53.
El láser más empleado es el de Nd:YAG. Debido al calibre de los vasos y a la profundidad de los mismos, la utilidad del láser de colorante pulsado resulta escasa ya que sólo penetra alrededor de 1 mm. El láser Nd:YAG produce sin embargo una onda continua de luz infrarroja a 1.064 nm que penetra hasta una profundidad de 5-7 mm. Existen dos métodos de aplicación del láser Nd:YAG: modo percutáneo e intralesional54-56. En este último caso la administración del láser se realiza a través de un catéter introducido en el interior de la lesión, visualizándose el proceso mediante control ecográfico. Esta técnica tiene un riesgo no despreciable de efectos secundarios por lo que su uso no está muy extendido en la actualidad. Además resulta difícil controlar dónde se aplica exactamente la radiación láser. Se ha sugerido la realización de una resonancia magnética tridimensional como método útil a la hora de determinar la extensión de la lesión y programar así de una manera más exacta y eficaz el tratamiento55.
A nivel de mucosas resulta útil la aplicación del láser sin contactar con el epitelio, en modo continuo, a una potencia constante de 30 w, utilizando una fibra de 600 mm de diámetro y una duración del pulso variable en función del área anatómica en la que operemos53. El procedimiento se realiza habitualmente bajo anestesia general y no requiere el uso concomitante de sistemas de enfriamiento de la superficie. Al incidir el impacto en la mucosa se observa una reducción inmediata del área tratada. Los impactos deben separarse entre 2-3 mm para evitar la aparición de necrosis. La aparición inmediata de un área blanquecina puntiforme después de cada impacto nos permitirá saber qué área concreta ha sido tratada. En el postoperatorio inmediato se suele observar casi de forma invariable edema e inflamación que mejoran considerablemente después de 24-48 horas. Este problema se puede minimizar administrando durante el procedimiento y los siguientes días una dosis de corticoesteroides orales a razón de 2 mg/kg peso al día. Habitualmente, después del procedimiento, los pacientes no experimentan dolor o éste es mínimo. La eficacia del láser puede ser tal que, tras 2 ó 3 sesiones, en algunos casos pueda ser innecesaria la realización de cirugía posterior. Aquellos pacientes con lesiones en la mucosa que hayan sido sometidos a cirugía convencional y que presenten una recurrencia o bien no haya podido extirparse por completo pueden ser subsidiarios también de tratamientos periódicos con este tipo de láser. En malformaciones venosas de la mucosa que tienen gran tamaño la aplicación del láser, previa a la cirugía, permitirá eliminar el componente superficial de la malformación y crear además una banda de fibrosis que facilite durante la cirugía posterior la movilización de colgajos así como la disección de la lesión, disminuyendo el sangrado durante la intervención. En áreas anatómicas como la lengua en donde las lesiones pueden ser de gran tamaño y estar localizadas profundamente, puede considerarse la aplicación de láser intersticial (intralesional) como por ejemplo Nd:YAG o de diodo57. Dicho procedimiento debe realizarse bajo anestesia general y preferiblemente bajo control ecográfico.
En el caso de malformaciones venosas localizadas en la superficie cutánea se puede utilizar un láser de Nd:YAG con diferentes sistemas de enfriamiento que minimicen el riesgo de cicatrices. El grado de profundidad de las lesiones marcará la eficacia del tratamiento en cada caso. Las lesiones superficiales pueden aclararse considerablemente tras varias sesiones, si bien raramente se consiguen eliminar por completo. Por otra parte, el riesgo de efectos secundarios en relación con la pigmentación y cicatrización es más alto que en lesiones de la mucosa. Los pacientes deberán seleccionarse cuidadosamente, aconsejándose realizar un test previo para conocer la respuesta individual y ajustar los parámetros más adecuados.
Malformaciones linfáticas
Las malformaciones linfáticas, especialmente aquellas localizadas en la cavidad oral, son también difíciles de tratar debido a que con frecuencia son difusas y alcanzan planos profundos, incluyendo el músculo subyacente53.
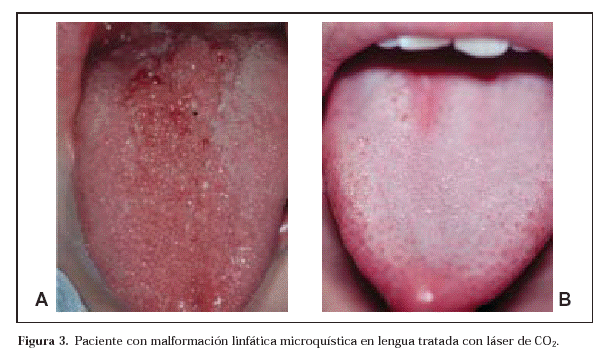
La ablación con láser CO2 esta indicada especialmente en las formas superficiales, caracterizadas clínicamente por la presencia de múltiples vesículas superficiales. Aunque este tratamiento no es curativo, permite controlar la enfermedad y mejorar de forma evidente la calidad de vida de estos pacientes (Fig. 3).
Es necesario aplicar varios tratamientos de forma periódica ya que la tasa de recidiva es elevada. La frecuencia dependerá de cada caso, no existiendo factores pronósticos que permitan predecir el número de sesiones que se requerirán. En nuestra experiencia utilizamos el láser de CO2 en modo continuo, con el haz de láser desenfocado y una potencia entre 20-40 w. Con esta técnica se puede eliminar la mayor parte de la malformación. En ocasiones, como consecuencia de una comunicación entre las lesiones superficiales y los reservorios profundos, la ablación deberá extenderse hasta el plano muscular. La lesión cicatriza en 2-3 semanas con escasa fibrosis y resultado funcional y cosmético aceptable. A pesar de ello la recurrencia es la norma y son necesarios tratamientos periódicos. Al igual que mencionamos al hablar de las malformaciones venosas, la administración de un ciclo de corticoesteroides durante el día del procedimiento y unos días después es siempre recomendable.
LUZ PULSADA intensa EN ANOMALÍAS VASCULARES
La luz pulsada intensa, que no es propiamente un láser, se basa en la generación de una fuente de luz policromática, no coherente de alta intensidad. El espectro de luz que emite se delimita entre 515 nm y 1.200 nm, siendo posible la colocación de filtros a distintos niveles según la patología que deseemos tratar. El uso de esta modalidad se está extendiendo cada vez más, ampliándose su uso a un número mayor de procesos dermatológicos. Sin embargo, este sistema tiene la desventaja de requerir de un periodo de entrenamiento del operador más prolongado así como de la obtención de una mayor variabilidad en los resultados. Además, la incidencia de efectos secundarios es mayor como por ejemplo el desarrollo de cicatrices inestéticas.
No hay experiencia publicada que nos conste en relación con el uso de luz pulsada en hemangiomas infantiles. En el caso de mancha en vino de Oporto puede plantearse como alternativa en aquellos pacientes que no respondan al tratamiento convencional con láser de colorante pulsado58,59. En relación con las malformaciones venosas, tampoco hay mucha experiencia, apreciándose una respuesta más satisfactoria en lesiones de pequeño tamaño60 respecto a las mayores que requerirán un número alto de sesiones. Aplicando la luz pulsada intensa mediante la colocación de un filtro a una longitud de onda de 590 nm, un pulso largo y administrando una fluencia media de 80 J/cm2 distribuida en tres pulsos, los efectos secundarios observados son transitorios y leves. Típicamente se produce eritema inmediato, con edema y formación de costras; la aparición de sangrado, alteraciones de la pigmentación o desarrollo de cicatrices es infrecuente según algunos estudios60.
CONCLUSIONES
Por su importancia y frecuencia hemos considerado en este capítulo aquellas anomalías vasculares más frecuentes, susceptibles de ser tratadas mediante láser, haciendo especial hincapié en los hemangiomas y en la mancha en vino de Oporto.
Aunque queda un largo recorrido hasta la obtención de un láser eficaz, que permita eliminar estas lesiones con un número bajo de sesiones y buenos resultados, hay que reconocer que el avance producido en este campo durante lo últimos años ha contribuido decisivamente a mejorar la calidad de vida de muchos pacientes. Los láseres son, hoy en día, una herramienta imprescindible en el tratamiento de las anomalías vasculares y en ocasiones la única alternativa que podemos ofrecer.
BIBLIOGRAFÍA
1. Anderson RR, Parrish JA. Selective photothermolysis: precise microsurgery by selective absorption of pulsed radiation. Science 1983; 220: 524-527. [ Links ]
2. Hirsch RJ, Anderson RR. Principles of laser-skin interactions. En: Dermatology. Bolognia JL, Jorizzo JL, Rapini R, Horn TD, Mascaro JM, Mancini AJ, Salasche SJ, Saurat JH, Stingl G, eds.,volume II, chapter 136, p. 2143-51. Spain: Mosby, 2003. [ Links ]
3. Poetke M, Philipp C, Berlien HP. Flashlamp-pumped pulsed dye laser for hemangiomas in infancy. Treatment of superficial vs. mixed hemangiomas. Arch Dermatol 2000; 136: 628-632. [ Links ]
4. Achauer BM, Chang C-J, Vander Kam VM. Management of hemangiomas of infancy: review of 245 patients. Plast Reconstr Surg 1997; 99: 1301-1308. [ Links ]
5. Achauer BM, Vander Kam VM. Capillary hemangioma (strawberry mark) of infancy: comparison of argon and Nd:YAG laser treatment. Plast Reconstr Surg 1989; 84: 60-69. [ Links ]
6. Landhaler M, Hohenleuther U, El-Raheem TA. Laser therapy of childhood hemangiomas. Br J Dermatol 1995; 133: 275-281. [ Links ]
7. Garden JM, Bakus AD, Paller AS. Treatment of cutaneous hemangiomas by the flashlamp-pumped pulsed dye laser: prospective analysis. J Pediatr 1992; 120: 555-560 [ Links ]
8. Barlow RJ, Walker NPJ, Markey AC. Treatment of proliferative haemangiomas with 585 nm pulsed dye laser. Br J Dermatol 1996; 134: 700-704. [ Links ]
9. Hohenleutner S, Badur-Ganter E, Landthaler M, Hohenleutner U. Long-term results in the treatment of childhood hemangioma with the flashlamp-pumped pulsed dye laser: an evaluation of 617 cases. Lasers Surg Med 2001; 28: 273-277. [ Links ]
10. Ashinoff R, Geronemus RG. Failure of the flashlamp-pumped pulsed laser to prevent progression to deep hemangioma. Pediatr Dermatol 1993; 10: 77-80. [ Links ]
11. Batta K, Goodyear HM, Moss C, Williams HC, Hiller L, Waters R. Randomised controlled study of early pulsed dye laser treatment of uncomplicated childhood haemangiomas: results of a 1-year analysis. Lancet 2002; 360: 521-527. [ Links ]
12. Chang CJ, Kelly KM, Nelson JS. Cryogen spray cooling and pulsed dye laser treatment of cutaneous hemangiomas. Ann Plast Surg 2001; 46: 577-583. [ Links ]
13. Vlachakis I, Gardikis S, Michailoudi E, Charissis G. Treatment of hemangiomas in children using a Nd:YAG laser in conjunction with ice cooling of the epidermis: techniques and results. BMC Pediatrics 2003, 3 (http:www.biomedcentral.com/1471-2431/3/2). [ Links ]
14. Clymer MA, Fortune DS, Reinisch L, Toriumi DM, Werkhaven, Ries WR. Interstitial Nd:YAG photocoagulation for vascular malformations and hemangiomas in childhood. Arch Otolaryngol Head Neck Surg 1998; 124: 431-436. [ Links ]
15. Burstein FD, Simms C, Cohen SR, Williams JK, Paschal M. Intralesional laser therapy of extensive hemangiomas in 100 consecutive pediatric patients. Ann Plast Surg 2000; 44: 188-194. [ Links ]
16. Achauer BM, Chang CJ, VanderKam VM, Boyko A. Intralesional photocoagulation of periorbital hemangiomas. Plast Reconstr Surg 1999; 103: 11-16. [ Links ]
17. Waner M, Suen JY. Treatment options for the management of hemangiomas. En: Hemangiomas and Vascular malformation of the head and neck. Waner M, Suen JY, eds., chapter 8, p. 233-62. New York: Wiley-Liss, 1999. [ Links ]
18. Esterly NB. Cutaneous hemangiomas, vascular stains and malformations, and associated sindromes. Curr Probl Pediatr 1996; 26: 3-39. [ Links ]
19. Maleville J, Taieb A, Roubaud E, Sarrat P, Fontan I, Guillet G. Hemangiomes cutanes immatures. Ann Dermatol Venerol 1985; 112: 603-608. [ Links ]
20. David LR, Malek MM, Argenta LC. Efficacy of pulse dye laser therapy for the treatment of ulcerated haemangiomas: a review of 78 patients. Br J Plast Surg 2003; 56: 317-327. [ Links ]
21. Morelli JG, Tan OT, Yohn JJ, Weston WL. Treatment of ulcerated hemangiomas in infancy. Arch Pediatr Adolesc Med 1994; 148: 1104-1105. [ Links ]
22. Morelli JG, Tan OT, Weston WL. Treatment of ulcerated hemangiomas with the pulsed tunable dye laser. AJDC 1991; 145: 1062-1064. [ Links ]
23. Kim HJ, Colombo M, Frieden IJ. Ulcerated hemangiomas: clinical characteristics and response to therapy. J Am Acad Dermatol 2001; 44: 962-972. [ Links ]
24. Lacour M, Syed S, Linward J, Harper JI. Role of the pulsed dye laser in the management of ulcerated capillary haemagiomas. Arch Dis Child 1996; 74: 161-163. [ Links ]
25. Middelkamp-Hup MA, Sánchez-Carpintero I, Kossodo S, Waterman P, González S, Mihm MC Jr et al. Photodynamic therapy for cutaneous proliferative vascular tumors in a mouse model. J Invest Dermatol 2003; 121: 634-639. [ Links ]
26. Ashinoff R, Geronemus RG. Flashlamp-pumped dye laser for port wine stains in infancy: earlier versus later treatment. J Am Acad Dermatol 1991; 24: 467-472. [ Links ]
27. Greve B, Hammes S, Raulin C. The effect of cold air cooling on 585 nm pulsed dye laser treatment of port-wine stains. Dermatol Surg 2001; 27: 633-636. [ Links ]
28. Chang CJ, Nelson JS. Cryogen spray cooling and higher fluence pulsed dye laser treatment improve port-wine stain clearance while minimizing epidermal damage. Dermatol Surg 1999; 25: 767-772. [ Links ]
29. Seukeran DC, Collins P, Sheehan-Dare RA. Adverse reactions following pulsed tunable dye laser treatment of port wine stains in 701 patients. Br J Dermatol 1997; 136: 725-729. [ Links ]
30. Lanigan SW. Port-wine stain unresponsive to pulsed dye laser: explanations and solutions. Br J Dermatol 1998; 139: 173-177. [ Links ]
31. Renfro L, Geronemus RG. Anatomical differences of Port-wine stains in response to treatment with the pulse dye laser. Arch Dermatol 1993; 129: 182-188. [ Links ]
32. Katugampola GA, Lanigan SW. Five years experience of treating port wine stains with the flashlamp-pulsed dye laser. Br J Dermatol 1997; 137: 750-754. [ Links ]
33. Fitzpatrick RE, Lowe NJ, Goldman MP, Borden H, Behr KL, Ruiz-Esparza JJ. Flashlamp-pumped pulsed dye laser treatment of port-wine stains. Dermatol Surg Oncol 1994; 20: 743-748. [ Links ]
34. Taieb A, Touati L, Cony M, Leaute-Labreze C, Mortureux P, Renaud P et al. Treatment of port-wine stains with the 585-nm flashlamp-pulsed tunable dye laser: a study of 74 patients. Dermatology 1994; 188: 276-281. [ Links ]
35. Fiskerstrand EJ, Svaasand LO, Kopstad G, Dalaker M, Norvang LT, Volden G. Laser treatment of port-wine stains: therapeutic outcome in relation to morphological parameters. Br J Dermatol 1996; 134: 1039-1043. [ Links ]
36. Procaccini EM, Argenziano G, Staibano S, Ferrara G, Monfrecola G. Epiluminiscence microscopy for port-wine stains: pretreatment evaluation. Dermatology 2001; 203: 329-32. [ Links ]
37. Troilius A, Ljunggren B. Reflectance spectrophotometry in the objective assessment of dye laser-treated port-wine stains. Br J Dermatol 1995; 132: 245-250. [ Links ]
38. Troilius A, Svendsen G, Ljunggren B. Ultrasound investigation of port wine stain. Acta Derm Venereol 2000; 80: 196-199. [ Links ]
39. Eubanks LE, McBurney EI. Videomicroscopy of port-wine stains: correlation of location and depth of lesion. J Am Acad Dermatol 2001; 44: 948-951. [ Links ]
40. Geronemus RG, Quintana AT, Lou WW, Kauvar ANB. High-fluence modified pulsed dye laser photocoagulation with dynamic cooling of Port-wine stain in infancy. Arch Dermatol 2000; 136: 942-943. [ Links ]
41. Kelly KM, Nanda VS, Nelson JS. Treatment of port-wine stain birthmarks using the 1.5-msec pulsed dye laser at high fluences in conjunction with cryogen spray cooling. Dermatol Surg 2002; 28: 309-313. [ Links ]
42. Scherer K, Lorenz S, Wimmershoff M, Landthaler M, Hohenleutner U. Both the flashlamp-pumped dye laser and the long-pulsed tunable dye laser can improve results in port-wine stain therapy. Br J Dermatol 2001; 145: 79-84. [ Links ]
43. Edstrom DW, Ros AM. The treatment of port-wine stains with the pulsed dye laser at 600 nm. Br J Dermatol 1997; 136: 360-363. [ Links ]
44. Chang CJ, Kelly KM, Van Gemert MJ, Nelson JS. Comparing the effectiveness of 585-nm vs. 595-nm wavelength pulsed dye laser treatment of port wine stains in conjunction with cryogen spray cooling. Lasers Surg Med 2002; 31: 352-358. [ Links ]
45. Bencini PL. The multilayer technique: a new and fast approach for flashlamp-pumped pulsed (FLPP) dye laser treatment of port-wine stains (preliminary reports). Dermatol Surg 1999; 25: 786-789. [ Links ]
46. Koster PH, van der Horst CM, van Gemert MJ, van der Wal AC. Histologic evaluation of skin damage after overlapping and nonoverlapping flashlamp pumped pulsed dye laser pulses: A study on normal human skin as a model for port wine stains. Lasers Surg Med 2001; 28: 176-181. [ Links ]
47. Orten S, Waner M, Flock S, Roberson PK, Kincannon J. Port-wine stains: An assessment of 5 years of treatment. Arch Otolaryngol Head Neck Surg 1996; 122: 1174-1179. [ Links ]
48. Michel S, Landthaler M, Hohenleutner U. Recurrence of port-wine stains after treatment with the flashlamp-pumped pulsed dye laser. Br J Dermatol 2000; 143: 1230-1234. [ Links ]
49. del Pozo J, Fonseca E. Port-wine stain nodules in the adult: report of 20 cases treated by CO2 laser vaporization. Dermatol Surg 2001; 27: 699-702. [ Links ]
50. Groot D, Rao J, Johnston P, Nakatsui T. Algorithm for using a long-pulsed Nd:YAG laser in the treatment of deep cutaneous vascular lesions. Dermatol Surg 2003; 29: 35-42. [ Links ]
51. Chowdhury MM, Harris S, LAnigan SW. Potassium titanyl phosphate laser treatment of resistant port-wine stains. Br J Dermatol 2001; 144: 814-817. [ Links ]
52. Molin L, Hallgren S. Hair ignition by dye laser for port-wine stain: risk factors evaluated. J Cutan Laser Ther 1999; 1: 121-124. [ Links ]
53. Waner M, Suen JY. Treatment options for the management of vascular malformations. En: Waner M. y Suen JY, eds. Hemangiomas and vascular malformations of the head and neck. Chapter 10, p. 315-50. New York: Wiley-Liss, 1999. [ Links ]
54. Werner JA, Lippert BM, Hoffmann P, Rudert H. Nd:Yag laser therapy of voluminous hemangiomas and vascular malformations. Adv Otorhinolaryngol 1995; 49: 75-80. [ Links ]
55. Glaessl A, Schreyer AG, Wimmershoff MB, Landthaler M, Feuerbach S, Hahenleutner U. Laser surgical planning with magnetic resonance imaging-based 3-dimensional reconstructions of intralesional Nd:YAG laser therapy of a venous malformation of the neck. Arch Dermatol 2001; 137: 1331-1335. [ Links ]
56. Derby LD, Low DW. Laser treatment of facial venous vascular malformations. Ann Plast Surg 1997; 38: 371-378. [ Links ]
57. Chang CJ, Fisher DM, Chen YR. Intralesional photocoagulation of vascular anomalies of the tongue. Br J Plast Surg 1999; 52: 178-181. [ Links ]
58. Raulin C, Schroeter CA, Weiss RA, Keiner M, Werner S. Treatment of port-wine stain with a noncoherent pulsed light source. Arch Dermatol 1999; 135: 679-683. [ Links ]
59. Cliff S, Misch K. Treatment of mature port wine stains with the PhotoDerm VL. J Cutan Laser Ther 1999; 1: 101-104. [ Links ]
60. Raulin C, Werner S. Treatment of venous malformations with an intense pulsed light source (IPLS) technology: a retrospective study. Lasers Surg Med 1999; 25: 170-177. [ Links ]