Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Anales del Sistema Sanitario de Navarra
versión impresa ISSN 1137-6627
Anales Sis San Navarra vol.27 supl.2 Pamplona 2004
Virología, pruebas diagnósticas, epidemiología y mecanismos de transmisión del VHC
Virology, diagnostic tests, epidemiology and transmission mechanisms of Hepatits C virus
M. P. Huarte, M. A. Casi
| RESUMEN El virus de la hepatitis C es un virus humano, clasificado dentro de un tercer género, (Hepacivirus), de la familia de los Flaviviridae. Es un virus esférico, de aproximadamente 50 nm de diámetro, con una envoltura glicoproteica que contiene lípidos, y su genoma es una molécula de RNA de cadena simple. Se caracteriza por un alto grado de heterogeneidad genómica, cuya consecuencia evolutiva, a largo plazo, es la aparición de grupos virales genéticamente distintos, genotipos y quasiespecies. Existen distintas técnicas diagnósticas para detectar la infección por el VHC. Técnicas serológicas: la detección de IgG específica contra el VHC mediante enzimoinmunoensayos es el método más práctico para el diagnóstico de la infección por este virus. Los test de inmunoblots suplementarios se emplean para confirmar la especificidad del resultado del EIA. Técnicas moleculares: se han desarrollado técnicas cualitativas y cuantitativas para detectar RNA-VHC, basadas en la detección directa de los viriones. La patogenia de la hepatitis C no es bien conocida. Su prevalencia mundial se estima en un 3%, por lo que no se recomienda screening rutinario para su detección. La transmisión del VHC, se produce fundamentalmente por exposición percutánea a sangre infectada, observándose mayores tasas de infección en personas encarceladas, vagabundos, adictos a drogas vía parenteral, personas hemofílicas y pacientes en hemodiálisis. Aunque la transmisión sexual existe, parece que esta vía es poco eficaz, habiéndose observado mayor prevalencia en personas con múltiples parejas sexuales. La transmisión vertical, se estima en un 2%, alcanzando un 20 % en caso de coinfección materna por el VIH. Palabras clave. Virus hepatitis C. Estructura. Genotipos. Quasiespecies. Epidemiología. Transmisión. | ABSTRACT The hepatitis C virus is a human virus, classified within a third type (Hepacivirus) of the Flaviviridae family. It is a spherical virus, of approximately 50 nm in diameter, with a glycoprotein covering that contains lipids, and its genome is a simple chain RNA molecule. It is characterised by a high degree of genomic heterogeneity, whose evolutionary consequence in the long term is the appearance of genetically different viral groups, genotypes and quasispecies. There are different diagnostic techniques for detecting hepatitis C virus infection. Serological assays: the detection of specific IgG against HCV by means of enzyme immunoassays is the most practical method for diagnosing infection by this virus. Supplementary immunblot tests are employed to confirm the specificity of the results of the EIA test. Molecular assays: qualitative and quantitative techniques have been developed for detecting RNA-HCV, based on the direct detection of the virions. The pathogeny of hepatitis C is not well understood. Its world prevalence is estimated at some 3%, which is why routine screening for its detection is not recommended. HCV transmission basically occurs through percutaneous exposure to infected blood, with higher rates observed in imprisoned persons, vagabonds, intravenous drug addicts, haemophiliacs and patients on haemodialysis. Although it can be transmitted sexually, it seems that this path is not very efficient, with a greater prevalence observed in persons with multiple sexual partners. Vertical transmission is estimated at some 2%, reaching 20% in cases of maternal coinfection with HIV. Key words. Hepatitis C virus. Structure. Genotypes. Quasispecies. Epidemiology. Transmission.
|
| Sección de Aparato Digestivo. Hospital Virgen del Camino. Pamplona. | Correspondencia: |
VIRUS DE LA HEPATITIS C
Características estructurales
El virus de la hepatitis C (VHC) (Fig. 1) es un virus humano que ha sido clasificado dentro de un tercer género, (Hepacivirus), de la familia de los Flaviviridae1.
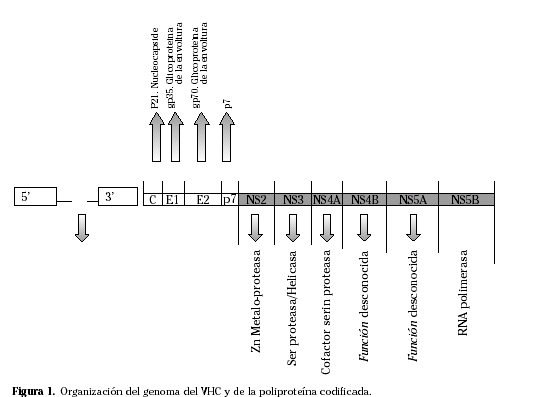
Fue identificado en 1989, como el principal agente causante de las hepatitis postransfusinales no-A no-B. Es un virus esférico, de aproximadamente 50 nm de diámetro. Consta de una envoltura glicoproteica que contiene lípidos, y su genoma es una molécula de RNA de cadena simple y polaridad positiva de 9.500 nucleótidos de longitud, que contiene una única estructura de lectura que ocupa casi todo el genoma y codifica una poliproteína de unos 3.010 aminoácidos.
La región 5´ no codificante (5´UTR) del VHC, primeros 332-342 nucleótidos, es esencial para la traducción, adoptando una estructura terciaria para el anclaje del ribosoma, lo que explica por qué su secuencia está tan bien conservada en todos los aislados (homología >97%). Ello le convierte en idónea para las técnicas de diagnóstico molecular basadas en PCR y para el diseño de nuevos fármacos antivirales.
La mayor parte del resto del genoma actúa como RNA mensajero de un precursor poliproteico a partir del cual se liberan las distintas proteínas virales por la acción combinada de proteasas celulares y virales. Un 25% de la poliproteína da lugar a las proteínas estructurales (nucleocápside y envoltura) y el resto a seis proteínas no estructurales. El orden de los genes codificantes es: 5´-C-E1-E2-p7-NS2-NS3-NS4A-NS4B-NS5A-NS5B-3´.
El producto del gen C, de 190 aminoácidos, constituye la subunidad básica de la proteína de la nucleocápside. Los siguientes genes E1 y E2 codifican las dos glicoproteínas de envoltura del VHC: gp35 y gp70. Una característica importante del gen E es la presencia de una región hipervariable (HVR-1) (primeros 27 aminoácidos de gp70, expuestos en la superficie del virus y que contienen epítopos para linfocitos B). E1 y E2 estarían implicadas en la unión a receptores celulares y su posterior fusión, es decir en la entrada del virus dentro de las células del huésped. Los genes no estructurales, NS2 y NS3 codifican dos proteasas que intervienen en el procesamiento de toda la región no estructural del precursor poliproteico. El producto de NS3, a continuación del dominio con actividad serín-proteasa, actúa como una helicasa capaz de desenrollar el molde de RNA durante la replicación del genoma. El producto NS4A actúa como cofactor de la actividad serín-proteasa de NS3. La función del producto p27 de NS4B es desconocida. NS5A da lugar a dos productos fosforilados de 56 y 58 kD cuya función se desconoce. Por último, el producto de NS5B contiene el dominio RNA polimerasa RNA-dependiente esencial para la replicación. La NS5 se ha implicado en la modulación de la respuesta antiviral del huésped mediada por el interferón. En concreto, se ha observado que la acumulación de mutaciones en una determinada región NS5A, la conocida como ISDR (interferon sensitivity determining region) se relaciona con una mejor respuesta al interferón en pacientes infectados por el genotipo 1b del VHC2.
La zona codificante termina en un único codón de parada, al que sigue una región 3´ no traducida (3´UTR) que contiene: una zona variable de 40 nucleótidos, seguida de una ristra de uracilos (poly-U), una secuencia polipirimidínica formada por secuencias poly-U con citocinas intercaladas y una región muy conservada (98-100% de homología) de 98 nucleótidos. 3´UTR es esencial para la replicación viral, aunque se desconocen sus funciones exactas. En todo caso también es una atractiva diana para el desarrollo de técnicas de diagnóstico molecular y de fármacos antivirales.
Variabilidad genómica del VHC. Quasiespecies y genotipos
Estudios clínicos y experimentales realizados antes y después del descubrimiento del VHC sugerían que la infección natural por VHC no induce una protección inmunológica en el huésped, pudiendo ser los individuos reinfectados en varias ocasiones con RNA-VHC homólogo o heterólogo3. No obstante, la observación en el huésped de una respuesta inmune celular y humoral vigorosa durante la fase aguda y crónica de la infección por VHC, incluyendo anticuerpos específicos contra la envuelta y linfocitos T citotóxicos multiespecíficos (CTL), sugiere que es probablemente la variabilidad viral la que juega un papel clave en la persistencia de la infección por VHC4.
El VHC, como casi todos los virus RNA, se caracteriza por un alto grado de heterogeneidad genómica como consecuencia de la incapacidad de la RNA polimerasa para corregir errores durante la replicación. La tasa global de fijación de mutaciones del VHC se ha calculado en aproximadamente 1,44-1,92 x 10-3 cambios de nucleótido por posición genómica y año. Esta tasa no es uniforme a lo largo del genoma, siendo menor en 5´UTR y C, mayor en E1 y E2 y máxima en la región hipervariable de E2 (HVR-1).
El pequeño tamaño de muchos genomas RNA, su alta tasa de mutación, y su tolerancia a la diversidad genética, favorecen el establecimiento de complejas mezclas de virus relacionados, en el mismo paciente. Como consecuencia de la baja fidelidad de la maquinaria de replicación viral, el VHC nunca está presente en vivo como una población homóloga de genomas RNA idénticos sino como una mezcla de genomas divergentes, aunque próximamente relacionados, mostrando una distribución que sigue un modelo de quasiespecies. La secuencia máster es la más frecuentemente representada dentro de la población, mientras que la secuencia consenso (promedio) es la que resulta de asignar a cada posición el nucleótido más frecuente.
La consecuencia evolutiva, a largo plazo, de esta heterogeneidad es la aparición de grupos virales genéticamente distintos o genotipos. La distribución en quasispecies representa una ventaja adaptativa y tiene numerosas implicaciones biológicas, como el establecimiento de infección persistente por selección de mutantes de escape a los anticuerpos neutralizantes y linfocitos T, la selección de mutantes resistentes a fármacos antivirales, los cambios en la virulencia o patogenicidad del virus, y selección de mutantes de escape frente a vacunas, entre otras.
La observación de mutaciones de nucleótidos y aminoácidos específicamente segregables en grupos o subgrupos en prácticamente todas las regiones genómicas del VHC ha permitido la clasificación de los VHC en genotipos y subtipos, cuyas secuencias difieren globalmente entre sí en 30 y 20%, respectivamente. En la actualidad se acepta la existencia de al menos 6 genotipos divididos, a su vez, en más de 84 subtipos. Los genotipos se denominan mediante un número (del 1 al 6), y los subtipos mediante una letra minúscula, por orden de descubrimiento (p. ej., 1a, 1b, 2a, 3a, etc.).
La existencia de distintos genotipos del VHC tiene implicaciones diagnósticas, tanto a nivel serológico como molecular:
La detección de RNA y su cuantificación debe dirigirse a los extremos 5´ y 3´ UTR (regiones mejor conservadas) mediante cebadores universales.
La reactividad frente a NS3 en los test de confirmación es menor en las infecciones por VHC genotipo 3.
La determinación del genotipo viral es obligatoria para establecer la fuente de infección por técnicas de epidemiología molecular.
Los diferentes genotipos pueden aparecer en cualquier parte del mundo, pero existen diferencias en cuanto a la distribución geográfica. Los genotipos 1a, 1b, 2a, 2b, 2c y 3a constituyen el 90% de todas las infecciones por el VHC en toda América, Europa, China, antigua Unión Soviética, Japón, Australia y Nueva Zelanda. Los genotipos 1a y 1b son los causantes del 40% de todas las infecciones por el VHC en los EEUU. El genotipo 1b es especialmente prevalente en el sur y este de Europa y también en China y Japón. El genotipo 3 es altamente prevalente en zonas de Nepal, Bangladesh, India y Pakistán. En Egipto existe una alta prevalencia del genotipo 4a y tanto éste como otros subtipos del genotipo 4 se pueden encontrar más frecuentemente en África central. En Sudáfrica, el genotipo 5 es el causante de alrededor del 50% de las infecciones por el VHC. Por último, el genotipo 6 se encuentra especialmente en el sudeste asiático5. A pesar de las variaciones geográficas, es importante remarcar que además, existen diferencias dentro de una misma área según los diferentes grupos de población. Así, en los países occidentales destaca la mayor prevalencia del genotipo 3a entre los jóvenes, especialmente entre aquellos que son usuarios de droga por vía parenteral6.
Aunque el genotipo no tiene influencia en la historia natural de la enfermedad, es el factor que más influye en la respuesta al tratamiento antiviral. Así, los pacientes infectados con genotipos 2 y 3 responden más rápidamente y tienen tasas de respuesta mantenida dos o tres veces superiores a las de los infectados por genotipos 1.
PRUEBAS DIAGNÓSTICAS
Técnicas serológicas
Enzimoinmunoensayos. Test de cribaje
La detección de IgG específica contra el VHC mediante enzimoinmunoensayos (EIA) continúa siendo el método más práctico para el diagnóstico de la infección por este virus. Dado que aún no es posible obtener proteínas nativas del VHC, los métodos de EIA utilizan antígenos artificiales obtenidos por ingeniería genética (antígenos recombinantes) o por síntesis química (péptidos sintéticos), o bien, mezclas de ambos, para capturar los anticuerpos anti-VHC en microplacas o micropartículas. Los primeros EIA para anti-VHC detectaban anticuerpos contra una única proteína antigénica recombinante (c-100-3). En los EIA de segunda generación (EIA-2) se incluyeron proteínas del core (c22-3) y el producto de la región NS3 (c33c). Los test de tercera generación (EIA-3), que incorporan además la proteína de NS5, son aún más sensibles por la optimización de los antígenos presentes en los EIA-27.
En grupos de riesgo inmunocompetentes, la sensibilidad de los EIA oscila entre el 98 y el 100%, lo que significa que la inmensa mayoría de pacientes inmunocompetentes con infección activa por VHC pueden identificarse mediante EIA. En hemodializados e inmunodeprimidos (receptores de trasplante sólido o médula ósea y pacientes infectados por el VIH), la sensibilidad de los EIA es menor, oscilando entre un 50 y un 95% según el grado de inmunodeficiencia8.
Test de confirmación. Inmunoblots y test para anti-E2
La asociación de un factor de riesgo percutáneo para infección por VHC con niveles elevados de ALT en un individuo anti-VHC positivo por EIA-2/3 es indicativa de infección activa por VHC en más del 98% de los casos, lo que hace innecesarios los test de confirmación. Para los donantes de sangre de bajo riesgo y transaminasas normales, se han desarrollado test suplementarios para confirmar la especificidad del resultado del EIA. Estos son inmunoblots en los que sobre un soporte de nitrocelulosa se han fijado por separado antígenos recombinantes o mezclas de antígenos recombinantes y péptidos sintéticos (core, NS3, NS4 y NS5). Se considera positiva cuando reacciona contra al menos dos antígenos distintos, indeterminada cuando hay reactividad frente a uno solo y negativa cuando no reacciona con ninguno. Estos test tienen poco valor en inmunodeprimidos.
Anticuerpos de tipo IgM
El significado clínico de los anti-VHC de clase IgM dirigidos contra la proteína del core (IgM anti-core VHC) es muy dudoso. Se pueden detectar IgM anticore en el 50-90% de pacientes con hepatitis aguda C, pero también, a título más bajo, en el 50-70% de pacientes con hepatitis crónica.
Técnicas para la detección de antígeno core del VHC
Existe un test EIA para la detección cualitativa de antígeno del core en suero que ha demostrado ser útil para acortar el período de ventana en el cribaje de donantes de sangre. Asimismo, se ha desarrollado un EIA fluorescente capaz de detectar y cuantificar antígeno del core del VHC en el suero de pacientes con infección crónica (anti-VHC positivos). Esta técnica podría complementar a los métodos moleculares para estimar la carga viral y monitorizar el tratamiento antiviral y la recurrencia del VHC en receptores de trasplante.
Técnicas moleculares
La replicación del VHC en los hepatocitos induce la destrucción de esas células y libera, así, las partículas víricas hijas al medio extracelular. Al menos una parte de ellas pasan al torrente circulatorio, ofreciendo distintas dianas potenciales para el diagnóstico de laboratorio basado en la detección directa de los viriones, bien por detección de su genoma o de sus proteínas.
Durante el período ventana de la infección aguda y en el caso de los pacientes inmunodeficientes humorales, el diagnóstico por detección de anti-VHC puede fallar, requiriéndose el uso directo de pruebas de detección de virus. Asimismo, la detección de RNA del VHC es fundamental en la monitorización de la respuesta al tratamiento antiviral en la infección crónica por el VHC.
Técnicas cualitativas para RNA VHC
Como el virus de la hepatitis C circula en la sangre a niveles relativamente bajos, indetectables mediante técnicas clásicas de hibridación, el RNA viral, debe amplificarse para su detección. La técnica más empleada es la amplificación por PCR (Reacción en Cadena de la Polimerasa) del DNA complementario (DNAc) a un fragmento del extremo 5´UTR, obtenido por retrotranscripción (RT-PCR). Numerosos laboratorios de investigación han desarrollado su propia variante de la técnica, que difieren en el método de extracción del RNA, la selección de cebadores de 5´UTR, el tipo de PCR (simple o anillada), el perfil y número de ciclos de amplificación, y el procedimiento de detección del producto amplificado. Debido a las diferencias en la sensibilidad y especificidad de estas técnicas, ha sido imposible su estandarización para el diagnóstico rutinario en la práctica clínica.
El test cualitativo para RNA VHC estandarizado y comercialmente disponible es el test Amplicor-HCVTM (Roche Molecular Diagnostics, Pleasanton, CA). Aunque la primera versión comercial de este test era menos sensible para la detección de genotipos no 1, la segunda versión es capaz de detectar hasta 50 UI/ml (aproximadamente 45 copias/ml) y detecta con la misma sensibilidad todos los genotipos. La especificidad del test Amplicor HCV de segunda generación es >97%.
Técnicas cuantitativas para RNA VHC
Las dos técnicas estandarizadas comerciales más ampliamente utilizadas para la cuantificación de RNA del VHC en suero o plasma son: el test Amplicor HCV Monitor 2.0 (Roche Molecular Systems, Pleasanton, CA), basado en RT-PCR y el test Quantiplex HCV RNA 2.0 (Bayer Corporation, Emeryville, CA), basado en la amplificación de señal mediante DNA ramificado (bDNA) .
Dado que las diferentes técnicas cuantitativas han sido estandarizadas mediante transcritos de RNA de distinta naturaleza, longitud y secuencia, las distintas unidades de medida no representan la misma cantidad de RNA en muestras clínicas. Por ello la Organización Mundial de la Salud (OMS) ha establecido un patrón internacional de referencia para la estandarización universal de los resultados de las técnicas cuantitativas en Unidades Internacionales por ml9.
PATOGENIA
A pesar de los avances realizados sobre la biología del VHC, sigue sin conocerse con exactitud la patogenia de la hepatitis C en lo que respecta a los determinantes de la persistencia del virus y a los mecanismos de daño hepatocelular y a la participación extrahepática. La observación de las lesiones histológicas hepáticas producidas por el VHC sugieren que éste tiene un efecto citopático directo aunque también parece que la cronicidad de la hepatitis C puede depender de la infección no citopática de células hepáticas y extrahepáticas, así como de la evasión a la respuesta inmunitaria del huésped.
EPIDEMIOLOGÍA
De acuerdo con la Organización Mundial de la Salud (WHO), se estima que alrededor de 170 millones de personas, el 3% de la población mundial, puede estar infectada por la hepatitis C, aunque la mayoría puede estar clínicamente asintomática.
El virus de la hepatitis C es transmitido por exposición percutánea de forma repetida a sangre. Se ha identificado un posible factor de riesgo en un 90% de los casos. En un 10% no se ha podido identificar la fuente de infección. Esta exposición ocurre en el contexto de uso de drogas vía parenteral, transplante de órgano sólido a partir de donantes infectados, prácticas médicas no seguras, exposición ocupacional a sangre infectada, nacimiento de un bebé a partir de madre infectada, mantener relaciones sexuales con una persona con VHC, prácticas sexuales de alto riesgo, y posiblemente el uso de cocaína vía nasal. La transmisión a través de sangre y derivados sanguíneos fue prácticamente eliminada con la introducción de test para la detección de VHC (anti-VHC) en donantes hacia 1992.
Las mayores cifras de prevalencia (15-50%) ocurren en personas que están en cárceles, vagabundos, adictos a drogas vía parenteral, y personas con hemofilia tratados con factores de la coagulación antes de 199211.
En EEUU se calcula que 3,9 millones de personas han sido infectados por el VHC, de los cuales 2,7 millones desarrollarán una infección crónica11. En España se estima que la prevalencia de la infección en la población general podría oscilar entre el 2-2,5%12. En Navarra, en el año 2003 fueron declarados 24 nuevos casos de hepatitis con marcadores serológicos positivos para VHC, cifra ligeramente superior a la observada en años anteriores13.
TRANSMISIÓN DEL VHC
Receptores de sangre y derivados
Antes de 1986 la incidencia de hepatitis C post-transfusional se situaba ente el 5-13%. Desde 1990, al comenzar a realizarse el estudio de marcadores serológicos de VHC la incidencia de hepatitis post-transfusional disminuyó hasta hacerse menor de un 1%. Parece que la incidencia de adquisición de la infección por VHC post-transfusión está directamente relacionada con el número y cantidad de productos sanguíneos recibidos14.
Hemodiálisis
En cuanto a otras rutas yatrogénicas de transmisión, se ha observado una mayor prevalencia de VHC en pacientes en tratamiento de hemodiálisis, observándose gran diferencia entre diferentes países. En Europa se ha estimado una incidencia en torno a un 11,6%. Parece existir una correlación directa entre la duración de diálisis y el número de transfusiones sanguíneas recibidas y la incidencia de infección por VHC. Otros posibles mecanismos de transmisión incluyen el uso compartido de máquinas de diálisis entre pacientes positivos para VHC y otros negativos y la transmisión nosocomial por el personal de diálisis. En España se observó una incidencia de VHC del 19,5% en pacientes en tratamiento con hemodiálisis; dichos valores son ligeramente superiores a los observados en otros países europeos15.
Tatuajes y perforaciones
En cuanto a la perforación de los lóbulos de las orejas y otras partes del cuerpo, la acupuntura y el tatuaje, han sido indicados como posibles factores de riesgo de hepatitis esporádica, si el equipo utilizado está contaminado. Sin embargo, la transmisión a través de estas actividades es rara11,16.
Riesgo en personal sanitario
El personal sanitario tiene una prevalencia similar de infección por VHC que la población general. El riesgo de adquirir la infección por VHC tras un pinchazo accidental es bajo, en torno a un 2%11,14,16. Los grupos de alto riesgo incluyen entre otros a cirujanos, ginecólogos, al personal de hemodiálisis, de medicina intensiva y de salas de urgencias. Se recomienda mantener las medidas de precaución estándar o universales como medida de prevención de la infección por VHC. Si ocurre un pinchazo accidental, el uso de inmunoglobulinas o profilaxis antiviral no está recomendada. Se recomienda que tanto al individuo fuente como al expuesto se les realicen anticuerpos de VHC. Si el individuo fuente es anti- VHC positivo se recomienda realizar RNA del VHC a la persona expuesta. Se recomienda realizar RNA del VHC, anti-VHC y ALT en el momento de la exposición y de nuevo a las 2-8 semanas posteriores al pinchazo, dado que el RNA se detecta en sangre a las dos semanas postexposición. Si existe seroconversión se recomienda remitir al médico especialista para valoración11.
Transmisión intrafamiliar
Aunque no está clara la ruta de transmisión, parece existir una mayor prevalencia de infección por VHC (vía no sexual) en familiares de un paciente con VHC. La vía de transmisión es especulativa e incluiría el uso compartido de cepillos dentales, cuchillas, maquinillas de afeitar y utensilios para el cuidado de las uñas. No hay evidencia de que estornudar, besar, compartir utensilios de comida, se asocie con la transmisión del VHC11.
Transmisión sexual en grupos de bajo riesgo
Aunque la transmisión sexual existe, parece que esta vía es poco eficaz17. En cuanto a las relaciones monógamas de larga duración, en EEUU se estima una seroprevalencia de VHC del 2 al 3% entre parejas con un miembro infectado. Parece que el riesgo de infección del VHC dentro de la pareja es mayor para la mujer que para el varón11. Algunos estudios muestran que las parejas de pacientes con hepatitis crónica por virus C tienen mayor riesgo de adquirir el VHC, y éste aumenta con la mayor duración de la exposición. Aunque los datos son muy contradictorios, la mayoría de los expertos creen que en relaciones monógamas de larga duración no se recomiendan modificaciones en las prácticas sexuales, excepto durante la menstruación o si hubiera ulceraciones genitales14. Aunque no se recomienda el uso de preservativo debido al bajo riesgo de transmisión, sí se debe advertir a los pacientes, de que su uso disminuye el riesgo de contagio. A pesar del bajo riesgo de contagio, parece recomendado realizar estudio de anti-VHC a las parejas de los pacientes infectados11.
Transmisión sexual en grupos de alto riesgo
En EEUU se estima una seroprevalencia del 4 al 6 % del VHC entre personas con múltiples parejas sexuales. Parece existir una correlación positiva entre la infección por el VHC y el número de parejas sexuales, el hecho de no utilizar preservativos, mantener relaciones sexuales vía anal, relaciones sexuales traumáticas, historia de enfermedades de transmisión sexual, y pacientes coinfectados por VIH. En estos casos se recomienda el uso de preservativo, tanto para prevenir el contagio del VHC como de otras enfermedades de transmisión sexual11,14.
Transmisión vertical
Todavía no conocemos la manera y el momento de transmisión materno-infantil. La transmisión perinatal del VHC de niños nacidos de madres positivas para anti-VHC ocurre en aproximadamente un 2% de los casos. Cuando una mujer embarazada tiene positivo el RNA el riesgo se incrementa hasta un 4-7%11. Las cargas virales menores a 106 parecen disminuir mucho el riesgo de transmisión18. La influencia del genotipo viral es discutible. La coinfección materna por el VIH es un factor de riesgo para la transmisión vertical, elevando hasta el 20% el riesgo de transmisión del VHC11. No está claro si la práctica de amniocentesis o una rotura prolongada de membranas están asociados con un mayor riego de transmisión materno-infantil. No hay estudios prospectivos que evalúen el uso de cesárea electiva para prevenir la transmisión al niño del VHC, por lo que dicha intervención no está recomendada en pacientes con infección por VHC, a menos que coexista infección por VIH11,18.
Aunque el VHC puede ser detectado en el calostro materno, la lactancia materna no parece aumentar el riesgo de contagio del VHC, siempre y cuando no haya heridas a nivel de la mama18. Se recomienda explicar los datos a la madre y que sea ella la que decida si dar lactancia o no.
A los niños nacidos de madres positivas para anti-VHC, se les recomienda realizar RNA de VHC a los 2 y 6 mes de vida y/o test para anti-VHC a los 18 y 24 meses. La positividad de anti-VHC previo a los 15 meses puede deberse a transferencia transplacentaria de anticuerpos de VHC11.
Usuarios de drogas vía parenteral
Las personas con abuso de drogas vía parenteral no sólo tienen la mayor prevalencia de infección por VHC, sino que constituyen un potencial reservorio de VHC en la comunidad. La prevalencia varía entre el 31 y el 98%, según la localización geográfica mundial. La prevalencia de la infección aumenta de forma proporcional a la duración del abuso de drogas.
Otros grupos de riesgo
Los adictos a drogas vía oral, al ser comparados con los adictos a vía parenteral tienen menor incidencia de infección por VHC14. En cuanto a los consumidores de cocaína vía nasal, dado que con frecuencia se comparte el material de inhalación, se ha observado que hay mayor incidencia del VHC, por lo que ésta, podría ser considerada como una posible vía de transmisión del VHC16.
RECOMENDACIONES DE SCREENING DEL VHC
Dada la baja prevalencia de la infección por el VHC en la población general, no se recomienda realizar de forma rutinaria el screening de infección por VHC en mujeres embarazadas, contactos familiares de personas positivas para VHC, trabajadores de centros sanitarios ni en la población general.
Se recomienda realizar anti-VHC en grupos de alto riesgo para infección por VHC, que incluyen a usuarios de drogas vía parenteral, pacientes en hemodiálisis, receptores de transfusión y órganos antes de 1992, niños nacidos de madres infectadas por el VHC, personas que han recibido factores de coagulación antes de 1987, personal sanitario expuesto al VHC y en pacientes con transaminasas persistentemente elevadas.
Parece ser recomendable detectar anti-VHC en pacientes con múltiples parejas sexuales, parejas de pacientes infectados con VHC, personas con antecedentes de tatuajes y perforaciones y usuarios de drogas de uso no parenteral y cocaína intranasal11,17.
Dado que no existe vacuna frente a la hepatitis por virus C, es importante su prevención, recomendándose realizar programas de prevención en usuarios de drogas por vía parenteral, así como identificar a sujetos infectados, evitar la posible transmisión perinatal, utilizar medidas universales de limpieza y métodos barrera en los centros sanitarios, y realizar programas educativos y de apoyo para modificar los factores de riesgo.
BIBLIOGRAFÍA
1. Farci P, Purcell R. Clinical significance of hepatitis C virus genotypes and quasispecies. Semin Liver Dis 2000; 20: 103-126. [ Links ]
2. Sáiz JC, López-Labrador FX, Ampurdanés S, Dopazo J, Forns X, Sánchez-Tapias JM et al. The prognostic relevance of the nonestructural 5A gene interferon sensitivity determining region is different in infections with genotipo 1b and 3a isolets of the hepatitis C virus. J Infected Dis 1998; 177: 839-847. [ Links ]
3. Prince AM, Brotman B, Huima T, Pascual D, Jaffery M, Inchauspe G. Immunity in hepatitis C infection. J Infect Dis 1992; 165: 438-443. [ Links ]
4. Kobayashi M, Tanaka E, Matsumoto A, Ichijo T, Kiyosawa K. Antibody response to E2/NS1 hepatitis C virus protein in patients with acute hepatitis C. J Gastroenterorol Hepatol 1997; 12: 73-76. [ Links ]
5. Bukh J, Miller RH, Purcell RH. Genetic heterogeneity of hepatitis C viru: quasispecies and genotypes. Semin Liver Dis 1995; 15: 41-54. [ Links ]
6. Garcia-Retortillo, Forns X. Variabilidad genómica e historia natural de la infección por el virus de la hepatitis C. Gastroenterol Hepatol 2002; 25: 514-520. [ Links ]
7. Pawlotsky J, Maisonneuve P, Duval J, Dhumeaux D, Noel L. Significance of NS5 indeterminate third-generation anti-hepatitis C virus serological assays. Transfusion 1995; 35: 453-454. [ Links ]
8. De Medina M, Hill M, Sullivan H, Leclerq B, Pennell JP, Jeffers L et al. Detection of anti-hepatitis C virus antibodies in patients undergoing dialysis by utilizing a hepatitis C virus 3.0 assay: correlation with hepatitis C virus RNA. J Lab Clin Med 1998; 132; 73-75. [ Links ]
9. Lee S, Antony A, Lee N, Leibow J, Yang JQ, Soviero A et al. Improved version 2.0 qualitative and quantitative AMPLICOR reverse transcription-PCR test for hepatitis C virus RNA: Calibration to international units, enhanced genotype reactivity, and performance characteristics. J Clin Microbiol 2000; 38: 4171-4179. [ Links ]
10. Anonymus. Hepatitis C: global prevalence. Weekly Epidemiol Record 1997; 72: 341-344. [ Links ]
11. National Institutes of health. Consensus development conference statement management of hepatitis C: 2002-June 10-12. Hepatology 2002; 36 (Suppl 1): 3S-20S. [ Links ]
12. Suarez A, Viejo G, Navascués CA, García R, Díaz G, Saro C et al. Prevención de marcadores frente a los virus A,B y C de la hepatitis en la población de Gijón entre 26 y 65 años de edad. Gastroenterol Hepatol 1997; 20: 347-352. [ Links ]
13. Boletín informativo. Instituto de Salud Pública de Navarra 2004; 27. [ Links ]
14. Memon MI, Memon MA. Hepatitis C: an epidemiological review. J Viral Hepat 2002; 9: 84-100. [ Links ]
15. Cruz JM, Piera L, Bragg-Gresham JL, Feldman H, Port FK. Resultados del estudio internacional de hemodiálisis DOPPS en Europa y España. Nefrología 2003; 23: 437-443. [ Links ]
16. Bruguera M. Hepatitis C esporádica: importancia relativa de la transmisión vertical, sexual y parenteral inaparente del virus de la hepatitis C. Med Clin (Barc) 1998; 111: 658-659. [ Links ]
17. Recommendations for prevention and control of hepatitis C virus (HCV) infection and HCV-related chronic disease. Centers for Disease Control ans Prevention. MMWR Recomm Rep 1998; 47: 1-39. [ Links ]
18. Roberts EA, Yeung L. Maternal-infant transmission of Hepatitis C virus infection. Hepatology 2002; 36 (Suppl 1): 106S-113S. [ Links ]














