Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Anales del Sistema Sanitario de Navarra
versión impresa ISSN 1137-6627
Anales Sis San Navarra vol.27 no.3 Pamplona sep./dic. 2004
REVISIONES
Técnicas de biopsia para el diagnóstico de lesiones mamarias no palpables
Biopsy techniques for the diagnosis of non-palpable mammary lesions
L. Pina1, L. Apesteguía2, E. de Luis1, J. Sáenz Bañuelos2, G. Zornoza1, F. Domínguez Cunchillos2
| RESUMEN Ante una lesión mamaria no palpable que precise una biopsia diagnóstica debe valorarse el método de guiado idóneo para acceder a la misma. En la actualidad se emplean tres métodos: la estereotaxia (fundamentalmente en casos de microcalcificaciones), la ecografía (sobre todo en los nódulos) y la resonancia magnética (para lesiones no visibles mediante los anteriores sistemas). El siguiente paso es elegir la técnica de biopsia más adecuada. La técnica más clásica y fiable es la biopsia quirúrgica con marcaje previo con un arpón metálico, pero tiene los inconvenientes de ser una técnica agresiva para el diagnóstico de la patología benigna, además de presentar un alto coste. Como alternativas se han desarrollado múltiples sistemas de punción. La punción con aguja fina es de fácil realización técnica y puede dar buenos resultados en los nódulos mamarios, pero la existencia de resultados falsos positivos y negativos han limitado progresivamente su utilización. Como alternativa, los sistemas de biopsia con aguja gruesa han permitido la obtención de múltiples cilindros con gran fiabilidad diagnóstica, sobre todo en el caso de los nódulos mamarios. Sin embargo, su empleo en las microcalcificaciones continúa mostrando resultados falsos negativos. El advenimiento de los sistemas de biopsia asistida por vacío ha permitido la obtención de cilindros de mayor calidad, mejorando claramente los resultados de los sistemas anteriores, sobre todo en los casos de microcalcificaciones. Por último, los sistemas de biopsia escisional percutánea mediante cánulas de hasta 22 mm de diámetro consiguen la extracción completa de lesiones de tamaño inferior al de la cánula, con una fiabilidad similar al de la biopsia quirúrgica. Palabras clave. Cáncer de mama. Biopsia. Estereotaxia. Ecografía. Resonancia magnética. | ABSTRACT Facing a non-palpable mammary lesion requiring a diagnostic biopsy, consideration must be given to the most suitable guiding method for obtaining the latter. Three methods are employed at present: stereotaxy (basically in cases of microcalcifications), echography (above all in the nodules), and magnetic resonance (for lesions not made visible through the previous systems). The next step is to select the most suitable biopsy technique. The most classical and reliable technique is the surgical biopsy with prior marking using a metallic harpoon, but, besides its high cost, it has the drawback of being an aggressive technique for the diagnosis of a benign pathology. Numerous systems of puncture have been developed as alternatives. Puncture with a fine needle is technically simple to carry out and can provide good results in the mammary nodules, but the existence of positive and negative false results has progressively limited its use. As an alternative, the systems of biopsy with a broad needle have made it possible to obtain multiple cylinders with a high diagnostic reliability, above all in the case of mammary nodules. However, their use in microcalcifications continues to show negative false results. The arrival of systems of vacuum-assisted biopsy has made it possible to obtain cylinders of greater quality, above all in cases of microcalcifications. Finally, the systems of percutaneous resection biopsy by means of cannulas with a diameter of 22mm make it possible to completely extract lesions of a size below that of the cannula, with a reliability similar to that of the surgical biopsy. Key words. Breast cancer. Biopsy. Echography. Magnetic resonance. |
| 1. Unidad de Patología Mamaria. Clínica Universitaria de Navarra. Pamplona. 2. Unidad de Patología Mamaria. Hospital Virgen del Camino. Pamplona Aceptado para su publicación el 15 de septiembre de 2004 | Correspondencia Luis Pina Insausti Departamento de Radiología Clínica Universitaria de Navarra C/ Pío XII, 36 31008 Pamplona Tfno. 948 296298 Fax: 948 296500 e-mail: ljpina@unav.es |
INTRODUCCIÓN
La amplia utilización de la mamografía como método de cribado del cáncer de mama, y muy especialmente la progresiva implantación de programas de detección precoz de ámbito poblacional, han incrementado significativamente la detección de lesiones mamarias no palpables (LMNP)1,2. Estas lesiones requieren un estudio minucioso mediante técnicas de imagen, ya que en la mayoría de los casos no es necesario realizar una biopsia para asegurar el carácter benigno de las mismas. El empleo de proyecciones mamográficas complementarias como compresiones focales, ampliaciones, etc., sirve en muchos casos para asegurar la benignidad de la lesión3. Asimismo, la ecografía ha supuesto una gran ayuda tanto para aclarar la naturaleza sólida o líquida de un nódulo detectado por mamografía como para detectar LMNP en mamas densas4.
En este contexto, el establecimiento de las categorías BI-RADS del Colegio Americano de Radiología ha supuesto un importante hito en la clasificación de las LMNP5, al permitir establecer unas pautas para su diagnóstico. La categoría 1 corresponde a la mama normal, sin lesiones; la categoría 2 a lesiones benignas intrascendentes; la categoría 3 a lesiones probablemente benignas, con valor predictivo positivo (VPP) para cáncer inferior al 2%; la categoría 4 a lesiones sospechosas con un VPP variable entre el 2 y el 85%, y por último la categoría 5, altamente sospechosa de malignidad, con un VPP superior al 85%. Evidentemente, no tiene sentido realizar una biopsia de las lesiones clasificadas en las categorías 1 ó 2. Sin embargo, es preciso realizar biopsia de las lesiones de las categorías 4 ó 5 dado su moderado o alto VPP para cáncer. Es más controvertido el manejo de las lesiones de la categoría 3, ya que si bien la primera opción puede ser el seguimiento de corto intervalo (cada seis meses durante dos años), existe la alternativa de practicar una biopsia por punción que evite la ansiedad de los controles mamográficos de seguimiento6.
Tradicionalmente la biopsia de LMNP se ha realizado mediante la colocación de un arpón, y de ese modo facilitar al cirujano la localización de la lesión en quirófano. Sin embargo, la elevada proporción de lesiones benignas sometidas a biopsia, así como la mayor agresividad de la técnica quirúrgica, han potenciado la utilización de diferentes técnicas de biopsia percutánea, con el fin de evitar la cirugía de las lesiones benignas y programar mejor la de los cánceres mamarios.
En la actualidad asistimos a una gran proliferación de técnicas de biopsia de LMNP alternativas a la cirugía tradicional, tales como la punción aspirativa con aguja fina (PAAF), la biopsia con aguja gruesa (BAG), la biopsia asistida por vacío (BAV) y las cánulas de biopsia escisional percutánea (BEP). Muchos de estos instrumentos pueden ser guiados mediante ecografía, estereotaxia o incluso resonancia magnética. En este trabajo realizamos una revisión del papel de cada técnica de biopsia así como de los sistemas de guiado existentes en la actualidad.
SISTEMAS DE GUIADO
Tanto si se va a proceder al marcaje de una LMNP mediante un arpón metálico como si se va realizar una técnica de biopsia percutánea, debemos contar con un sistema de guiado fiable que permita la correcta localización de lesión.
Localización mediante mamografía
Existen diversas posibilidades, como la estimación geográfica, el método lineal, el método de arco, la triangulación, el sistema de doble compresión y el sistema de compresor fenestrado (con orificio rectangular y marcas alfanuméricas o con múltiples orificios redondeados). Todos ellos tienen la ventaja de ser de muy bajo costo; sin embargo, requieren de gran habilidad por parte del operador y a menudo son inexactos. Además son inviables para biopsias con agujas gruesas. Destacamos únicamente el papel del compresor fenestrado7 en la colocación de arpones metálicos para la localización de LMNP.
Localización mediante estereotaxia
Un sistema de estereotaxia es aquél que permite la localización de una lesión no palpable mediante el cálculo de sus tres coordenadas X, Y y Z a partir de dos imágenes de la lesión obtenidas con un ángulo conocido entre sí. A diferencia de los métodos de localización mediante mamografía, la estereotaxia aporta una gran precisión, reduce la curva de aprendizaje del operador y pueden ser utilizadas con la totalidad de instrumentos de biopsia presentes en el mercado.
En la actualidad se dispone de dos tipos de estereotaxias: las mesas de estereotaxia y los sistemas de estereotaxia adaptables al mamógrafo convencional. Aunque inicialmente la imagen se realizaba en todas ellas sobre soporte de película convencional, los equipos modernos trabajan con imagen digital.
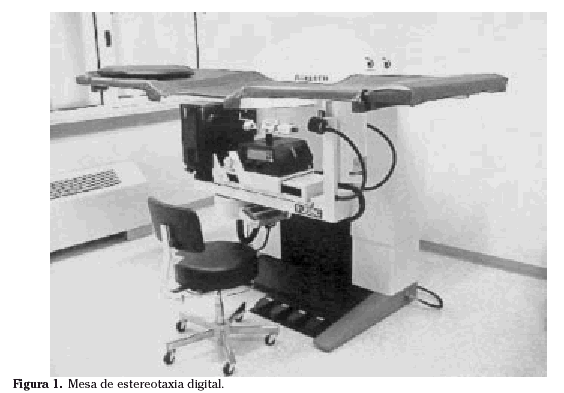
Mesas de estereotaxia
Se trata de un equipamiento sofisticado y muy preciso (Fig.1). Consiste en una mesa horizontal con una abertura para que la paciente, colocada en decúbito prono, introduzca su mama a través de la mencionada abertura. Por debajo de la mesa se encuentra el sistema de estereotaxia propiamente dicho y un mamógrafo digital. La adquisición digital de la imagen acorta en gran medida la realización del procedimiento. Además, el procesamiento mediante filtros especiales, inversión, etc., facilita la identificación de las lesiones.
La posición de la paciente en decúbito prono ofrece unas ventajas importantes: comodidad para la paciente y para el radiólogo, adecuada inmovilización de la mama y disminución de las lipotimias durante la realización del procedimiento8. Además la paciente no visualiza la realización de la prueba. Pero quizá la característica más destacable es que se trata de un sistema polivalente, que permite la realización de biopsias con todos los dispositivos existentes en el mercado8.
Los inconvenientes de estos sistemas son su alto costo, el espacio que requiere su instalación y la imposibilidad de utilizarlos para otros usos diferentes del intervencionismo mamario. Además pueden surgir dificultades en mamas muy hipoplásicas, que apenas cuelgan a través de la abertura, o en lesiones muy periféricas o posteriores. En estas últimas existe la posibilidad de introducir a la vez el brazo homolateral y la mama a través de la abertura, consiguiendo un mejor campo de trabajo9.
Estereotaxias convencionales
Estos sistemas se encuentran ampliamente difundidos, ya que su costo es muy inferior al de las mesas específicas. De hecho todos los fabricantes de mamógrafos ofrecen sistemas de estereotaxia para sus productos. Estos equipos de estereotaxia se acoplan al mamógrafo en el momento en que se realiza el procedimiento intervencionista. La paciente permanece sentada frente al mamógrafo, siendo partícipe del acto. Algunos equipos más recientes permiten también la colocación de la paciente sobre una camilla en decúbito lateral. En la mayoría de estas estereotaxias la adquisición de la imagen es convencional, mediante revelado de película, con lo que se alarga enormemente la prueba. Sin embargo los equipos más recientes están dotados de adquisición de imagen digital. No obstante, el principal problema de la mayoría de estos equipos es el escaso espacio existente entre el tubo de rayos X y la pala de compresión, lo que impide completamente la realización de algunos tipos de biopsia. Además la posición de la paciente sentada frente al mamógrafo facilita la aparición de lipotimias y de movimientos involuntarios, disminuyendo la precisión. Por último, son sistemas incómodos para el radiólogo, al hacer muy dificultoso o imposible el acceso a las lesiones mamarias por vía inferior.
Localización mediante ecografía
La ecografía, que es una técnica cada vez más empleada para la detección y caracterización de lesiones mamarias10,11, es también de gran utilidad para la localización de las mismas. Con el empleo de transductores de alta frecuencia (7,5-10 MHz) se consigue obtener imágenes de buena calidad de muchas lesiones mamarias, permitiendo incluso la detección y localización de lesiones no visibles mediante mamografía, aunque esto no la valida como técnica de screening. Sin embargo, también existen lesiones detectadas por mamografía no visibles mediante ecografía, sobre todo las agrupaciones de microcalcificaciones. En estas lesiones el tamaño de las partículas es diminuto, en torno a 100 micras, lo que unido a la menor capacidad de los ultrasonidos para detectar lesiones cálcicas comparativamente con la mamografía, hacen imposible la detección de la mayoría de agrupaciones de microcalcificaciones mediante ecografía. No obstante, las mejoras técnicas introducidas en los ecógrafos posibilitan la detección de incluso algunas de estas imágenes, especialmente si se encuentran asociadas a nódulos mamarios.
La ecografía es muy útil para localizar LMNP visibles por esta técnica, ya que se tiene control en tiempo real sobre la posición de la aguja o del instrumento de biopsia. Ello permite que la precisión sea grande, aunque siempre depende de la pericia del operador que realiza el procedimiento. La posición de la paciente, en decúbito supino o lateral, hace que se tolere bien y se eviten lipotimias. Otras ventajas son su bajo costo y la posibilidad de realizar una amplia gama de biopsias, desde los marcajes tradicionales hasta la biopsia asistida por vacío, pasando por la BAG. Sin embargo, tiene el inconveniente de que se puede producir de manera accidental un neumotórax iatrogénico en el caso de lesiones muy próximas a la pared torácica. Esta complicación es muy poco frecuente, especialmente en manos experimentadas.
Básicamente existen dos maneras de localizar lesiones con ecografía: mediante guías adaptadas al transductor, facilitadas por el fabricante, y mediante la técnica de manos libres. En la primera, la punción es más fácil, dado que el trayecto virtual de la aguja se dibuja en el monitor como una línea de puntos. Sin embargo, el ángulo de incidencia que presenta a menudo puede no ser el más adecuado, además de imposibilitar la realización de BAV.
En cambio, en la técnica de manos libres mientras una mano sujeta el transductor la otra sujeta el instrumento de biopsia (Fig. 2). El ángulo de entrada puede ser variable, pero lo habitual es introducir la aguja lo más paralela al tórax dentro de lo posible para evitar la complicación del neumotórax y tener también una mejor visión de la aguja. La principal ventaja es la gran rapidez del procedimiento y la posibilidad de emplear agujas de gran calibre.
Localización mediante resonancia magnética
La resonancia magnética (RM) de mama es una técnica emergente, y en la actualidad está considerada como la más sensible para la detección del carcinoma infiltrante, próxima al 100%. Sin embargo, su especificidad es más variable12, entre un 30 y un 90%. Ante una imagen sospechosa únicamente detectada mediante RM debe revisarse, en primer lugar, el estudio mamográfico y completar mediante una ecografía selectiva de la zona problemática. De este modo se pueden evidenciar las lesiones mediante técnicas convencionales. En aquellos casos en los que no es posible su detección ecográfica o mamográfica, existe la posibilidad de realizar una localización mediante dispositivos adaptables a la RM13. Estos dispositivos permiten colocar tanto un arpón metálico como practicar una biopsia con aguja gruesa, así como los modernos sistemas de biopsia asistidos por vacío.
TÉCNICAS DE BIOPSIA DE LESIONES MAMARIAS NO PALPABLES
En la actualidad existe un amplio espectro de sistemas de biopsia percutánea de LMNP, muy diferentes entre sí (Fig. 3). Estas técnicas tienen las ventajas de ser realizadas en régimen ambulatorio, empleando anestesia local, con una buena tolerancia por parte de las pacientes, con mínima o nula cicatriz, con un coste inferior al de la biopsia quirúrgica y con una rápida incorporación de la paciente a sus quehaceres diarios. Conviene realizar un breve recuerdo de las diferentes técnicas de biopsia mamaria.
Biopsia quirúrgica
La biopsia quirúrgica (BQ) continúa siendo el método de referencia para obtener un estudio histológico de las lesiones de la mama7. Dado que permite en ocasiones la extirpación completa y no fragmentada de la lesión mamaria, con la posibilidad de poder evaluar los márgenes en el especimen, este tipo de biopsia tiene también valor terapéutico en algunos casos malignos. El estudio anatomopatológico puede realizarse para determinar si se trata de una lesión maligna y evaluar sus márgenes en el propio acto quirúrgico (biopsia intraoperatoria) o de manera diferida. Los inconvenientes de la biopsia quirúrgica son su excesiva agresividad, ya que a menudo requiere de ingreso, anestesia general o sedación, deja defectos estéticos permanentes, y su más alto costo. Teniendo en cuenta que la mayoría de las LMNP detectadas por mamografía pertenecientes a la categoría BI-RADS 4 son benignas, parece evidente que esta técnica puede ser desproporcionada en muchos casos, sobre todo si se busca confirmar la benignidad de una lesión. Sin embargo, en las lesiones de la categoría 5, que mayoritariamente son cáncer, la biopsia quirúrgica puede ser adecuada para confirmar el diagnóstico y además ser terapéutica. A pesar de que la BQ es el sistema de biopsia mamario de referencia, no está exento de resultados insuficientes (ausencia de lesión en el espécimen) y falsos negativos. Así, en la serie de Jackman14 sobre 280 lesiones no palpables, la biopsia resultó fallida en 7 casos (2,5%). Este autor expone que todos los casos fallidos se correspondieron con microcalcificaciones y de tamaño inferior a 10 mm. Norton15 obtuvo unos resultados de biopsias fallidas de hasta un 17,9 %.
Con ayuda de la mamografía, estereotaxia o ecografía, se pueden colocar con precisión marcajes preoperatorios que sirvan como guía al cirujano en el acto operatorio. Básicamente existen dos modelos de marcajes: los metálicos7 y los de carbono al 4 %. Los primeros, con las múltiples variantes existentes, son más fáciles de seguir en el quirófano que las soluciones de carbono. Sin embargo, los marcajes de carbono son más inocuos y no requieren su colocación en los momentos previos a la cirugía, además de no movilizarse16,17.
Punción aspirativa con aguja fina (PAAF)
De todas las técnicas de diagnóstico percutáneo se trata de la más simple, inocua y económica18,19, pero es también la que más resultados falsos negativos y positivos ofrece. Se ha realizado con agujas de diferentes calibres (habitualmente 20–25 G) y con diversos dispositivos (desde agujas simples hasta otras en forma de sacacorchos). Bien con guía ecográfica o estereotáxica, sus resultados pueden ser satisfactorios, sobre todo en el caso de los nódulos mamarios. De hecho es la técnica de elección para la evacuación de quistes mamarios7. Sin embargo, es una técnica operador dependiente, tanto del que realiza la punción como del citólogo que interpreta los resultados y difícilmente reproducible entre diferentes centros20. La sensibilidad en diferentes series varía desde un 7719 hasta el 93%21. En cuanto a la especificidad oscila entre un 7222 y un 100%23. La proporción de aspirados con material insuficiente es variable, oscilando desde un 8,6% en la serie de Azavedo18 hasta el 42% en la de Iles24. Otro aspecto es la desviación de su trayectoria que experimentan en ocasiones las agujas finas, sobre todo al atravesar tejido fibroso, así como el desplazamiento de las lesiones al ser puncionadas, lo que resta precisión a la prueba. Pero quizá son los pobres resultados que se obtienen, especialmente en el caso de microcalcificaciones22 y los falsos negativos producidos por los carcinomas hipocelulares, como los intraductales, así como la imposibilidad de diferenciar con fiabilidad suficiente los carcinomas in situ de los infiltrantes, circunstancias que han determinado el desarrollo de nuevas técnicas de biopsia más fiables.
Biopsia con aguja gruesa (BAG)
Habitualmente realizada con agujas de calibre 18G, 16G y sobre todo 14G, esta técnica ha supuesto un auténtico cambio en el diagnóstico de las lesiones mamarias. Desde su introducción a principios de los años 9025, su uso se ha ido generalizando. A diferencia del diagnóstico citológico, la BAG permite un diagnóstico histológico, con el reconocimiento de la arquitectura de la lesión, y con ello realizar un diagnóstico mucho más fiable.
La diversidad de instrumentos de BAG es muy amplia, aunque son los sistemas automáticos con agujas de corte Tru-cut los más empleados.
Desde las grandes series del estudio multicéntrico de Parker26, con 6.152 casos, hasta otras más recientes, como la de Brenner27 se ha demostrado la utilidad de esta técnica. En la literatura existen múltiples estudios sobre la utilidad de la BAG en el diagnóstico de LMNP. Lee28 se demostró una tasa de resultados falsos negativos del 2%, con un seguimiento medio de 20 meses sobre 298 lesiones. Sin embargo, lesiones complejas y heterogéneas, como pueden ser las distorsiones arquitecturales, tampoco pueden ser manejadas de manera fiable mediante BAG29. Por otro lado los resultados anatomopatológicos dudosos, tales como hiperplasia ductal atípica, carcinoma lobulillar in situ, o lesiones papilares pueden infravalorar una lesión maligna29. En los casos de microcalcificaciones el rendimiento diagnóstico de la BAG es claramente inferior al obtenido en los nódulos30.
La capacidad de la BAG para caracterizar un cáncer de mama como infiltrante tiene implicaciones en el manejo posterior de la lesión, ya que supone la realización de un vaciamiento axilar o un estudio del ganglio centinela al mismo tiempo que el tratamiento convencional sobre la mama. Sin embargo, existe el riesgo de infravalorar la infiltración. Ello se debe a que pueden coexistir un carcinoma infiltrante con otro intraductal, y la BAG puede haber obtenido material únicamente del segundo. En el estudio multicéntrico de Jackman31 se infravaloró la infiltración en un 20,4%. Menos frecuentemente se puede sobrediagnosticar una infiltración por un desplazamiento del epitelio glandular que no es reconocido como artefacto, ya sea en los propios cilindros de la muestra o en la propia lesión de la mama32. En cuanto a la posibilidad de siembra tumoral en el trayecto de la aguja hay artículos que destacan su valor, por lo que recomiendan la extirpación del trayecto en el acto quirúrgico33. Otros autores encuentran asimismo desplazamiento de células tumorales en el trayecto, pero ponen en duda la supervivencia de esas células34.
Otro tema estudiado en la literatura es el ahorro de costes que supone la introducción de estos sistemas. Así, en un trabajo de Liberman35 se calcula un ahorro superior al 50%. Otros autores ven un ahorro diferente según el tipo de lesión, Lee36 calcula un ahorro de 807$ por caso si la lesión es una masa, mientras que el ahorro es de 630$ si se trata de microcalcificaciones.
En cuanto a las complicaciones de la técnica, en el estudio multicéntrico de Parker26 sólo se apreciaron 6 casos con trascendencia clínica entre 3.765 (0,9 %).
Biopsia asistida por vacío (BAV)
Debido a los resultados falsos negativos obtenidos con las agujas de corte Tru-cut de calibre 14, y como evolución técnica de las mismas, se ideó un nuevo sistema de biopsia con aguja asistida por vacío. En la actualidad existen varios dispositivos que emplean esta técnica, siendo los más empleados el Mamotomo (Biopsys Medical, EEUU) y el Vacuflash (BIP Medical, Alemania). Ambos son similares, mostrando escasas diferencias entre sí. Lo más destacable es el empleo de agujas de gran calibre (11G y 10G respectivamente) asistidas mediante aspiración, que permiten por tanto una succión del tejido. Además, las cuchillas accionadas eléctricamente realizan un corte de mejor calidad que el de los sistemas de BAG (Fig. 4).
Otra de las características del sistema es que no precisa retirar la aguja para extraer el especimen, con lo que se pueden obtener múltiples cilindros con una mínima incisión en la piel. Aunque en la literatura consultada la inmensa mayoría de casos han sido realizados en mesas de estereotaxia, algunas referencias existen en estereotaxias adaptables a mamógrafos convencionales, aunque dotadas de imagen digital37.
La bibliografía es cada vez más amplia sobre estos instrumentos de biopsia, que se emplean mayoritariamente en casos de microcalcificaciones38-41. En la serie de Liberman42 se demuestra que la discordancia entre la imagen mamográfica y el resultado histológico es significativamente menor para el Mamotomo de 11G que para las agujas Tru-cut 14G en los casos de las microcalcificaciones. Sin embargo, estos autores no apreciaron diferencias significativas entre ambos sistemas para los nódulos mamarios. Philpotts43 demostró que la proporción de pacientes a las que se realizaba una segunda biopsia debido a la existencia de microcalcificaciones se reducía significativamente con el empleo de agujas asistidas por aspiración de calibre 11G. Ese mismo autor demostró que para los nódulos mamarios esa reducción no era significativa.
Existen trabajos en los que se destaca la mejora en el diagnóstico de las lesiones borderline mediante BAV, tales como la hiperplasia ductal atípica, carcinoma lobulillar in situ o lesiones papilares, comparativamente con las agujas Tru-cut de calibre 14G44. Sin embargo, se sigue proponiendo la extirpación quirúrgica de dichas lesiones. Así, en la serie de Brem 45 hasta un 25% de las lesiones diagnosticadas como hiperplasia ductal atípica correspondieron a lesiones malignas En otro trabajo de Brem46 un 9% de los carcinomas intraductales fueron posteriormente infiltrantes.
Una de las características de estos sistemas de biopsia es la capacidad de extraer completamente pequeñas lesiones. En estos casos está previsto la colocación de un clip metálico en el lugar de la biopsia como parte del procedimiento. El objetivo de dicho clip es servir como marcador, bien para la ampliación de márgenes tras un resultado maligno o borderline, o bien para facilitar el seguimiento posterior. Sin embargo, existen referencias sobre el movimiento de dichos marcadores metálicos, especialmente en el eje Z47. Además, es habitual la persistencia de tumor tras la aparente extirpación de la lesión. Así, en la serie de Liberman48 encontraron tumor residual en el 73% de los cánceres extirpados radiológicamente con Mamotomo.
La incidencia de complicaciones que aparece recogida en la literatura es baja, en torno al 3,9% durante el procedimiento y un 3,6 % en el periodo posterior49. Habitualmente se trata de hematomas que no requieren drenaje, o reacciones vasovagales sin trascendencia.
En un estudio de Liberman50 se demuestra que el empleo de esta técnica puede disminuir un 76% la realización de biopsias quirúrgicas, ahorrando un 20% de los costes.
Biopsia escisional percutánea (BEP)
El primer instrumento de biopsia escisional percutánea fue el sistema ABBI (Advanced Breast Biopsy Instrumentation, USSC/Tyco, EEUU). Este instrumento permitía obtener un único cilindro de tejido mamario de gran tamaño, encontrándose disponible la cánula de biopsia en cuatro calibres diferentes: 5, 10, 15 y 20 mm.
Se trataba, en realidad, de una cirugía menor bajo control estereotáxico. De hecho era realizada mayoritariamente por cirujanos, ayudados por radiólogos para la localización estereotáxica.
En la actualidad el sistema ABBI ha dejado de comercializarse, siendo sustituido por el sistema Site-Select (Imagyn Medical Technologies Inc, EEUU), que es de características muy similares.
La principal característica de la BEP es la de obtener un especimen único de gran tamaño, similar al de una biopsia quirúrgica (Fig. 5). Esto permite aunar las ventajas de un diagnóstico fiable y de una buena tolerancia por parte de la paciente. De hecho esta técnica se realiza de manera ambulatoria y con empleo de anestesia local. El especimen es sistemáticamente radiografiado (Fig. 6), con lo que se confirma la correcta extirpación de la lesión. Además se obtiene una radiografía digital de la cavidad de biopsia. Sin embargo, produce una cicatriz en la piel y un defecto estético, que pueden ser similares a las de algunas biopsias quirúrgicas.
La biopsia BEP no está aprobada por la FDA con fines terapéuticos, aunque ocasionalmente se ha utilizado de esa manera tras la confirmación de márgenes libres.
A pesar de ser unas técnicas prometedoras, de agresividad intermedia entre la biopsia asistida por vacío y la biopsia quirúrgica, han generado gran controversia como queda reflejado en la literatura51-55. Los argumentos esgrimidos contra el ABBI aparecen recogidos en un artículo de Liberman51, y básicamente son:
a) Elevada proporción de casos no adecuados para la técnica.
b) Tasa de fallos técnicos.
c) Especímenes excesivamente grandes.
d) Complicaciones frecuentes.
e) Escasa proporción de cánceres mamarios en diferentes series.
f) Costes elevados de la técnica.
Sin embargo, las publicaciones en medios quirúrgicos son más entusiastas con la técnica56,57. En una revisión de Velanovich57 se confirmó la técnica de biopsia ABBI como la más eficiente, comparativamente con las biopsias con aguja gruesa o asistidas por vacío. De hecho, la biopsia ABBI tuvo una sensibilidad del 100% y una especificidad del 100%.
Esta posibilidad de extirpar completamente LMNP la hace particularmente útil en el caso de distorsiones arquitecturales de tamaño inferior a 20 mm58.
En cuanto a los fallos técnicos del sistema en la serie de Velanovich57 ascendieron a un 7,5%, y la afectación de márgenes en los casos malignos fueron de un 63,6%, con una persistencia tumoral en un 71,4%. Sin embargo otros autores58 obtienen márgenes libres en el 48% de los cánceres menores de 20 mm de tamaño máximo, ascendiendo hasta el 77% en el caso de carcinomas de tamaño igual o inferior a 10 mm.
En la tabla 1 se ofrece un breve resumen comparativo de las diferentes técnicas de biopsia que se han expuesto con anterioridad.
CONCLUSIÓN
Ante toda LMNP que requiera una biopsia hay que plantearse, en primer lugar cuál va a ser el sistema de guiado más adecuado (estereotaxia, ecografía, RM), y en segundo lugar cuál es la técnica con mejor rendimiento diagnóstico y mejor relación coste/efectividad. No puede establecerse un protocolo inamovible de manejo diagnóstico de LMNP, pero a la luz de los datos de la literatura puede concluirse que la mayoría de los nódulos mamarios pueden ser diagnosticados mediante BAG o incluso PAAF, preferiblemente guiada por ecografía. En los casos de microcalcificaciones debe extraerse mayor cantidad de tejido, siendo la BAV dirigida mediante estereotaxia la opción más comúnmente utilizada, aunque puede emplearse en casos concretos la BEP. En las distorsiones de la arquitectura mamaria se debe seguir aconsejando su extirpación, bien quirúrgica o mediante BEP si se trata de una lesión de tamaño inferior a 20 mm. No obstante, debe ser la experiencia individual de cada centro la que dictamine el protocolo de manejo diagnóstico de estas lesiones.
BIBLIOGRAFÍA
1. Ciatto S, Rosselli Del Turco M, Giorgi D, Morrone D, Catarzi S, Ambrogetti D et al. Non-palpable lesions of the breast detected by mammography. Eur J Cancer 1994; 30: 40-44. [ Links ]
2. Azavedo E. Non-palpable breast cancers: detection, diagnostic and prognostic aspects. Acta Radiol Suppl 1992; 378: 137-146. [ Links ]
3. Feig HP. The importance of supplementary mammographic views to diagnostic accuracy. AJR 1998; 151: 40-41. [ Links ]
4. Kaplan SS. Clinical utility of bilateral whole-breast US in the evaluation of women with dense breast tissue. Radiology 2001; 221: 641-649. [ Links ]
5. American College of Radiology. Breast imaging reporting and data system (BI-RADS). 2nd ed. Reston. En: American College of Radiology, 1998. [ Links ]
6. Apesteguía L, Pina L, Inchusta M, Mellado M, Franquet T, De Miguel C et al. Nonpalpable, well-defined, probably benign breast nodule: management by fine-needle aspiration biopsy and long-interval follow-up mammography. Eur Radiol 1997; 7: 1235-1239. [ Links ]
7. Kopans DB. Colocación de agujas para biopsia por métodos guiados por imagen. En: La mama. Kopans DB. Editorial Marban 1999. [ Links ]
8. Pina L, Mellado M, Cojo R, Laso C, Alberoo JA, Rezola R. Aplicaciones de una mesa de estereotaxia digital en el diagnóstico de lesiones mamarias no palpables: presentación de nuestra experiencia. Radiol 2000; 42: 155-163. [ Links ]
9. Soo MS, Walsh R, Patton J. Prone table stereotactic breast biopsy: facilitating biopsy of posterior lesions using the arm-through-the-hole technique. AJR 1998; 171: 615-617. [ Links ]
10. Kaplan SS. Clinical utility of bilateral whole-breast US in the evaluation of women with dense breast tissue. Radiology 2001; 221: 641-649. [ Links ]
11. Smith DN. Breast ultrasound. Radiol Clin North Am 2001; 39: 485-497. [ Links ]
12. Kuhl CK. MRI of breast tumors. Eur Radiol 2000; 10: 46-58. [ Links ]
13. Heywang-Köbrunner SH, Heinig A, Pickuth D, Alberich T, Spielman RP. Interventional MRI of the breast: lesion localisation and biopsy. Eur Radiol 2000; 10: 36-45. [ Links ]
14. Jackman RJ, Marzoni FA. Needle-localized Breast Biopsy: Why Do We Fail? Radiology 1997; 204: 677-684. [ Links ]
15. Norton LW, Zeligman BE, Pearlman NW. Accuracy and cost of needle localization breast biopsy. Arch Surg 1988; 123: 947-950. [ Links ]
16. Canavese G, Catturich A, Vecchio C, Tomei D, Estieme M, Moresco L et al. Preoperative localization of nonpalpable lesions in breast cancer by charcoal suspension. Eur J Surg Oncol 1995; 21: 47-49. [ Links ]
17. Langlois S, Carter ML. Carbon localisation of impalpable mammographic abnormalities. Australas Radiol 1991; 35: 237-241. [ Links ]
18. Azavedo E, Svane G, Auer G. Stereotactic fine needle biopsy in 2594 mammographically detected nonpalpable lesions. Lancet 1989; 1: 1033-1036. [ Links ]
19. Fajardo LL, Davis JR, Wiens JL. Mammography guided stereotactic fine needle aspiration cytology of nonpalpable breast lesions: prospective comparison with surgical biopsy results. AJR 1990; 155: 977-981. [ Links ]
20. Dixon JM, Lamb J, Anderson TJ. Fine needle aspiration of the breast: importance of the operator. Lancet 1983; 2: 564. [ Links ]
21. Löfgren M, Anderson I, Lindholm K. Stereotactic fine-needle aspiration for cytologic diagnosis of nonpalpable breast lesions. AJR 1990; 154: 1195-1196. [ Links ]
22. Dowlatshashi K, Yaremko ML, Kluskens LF, Jokich PM. Nonpalpable breast lesion: Findings of stereotaxic needle-core biopsy and fine-needle aspiration cytology. Radiology 1991; 181: 745-750. [ Links ]
23. Evans WP, Cade SH. Needle localization and fine-needle aspiration biopsy of nonpalpable breast lesions with use of standard and stereotactic equipment. Radiology 1990; 173: 53-56. [ Links ]
24. Iles SE, MacGregor JH, Bohurta AJ, Bernardo AI, Daniels C. Stereotactic fine-needle aspiration cytology of nonpalpable breast lesions: initial experience in a tertiary-care institution. Can Assoc Radiol J 1994; 45: 28-34. [ Links ]
25. Parker SH, Lovin JD, Jobe WE, Luethke JM, Hopper KD, Yakes WF et al. Stereotactic breast biopsy with a biopsy gun. Radiology 1990; 176: 741-747. [ Links ]
26. Parker SH, Burbank F, Jackman RJ, Aucreman CJ, Cardenosa G, Cink TM et al. Percutaneous Large-core Breast biopsy: A Multi-institutional Study. Radiology 1994; 193: 359-364. [ Links ]
27. Brenner RJ, Basset LW, Fajardo LL, Dershaw DD, Evans WP, Hunt R et al. Stereotactic core-needle breast biopsy: a multi-institutional prospective trial. Radiology 2001; 218: 866-872. [ Links ]
28. Lee CH, Philpotts LE, Horvath LJ, Tocino I. Follow-up of breast lesions diagnosed as benign with stereotactic core-needle biopsy: frequency of mammographic change and false-negative rate. Radiology 1999; 212: 189-194. [ Links ]
29. Philpotts LE, Shaheen NA, Jain KS, Carter D, Lee CH. Uncommon high-risk lesions of the breast diagnosed at stereotactic core-needle biopsy: clinical importance. Radiology 2000; 216: 831-837. [ Links ]
30. Liberman L, Dershaw DD, Rosen PP, Abramsom AF, Deutch BM, Hann LE. Stereotactic 14-gauge Breast Biopsy: how many core specimens are needed? Radiology 1994; 192: 793-795. [ Links ]
31. Jackman R, Burbank F, Parker S, Evans W, Lechner M, Richardson T et al. Stereotactic breast biopsy of nonpalpable breast lesions: determinants of ductal carcinoma in situ underestimation rates. Radiology 2001; 218: 497-502. [ Links ]
32. Youngson BJ, Liberman L, Rosen PP. Displacement of carcinomatous epithelium in surgical breast specimens following stereotaxic core biopsy. Am J Clin Pathol 1995; 103: 598-602. [ Links ]
33. Stolier A, Skinner J, Levine EA. A prospective study of seeding of the skin after core biopsy of the breast. Am J Surg. 2000; 180: 104-107. [ Links ]
34. Chao C, Torosian MH, Boraas MC, Sigurdson ER, Hoffman JP, Eisenberg BL et al. Local recurrence of breast cancer in the stereotactic core needle biopsy site: case reports and review of the literature. Breast J 2001; 7: 124-127. [ Links ]
35. Liberman L, Fahs MC, Dershaw DD, Bonaccio E, Abramson AF, Cohen MA et al. Impact of stereotaxic core breast biopsy on cost of diagnosis. Radiology 1995; 195: 633-637. [ Links ]
36. Lee CH, Egglin TK, Philpotts L, Mainiero MB, Tocino I. Cost-effectiveness of stereotactic core needle biopsy: analysis by means of mammographic findings. Radiology 1997; 202: 849-854. [ Links ]
37. Nisbet AP, Borthwick-Clarke A, Scott N. 11-gauge vacuum assisted directional biopsy of breast calcifications, using upright stereotactic guidance. Eur J Radiol 2000; 36: 144-146. [ Links ]
38. Parker SH, Klaus AJ. Performing a breast biopsy with a directional, vacuum-assisted biopsy instrument. Radiographics 1997; 17: 1233-1252. [ Links ]
39. Heywang-Köbrunner SH, Schaumloffel U, Viehweg P, Hofer H, Buchmann J, Lampe D. Minimally invasive stereotaxis vacuum core breast biopsy. Eur Radiol 1998; 8: 377-385. [ Links ]
40. Apesteguía L, Mellado M, Sáenz J, Cordero JL, Reparaz B, De Miguel C. Vacuum-assisted breast biopsy on digital stereotaxic table of nonpalpable lesions non-recognisable by ultrasonography. Eur Radiol 2002; 12: 638-645. [ Links ]
41. Liberman L, Smolkin JH, Dershaw DD, Morris EA, Abramson AF, Rosen PP. Calcificationn retrieval at stereotactic, 11-gauge, directional, vacuum-assisted breast biopsy. Radiology 1998; 208: 251-260. [ Links ]
42. Liberman L, Drotman M, Morris EA, LaTrenta LR, Abramson AF, Zakowski MF et al. Imaging-histologic discordance at percutaneous breast biopsy. Cancer 2000; 89: 2538-2546. [ Links ]
43. Philpots LE, Shaheen NA, Carter D, Lange RC, Lee CH. Comparison of rebiopsy rates after stereotactic core needle biopsy of the breast with 11-gauge vacuum suction probe versus 14-gauge needle and automatic gun. AJR 1999; 172: 683-687. [ Links ]
44. Rosenfield Darling ML, Smith DN, Lester SC, Kaelin C, Selland DLK, Denison CM et al. Atypical ductal hyperplasia and ductal carcinoma in situ as revealed by large-core needle breast biopsy: results of surgical excision. AJR 2000; 175: 2341-1346. [ Links ]
45. Brem RF, Behrndt VS, Sanow L, Gatewood OM. Atypical ductal hyperplasia: histologic underestimation of carcinoma in tissue harvested from impalpable breast lesions using 11-gauge stereotactically guided directional vacuum-assisted biopsy. AJR 1999; 172: 1405-1407. [ Links ]
46. Brem RF, Schoonjans JM, Sanow L, Gatewood OM. Reliability of histologic diagnosis of breast cancer with stereotactic vacuum-assisted biopsy. Am Surg 2001; 67: 388-392. [ Links ]
47. Rosen E, Vo T. Metallic clip deployment during stereotactic breast biopsy: retrospective analysis. Radiology 2001; 218: 510-516. [ Links ]
48. Liberman L, Dershaw DD, Rosen PP, Morris EA, Abramson AF, Borgen PI. Percutaneous removal of malignant mammographic lesions at stereotactic vacuum-assisted biopsy. Radiology 1998; 206: 711-715. [ Links ]
49. Lai JT, Burrowes P, MacGregor JH. Vacuum-assisted large-core breast biopsy: complications and their incidence. Can Assoc Radiol J 2000; 51: 232-236. [ Links ]
50. Liberman L, Sama MP. Cost-effectiveness of stereotactic 11-gauge directional vacuum-assisted breast biposy. AJR 2000; 175: 53-58. [ Links ]
51. Liberman L. Advanced Breast Biopsy Instrumentation (ABBI): analysis of published experience. AJR 1999; 172: 1413-1416. [ Links ]
52. Leibman AJ, Frager D, Choi P. Experience with breast biopsies using the Advanced Breast Biopsy Instrumentation system. AJR 1999; 172: 1409-1412. [ Links ]
53. Rebner M, Chesbrough R, Gregory N. Initial Experience with the Advanced Breast Biopsy Instrumentation device. AJR 1999; 173: 221-226. [ Links ]
54. Smathers RL. Advanced Breast Biopsy Instrumentation device: percentages of lesion and surrounding tissue removed. AJR 2000; 175: 801-803. [ Links ]
55. Pina L, Alberro JA, Regueira F, Imaña J, Vivas I, Martínez-Cuesta A et al. An experience with the Advanced Breast Biopsy Instrumentation (ABBI) system in the management of non-palpable breast lesions. Eur Radiol 2002; 12: 1703-1710. [ Links ]
56. Kelley WE, Bailey R, Bertelsen C, Diaco J, Hagans J, Kritsky K et al. Stereotactic automated surgical biopsy using the ABBI biopsy device: a multicenter study. Breast J 1998; 4: 302-306. [ Links ]
57. Velanovich V, Lewis FR, Nathanson SD, Strand VF, Talpos GD, Bhandarkar S et al. Comparison of mammographically guided breast biopsy techniques. Ann Surg 1999; 229: 625-633. [ Links ]
58. Pina L. Lesiones mamarias no palpables: criterios para la elección entre las distintas técnicas de biopsia diagnóstica (Tesis Doctoral). Pamplona (Navarra). Univ de Navarra, 2002. [ Links ]