Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Anales del Sistema Sanitario de Navarra
versión impresa ISSN 1137-6627
Anales Sis San Navarra vol.27 supl.3 Pamplona 2004
Enfermedad metastásica ósea. Diagnóstico y tratamiento
Metastatic bone disease. Diagnosis and treatment
A.J. Garbayo1, E. Villafranca2, A. De Blas3, A. Tejero1, E. Eslava1, A. Manterola2, P. Romero2, M. Martínez4
| RESUMEN La alta incidencia de metástasis óseas secundarias a carcinomas y la grave repercusión funcional que provocan, son motivos de constante estudio y avance en los métodos de evaluación, diagnóstico y tratamiento. El dolor es el síntoma más frecuente de presentación, aunque a veces el comienzo es una fractura patológica. Palabras clave. Cáncer. Metástasis óseas. Diagnóstico y tratamiento. | ABSTRACT The high incidence of bone metastasis secondary to carcinomas and its serious functional repercussion are motives for constant study and advance in the methods of evaluation, diagnosis and treatment. Pain is the most frequently shown symptom, although at times the start is a pathological fracture. Key words. Cancer. Bone metastasis. Diagnosis and treatment. |
| 1. Servicio de Traumatología y Cirugía Ortopédica. Hospital de Navarra. Pamplona. 2. Servicio de Oncología Radioterápica. Hospital de Navarra. Pamplona. 3. Servicio de Radiología. Hospital de Navarra. Pamplona. 4. Servicio de Oncología Médica. Hospital de Navarra. Pamplona. | Correspondencia: Antonio Jesús Garbayo Marturet Servicio de Traumatología y Cirugía Ortopédica Hospital de Navarra C/ Irunlarrea, 3 31008 Pamplona Tfno. 848 422206 E-mail: aigarbayom@retena.com ajgarbayom@eresmas.com |
INTRODUCCIÓN
Los recientes avances en los métodos de evaluación y diagnóstico, así como los progresos en el tratamiento de pacientes con tumores malignos han repercutido en una mejoría en su expectativa de vida. En el plano negativo hay que reseñar un aumento paralelo de las metástasis óseas, con todas sus manifestaciones clínicas.
Se ha calculado que hasta 3/4 partes de los pacientes que fallecen por cáncer presentan metástasis óseas en el momento de su muerte1. Esto supone una amenaza para una calidad de vida ya de por sí deteriorada y un reto para oncólogos y ortopedas, que conjuntamente tratan de paliar los efectos negativos de esta complicación de la enfermedad general.
Se estima que en EEUU se diagnostican 1,2 millones de nuevos casos de cáncer por año. Entre el 50 y 65%, es decir, entre 600.000 y 780.000, presentarán metástasis en el esqueleto2.
Actualmente, en nuestro país, el número de nuevos casos de cáncer es de 162.000 por año. Unos 52.000 corresponden a localizaciones primarias con una gran predisposición a metastatizar en hueso, por orden de frecuencia en números absolutos de casos por año: pulmón, mama, próstata, riñón y tiroides3. De entre estos últimos, alrededor del 75% presentarán alguna metástasis ósea durante su evolución4,5.
La magnitud global del problema y su grave repercusión en los pacientes obligan a un proceso constante de revisión en los métodos de detección y tratamiento de la llamada enfermedad metastásica ósea.
FISIOPATOLOGÍA
Las metástasis óseas se desarrollan a partir de émbolos de células malignas que, procedentes del tumor primario y favorecidas por el crecimiento y la necrosis tumoral, acceden a través de los vasos linfáticos y sanguíneos al tejido óseo. Otras vías menos frecuentes son la extensión directa desde el tumor primario (carcinoma nasofaríngeo hacia base de cráneo) o desde una localización secundaria (extensión vertebral desde adenopatías retroperitoneales).
El número de émbolos tumorales en circulación se correlaciona con el tiempo de evolución y el tamaño del tumor original, aunque no es pronóstico de una incidencia segura de metástasis a distancia6.
Debido a peculiaridades en su anatomía vascular y hemodinámica, las células tumorales en circulación son filtradas principalmente por tres órganos: el pulmón, el hígado y la médula ósea7.
Por otra parte, factores quimiotácticos segregados por el propio tejido huésped, favorecen una "apetencia selectiva" de las células tumorales por determinados órganos. Esto explica el que algunos tumores como el carcinoma de próstata o mama tengan una especial "atracción" por el tejido óseo. Este conjunto de factores anatómicos y bioquímicos proporciona un "microambiente" adecuado para la colonización y desarrollo de las células tumorales.
Una vez en el hueso, su destrucción se produce por un doble mecanismo: el crecimiento del tumor y la activación de los osteoclastos. Las células tumorales aportan poco de forma directa en la reabsorción ósea, sin embargo, producen factores que estimulan el reclutamiento y la activación de los osteoclastos. Algunos de los factores involucrados en la reabsorción ósea mediada por los tumores son: interleukinas 1 y 6, colágeno tipo I, TGF-b (Transforming Growth Factor-b), TNF-a (Tumor Necrosis Factor-a) y osteocalcina1,8,9.
Recientemente se ha descrito otra vía importante en la osteoclastogénesis: la vía RANKL/RANK/osteoprotegerina10. RANKL (Receptor Activator of Nuclear factor Kappa b-Ligand) la producen los osteoblastos y los osteoclastos expresan RANK (Receptor Activator of Nuclear factor Kappa b). RANKL estimula la diferenciación y activación de los osteoclastos. La osteoprotegerina es una sustancia que compite con RANK para su receptor RANKL y modula su efecto, disminuyendo la osteolisis y favoreciendo la formación ósea. Por el contrario la ausencia de osteoprotegerina aumenta la reabsorción ósea. Esta vía tendrá importante repercusión clínica, todavía en desarrollo, en el tratamiento de las metástasis óseas.
Otra sustancia importante en la fisiopatología de las metástasis óseas es la PTHrP (Parathyroid Hormone-Related Peptide). La PTHrP actúa sobre los receptores de la hormona paratiroidea (PTH) y estimula la reabsorción ósea, además de favorecer la reabsorción renal del calcio. Esta sustancia interviene en la hipercalcemia tumoral11 y en la formación y mantenimiento de las metástasis óseas12.
A diferencia de lo que sucede en el remodelado óseo normal, la reabsorción ósea que se produce en la enfermedad metastásica se acompaña de una formación de hueso compensatoria insuficiente, lo que deriva en una osteolisis progresiva con deterioro de las capacidades mecánicas del hueso y en último término fractura patológica.
INCIDENCIA
Es difícil valorar la incidencia exacta global de las metástasis óseas. Es bien conocido que, con distintas frecuencias, cualquier tumor maligno puede metastatizar en hueso. Con gran diferencia, el tumor maligno óseo más frecuente es la metástasis, habitualmente en relación con carcinomas y menos con sarcomas. La incidencia varía dependiendo de los medios utilizados para el diagnóstico. Así, cuando empleamos datos clínicos y radiológicos, el 15% de los pacientes con algún tipo de carcinoma presenta metástasis en hueso, cifra que aumenta al 30% si los datos provienen de autopsias. Probablemente hay muchos casos en los que pasan desapercibidas y la incidencia real es mucho mayor, y ronda globalmente el 50%. Por otra parte se trata de cifras en aumento debido al incremento en la esperanza de vida.
Para determinados tipos de tumores primarios, con especial afinidad por el tejido óseo (mama, próstata, pulmón, tiroides y riñón), la posibilidad de presentar metástasis esqueléticas aumenta oscilando entre el 30 y 85%6.
EPIDEMIOLOGÍA
La enfermedad metastásica ósea puede aparecer en pacientes jóvenes, pero es más habitual en mayores de 40 años. En cuanto al sexo, los tumores de mama son los que más metastatizan en mujeres y los de próstata en hombres.
LOCALIZACIÓN
Las metástasis pueden afectar a cualquier hueso del cuerpo. Presentan mayor afinidad por el esqueleto axial. La columna vertebral constituye el asiento más frecuente. La región lumbar es la más afectada, seguida de la torácica, cervical y sacra. Costillas y pelvis son también localizaciones habituales de este tipo de lesiones5. En la vértebra, inicialmente la invasión tiene lugar en el cuerpo, si bien la primera manifestación radiológica puede ser la lesión en el pedículo.
En las extremidades es frecuente la afectación proximal de fémur y húmero. Son raras las metástasis distales a la rodilla y al codo, aunque las hay descritas hasta en los pequeños huesos de manos y pies13.
CLÍNICA
El dolor es el síntoma más frecuente y suele ser el inicial. Las características son típicas: insidioso, progresivo, constante, no cede con el reposo, se exacerba con el descanso nocturno y con mala o nula respuesta a los analgésicos ordinarios5. Es un síntoma revelador si se tienen en cuenta los antecedentes de enfermedad maligna del paciente y puede comenzar antes de que las metástasis se manifiesten en la radiología.
No siempre el dolor está presente. Entre el 30 y el 40% de los pacientes con metástasis óseas no refieren dolor y el motivo del diagnóstico es una fractura patológica6. Éstas son más comunes en el fémur (68%) y en el húmero (28%). A veces la fractura patológica no se muestra con claridad en la radiografía, porque no se aprecian lesiones destructivas nítidas en un paciente de edad avanzada y con osteoporosis, pero hay que sospecharla si se ha producido como consecuencia de un traumatismo de baja energía o sin traumatismo claro.
Cuando la metástasis afecta a los pequeños huesos de manos y pies, además del dolor aparecen signos de inflamación local que provocan demoras y errores en el diagnóstico13.
En los casos de afectación vertebral, puede existir dolor local e irradiado, con o sin signos de déficit neurológico7.
LABORATORIO
La bioquímica no ayuda mucho en la detección y evaluación de metástasis óseas. Casi todos los parámetros alterados son inespecíficos y pueden verse en otras afecciones no neoplásicas.
En metástasis osteolíticas múltiples diseminadas con gran destrucción ósea aumentan la calcemia y la calciuria. La elevación de la fosfatasa alcalina, más relacionada con metástasis blásticas, es totalmente inespecífica, al estar elevada en otros procesos (Paget, hiperparatiroidismo) y no ser constante. Los niveles de fosfatasa ácida sí tienen cierta significación en el carcinoma de próstata. Los niveles de hidroxiprolina en orina, reflejo del metabolismo del colágeno y por tanto indicador de reabsorción ósea, también están anormalmente elevados en otras patologías ya mencionadas.
RADIOLOGÍA
La radiología simple es el primer estudio y el más usado en la detección y evaluación de las metástasis óseas junto con la gammagrafía.
Por su aspecto, la metástasis puede ser lítica, blástica o mixta. En el cáncer de mama la lesión es lítica casi siempre, sin embargo, en el 10-20% de los casos puede aparecer como una imagen mixta de osteolisis y osteoesclerosis. Algo similar ocurre con el cáncer de pulmón. El carcinoma prostático produce lesiones típicamente blásticas, mientras que las de riñón y tiroides son líticas1.
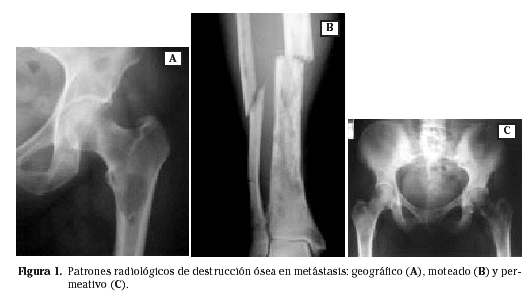
Se han descrito tres tipos de lesiones radiológicas según la forma y características de la destrucción ósea (Fig. 1). La primera asemeja una imagen geográfica, con una osteolisis grande, solitaria, con buena definición de márgenes, que puede confundir en ocasiones con una lesión benigna. La segunda es una imagen moteada, con múltiples pequeñas áreas líticas afectando a hueso esponjoso y cortical, con bordes poco definidos o indefinidos, dando ya un aspecto claro de malignidad. La tercera es una imagen permeativa de múltiples pequeñas áreas osteolíticas de 1 mm de tamaño o menores que se unen para dar un aspecto de destrucción corticomedular franco, límites indefinibles y apariencia de gran agresividad 6,14.
Hay un período de latencia entre el comienzo de la destrucción ósea y la aparición de los primeros signos radiológicos. La radiología es por tanto un método de detección bastante tardío. Es bien conocido que se precisa una destrucción de al menos el 40-50% del tejido óseo para que la lesión sea visible en la radiología, especialmente en el hueso esponjoso6,14. En el cortical una destrucción menor puede ser apreciada antes. Por otra parte, la radiología simple proporciona pocos datos de la lesión en cuanto a la extensión en el hueso y hacia partes blandas.
Para llegar a un diagnóstico más precoz y exacto del proceso es necesario el empleo de otros medios complementarios.
GAMMAGRAFÍA ÓSEA
Es un método muy usado y de una gran sensibilidad en la detección de metástasis esqueléticas. Es muy útil en la evaluación de la extensión en la diseminación metastásica. El isótopo más utilizado es el fosfato de Tecnecio 99. El ión fosfato se incorpora en todas las áreas con formación ósea activa, permitiendo la fijación del Tecnecio que puede ser detectado (Fig. 2).
La mayor parte de las metástasis esqueléticas, aunque sean de tipo osteolítico, se asocian en mayor o menor grado con una neoformación de hueso y aumento de la vascularización local. El radioisótopo se localiza en este nuevo hueso reactivo por presentar una mayor actividad osteoblástica y ser metabólicamente más activo que el hueso normal6. Este es el motivo de la alta sensibilidad de la prueba, que permite descubrir lesiones precoces, silenciosas desde el punto de vista clínico y radiológico.
Tiene en su contra, sin embargo, su pobre especificidad, ya que existe un amplio abanico de situaciones no malignas que cursan con un aumento de la formación de hueso y marcada captación isotópica. Por ello, se considera que la gammagrafía es una prueba sensible pero poco específica que debe ser correlacionada siempre con los datos clínicos.
Hay una serie de situaciones en las que una insuficiente respuesta neoformativa ósea puede cursar con falsos negativos: lesiones muy pequeñas o iniciales, o muy agresivas con rápida e intensa destrucción y pobre o nula formación ósea reactiva.
A pesar de ello se considera a la gammagrafía como una prueba muy eficaz en la detección precoz y determinación del grado de extensión o diseminación en el esqueleto de la enfermedad metastásica ósea.
TOMOGRAFÍA COMPUTARIZADA Y RESONANCIA MAGNÉTICA
Estas técnicas son de más ayuda en la valoración de las características de la lesión (tamaño, extensión real dentro del hueso, afectación de partes blandas y tejidos adyacentes), que en la detección de su presencia, probablemente ya establecida por la radiología y/o gammagrafía.
La Tomografía Computarizada (TC) puede mostrar detalles óseos sutiles sobre la cantidad de destrucción ósea, invasión cortical, calcificación intralesional. Es la mejor prueba para valorar el grado de alteración de la estructura ósea.
La Resonancia Magnética (RM) ha mostrado su eficacia en dos aspectos: es el método más seguro para evaluar la extensión en hueso medular de una metástasis y es la mejor técnica para delimitar la extensión a partes blandas y su relación con estructuras neurovasculares y tejidos adyacentes. La extensión intramedular se visualiza en las secuencias T1, mediante cortes coronales y sagitales, debido a que el tumor da una baja intensidad de señal en contraste con la alta señal normal de la médula ósea grasa (Fig. 3). La lesión extraósea se evalúa en la secuencia T2 mediante cortes axiales, en los que en condiciones normales la masa muscular que rodea al hueso es de baja intensidad de señal y el tumor es de alta señal, permitiendo una buena diferenciación entre uno y otro14.
En contra de lo que pueda parecer, ambas técnicas se complementan y refuerzan. La mejor información se obtiene cuando se interpretan juntas. Son especialmente importantes cuando el tumor afecta a la columna vertebral porque permiten valorar la extensión hacia canal espinal y la posible compresión medular, de cola de caballo o radicular. Juegan un papel primordial en la planificación previa a la cirugía.
TOMOGRAFÍA POR EMISIÓN DE POSITRONES (PET)
Es una prueba reciente y en desarrollo por lo que no se sabe aún con certeza el papel que puede desempeñar en el diagnóstico de la enfermedad metastásica ósea. El trazador más empleado es la fluorodesoxiglucosa (FDG), análogo de la glucosa, que alcanza las células a través de las mismas proteínas transportadoras de la glucosa. El aumento de la actividad metabólica en procesos malignos explica su acumulación.
Aunque la resolución de las imágenes obtenidas con PET no es tan buena como la que da la gammagrafía, su sensibilidad es superior. Es una prueba importante para la identificación de tumores primarios desconocidos con metástasis como primer signo de la enfermedad15 y para el diagnóstico diferencial entre lesión benigna o maligna en fracturas patológicas cuando esta duda se plantea16.
DIAGNÓSTICO
El diagnóstico de una metástasis ósea se produce en tres posibles contextos generales: la metástasis ósea se diagnostica a la vez que el carcinoma primario al realizar un estudio de extensión, la metástasis ósea se diagnostica en la evolución de un carcinoma primario ya diagnosticado y en tratamiento o ya tratado y la metástasis ósea es la presentación de un carcinoma desconocido hasta ese momento.
Aunque las dos primeras situaciones puedan parecer las que razonablemente con más frecuencia nos podemos encontrar, la tercera no es rara, y plantea un interrogante a veces complicado de solventar: la localización y características del tumor primario, origen del proceso.
BIOPSIA Y ESTUDIO HISTOLÓGICO
La biopsia ósea de las lesiones en que el tumor primario no es conocido tiene su importancia y a menudo puede ser la única pista si el resto de estudios no revelan ningún dato.
Existen diversas formas para la obtención de la muestra: punción aspiración con aguja fina (PAAF), punción con aguja guiada por TC, punción percutánea clásica bajo control radiológico con trócar y biopsia abierta.
El diagnóstico histológico de metástasis es sencillo, no así el reconocimiento del órgano origen, al que no se llega en todos los casos17. Encontrar tejido epitelial neoplásico en el interior de un hueso no puede significar otra cosa que la presencia de una metástasis. Los marcadores inmunohistoquímicos específicos de las metástasis son la citoqueratina y el antígeno epitelial de membrana5.
CONCEPTO DE FRACTURA INMINENTE
Se define como aquella situación en la que puede producirse una fractura con una carga fisiológica, caminando por ejemplo, en ausencia de traumatismo o aumento de solicitación mecánica sobre el hueso. La intensidad del dolor y el aspecto radiológico de la metástasis son las variables que, en determinadas circunstancias, sugieren que la fractura puede producirse de forma inmediata o a corto plazo, durante las actividades de la vida diaria. Aun sin ser una definición exacta, viene a expresar lo que en la literatura anglosajona se denomina fractura inminente6,18. Otras formas de llamarla son amenaza de fractura19 o metástasis con alto riesgo de fractura14.
Existe un acuerdo generalizado en que este tipo de lesiones deben tratarse mediante una estabilización quirúrgica profiláctica antes de que se produzca definitivamente la fractura, lo que condicionaría aumento del dolor, de la limitación funcional, cirugía probablemente en peores condiciones generales y con más complicaciones técnicas. Sin embargo, no hay tanta unanimidad a la hora de establecer qué metástasis reúnen los requisitos para ser catalogadas en el grupo de fracturas inminentes.
Para Fidler el riesgo de fractura está directamente relacionado con el porcentaje de destrucción cortical cuantificable en una radiografía normal20. Considera que la destrucción de más de 2/3 partes de la circunferencia que forma la cortical ósea en una metástasis de un hueso largo evoluciona en alrededor de un 70% de los casos hacia una fractura patológica. Otros autores estiman que ya por encima del 50% de destrucción circunferencial el riesgo es alto y debe considerarse la cirugía21,22. Un dato similar es la medida de la relación entre la anchura de la metástasis y la del hueso. Si es igual o superior a 0,60 parece necesario indicar la fijación interna22. La longitud de la destrucción cortical en un hueso largo igual o superior a 2,5 cm también se relaciona con una mayor frecuencia de fractura, especialmente en huesos de carga21,22.
Mirels propone un sistema de valoración para calcular las posibilidades de fractura en metástasis basado en el estudio de cuatro variables23. Además del tamaño de la destrucción cortical circunferencial, introduce la localización, el tipo de lesión y la intensidad del dolor. Para el autor el riesgo de fractura es menor en la extremidad superior, aumenta si la localización es en la extremidad inferior y todavía más si afecta a la región trocantérea del fémur. También varía de menos a más si la intensidad del dolor es leve, moderada o incapacitante. Y ocurre lo mismo si el tipo de lesión es blástica, mixta o lítica. Obtiene para cada caso una puntuación global que relaciona con la posibilidad de sufrir una fractura.
Hipp introduce un nuevo factor de riesgo relacionando la necesidad de carga con la capacidad de carga de un hueso concreto24. La necesidad de carga se calcula atendiendo a la edad y el peso del paciente, su actividad y capacidad para proteger la extremidad afectada. La capacidad de soportar carga depende de la geometría del defecto óseo, tipo de lesión (lítica, mixta, blástica) y localización.
En resumen, se aceptan como criterios básicos de riesgo alto de fractura: la destrucción del 50% o más de hueso cortical circunferencial, la afectación de más de 2,5 cm de longitud en un hueso largo, el tipo de lesión que produce osteolisis y la localización trocantérea en el fémur6,21.
TRATAMIENTO
Consideraciones generales
El planteamiento terapéutico de las metástasis óseas, como el del resto de la patología neoplásica, es multidisciplinar. La coordinación de esfuerzos entre oncólogos, anatomopatólogos, radiólogos intervencionistas, especialistas en tratamiento del dolor y cirujanos ortopédicos es esencial.
Antes de planificar un tratamiento es necesaria una valoración previa del paciente tanto global, estado de evolución y tratamiento del tumor original, supervivencia estimada, condiciones generales, como local: metástasis presumiblemente única o múltiple, localización, tamaño, extensión2.
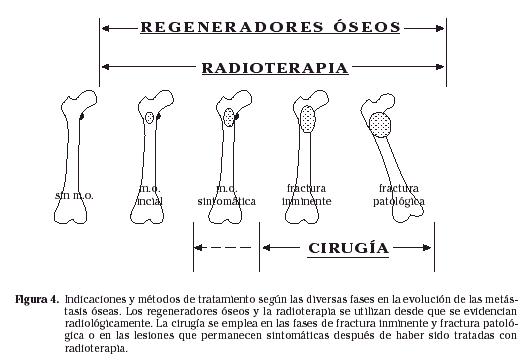
Las posibilidades de tratamiento de los tumores con metástasis óseas incluyen: quimioterapia, radioterapia, inmunoterapia, hormonoterapia, tratamiento médico del dolor y la destrucción ósea, técnicas de supresión vascular tumoral (embolización) y cirugía. Su uso combinado aumenta las posibilidades de éxito. Los más empleados específicamente en el tratamiento de las complicaciones óseas y por tanto a los que nos referiremos son los regeneradores óseos, la radioterapia y la cirugía25 (Fig. 4). El tratamiento del tumor primario y del dolor estarán siempre presentes, pero no son el motivo de este trabajo.
Los objetivos globales del tratamiento son en primer lugar aliviar el dolor mejorando así la calidad de vida del paciente y en segundo lugar recuperar la función de una forma rápida y duradera para conseguir, si es posible, autonomía para las actividades cotidianas habituales.
Regeneradores óseos
Los bifosfonatos son potentes inhibidores de la actividad osteoclástica, causante directa de la destrucción ósea en las metástasis. Se asocian a la matriz ósea liberándose durante su reabsorción, interfiriendo en los procesos bioquímicos de los osteoclastos y anulándolos. Los bifosfonatos también son antagonistas de la génesis osteoclástica y favorecedores de la diferenciación osteoblástica. Como consecuencia de la disminución de la formación y actividad osteoclástica, inhiben la osteolisis inducida por el tumor, reduciendo su morbilidad26.
En los años 80 se publicaron los resultados con los bifosfonatos de primera generación (clodronato, etidronato) en el tratamiento de la hipercalcemia, posteriormente se han desarrollado los de segunda y tercera generación (pamidronato, ibandronato, alendronato, ácido zoledrónico), que requieren menor dosificación y se han asociado a menor toxicidad renal27.
Ross y colaboradores desarrollaron una revisión sistemática de todos los ensayos randomizados en pacientes con metástasis óseas28. Se trata de un metanálisis a partir de 18 ensayos randomizados, en los que se han comparado diferentes bifosfonatos frente a placebo o entre ellos. La mayoría de los estudios se realizaron en pacientes con carcinoma de mama, pero también se incluyeron pacientes con mieloma óseo y en uno de ellos con carcinoma de próstata.
Cuando se comparan frente a placebo, los bifosfonatos reducen significativamente el índice de fracturas patológicas vertebrales, de fracturas no vertebrales, fracturas combinadas, indicaciones de radioterapia y de hipercalcemia. No disminuye el número de cirugías ortopédicas ni la aparición de compresión medular.
El tratamiento con los bifosfonatos intravenosos (pamidronato, ácido zoledrónico) mostró resultados semejantes al estudio global y además un retraso en la aparición del primer evento óseo. El empleo de pamidronato (90 mg iv al mes durante 12 meses) en pacientes con cáncer de mama y metástasis óseas, ha demostrado una reducción en la incidencia y un aumento en el tiempo transcurrido hasta la aparición de complicaciones óseas, con mejor evolución del dolor y la capacidad funcional, con respecto al grupo control con placebo29. Un ensayo comparó los dos bifosfonatos intravenosos y no mostró diferencias.
El tratamiento con los bifosfonatos orales (clodronato, etidronato) redujo el número de fracturas vertebrales y no vertebrales, pero no las indicaciones de radioterapia ni la hipercalcemia.
En ninguno de los ensayos individuales se observó una mejoría en la supervivencia con la utilización de bifosfonatos. En cuanto a la mejoría de la calidad de vida, la mayoría de los ensayos no realizaron estas mediciones con escalas adecuadas.
Los autores recomiendan continuar la investigación en bifosfonatos en diversas líneas: ensayos que determinen el momento óptimo del inicio de los bifosfonatos en pacientes sintomáticos o tras el diagnóstico inicial de las metástasis óseas; estudios sobre la combinación de bifosfonatos con fármacos que bloqueen la acción de la PTHrP; ensayos sobre coste-eficacia; papel de los bifosfonatos en la prevención de morbilidad ósea en el tratamiento del carcinoma de próstata30.
La Sociedad Americana de Oncología Clínica (ASCO), en relación al tratamiento con bifosfonatos en pacientes con carcinoma de mama y metástasis óseas, recomienda iniciarlo cuando exista evidencia radiológica de lesión lítica independientemente de si produce dolor31.
Después de este metaanálisis se han publicado los resultados de tres ensayos sobre la utilización de ácido zoledrónico. Han incluido pacientes con carcinoma de mama y mieloma32, carcinoma de próstata con metástasis líticas y blásticas33 y otros tumores como carcinoma de pulmón, carcinoma renal y carcinoma de vejiga34. En ellos se ha vuelto a observar una reducción en el número y un retraso en la aparición de eventos óseos35.
Como se describió previamente, una de las vías más estudiadas hoy día, implicada en la fisiopatología de las metástasis óseas, es la vía RANKL/RANK/ osteoprotegerina. Está en desarrollo una osteoprotegerina recombinante que bloquea la unión RANKL-RANK y disminuye la activación de los osteoclastos. Un ensayo clínico mostró una eficacia semejante al pamidronato en el control de la hipercalcemia36. También están en estudio anticuerpos monoclonales que bloquean a RANK y disminuirían la activación de los osteoclastos10.
La producción de la osteoprotegerina puede estimularse con los bifosfonatos, el raloxifeno o el 17b-estradiol37.
Otra vía de actuación es la PTHrP sobre la que se están desarrollando anticuerpos monoclonales que en estudios animales han logrado disminuir las lesiones líticas óseas10.
Radioterapia
La radioterapia es el método de tratamiento paliativo más utilizado en metástasis óseas. Es el tratamiento de elección para metástasis óseas dolorosas líticas sin riesgo de fractura a corto plazo y se combina con la cirugía cuando la fractura es inminente o ya se ha producido. Su efecto es la necrosis de las células tumorales que permite la regeneración posterior del tejido óseo. El resultado es el alivio del dolor y más tardíamente la recalcificación de las zonas de hueso destruidas38, importante para la recuperación funcional del paciente y en la prevención de fracturas patológicas.
Se utilizan dos métodos de irradiación: la radioterapia externa localizada y la radioterapia sistémica o metabólica.
Radioterapia externa
La radioterapia consigue un alivio del dolor en el 80-90% de los pacientes8,38-40 y en el 55-60% de ellos el efecto se mantiene durante al menos un año. Tong y col encontraron en un ensayo que el 50-70% de los pacientes que presentan alivio del dolor en la zona radiada no vuelven a presentar dolor en la misma localización durante toda su vida41. La recalcificación ósea se objetiva en las radiografías entre el mes y los tres meses después de la irradiación en el 60-80% de los pacientes, por lo que se hace necesario un período de protección y prevención de solicitaciones mecánicas que puedan poner en riesgo la integridad del hueso afectado durante este período.
La radioterapia se administra sobre la lesión ósea con unos márgenes que son variables según la localización y el tipo de tumor. En la planificación del tratamiento resultan necesarias las técnicas de imagen antes descritas para definir la lesión ósea y la posible afectación de partes blandas.
Se han utilizado diversos cursos y fraccionamientos del tratamiento. En los años 80 se publicaron los resultados de un ensayo donde se comparaban diversos fraccionamientos (15 fracciones de 275cGy, 15 fracciones de 300cGy, 10 fracciones de 300cGy, 5 fracciones de 400cGy, 5 fracciones de 500cGy)42. No se encontraron diferencias significativas en el control del dolor, si bien los más eficaces a largo plazo fueron los esquemas más fraccionados: 15 fracciones de 275cGy y 10 fracciones de 300cGy.
Algunos grupos europeos han realizado estudios con la administración de radioterapia en una sola fracción, mostrando un alivio sintomático del dolor en el 70% de los pacientes43. Cuando se han comparado los ensayos con radioterapia fraccionada frente a la radioterapia en una sola fracción, esta última mostró mayor necesidad de retratamientos y mayor número de fracturas patológicas44.
Radioterapia metabólica
El tratamiento sistémico con radiofármacos está indicado en pacientes con afectación ósea difusa sintomática y como tratamiento adyuvante en pacientes que reciben radioterapia localizada y tienen además afectación difusa.
Los pacientes deben tener una gammagrafía positiva, dolor progresivo en múltiples localizaciones o dolor sobre una zona previamente radiada. Está contraindicada en el momento agudo de una fractura patológica o de una compresión medular, pero una vez resuelto el tratamiento urgente puede administrarse45.
Los radiofármacos más utilizados son el estroncio-89 y el samario-153. Ambos se depositan sobre el tejido óseo con una preferencia 10/1 frente a tejidos blandos, permitiendo el tratamiento de lesiones óseas de manera bastante específica.
El tratamiento con radioterapia metabólica consigue un alivio del dolor en el 70-75% de los pacientes que se mantiene por un período de 2-4 meses45. En pacientes con buena respuesta clínica es posible repetirlo.
Los resultados clínicos han sido probados en estudios durante los últimos 10-15 años46,47. Se observa un beneficio significativo en el control del dolor tras el tratamiento con radiofármacos frente a placebo.
Cirugía
La cirugía de las metástasis óseas requiere una valoración previa general y local completa, tiene unas indicaciones, busca unos objetivos, utiliza unas técnicas y medios concretos y se asocia con un programa de radioterapia postoperatoria en términos similares a los ya descritos.
Antes de la intervención debe conocerse si el estado general del paciente la permite y la supervivencia estimada según la fase de la enfermedad y el tipo de tumor original. Hay carcinomas como el de tiroides con supervivencias largas, de varios años a pesar de la aparición de metástasis óseas, mientras que en el carcinoma de pulmón el pronóstico es sombrío a corto plazo, en meses48. La estrategia quirúrgica puede cambiar según varíen estos datos y otros propios de la metástasis como la localización, el tamaño y extensión2.
El tratamiento quirúrgico está indicado en: las fracturas patológicas, las fracturas inminentes y las lesiones que no perteneciendo a los dos grupos anteriores tienen una pobre o nula respuesta a la radioterapia, permaneciendo sintomáticas y siendo previsible su progresión2,4,19,49,50. Aunque estos conceptos referidos a los huesos largos de las extremidades, por generales, pueden aplicarse también a raquis y pelvis, estas localizaciones tienen unas connotaciones específicas que se abordarán más adelante.
El objetivo principal de la cirugía en las metástasis óseas es restaurar la función de la región afectada. Concretando, los efectos que se buscan son: la desaparición parcial o completa del dolor mediante la estabilización ósea asegurando la mejor función posible, conseguir resultados de forma inmediata y duradera al tratarse de pacientes con esperanza vital limitada, no interferir en el tratamiento global del cáncer primario y prevenir o disminuir la ansiedad y depresión que provocan las fracturas patológicas en pacientes ya de por sí afectados por el diagnóstico de una enfermedad grave2,4.
Con respecto a las técnicas quirúrgicas, se emplean placas y clavos endomedulares para las lesiones diafisarias. Si se incluye la resección del fragmento óseo afectado, deberá planificarse su sustitución por cemento óseo, aloinjertos masivos intercalares u otro tipo de sustitutos biológicos o metálicos que den una solidez mecánica suficiente a la osteosíntesis y eviten su fracaso. Para las lesiones localizadas en la epífisis y/o metáfisis, se utilizan diversos tipos de prótesis articulares normales o especiales de resección, asociadas o no a aloinjertos articulares4.
La radioterapia postoperatoria de la zona de hueso afectada con amplios márgenes, se haya realizado resección o no, es obligada. Su efecto será detener la progresión tumoral que pueda poner en peligro la estabilidad de la osteosíntesis, disminuyendo así los riesgos de fallo de la fijación interna2.
Cirugía en los huesos largos de las extremidades
Los huesos habitualmente afectados son el fémur y el húmero, por este orden, en sus porciones proximal y media, más que en la distal. En el fémur la repercusión funcional es más importante ya que soporta solicitaciones mecánicas superiores, especialmente durante la marcha.
En las metástasis óseas diafisarias el tratamiento consiste en una ostesíntesis lo más amplia y estable posible del hueso, que cubra todas las áreas de debilidad, anticipándose incluso a la progresión previsible de la enfermedad (Figs. 5 y 6).
Ya en la década de los 50-60 comienzan a aparecer trabajos en los que se enfatiza sobre las ventajas que proporciona la fijación interna de las fracturas patológicas con respecto a los clásicos procedimientos de reposo en cama durante largos períodos de hospitalización y ortesis o aparatos de inmovilización externa más o menos complicados. Proponían la estabilización de las fracturas patológicas con clavos intramedulares y el empleo de estos métodos de forma profiláctica en algunos casos de lesiones líticas con amenaza de fractura, asociando radioterapia postoperatoria, es decir, las mismas bases del tratamiento actual con los materiales y procedimientos de la época. Los resultados en la mejoría del dolor y la función inmediata ya eran esperanzadores19.
La introducción posterior de los clavos endomedulares encerrojados supuso un salto cualitativo, mejorando la estabilidad rotacional y global del montaje, evitando el colapso en el defecto óseo originado por la metástasis mediante una intervención corta, segura y poco agresiva, pues no precisaba el abordaje del foco y permitía la radioterapia temprana al estar las cicatrices alejadas del área a irradiar.
Giannoudis, utilizando clavos encerrojados en 30 fracturas patológicas e inminentes de la diáfisis del fémur, consigue la estabilidad suficiente para la movilización sin dolor o con mínimas molestias en todos los casos49. Otros autores presentan casuísticas con similares resultados50,51. Ocurre lo mismo al aplicar la técnica en la diáfisis humeral18.
El posible efecto diseminador de células tumorales en los procedimientos endomedulares es un tema controvertido y en debate. Aunque algunos autores relatan casos aislados de extensión local tras el empleo de estas técnicas51, otros estudios han demostrado que es en el momento en que se produce la fractura patológica cuando aumenta de forma marcada la posibilidad de dispersión tumoral vía hemática. Por este motivo, el enclavado aplicado de forma profiláctica, al disminuir el riesgo de fractura, también disminuye la posibilidad de diseminación52. En la práctica son pocos los casos referidos con estas complicaciones.
La eficacia de la estabilización quirúrgica de las metástasis óseas diafisarias de los huesos largos no está cuestionada. Tampoco el valor de la radioterapia asociada después de la cirugía. Townsend refiere mejores resultados funcionales y mantenidos en el tiempo, menor número de reintervenciones por fallo de la fijación interna y una supervivencia media superior en pacientes tratados con estabilización quirúrgica y radioterapia con respecto al empleo de solo cirugía en fracturas patológicas e inminentes de fémur53.
A pesar de los excelentes resultados obtenidos con la fijación interna seguida de radioterapia, estos no siempre se mantienen en el tiempo. La progresión del tumor origina el fracaso de la estabilización quirúrgica en más del 10% de los casos17. El factor de riesgo más importante es la supervivencia prolongada después de la cirugía. Otros factores con tendencia a aumentar el riesgo de reintervenciones son el carcinoma de riñón como tumor primario, la localización femoral por mayor solicitación mecánica y la cirugía de osteosíntesis con respecto a las prótesis.
Del análisis de estos datos se deriva la necesidad de identificar a los pacientes con expectativas de supervivencia prolongada, para adaptar la estrategia de tratamiento. En estos casos está indicado el abordaje del foco de metástasis, la resección del fragmento óseo afectado y su reconstrucción con cemento óseo, más utilizado en la década de los 80-9021,54,55 o aloinjertos intercalares masivos en la actualidad56. La radioterapia postoperatoria es más efectiva al disminuir la masa tumoral sobre la que actúa. Hay una mejora evidente en la capacidad mecánica y estabilidad de la fijación interna, con mejores resultados en la función y más duraderos en el tiempo.
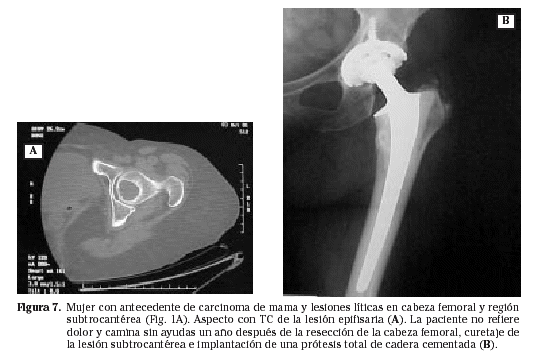
El planteamiento cambia en las lesiones epifisarias y metafisarias. La osteosíntesis pierde eficacia y es sustituida por las prótesis6 (Fig. 7). En la afectación predominantemente epifisaria, la solución es su resección con colocación de una prótesis articular convencional cementada, tanto en la cadera50 como en el hombro18. El cemento y el empleo de vástagos largos sirven para prevenir las consecuencias de la aparición posterior de otros focos. Si hay una afectación metafisaria amplia, que va a requerir de una resección ósea también amplia, en el defecto óseo se emplean bien prótesis especiales de resección o aloinjertos óseos compuestos: prótesis más injerto56.
Cirugía en la columna vertebral
El raquis es la primera localización en frecuencia de las metástasis óseas, aunque afortunadamente la mayor parte son asintomáticas y del resto pocas llegan a precisar ser tratadas quirúrgicamente6. En la valoración previa es imprescindible la definición del déficit neurológico si existe y si no la probabilidad de su aparición en algún momento del proceso. En las metástasis vertebrales las opciones de tratamiento son los corticoides, la radioterapia y la cirugía.
Los corticoides se utilizan por su efecto antiedema en lesiones neurológicas, nunca aislados, salvo cuando la situación general del paciente no permite otra cosa.
La radioterapia está indicada para pacientes con dolor intenso sin complicación medular o con déficit neurológico de comienzo y progresión lenta e incompleta, siempre que se descarte inestabilidad vertebral osteoarticular, punto clave de indicación quirúrgica. En los casos en que el pronóstico sea malo a corto plazo o la situación general del paciente contraindique la cirugía, es la única opción.
La cirugía está indicada ante un dolor de intensidad creciente incontrolable con otros métodos, un déficit neurológico agudo, completo, de instauración rápida y cuando la destrucción ósea provoca una inestabilidad segmentaria de la columna vertebral. Consiste en la resección del tejido tumoral, liberación de toda compresión sobre el tejido medular y fijación interna mediante osteosíntesis vertebrales asociadas a injertos óseos por vías de abordaje anterior y/o posterior, intentando la fusión del segmento afectado con los inmediatamente superior e inferior4,7.
Cirugía en la pelvis
La complejidad de la anatomía y abordaje de la pelvis la hacen un lugar de difícil rescate quirúrgico y en donde otras técnicas paliativas como la embolización arterial de la metástasis o la radioterapia pueden tener su indicación de entrada5. Estos tratamientos son ideales si la lesión afecta a zonas aisladas de isquion, pubis, región sacroilíaca y ala ilíaca, sin embargo, no suelen ser efectivos en la región periacetabular, sometida a grandes solicitaciones mecánicas, donde se hace necesaria la reconstrucción quirúrgica.
La reconstrucción de lesiones destructivas periacetabulares es excepcional y de gran complejidad. Los resultados no son tan rápidos o espectaculares como los conseguidos en otras zonas y las complicaciones pueden ser más numerosas y graves. Por ello, la elección del paciente y de la técnica a emplear debe ser especialmente cuidadosa.
Las posibilidades de tratamiento quirúrgico van a depender de la magnitud de la destrucción periacetabular. En los casos de destrucción leve o moderada el tratamiento inicial puede ser la radioterapia sola y si ésta fracasa, la indicación es el curetaje de la lesión, rellenando el espacio generado con cemento óseo y añadiendo una prótesis total de cadera convencional6,57. Diversos materiales metálicos pueden aportar estabilidad a la zona, como anillos acetabulares antiprotrusión y mallas para evitar la invasión pélvica del cemento óseo.
En los casos de destrucción grave o severa, pueden seguir empleándose los mismos métodos o valorar la posibilidad de resecciones amplias asociadas a la implantación de aloinjertos óseos masivos como sustitución, teniendo en cuenta que siempre se acabará implantando una prótesis total de cadera.
BIBLIOGRAFÍA
1. O'Keefe RJ, Terek RM. Oncología musculoesquelética. En: Beaty JH Editor. Orthopaedic Knowledge Update 6 (Ed Español). Barcelona, Medical Trend SL, 2000: 23-51. [ Links ]
2. Swanson KC, Pritchard DJ, Sim FH. Surgical treatment of metastatic disease of the fémur. J Am Acad Orthop Surg 2000; 8: 56-65. [ Links ]
3. López-Abente G, Pollán M, Aragones N, Pérez Gómez B, Hernández Barrera V, Lope V et al. Situación del cáncer en España: incidencia. An Sist Sanit Navar 2004; 27: 165-173. [ Links ]
4. Ferrandez L. Tumores óseos. En: Cáceres E y cols Editores. Manual SECOT de Cirugía Ortopédica y Traumatología. Madrid, Editorial Médica Panamericana SA, 2003: 154-169. [ Links ]
5. Campanacci M, Ruggieri P. Métastases osseuses carcinomateuses. En: Encyclopédie Médico-Chirurgicale, Appareil locomoteur. París: Elsevier, 1993: 14-030-H-10. [ Links ]
6. Habermann ET, López RA. Metastatic disease of bone and treatment of pathological fractures. Orthop Clin North Am 1989; 20: 469-486. [ Links ]
7. Caceres E, Ruiz A, Del Pozo P, García A, Pomerol L. Diagnóstico y tratamiento de los tumores del raquis. En: Ferrández L Editor. Actualizaciones en Cirugía Ortopédica y Traumatología 3. Barcelona, Masson SA, 2002: 215-232. [ Links ]
8. Brown HK, Healey JH. Metastatic cancer to the bone. En: DeVita VT, Hellman S, Rosenberg S Editores. Cancer. Principles and practice of oncology. Philadelphia, Lippincott Williams and Wilkins, 2001: 2713-2729. [ Links ]
9. Ranatharathorn V, Powers WE, Temple HT. Palliation of bone metastases. En: Perez CA, Brady LW, Halperin EC, Schimdt-Ullrich RK Editores. Principles and practice of radiation oncology. Philadelphia, Lippincott Williams and Wilkins, 2004: 2385-2404. [ Links ]
10. Hortobagyi GN. Novel approaches to the management of bone metastases. Semin Oncol 2003; 30: 161-166. [ Links ]
11. Rankin W, GRill V, Martin TJ. Parathyroid hormone-related protein and hypercalcemia. Cancer 1997; 80: 1564-1571. [ Links ]
12. Guise TA. Parathyroid hormone-related protein and bone metastases. Cancer 1997; 80: 1572-1580. [ Links ]
13. Healey JH, Turnbull A, Miedema B, Lane JM. Acrometastases. J Bone Jt Surg 1986; 68A: 743-746. [ Links ]
14. Ferrandez L, Ortiz EJ, Ramos L. Diagnóstico de los tumores óseos. En: Herrera A Editor. Actualizaciones en Cirugía Ortopédica y Traumatología 1. Barcelona, Masson SA, 2000: 99-121. [ Links ]
15. Choong P. Tratamiento del paciente con metástasis óseas por carcinoma de origen desconocido. En: Menéndez LR Editor. Actualizaciones en Cirugía Ortopédica y Traumatología: tumores osteomusculares. Barcelona, Medicina STM Editores, 2003: 343-350. [ Links ]
16. Kato K, Aoki J, Endo K. Utility of FDG-PET in differential diagnosis of benign and malignant fractures in acute to subacute phase. Ann Nucl Med 2003; 17: 41-46. [ Links ]
17. Wedin R. Surgical treatment for pathologic fracture. Acta Orthop Scand 2001; 72: 1-29. [ Links ]
18. Frassika FJ, Frassica DA. Metástasis óseas humerales. J Am Acad Orthop Surg (Ed Esp); 2003: 2: 326-332. [ Links ]
19. Mayer M. Limmobilisation chirurgicale dans les métastases osseuses menacées ou compliquées de fracture. La Revue du Praticien 1966; 16: 3491-3499. [ Links ]
20. Fidler M. Incidence of fracture through metastases in long bones. Acta Orthop Scand 1981; 52: 623-627. [ Links ]
21. Harrington KD. Impending pathologic fractures from metastatic malignancy: evaluation and management. Instr Course Lect 1986; 35: 357-381. [ Links ]
22. Menck H, Schulze S, Larsen E. Metastasis size in pathologic femoral fractures. Acta Orthop Scand 1988; 59: 151-154. [ Links ]
23. Mirels H. Metastatic disease in long bones: A proposed scoring system for diagnosing impending pathologic fractures. Clin Orthop 1989; 249: 256-264. [ Links ]
24. Hipp JA, Springfield DS, Hayes WC. Predicting pathologic fracture risk in the management of metastatic bone defects. Clin Orthop 1995; 312: 120-135. [ Links ]
25. Weber KL, Lewis VO, Randall RL, Lee AK, Springfield D. An approach to the management of the patient with metastatic bone disease. Instr Course Lect 2004; 53: 663-676. [ Links ]
26. Lipton A. Pathophysiology of bone metastases: how this knowledge may lead to therapeutic intervention. J Support Oncol 2004; 2: 205-213. [ Links ]
27. Berenson J, Hirschberg R. Safety and convenience of a 15-minute infusion of zoledronic acid. Oncologist 2004; 9: 319-329. [ Links ]
28. Ross JR, Saunders Y, Edmonds PM, Patel S, Broadley KE, Johnston SR. Systematic review of role of bisphosphonates on skeletal morbidity in metastatic cancer. Brit Med J 2003; 327: 469-475. [ Links ]
29. Hortobagyi GN, Theriault RL, Porter L. Efficacy of pamidronate in reducing skeletal complications in patients with breast cancer and lytic bone metastases: Protocol 19 Aredia Breast Cancer Study Group. N Eng J Med 1996; 335: 1785-1791. [ Links ]
30. Ross JR, Saunders Y, Edmonds PM, Patel S, Wonderling D, Normand C et al. A systematic review of the role of bisphosphonates in metastatic disease. Health Technol Assess 2004; 8: 1-176. [ Links ]
31. Hillner BE, Ingle JN, Chlebowski RT, Gralow J, Yee GC, Janjan NA et al. American Society of Clinical Oncology. American Society of Clinical Oncology 2003 update on the role of bisphosphonates and bone health issues in women with breast cancer. J Clin Oncol 2003; 21: 4042-4057. [ Links ]
32. Rosen LS, Gordon D, Tchekmedyian NS, Yanagihara R, Hirsh V, Krzakowski M et al. Long-term efficacy and safety of zoledronic acid in the treatment of skeletal metastases in patients with nonsmall cell lung carcinoma and other solid tumors: a randomized, Phase III, double-blind, placebo-controlled trial. J Cancer 2004; 100: 2613-2621. [ Links ]
33. Saad F, Gleason DM, Murray R, Tchekmedyian S, Venner P, Lacombe L et al. Long-term efficacy of zoledronic acid for the prevention of skeletal complications in patients with metastatic hormone-refractory prostate cancer. J Natl Cancer Inst 2004; 96: 879-882. [ Links ]
34. Rosen LS, Gordon D, Kaminski M, Howell A, Belch A, Mackey J et al. Long-term efficacy and safety of zoledronic acid compared with pamidronate disodium in the treatment of skeletal complications in patients with advanced multiple myeloma or breast carcinoma: a randomized, double-blind, multicenter, comparative trial. Cancer 2003; 98:1735-1744. [ Links ]
35. Lacerna L, Hohneker J. Zoledronic acid for the treatment of bone metastases in patients with breast cancer and other solid tumors. Semin Oncol 2003; 30: 150-160. [ Links ]
36. Body JJ, Greipp P, Coleman RE, Facon T, Geurs F, Fermand JP et al. A phase I study of AMGN-0007, a recombinant osteoprotegerin construct, in patients with multiple myeloma or breast carcinoma related bone metastases. Cancer 2003; 97: 887-892. [ Links ]
37. Hofbauer LC, Schoppet M. Clinical implications of the osteoprotegerin/RANKL/RANK system for bone and vascular diseases. JAMA 2004; 292: 490-495. [ Links ]
38. Papagelopoulos PJ. Tratamiento no quirúrgico de metástasis óseas por carcinoma. En: Menéndez LR Editor. Actualizaciones en Cirugía Ortopédica y Traumatología: tumores osteomusculares. Barcelona, Medicina STM Editores, 2003: 363-368. [ Links ]
39. Falkmer U, Jarhult J, Wersall P, Cavallin-Stahl E. A systematic overview of radiation therapy effects in skeletal metastases. Acta Oncol 2003; 42: 620-633. [ Links ]
40. Saarto T, Janes R, Tenhunen M, Kouri M. Palliative radiotherapy in the treatment of skeletal metastases. Eur J Pain 2002; 6: 323-330. [ Links ]
41. Tong D, Gillick L, Hendrickson FR. The palliation of symptomatic osseous metastases: final results of the Study by the Radiation Therapy Oncology Group. Cancer 1982; 50: 893-899. [ Links ]
42. Blitzer PH. Reanalysis of the RTOG study of the palliation of symptomatic osseous metastasis. Cancer 1985; 55: 1468-1472. [ Links ]
43. VAN DER LINDEN YM, LOK JJ, STEENLAND E, MARTIJN H, VAN HOUWELINGEN H, MARIJNEN CA et al. Single fraction radiotherapy is efficacious: a further analysis of the Dutch Bone Metastasis Study controlling for the influence of retreatment. Int J Radiat Oncol Biol Phys 2004; 59: 528-537. [ Links ]
44. WAI MS, MIKE S, INES H, MALCOLM M. Palliation of metastatic bone pain: single fraction versus multifraction radiotherapy. A systematic review of the randomised trials. Cochrane Database Syst Rev 2004: CD004721. [ Links ]
45. MCEWAN AJ. Use of radionuclides for the palliation of bone metastases. Semin Radiat Oncol 2000; 10: 103-114. [ Links ]
46. MAXON HR, SCHRODER LE, HERTZBERG VS, THOMAS SR, ENGLARO EE, SAMARATUNGA R et al. Rhenium-186(Sn)HEDP for treatment of painful osseous metastases: results of a double-blind crossover comparison with placebo. J Nucl Med 1991; 32: 1877-1881. [ Links ]
47. LEWINGTON VJ, MCEWAN AJ, ACKERY DM, BAYLY RJ, KEELING DH, MACLEOD PM et al. A prospective, randomised double-blind crossover study to examine the efficacy of strontium-89 in pain palliation in patients with advanced prostate cancer metastatic to bone. Eur J Cancer 1991; 27: 954-958. [ Links ]
48. HOROWITZ SM. Neoplasias del sistema musculoesquelético. En: Frymoyer JW Editor. Orthopaedic Knowledge Update 4 (Ed Español). Madrid, Garsi SL, 1993: 169-178. [ Links ]
49. GIANNOUDIS PV, BASTAWROUS SS, BUNOLA JA, MACDONALD DA, SMITH RM. Unreamed intramedullary nailing for pathological femoral fractures. Good results in 30 cases. Acta Orthop Scand 1999; 70: 29-32. [ Links ]
50. BERJON J, RUBIO R, NIEVA F, DE LA VEGA A. Tratamiento quirúrgico de las fracturas patológicas metastásicas del fémur proximal. Rev Ortop Traumatol 2002; 46: 141-148. [ Links ]
51. RUBIO R, BERJON J, NIEVA F. Cirugía profiláctica de las fracturas patológicas pertrocantéreas y diafisarias del fémur. Rev Ortop Traumatol 2001; 45: 114-117. [ Links ]
52. BOUMA WH, MULDER JH, HOP WC. The influence of intramedullary nailing upon the development of metastases in the treatment of an impending pathological fracture: an experimental study. Clin Exp Metastasis 1983; 1: 205-212. [ Links ]
53. TOWNSEND PW, ROSENTHAL HG, SMALLEY SR, COZAD SC, HASSANEIN RE. Impact of postoperative radiation therapy and other perioperative factors on outcome after orthopedic stabilization of impending or pathologic fractures due to metastatic disease. J Clin Oncol 1994; 12: 2345-2350. [ Links ]
54. HABERMANN ET, SACHS R, STERN RE, HIRSH DM, ANDERSON WJ JR. The pathology and treatment of metastatic disease of the femur. Clin Orthop 1982; 169: 70-82. [ Links ]
55. BOWMA WH, CECH M. The surgical treatment of pathologic and impending pathologic fractures of the long bones. J Trauma 1980; 20: 1043-1045. [ Links ]
56. SALAI M, RAHAMIMOV N, PRITCH M, ROTSTEIN Z, HOROSZOWSKI H. Massive bone allografts in the treatment of pathologic fractures due to bone metastases. J Surg Oncol 1997; 66: 93-96. [ Links ]
57. VAUGHAN LM. Tratamiento de metástasis en la pelvis y el acetábulo por carcinoma. En: Menéndez LR Editor. Actualizaciones en Cirugía Ortopédica y Traumatología: tumores osteomusculares. Barcelona, Medicina STM Editores, 2003: 377-381. [ Links ]