Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Anales del Sistema Sanitario de Navarra
versión impresa ISSN 1137-6627
Anales Sis San Navarra vol.29 supl.2 Pamplona may./ago. 2006
Bone transplant
M. San Julián, A. Valentí
Dpto. de Ortopedia y Traumatología. Clínica Universitaria.
Dirección para correspondencia
RESUMEN
Describimos la metodología del Banco de Huesos y Tejidos blandos desde su extracción y su almacenamiento hasta su utilización.
Desde el año 1986 con la creación del Banco de Huesos en la Clínica Universitaria de Navarra, se han utilizado más de 3.000 injertos para cirugías muy diversas.
Los injertos óseos se pueden clasificar en corticales y esponjosos; los primeros se emplean principalmente en cirugía de salvamento en pacientes tumorales, en grandes reconstrucciones postraumáticas y en cirugía de reemplazo en el que los defectos óseos son masivos y requieren un soporte estructural. Los injertos esponjosos son los más utilizados por sus numerosas indicaciones, de especial utilidad en el relleno de cavidades que precisan una cantidad importante de injerto cuando el autoinjerto es insuficiente o como complemento; también son de especial ayuda en el tratamiento de las fracturas cuando existen pérdidas óseas y en el tratamiento de los retrasos de consolidación y seudoartrosis en zonas poco vascularizadas y atróficas. Se usan también en cirugía protésica ante la presencia de defectos de tipo cavitario.
Los aloinjertos de tejidos blandos están especialmente reconocidos en lesiones ligamentosas múltiples que requieren reconstrucciones. Hoy en día, los más utilizados son los empleados en la cirugía del ligamento cruzado anterior aunque pueden ser utilizados para reemplazar cualquier defecto ligamentoso o tendinoso.
Las principales dificultades de los aloinjertos corticales están en la consolidación de los extremos con el hueso propio y en cirugía tumoral, dado que son enfermos inmunodeprimidos por el tratamiento, la incidencia de infección se encuentra aumentada con respecto a los injertos esponjosos y de tejidos blandos que es irrelevante.
En definitiva, el uso de aloinjertos cada vez más extendido es un arma terapéutica imprescindible en cirugía ortopédica y traumatología, que debe ser usada por manos expertas.
Palabras clave. Aloinjerto. Banco de huesos. Donante. Reconstrucción.
ABSTRACT
We describe the methodology of the Bone and Soft Tissue Bank, from extraction and storage until use.
Since the year 1986, with the creation of the Bone Bank in the University Clinic of Navarra, more than 3,000 grafts have been used for very different types of surgery.
Bone grafts can be classified into cortical and spongy; the former are principally used in surgery to save tumour patients, in large post-traumatic reconstructions and in replacement surgery where there are massive bone defects and a structural support is required. The spongy grafts are the most used due to their numerous indications; they are especially useful in filling cavities that require a significant quantity of graft when the autograft is insufficient, or as a complement. They are also of special help in treating fractures when there is bone loss and in the treatment of delays in consolidation and pseudoarthrosis in little vascularized and atrophic zones. They are also used in prosthetic surgery against the presence of cavity type defects.
Allografts of soft tissues are specially recognised in multiple ligament injuries that require reconstructions. Nowadays, the most utilised are those employed in surgery of the anterior cruciate ligament although they can be used for filling any ligament or tendon defect.
The principal difficulties of the cortical allografts are in the consolidation of the ends with the bone itself and in tumour surgery, given that these are patients immunodepressed by the treatment, the incidence of infection is increased with respect to spongy grafts and soft tissues, which is irrelevant.
In short, the increasingly widespread use of allografts is an essential therapeutic weapon in orthopaedic surgery and traumatology. It must be used by expert hands.
Key words. Allograft. Bone bank. Donor. Reconstruction.
Introducción
Los injertos tisulares se han impuesto progresivamente como posibilidad terapéutica en casi todos los campos de la cirugía. La idea de transplantar una parte de un organismo sin vida a otro vivo y enfermo ha sido objeto de múltiples intentos fallidos durante décadas. Sólo a partir de los últimos 40 años, con los nuevos conocimientos de la respuesta inmune, se comenzaron a obtener resultados esperanzadores. Los primeros en utilizarse, ya en el siglo XIX, fueron aloinjertos del aparato locomotor.Después de la sangre, el hueso es el tejido humano que se emplea con más frecuencia como injerto. La demanda de tejidos u otros sustitutos para reconstruir los defectos del aparato locomotor está en constante aumento.
La historia del trasplante masivo de hueso se remonta a finales del siglo pasado con los trabajos de MacEwen, quien en 1879 utilizó un fragmento autólogo tibial para tratar una pseudoartrosis infectada en el húmero de un niño. Desde entonces se utilizaron fragmentos provenientes de osteotomías o amputaciones, hasta que Josef Horak en 1914 fue el primer cirujano que publicó el uso de hueso procedente de cadáver para reconstruir una resección de un sarcoma. En su publicación ya habla de que es necesario que el recién muerto (el donante) esté completamente sano y no contenga ninguna sustancia infecciosa que pueda pasar al receptor. No obstante, algunos especialistas como el profesor Mankin atribuyen este invento a San Cosme y a San Damián que, varios siglos antes, implantaron la pierna del cadáver de un africano a un blanco que había sufrido una amputación traumática.
En España fue Sanchis Olmos el pionero en la creación de un banco de huesos1, en una época en la que nadie apostaba por ellos. Los principios de los bancos de huesos se plantearon ante los retos de las cirugías reconstructivas, y entre ellas la tumoral. Hoy son más de 80 los bancos de huesos reconocidos en nuestro país (Tabla 1).
La creación y extracción desproporcionada de injertos hace que se acerque la fecha de caducidad de miles de aloinjertos de hueso cortical –indicados fundamentalmente para el tratamiento de los sarcomas óseos– que jamás serán utilizados. No es previsible que vayan a aumentar los tumores óseos malignos en nuestro país ya que son tumores propios de la infancia y juventud, y los índices de natalidad en España están entre los más bajos del mundo.
Tampoco parece necesario que todos los hospitales tengan un banco de huesos y de tejidos blandos propio. Son costosos y requieren unos cuidados específicos. Un banco de huesos requiere un servicio muy especial como es su vigilancia continua, prevenir los problemas, controlar las serologías, administración y secretaría, mantenimiento, formación de personal, etc.
Mientras en los países más avanzados disponen de un centro de referencia para sarcomas por cada 10 millones de habitantes, en nuestro país a veces ocurre lo contrario: contamos con varios centros por cada paciente afecto de un sarcoma óseo. Y esto no beneficia ni al paciente, ni a su tratamiento, ni a la formación de los especialistas, ni por supuesto es lógico desde el punto de vista económico.
Indicaciones
Existen 2 tipos de aloinjertos óseos:– Hueso esponjoso: fundamentalmente se obtiene de donantes vivos (cabeza de fémur en pacientes sometidos a prótesis de cadera), aunque también se puede obtener de cadáver. Es el tipo de injerto más empleado, en múltiples aplicaciones de la cirugía ortopédica (Fig. 1).
– Hueso cortical: se obtiene sólo de donantes cadáver, y se emplea fundamentalmente en una patología muy infrecuente (tumores óseos malignos), por lo que en España se implantan cada año como mucho 200-300 de estos aloinjertos, incluyendo en esta cifra cirugías de revisión, y otras utilidades raras de este tipo de aloinjertos.
La demanda de injertos de hueso ha aumentado con el perfeccionamiento de las técnicas de salvamento de extremidades después de la resección de tumores, en reconstrucción de defectos óseos traumáticos, infecciosos, artroplastias fallidas, defectos de consolidación.
El hueso autólogo (autoinjerto) ha demostrado ser un mejor comportamiento biológico, pero su cantidad es limitada, la morbilidad en los sitios de extracción es importante y se presentan dificultades para reconstruir grandes defectos con este tipo de injertos. Los autoinjertos pueden ser vascularizados (el más empleado es el de peroné), no vascularizados, o una mezcla de ambos. La consolidación es más rápida, la integración es mejor, pero la disponibilidad y las propiedades mecánicas son menores. Por este motivo son empleados más en reconstrucciones de la extremidad superior, en tumores pequeños, o en fracasos de otras técnicas de reconstrucción. También se emplean en reconstrucción estética.
Los aloinjertos se utilizan para: remplazo de defectos óseos en resecciones tumorales amplias, relleno de defectos óseos intracavitarios, cirugía de revisión de artroplastias de cadera y rodilla, reconstrucción de grandes defectos óseos por trauma, reconstrucciones ligamentosas Con el tiempo, el hueso implantado, será reemplazado por el propio hueso del paciente receptor. Esto se logra gracias a las propiedades biológicas del hueso implantado que estimula el crecimiento del hueso del propio paciente. En los últimos años, el avance de la quimioterapia, las nuevas tecnologías de criopreservación de tejidos y el desarrollo de nuevos instrumentos y técnicas quirúrgicas en el tratamiento de los tumores, han cambiado los planteamientos de la cirugía oncológica ósea, lo que hace que la amputación sea cada vez menos frecuente2-9 y prosperen técnicas más conservadoras. En la cirugía tumoral se requieren resecciones extensas con una cirugía agresiva que puede causar problemas en su reconstrucción10-13, para los que se pueden proponer diferentes alternativas como las endoprótesis y el trasplante óseo, autólogo o alogénico14-19. Se requiere una colaboración muy estrecha entre el banco de huesos y el equipo de cirugía ortopédica oncológica para conseguir los mejores resultados gracias a la selección de los injertos más apropiados. Los injertos óseos tienen como función promover la osteogénesis y ofrecer un soporte mecánico y pueden ser utilizados para inmovilizar una articulación, como material osteogénico, para rellenar cavidades o estimular la osteogénesis en los retrasos de consolidación y las pseudoartrosis20. También están indicados como sustitutos en los grandes defectos diafisarios de los huesos. En cualquier caso, todo injerto óseo cortical debe restablecer la continuidad ósea como un material de sustitución capaz de resistir y de transmitir las solicitaciones esqueléticas (Fig. 2).
La artroplastia total de cadera es una cirugía muy habitual en los servicios de cirugía ortopédica y traumatología, que consigue una mejoría en la calidad de vida. Es una cirugía que presenta una serie de riesgos tanto durante la intervención como postoperatorios. Los problemas intraoperatorios se resuelven en el propio quirófano, cosa que se consigue en un alto porcentaje de casos. En cambio, las complicaciones postoperatorias generalmente requieren otra intervención para resolverlas21.
Los fallos en las prótesis generalmente se dan en el componente acetabular, otras veces en el vástago o más raramente en ambos. Se producen fenómenos de osteolisis, desgaste del material o movilizaciones asépticas por traumatismos.En la cirugía de revisión es importante la elección de los componentes a utilizar ya que existe una gran variedad (cótilos cementados o no, con o sin injerto...) dependiendo de los defectos óseos, tanto a nivel femoral como acetabular.
Generalmente se utilizan los aloinjertos:– En el acetábulo:
a)Triturados en defectos parciales.
b)En láminas, para cerrar la pared posterior o defectos del trasfondo acetabular.
c)En empalizada o en bloques, en defectos segmentarios o combinados.
d)En bloques atornillados, en grandes pérdidas combinadas.– En el fémur:
a)Triturados en defectos intraluminales.
b)En empalizada, en lesiones estructurales no circunferenciales.
En la cirugía raquídea se comenzó con el uso de aloinjertos a mediados de siglo XX, sin embargo, no fue hasta la década de los 80, coincidiendo con la aparición de los primeros bancos de hueso nacionales y el crecimiento de la cirugía raquídea cuando aumentó la práctica. La alta frecuencia de artrodesis hace que sea la cirugía vertebral uno de los campos de mayor aplicación de los aloinjertos. El uso de autoinjerto de cresta ilíaca presenta limitaciones tanto cuantitativas por la cantidad de injerto, como complicaciones de la cirugía como posible lesión del nervio femorocutáneo, dolor de la zona donante...
Existe ya una amplia experiencia en cirugía por cifoescoliosis, tratamiento de fracturas vertebrales y otras cirugías raquídeas aunque persiste la polémica sobre la incorporación, inmunogenicidad y tasa de seudoartrosis de los aloinjertos respecto el autoinjerto22,23. Las lesiones de los tejidos blandos son comunes y potencialmente incapacitantes. En los últimos años han aumentado los procedimientos reconstructivos, con diversas técnicas, tanto para lesiones agudas como crónicas. Muchos cirujanos utilizan autoinjertos; sin embargo, tiene algunas limitaciones: no deja de ser una cirugía mutilante, ya que sacrifica una estructura para ser remplazada por otra y este aspecto presenta implicaciones, ya que limita el tipo de tendón que se va a extraer, la cantidad tanto en grosor como en longitud. Todo ello trae consigo el aumento de la morbilidad quirúrgica de la zona dadora24.En la actualidad se extrae el tendón rotuliano completo incluyendo rótula y un fragmento de tuberosidad anterior de tibia; el cual se divide en dos mitades. También es frecuente la extracción de fascia lata, tendón de Aquiles, meniscos y otros tendones de las extremidades (Fig. 3). Todos estos injertos son utilizados en reconstrucciones de ligamento cruzado de rodilla, tratamiento de inestabilidades articulares, sustitución tendinosa etc.
En cualquier caso se considera que la utilización de aloinjertos blandos, es una técnica eficaz y válida en el tratamiento de los procesos del aparato locomotor25.
Síntesis, consolidación e incorporación
Los aloinjertos de esponjosa se emplean generalmente para rellenar cavidades, por lo que no suelen requerir osteosíntesis. Normalmente son pacientes que no están inmunosuprimidos y por lo tanto la incorporación es más sencilla y no suelen provocar problemas infecciosos.Los aloinjertos corticales, por el contrario, tienen una tasa más alta de complicaciones. La estabilización del injerto debe ser lo suficientemente segura como para permitir su consolidación. Dependiendo de la zona se pueden optar por diferentes soluciones26 (agujas de Kirschner, placas de osteosíntesis, clavos intramedulares).
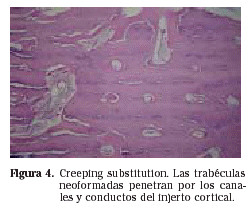
A nivel metafisario se ha comprobado que la consolidación se lleva a cabo con bastante facilidad sea cual sea el método utilizado, por lo que no es necesario síntesis complejas y laboriosas, y la utilización de dos agujas de Kirschner cruzadas es suficiente en la mayoría de las ocasiones. A nivel diafisario la consolidación es más lenta y dificultosa. El uso de placas o clavos endomedulares no influye significativamente, aunque sí lo hará en las posibles complicaciones. Además la utilización de clavo endomedular permite un apoyo más rápido que cuando se utilizan placas como método de síntesis. La forma de la osteotomía tampoco tiene carácter determinante en el resultado. La consolidación de un injerto esta influenciada por tres factores demostrados: quimioterapia sistémica, radioterapia externa y edad del receptor. De forma que un paciente que reúna estos tres determinantes tiene altas probabilidades de presentar una seudoartrosis. Los injertos óseos tienen dos funciones principales: ostogénesis y soporte mecánico. La osteogénesis es la síntesis de hueso nuevo a partir de células del receptor o bien del injerto. En el injerto de hueso autólogo hay osteogénesis en las células que sobreviven al periodo inicial del trasplante y esta capacidad es mayor en el hueso esponjoso que en el cortical. Otra forma de llegar a la osteogénesis es la osteoconducción, que se define como la producción de hueso a partir de células mesenquimales primitivas diferenciadas hacia osteoblastos, y presentes en los tejidos que rodean el injerto. La osteoinducción describe un proceso de crecimiento de capilares, tejido perivascular y células osteoprogenitoras desde los tejidos blandos circundantes del huésped hasta el injerto. De esta forma el injerto funcionaría como un andamio o soporte físico sobre el que se forma hueso (Fig. 4).
Horas después del trasplante ocurre una respuesta inflamatoria con migración de macrófagos y fibroblastos que son atraídos por quimiotaxis. Hacia el tercer día se comienzan a observar célula mesenquimales que proliferan de manera que en quinto día aproximadamente se pueden ver condroblastos y al décimo osteoblastos27,28. Este proceso de osteoinducción dura de 2 a 3 meses en el caso de hueso esponjoso pero puede llegar a los 2-3 años en caso de injerto cortical voluminoso. Los injertos de esponjosa son generalmente reabsorbidos y remplazados por hueso nuevo, mientras que los corticales pueden permanecer reabsorbidos de manera incompleta y ser una mezcla de hueso necrótico y hueso vivo, proveniente este último del receptor.
En aloinjertos frescos no tratados, la respuesta inmune es muy agresiva, con una fase inflamatoria intensa y de aproximadamente 2 semanas de duración. Esta respuesta demora e incluso puede destruir la fase de osteoinducción. Los capilares del aloinjerto son rápidamente rodeados por células inflamatorias y terminan ocluidos con necrosis de progresión rápida como resultado29. En aloinjertos congelados o deshidratados la incorporación mejora. La revascularización y remodelación es más lenta comparándola con injertos frescos, pero la reabsorción, osteoconducción e inducción ocurren mucho más rápido, y sobre todo de manera más completa. Si se añade una fijación rígida los resultados clínicos son satisfactorios, son fuente de conducción e inducción.Selección de donantes
Los tejidos humanos, al igual que los órganos, son un bien limitado en el mundo. Cada vez hay más recursos para la detección de pacientes que han fallecido y son candidatos a la donación. Por otro lado, la continua revisión que existe en los criterios de selección de los donantes, con el objetivo final de obtener una mayor cantidad de tejidos con una mayor seguridad para los receptores. Los tejidos musculoesqueléticos disponen de un periodo más prolongado de tiempo desde su extracción hasta su implantación, generando unos cuidados tanto en el almacenamiento en los bancos de tejidos como en el procesamiento de los mismos muy diferente a los órganos. Cada tejido requiere un análisis, evaluación procesamiento y conservación determinado y que no es el mismo en todos los bancos de tejidos. Detección del donante Los tejidos osteotendinosos se pueden obtener de donante vivo o cadáver. Donante vivo En general se trata de pacientes que son sometidos a un reemplazo total de cadera y cuya cabeza femoral será extraída para la colocación de una prótesis ortopédica. Esta pieza ósea, que de otra manera sería desechada, se utiliza sólamente si el paciente ha expresado su consentimiento. Al ingresar al banco es procesada y esterilizada, pudiendo luego ser implantada en otro paciente. Este tipo de donaciones representa casi el 90% de las extracciones que se realizan en nuestro país2. Probablemente sean los más fiables y seguros de todos los aloinjertos ya que se obtienen en circunstancias ideales, con la más estricta asepsia y generalmente en personas de mayor edad donde las enfermedades transmisibles son de menor incidencia y además existe una relación médico-paciente con la posibilidad de hacer nuevas serologías. Donante cadáver Son aquellos pacientes fallecidos que no han mostrado en vida su rechazo a la donación y cuya familia accede. Los tejidos musculoesqueléticos no requieren las mismas exigencias que los órganos en cuanto a tiempo de isquemia fría y caliente y, por lo tanto, son potenciales donantes aquellos fallecidos de muerte tanto intra como extrahospitalariamente, siempre y cuando cumplan una serie de criterios mínimos. Selección del donante Una vez nos encontramos con un posible donante es necesario una evaluación clínica de su idoneidad valorando la causa de la muerte, revisión de la historia clínica para descartar causas excluyentes de donación y conseguir así piezas de calidad y con seguridad. La calidad hace referencia a las características idóneas del injerto; por ejemplo, edad. La seguridad alude principalmente de evitar el riesgo de transmisión de enfermedades, pero también incluye todos los procesos siguientes a la extracción como son el almacenamiento, procesamiento y la esterilización. El objetivo es detectar enfermedades tumorales pasadas o actuales, infecciosas potencialmente transmisibles, tratamientos o hábitos tóxicos que pudieran comprometer el estado de los tejidos o poner en peligro la salud de los receptores. Contraindicaciones absolutas Existen pocas contraindicaciones como tales en general30. Son:– Infección por VIH o seropositividad.
– Sepsis no controlada bacterial, fúngica o viral.
– Neoplasia maligna pasada o actual de cualquier localización (excepto carcinoma, basocelular, carcinoma in situ de útero o algunos primarios de SNC.
– Causa desconocida de muerte, incluso tras autopsia.
– Enf. autoinmunes sistémicas con repercusión de los posibles tejidos donantes.
– Infecciones activas: hepatitis B y C, TBC, sífilis...
– Enfermedades causadas por priones.
– Otro: historia de hemodiálisis crónica
Contraindicaciones relativas
Varían en función de cada banco de tejidos, de las necesidades clínicas de los hospitales además de otros criterios. Por citar alguna:– Edad superior a 65 años en donante cadáver.
– Prácticas conocidas de riesgo en los últimos 12 meses: tatuajes, drogas...
– Tratamiento conocido con sustancias que alteren la calidad ósea (corticoides, plomo...).
– Traumatismos con solución de continuidad cutánea.
Análisis serológicos
Ante el aumento notable de los trasplantes de tejidos, el control de la calidad de los bancos de huesos y tejidos es imprescindible. La cirugía protésica reconstructiva, la cirugía del raquis, la cirugía reparadora de lesiones ligamentosas y la cirugía tumoral con conservación del miembro, son cada vez más frecuentes en nuestro ámbito. Todo ello hace que el riesgo de transmisión de enfermedades se plantee para los receptores, por lo que es fundamental mantener los injertos seguros tanto biológicamente como bacteriológicamente y ello se logra con un banco de huesos fiable. Existe un número no desdeñable de injertos que son desechados por hallazgos serológicos o microbiológicos (por contaminación de las piezas) además de otros problemas técnicos (Fig. 5). Existe un periodo ventana en los donantes que es cuando el donante infectado por un virus todavía no presenta ningún marcador serológico que permita detectarlo. Este periodo es variable en función del virus y los test utilizados para detectarlos31,32.Ante las posibles complicaciones que conlleva implantar un aloinjerto, es incuestionable que exista un beneficio para la utilización e indicación de un aloinjerto. El riesgo de transmisión es un reflejo de los parámetros utilizados para la selección del donante y la metodología del banco de tejidos. Se ha considerado que la probabilidad de transmisión de una enfermedad viral es algo menor de 1 entre 1 millón, así se da por ejemplo, la transmisión del virus del sida en donantes meticulosamente seleccionados.
Se debe rechazar un donante ante cualquier duda en relación a su historia médica, hábitos sociales o datos de laboratorio difíciles de interpretar. Cualquier enfermedad que se transmita vía sanguínea puede ser transmitida a tejidos que la contengan. Aproximadamente el 5% del volumen sanguíneo se deposita en los huesos, así por ejemplo una cabeza femoral puede contener entre 2-5 ml, cantidad suficiente para transmitir enfermedades o estimular anticuerpos33.
Por lo general las serologías solicitadas de forma rutinaria se solicitan en las primeras 24 horas tras el fallecimiento y son:– Serología citomegalovirus IgG.
– Serología citomegalovirus IgM.
– Serología de hepatitis B (HBs Ag).
– Serología de hepatitis B (aHBc IgG). Si el resultado da (+) se solicitará Serología HBsAC.
– Serología de hepatitis C (aHCV).
– PCR VHC (al laboratorio de Medicina Interna).
– Serología de VIH 1-2 TR.
– PCR VIH (al laboratorio de Microbiología).
– Serología sífilis VDRL y hemaglutinación indirecta en suero (Ag treponémico).
– Serología de brucelosis.
– Serología de HTLV-1-2.
– Serología de toxoplasmosis IgG.
– Serología de virus Epstein-Barr (VCA)-IgG.
Metodología de un banco
En caso de muerte cerebral declarada y de manifiesta voluntad de donación múltiple por parte de los familiares, el banco de huesos realiza la extracción después de que se extraigan los riñones, el hígado y el corazón, en el centro hospitalario donde se encuentre el paciente. Si el donante es cadavérico y sólo se extraen huesos la extracción se realiza en la sala quirúrgica del centro donde se encuentra el banco.
Extracción Las extracciones se realizan en quirófano bajo condiciones de esterilidad. Es importante que se mantenga durante todo el proceso la máxima asepsia. El mayor contaminante de aloinjertos es el Staphylococcus epidermidis y, por tanto, está en nuestras manos evitar la contaminación. El tejido será obtenido lo antes posible tras el fallecimiento, en caso de donante cadáver, tratando de llevarse a cabo en las 12 horas siguientes al paro cardiocirculatorio y se extiende hasta las 24 horas si ha sido refrigerado en las primeras 4-6 horas. Conforme más tiempo transcurre se ha observado un aumento en la tasa de contaminación de los injertos y de hemocultivos positivos34. El equipo extractor ha de estar formado preferentemente por un equipo pequeño y experimentado compuesto como máximo por tres miembros ya que favorece la baja tasa de infección. Se realiza una inspección del donante, en particular de las zonas a intervenir; evitando incisiones en áreas con abrasiones, heridas Los tejidos a extraer dependen de la edad del paciente, de la presencia de lesiones traumáticas y de las necesidades del banco.Procesamiento y fragmentación
En condiciones de asepsia y antisepsia se extraen los huesos largos de las extremidades, ilíacos, tendones... Terminado el procedimiento se reconstruyen cosméticamente las extremidades. A todos los segmentos óseos se les toma cultivo en cada fase del procesamiento. El paso siguiente es la limpieza del hueso para retirar todos los tejidos blandos adyacentes y la médula ósea, elementos que favorecerían la proliferación bacteriana y que además por el alto contenido celular, determinan la intensidad de la respuesta inmune en el receptor
Una vez extraídas las piezas, se realiza un lavado con suero fisiológico y se envían muestras a cultivo para valorar el crecimiento de bacterias aerobias, anaerobias y hongos.Una vez obtenidas las muestras, se coloca cada fragmento correctamente embalado, estéril y estanco, de tal manera que no se abrirá hasta el día de su utilización. Se etiquetará de acuerdo al protocolo del banco y posteriormente se procederá a su conservación.
Conservación El método más habitual35 de conservación es la congelación a -80ª C, en congelador mecánico que registra de forma permanente la temperatura y posee un sistema de alarma. El tiempo de conservación a esta temperatura es de 5 años. Es importante la separación entre los injertos pendientes de resultado analítico, de los injertos ya disponibles para su uso. De las distintas técnicas empleadas (autoclavado, liofilización, conservación en frío...) la criopreservación con descenso progresivo de la temperatura ha resultado ser la más idónea y sencilla36-38, puesto que permite conservar un mayor número de células viables. Para evitar la formación de macrocristales de hielo se recomienda impregnar los tejidos con un criopreservador tipo DMSO (dimetil sulfóxido), al 10%. El mantenimiento de la viabilidad celular representa el principal condicionante para garantizar las propiedades biológicas y mecánicas del cartílago a largo plazo. La mayoría de los estudios demuestran que las mejores condiciones se consiguen utilizando protocolos de ritmo y temperatura controlados con agentes crioprotectores. La compleja interacción entre las células del cartílago y la matriz extracelular presenta una viabilidad tras la congelación desde un 90% en las células aisladas hasta un 30-50% en el cartílago intacto. Con relación a la respuesta inmune y a la antigenicidad de un aloinjerto al cual no se le hacen de rutina pruebas cruzadas para determinar histocompatibilidad, se acepta que la limpieza meticulosa, la congelación profunda y la deshidratación disminuyen esta respuesta del receptor a niveles subclínicos en la mayoría de los trasplantes de hueso.Resultados
Desde la creación del Banco de huesos en la Clínica Universitaria se han utilizado más de 3.000 aloinjertos en diferentes intervenciones, de los cuales aproximadamente un 60% corresponden a injertos esponjosos, un 22 % injertos corticales y un 18% a injertos de partes blandas. El 92% de los aloinjertos esponjosos se incorporan al hueso receptor en cirugía de recambio protésica39 y estos resultados son algo inferiores con aloinjertos corticales.Los aloinjertos de hueso cortical, como hemos mencionado, se emplean fundamentalmente en el tratamiento de los tumores óseos malignos, que a pesar de ser sumamente infrecuentes (2-3 casos por millón de habitantes al año), han llegado a constituir una de las patologías favoritas de nuestro departamento. Desde finales de la década de los 70, la Clínica Universitaria de Navarra ha atendido a más de 700 casos de tumores óseos malignos. Desde 1980 se están aplicando protocolos con quimioterapia intraarterial. Desde 1986 se posee uno de los Bancos de Huesos pionero en España y gracias a los esfuerzos e investigación del Dr. José Cañadell (director médico y del departamento de Cirugía Ortopédica y Traumatología de la Clínica Universitaria durante muchos años), desde 1984 podemos salvar en muchos casos la articulación de un niño en crecimiento mediante la distracción fisaria previa a la resección del tumor.
La supervivencia en los sarcomas óseos es superior al 70% en nuestro centro gracias a su enfoque multidisciplinar. En su tratamiento coinciden diferentes especialistas, como oncólogos-pediatras, radiólogos, radioterapeutas, que estudian cuál es el mejor tratamiento para cada paciente.
Complicaciones y tratamiento Las complicaciones que ocurren con el empleo de aloinjertos óseos corticales (los menos empleados) son básicamente tres: Infección, seudoartrosis, y fractura. Infección: aunque después de implantar un hueso de banco se hace profilaxis antibiótica con una cefalosporina de 3ª generación durante un periodo de tres semanas, el índice de infección llega al 2% en aloinjertos primarios aumentando al 8-10% en el caso de reintervenciones por fractura o seudoartrosis. Al igual que ocurre con las válvulas cardiacas, las infecciones tardías ocurren en un 3% de los casos, debiendo realizar profilaxis antibiótica en caso de intervenciones menores, cirugía dental, etc.Hay que tener en cuenta que esta cifra está determinada no sólo por el injerto en sí, sino por el tipo de huésped: paciente oncológico con tratamientos complementarios a la cirugía, en el caso de los aloinjertos corticales. La radioterapia también va a comprometer la respuesta inflamatoria local de los tejidos periinjerto y la quimioterapia sistémica produce una inmunodepresión. Estos dos factores hacen que la defensa ante los patógenos sea limitada tanto a nivel local como general. Igualmente la cirugía realizada también tiene influencia en las posibilidades de infección. La resección amplia del tumor obliga a disminuir las posibilidades de una adecuada cobertura de tejidos blandos, requiriendo frecuentemente hacer uso de colgajos musculares para dar al nuevo hueso una cobertura lo más adecuada posible.
El germen más frecuentemente aislado en los cultivos obtenidos es el Estafilococcus epidermidis, lo que recuerda la importancia de mantener una asepsia y antisepsia extrema en todo el proceso, desde la extracción, recogida y conservación hasta su implantación. El tratamiento de una infección en un aloinjerto requiere la extracción de éste, limpieza de tejidos necróticos, sustitución por un espaciador durante al menos 6 semanas, y finalmente la reposición de un nuevo injerto. Fractura: la rotura del injerto se ve influenciada por el tipo de síntesis principalmente. La utilización de placas de osteosíntesis obliga a perforar el injerto en varios puntos, con lo que se debilita de forma ostensible. Incluso con la utilización de clavos endomedulares como medio de fijación, hay que evitar la colocación de tornillos de bloqueo que disminuyen la resistencia de la pieza.El tratamiento de una fractura en un aloinjerto consiste en la inmovilización estricta del foco de fractura con algún material de síntesis. De esta forma se llega formar callo óseo, lo que demuestra la viabilidad del injerto a pesar de tratarse de un hueso con un alto componente de necrosis, pero con capacidad de inducir a la formación de hueso nuevo.
Seudoartrosis: el número de no uniones llega al 18%, y está influenciada por la utilización de quimioterapia sistémica, radioterapia y edad del receptor. Estas tres variables son las únicas que han demostrado una significación estadística. El tratamiento de una seudoartrosis en este caso se lleva a cabo refrescando el foco y aportando hueso autólogo con capacidad osteogénica, con lo que se llega a la consolidación en un 90% de los casos de pseudoartrosis.Futuro
Plantear hoy la investigación en los trasplantes de tejidos del sistema músculo-esquelético, implica mejorar las técnicas de conservación de los injertos, conseguir su integración de una forma rápida y segura y establecer nuevas líneas terapéuticas de los injertos como material de sustitución.
La incorporación del injerto óseo es un proceso secuencial que comienza con la inflamación y atraviesa por diferentes estadios de revascularización, osteogénesis y remodelación para establecer finalmente una estructura mecánicamente adecuada. En la integración de un injerto, uno de los aspectos que han despertado mayor controversia es conocer cuál de las células formadoras de hueso, las del receptor o del injerto, juegan el papel preeminente. Comprender mejor el proceso de formación ósea y los mecanismos reguladores de la integración del aloinjerto, ayudaría a encontrar nuevos tratamientos que aceleraran el proceso. Se trata de una línea de investigación prioritaria en el Laboratorio de Ortopedia Experimental de la Universidad de Navarra. El cirujano se enfrenta a un problema reconstructivo y debe elegir el injerto a utilizar que mayor potencial de integración tenga, según las condiciones locales y minimizar el riesgo de complicaciones.
Bibliografía
1. Sanchís Olmos V. El banco de huesos del Hospital Provincial de Madrid. Acta Ortop Traum Ibérica. 1953; 1: 3-12 [ Links ]
2. Marcove RC. En bloc resections for osteogenic sarcoma. Can J Surg 1977; 20: 521-528. [ Links ]
3. Yip KMH, Lin J. A pelvic osteosarcoma with metastasis to the donor site of the bone graft. Int Orthop 1996; 20: 389-391. [ Links ]
4. Monticelli G, Santori FS, Ghera S, Folliero A. Resection and reconstruction of the distal end of the femur or proximal end of the tibia after radical excision of diaphyseal and epiphyseal segments. Ital J Orthop Traum 1983; IX: 427-437. [ Links ]
5. Nilsonne V. Homologous joint transplantation in man. Acta Orthop Scand 1969; 40: 429-447. [ Links ]
6. Ottolenghi CE. Massive osteo and osteo-articular bone grafts. Clin Orthop 1972; 87: 156-164. [ Links ]
7. Parrish FF. Treatment of bone tumors by total excision and replacement with massive autologous and homologous grafts. J Bone Joint Surg 1966; 48: 968-990. [ Links ]
8. San-Julian M, Amillo S, Cañadell J. Allografts in malignant bone tumors. In: Czitrom and Winkler (Eds.). Orthopaedic Allograft Surgery. Springer Verlag, New York-Wien.1996: 157-163. [ Links ]
9. San-Julian M, Cañadell J. Fractures in massive bone allografts for limb preserving operations. Int Orthop 1998; 22: 32-36. [ Links ]
10. San-Julian M, Leyes M, Mora G, Cañadell J. Consolidation of massive bone allografts in limb-preserving operations for bone tumours. Int Orthop 1995; 19: 377-382. [ Links ]
11. Cañadell J, San Julian M. Radiological, isotopic and histological study about incorporation of allografts. Rev Mapfre Medicina 1997; 8 (Supl. I): 267-271. [ Links ]
12. Cotta H, Rohe K. Extremitatenerhaltende Resektionsverfahren bei Primaren Malignen Knochentumoren. Z Orthop 1984; 122: 2-15. [ Links ]
13. Chao EY, Ivins JC (Eds). Tumor prosthesis for bone and joint reconstruction. Stuttgart-Nueva York, G Thieme Verlag, 1983. [ Links ]
14. Wilson PD. A clinical study of the biomechanical behavior of massive bone transplants used to reconstruct large bone defects. Clin Orthop 1972; 87: 81-109. [ Links ]
15. Böhm P, Kinner B. The effect of electromagnetic fields on the healing pattern of autoclaved autogenous bone transplants. Int Orthop 1996; 4: 43-58. [ Links ]
16. Burwell GR, Friedlander GE, Mankin, HJ. Current perspectives and future directions: the 1983 international conference on osteochondral allografts. Clin Orthop 1985; 197: 141-157. [ Links ]
17. Chalmer J. Bone transplantation. Symposium Tissue Org Transplant. J Clin Path 1967; 20: 540-550. [ Links ]
18. Chao EY, Ivins JC (Eds). Tumor prosthesis for bone and joint reconstruction. Stuttgart-Nueva York, G Thieme Verlag, 1983. [ Links ]
19. Friedlaender GE. Current concepts review bone banking. J Bone Joint Surg 1982; 64(A): 307-311. [ Links ]
20. Leniz P. Incorporación de diferentes tipos de injerto de hueso trabecular (autoinjerto, aloinjerto congelado y liofilizado). Estudio experimental en corderos. Tesis doctoral, Universidad de Navarra, 1998. [ Links ]
21. Actualizaciones en Cirugía Ortopédica y Traumatología OKU-5. Reconstrucción en la cadera y la pelvis. Barcelona: Masson. 1997; 5: 399-437. [ Links ]
22. Bago J, Leon A, Pisa J, Villanueva C. Aloinjerto o autoinjerto en las artrodesis lumbosacras. Rev Ortop Traumatol 1994; 38 IB: 127-131. [ Links ]
23. Buttermann GR, Glazer PA, Bradford DS. The use of bone allograft in the spine. Clin Orthop 1966; 324: 75-85. [ Links ]
24. Gillquist J. Repair and reconstruction of the ACL: Is it good enough? Arthroscopy 1993; 9: 68-71. [ Links ]
25. Douglas W. Soft tissue allograft reconstruction in knee. Allog Orthop Practice 1992; 10: 197. [ Links ]
26. Vander Griend R. The effect of internal fixatión on the healing of large allografts. J Bone Joint Sur. 1994; 76-A: 657-63. [ Links ]
27. Stevenson S, Horowitz M. The response to bone allografts. J Bone Joint Surg 1992; 74-A: 939-50. [ Links ]
28. Thompson Rc Jr, Pickvance Ea, Garry D. Fractures in large segment allografts. J Bone Joint Surg 1993; 75-A: 1663-1673. [ Links ]
29. Perry C. Bone repair techniques, bone graft, and bone graf substitutes. Clin Orthop 1999; 360: 71-86. [ Links ]
30. Estadísticas de trasplantes y tejidos. Disponible en www.msc.es/ont. [ Links ]
31. Suso Vergara S, Segur Vilalta JM. Metodología de los bancos de huesos. MAPFRE Medicina 1996; 7(III): 149-158. [ Links ]
32. Tomford WW, Mankin HJ. Musculoeskeltal tissue banking. New Cork: Raven Press, 1993. [ Links ]
33. Tomford WW, Mankin HJ. Bone banking: Update on methods and materials. Orthop Clin North Am 1999; 30: 565-570. [ Links ]
34. Johnson CA, Brown BA, Lasky Lc. Rh inmunization caused by osseus allograft. N Engl J Med 1985; 312: 121-122. [ Links ]
35. Veen MR. Bone allografts. A study into bacterial contamination, sensitivity of cultures, decontamination and contribution to postoperative (tesis). Leiden 1994. [ Links ]
36. Asociación española de Bancos de Tejidos. Estándares tejido musculoesquelético 1999; VII; 111-124. [ Links ]
37. Losada J.I. Osteogenicidad de los aloinjertos de esponjosa congelados. Estudio experimental en corderos. Tesis doctoral, Universidad de Navarra, 1995. [ Links ]
38. Cornejo F. Los injertos en el tratamiento de los defectos óseos masivos. Tesis doctoral. Universidad de Navarra. 1988. [ Links ]
39. Leyes M, Valentí JR, Schweitzer D. La utilización de los aloinjertos en la cirugía de revisión de la prótesis total de cadera. Revista de Ortopedia y Traumatología 1994; 39: 400-411. [ Links ]
Mikel San Julián Aranguren
Departamento de Cirugía Ortopédica y Traumatología
Clínica Universitaria de Navarra
Avda. Pio XII, 36
31080 Pamplona
Tfno: 948 29 65 85 Fax 948 29 65 00
E-mail: msjulian@unav.es