My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Anales del Sistema Sanitario de Navarra
Print version ISSN 1137-6627
Anales Sis San Navarra vol.30 suppl.2 Pamplona 2007
Clínica y radiología de la tuberculosis torácica
Clinical manifestations and radiology of thoracic tuberculosis
F. J. Domínguez Del Valle, B. Fernández, M. Pérez De las Casas, B. Marín, C. Bermejo
Sección de Neumología. Hospital de Navarra. Pamplona.
Dirección para correspondencia
RESUMEN
La clínica de la tuberculosis torácica es muy variada e inespecífica, superponible a la de cualquier otra infección bacteriana que afecte a los mismos órganos, llamando especialmente la atención la alta frecuencia con la que pasa desapercibida la infección primaria y la persistencia de la sintomatología en la secundaria. En la presente revisión se analizan los signos y síntomas más comunes y su frecuencia de presentación.
La tuberculosis torácica tiene una serie de patrones de presentación y de curación que aunque igualmente variados y no patognomónicos son en ocasiones muy característicos, permitiendo su hallazgo concebir una alta sospecha diagnóstica. Se describen todos los patrones de presentación de la tuberculosis primaria y post-primaria clásicamente admitidos y su frecuencia así como las características radiológicas de las complicaciones y secuelas más relevantes.
Palabras clave. Tuberculosis. Clínica. Radiología. Complicaciones. Patrones.
ABSTRACT
The clinical manifestations of thoracic tuberculosis are highly varied and unspecific, and can be superimposed on that of any other bacterial infection that affects the same organs. What is especially notable is the high frequency with which the primary infection goes unnoticed and the persistence of the symptomology in the secondary infection. This review analyses the most common signs and symptoms and the frequency of their presentation.
Thoracic tuberculosis has a series of patterns of presentation and cure that, although equally varied and non-pathognomonic, are on occasion highly characteristic, with their discovery making possible a high level of diagnostic suspicion. We describe all the patterns of presentation of all the classically accepted primary and post-primary tuberculosis and their frequency, as well as the radiological characteristics of the most relevant complications and sequels.
Key words. Tuberculosis. Clinical manifestations. Radiology. Complications. Patterns.
Manifestaciones clínicas
Las manifestaciones clínicas de la tuberculosis (TB) son variadas pero también inespecíficas, no existiendo ningún signo o síntoma clínico exclusivo de la enfermedad. Asimismo, son dependientes de una serie de factores en relación tanto con el huésped como con el agente infeccioso y la interacción entre ambos (Tabla 1). Antes de la aparición del VIH, el 85% de los casos de tuberculosis estaban limitados al pulmón, afectando el 15% restante a órganos extrapulmonares1.
Al igual que posteriormente haremos con las manifestaciones radiológicas, hablaremos en primer lugar de la TB primaria y, a continuación, de la forma postprimaria.
La forma primaria de la enfermedad ha sido considerada clásicamente propia de la edad infantil, iniciándose con un cuadro clínico inespecífico de febrícula, afectación del estado general, tos y adenomegalias, si bien, con la disminución de la prevalencia de la infección en muchos países, puede aparecer en la edad adulta. Mientras que aproximadamente un 40% de los niños afectos presentan clínica, siendo la tos y la fiebre los síntomas más frecuentes2, en los adultos, el 84% de los casos de una serie de 103 pacientes estaban sintomáticos, destacando la presencia de fiebre, tos, pérdida de peso y hemoptisis3. Este cuadro suele resolverse de forma espontánea, pero se reactiva en el 50-60% de los pacientes que no reciben tratamiento adecuado.
La forma postprimaria o tuberculosis secundaria es la más frecuente, siendo en esta ocasión también la inespecificidad de los síntomas una constante que hace necesario un alto índice de sospecha que nos lleve a la realización de pruebas auxiliares que confirmen el diagnóstico. Por un lado, entre los efectos sistémicos de la enfermedad destaca la fiebre. Así, en alguna serie sobre fiebre de origen desconocido, la tuberculosis es el diagnóstico final hasta en un 17% de los casos4, si bien, en otros estudios5, el 21% de los pacientes no tuvieron fiebre en ningún momento del desarrollo de la enfermedad. Otros síntomas generales incluyen la pérdida de apetito y peso, debilidad general y sudoración nocturna, todos ellos de difícil cuantificación y, en ocasiones, relacionados con otras enfermedades subyacentes. La presencia de eritema nodoso se asocia a tuberculosis pulmonar en una proporción variable, que según las series consultadas, oscila entre un 1,5% y un 20%6,7.
En cuanto a la sintomatología respiratoria, puede estar ausente hasta en un 30% de los pacientes, siendo la tos el síntoma más común, afectando hasta al 78% de los pacientes en alguna serie publicada8. Generalmente es poco productiva, si bien se puede asociar a hemoptisis, siendo ésta habitualmente de escasa cuantía como síntoma inicial. La expectoración hemoptoica franca se presenta más frecuentemente como resultado de la presencia de complicaciones de una tuberculosis previa como el aspergiloma, bronquiectasias, aneurisma de Rasmussen o broncolitiasis, por lo que la presencia de hemoptisis no siempre es sinónimo de enfermedad activa. La inflamación del parénquima adyacente a la superficie pleural puede ser causa de dolor de características pleuríticas, así como la presencia de neumotórax o derrame pleural. En nuestro país la tuberculosis es la segunda causa, tras el carcinoma, de exudados pleurales, pasando al primer puesto en pacientes menores de 40 años y en los afectos por VIH9. En España se estima que el 23% de los pacientes tuberculosos presentan afectación pleural10. El líquido obtenido mediante toracocentesis suele tener valores de glucosa bajos, oscilando el recuento celular entre 1.000-6.000 céls/mm3, con predominio linfocitario (cuando la enfermedad tiene más de dos semanas de evolución) y niveles elevados de adenosindeaminasa (ADA) e interferón γ. Niveles de ADA superiores a 45 U/L permiten el diagnóstico de pleuritis tuberculosa con una alta sensibilidad aunque no tan buena especificidad ya que se encuentra también elevada en otras situaciones como en los empiemas no tuberculosos y en los linfomas. La disnea no es habitual salvo que la extensión de la enfermedad la justifique como en los casos de bronconeumonía o enfermedad miliar complicada con SDRA, constituyendo la tuberculosis el 4,9% de todos los casos de SDRA ingresados en una unidad de cuidados intensivos en una serie de reciente publicación, falleciendo dos de los siete casos11.
Aktogu y col12, en 1998, publicaron una serie de 5.480 casos de tuberculosis, tanto pulmonar como extrapulmonar, siendo los síntomas más habituales los referidos en la tabla 2.
Al igual que en otras patologías, se ha sugerido que las características de la tuberculosis en pacientes ancianos son diferentes a las observadas en jóvenes; así, en un reciente meta-análisis13, se ha objetivado menor prevalencia de fiebre, sudoración, hemoptisis y enfermedad cavitaria, con mayor presencia de disnea y, como es lógico, enfermedades concomitantes en los pacientes de mayor edad.
La mortalidad por tuberculosis se ha relacionado en nuestro medio con la existencia de comorbilidad, retraso en el diagnóstico y bajo cumplimiento terapéutico14.
La exploración física muestra la semiología propia del tipo de lesión subyacente: hipofonesis y roce pleural en el derrame, crepitantes en los casos de infiltrado y sibilantes si la sospecha es de enfermedad endobronquial.
En cuanto a los hallazgos de laboratorio, el más frecuente es la presencia de anemia de perfil inflamatorio, objetivándose leucopenia y neutropenia en los pacientes con enfermedad diseminada15. Podemos encontrar también hiponatremia (43%), en relación con un SIADH, e hipoalbuminemia (72%) así como elevación de la velocidad de sedimentación y alteración de las pruebas de función hepática, relacionándose la persistencia de su elevación con el fallo terapéutico16.
Manifestaciones radiológicas
A la tuberculosis pulmonar se le ha llamado la gran simuladora y con ello quiere decirse que puede presentarse tanto con una clínica como con una radiología sugestivas de otras enfermedades o, dicho de otra forma, que dependiendo de los factores enumerados en la tabla 1, del número y abundancia de los inóculos inhalados y del momento evolutivo en que la encontremos, su expresión clínica y radiológica puede ser muy variada y por lo tanto con un diagnostico diferencial muy amplio. Dicho esto, no es menos cierto que algunos de sus patrones de presentación, tanto en fase activa como residual, si no patognomónicos, sí son al menos muy sugestivos.
Clásicamente se ha dividido la TB en primaria (TBp) y secundaria (TBs) o postprimaria. La TBp se presenta en pacientes sin contacto previo con el bacilo y la TBs en pacientes que, habiendo desarrollado ya una hipersensibilidad frente al germen, sufren un nuevo contagio o, lo que es mucho más frecuente, una reactivación de alguna de las lesiones residuales de la primoinfección. Es importante recordar que en cuanto se desarrolla la hipersensibilidad celular en la TBp, generalmente a partir de la cuarta semana o si el paciente ha sido previamente vacunado con la BCG, las lesiones radiológicas que vamos a observar van a ser muy parecidas a las de la TBs. Por el contrario la TBs desarrollada en un paciente con severa depleción de los linfocitos T, como en las fases avanzadas del SIDA va a tener el perfil de una TBp.
Cuatro son los patrones radiológicos que suelen describirse en la TBp17: la TB gangliopulmonar, la TB pleural, la TB miliar y la TB traqueobronquial. En realidad los tres últimos pueden observarse igualmente en la TBs y se describirán conjuntamente.
Patrón gangliopulmonar
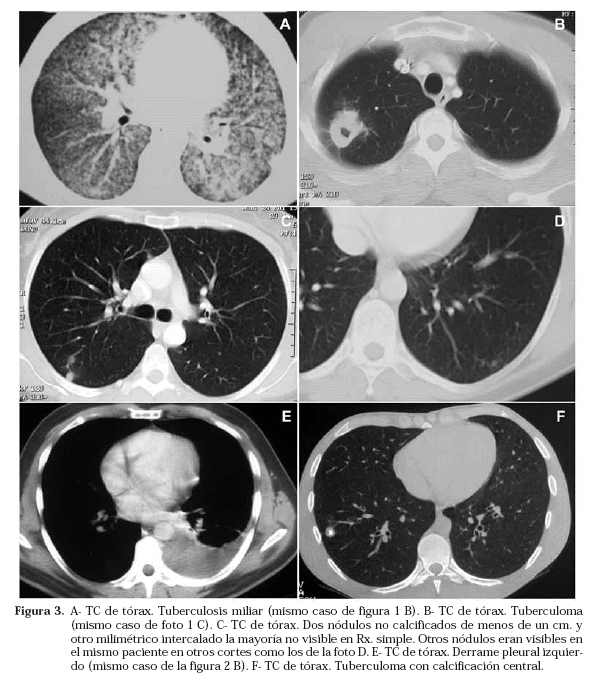
Si recordamos los pasos en el desarrollo de la infección experimental en el conejillo de Indias18, tras un inicial infiltrado polimorfonuclear, hacia la primera semana se observa ya su sustitución por macrófagos que forman un infiltrado tenue que, en la siguiente semana, se va haciendo más denso y extenso a la vez que se diferencia en células epitelioides, algunas de ellas multinucleadas y se observa una acumulación de linfocitos en la periferia de la lesión. Hacia la tercera o cuarta semana, coincidiendo con el desarrollo de la hipersensibilidad, tiene lugar la necrosis caseosa del centro de la lesión produciéndose ya la típica neumonía caseosa que, en las siguientes semanas, se ve rodeada de un progresivo número de fibroblastos que desarrollarán una cápsula que delimite y aísle la lesión. Es durante las primeras semanas, antes de que la respuesta inmunológica lo dificulte, cuando los bacilos pueden llegar a los ganglios linfáticos hiliares y mediastínicos y, a través de ellos por la linfa drenada por el conducto torácico, producirse una diseminación a posibles focos secundarios pulmonares o extrapulmonares que, en ausencia de una terapia eficaz, típicamente podían reactivase a los 18-24 meses de haberse curado el proceso inicial. Por lo tanto, si al paciente se le hace una radiografía de tórax durante este periodo, podremos observar un infiltrado al principio tenue y mal delimitado y progresivamente más denso, de tamaño variable pero generalmente pequeño, desde invisible en placa simple hasta subsegmentario y en ocasiones mayor que suele acompañarse de adenopatías de tamaño y número variable, típicamente hiliares unilaterales y algunas veces bilaterales o con gran componente mediastínico (Figs. 1 C y D). Se acepta en general que este infiltrado inicial puede aparecer en cualquier parte del pulmón aunque algunos autores han observado una cierta preferencia por los campos medios e inferiores. A este infiltrado inicial, denso y homogéneo cuando el proceso ha madurado, periférico y con frecuencia subpleural, se le conoce como chancro o foco primario de Ghon y al conjunto del infiltrado más la(s) adenopatía(s), complejo primario de Ghon o complejo primario de Ranke. Tanto el infiltrado como la adenopatía, si curan tienen una marcada tendencia a calcificarse con el tiempo, entre uno y varios años después, de forma que en ocasiones tras una primoinfección no detectada, es este complejo calcificado el que delata su existencia. Este patrón que solía verse en la primera infancia, a medida que se ha ido erradicando la tuberculosis en nuestro país ha ido apareciendo en edades cada vez mas tardías, en el adulto e incluso el anciano, en los que el componente adenopático suele estar más atenuado, a la vez que desaparecía de la primera infancia autóctona, inmunocompetente, y sanitariamente bien controlada. La tomografía axial computarizada (TC) ha permitido observar que estos ganglios presentan un perfil característico aunque no patognomónico con un centro hipodenso y un anillo periférico que capta contraste19 (Figs. 2 C-F).
En la población sana, bien nutrida e inmumocompetente curan la mayor parte de estos procesos, probablemente más del 90%. Si los bacilos llegaran a ser destruidos antes de la fase caseosa, lo que es excepcional, se puede producir una resolución completa con recuperación de la estructura normal del parénquima, como suele acontecer en una neumonía de otro origen no complicada. Incluso si como es habitual llega a dicha fase, el caseum puede reabsorberse y la lesión sufrir un proceso de retracción, fibrosis y calcificación quedando una cicatriz para siempre. Si el caseum persiste, los bacilos suelen permanecer en él en forma latente y el paciente, si no ha recibido el tratamiento oportuno, pasa a engrosar el reservorio de la enfermedad. Las posibles diseminaciones linfohematógenas producidas durante las primeras semanas suelen curar a la vez que el foco primario. Si se han producido metástasis en el vértice pulmonar a veces son visibles, constituyendo el foco de Simon, probable origen de muchas TBs.
El uso cada vez más frecuente de la TC ha permitido observar que el número de sujetos con pequeños nódulos residuales no visibles en radiografía de tórax simple es relativamente alto, y en zonas con alta incidencia de TB una significativa proporción es de origen tuberculoso (Figs. 3 C y D).
Si por las condiciones del paciente, la virulencia de la cepa o la abundancia del inóculo, el proceso no es controlado, éste tiende a extenderse y cavitarse dando lugar a un patrón de infiltrados irregulares con tendencia a la cavitación múltiple progresiva de lenta evolución superponible en esta fase a la TBs.
La tuberculosis postprimaria, secundaria, tisis o TB del adulto se origina como su nombre indica por una posterior reinfección, ocasionalmente por nueva exposición al bacilo, pero generalmente por reactivación de algún foco residual, ya sea el foco primario, la perforación de una adenopatía a un bronquio o, lo que es más frecuente, de uno de los focos de diseminación linfohematógena producidos en las fases iniciales de la primoinfección. Además de los patrones antes citados que después describiremos, esta forma de TB tiene un patrón característico que es el patrón exudativo-ulcerado fibroproliferativo, generalmente muy destructivo.
Patrón exudativo-ulcerado-fibroproliferativo
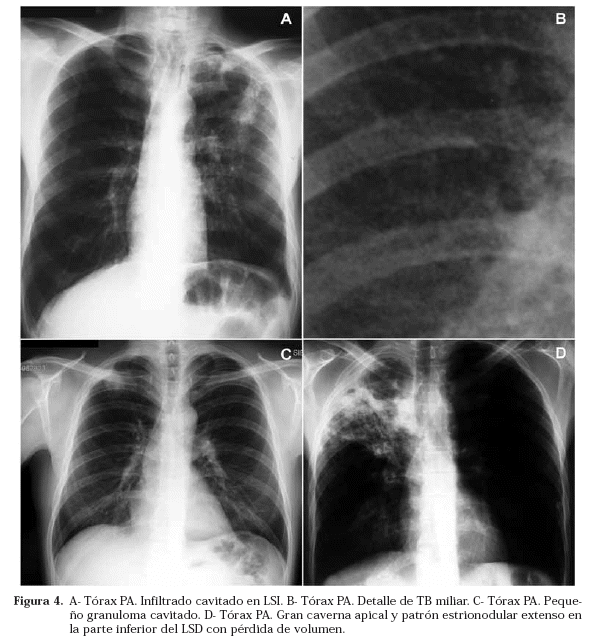
Las lesiones comienzan inicialmente como infiltrados heterogéneos mal definidos (fase exudativa) (Fig. 4 A) situados típicamente en los segmentos apicales y/o posteriores de los lóbulos superiores o con menor frecuencia en el segmento apical de los inferiores. Generalmente afectan a más de un segmento y con frecuencia son bilaterales17. Lo más característico de estas lesiones es su tendencia a cavitarse (fase ulcerativa)20 (Fig. 4 D). Estas cavidades suelen ser de paredes gruesas, irregulares, inicialmente pueden ser pequeñas y múltiples con tendencia coalescente a formar una cavidad única mayor y típicamente sin nivel si no hay complicaciones (hemoptisis o sobreinfección). Con tratamiento eficaz tienden a reducirse de tamaño, sus paredes se adelgazan y quedan reducidas a tractos fibrosos groseros residuales pero, ocasionalmente, la cavidad detergida permanece. Si no se cavita, el infiltrado mal definido suele evolucionar hacia lesiones más densas y mejor definidas con un característico aspecto estrionodular típico de una mezcla de granulomas maduros y atelectasias lineares residuales cicatrizales (fase fibroproliferativa) (Fig. 4 D). El cuadro en conjunto es agresivamente destructivo y, cuando cura, lo hace generalmente con marcada pérdida de volumen de la zona afectada, pudiendo estar presentes claros signos de retracción a nivel mediastínico, hiliar, costal y en las cisuras, así como fibrosis y bronquiectasias extensas residuales (Figs. 1 F y 5 A). También es bastante característico el desarrollo de una reacción local, el típico casquete apical, que en cuadros menos avanzados puede ser la lesión residual más llamativa en el tórax simple y que la TC demostró que corresponde a un engrosamiento pleural, fibrosis del parénquima subpleural y depósito de grasa extrapleural por dentro de los músculos intercostales, generalmente muy vascularizada21. Por el contrario, si el proceso se detiene muy tardíamente la afectación pleural suele ser más severa y puede acabar en un fibrotórax total o parcial.
Sorprendentemente, y en contraposición a las extensas lesiones parenquimatosas que en esta forma de presentación de la TBs pueden observarse, la afectación ganglionar, tanto hiliar como mediastínica es inusual y este hecho, junto con la posible diferente localización, puede ayudarnos a diferenciarla de una rara TBp en fase de extensión.
Una de las complicaciones más características de la cavitación es la diseminación bronquial, se detecta en alrededor de un 20% de los casos y aparece como múltiples nódulos mal definidos de pequeño tamaño en la zona de aspiración. En la TC pueden dar una imagen característica aunque no especifica de árbol en brote por relleno de los bronquiolos por material caseoso y de pequeños nódulos de localización centrilobular.
Patrón miliar
La TB miliar se debe a una amplia diseminación hematógena pulmonar y extrapulmonar y puede verse tanto en la TBp como en la TBs como consecuencia de la perforación de un foco tuberculoso a un vaso. Típicamente se presenta en la primera infancia, ancianos y pacientes inmunocomprometidos, aunque más raramente también puede afectar a pacientes sin factores de riesgo de cualquier edad. El patrón es muy característico (Figs. 4B y 3A), aunque no especifico de la TB, y consiste en multitud de pequeños nódulos de entre 1 y 3 mm de diámetro de bordes bien definidos que de forma uniforme y homogénea ocupan todos los campos pulmonares, aunque excepcionalmente, según el vaso afecto puede verse en un solo pulmón o en una zona más restringida, siempre con una distribución uniforme. El tamaño de las lesiones las sitúa muy por debajo del límite de resolución de la placa simple y sólo un fenómeno de sumación de imágenes las hace visibles. Pueden ser muy difíciles de ver en fases iniciales a pesar de su número; suelen evolucionar muy lentamente y en fases muy tardías pueden tener una cierta tendencia coalescente con un patrón en tormenta de nieve o incluso desembocar en un distrés respiratorio del adulto. Cuando existe la sospecha de este tipo de TB, una TC de alta resolución puede ayudar a detectarla incluso semanas antes de que sea visible en la radiografía simple de tórax. Su evolución suele ser igualmente lenta con un tratamiento eficaz pero la resolución suele ser completa. En un significativo número de casos puede coexistir con otros patrones más comunes de afectación tuberculosa pulmonar.
Patrón pleural
Aunque clásicamente descrito como uno de los patrones típicos de la TB es evidente que la pleura no está en contacto directo con el exterior y, al igual que el patrón miliar, precisa un foco previo por lo que quizás debería mejor estar contemplado como una complicación. Potencialmente los bacilos pueden llegar a la pleura por tres vías diferentes: hematógena, apertura a pleura de un ganglio y vaciamiento en la misma de un granuloma pulmonar subpleural; este último mecanismo es probablemente el más frecuente y es excepcional encontrar un derrame pleural sin ninguna otra lesión visible parenquimatosa ni ganglionar que, en ocasiones, sólo se puede evidenciar tras el drenaje del propio derrame. En la era anterior a la TC no era excepcional que en los derrames pleurales puros, sin ninguna otra lesión aparente, años después de haberse curado la pleuritis apareciese un pequeño granuloma subpleural sólo visible cuando la progresiva calcificación aumentaba su densidad.
El derrame pleural tuberculoso no complicado (Fig. 1 A), no tiene ninguna característica propia radiológica que lo distinga de los de otro origen en la placa de tórax simple y es más propio de la TBp; es habitualmente unilateral y muestra una clara tendencia a organizarse y locularse, especialmente después de realizar maniobras invasivas (punciones o biopsias) (Fig. 1 B). En la TC es característico observar sobre todo en la TBs evolucionada un engrosamiento uniforme de contornos lisos de ambas pleuras, la parietal y la visceral, cuya densidad se ve aumentada por el contraste y separadas por el líquido pleural en cantidad variable. En no pocas ocasiones pueden observarse con la TC finos tabiques de fibrina incluso en fases relativamente precoces.
El empiema tuberculoso constituye una colección de líquido pleural purulento con abundantes bacilos generalmente en un espacio bien delimitado por una pleura muy engrosada. Es una complicación mayor muy raramente observada actualmente en nuestro medio que puede acabar produciendo un fibrotórax, suele calcificarse y puede dar a su vez, si el tratamiento no es adecuado, otras dos complicaciones de especial relevancia con una notable tendencia a la cronificación y que pueden aparecer incluso muchos años después cuando el proceso inicial suele llevar ya mucho tiempo olvidado: el empiema necessitatis seguido normalmente de una fístula pleurocutánea y la fístula broncopleural (Fig. 6 C) según que se perfore hacia el exterior o el interior. En ambos casos la aparición de aire o un nivel hidroaéreo dentro de la cavidad pleural será el signo radiológico más característico.
Patrón traqueobronquial
La tuberculosis traqueobronquial, sin otros signos radiológicos de la enfermedad a otros niveles en la radiografía simple de tórax, es una rareza22, pero asociada a una lesión pulmonar bacilífera, especialmente a una caverna postprimaria es muy frecuente si bien raramente hoy día da sintomatología propia. En el primer caso, la perforación de una adenopatía a un bronquio central o tráquea es probablemente la causa más frecuente aunque una posible diseminación hematógena o linfática también han sido invocadas. En el segundo, la vía aérea, a través del continuo trasiego de bacilos en las secreciones y detritus expulsados, es probablemente el camino de extensión más común.
Si algo es característico de la TB traqueobronquial, es la ausencia de signos radiológicos en la radiografía de tórax simple, al menos hasta fases avanzadas de la enfermedad. La infiltración submucosa granulomatosa inicial puede ir seguida de una ulceración de la mucosa y finalmente, si el proceso no es tratado, de lesiones polipoideas intraluminares granulomatosas que a su vez pueden ulcerarse y/o fibrosarse. Estas lesiones pueden favorecer la retención de secreciones que producen tapones y atelectasias que darán las correspondientes imágenes radiológicas y, en todo caso, inducirán al curarse lesiones fibróticas residuales cicatriciales con estenosis bronquiales que pueden deformar o incluso obstruir completamente el bronquio y suelen acompañarse de dilataciones postestenóticas. Estas bronquiectasias centrales no deben confundirse con las bronquiectasias periféricas por tracción secundarias a la destrucción del parénquima pulmonar.
Con la TC de alta resolución en fase aguda puede observarse un estrechamiento, al principio regular y con el tiempo menos uniforme, de la luz de porciones relativamente largas del bronquio afectado asociado a un engrosamiento de la pared (Figs. 2 D y E). En fase residual, si las lesiones han sido suficientemente severas, aparecerán las citadas estenosis, deformaciones y dilataciones bronquiectasicas postestenóticas que, excepcionalmente, podrán acompañarse de atelectasias periféricas a veces permanentes.
Tuberculoma
El tuberculoma es una forma de resolución típica de la TBp aunque puede verse ocasionalmente en la TBs en donde puede quedar enmascarado en la radiografía simple de tórax por el resto de lesiones residuales acompañantes. Debería por lo tanto considerarse como una complicación o secuela, pero como con frecuencia es lo único que se encuentra tras la curación de la enfermedad, suele describirse como un patrón más.
El tuberculoma es un nódulo típicamente menor de 3 cm (Fig. 4 C), con frecuencia subcentimétrico, aunque ocasionalmente se han descrito masas de hasta 5 cm. Suele estar constituido por un núcleo caseoso central donde pueden encontrarse bacilos ácido-alcohol resistentes no siempre viables, una doble corona de células epitelioides, células gigantes multinucleadas y linfocitos y una cápsula fibrosa que, habitualmente, permite delimitar en la placa unos contornos nítidos bien definidos. La histología muestra en ocasiones una o más capas de cebolla a veces visibles también en la TC (Fig. 5 B) formadas por cápsulas fibrosas embebidas en el caseum que sugieren que éstas fueron sobrepasadas una o más veces durante la fase de formación pero una vez evolucionado su tamaño suele permanecer estable siendo ésta una de las características que lo distingue de los tumores. Es bastante frecuente que se calcifique (Figs. 1 E, 3 F y 5 B) (generalmente de forma difusa y nodular) y para ello precisa a veces muchos años; puede llegar a cavitarse (Figs. 4 C, 3 B y 5 B) siguiendo entonces un curso variable, desde su completa desaparición en la placa de tórax simple, hasta la reactivación de la enfermedad. Con gran frecuencia la lesión principal viene rodeada de otras pequeñas opacidades en su proximidad, denominadas lesiones satélites.
En la tabla 3, adaptada de Rubin23 puede observarse la frecuencia de presentación de los principales patrones radiográficos en diferentes series.
Complicaciones y secuelas
Como ya se ha dicho previamente, la TB pulmonar, especialmente la TBs es una enfermedad que habitualmente incluso cuando cura lo hace con algún tipo de secuela cuya magnitud viene relacionada con la severidad y extensión del proceso previo. Algunos autores incluyen entre las complicaciones los patrones comunes ya mencionados y alguna de las secuelas como es el caso del tuberculoma que acabamos de describir.
Habitualmente se suelen agrupar según el órgano afecto y en la tabla 4 se exponen las más relevantes26-28. Todas estas lesiones no son excluyentes y con frecuencia dos o más se presentan conjuntamente o preceden y son la base de otras.
No es nuestra intención hacer un repaso exhaustivo de toda la lista de secuelas citadas, por otra parte incompleta, pero sí recordar algunas de las más frecuentes o con peculiaridades que permiten diferenciarlas de cuadros similares de otro origen.
Micetoma
El micetoma o aspergiloma, pues el aspergillus suele ser el hongo generalmente implicado, es una masa formada por hifas, moco, detritus celulares y restos de sangre que coloniza una cavidad previa (Fig. 6 D). En alrededor de un 40% de los casos esta cavidad previa es de origen tuberculoso27. En su presentación típica la bola ocupa sólo parte de la cavidad y está libre de forma que se puede comprobar su cambio de posición poniendo al paciente en diferentes posiciones (Figs. 2 A y B), ocupando la parte más declive y dejando un espacio aéreo en forma de media luna por encima característico. Una vez evolucionada es una bola lisa muy compacta, friable y lógicamente no capta contraste en la TC pues es un cuerpo extraño pero durante su formación, esta técnica radiológica permite evidenciar un infiltrado no homogéneo, esponjoso y de forma amorfa. La hemoptisis es la complicación más severa y frecuente, pudiendo llenarse la cavidad o presentar un nivel hidroaéreo durante la fase aguda. Ocasionalmente puede disgregarse y desaparecer espontáneamente y raramente se calcifica. El engrosamiento de las paredes de la cavidad o de la pleura adyacente ha sido descrito por algún autor como signo precoz del desarrollo del micetoma.
Cicatrización postprimaria
Como ya se ha descrito previamente, la aparición de un patrón estrionodular en uno o ambos lóbulos superiores, de extensión variable, acompañado de bronquiectasias de tracción y con signos de una marcada pérdida de volumen por la retracción de las cisuras, de los hilios y de las costillas y con clara desviación del mediastino superior en el caso de que sea unilateral, coronado todo ello por un casquete apical es una imagen muy sugestiva, aunque no específica, de TBs en fase residual (Figs. 1 F y 5 A) ya que también puede verse en la TB activa evolucionada (Fig. 4 D). Básicamente es un patrón destructivo fibrótico y en la zona afecta deja un pulmón no funcionante pero con una rica vascularización sistémica a través de las arterias bronquiales hipertrofiadas y/o de vasos neoformados desde las arterias intercostales que atraviesan la pleura engrosada y fibrosada y que pueden ser la base de futuras hemoptisis, a veces muchos años después de curado el proceso y sin que ello signifique una reactivación de la TB. La embolización de estos vasos anómalos suele ser la forma más eficaz y menos agresiva de tratar esta complicación.
Empiema y fibrotórax
El derrame pleural tuberculoso generalmente es un exudado ambarino, rico en fibrina, escaso en bacilos y, como ya se ha dicho, con marcada tendencia a la organización. Drenado a tiempo si es voluminoso y tratada la enfermedad causal, no suele dejar secuelas o sólo un discreto pinzamiento del seno costofrénico lateral y posterior, pero inadecuada o tardíamente tratado puede conducir a una paquipleuritis de intensidad variable que requiera posterior decorticación cuando el proceso esté controlado y, en casos extremos, puede desembocar en un auténtico empiema, purulento, rico en bacilos, rodeado de una pleura a veces muy gruesa que comprime y compromete la función del parénquima adyacente al que progresivamente colapsa y deteriora, constituyendo el típico fibrotórax. Tiene una marcada tendencia a calcificarse con los años y puede acompañarse en las fases avanzadas de una marcada retracción del hemotórax afecto con escoliosis secundaria. Forma a veces auténticas corazas de piedra que bloquean cualquier movimiento del pulmón en la zona afecta (Fig. 6 A). Se considera un signo de inactividad la ausencia o mínima expresión en la TC del espacio pleural aunque las pleuras estén muy engrosadas. Si el proceso no se trata y no se autolimita, como ya se ha comentado, el pus puede buscar un punto de salida a través de la pared costal o un bronquio creando las correspondientes fístulas y apreciándose entonces generalmente un nivel hidroaéreo en la cámara residual (Fig. 6 C).
Cáncer de pulmón
El cáncer de pulmón puede coexistir con una TB, haciendo especialmente difícil su diagnóstico si se desarrollan en la misma zona. Por otra parte las extensas lesiones fibróticas residuales de una TBs pueden facilitar la aparición de un cáncer de pulmón (scar cáncer) y a su vez el cáncer de pulmón, ya sea deprimiendo la inmunidad o erosionando un granuloma puede facilitar la reactivación de una TB latente. Actualmente, en nuestro medio, ante la aparición de un nuevo nódulo en un campo residual largo tiempo inactivo, especialmente si el paciente es fumador y en su momento fue tratado, es más probable un cáncer de pulmón que una reactivación de su TB.
Silicotuberculosis
En nuestra comunidad la silicosis siempre ha sido una enfermedad infrecuente, generalmente importada por trabajadores de minas subterráneas de otras regiones, donde también ha ido desapareciendo gracias a las medidas de higiene ambiental laboral y la mecanización de las labores de extracción. Es una enfermedad típica de países en vías de desarrollo donde además la prevalencia de la TB es mucho más alta que en nuestro medio. La silicosis da con el tiempo un patrón inicialmente reticular, después típicamente nodular y si es más agresiva, los granulomas tienen una tendencia coalescente formando masas fibrosas con tendencia a la cavitación. Por lo tanto los patrones y complicaciones pueden ser muy parecidos a los observados en la TB cuyo desarrollo puede quedar oculto por las lesiones de la silicosis (Fig. 6 B). En los silicóticos la TB es una enfermedad que se desarrolla con especial facilidad y en determinados países la silicotuberculosis sigue siendo un problema serio29. Dada la ausencia de lesiones características, sólo la continua sospecha ante la aparición de lesiones nuevas puede ayudarnos a realizar un diagnóstico relativamente precoz. La TC puede permitirnos detectar pequeños infiltrados y cavitaciones que en fases iniciales podrían pasar desapercibidos en la radiografía de tórax simple, enmascarados por las lesiones silicóticas.
Colapsoterapia
No deseamos finalizar esta revisión de las complicaciones sin dedicar un breve recuerdo a estas técnicas, que en su momento fueron el único medio eficaz de tratar las cavernas tuberculosas y permitir su curación30. Básicamente había dos tipos de actuaciones:
Toracoplastia: permitía mediante diferentes técnicas quirúrgicas romper literalmente la rigidez de la caja torácica, logrando su colapso en la zona oportuna (Fig. 6 C).
Neumotórax: aplicado en la cavidad pleural o extrapleuralmente sobre la caverna permitía igualmente su colapso sin comprometer la integridad de la caja torácica.
Con el descubrimiento de la estreptomicina, la isoniacida y el PAS en la segunda mitad de los cuarenta, el tratamiento farmacéutico ganó impulso y estas técnicas dejaron de usarse en nuestro país a mediados de los 50 de forma que ninguno de los neumólogos actualmente en ejercicio hemos llegado a conocerlas en activo. Sin embargo, aunque cada vez con menor frecuencia, seguimos atendiendo a pacientes sometidos en tiempos a estas técnicas, que les permitieron sobrevivir a la tuberculosis, aunque en muchas ocasiones con secuelas que les han producido con el paso de los años serios problemas ventilatorios (Fig. 6 A).
Bibliografía
1. Farer L, Lowell LM, Miador MP. Extrapulmonary tuberculosis in the United States. Am J Epidemiol 1979; 109: 205-217. [ Links ]
2. Pineda RR, Leung A, Muller NL, Allen EA, Black WA, FitzGerald JM. Intrathoracic paediatric tuberculosis: a report of 202 cases. Tuber Lung Dis 1993; 74: 261-266.
3. Choyke PL, Sostman HD, Curtis AM, Ravin CE, Chen JT, Godwin JD. Adult onset tuberculosis. Radiology 1983; 148: 357-362.
4. Saltoglu N, Tasova Y, Midikli D, Aksu HS, Sanli A, Dundar IH. Fever of unknown origin in Turkey : evaluation of 87 cases during a nine year period of study.
5. Arango L, Brewin AW, Murray JF. The spectrum of tuberculosis as currently seen in a metropolitan hospital. Am Rev Respir Dis 1973; 108: 805-812.
6. Psychos DN, Voulgari PV, Skopouli FN, Drosos AA, Moutsopoulos HM. Erythema nodosum: the underlying conditions. Clin Rheumatol 2000; 19: 212-216.
7. Mert A, Ozaras R, Tabak F, Ozturk R. Primary tuberculosis cases presenting with erythema nodosum. J Dermatol 2004; 31: 66-68.
8. Barnes PF, Verdegem TD, Vachon LA, Leedom JM, Overturf GD. Chest roentgenogram in pulmonary tuberculosis. Chest 1988; 94: 316-320.
9. Villena V, López A, Echave J, Álvarez C, Martín P. Estudio prospectivo de 1000 pacientes consecutivos con derrame pleural. Etiología del derrame y características de los pacientes. Arch Bronconeumol 2002; 38: 21-26.
10. Vidal R, De Gracia J, Ruiz J, Fite E, Monsó E, Martín N. Estudio controlado de 637 pacientes con tuberculosis: diagnóstico y resultados terapéuticos con esquemas de 9 y 6 meses. Med Clin (Barc) 1986; 87: 368-370.
11. Agarwal R, Gupta D, Aqqarwal AN, Behera D, Jindal SK. Experience with ARDS caused by tuberculosis in a respiratory intensive care unit. Intensive Care Med 2005; 31: 1284-1287.
12. Aktogu S, Yorgancioglu A, Cirak K, Kose T, Dereli SM. Clinical spectrum of pulmonary and pleural tuberculosis: a report of 5480 cases. Eur Respir J 1996; 9: 2031-2035.
13. Pérez Guzmán C, Vargas M, Torres Cruz A, Villareal Velarde H. Does aging modify pulmonary tuberculosis? Chest 1999; 116: 961-967.
14. Golpe R, Cifrián JM, Fernández S, Fernández B, Marín B, Alonso MA. Características de los pacientes fallecidos por tuberculosis. An Med Interna 1999; 16: 65-68.
15. Singh KJ, Ahluwalia G, Sharma SK, Saxena R, Chaudhary VP, Anant M. Significance of haematological manifestations in patients with tuberculosis. J Assoc Physicians India 2001; 49: 788, 790-791.
16. Morris CD, Bird AR, Nell H. The haematological and biochemical changes in severe pulmonary tuberculosis. S J Med 1989; 73: 1151-1159.
17. Curvo-Semedo L, Teixeira L, Caseiro-Alves F. Tuberculosis of the chest. Eur J Radiol 2004; 51: 139-149.
18. Felson B. The radiology of tuberculosis. Grune & Stratton, New York 1979.
19. Van Dyck P, Vanhoenacker FM, Van den Brande P, De Schepper AM. Imaging of pulmonary tuberculosis. Eur Radiol 2003; 13: 1771-1785.
20. Andreu J, Cáceres J, Pallisa E, Martínez-Rodríguez M. Radiological manifestations of pulmonary tuberculosis. Eur J Radiol 2004; 51: 139-149.
21. Woodring JH, Vandiviere HM, Fried AM, Dillon ML, Williams TD, Melvin IG. Update: the radiographic features of pulmonary tuberculosis. AJR 1986; 146: 497-506.
22. Lee KS, Kim YH, Kim WS, Hwang SH, Kim PN, Lee BH. Endobronquial tuberculosis: CT features. J Comput Assist Tomogr 1991; 15: 424-428.
23. Rubin SA. Tuberculosis and atypical mycobacterial infections in the 1990s. RG 1997; 17: 1051-1059.
24. Stead WW, Kerby GR, Schlueter DP, Jordahl CW. The clinical spectrum of primary tuberculosis in adults: confusion with reinfection in the pathogenesis of chronic tuberculosis. Ann Intern Med 1968; 68: 731-745.
25. Hadlock FP, Park SK, Awe RJ, Rivera M. Unusual radiographic findings in adult pulmonary tuberculosis. AJR 1980; 134: 1015-1018.
26. Leung AN. State of the art. Pulmonary tuberculosis: The essentials. Radiology 1999; 210: 307-322.
27. Kim HY, Song K-S, Goo JM, Lee KS, Lim TH. Thoracic sequelae and complications of tuberculosis. Radiographics 2001; 21: 839-860. Discussion 859-860.
28. Castaner E, Gallardo X, Mata JM. Common and uncommon complications of reactivation tuberculosis in inmunocompetent patients. Eur J Radiol 1998; 27: 43-52.
29. Mulenga EM, Miller HB, Sinkala T, Hysong TA, Burgess JL. Silicosis and tuberculosis in Zambian miners. Int J Occup Environ Health 2005; 11: 259-262.
30. Tapia M. Formas anatomoclínicas de la tuberculosis pulmonar (Diagnóstico y Tratamiento) Tomo III Ediciones Afrodisio Aguado. Madrid, 1942.
 Dirección para correspondencia:
Dirección para correspondencia:
F. J. Domínguez Del Valle
Sección de Neumología
Hospital de Navarra
C/ Irunlarrea, 3
31008 Pamplona
Navarra