My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Anales del Sistema Sanitario de Navarra
Print version ISSN 1137-6627
Anales Sis San Navarra vol.31 suppl.1 Pamplona 2008
Reperfusión en el ictus isquémico agudo: estado actual y futuro
Reperfusion in acute ischaemic stroke: present and future
M. Herrera, J. Gállego, R. Muñoz, N. Aymerich, B. Zandio
Servicio de Neurología. Hospital de Navarra. Pamplona.
Dirección para correspondencia
RESUMEN
La isquemia cerebral es un proceso dinámico desencadenado al ocluirse una arteria intracraneal de forma aguda, habitualmente por un embolismo, desde el corazón o desde lesiones arterioescleróticas de arterias más proximales. La recanalización urgente de dichas arterias y reperfusión precoz del tejido cerebral, las terapias neuroprotectoras que intervengan en la cascada isquémica y la prevención de la recurrencia son los objetivos terapéuticos en la fase aguda del ictus isquémico. El tratamiento trombolítico persigue la lisis del coágulo que ocluye la arteria intracraneal. En la actualidad, el único aprobado es el activador tisular del plasminógeno (rtPA) por vía intravenosa. Se ha demostrado su seguridad y eficacia dentro de las tres primeras horas de evolución del ictus isquémico. La instauración de este tratamiento implica una profunda modificación de las estructuras sanitarias y entrenamiento del personal responsable. La pequeña ventana terapéutica y las limitaciones que este fármaco tiene en la práctica diaria han urgido a abrir caminos para explorar nuevas estrategias: se revisan la reconsideración de los criterios de exclusión (especialmente en ancianos y déficits neurológicos menores o de rápida mejoría), la expansión de la ventana terapéutica mas allá de las 3 horas con selección de pacientes por imagen multimodal, la posibilidad de trombolisis combinada con fármacos antitrombóticos o con potenciación por ultrasonidos. Se revisan asimismo nuevos trombolíticos que van surgiendo y el abordaje intraarterial trombolisis intraarterial y terapias de reperfusión endovascular mecánica.
Palabras clave. Reperfusión. Ictus agudo. Trombolisis. Recanalización.
ABSTRACT
Cerebral ischaemia is a dynamic process triggered when an intracraneal artery is acutely occluded, normally due to an embolism from the heart or from arteriolosclerotic lesions of more proximal arteries. Urgent rerouting of these arteries and early reperfusion of the cerebral tissue, neuroprotector therapies that intervene in the ischaemic cascade and prevention of recurrence are the therapeutic aims in the acute phase of ischaemic stroke. Thrombolytic treatment pursues the lysis of the dot occluding the intracranial artery. At present, the only approved thrombolytic treatment is the intravenous Recombinant Tissue Plasminogen Activator (rtPA). Its safety and efficacy within the first three hours of evolution of the ischaemic stroke have been demonstrated. Establishment of this treatment involves a profound change in the health structures and the training of the personnel responsible. The small therapeutic window and the limitations of this medicine in daily practice have led to the urgent exploration of new strategies: we review the reconsideration of exclusion criteria (especially in the elderly and in minor neurological deficits or those of rapid improvement), the widening of the therapeutic window beyond 3 hours with the selection of patients by multimodal image, the possibility of thrombolysis combined with antithrombotic drugs or with enhancement through ultrasound. We also review the new thrombolytics that are appearing and the intra-arterial thrombolysis approach and therapies of endovascular mechanical reperfusion.
Key words. Reperfusion. Acute stroke. Thrombolysis. Recanalization.
La isquemia cerebral: un proceso dinámico
Aproximadamente un 85% de los ictus son de causa isquémica, al ocluirse una arteria intracraneal de forma aguda habitualmente por un embolismo, desde el corazón o desde lesiones arterioescleróticas de arterias más proximales. Esto condiciona una reducción brusca del flujo sanguíneo cerebral regional en el territorio irrigado por dicha arteria. Las consecuencias inmediatas sobre el tejido cerebral dependerán del grado de reducción del flujo cerebral. En el núcleo del tejido isquémico, la caída del flujo por debajo de 10 ml/100g/min producirá una rápida muerte celular (infarto). Entre este núcleo y el parénquima normalmente perfundido (>50ml/100g/min) existe una zona moderadamente hipoperfundida, cuya extensión dependerá de los mecanismos de compensación hemodinámica a través de la circulación colateral. En esta zona hipoperfundida pueden delimitarse a su vez dos regiones: la llamada oligohémica (>22ml/100g/min) que raramente se convertirá en tejido infartado, y otra denominada penumbra isquémica (<22ml/100g/min ), que progresará a infarto cerebral si no se restablece precozmente una perfusión cerebral adecuada.
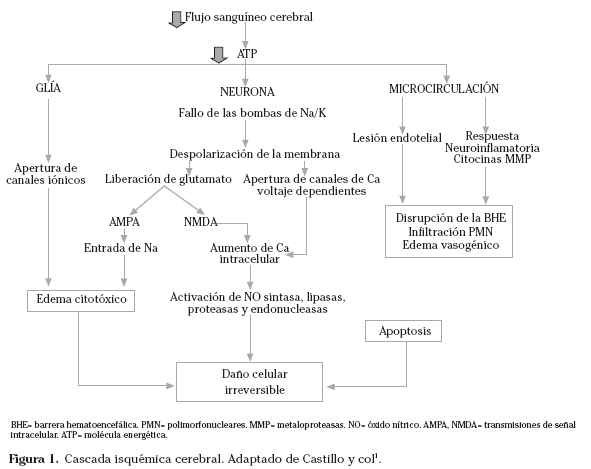
La isquemia cerebral pone en marcha un proceso destructivo dinámico1 en la llamada unidad neurovascular, compuesta por neuronas, glía y endotelio vascular; de manera que de no ocurrir la reperfusión eficaz precoz, terminará en destrucción celular y edema citotóxico, apoptosis, disrupción de la barrera hematoencefálica y riesgo de transformación hemorrágica por reperfusión tardía (Fig. 1).
Por ello, la recanalización urgente de dichas arterias y reperfusión precoz del tejido cerebral, así como las terapias neuroprotectoras que intervengan en la cascada isquémica son los objetivos terapéuticos en la fase aguda del ictus isquémico. Otro de los objetivos en esta fase será, prevenir la reoclusión y la recurrencia precoz. En este capítulo abordaremos las terapias de reperfusión.
Trombolisis endovenosa con RT-PA. Estado actual
Generalidades e historia
El tratamiento trombolítico persigue la lisis del coágulo que ocluye la arteria intracraneal. En la actualidad, el único aprobado por vía sistémica por la Agencia Europea del Medicamento y Productos Sanitarios (AEMPS) y la FDA es el activador tisular del plasminógeno (rTPA) por vía intravenosa (iv) a dosis de 0,9 mg/kg dentro de las 3 primeras horas de evolución del ictus isquémico. Es el primer fármaco que ha demostrado una notable eficacia en el tratamiento de pacientes seleccionados, y ha supuesto un avance crucial en el tratamiento de estos pacientes desde su publicación en el ensayo clínico NINDS en 19952.
La AEM promovió un estudio de fase IV para la monitorización de la eficacia y seguridad de este fármaco, el registro SITS-MOST. Esto supuso una previa acreditación a los profesionales y hospitales para rentabilizar lo mejor posible el éxito de este tratamiento. Sus resultados han sido publicados en el 20073, con 6.483 pacientes reclutados en 285 centros pertenecientes a 14 países desde 2002 a 2006. España contribuyó con 1.305 pacientes de 42 centros, y Navarra con 63. El estudio ha confirmado la seguridad y eficacia del tratamiento trombolítico dentro de las tres primeras horas (Tabla 1).
La indicación debe provenir de una minuciosa evaluación individual y debe ser administrado por neurólogos expertos en la fisiopatología y tratamiento del ictus y con suficiente experiencia en su uso. El grado de afectación clínica se objetiva en una escala de evaluación neurológica, la NIHSS. Siempre ha de realizarse un estudio neurorradiológico antes de iniciar la trombolisis así como todas aquellas exploraciones encaminadas a descartar cualquiera de los procesos que contraindican el tratamiento (Tabla 2). También es conveniente conocer la localización y grado de oclusión arterial. Todo ello en el menor tiempo posible ya que se trata de un proceso dinámico en el que cada minuto cuenta (tiempo es cerebro), y afecta tanto a la seguridad como a la eficacia del tratamiento. Durante las primeras 24 horas el paciente debe estar monitorizado según un protocolo establecido (Tabla 3), dentro de una unidad de ictus o de cuidados semi-intensivos bajo la responsabilidad de un neurólogo experto en ictus.Por ello, el rTPA implica una profunda modificación de las estructuras sanitarias y entrenamiento del personal responsable y está demostrado que si la selección y el proceso asistencial no es adecuado, y se administra por personal no adiestrado, el beneficio del tratamiento desaparece y las complicaciones son graves.
Además de estas exigencias hospitalarias, el hecho de que se disponga de un margen temporal tan estrecho obliga a disponer de un circuito de coordinación extrahospitalario ante la sospecha de ictus que sea muy rápido y eficaz, así como a un conocimiento por parte de la población de los síntomas de alarma para activar éste urgentemente.
Factores pronósticos de respuesta
Además de la experiencia del centro hospitalario responsable, otros factores clínico-radiológicos se han ido reconociendo como predictores de la respuesta al rTPA: los más frecuentemente relacionados con una escasa respuesta al rTPA en los numerosos estudios realizados4,5 al respecto son la hiperglucemia >140mg/kg, el tiempo transcurrido hasta la administración del fármaco, la no recanalización arterial o recanalización tardía, la edad, una mayor afectación clínica (NIHSS más altas) con alteración de la conciencia, y una oclusión arterial más proximal y de origen aterotrombótico.
Tras la experiencia se ha sabido que no toda transformación hemorrágica es una complicación de mal pronóstico: así, se ha clasificado en 4 tipos6, que diferencian la transformación hemorrágica en el seno del infarto o infarto hemorrágico (IH1, IH2), consecuencia de la reperfusión en el tejido isquémico con la barrera hematocencefálica alterada y no necesariamente ligada a empeoramiento clínico, y el hematoma parenquimatoso sintomático, (PH1, PH2), complicación cifrada en torno al 5%. Los factores más frecuentemente relacionados con esta hemorragia sintomática son la violación del protocolo, la edad, la hipertensión arterial sistólica y la hiperglucemia. Se está haciendo un esfuerzo notable de investigación para conocer los mecanismos biológicos implicados. En este sentido son muy interesantes y esperanzadores los hallazgos en el campo del metabolismo de las metaloproteasas7,8.
Estado de la arteria: oclusión, recanalización, reoclusión
Los pacientes con ictus isquémico agudo tienen una oclusión arterial intracraneal, no objetivable por la tomografía computarizada (TC) craneal. Sin embargo, la recanalización de esta arteria en las primeras horas ha demostrado ser un factor predictivo de buen pronóstico en pacientes tratados9,10 (Fig. 2). Además del tiempo transcurrido hasta la recanalización, el grado y rapidez con que ésta se produce también se han demostrado predictores de respuesta10,11: así, una recanalización completa de aparición súbita es el objetivo de las terapias de reperfusión. Conocer de forma dinámica el estado de la arteria responsable de la clínica permite por tanto predecir la evolución y tomar decisiones terapéuticas12. Son numerosos los estudios con técnicas Doppler que avalan esta afirmación. Por estos estudios también se ha conocido que el fenómeno de la reoclusión, por el que la arteria previamente recanalizada (la mayoría de las veces de manera parcial) vuelve a ocluírse, es relativamente frecuente (hasta un 34% de las recanalizaciones iniciales), y responsable hasta en un 60-80% de los pacientes con empeoramiento clínico tras una inicial respuesta al rTPA13. La reoclusión es más frecuente en el caso de oclusiones más proximales o de la arteria basilar, recanalización previa no completa, y trombos de origen ateromatoso (estenosis carotídea ipsilateral)13,14.
Limitaciones
El retraso en la llegada de los pacientes a los hospitales o su tratamiento fuera de hospitales con medios y especialistas adecuados, unido a los estrictos criterios de exclusión actuales, hacen que en la actualidad este tratamiento sólo se aplique a una escasa proporción de pacientes con ictus isquémico agudo, no superando el 5%15. Cifras muy similares se dan actualmente en nuestra comunidad a pesar de ser la que presenta la proporción más alta de pacientes tratados en el registro SITS MOST de toda España.
Así pues hemos visto, la eficacia del rTPA depende de varios factores. Uno de los más importantes, además del tiempo transcurrido, es la localización de la oclusión arterial y por tanto el tamaño del trombo obliterante. Las mayores tasas de recanalización completa publicadas con el rTPA iv tras dos horas desde la inyección difieren desde un 54% en oclusiones distales hasta un 19% en oclusiones proximales. Hasta en un 39% de pacientes no se consigue el objetivo de la recanalización en las primeras 6 horas10,12. Esta es una de las principales limitaciones de este tratamiento: la falta de eficacia en un porcentaje importante de pacientes, con un 40-45% de ellos con discapacidad y dependencia a los tres meses, y una mortalidad del 12%3,4.
Técnicas diagnósticas en el ictus agudo
Técnicas radiológicas. Imagen multimodal
Las técnicas de imagen son un punto fundamental en el diagnóstico y tratamiento del ictus isquémico. La TC sin contraste continúa siendo la técnica más accesible y que ha demostrado suficientemente su utilidad en el proceso de selección de pacientes para el tratamiento trombolítico dentro de las tres primeras horas. Sin embargo, la resonancia magnética (RM) va demostrando una mayor capacidad diagnóstica del ictus, especialmente en las secuencias de difusión, con una sensibildad de 83% en un estudio prospectivo realizado a una amplia serie de pacientes con posible ictus agudo16,17. Además, los pacientes con ictus seleccionados para trombolisis mediante RM tienen una menor tasa de complicación hemorrágica18. La menor accesibilidad de esta técnica y sus contraindicaciones en ciertos pacientes como los portadores de marcapasos hacen que su aplicación como screening en urgencias sea más difícil.
La llamada imagen multimodal, bien mediante técnicas de RM con secuencias difusión (DWI), perfusión (PWI) y angioRM, o bien mediante técnicas de TC-perfusión y angioTC, ha permitido ahondar en la fisiopatología y diagnóstico del ictus. Han servido para acercarnos al concepto de penumbra isquémica, entendido como el tejido cerebral hipoperfundido pero no dañado y por tanto en riesgo de convertirse en infarto en caso de persistir el defecto de perfusión, o con posibilidades de sobrevivir si se restablece éste. En efecto, el llamado mismatch o desacoplamiento entre la región hipoperfundida y la región infartada correspondería a esta área de tejido en penumbra y recuperable tras la intervención terapéutica. Los datos disponibles acerca de la comparación de ambos métodos de imagen multimodal muestran un grado de concordancia excelente, y no permiten de momento afirmar la superioridad de ninguno de ellos19. Las ventajas y desventajas de cada uno de ellos se muestran en la tabla 4.
Los numerosos estudios al respecto en series de pacientes20 muestran cómo hasta en el 80% de los pacientes entre las 3 y las 6 horas de evolución está presente este mismatch o área de tejido en penumbra, que disminuye rápidamente con el tiempo (Fig. 2). Este hallazgo, se está tomando de base para ampliar la ventana terapéutica de la trombolisis por encima de la tres horas, en ensayos clínicos o por uso compasivo.
Sin embargo, quedan aún tres interrogantes sin resolver20: no existe una clara definición estandarizada del mismatch, ni de los métodos técnicos para los estudios de perfusión (en una revisión reciente advierte que los estudios realizados al respecto usan hasta 5 diferentes técnicas); no hay una clara evidencia del valor pronóstico de la existencia de mismatch, en cuanto a crecimiento del infarto o diferente evolución clínica entre los pacientes con y sin mismatch; definir su papel en la sección de pacientes para tratamiento trombolítico después de las tres primeras horas. Los últimos estudios, y sobre todo el ensayo EPITHET, recientemente publicado, arrojan más luz sobre este asunto y van despejando estos interrogantes.
Otro potencial valor de las técnicas de imagen se refiere a la predicción de riesgo hemorrágico secundario al trombolítico. En este sentido, el estudio BRASIL21 analizó las secuencias HEMO de RM de 570 pacientes tratados con rTPA en las 6 primeras horas, no hallando una correlación significativa entra la presencia previa de microsangrados cerebrales y la transformación hemorrágica sintomática. Cabe destacar que los pacientes con múltiples microsangrados (≥5) representaron un 1% del total, por lo que los autores concluyeron que no podían concluir sobre la seguridad del rTPA en este raro supuesto.
Técnicas ultrasonográficas
Las técnicas de Doppler transcraneal (DTC), con o sin imagen ecográfica con codificación de color (dúplex transcraneal, DTCC) han demostrado su capacidad en el diagnóstico a tiempo real del estado de la arteria: localización de la oclusión, momento y grado de recanalización, y reoclusión, con excelente correlación en manos expertas con otras técnicas como la angiografía y la angioRM o angioTC. Hay unos patrones establecidos de espectrografía que se correlacionan con los grados de flujo arterial en la imagen angiográfica: los llamados patrones de flujo TIBI (Thrombolysis In Brain Ischemia) (Fig. 3), en correlación a los conocidos TIMI de la coronariografía22-24.
Las arterias extracraneales involucradas en la patogenia del ictus isquémico (carótidas y vertebrales) también pueden ser exploradas con estas técnicas (Doppler continuo cervical, eco-Doppler-color). Son una herramienta muy útil y dinámica que además de ofrecer información diagnóstica muy valiosa, pueden ofrecer un potencial efecto terapéutico, y permitir obtener una información pronóstica con implicaciones terapéuticas25. Sus valores de sensibilidad y especificad en combinación se acercan al 100%. Sus principales limitaciones son la ausencia de ventana temporal para los ultrasonidos (hasta un 10% de los casos), solucionable con el uso de ecopotenciadores, y la exigencia de un entrenamiento y experiencia por parte del explorador para su fiabilidad diagnóstica. Los nuevos aparatos permiten una gran accesibilidad y la posibilidad de utilizarlos a la cabecera del enfermo.
Nuevas posibilidades de desarrollo de la trombolisis con rTPA
Reconsideración de los criterios de inclusión/exclusión
Los criterios en los cuales se basa la selección de los pacientes para el tratamiento trombolítico son básicamente los usados en los ensayos clínicos. En muchas de las circunstancias no hay evidencia científica disponible, y las recomendaciones están basadas en el juicio de expertos y el sentido común. Por este motivo, existen las contraindicaciones enumeradas en las guías europeas, americanas y canadienses son algo diferentes entre ellas (Tabla 2). La extensión en el uso del fármaco y la experiencia de estos últimos años han hecho que en situaciones particulares se hayan tomado decisiones terapéuticas por valoración del cociente riesgo/beneficio fuera de estos criterios, comunicándose después los resultados obtenidos. Así, el uso en niños de 12 a 16 años, ictus severos con NIHSS alta, existencia de signos precoces de infarto en la TC, pacientes con crisis epilépticas de inicio con evidencia de oclusión arterial, disecciones de carótida, trombos intracardíacos, embarazo y menstruación ha sido comunicado en series de pacientes de número variable, sugiriendo que el riesgo de sangrado en esta condiciones puede no ser tan alto como se presumía26,27.
Especial atención merecen dos condiciones fuera de protocolo especialmente frecuentes: los ancianos mayores de 80 años y los pacientes con déficits menores.
Ancianos mayores de 80 años
Una sistemática revisión de 6 estudios28, comparando los resultados en pacientes de ≥80 versus <80 años, no encontró un mayor riesgo de hemorragia cerebral sintomática en el grupo mayor. Sí hay una diferencia significativa en cuanto a morbimortalidad del ictus en estos pacientes, al igual que en los no tratados. Por tanto, desde un punto de vista de seguridad, no hay motivos para excluir a estos pacientes. La duda está en si realmente mejora el estado funcional a los tres meses. Habrá por tanto que individualizar y esperar a otros ensayos en marcha en que se incluyen a grupos de este segmento de edad. En nuestra comunidad estamos ya tratando a algunos de estos pacientes seleccionados, por uso compasivo del fármaco y con permiso del Comité Ético de Investigación Clínica. La creciente esperanza de vida media de la población obligará a no ser rígidos con este criterio numérico.
Pacientes con déficits menores o con mejoría rápida
Ésta es una proporción nada desdeñable de los pacientes con ictus isquémico agudo, (5-18%). Muchos no reciben rTPA sobre la base de la mejoría espontánea, el habitual buen pronóstico funcional global a largo plazo y por tanto la incertidumbre de que el cociente beneficio/riesgo sea a favor de tratar. De hecho, es uno de los criterios de exclusión más utilizados15. Sin embargo, hay estudios que muestran que hasta una tercera parte de estos pacientes que no se tratan desarrollan un deterioro neurológico posterior, y pueden desarrollar un crecimiento del infarto29,31. Además no hay que olvidar que a pesar de haber mejorado inicialmente, pueden quedar con secuelas neurológicas que, aunque no les condicione dependencia o invalidez, les afecte significativamente a su calidad de vida, como por ejemplo la afectación del lenguaje o la pérdida de habilidades cognitivas.
El punto clave es la existencia o no de una oclusión arterial. Se conoce que la presencia de circulación colateral que se pone en marcha tras la oclusión de un vaso puede inicialmente suplir a la región isquémica y condicionar una mejoría clínica, y es cuando finalmente claudica cuando se produce el deterioro neurológico subsiguiente, y el infarto cerebral32. También puede existir una mejoría clínica coincidiendo con la migración del trombo a territorios más distales reperfundiéndose parte del territorio isquémico, persistiendo sin embargo la oclusión más distal y un tejido hipoperfundido con riesgo de infarto. Por tanto, basar la decisión terapéutica únicamente en la valoración clínica puede inducir a error, y es fundamental conocer el estado de las arterias, por las técnicas mencionadas anteriormente, para tomar una decisión. La seguridad del tratamiento demostrada en estos pacientes, con muy bajas tasas de transformación hemorrágica, también será un factor a tener en cuenta33.
Expansión de la ventana terapéutica: más allá de las 3 horas
El análisis de los datos extraídos de los ensayos clínicos (NINDS; ECASS 1 y 2, ATLANTIS) sugiere un potencial beneficio del tratamiento con rTPA entre las 3 y 6 horas de evolución. El ensayo europeo ECASS 3 está evaluando el uso de este fármaco en la ventana de 3 a 4,5 horas, y el IST-3 en la ventana de 3 a 6 horas; éstos arrojarán más luz sobre este asunto.
La reducción en el beneficio más allá de las tres primeras horas en los ensayos no era explicable por una mayor tasa de hemorragia cerebral; es más probablemente atribuible a la progresiva desaparición de la penumbra isquémica. Este es el punto de partida por el cual, numerosas series de casos publicadas sugieren que en pacientes seleccionados con tejido isquémico rescatable podrían beneficiarse de las terapias de reperfusión más allá de las tres primeras horas20. El diagnóstico de la presencia o no de penumbra isquémica reperfundible y la capacidad de pronosticar transformación hemorrágica en cada paciente es el reto de las técnicas de imagen multimodal antes mencionadas.
En el estudio DEFUSE34 se realiza un análisis prospectivo en un grupo de 74 pacientes con infarto cerebral agudo, tratados con rTPA intravenoso entre 3 y 6 horas después del comienzo de la sintomatología. Se analizan los datos de los estudios de RM, obtenidas inmediatamente antes del tratamiento y de 3 a 6 horas después de éste, comparándolas con la evolución clínica y respuesta al tratamiento de los pacientes. Los resultados obtenidos confirman que los pacientes en los que existe un mismatch perfusión/difusión y tienen una reperfusión precoz, tienen una evolución clínica significativamente mejor que los pacientes que no tienen mismatch. Dentro de este grupo con mismatch distinguen dos subgrupos en función de la respuesta al tratamiento; uno con el denominado target mismatch profile, en los que existe una gran desproporción entre la imagen en difusión y en perfusión, y el volumen de tejido cerebral afectado en difusión es moderado (≥10 ml pero <100 ml ). Estos pacientes son los que presentan una respuesta más favorable al tratamiento. El otro subgrupo es el que denominan malignant profile, en el que el mismatch es pequeño y el volumen de tejido afectado en el estudio de difusión es superior a 100 ml; éstos son los pacientes en los que hay una mayor tasa hemorragia intracraneal tras la reperfusión precoz con tratamiento y, por tanto, no se considerarían candidatos.
El ensayo EPITHET35, de muy reciente publicación, es un ensayo en fase 2 en el que 101 pacientes con ictus isquémico de 3 a 6 horas son randomizados para recibir rTPA o placebo; a todos ellos se les realiza una RM multimodal antes del tratamiento y de 3 a 5 días después, no siendo vinculante el hallazgo de la RM con el tipo de tratamiento. Los resultados muestran que la reperfusión ocurre más en los pacientes tratados, y en los pacientes con mismatch (entendido como volumen PWI: DWI >1,2 y volumen PWI–DWI ≥10 mL) el tratamiento con rTPA está asociado con menor crecimiento del infarto y mejor evolución clínica. Únicamente 11 pacientes no tuvieron mismatch, por lo que los autores afirman que en este grupo los resultados no son concluyentes. Estos prometedores resultados dan pie a un ensayo en fase 3 que permitirá concluir con más nitidez el valor predictivo de la respuesta al tratamiento de la imagen multimodal, y a las posibilidades del rTPA en este rango temporal de 3 a 6 horas.
La localización topográfica del ictus isquémico puede modificar la ventana terapéutica para el tratamiento y puede ser mayor para los ictus de circulación porterior o vértebro-basilar, que representan aproximadamente una quinta parte. Las oclusiones de la arteria basilar, de muy mal pronóstico, clásicamente eran tratadas con abordaje intraarterial; sin embargo, hay estudios que muestran un beneficio de la trombolisis intravenosa, tanto en las tres primeras horas como en las siguientes. Lindsberg y col concluyen en sus trabajos36,37 que en estos casos el rTPA iv tiene unas cifras de supervivencia, recanalización y evolución funcional independiente comparables con los resultados de técnicas endovasculares. Las ventanas terapéuticas utilizadas por este grupo son de hasta 24-48 horas sugiriendo que, además de que son pacientes cuyo pronóstico ominoso sin tratamiento fuerza a los profesionales a individualizar sus decisiones, hay datos para hipotetizar que la resistencia del tejido a la oclusión de estas arterias y al tiempo en penumbra isquémica puede ser mayor38, probablemente debido a los patrones de circulación colateral que se desarrollan.
Tratamientos combinados
Combinación con fármacos antitrombóticos. En el protocolo actual, después de la trombolisis iv y durante 24 horas no se permite administrar tratamientos antitrombóticos por el riesgo de transformación hemorrágica. Es más que probable que esta limitación pueda ser modificada habida cuenta de la vida media corta del fármaco, alrededor de las 2 horas. Esta medida interesa sobre todo en:
– Recanalizaciones parciales o incompletas.
– Pacientes con alto riesgo de reoclusión arterial, como las lesiones en tándem carótida interna-cerebral media
– Pacientes con alto riesgo de re-embolismo precoz, como los trombos intracardíacos.
Se ha realizado algún estudio con inhibidores de la glicoproteína IIbIIIa, como el abciximab (estudio AbESTT II39), con mayores tasas de recanalización arterial pero también de transformación hemorrágica, con un balance global riego/beneficio negativo. Otros estudios de series cortas de pacientes presentan prometedores resultados con el tirofiban40, que deberán ser contrastados en ensayos clínicos. Otros están ya en marcha con el eptifibatide, el CLEAR y el ROSIE-2. En la actualidad la comisión de expertos multidisciplinares, avalada por la academia americana de Neurología, asigna una recomendación clase III con nivel de evidencia B a los inhibidores IIb-IIIa por vía iv en el ictus agudo, no recomendado fuera de ensayos clínicos41,42.
Otro fármaco ensayado es un inhibidor de la trombina, el argatroban, que inhibe la formación de fibrina en el trombo y reduce la agregación plaquetar en la microcirculación. El estudio TARTS investiga la combinación de este fármaco con rTPA en una serie de pacientes con oclusión de la arteria cerebral media documentada por DTC; tras unos resultados preliminares positivos43, se encuentra en fase II.
Sonotrombolisis y microburbujas
La capacidad de los ultrasonidos para potenciar la trombolisis ha sido demostrada en estudios experimentales y clínicos. Los ultrasonidos incrementan el transporte de rTPA al interior del trombo, promueven un cambio conformacional de la fibrina que facilita la penetración del fármaco y potencian su afinidad por la fibrina. El estudio CLOTBUST 44 demostró que la combinación de rTPA con la administración conjunta durante dos horas de ultrasonidos a 2 MHz (frecuencia habitual de los aparatos de Doppler disponibles para diagnóstico) es segura e incrementa de forma significativa las tasas de recanalización arterial y de recuperación clínica precoz.
Molina y col45 observaron que la frecuencia y rapidez de recanalización de la arteria cerebral media se incrementaba con el uso concomitante de ultrasonidos y la administración de 3 dosis de un contraste usado como potenciador de señal, compuesto de microburbujas fijadas en galactosa (Levovist®), durante el período de infusión del rt-PA en comparación con lo observado en pacientes tratados previamente con y sin ultrasonidos en el estudio CLOTBUST. El Sonovue®, otro potenciador de señal es tan eficaz y seguro como el Levovist. El efecto adicional de las microburbujas podría intensificar el efecto potenciador de los ultrasonidos sobre la trombolisis. La seguridad y eficacia de este procedimiento debe ser analizada en un estudio de fase II, actualmente en marcha.
Combinación con trombolisis intraarterial y reperfusión endovascular mecánica
Esta estrategia permitiría iniciar el tratamiento del ictus con medicación endovenosa cuanto antes, y proseguir con el abordaje intraarterial (ia) en caso de falta de respuesta y persistencia de oclusión. El estudio IMS46 (Interventional Management of Stroke) fases 1 y 2 analizó la seguridad y eficacia de la combinación de una dosis de rTPA iv a menor dosis (dosis puente, 0,6 mg/Kg) seguido de una dosis ia dividida en bolos con un total máximo de 22 mg, en las 3 primeras horas del ictus isquémico. Las tasas de transformación hemorrágica fueron de 9,9%, no significativamente mayores que las descritas para el rTPA iv en el estudio NINDS, y el porcentaje de pacientes con mejor grado funcional a los tres meses mayor que los pacientes tratados del NINDS. Está en marcha un ensayo en fase 3 (IMS 3) para comparar la dosis puente o la dosis estándar (0,9 mg/kg) del rTPA iv previo con el abordaje ia comenzado en las 5 primeras horas, bien administrando rTPA con un catéter de ultrasonidos bien con una técnica de eliminación mecánica del trombo.
Nuevos fármacos trombolíticos en estudio
El ensayo en fase 3 DIAS 247, 48 ha analizado la eficacia y seguridad del desmoteplase, activador del plasminógeno con actividad catalítica dependiente de fibrina y administrado por vía venosa, en dos dosis diferentes, en 186 pacientes con ictus isquémico en una ventana de 3 a 9 horas tras los síntomas, seleccionados por RM multimodal o TC- perfusión con mismatch >20%. A pesar de los prometedores resultados de los anteriores ensayos en fase 2 (DIAS, DEDAS), ha sido interrumpido al observarse una tendencia al incremento de la mortalidad en el brazo del desmoteplase a dosis de 125 ug/kg. El exceso de mortalidad en este grupo ocurrió tarde en el tiempo respecto al tratamiento y fue predominantemente de causa no neurológica. Las razones de este resultado permanecen inaclaradas; podría ser relacionado con el tratamiento en sí, pero también atribuible al modo de selección de los pacientes, la baja potencia estadística, o a una significativa mala suerte.
Otro posible trombolítico utilizable por vía venosa es el tenecteplase (TNK), trombolítico resultante de la modificación por ingeniería genética de la molécula de rTPA ampliamente usado en infartos de miocardio, con vida media más larga, mayor afinidad por la fibrina y menores tasas de hemorragia, y probado en un ensayo en fase 2 en ictus isquémico, con resultados prometedores49.
Otro estudio en marcha, el ROSIE, analizará el tratamiento con reteplase iv combinado con abciximab iv en las primeras 24 horas de un ictus isquémico no grave con evidencia de oclusión arterial y déficit de perfusión documentadas.
Otros trombolíticos, como el anistreplase, etc. no han sido probados suficientemente.
Trombolisis intraarterial y técnicas de reperfusión endovascular mecánica
Como hemos visto, el rTPA es menos efectivo en el tratamiento de oclusiones proximales y en el caso de trombos de origen ateromatoso, con unas tasas de recanalización globales menores a las deseadas en el caso especialmente de oclusiones proximales. Esto unido a los estrictos criterios de exclusión del tratamiento con rTPA iv hacen que el abordaje endovascular se convierta en una esperanzadora alternativa: en efecto, teóricamente podríamos administrar una menor dosis de trombolítico de forma local intraarterial (ia) optimizando su efecto y minimizando sus potenciales efectos sistémicos50.
El ensayo en fase 3 PROACT 251 estudió la seguridad y eficacia de la infusión ia de pro-urokinasa durante 2 horas vs placebo en ictus isquémico por oclusión de la arteria cerebral media en las primeras 6 horas. Las tasas de recanalización en el grupo tratado fueron del 66%, y las de hemorragia intracraneal sintomática del 10%. Los resultados de escalas funcionales a los tres meses fueron superponibles a los del NINDS. El tiempo medio hasta el tratamiento fue de 5 1/2 horas, hecho que podría haber subestimado su eficacia. Otro ensayo con urokinasa ia es el MELT52 realizado en Japón antes de obtener en ese país la aprobación para el uso del rTPA iv en el 2005, en este estudio la ventana terapéutica también fue de 6 horas, con bolos de urokinasa ia hasta la disolución del trombo, y con la posibilidad de la disrupción mecánica del trombo con el microcatéter. La tasa de recanalización fue del 74%, y la de hemorragia intracraneal sintomática del 9%.
Sin embargo, la recanalización en ambos estudios fue completa en una minoría de los casos (5% en el MELT, 18% en PROACT 2); esto confirma que la trombolisis ia por sí sola no es suficiente y son necesarias terapias coadyuvantes.
Los dispositivos diseñados para la extracción y disrupción mecánica de trombos en las coronarias están siendo modificados y probados en la circulación intracraneal. Así, los estudios MERCI y multi-MERCI53,54, realizados en pacientes fuera de ventana o que no cumplían criterios de selección para rTPA iv, mostraron que estas terapias conseguían unas tasas de recanalización más elevadas, y de hemorragia en torno al 8-9%. Otros muchos están siendo diseñados y presentados, como también la angioplastia y la implantación de stents.
La selección de candidatos para estas terapias más allá de las 3 primeras horas también podría basarse en las técnicas de imagen multimodal. Se encuentra en marcha el ensayo MR Rescue, que compara el dispositivo MERCI con el tratamiento estándar en pacientes no candidatos a rTPA en las primeras 8 horas, y realiza RM previa a todos ellos.
En todas esta terapias es indispensable el diagnóstico previo de la oclusión arterial a tratar, por método no invasivo ( Doppler, angioRM/angioTC) o en la propia angiografía.
Hoy por hoy, la comisión de expertos multidisciplinares avalada por la academia americana de Neurología y publicada en mayo de 200742 asigna las siguientes recomendaciones:
Clase I:
– «la trombolisis intraarterial es una opción de tratamiento para pacientes seleccionados con < 6 horas de evolución y oclusiones de la arteria cerebral media (ACM ) que no son candidatos al rTPA iv». Nivel de evidencia B.
– «este tratamiento exige la atención en un centro con posibilidades de acceso inmediato a una angiografía cerebral y con neurointervencionistas cualificados». Nivel de evidencia C.
Clase II:
– «la trombolisis ia es una opción razonable en pacientes con contraindicaciones al rTPA iv, como las intervenciones quirúrgicas recientes». Clase IIa, Nivel de evidencia C.
– «aunque el dispositivo MERCI es una intervención razonable para la extracción del trombo intraarterial en pacientes seleccionados cuidadosamente, la comisión reconoce que su utilidad en mejorar la evolución clínica a más largo plazo no está aclarada». Clase IIb, Nivel de evidencia B.
– «la utilidad de otros dispositivos de reperfusión mecánica no está establecida y sólo deberían utilizarse bajo ensayos clínicos». Clase IIb, nivel de evidencia C.
Clase III:
– «la disponibilidad de la trombolisis ia nunca debería excluir de la trombolisis iv a los pacientes candidatos».
En la figura 4 se propone un esquema de tratamiento y árbol de decisión terapéutica a la luz de lo revisado. Indudablemente, los tratamientos de reperfusión suponen un reto y una exigencia en cuanto a infraestructuras, entrenamiento y cualificación del personal médico. Sin embargo, también es un hecho que la patología cerebrovascular va en aumento y ya constituye la primera causa de muerte en mujeres y la segunda en varones, con la consiguiente repercusión socioeconómica y en la sanidad. Apostar por ellos y ofertar lo mejor a estos pacientes constituye ya hoy y lo será cada vez más, una obligación profesional, ética y social.
Bibliografía
1. Castillo J, Álvarez-Sabin J, Dávalos A, Díez-Tejedor E, Lizasoain I, Martínez-Vila E et al. Consensus review. Pharmacological neuroprotection in cerebral ischemia: is it still a therapeutic option? Neurologia 2003; 18: 368-384. [ Links ]
2. The National Institute of Neurological Disorders and rt-PA Stroke Study Group. Tissue plasminogen activator for acute ischemic stroke. N Engl J Med 1995; 333: 1581-1587. [ Links ]
3. Wahlgren N, Ahmed N, Dávalos A, Ford GA, Grond M, Hacke W et al. Thrombolysis with alteplase for acute ischaemic stroke in the Safe Implementation of Thrombolysis in Stroke-Monitoring Study (SITS-MOST): an observational study. Lancet 2007: 369; 275-282. [ Links ]
4. Saposnik G, Young B , Silver B, Di Legge S, Webster F, Beletsky V et al. Lack of improvement in patients with acute stroke after treatment with thrombolytic therapy: predictors and association with outcome. JAMA 2004; 292: 1839-1844. [ Links ]
5. Kent DM, Selker HP, Ruthazer R, Bluhmki E, and Hacke W. The stroke-thrombolytic predictive instrument: a predictive instrument for intravenous thrombolysis in acute ischemic stroke. Stroke 2006; 37: 2957-2962. [ Links ]
6. Trouillas P, von Kummer R. Classification and pathogenesis of cerebral hemorrhages after thrombolysis in ischemic stroke. Stroke 2006; 37: 556- 561. [ Links ]
7. Montaner J, Molina CA, Monasterio J, Abilleira S, Arenillas JF, Ribó M et al. Matrix metalloproteinase 9 pretreatment level predicts intracranial hemorrhagic complications after thrombolysis in human stroke. Circulation 2003; 107: 598-603. [ Links ]
8. Castellanos M, Sobrino T, Millan M, Garcia M, Arenillas JF, Nombela F et al. Serum cellular fibronectin and matrix metalloproteinase-9 as screening biomarkers for the prediction of parenchymal hematoma after thrombolytic therapy in acute ischemic stroke: a multicenter confirmatory study. Stroke 2007; 38: 1855- 1859. [ Links ]
9. Christou I, Alexandrov AV, Burgin WC et al. Timing of recanalization after tissue plasminogen activator therapy determined by transcranial Doppler correlates with clinical recovery from ischemic stroke. Stroke 2000; 31: 1812-1816. [ Links ]
10. Wunderlich MT, Goertler M, Postert T, Schmitt E, Seidel G, Gahn G et al for the duplex sonography in acute stroke (DIAS) study group and the competence network stroke. Recanalization after intravenous thrombolysis: does a recanalization time window exist? Neurology 2007; 68: 1364-1368. [ Links ]
11. Alexandrov AV, Burgin S, Demchuk AM, El-Mitawalli A, Grotta JC. Speed of intracranial clot lysis with intravenous tissue plasminogen activator therapy. Sonographic classification and short-term improvement. Circulation 2001; 103: 2897-2902. [ Links ]
12. Ribo M, Alvarez-Sabín J, Montaner J, Romero F, Delgado P, Rubiera M et al. Temporal profile of recanalization after intravenous tissue plasminogen activator: selecting patients for rescue reperfusion techniques. Stroke 2006; 37: 1000-1004. [ Links ]
13. Alexandrov AV, Grotta JC. Arterial reocclusion in stroke patients treated with intravenous tissue plasminogen activator. Neurology 2002; 59: 862-867. [ Links ]
14. Rubiera M, Alvarez-Sabín J, Ribo M, Montaner J, Santamarina E, Arenillas JF et al. Predictors of early arterial reocclusion after tissue plasminogen activator-induced recanalization in acute ischemic stroke. Stroke 2005; 36: 1452-1456. [ Links ]
15. Barber PA, Zhang J, Demchuk AM, Hill MD, Buchan AM. Why are stroke patients excluded from TPA therapy?: an analysis of patient eligibility. Neurology 2001; 56: 1015-1020. [ Links ]
16. Chalela JA, Kidwell CS, Nentwich LM, Luby M, Butman JA, Demchuk AM et al. Magnetic resonance imaging and computed tomography in emergency assesment of patientes with suspected acute stroke: a prospective comparison. Lancet 2007; 369: 293-298. [ Links ]
17. Schellinger PD, Thomalla G, Fiehler J, Kormann M, Molina CA, Neumann-Haefelin T, Ribo M et al. MRI-based and CT- based thrombolytic therapy in acute stroke within and beyond established time windows: an analysis of 1210 patients. Stroke 2007; 38: 2640-2645. [ Links ]
18. Lansberg MG, Thijs VN, Bammer R, Kemp S, Wijman CA, Marks MP et al. DEFUSE Investigators. Risk factors of symptomatic intracerebral hemorrhage after tPA therapy for acute stroke. Stroke 2007; 38: 2275-2278. [ Links ]
19. Wintenmark M, Meuli R, Browaeys P, Reichhart M, Bogousslavsky J, Schnyder P et al. Comparison of CT perfusion and angiography and MRI in selecting stroke patientes for acute treatment. Neurology 2007; 68: 694-697. [ Links ]
20. Kane I, Sandercock P, Wardlaw J. Magnetic resonance perfusion diffusion mismatch and thrombolysis in acute stroke: a systematic review of the evidence to date. J Neurol Neurosurg Psychiatry 2007; 78: 485-490 [ Links ]
21. Fiehler J, Albers GW, Boulanger JM, Derex L, Gass A, Hjort N, for the MR STROKE group. Bleeding risk analysis in stroke imaging before thrombolysis ( BRASIL): pooled analysis of T2*-weighted magnetic resonance imaging data from 570 patients. Stroke 2007; 38: 2738- 2744. [ Links ]
22. Demchuk AM, Christou I, Wein TH, Felberg RA, Malkoff M, Grotta JC, Alexandrov AV. Specific transcranial Doppler flow findings related to the presence and site of arterial occlusion. Stroke 2000; 31: 140-146. [ Links ]
23. Burgin WS, Malkoff M, Felberg RA, Demchuk AM, Christou I, Grotta JC, Alexandrov AV. Transcranial Doppler ultrasound criteria for recanalization after thrombolysis for middle cerebral artery stroke. Stroke 2000; 31: 1128-1132. [ Links ]
24. Alexandrov AV. Thrombolysis in brain ischemia (TIBI) transcranial Doppler flow grades predict clinical severity, early recovery, and mortality in patients treated with intravenous tissue plasminogen activator. Stroke 2001; 32: 89-93. [ Links ]
25. Chernyshev OY, Garami Z, Calleja S, Song J, Campbell MS, Noser EA et al. Yield and accuracy of urgent combined carotid/transcranial ultrasound testing in acute cerebral ischemia. Stroke 2005; 36: 32-37. [ Links ]
26. De Keyser J, Gdovinová Z, Uyttenboogaart M, Vroomen PC, Luijckx GJ. Intravenous alteplase for stroke. Beyond the guidelines and in particular clinical situations. Stroke 2007; 38: 2612-2618. [ Links ]
27. Aleu A, Mellado P, Lichy C, Köhrmann M, and Schellinger PD. Hemorrhagic complications after off-label thrombolysis for ischemic stroke. Stroke 2007; 38: 417- 422. [ Links ]
28. Engelter ST, Bonati LH, Lyrer PA. Intravenous thrombolysis in stroke patientes 80 versus <80 years of age-a systematic review across cohort studies. Age Ageing 2006; 35: 572-580. [ Links ]
29. Nedeltchev K, Schwegler B, Haefeli T, Brekenfeld C, Gralla J, Fischer U et al. Outcome of stroke with mild or rapidly improving symptoms. Stroke 2007; 38: 2531- 2535. [ Links ]
30. Smith EE, Abdullah AR, Petkovska I, Rosenthal E, Koroshetz WJ, Schwamm LH. Poor outcomes in patients who do not receive intravenous tissue plasminogen activator because of mild or improving ischemic stroke. Stroke 2005; 36: 2497-2499. [ Links ]
31. Rajajee V, Kidwell C, Starkman S, Ovbiagele B, Alger JR, Villablanca P et al. Early MRI and outcomes of untreated patients with mild or improving ischemic stroke. Neurology 2006; 67: 980-984. [ Links ]
32. Alexandrov A, Felberg R, Demchuk AM, Christou I, Burgin WS, Malkoff M et al. Deterioration following spontaneous improvement: sonographic findings in patients with acutely resolving symptoms of cerebral ischemia. Stroke 2000; 31: 915-919. [ Links ]
33. Baumann C, Baumgartner R, Gandjour J, von Büdingen HC, Siegel A, Georgiadis D. Good outcomes in ischemic stroke patients treated with intravenous thrombolysis despite regressing neurological symptoms. Stroke 2006; 37: 1332-1333. [ Links ]
34. Albers GW, Thijs VN, Wechsler L, Kemp S, Schlaug G, Skalabrin E et al. DEFUSE Investigators. Magnetic resonance imaging profiles predict clinical response to early reperfusion: the Diffusion and perfusion imaging Evaluation For Understanding Stroke Evolution (DEFUSE) study. Ann Neurol 2006; 60: 508-517 [ Links ]
35. Davis S, Donnan G, Parsons M, Levi C, Butcher K, Peeters A et al. For the EPITHET investigators. Effects of alteplase beyond 3 h after stroke in the Echoplanar Imaging Thrombolytic Evaluation Trial (EPITHET): a placebo-controlled randomised trial. Lancet Neurol. Publicado Online 22 febrero, 2008 DOI:10.1016/S1474- 4422(08)70044-9. [ Links ]
36. Lindsberg PJ, Soinne L, Tatlisumak T, Roine RO, Kallela M, Happola O et al. Long-term outcome after intravenous thrombolysis of basilar artery occlusion. JAMA 2004; 292: 1862-1866. [ Links ]
37. Lindsberg PJ, Mattle HP. Therapy of basilar artery occlusion: a systematic analysis comparing intra-arterial and intravenous thrombolysis. Stroke 2006; 37: 922-928. [ Links ]
38. Ostrem J, Saver J, Alger J, Starkman S, Leary M, Duckwiler G et al. Acute basilar artery occlusion: diffusion-perfusion MRI characterization of tissue salvage in patients receiving intra-arterial stroke therapies. Stroke 2004; 35: e30-e34 [ Links ]
39. Abestt investigators. Effects of abciximab for acute ischemic stroke: final results of abciximab in emergent stroke treatment trial (Abestt). Stroke 2003; 34: 253. [ Links ]
40. Straub S, Junghans U, Jovanovic V, Wittsack HJ, Seitz R, Siebler M. Systemic thrombolysis with recombinant tissue plasminogen activator and tirofiban in acute middle cerebral artery occlusion. Stroke 2004; 35: 705-709. [ Links ]
41. Ciccone A, Abraha I, Santilli I. Glycoprotein IIb-IIIa inhibitors for acute ischaemic stroke. Cochrane Database of Systematic Reviews 2006, Issue 4. Art. No.: CD005208. [ Links ]
42. Adams H, del Zoppo G, Alberts M, Bhatt DL, Brass L, Furlan A et al. Guidelines for the early management of adults with ischemic stroke. A guideline from the American Heart Association/ American Stroke Association Stroke Council, Clinical Cardiology Council, Cardiovascular Radiology and Intervention Council, and the Atherosclerotic Peripheral Vascular Disease and Quality of Care Outcomes in Research Interdisciplinary Working Groups. The American Academy of Neurology affirms the value of this guideline as an educational tool for neurologists. Stroke 2007; 38: 1655-1711. [ Links ]
43. Sugg R, Pary JK, Uchino K, Baraniuk S, Shaltoni HM, Gonzales NR. Argatroban tpa stroke study; study design and results in the first treated cohort. Arch Neurol 2006; 63: 1057-1062. [ Links ]
44. Alexandrov AV, Molina CA, Grotta JC, Garami Z, Ford SR, Alvarez-Sabin J et al. CLOTBUST Investigators. Ultrasound-enhanced systemic thrombolysis for acute ischemic stroke. N Engl J Med 2004; 351: 2170-2178. [ Links ]
45. Molina CA, Ribo M, Rubiera M, Montaner J, Santamarina E, Delgado-Mederos R et al. Microbubble administration accelerates clot lysis during continuous 2-mHz ultrasound monitoring in stroke patients treated with intravenous tissue plasminogen activator. Stroke 2006; 37: 425-429. [ Links ]
46. Interventional Management of Stroke Investigators. The Interventional Management of Stroke (IMS) II Study. Stroke 2007; 38: 2127-2135. [ Links ]
47. Mayer S, Schwab S. Advances in Critical Care and Emergency Medicine 2007. Stroke 2008; 39: 261-263. [ Links ]
48. Quinn T, Lees K. Advances in Emerging Therapies 2007. Stroke 2008; 39: 255-257. [ Links ]
49. Haley EC Jr, Lyden PD, Johnston KC, Hemmen TM. TNK in Stroke Investigators. A pilot dose-escalation safety study of tenecteplase in acute ischemic stroke. Stroke 2005; 36: 607-612. [ Links ]
50. Janjua N, Brisman JL. Endovascular treatment of acute ischaemic stroke. Lancet Neurol 2007; 6: 1086-1093. [ Links ]
51. Furlan A, Higashida R, Wechsler L et al. Intra-arterial prourokinase for acute ischemic stroke. The PROACT II study: a randomized controlled trial. Prolyse in acute cerebral thromboembolism. JAMA 1999; 282: 2003-2011. [ Links ]
52. Ogawa A, Mori E, Minematsu K, Taki W, Takahashi A, Nemoto S et al for The MELT Japan Study Group. Randomized trial of intraarterial infusion of urokinase within 6 hours of middle cerebral artery stroke: the Middle cerebral artery Embolism Local fibrinolytic intervention Trial (MELT) Japan. Stroke 2007; 38: 2633-2639. [ Links ]
53. Smith WS, Sung G, Starkman S et al. Safety and efficacy of mechanical embolectomy in acute ischemic stroke: results of the MERCI trial. Stroke 2005; 36: 1432-1438. [ Links ]
54. Smith WS. Safety of mechanical thrombectomy and intravenous tissue plasminogen activator in acute ischemic stroke. Results of the multi mechanical embolus removal in cerebral ischemia (MERCI) trial, part I. AJNR Am J Neuroradiol 2006; 27: 1177-1182. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
María Herrera Isasi
Servicio de Neurología
Hospital de Navarra
C/ Irunlarrea, 3
31008 Pamplona
Tfno. 848 422292
Fax. 848 422303
E-mail: isasima@hotmail.com