Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Anales del Sistema Sanitario de Navarra
versión impresa ISSN 1137-6627
Anales Sis San Navarra vol.31 supl.2 Pamplona 2008
Talla baja y enfermedades raras
Low height and rare diseases
M.J. Chueca, S. Berrade, M. Oyarzábal
Unidad de Endocrinología Pediátrica. Hospital Virgen del Camino. Pamplona.
Dirección para correspondencia
RESUMEN
La baja talla constituye el primer motivo de consulta en endocrinología pediátrica. En un alto porcentaje su etiología es clara y obedece fundamentalmente a variantes de normalidad. Sin embargo, en aproximadamente un 20% esta baja talla es patológica y obliga a estudios exhaustivos.
La asociación de enfermedades raras (ER) con talla baja es altamente frecuente. En este trabajo repasamos las etiologías de la baja talla en enfermedades raras, describiendo:
– las formas genéticas de la hormona de crecimiento (GH) bien sean aisladas o asociadas a malformaciones de la línea media u otras.
– aquellas de gran importancia por su repercusión clínica como el Síndrome de Turner, Síndrome de Noonan y el Síndrome de Willi-Prader.
– Las frecuentes displasias óseas, con alteración genética en algunos casos para el gen SHOX, situado en el brazo corto del cromosoma Xp.
La importancia de estos diagnósticos radica en la posibilidad de hacer un tratamiento precoz y eficaz, en algunos de ellos, con GH.
En conclusión, el diagnóstico de enfermedades raras con baja talla es un reto actual y habitual en endocrinología pediátrica por los grandes avances de la genética molecular y la posibilidad de tratamiento en algunas de ellas. Implica siempre un abordaje multidisciplinario por la asociación frecuente de patología que presenta y a su vez, ofrece la posibilidad de realizar el oportuno consejo genético.
Palabras clave. Baja talla. Enfermedad rara.
ABSTRACT
Low stature is the main reason of consultation in paediatric endocrinology. In a high percentage of cases, its etiology is clear and fundamentally answers to variants of normality. However, in approximately 20% of cases low stature is pathological and requires exhaustive studies.
The association of rare diseases (RD) with low height is very frequent. In this article we review the etiology of low height, describing:
– The genetic forms of the growth hormone (GH), whether isolated or associated with malformations of the average line or others.
– Those which are of great importance due to their clinical repercussion, such as Turners Syndrome, Noonans Syndrome and Willi-Praders Syndrome.
– The frequent osseous dysplasias, in some cases with genetic alterations of the SHOX gene, situated in the short arm of the Xp chromosome.
The importance of these diagnoses lies in the possibility of carrying out early and efficient treatment, in some of them, with GH.
In conclusion, the diagnosis of rare diseases with low height is a current and normal challenge in paediatric endocrinology due to the great advances in molecular genetics and the possibility of treatment in some of them. It always involves a multidisciplinary approach due to the frequent association of pathology it presents, and, in its turn, it offers the possibility of carrying out timely genetic counselling.
Key words. Low height. Rare disease.
Introducción
Los fenómenos de crecimiento (cuantitativo) y maduración (cualitativo) son los procesos fisiológicos que más caracterizan a la infancia, y se traducen en la modificación progresiva, desde el nacimiento hasta la edad adulta, de las medidas y morfología corporales.
El crecimiento se considera un buen indicador del estado de salud del individuo (y de la población en general), y se evalúa principalmente mediante tres parámetros: peso, talla y velocidad de crecimiento.
Clásicamente se distinguen 3 períodos de crecimiento bien definidos1:
– Neonatal. Caracterizado por un crecimiento rápido exponencial hasta los 2-3 años de edad, e influenciado principalmente por factores nutricionales y hormonas tiroideas.
– Infantil. Desde la segunda infancia hasta la adolescencia, con un progresivo enlentecimiento de la velocidad de crecimiento, dependiente sobre todo del componente genético, de la GH y de los factores de crecimiento (IGF1, BP3) entre otros.
– Puberal. Con un aumento de la velocidad de crecimiento y maduración sexual (estirón puberal), a expensas de las hormonas sexuales (andrógenos y estrógenos) y del incremento de la secreción de hormona y factores de crecimiento (GH, IGF1)2.
Hoy en día, especialmente en los países desarrollados, en los que predomina lo que en la sociedad occidental se denomina como cultura del altismo3 el número de consultas pediátricas por baja talla ha sufrido un claro incremento.
Talla baja
Se habla de talla baja cuando ésta se sitúa por debajo de -2DE para la media de edad y sexo (aproximadamente al percentil 3) y de talla baja extrema cuando se encuentra por debajo de -3DE.
Es importante, además de la talla, evaluar también la velocidad de crecimiento: en general, si es inferior a -1DE de la media (percentil 25), se considera patológico.
Etiología
Teniendo en cuenta, que el crecimiento es un fenómeno biológico muy complejo, determinado genéticamente y modulado por múltiples factores (tanto propios del individuo como ambientales), existe una gran variedad etiológica de trastornos de crecimiento y por consiguiente de talla baja.
Es por ello, que llegar a un diagnóstico certero de la talla baja a veces es extremadamente difícil, pero de gran trascendencia de cara a su pronóstico y sobre todo por la posibilidad de tratamiento adecuado.
En general, el 80% de los niños con talla entre -2DE y -3DE corresponden a una variante normal, influyendo fundamentalmente su componente genético y en cambio, la mayoría de los que están por debajo de -3DE tendrán una baja talla patológica4.
El estudio inicial del niño con baja talla debe incluir una historia clínica exhaustiva, examen físico completo, valoración auxológica y determinación de la maduración ósea. Con ello se consigue establecer un adecuado enfoque diagnóstico en la mayoría de los casos y permite orientar las exploraciones complementarias a realizar.
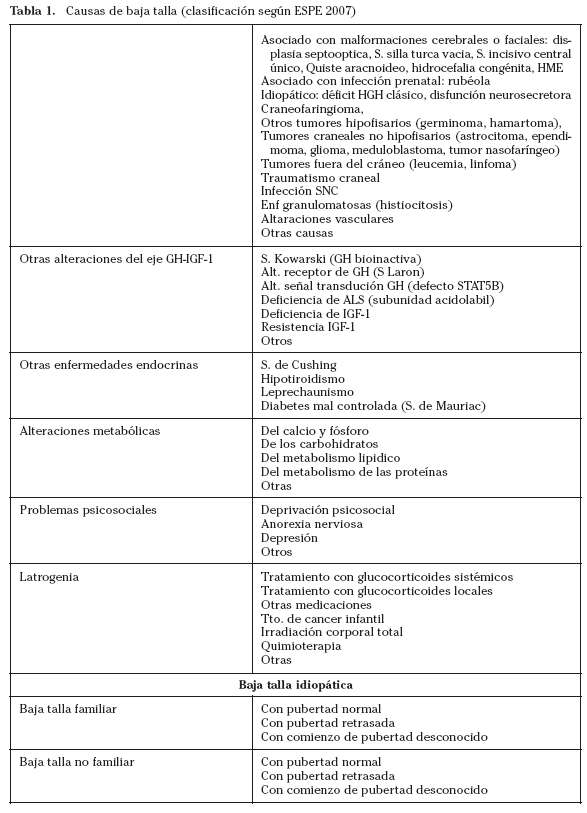
La clasificación de la baja talla según la Sociedad Europea de Endocrinología Pediátrica (ESPE) publicada recientemente se detalla en la tabla 11.
Enfermedades raras que cursan con baja talla
Se considera enfermedad rara la que tiene una incidencia menor de 0,05 % de la población (1 caso por cada 2.000 personas). Según la OMS, se calcula que hoy día existen entre 5.000 y 8.000 enfermedades raras distintas y que hasta en un 80 % de las mismas se puede identificar una causa genética5. La talla baja, de comienzo prenatal o postnatal, es un componente habitual de muchas de estas enfermedades raras.
El escaso crecimiento puede reflejar alteraciones de la acción de la GH todavía no conocidas, o bien defectos a nivel celular. En algunos de estos síndromes podemos encontrar también deficiencia de hormona de crecimiento. Tras la utilización de GH recombinante en la práctica clínica, varios grupos de trabajo han probado su utilización en estos niños, sean deficitarios o no6.
Como causas raras de baja talla se describen las siguientes:
1. Patología de GH
– deficiencia de GH
– resistencia a la GH
2. Síndromes dismórficos
– S. de Turner
– S. de Noonan
– S. Prader Willi
– S. de Silver Russell
3. Otros síndromes genéticos menos frecuentes
– S. de Aarskog
– S. de Cornelia de Lange
– S. Floating-harbor
– S. de Kabuki
– S. de Williams-Beuren
– Anemia de Fanconi
– S. de Rubinstein-Taybi
– Hipoplasia cartílago-pelo
– S. de Klippel-Feil
– Anemia de Blackfan-Diamond
4. Displasias óseas
5. Histiocitosis de celulas de Langherhans y neurofibromatosis
6. Anomalías metabólicas. Diversas anomalías metabólicas como las mucopolisacaridosis, las glucogenosis o la fenilcetonuria cursan con retraso del crecimiento. Estas enfermedades exhiben características clínicas específicas (cara tosca, organomegalia, etc.) que orientan el diagnóstico. El tratamiento debe ser precoz de forma que evitemos los efectos negativos en el crecimiento y, sobre todo, en el desarrollo psicomotor.
7. Otras enfermedades raras menos prevalentes
Patología de GH
El diagnóstico de deficiencia de GH, debido a la secreción pulsátil de esta hormona, es complejo y difícil de establecer, y se ha de basar, además de en la determinación de la misma (GH) y de los factores de crecimiento (IGF1, IGFBP3) tras distintos estímulos farmacológicos, principalmente en los datos clínicos y auxológicos.
La deficiencia de GH puede ser debida a múltiples causas: idiopática u orgánica, congénita o adquirida, aislada o con deficiencia combinada de otras hormonas hipofisarias, familiar o esporádica7.
Aunque las causas genéticas de deficiencia de GH son raras, se ha objetivado que entre un 5 y un 30 % de las formas idiopáticas son de origen familiar, lo que sugiere que la etiología genética pueda ser mayor de lo reportado hasta el momento8.
Deficiencia de GH
A. Causas congénitas
a. Alteraciones genéticas
I. Deficiencia combinada de hormonas hipofisarias: mutaciones de distintos genes de factores de transcripción hipofisarios9: HESX-1, PROP-1, PIT-1/POU1F1, LHX3, LHX4, PITX2 (síndrome de Rieger), FOXL2
I. Deficiencia aislada de GH:
1. Gen y receptor GR.
2. Gen GH1: tipo IA, IB, II, III, GH bioinactiva
b. Malformaciones de la línea media
– Holoprosencefalia
– Displasia septo-óptica (Síndrome de De Dossier)
– Paladar hendido y labio leporino
– Incisivo central único
– Síndrome EEC (ectrodactilia y displasia ectodérmica)
– Síndrome de Aarskog
c. Anomalías hipotalamo-hipofisarias
– Síndrome de Bloom
– Ataxia-telangiectasia
– Síndrome de Lawrence-Moon-Biedl
– Síndrome de Prader-Willi
d. Infecciones prenatales
– Citomegalovirus
– Rubéola
B. Causas adquiridas:
– Procesos expansivos intracraneales
– Infecciones SNC
– Radioterapia intracraneal
– Hipofisisitis autoinmune
– Procesos infiltrativos (histiocitosis, sarcoidosis)
– Psicosocial
Deficiencia aislada de GH
Se describen cuatro grupos:
– DAGH IA: se caracteriza por un fenotipo severo de déficit de HGH (hipocrecimiento muy marcado desde los primeros meses de vida, hipoglucemias en período neonatal, y facies característica de muñeco con frente abombada y puente nasal hundido), con valores indetectables de hormona de crecimiento. Tiene una herencia autonómica recesiva y se han descrito distintas deleciones y mutaciones del gen que codifica para la GH hipofisaria (GH1). Inicialmente presentan buena respuesta al tratamiento con GH exógena, pero con el tiempo, la mayoría desarrollan anticuerpos anti-GH que bloquean la efectividad de la misma.
– DAGH IB: es la forma más frecuente de déficit de GH, de transmisión también autonómica recesiva, con clínica menos intensa que el tipo IA y valores disminuidos pero detectables de hormona de crecimiento. Presentan buena respuesta al tratamiento con GH y no generan anticuerpos anti-GH.
– DAGH II: tiene características similares a DAGH IB pero el patrón de herencia es autonómico dominante.
– DAGH III: enfermedad recesiva ligada a cromosoma X que asocia deficiencia de HGH e hipogammaglobulinemia.
Resistencia a la GH
GH bioinactiva (Síndrome de Kowarski)
Cursa con talla baja extrema, niveles de GH normales y de IGF-1 disminuidos, con buena respuesta a la administración de GH exógena. Se han identificado mutaciones en el gen de la GH1 que origina una hormona con activitadad biológica reducida11.
Insensibilidad a la GH (enanismo o Síndrome de Laron)
Enfermedad autonómica recesiva debida a mutaciones en homocigosis en el gen del receptor GH, que cursa con talla baja extrema, niveles elevados de GH y muy bajos de IGF-1.
Fue descrito por Laron12 en 1966 en una familia judía, y en la actualidad hay descritos cientos de casos, la mayoría procedentes del área mediterránea, de países de Oriente Medio y ecuatorianos de origen judío. Se ha postulado que alteraciones en heterocigosis del gen del receptor de GH podrían ser responsables de algunos casos de baja talla idiopática13.
Clínicamente, además de la severa deficiencia estatural, los pacientes presentan unos rasgos fenotípicos característicos, como frente prominente con puente nasal hundido (en silla de montar), mandíbula y mentón pequeños, pelo ralo, retraso en la erupción dental, protusión ocular, acromicria e hiperlordosis. Generalmente presentan genitales hipoplásicos con retraso de la pubertad, voz chillona (laringe pequeña) y frecuentes episodios de hipoglucemia en período neonatal. En los últimos años se ha ensayado tratamiento con IGF-1 recombinante con resultados alentadores.
Alteraciones post-receptor de GH
Fue descrito por primera vez en 1993, en una familia con clínica similar al síndrome de Laron, en la que el test de estimulación de IGF1 no produjo respuesta pero sí un incremento de IGFBP3, que demostraba que la vía de señalización para IGFBP3 no estaba afectada14.
Anomalías en la síntesis y acción de IGF-1
Se describió en un varón con clínica similar al síndrome de Laron, al demostrar la existencia de una deleción de exones 4 y 5 del gen de la IGF115. Según una revisión reciente, la talla baja de los pigmeos africanos se debería a una deficiencia de IGF1 secundaria a una disminución de los receptores de GH16.
Síndromes dismórficos
Síndrome de Turner (ST)
El ST es una enfermedad causada por la ausencia parcial o total de uno de los dos cromosomas X, en algunas o todas las células del organismo.
La primera descripción clínica se atribuye a Ullrich17 (1930) en una niña de 8 años y la completó Turner18 (1938) con una casuística de 7 mujeres con talla baja e infantilismo sexual. En 1959, gracias a los avances de la citogenética, Ford y col19 descubrieron la alteración cromosómica causante del síndrome.
Se estima que la incidencia del ST está alrededor de 1:2.000 a 1:2.500 de niñas recién nacidas vivas, aunque hay que tener en cuenta que sólo un escaso porcentaje de los fetos con monosomía 45,X llega a término, y que dicha alteración cromosómica sería la responsable del 10-20 % de todos los abortos espontáneos.
Las alteraciones cromosómicas20 son variadas:
– aneuploidía 45, X (ausencia completa de un cromosoma X): la más frecuente (60%).
– alteraciones estructurales del cromosoma X (20%): delecciones mayores (46, XXp-; 46,XXq-); isocromosomas (46,X,i); cromosoma X en anillo (46,X,r); delecciones menores.
– mosaicismos (20%): presencia de dos o más líneas celulares con alteraciones estructurales o numéricas de un cromosoma X al menos en una de ellas (45,X/46,XX).
Las manifestaciones clínicas21 son muy heterogéneas, siendo las más características la baja talla y el hipogonadismo por disgenesia gonadal.
– Baja talla (100%): el crecimiento es patológico en la etapa fetal (longitud al nacimiento 2,5-3 cm menos de la media), infantil (menor velocidad de crecimiento) y puberal (menor estirón puberal). La talla final alcanzada es variable dependiendo de la talla media paterna22, pero en general es unos 20 cm inferior a la media, oscilando entre 136-147 cm según distintas series. En 1994, en un estudio multicéntrico realizado en nuestro país en 58 pacientes que no habían recibido tratamiento con GH, la talla media fue de 142,9 ± 5,8 cm23.
– Disgenesia gonadal que conduce a una insuficiencia ovárica en el 90 % de los casos con ausencia de caracteres secundarios, amenorrea e infertilidad. Sin embargo, hay que tener en cuenta que hasta un 10% de las pacientes conservan tejido ovárico suficiente para producir estrógenos e inducir distintos cambios puberales, la mayoría telarquia grado 2 y en casos aislados hasta menarquia (en general con ciclos menstruales irregulares y menopausia precoz).
– Facies característica en esfinge, con escasa mímica y expresión melancólica, ptosis palpebral y hendiduras palpebrales hacia abajo, orejas grandes y de baja implantación, paladar ojival, micrognatia y baja implantación de pelo.
– Alteraciones linfáticas: higroma nucal prenatal que al reabsorberse deja piel redundante en cuello (pterigium colli); en periodo neonatal puede aparecer hasta en un 40 % de los casos edemas en dorso de pies y manos.
– Alteraciones esqueléticas: hábito recio (seudoatlético) con tórax ancho (en coraza), displasia de extremidades (cubitus valgus, acortamiento 4º metacarpiano, deformidad de Madelung, clinodactilia, uñas hipoplásicas) y escoliosis.
– Cardiopatía congénita (30%): predominan los defectos lado izquierdo (válvula aórtica bicúspide y coartación de aorta). También presentan mayor riesgo de aneurisma disecante de aorta.
– Malformaciones renales (30%): riñón en herradura, hipoplasia o agenesia renal.
– Otros: otitis recurrentes y mayor riesgo de sordera, múltiples nevus, alteraciones oculares (estrabismo, miopía), problemas de aprendizaje, enfermedades autoinmunes (tiroiditis, enfermedad celiaca) y obesidad.
Tratamiento
Teniendo en cuenta el amplio abanico de alteraciones que pueden presentar estas niñas, es necesario un abordaje multidisciplinar que incluya distintas subespecialidades de pediatría, como endocrinología, cardiología, oftalmología, ORL y ortopedia.
Se debe iniciar tratamiento con GH de forma precoz (en general a partir de los 3-4 años de vida (cuando se evidencia una pérdida de talla de -2DE) e inducción de la pubertad con estrógenos hacia los 13 años.
Síndrome de Noonan (SN)
Se trata de una enfermedad autonómica dominante con penetrancia variable, que afecta a 1 de cada 2.500 recién nacidos, y se caracteriza por presentar talla baja, dismorfia facial y defectos cardiacos.
Fue descrito por primera vez en 1963 por la cardióloga pediatra JA Noonan24,25, al describir 9 casos de niños que presentaban estenosis valvular pulmonar y una serie de estigmas comunes al fenotipo del síndrome de Turner.
El SN es genéticamente heterogéneo, con mutaciones missense en el gen PTPN11 en el 50% de los casos26. Este gen se localiza en el cromosoma 12q24.1 y codifica la proteína tirosinkinasa SHP-2, especialmente implicada en la valvulogénesis de las válvulas cardiacas. Este gen también se ha relacionado con otras enfermedades como neurofibromatosis tipo 1, síndrome de LEOPARD27 y diferentes tipos de leucemias y tumores sólidos (neuroblastoma)28.
Desde el punto de vista clínico se caracteriza por talla baja armónica (talla adulta en -2DE), cardiopatía congénita (especialmente estenosis pulmonar y miocardiopatía hipertrófica), fenotipo característico: hipertelorismo, fisuras palpebrales antimongoloides, orejas bajas y rotadas, cuello corto con piel redundante (pterigium colli), implantación baja del cabello, deformidades torácicas y vertebrales y cubitus valgus. Otras anomalías descritas son retraso mental leve y retraso puberal con criptorquidia en varones.
Aunque la talla adulta se sitúa en general -2.5DE, actualmente no está indicada la hormona de crecimiento para estos pacientes.
Síndrome de Prader-Willi (SPW)
El SPW es una enfermedad de origen genético descrita en 1956 por Prader, Labarth y Willi29 en pacientes que presentaban obesidad, baja talla y criptorquidia con hipotonía severa en periodo neonatal.
Su prevalencia es de 1 de cada 10.000 a 25.000 RN30, sin diferencia por sexo o raza. Se relaciona con diferentes anomalías genéticas en la región q11-q13 del cromosoma 15, donde se encuentran varios genes sometidos al fenómeno de imprinting, por el cual un gen o grupo de genes sufren un proceso de silenciación de tal manera que el único alelo funcional es el del cromosoma paterno.
En aproximadamente el 70% de los casos existe una deleción en el brazo largo del cromosoma 15 paterno (15q11-q13), en el 20-25 % una disomía uniparental materna, en 5% un defecto de la impronta y en menos del 1 % traslocaciones31.
El riesgo de transmisión de la enfermedad es bajo (< 1%) en los casos de deleción y disomía, pero elevado (hasta el 50%) en el resto, por ello es importante diferenciar bien la alteración causante del síndrome para ofrecer un adecuado consejo genético.
La clínica del SPW es variada con manifestaciones distintas según la edad. Se distinguen 3 fases bien delimitadas:
1. Período fetal, neonatal y lactante
Disminución de los movimientos fetales, con mayor frecuencia de partos distócicos y presentación de nalgas. La talla y peso al nacer son normales. Los recién nacidos presentan una marcada hipotonía axial, con llanto y succión débiles, dificultades para la alimentación y escasa ganancia ponderal.
Además, presentan hipogenitalismo (criptorquidia y micropene en el varón e hipoplasia de labios menores y clítoris en las niñas) y rasgos faciales característicos: frente estrecha con disminución de diámetro bitemporal, dolicocefalia, ojos almendrados, pelo claro, nariz pequeña, labio superior fino con comisuras hacia abajo. Es también prácticamente constante el retraso en el desarrollo psicomotor.
2. Infancia
A partir de los 2 años más o menos, mejora la hipotonía y comienza la hiperfagia que condiciona el desarrollo de obesidad severa.
Otras manifestaciones clínicas que aparecen en esta etapa son: retraso de crecimiento, manos y pies pequeños, escoliosis, problemas visuales (estrabismo, miopía.), hipopigmentación cutánea, somnolencia diurna, caries, saliva espesa.
Alrededor del 60 % presentan un retraso mental, generalmente leve (media CI de 70) con problemas de aprendizaje especialmente en el área de las matemáticas y de la memoria. Es característica su habilidad para resolver rompecabezas.
Además, presentan trastornos de conducta como rabietas, arranques violentos, carácter obsesivo y posesivo (especialmente lo relacionado con comida) y es muy característico la tendencia a rascarse heridas e incluso a autolesionarse.
3. Adolescencia
Se incrementa la obesidad, se manifiestan los signos de hipogonadismo hipogonadotrópico, y se acentúan la baja talla, los trastornos del sueño y la conducta obsesiva.
En esta etapa pueden aparecer complicaciones en relación a la obesidad, como diabetes tipo 2, HTA y alteraciones respiratorias que condicionan la calidad y esperanza de vida de estos pacientes.
Criterios diagnósticos
En 1993 se publicaron los criterios clínicos diagnósticos del SPW32 con el fin de evitar errores diagnósticos, tanto por exceso como por defecto. Estos criterios recogían una amplia lista de síntomas enumerados, agrupados en criterios mayores y menores. En 200133 se propuso una simplificación de los signos clínicos, con criterios que difieren según la edad y justifican la realización del test genético para el diagnóstico definitivo de SPW:
– Nacimiento-2 años
Hipotonía y succión débil
– De 2 a 6 años
Hipotonía con historia de succión débil
Retraso global de desarrollo
– De 6 a 12 años
Hipotonía con historia de succión débil
Retraso global de desarrollo
Apetito exagerado con obesidad central si no se controla
– De 13 años a adulto
Déficit cognitivo, retraso mental leve
Apetito exagerado y obesidad central si no se controla
Hipogonadismo hipotalámico y/o problemas de conducta característicos
Tratamiento multidisciplinar
– El objetivo más importante y más difícil de conseguir es el control de la obesidad. Las recomendaciones se basan en la indicación de ejercicio físico y restricción calórica, dado que hasta el momento no se dispone de ningún tratamiento médico ni quirúrgico eficaz para estos pacientes.
– Seguimiento y estimulación precoz del retraso psicomotor y tratamiento de los trastornos de conducta
– Tratamiento con GH34 (mejoría de talla y composición corporal)
– Inducción de pubertad con hormonas esteroideas, a valorar individualmente (en algunos pacientes el uso de testosterona conlleva un aumento de la agresividad)
– Fisioterapia respiratoria precoz y control de las apneas nocturnas
Síndrome de Silver Russell (SSR)
Es un síndrome definido por retraso de crecimiento intrauterino (CIR) y postnatal, asimetría corporal y facies característica.
Fue descrito de forma casi simultánea por dos autores, Silver35 en 1953 al presentar dos niños con CIR y asimetría corporal y Russell36 en 1954 con la publicación más completa de 5 casos con CIR, baja talla y alteraciones craneofaciales.
Es un síndrome muy heterogéneo, tanto desde el punto de vista genético como clínico, y por tanto de difícil diagnóstico. La incidencia real de SSR es desconocida, con variaciones en la estimación según distintas series desde 1:3.000 a 1:50.000 recién nacidos.
Se han descrito distintas alteraciones genéticas del cromosoma 7 (disomía uniparental materna) y del cromosoma 11 (disomía uniparental materna, triple dosis materna de 11p e hipometilación del centro de imprinting telomérico del 11p)37.
Las manifestaciones clínicas más típicas incluyen el retraso de crecimiento intrauterino (peso y/o longitud al nacimiento menos de 2 DE por debajo de la media) y postnatal, asimetría de extremidades, clinodactilia del 5º dedo y fenotipo característico con facies tringular, micrognatia y perímetro craneal normal38.
Respecto al tratamiento, se han realizado ensayos terapéuticos con GH, con pobres resultados.
Otros síndromes genéticos menos frecuentes
Síndrome de Aarskog
Conocido como displasia faciogenital39, fue descrito por primera vez en 1970 por Aarskog40. Se caracteriza por tener una cara típica, escroto bífido y baja talla.
Existe una variabilidad fenotípica entre los miembros de una familia y variabilidad de expresión entre los sexos, estando los varones afectados más severamente que las mujeres. Los criterios 1ª41 incluyen baja talla, hipertelorismo, puente nasal ancho, nariz corta y narinas antevertidas, filtrum amplio, hipoplasia maxilar con o sin mal oclusión, pliegues debajo del labio inferior, orejas dobladas en la parte superior, manos cortas y anchas, 5º dedo corto con clinodactilia y escroto bífido. Los criterios 2ª para su diagnóstico son ptosis palpebral, hiperlaxitud articular, pies anchos, criptorquidia y hernia inguinal.
La baja talla, presente hasta en un 90% de los niños con este síndrome, es generalmente desproporcionada, a favor del segmento superior42, siendo ésta una de las principales características del síndrome. El perímetro craneal es normal pero en ocasiones podemos encontrar macrocefalia. Los hallazgos oftalmológicos incluyen estrabismo, oftalmoplejia, córnea grande, isotropía, nistagmus y ambliopía. Pueden aparecer alteraciones dentales como erupción retrasada de los dientes definitivos o mala oclusión dental.
La herencia es recesiva ligada al X en la mayoría de casos43. El gen, FGD1, se ha localizado en el cromosoma Xp11.21. Mutaciones en dicho gen se han encontrado en algunas familias, sin embargo, la baja frecuencia de mutaciones encontradas sugiere que otros genes puedan estar involucrados.
El peso y la talla al nacer están por debajo de la media44. En un tercio de los niños el crecimiento se altera en el primer año de vida debido a problemas en la alimentación o infecciones repetidas del aparato respiratorio. En el resto de los niños el crecimiento se afecta entre el 1º y 3º año de vida. Casi todos los niños se sitúan por debajo del percentil 3 a los 3 años de edad. El crecimiento es lento a lo largo de la infancia, y la pubertad generalmente se retrasa y falla el estirón puberal de crecimiento. La talla final en los varones se sitúa entre 150-160 cm y en las mujeres entre 140-150 cm.
Analizando los datos de KIGS (base de datos que incluye el seguimiento internacional de niños en tratamiento con GH), concluyen que no se produce un incremento significativo de la talla en el grupo, pero que existe una gran variabilidad individual, mostrando algunos de ellos un incremento considerable de la velocidad de crecimiento. Por tanto, se deduce que hacen falta más estudios para identificar qué pacientes se podrían beneficiar del tratamiento con HGH.
Síndrome de Cornelia de Lange
Descrito por Lange en 193345 este síndrome tiene una incidencia de 1 por 10.00046 y difiere según las poblaciones estudiadas. El diagnóstico es fundamentalmente clínico; se basa en el reconocimiento de los rasgos fenotípicos faciales característicos, fallo del crecimiento intrauterino, anomalías en las extremidades, retraso del desarrollo postnatal y retraso mental, que puede ser moderado o severo47.
El fenotipo facial se caracteriza por microbraquicefalia, implantación baja del cabello, pestañas largas, hipertricosis, implantación baja de orejas, puente nasal bajo, fosas nasales antevertidas, filtro largo y boca en forma de carpa con labios finos, prognatismo maxilar y micrognatia.
Las anomalías de los miembros superiores pueden ser mayores o menores según el grado de discapacidad que produzcan, como micromelia, focomelia, implantación proximal de los pulgares, oligodactilia, agenesia o hipoplasia del cúbito, sindactilia y línea simiana. El llanto es típico y algunos pacientes pueden presentar convulsiones. También se han observado anomalías oculares, esqueléticas, cardíacas, digestivas, neurosensoriales, dermatológicas, genitales y endocrinas48,49. El síndrome de Cornelia se asocia, además, con alteraciones del comportamiento, tipo autista o hiperactividad50,51. La variabilidad clínica dentro de este síndrome ha llevado al reconocimiento de formas severas, clásicas tipo I y forma más leves o tipo II, que se presentan en el 20% de los casos, y pueden permanecer irreconocibles hasta la edad adulta. Casi todos los casos del Síndrome de Cornelia son esporádicos, pero se han descrito algunos familiares con patrones de herencia autosómica dominante52.
Recientemente Tonkin y col53 han encontrado mutaciones en el gen NIPBL (Nipped-B gene like) (5p13.1). Este gen codifica una proteína que promueve la expresión de otros genes pero se desconoce su función exacta para regular el desarrollo.
El fallo de crecimiento es una de las principales características de este síndrome. En un estudio realizado por Kline y col54 en 180 pacientes encuentran que en el 89% de pacientes el peso y la talla al nacer fueron <P50. La talla cae por debajo del P 5 para los 6 meses de edad, y permanece así hasta la pubertad, que se produce a una edad normal, pero sin estirón de crecimiento. La talla adulta media en los varones es de 155 cm y en las mujeres de 131.
La deficiencia de HGH se ha implicado en algunos estudios como causa de la baja talla. Los datos de pacientes tratados con HGH en la base KIGS permiten concluir que no hay una adecuada respuesta al tratamiento con HGH a corto plazo.
Síndrome de Floating-Harbor
Las características típicas del síndrome de Floating-Habor55 incluyen rasgos craneofaciales como la cara triangular, ojos grandes pero hundidos, nariz bulbosa con puente nasal alto, orificios nasales grandes, boca ancha con labios finos y orejas retrovertidas; talla baja proporcionada (-4 SDS) con edad ósea retrasada, clinodactilia del quinto dedo de la mano y cuello corto, y finalmente retraso en el área del lenguaje expresivo.
La etiología es desconocida. Se trata de casos esporádicos dentro de familias normales. En 3 casos se sugieren herencia autosómica dominante o variante familiar, basado en rasgos peculiares maternos56.
En cuanto al crecimiento, éste ya está comprometido al nacer57. En los 2 primeros años de vida se produce una disminución de la velocidad de crecimiento, y a partir de entonces van creciendo paralelos al percentil más bajo. Durante la infancia la talla está entre -4 y -5 SDS, y lo mismo ocurre en la edad adulta. En los casos en los que se detecta un déficit de HGH, el incremento en la velocidad de crecimiento durante el tratamiento es espectacular.
Los datos de la base KIGS en este tipo de pacientes son tan escasos que no permiten conclusiones claras.
Síndrome de Kabuki
Fue descrito por primera vez en 1981 por Niikawa y col58 y Kuroki y col59. Su diagnóstico se basa en cinco criterios principales60
1. Retraso mental leve o moderado
2. Anomalías esqueléticas
3. Retraso de crecimiento postnatal
4. Alteraciones dermatoglíficas
5. Facies característica
Se han descrito otras muchas anomalías presentes en un elevado porcentaje de pacientes como son paladar ojival/fisura palatina, cardiopatía congénita, alteraciones urogenitales, anomalías oftalmológicas, y problemas de comportamiento. A pesar de su facies característica, con fisuras palpebrales largas, eversión del párpado inferior, cejas arqueadas y orejas grandes y despegadas, este síndrome no siempre es diagnosticado en nuestro medio.
Es más frecuente en japoneses, con una prevalencia de 1/32.00061. La mayoría de los casos son esporádicos. Los casos familiares sugieren herencia AD con diferente expresividad62.
En cuanto al crecimiento63, la longitud al nacer es normal, pero la deficiencia progresiva de crecimiento postnatal es una característica principal. Sin embargo, en el 20% de los pacientes se han descrito tallas finales normales, pero nunca mayores del P50. Algunos pacientes presentaban deficiencia o disfunción neurosecretora de HGH. Pocos pacientes han sido tratados con HGH sin apreciarse cambios en la velocidad de crecimiento a corto y/o largo plazo. En el 23% de las pacientes se ha producido desarrollo puberal temprano. La diabetes tipo 1, diabetes insípida y excesiva ganancia ponderal pueden también asociarse.
Según los datos del KIGS, la terapia con HGH parece no ser efectiva en estos pacientes, aunque existe mucha variabilidad en el crecimiento.
Síndrome de Williams-Beuren
El síndrome de Williams-Beuren es un cuadro dismórfico con alteraciones neurológicas y cardiopatía cuya incidencia es de 1/10.00064.
Este síndrome presenta unas características faciales muy peculiares (labios gruesos y evertidos, boca grande y casi siempre abierta o semiabierta y enseñando dientes separados en arcada inferior, zonas malares hundidas, carrillos prominentes y blandos, nariz corta con final redondeado y ventanas nasales antevertidas, aperturas oculares bastante redondeadas y rodeadas de zonas orbiculares algo hundidas, y mandíbula discretamente pequeña), que hacen que su diagnóstico clínico ofrezca pocas dudas antes de confirmarse la malformación cardíaca (estenosis aórtica supravalvular) que presentan el 75% de los casos65. La hipertensión, que puede ser de diversa etiología, aparece hasta en un 60% de pacientes. Las alteraciones renales que pueden aparecer son nefrocalcinosis, riñones pequeños o asimétricos y estenosis de la arteria renal, acompañadas o no de trastornos funcionales. El retraso mental es una de las principales características, situando la mayoría de los autores el CI de los pacientes con síndrome de Williams-Beuren entre 40 y 7966. Los pacientes tienen un comportamiento muy cariñoso, sin reservas ante extraños. Las alteraciones músculo-esqueléticas incluyen limitación articular, cifosis, escoliosis, lordosis y pectus excavatum. Algunos pacientes pueden presentar hipercalcemia que se resuelve después de la infancia.
Casi siempre se presenta de forma esporádica, pero existen algunos casos familiares con herencia AD67,68. Está causado por una microdelección del cromosoma 7q11.23, que contiene el gen de la elastina, y se detecta en el 90-95% de los casos69,70. Además del gen de la elastina, en esta región se han identificado otros genes.
El retraso de crecimiento intrauterino es un hallazgo frecuente. El peso y la talla al nacer suelen ser algo más bajos del promedio normal; su crecimiento durante la infancia también lleva cierto retraso por problemas para alimentarse71,72,. La pubertad, sin embargo, puede presentarse a veces de forma algo precoz y sin estirón puberal de crecimiento. No se han encontrado diferencias de talla entre los niños con síndrome de Williams-Beuren que mostraban cardiopatía y los que no la tenían73. El déficit de hormona de crecimiento no es causa probable de la baja talla de estos niños.
Los datos de KIGS muestran que la respuesta al tratamiento con GH es escasa.
Anemia de Fanconi (AF)
Fue descrita en 1927 por Fanconi74 y es un síndrome de fragilidad cromosómica, autosómico recesivo, que afecta a 1:360.000 nacimientos. Se caracteriza por presentar malformaciones congénitas en diferentes órganos en un 70% de los casos, cambios en la pigmentación de la piel, insuficiencia medular progresiva y tendencia a enfermedades malignas. Las anomalías congénitas están presentes en el 60-75% de los niños75,76.
Existe una amplia variabilidad clínica tanto intra como inter familiar, y hay un gran solapamiento con otras enfermedades genéticas y no genéticas, lo que hace que el diagnóstico clínico sea difícil.
Según el registro internacional de la AF77, el análisis de más de 700 pacientes mostró que las malformaciones congénitas mayores en AF incluían ausencia o hipoplasia de radio (49,1%), alteraciones esqueléticas (21,6%), renales (33,8%), de los genitales, sobre todo masculinos (19,7%), gastrointestinales (14,3%), cardíacas (13,2%), del SNC (7,7%) y malformaciones y pérdida de audición (11,3%).
Las anomalías en el primer dedo y brazo presentes en el 50% de los niños, consisten en ausencia del dedo, pulgares bífidos o supernumerarios y ausencia o hipoplasia del radio. Otras anomalías esqueléticas menos frecuentes son la displasia congénita de cadera, malformaciones espinales, escoliosis, anomalías costales, sindactilias o alteración en la implantación en los dedos de los pies. Las anomalías gonadales y del desarrollo sexual consisten en hipogonadismo, criptorquidia, hipospadias, útero bicorne, aplasia de útero o vagina78. En el 25% de los casos se encuentra alguna anomalía cráneo-facial u otros rasgos fenotípicos como microcefalia, microftalmia, raíz nasal ancha, implantación anómala del pelo, implantación baja de las orejas o retromicrognatia. Las anomalías renales descritas han sido del tipo de agenesia, malposición o riñón en herradura. El retraso mental no es tan frecuente como se sugirió en un principio y sólo un 13% de los pacientes lo presentan. Las manifestaciones gastrointestinales incluyen malformaciones anorectales en un 5,1% y atresia duodenal en un 4,6%.
La piel está afectada en el 60% de los casos, presentando manchas café con leche o lunares de gran tamaño. Puede existir una hiperpigmentación generalizada dando lugar a una piel bronceada.
Entre los pacientes afectos de AF, el 80% presentan fallo de la médula ósea y el 23% desarrollaron neoplasias, siendo el 60% hematológicas, principalmente leucemia mieloide aguda y el 40% no hematológicas (más frecuentes tumores gastro-intestinales y ginecológicos).
La variabilidad clínica refleja la heterogeneidad genética. Esta enfermedad puede ser causada por mutaciones en cualquiera de los 7 genes: FANCA (16q24.3), FANCC (9q22.3), FANCD (3p22-26), FANCG (9p13), FANCE (6p21.2-21.3) y FANCF (11p15)79. Soulier y col80 comunicaron que las proteínas codificadas por estos genes son parte de un complejo nuclear multiproteico con papel importante en la reparación del daño de ADN.
La AF se asocia con fallo de crecimiento que comienza prenatalmente. La baja talla puede ser el síntoma de presentación inicial en pacientes sin malformaciones congénitas. La talla final media de estos pacientes se encuentra ligeramente por debajo de -2SDS. Casi todos los niños tuvieron déficit de GH, lo que empeora el pronóstico de talla, y un tercio, además hipotiroidismo 1º. La edad ósea se encuentra retrasada, y no se produce el estirón puberal de crecimiento. En algunos pacientes aparece intolerancia a la glucosa, hiperinsulinismo y diabetes mellitus81. Puede aparecer hipogonadismo hipergonadotropo. Las mujeres tienen menstruaciones irregulares, pero pueden tener embarazos espontáneos. Las malformaciones genitales y la hipoplasia de las gónadas son frecuentes en varones, y la espermatogénesis está alterada.
Los datos sobre el tratamiento con GH son escasos y no concluyentes82. No está indicado el tratamiento profiláctico con GH por la alta posibilidad de desarrollar leucemia, porque la respuesta es controvertida y porque no todos los pacientes van a tener una talla baja. Los datos de KIGS muestran que la respuesta a corto plazo tras el tratamiento con HGH en estos pacientes no fue satisfactoria, si bien hay que tener en cuenta que existe una gran variabilidad individual y que las dosis que se usaron fueron bajas.
Síndrome de Rubinstein-Taybi
El síndrome de Rubinstein-Taybi, con una prevalencia estimada del 1/100.000-1/125.00083, se caracteriza por presentar retraso mental, pulgares y primeros dedos de los pies anchos (en porra o maza) y facies característica. Se trata de una enfermedad sistémica con variabilidad en su expresión clínica.
Las anomalías craneofaciales pueden incluir microcefalia, frente prominente, estrabismo, astigmatismo, ptosis palpebral, pliegues antimongoloides, epicantus, puente nasal amplio, orificios nasales anormalmente grandes, paladar ojival y micrognatia. La mayoría presentan una mueca característica cuando sonríen. Los pulgares y dedos gordos de los pies anormalmente anchos están presentes en el 100% de los pacientes. La clinodactilia del quinto dedo está presente en el 50% de los casos.
Muchos pacientes con síndrome de Rubinstein Taybi pueden tener malformaciones del corazón, de los riñones, del aparato urogenital y del sistema esquelético, presentando una marcha rígida e inestable, y alteraciones en las costillas; pectum excavatum, cifosis, escoliosis, laxitud de ligamentos, hiperextensibilidad de las articulaciones e incremento de fracturas. En la mayoría de los casos, la piel también se afecta. Estos niños padecen con cierta frecuencia infecciones de repetición (del oído medio con pérdida auditiva), estreñimiento y dificultades en la alimentación. No son infrecuentes los problemas dentales por superposición de piezas. Hay un incremento en la tasa de malignidad, incluyendo rabdomiosarcomas, feocromocitomas, meningiomas, otros tumores cerebrales y leucemias.
La deficiencia mental es un hallazgo frecuente, con una media de coeficiente intelectual de 36, y casi todos los niños afectos presentan retrasos en las etapas del desarrollo y retraso psicomotor, y tienen dificultades de lenguaje.
La mayoría de los casos son esporádicos. Se han descrito casos de transmisión entre padres e hijos84 así como concordancia en gemelos monocigóticos85 Esto sugiere una posible mutación autosómica dominante. No se descarta la heterogeneidad genética. Se han descrito mutaciones en el gen que codifica la proteína fijadora del coactivador transcripcional CREB, localizado en 16p13.3; se trata de una proteína nuclear que participa como coactivador en la expresión génica regulada por AMP cíclico. Aproximadamente el 25% de los pacientes diagnosticados presentan una microdelección en la región 16p13.3 demostrable por técnicas de hibridación in situ (FISH).
El crecimiento, el peso y la talla al nacer son normales. El retraso del crecimiento es evidente en la infancia. El estirón puberal está suprimido y la edad ósea retrasada. Es frecuente talla baja final y sobrepeso. En cuanto al tratamiento con hormona de crecimiento en estos niños, no hay suficientes datos longitudinales para apoyar su utilización.
Hipoplasia cartílago-pelo
También conocida como condrodisplasia metafisaria tipo McKusick. Es una enfermedad heredada en forma autosómica recesiva, que presenta múltiples manifestaciones fenotípicas, tales como pelo hipoplásico, baja talla con cortedad de miembros, alteraciones osteocondrales, defectos variables en la inmunidad celular y predisposición a una variedad de neoplasias (linfomas, neoplasias en la piel y leucemia)86.
Se origina por un defecto genético localizado en el brazo corto del cromosoma 9 (9p21-p12), debido a mutaciones en el gen de procesamiento del RNA mitocondrial (MRP) y se transmite con carácter AR. Este gen codifica para el componente RNA de una ribonucleoproteína endorribonucleasa, involucrada en múltiples funciones mitocondriales y celulares.
Los criterios clínicos para el diagnóstico son los siguientes: en la mayoría de los pacientes el pelo es escaso, fino y claro; en cuanto a las manifestaciones esqueléticas, además del fallo de crecimiento de los miembros cortos y laxitud ligamentosa, se produce un aumento de la lordosis lumbar, arqueamiento de los miembros inferiores, deformidad torácica, limitación a la extensión del codo y escoliosis moderada. En esta enfermedad se presenta una linfopenia marcada acompañada de neutropenia. La anemia puede estar presente en el 80% de los pacientes.
El fallo del crecimiento es evidente ya al nacer, y la cortedad de miembros puede notarse en el periodo neonatal. El fallo de crecimiento es progresivo, y la talla final muy baja.
En algunos pacientes se ha probado el tratamiento con hormona de crecimiento mejorando su talla. La tendencia a presentar diversas neoplasias en estos niños es un inconveniente para la utilización de HGH, aunque aquellos que han sido tratados no han presentado efectos adversos, según la base de datos KIGS.
Síndrome de Klippel-Feil
Fue descrito por primera vez en 1912 por Maurice Klippel y André Feil. Su incidencia es de 1/40.000. Es una enfermedad congénita que consiste en la fusión de dos o más vértebras cervicales y está definida por la triada característica, implantación baja del cabello, cuello corto y limitación de la movilidad del mismo. Como consecuencia de la cortedad del cuello la cabeza parece estar asentada directamente sobre el tórax, la cara parece distorsionada y las orejas son de implantación baja.
Presenta una gran variabilidad clínica, ya que menos de 50% de los casos tienen estas características y algunos apenas tienen síntomas. La presencia de alteraciones sistémicas y esqueléticas es frecuente. Se asocia con escoliosis en el 60% de los casos, anomalías renales en el 35%, deformidad de Sprengel (fusión de la clavícula con las vértebras cervicales) en el 30%, hipoacusia en el 30%, sincinesias en el 20% y anomalías cardíacas en el 15%.
Se desconoce la etiología de este síndrome, pero se han asociado factores ambientales y genéticos, que provocan un defecto en el desarrollo embrionario, entre las 3 y 8 semanas de gestación, que provoca la falta de segmentación de las metámeras cervicales y como consecuencia, los cuerpos vertebrales de la columna cervical no se separan. Presenta una gran heterogeneidad genética, habiéndose descrito casos con herencia AD y otros con herencia AR, así como casos esporádicos debidos a una mutación de novo.
El diagnóstico de sospecha es clínico y se confirma mediante técnicas de estudio por imagen, resonancia magnética nuclear y tomografía helicoidal, que demuestran las múltiples fusiones de las vértebras cervicales y otras alteraciones óseas acompañantes: alteración discal, osteofitos, siringomielia y estrechamiento de la unión craneocervical. Debe acompañarse de ecografía renal, audiometrías y pruebas de función tiroidea para descartar otras anomalías asociadas.
El crecimiento en estos niños es escaso y referente al tratamiento con hormona de crecimiento, no existe un seguimiento longitudinal en estos pacientes para sacar conclusiones sobre el tratamiento con GH.
Anemia de Blackfan-Diamond
Descrita en 1938, es una enfermedad de causa desconocida caracterizada por una aplasia eritrocitaria congénita y otras anomalías congénitas, especialmente de los miembros superiores y de la región craneofacial. Puede ser de carácter hereditario o adquirido, y esta última se asocia a diferentes neoplasias, enfermedades del colágeno, ciertas enfermedades virales y algunos medicamentos. El 25% de los casos se producen por mutaciones en el gen que codifica la proteína ribosomal SI9 (RPS19;19q13.2)87.
Clínicamente se caracteriza por una anemia severa, presente al nacer en el 10% de los casos, que se evidencia en el 90% restante antes del año de edad. Se acompaña de anomalías craneofaciales en el 38% y en el 18% de los pulgares. La talla está por debajo del percentil 3 en el 28% de los casos, mientras que en el 31% la talla es normal y no presentan alteraciones físicas88.
La baja talla puede encontrarse en el 10-30% de pacientes de forma aislada o asociada con otras malformaciones. Una causa posible puede ser el tratamiento crónico con esteroides, aunque en algunos pacientes se ha diagnosticado un déficit de GH. Según los datos publicados en KIGS los pacientes en tratamiento con GH han respondido menos que los déficit idiopáticos de GH, sin embargo el número de pacientes es muy bajo para sacar conclusiones.
Displasias óseas
Las displasias óseas son un grupo heterogéneo de enfermedades que afectan al esqueleto y provocan, la mayoría de ellas, baja talla severa desproporcionada. El grupo comprende más de 200 tipos diferentes con defectos genéticos que pueden afectar al colágeno o a los receptores de los factores de crecimiento. La talla final difiere sustancialmente, siendo aproximadamente entre 110-130 cm. Existen 2 grandes grupos que se diferencian por la localización del acortamiento, ya sea en las extremidades (característico de la acondroplasia) o en el tronco (displasia espóndiloepifisaria). Por este motivo es imprescindible en la talla baja desproporcionada la estimación de los segmentos corporales y la valoración del índice segmento superior/segmento inferior que en el niño normal será de 1, estará aumentado en el enanismo de miembros cortos (acondroplasia) y disminuido en el enanismo de tronco corto (displasia espóndiloepifisaria).
La forma más prevalente es la acondroplasia, con una incidencia estimada de 1 por cada 25.000 nacimientos. Otras displasias esqueléticas incluyen la hipocondroplasia, discondrosteosis (S. Leri-Weill), displasia espóndilo-epifisaria congénita, pseudoacondroplasia, displasia epifisaria múltiple, displasia metafisaria tipo Jansen, Mckusick y Schmid, picnodisostosis y muchas otras.
La alteración tan severa que se produce en el crecimiento en estos niños ha motivado que se hayan intentado diversos tratamientos; el primer paciente con acondroplasia tratado con hormona de crecimiento fue en 196489. La mayoría de las investigaciones sobre el efecto de la GH en niños con displasias óseas se han hecho en pacientes con acondroplasia o hipocondroplasia, pero no existe ningún trabajo publicado placebo-control randomizado. Tampoco se ha reportado cómo se produce el cambio en las proporciones corporales durante el tratamiento con hormona de crecimiento. Existen pocos estudios de niños con otros tipos de displasias tratados con GH, y la mayoría incluyen pocos pacientes.
La acondroplasia se produce por mutación en la región transmembrana del gen del receptor del factor de crecimiento de fibroblasto 3 (FGFR3), lo que provoca una activación de FGFR3 y lleva al cese prematuro de los condrocitos, especialmente de los huesos largos. La talla final media en pacientes no tratados es de 124 cm en niñas y 132 cm en niños. Varios investigadores han publicado tratamiento con hormona de crecimiento, encontrando una ganancia de 1-1,5 SDS en 3-5 años de tratamiento, sin que se conozcan datos de talla final. Estos trabajos corroboran la idea de que el tratamiento con GH no afecta negativamente el desarrollo de las proporciones corporales90. La alteración del crecimiento en estos pacientes es de tal magnitud que es muy poco probable que el tratamiento con GH sea beneficioso en estos pacientes, salvo que se utilicen dosis muy altas.
En la hipocondroplasia se han encontrado mutaciones en el gen FGFR3 en el 60% de pacientes, mientras que en el 40% con manifestaciones clínicas y radiológicas diagnósticas no se han encontrado mutaciones en este gen ni en otros. La mutación más frecuentemente encontrada (N540K) se sitúa en la región tirosin-kinasa de la proteína y conduce a una activación de la misma, aunque a un nivel menor que en la acondroplasia o en la displasia tanatofora. En la mayoría de los casos la talla final oscila entre 132 y 147 cm. En unos pocos la talla final es normal, pero con unas proporciones corporales anormales. Varios investigadores han estudiado el efecto de la GH, encontrando ganancias de alrededor de 1 DS en 2-3 años de tratamiento91, con algunas variaciones. El amplio rango en la respuesta al tratamiento en aquellos que han alcanzado ya talla final, sugiere que algunos pacientes se podrían beneficiar del tratamiento con GH.
La discondrosteosis o síndrome de Leri-Weill se produce por delección o mutación en el gen SHOX92. Existe una buena correlación genotipo-fenotipo, especialmente cuando incluimos la radiografía de muñeca. Los pacientes tienen proporciones corporales anormales debido a unos miembros inferiores cortos. La talla adulta es variable, siendo en casi todos ellos baja, objetivándose mayor pérdida en mujeres que en varones. Recientemente se ha aprobado la indicación de tratamiento con GH en los niños con alteraciones en el gen SHOX.
La displasia espondiloepifisaria está causada por delecciones o mutaciones del gen que codifica el colágeno tipo II (COL2A1). Mutaciones en este gen producen una variedad de fenotipos que van desde la hipocondrogénesis letal hasta formas muy leves, con escasos síntomas93. El fenotipo de la displasia espondiloepifisaria consiste en baja talla severa con talla final alrededor de 100-125 cm. Otros síntomas incluyen cortedad de tronco, miembros cortos, miopía, platiespondilia. A pesar de la baja talla tan severa en estos niños, pocos trabajos se han publicado en cuanto al uso de GH, y en ellos el resultado no ha sido bueno.
La pseudoacondroplasia está producida por mutaciones en el gen COMP que provocan un defecto en la matriz proteica del cartílago. Las mutaciones interfieren con el acodamiento proteico, conduciendo a una acumulación de proteínas en el retículo endoplásmico de éstas y otras proteínas (incluyendo colágeno tipo IX, y condroitín sulfato) lo que conduce a la muerte celular94. El resultado es una disminución de las células viables de la matriz del hueso y una reducción de su tamaño. La talla final se afecta severamente, siendo alrededor de 80-130 cm. El patrón de crecimiento difiere de la mayoría de las displasias, siendo durante el primer año de vida normal. El fenotipo incluye además de la baja talla, marcha de pato, deformidad de las piernas, dedos cortos, laxitud ligamentosa y articular. Al parecer la utilización de GH en estos niños no produce beneficio y altera más las proporciones corporales.
Histiocitosis de células de langerhans y neurofibromatosis
La histiocitosis de células de Langerhans (LCH) es una enfermedad poco frecuente, caracterizada por el acúmulo y proliferación de histiocitos y eosinófilos, afectando órganos y sistemas, de forma aislada o múltiple. Las manifestaciones clínicas y el curso de la enfermedad son muy variables y van desde afectación aislada con remisión espontánea de una lesión ósea a la afectación multisistémica con disfunción orgánica severa. La hipófisis es un órgano diana en esta entidad.
La fisiopatología es desconocida. En aquellos pacientes que tienen disfunción hipofisaria, el déficit de hormona de crecimiento se encuentra con relativa frecuencia. Su diagnóstico se realiza años después del fallo de la hipófisis posterior, y es responsable del retraso de crecimiento. Se estima en un 42% los pacientes con LCH y diabetes insípida; tienen déficit de GH95, siendo de gran valor la monitorización del crecimiento y la medición del tamaño de la hipófisis anterior por RNM para la detección temprana de estos pacientes. La frecuencia del déficit de GH se incrementa con el tiempo, por ello que estos pacientes deben seguirse a largo plazo.
El tratamiento con radioterapia a dosis bajas que se ha empleado en estos niños (10-15 Gy) se ha asociado con un riesgo incrementado de déficit de GH, siendo por ello una razón para limitar su uso. La quimioterapia con corticoides o vincristina utilizados en estos pacientes, también puede comprometer el crecimiento. El tratamiento con GH ha sido eficaz, pero se necesitan estudios prospectivos para confirmar estos resultados.
La neurofibromatosis tipo 1 o enfermedad de Von Recklinghausen es una enfermedad AD, generalmente hereditaria que afecta a 1/3.000 individuos96. Está causada por mutaciones en el gen NF1 localizado en el cromosoma 17q11.2, que codifica la proteína neurofibromina. Se considera que esta proteína es un gen supresor tumoral. Su inactivación conduce al desarrollo de una variedad de tumores como neurofibromas y gliomas ópticos, entre otros. Un tercio de los pacientes son asintomáticos y se identifican durante exploraciones de rutina, un tercio presenta alteraciones cutáneas y el otro tercio tiene alteraciones neurológicas.
El diagnóstico se realiza en base a los criterios clínicos, tales como manchas café con leche, neurofibromas cutáneos, glioma óptico, pecas en las axilas o familiares de primer grado afectos de NF1; el hallazgo de 2 ó más de éstos justifica el diagnóstico. Los tumores del sistema nervioso central ocurren a lo largo de la vía óptica (70% aproximadamente) o fuera de ella y pueden ser de diversa histología. La localización del tumor y la extensión de su crecimiento o infiltración en la región hipofisaria condicionan la alteración endocrinológica, mayoritariamente déficit de GH o pubertad precoz.
Una característica de la neurofibromatosis tipo 1 es la baja talla (<-2 DS) que afecta aproximadamente al 13-24% de los pacientes prepuberales y a más del 40 % de los adultos97. La etiología de la baja talla en estos pacientes no se correlaciona con la severidad de la enfermedad. Se han descrito una serie de factores de riesgo para la limitación de crecimiento, como son: la cirugía o radioterapia de lesiones intracraneales, el déficit de GH, el déficit de TSH, la pubertad precoz central, el retraso puberal, la escoliosis, los neurofibromas plexiformes, la baja talla familiar o el metilfenidato empleado en el déficit de atención.
El déficit de GH es una complicación importante en niños afectos de NF1 y la etiología en algunos pacientes permanece desconocida. En la mayoría de los niños que tienen lesión intracraneal, el déficit de GH ocurre primariamente, tras el tratamiento de cirugía o radioterapia. El tratamiento sustitutivo con GH incrementa el ritmo de crecimiento. A pesar de que es un tratamiento seguro, se teme que se incremente el riesgo de nuevos tumores, la recurrencia de tumores primarios o aumente la incidencia de segundos tumores.
La historia natural de los pacientes con glioma de la via óptica y NF198 sugiere una incidencia de recurrencia de tumores del 11-14%. También se ha descrito la aparición de segundos tumores intracraneales entre un 21 y un 52% a lo largo de 9 años de seguimiento, según las series99,100. Hasta el momento no se ha producido un incremento del riesgo de recurrencia de tumores o de aparición de segundos tumores en los niños con NF1 y tratamiento con GH, pero estos pacientes deben ser seguidos de forma muy estrecha.
Está bien documentado que el tamaño de las manchas café con leche se incrementa en la pubertad. Es conocido también que los neurofibromas se incrementan de tamaño y en número en los pacientes puberales. El crecimiento superficial de los neurofibromas puede producir hipertrofia de los segmentos subyacentes, y la invasión de estructuras más profundas comprometer la médula, produciendo compresión de la misma. Si el tratamiento con hormona de crecimiento puede acelerar estos procesos, permanece desconocido. De hecho en la base KIGS el 13% de pacientes con neurofibromas tuvieron cambios en las manchas café con leche y en los neurofibromas.
Otras enfermedades raras asociadas con baja talla
– El quiste aracnoideo asociado a otras malformaciones del cerebro como holoprosencefalia, ausencia de cuerpo calloso, está acompañado de un espectro amplio de alteraciones endocrinas incluyendo el déficit aislado o múltiple de hormonas hipofisarias, o pubertad precoz.
– La silla turca vacía y la aplasia hipofisaria pueden entrar dentro del espectro del síndrome de interrupción de talla hipofisario.
– Fisura palatina y defectos labiales así como el Síndrome del Incisivo central único son defectos de la línea media que pueden estar asociados a déficit de GH. Distintos grados de alteración de la función hipotálamo-hipofisaria se ha visto en estos pacientes, teniendo el 50% de los niños baja talla (el 33% presentan déficit de GH).
– El Síndrome del Incisivo central único puede estar asociado además a otras anomalías como holoprosencefalia.
– Hidrocefalia congénita asociada o no a mielomeningocele se acompaña frecuentemente de déficit de GH o disfunción neurosecretora.
Los datos aportados por la base KIGS en este grupo de pacientes indican que en aquellos con déficit de hormona de crecimiento y quiste aracnoideo asociado respondieron bien al tratamiento con GH a corto plazo, así como en los que tenían déficit de GH y silla turca vacía asociada.
En conclusión, la talla baja es un componente muy frecuente en el contexto de enfermedades raras y en ocasiones es el primer motivo de consulta de estos niños. No es raro que sea en las consultas de endocrinología pediátrica donde se realicen los diagnósticos precisos. La genética y especialmente la genética molecular han ayudado de un modo fundamental a aclarar muchas de estas etiologías, y a poder ofertar en algunos casos tratamientos hormonales con GH, con muy buenos resultados. El diagnóstico temprano, si es posible, su seguimiento y el apoyo interdisciplinar es fundamental para clasificar el cuadro y abordar otras patologías sistémicas, frecuentemente asociadas.
Bibliografía
1. Karlberg J. A biologically-oriented mathematical model (ICP) for Human Growth. Acta Paediatric ScandGoteborg: kompendie-tryckeriet-Kallered, 1987. [ Links ]
2. Tanner JM. Growth at adolescente. Oxford, Londres, Edimburgo, Melbourne: Blackwell Scientific Publications, 1973. [ Links ]
3. Grimberg A, Lifshitz F. Worrisome Growth. En: Lifshitz F, ed Pediatric Endocrinology. 5th ed, New York, 2007: 1-38. [ Links ]
4. Pozo J, Gracia R, Argente J. Hipocrecimiento: concepto, clasificación y metodología diagnóstica. En: Argente J. Tratado de Endocrinología Pediátrica y de la Adolescencia. 2ª Ed. Barcelona: Doyma 2000: 201-238. [ Links ]
5. Avellaneda A, Izquierdo M, Torrent-Farnell J, Ramón JR et al. Enfermedades raras: enfermedades crónicas que requieren un nuevo enfoque sociosanitario. An Sist Sanit Navar 2007; 30: 177-190. [ Links ]
6. Ranke M, Price D, Reiter EO (eds). Growth Hormone Therapy in Pediatrics. 20 Years of KIGS. Basel, Karger, 2007; 213-239. [ Links ]
7. Argente J, Pozo J, Perez-Jurado LA. Hipocrecimiento por alteraciones de la hormona de crecimiento. En: Argente J. Tratado de Endocrinología Pediátrica y de la Adolescencia. 2ª Ed. Barcelona: Doyma 2000: 303-332. [ Links ]
8. Lindsay R, Harris D, Feldkamp M, Robertson J, Rallison M. Utah growth Study: growth standars and the prevalence of hormone deficiency. J Pediatr 1994; 125: 29-35. [ Links ]
9. Mullis PE. Transcripcion factors in pituitary gland development and their clinical impacto in phenotype. Horm Res 200; 54: 107-119. [ Links ]
10. Vicens-Calvet E; Etiología de la deficiencia de GH. En: Experiencias y perspectivas en la terapéutica con hormona de crecimiento. Lenoir ediciones. Barcelona 2007; 71-81. [ Links ]
11. Kowarski SA, Schneide JJ, Ben-Galin E, Weldon WW, Daughaday WH. Growth failure with normal serum RIA-GH and low somatomedin activity. J Clin Endocrinol Metab 1978; 47: 461-464. [ Links ]
12. Laron Z. Hipocrecimiento por alteraciones en el receptor de la GH y anomalías potreceptor (síndrome de Laron): resistencia o insensibilidad a la acción de la GH. En: Argente J. Tratado de Endocrinología Pediátrica y de la Adolescencia. 2ª Ed. Barcelona: Doyma 2000: 339-356. [ Links ]
13. Attie KM, Carlsson LMS, Rundle AC, Sherman BM for the National Cooperative Growth Study. Evidence for partial growth hormone insensitivity among patients with idiopathic short stature. J Pediatr 1995; 127: 244-250. [ Links ]
14. Laron Z, Klinger B, Eshet R, Kaneti H, Karasik A, Silbergeld A. Laron syndrome due to a post-receptor defect: response to IGF-I treatment. Isr J Med Sci 1993; 29: 757-763. [ Links ]
15. Woods KA, Camacho-Hubner C, Savage MO, Clark AJL. Intrauterine growth retardation and postnatal growth failure associated with deletion of the insulin-like growth factor I gene. N Engl J Med 1996; 335: 1363-1367. [ Links ]
16. Merimee TJ, Laron Z. The pygmy. En: Merimee TJ, Laron Z, eds. Growth hormone, IGF-I and growth: New views of old concepts. London-Tel Aviv: Freund Publishing House Ltd. 1996; 217-240. [ Links ]
17. Ullrich O. Uber typische kombinationsbilder multipler abartungen. Z. Kindeertheilkd 1930; 49: 271-276. [ Links ]
18. Turner HH. A syndrome of infantilism, congenital webbed neck and cubitus valgus. Endocrinology 1938; 23: 566-574. [ Links ]
19. Ford CE, Jones KW, Polani PE, Almeida JC, de Briggs JH. A sex chromosome anomaly in a case of gonadal dysgenesis (Turner´s syndrome). Lancet 1959; 1: 711-713. [ Links ]
20. Calvo Martin MT. Diagnóstico citogenético del síndrome de Turner: mosaicismo críptico. En: Síndrome de Turner. 9º Curso de Formación de SEEP, Zaragoza, 2003; 13-23. [ Links ]
21. Lippe BM. Physical and anatomical abnormalities in Turner síndrome. EN: Rosenfeld RG, Grumbavch MM. Turner syndrome. Nueva York: Marcel Dekker, 1990; 183-196. [ Links ]
22. Massa G, Vanderschueren Lodeweckx M. Age and height at diagnosis in Turner syndrome: influence of parenteral height. Pediatrics 1991; 88: 1148-1152. [ Links ]
23. Ferrandez A, Labarta JI, Mayayo E, Snjuan P, Cancer E y Grupo colaborativo Español. Talla final en el síndrome de Turner. Endocrinología 1994; 41: 26-30. [ Links ]
24. Noonan JA, Ehmke DA. Associated non-cardiac malformations in children with congenital heart disease. J Pediatr 1963; 31: 150-153. [ Links ]
25. Noonan JA. Hypertelorism with Turner phenotype. A new syndrome with associated congenital heart disease. Am J Dis Child 1968; 116: 373-380. [ Links ]
26. Tartaglia M, Mehler EL, Goldberg R et al. mutations in PTPN11, encoding the protein tyrosine phosphatase SHP2, cause Noonan syndrome. Nat Genet 2001; 29: 465-468. [ Links ]
27. Sarkozy A, Conti E, Sepira D. Correlation between PTPN11 gene mutations and congenital heart defects in Noonan and LEOPARD syndromes. J Med Genet 2003; 40: 704-708. [ Links ]
28. Bentires-Alj M, Guillermo J, David F. Activating mutations of the Noonan síndrome associated SHPº/PTPN11 gene in human solid tumors and adulta cute myelogenous leucemia. Cancer Res 2004; 64: 8816-8820. [ Links ]
29. Prader A, Labahart A, Willi H. Ein síndrome von adipositas, kleinbuchs, kriptorchidismus und oligofrenie nch myotonieartigem zustandim neugeborenen alter. Schweiz Med Wochenschr 1956; 86: 1260-1261. [ Links ]
30. Cassidy S. Prader-Willi Síndrome. VI Internacional meeting PWS. Julio 2007. Rumanía. [ Links ]
31. Butler MG, Thompson TT, Prader-Willi síndrome: clinical and genetic findings. The Endocrinologist 2000; 10(s): 3-16. [ Links ]
32. Holm VA, Cassidy SB, Butle MG, Hanchett JM, Greenswag LR, Witman BY et al. Prader-Willi syndrome: consensus diagnostic criteria. Pediatrics 1993; 91: 398-402. [ Links ]
33. Gunay-Aygún M, Swartz S, Heeger S, O´Riordad MA, Cassidy SB. The changing purpose of Prader-Willi syndrome clinical diagnostic criteria and proposed revised criteria. Pediatrics 2001; 108: e92. [ Links ]
34. Nosas R, Corripio R, Gabán E. Síndrome de Prader-Willi y terapeútica con hormona de crecimiento. En: Vicens-Calvet E. Experiencias y perspectivas en la terapeútica con hormona de crecimiento. Lenoir ediciones. Barcelona 2007; 245-257. [ Links ]
35. Silver HK, Kiyasu W, George J, Deamer WC. Syndrome of congenital hemihypertrophy, shortness of stature, and elevated urinary gonadotrophins. Pediatrics 1953; 12: 368-365. [ Links ]
36. Russel A. A syndrome of intra-uterine dwarfism recognizable at birth with cranio-facial dysostosis, disproportionately short arms and other anomalies. Proc R Soc Med 1954; 47: 1040-1044. [ Links ]
37. Eggermann T, Schönherr N, Meyer E, Obermann C, Mavany M, Eggermann K et al. Epigenetic mutations in 11p15 in Silver-Russell syndrome are restricted to the telomeric imprinting domain. J Med Genet 2006; 43: 615-616. [ Links ]
38. Price SM, Stanhope R, Garret C, Preece MA, Trembath RC. The spectrum of Silver-Russell syndrome: a clinical and molecular genetic study and new diagnostic criteria. J Med Genet 1999; 36: 837-842. [ Links ]
39. Glover TW, Verga V, Rafael J, Barcroft C, Gorski JL, Bawle EV, Higgins JV. Translocation breakpoint in Aarskog syndrome maps to Xp11.21. Hum Mol Genet 1993; 2: 1717-1718. [ Links ]
40. Aarskog D: A familial syndrome of short stature associated with facial dysplasia and genital anomalies. J Pediatr 1970; 77: 856-861. [ Links ]
41. Teebi AS, Rucquoi JK, Meyn MS: Aarskog syndrome: report of a family with review and discussion of nosology. Am J Med Genet 1993; 46: 501-509. [ Links ]
42. Duncan PA, Klein RM, Wilmat PL, Shapiro LR. Additional features of the Aarskog syndrome. J Pediatr 1977; 91: 769-770. [ Links ]
43. Furukawa CT, HallBD, Smith DW. The Aarskog syndrome. J Pediatr 1992; 43: 420-427. [ Links ]
44. Fryns JP. Aarskog syndrome: the changing phenotype with age. Am J Med Genet 1993; 47: 1042-1049. [ Links ]
45. Lange C. Sur un type nouveau de degenerescence (typus Amstelodamensis). Arch Med Enfants 1933; 36: 713-719. [ Links ]
46. Beck B. Epidemiology of Cornelia de Lange syndrome. Acta Paediatr Scand 1976; 65: 631-638. [ Links ]
47. Martínez-Frías ML, Bermejo E, Félix V, Jiménez N, Gómez-Ullate J, López JA et al. Síndrome de Brachmann de Lange en nuestro medio: características clínicas y epidemiológicas. An Esp Pediatr 1998; 48: 293-298. [ Links ]
48. Ruiz de la Cuesta-Martín C, Abio-Albero S, García-Bodega O, Rite-Gracia S, López-Pisón J, Vera-Cristóbal F et al. Síndrome de Cornelia de Lange Neonatal. Rev Neurol 2004; 38: 1027-1031. [ Links ]
49. Jones K, Smith DW. Recognizable patterns of human malformations. 5th ed. Philadelphia: W.B.Saunders Co; 1997:374-375. [ Links ]
50. Bryson Y, Sakati N, Nyhan WL, Fish CH. Self-mutilaty behavior in the Cornelia de Lange syndrome. Am J Med Defic 1971; 76: 319-324. [ Links ]
51. Shear S, Nyhan L, Kirman H, Stern J. Self-mutilative behavioral as a feature of the Lange syndrome. J Pediatr 1971; 78: 506-509. [ Links ]
52. Smith M, Herrell S, Lusher M, Lako L, Simpson C, Wiestner RS et al. Genomic organisation of the human chordin gene and mutation screening of candidate Cornelia de Lange syndrome genes. Hum Genet 1999; 105: 104-111. [ Links ]
53. Tonkin T, Wang J, Lisgo S, Bamshad J, Strachan T. NIPBL, encoding a homolog of fungal Scc2-type sister chromatid cohesion proteins and fly Nipped-B, is mutated in Cornelia de Lange syndrome. Nature Genet 2004; 36: 636-641. [ Links ]
54. Kline AD, Barr M, Jackson LG,. Growth manifestations in the Brachman de Lange Síndrome. Am J Med Genet 1993; 47: 1042-1049. [ Links ]
55. Majewski F, Lenard HG. The Floating-Harbor syndrome. Eur J Pediatr 1991; 150: 250-252. [ Links ]
56. Rosen AC, Newby RF, Sauer CM, Lacey T, Hammeke TA, Lubinsky MS. A further report on a case of Floating-Harbor syndrome in a mother and daughter. J Clin Exp Neuropsychol 1998; 20: 483-495. [ Links ]
57. Robinson PL, Shohat M, Winter RM, Conte WJ, Gordon-Nesbitt D, Feingold M et al. A unique association of short stature, dysmorphic features and speech impairment (Floating-Harbor syndrome). J Pediatr 1988; 113: 703-706. [ Links ]
58. Niikawa N, Matsuura N, Fukushima Y, Ohsawa T, Kajii T. Kabuki make-up síndrome: a syndrome of mental retardation, unusual facies, large and protuding ears, and postnatal growth deficiency. J Pediatr 1981; 99: 565-569. [ Links ]
59. Kurobi Y, Suzuki Y, Chiyo H, Hata A, Matsui I: A new malformation syndrome of long palpebral fissures, large eras, depressed nasal tip and skeletal anomalies associated with postnatal growth deficiency. J Pediatr 1981; 99: 570-573. [ Links ]
60. Niikawa N, Kurobi Y, Kajii T, matsuura n, ishikiriyama s, tonoki H et al. Kabuki make-up (Niikawa-Kurobi) syndrome: a study of 62 patients. Am J Med Genet 1988; 31: 565-589. [ Links ]
61. Wilson GN. Thirteen cases of Niikawa-Kurobi syndrome: report and review with emphasis on medical complications and preventive management. Am J Med Genet 1998; 79: 112-120. [ Links ]
62. Armstrong L, Abd El Moneim A, Aleck K et al. Further delineation of Kabuki síndrome in 48 well-defined new individuals. Am J Med Genet 2005; 132A: 265-272. [ Links ]
63. White SM, Thompson EM, Kidd A et al. Growth, behavior and clinical findings in 27 patients with Kabuki (Niikawa-Kurobi) syndrome. Am J Med Genet 2004; 127A: 118-127. [ Links ]
64. Morris CA, Demsey SA, Leonard CO, Dilts C, Blackburn BL. Natural history of Williams syndrome: Physical characteristics. J Pediatr 1988; 113: 318-326. [ Links ]
65. Hallidie-Smith KA, Karas S. Cardiac anomalies in Williams-Beuren syndrome. Arch Dis Child 1988; 63: 809-813. [ Links ]
66. Gosch A, Pankau R. Longitudinal study of the cognitive development in children with Williams syndrome. Am J Med Genet 1996; 61: 26-29. [ Links ]
67. Morris CA, Demsey SA, Leonard CO, Dilts C, Blackburn BL. Natural history of Williams syndrome: Physical characteristics. J Pediatr 1988; 113: 318-326. [ Links ]
68. Ounap K, Laidre P, Bartsch O, Rein R, Lipping-Sitska M. Familial Williams-Beuren syndrome. Am J Med Genet 1998; 80: 491-493. [ Links ]
69. Kotzot D, Bernasconi F, Brecevic L, Robinson WP, Kiss P, Kosztolanyi G et al. Phenotype of the Williams-Beuren syndrome associated with hemizygosity at the elastin locus. Eur J Pediatr 1995; 154: 477-482. [ Links ]
70. Nickerson E, Greenberg F, Keating M, McCaskill C, Shaffer L. Deletions of the elastin gene at 7q11.23 occur in ~ 90 % of patients with Williams syndrome. Am J Hum Genet 1995; 56: 1156-1161. [ Links ]
71. Morris CA, Demsey SA, Leonard CO, Dilts C, Blackburn BL. Natural history of Williams syndrome: Physical characteristics. J Pediatr 1988; 113: 318-326. [ Links ]
72. Pagon RA, Bennett FC, La Veck B, Stewart KB, Johnson J. Williams syndrome: features in late childhood and adolescence. Pediatrics 1987; 80: 85-91. [ Links ]
73. Pankau R, Partsch CJ, Gosch A, Oppermann HC, Wessel A. Statural growth in Williams-Beuren syndrome. Eur J Pediatr 1992; 151: 751-755. [ Links ]
74. Fanconi G: Familäre infantile perniziosaartige Anämie (pernizioses Blutbild und Konstitution). Jahre Kinderh 1927; 17-257. [ Links ]
75. Frohmayer 1, Frohmayer D. Definition, Characteristics and Diagnosis of Fanconi Anemia. En: Fanconi anemia: A Handbook for Families and Their Phisicians. Fanconi Anemia Research Fund, Inc. Industrial Publishing, Inc. Koke Printing. Oregon. Third Ed 2000; 3-19. [ Links ]
76. Glanz A, Frasser FC. Spectrum of anomalies in Fanconi Anaemia. J Med Genet 1982; 19: 412-416. [ Links ]
77. Giampietro PF, Adler-Brecher B, Verlander PC, Pavlakis SG, Davis JG, Auerbach AD: The need for more accurate and timely diagnosis in Fanconi anemia: a report from the international Fanconi Anemia registry. Pediatrics 1993; 91: 116-1120. [ Links ]
78. Alter BP, Frissora CL, Halpérin DS, Freedman mh, Chitkara u, Alvarez E et al. Fanconi´s anemia and pregnancy. Br J Haematol 1991; 77: 410-418. [ Links ]
79. Mondovits B, Vermylen C, Brichard B, Cornu G. Fanconi´s Anemia and molecular biology research. Arch Pediatr 2001; 8: 853-860. [ Links ]
80. Soulier J, Leblanc T, Larghero J, Dastot H, Shimamura A, Guardiola P et al. Detection of somatic mosaicism and lassification of Fanconi anemia patients by analysis of the FA/BRCA pathway. Blood 2005; 105: 1329-1336. [ Links ]
81. Swift M, Sholman L, Gilmour D. Diabetes mellitus and the gene for Fanconi´s anemia. Science 1972; 178: 308-310. [ Links ]
82. Wajnrajch MP, Gertner JM, Huma Z, Popovic J, Lin K, Verlander PC et al. Evaluation of growth and hormonal status in patients referred to the international fanconi Anemia registry. Pediatrics 2001;107:744-754. [ Links ]
83. Petrij F,Giles RH, Breuning MH. Rubinstein-Taybi syndrome. En Scriter CR, Beaudet Al, Sly WS, Valle D(eds): the metabolic and molecular bases od inherited disease, ed 8. New York, Mc Graw-Hill, 2001, vol 4, 6167-6182. [ Links ]
84. Marion RW, Garcia DM, Karasik JB. Apparent dominant transmission of the Rubinstein-Taybi syndrome. Am J Med Genet 1993 ; 46: 284-287. [ Links ]
85. Preis S, Majewski F. Monozygotic twins concordant for Rubinstein-Taybi syndrome: changing phenotype during infancy. Clin Genet 1995; 48: 72-75. [ Links ]
86. Mäkitie O, PukkalaE, Teppo L, Kaitilia I. Increased incidence of cancer in patients with cartilage-hair dysplasia. J Pediatr 1999; 134: 315-318. [ Links ]
87. Draptchinskaia N, Gustavsson P, Andersson B, Pettersson M, Williq TN, Dianzani I et al. The gene encoding ribosomal protein S19 is mutated in Diamond-Blackfan anaemia. Nat Genet 1999; 21: 169-175. [ Links ]
88. Ball SE, McGuckin CP, Jenkins G, Gordon-Smith EC: Diamond-Blackfan anaemia en the UK: analysis of 80 cases from a 20-year birth cohort. Br J Haematol 1996; 94:645-653. [ Links ]
89. Gershberg H, Mari S, Hulsa M, St Paul H. Long-term treatment of hypopituitary and of achondroplastic dwarfism with human growth hormone. Metabolism 1964; 13: 152-160. [ Links ]
90. Hertel NT, Eklof O, Aronson S et al. Growth hormone treatment in 35 prepuberal children with achondroplasia: a five year dose response trial. Acta Paediatr 2005; 94: 1402-1410. [ Links ]
91. Bridges NA, Hindmarsh P, Brook CGD. Growth of children with hypocondroplasia treated with growth hormone for up to three years. Horm Res 1999; 36 (Suppl 1): 56-60. [ Links ]
92. Belin V, Cusin V, Viot G, Girlich D, Toutain A, Moncla A et al. SHOX mutations in dyschondrosteosis (Leri Weill syndrome). Nat Genet 1998; 19: 67-69. [ Links ]
93. Nishimura G, Haga N, Kitoh H et al. The phenotypic spectrum of COL2A1 mutations. Hum Mut 2005; 26: 36-43. [ Links ]
94. Briggs MD, Hoffman SMG, King LM, Olsen AS, Mohrenweiser H, Lerov JG et al. Pseudoachondroplasia and multiple epiphyseal dysplasia due to mutations in the cartilage oligomeric matrix protein gene. Nat Genet 1995; 10: 330-336. [ Links ]
95. Nanduri VR, Bareille P, Pritchard J, Stanhope R: Growth and endocrine disorders in multisystem Langerhans´cell histiocytosis. Clin Endocrinolo (Oxf) 2000; 53: 509-515. [ Links ]
96. Riccardi VM, Eichner JE. Neurofibromatosis : Phenothype, natural history apathogenesis. Baltimore, Johns Hopkins University press, 1986, 29-36. [ Links ]
97. Carmi d, Shohat M, Metzker A, Dickerman Z. Growth, puberty and endocrine functions in patients with sporadic or familial neurofibromatosis type 1: a longitudinal study. Pediatrics 1999; 103: 1257-1262. [ Links ]
98. Janss AJ, Grundy R, Cnaan A, Savino PJ, Packer RJ, Zackai EH et al. Optic pathway and hypothalamic/chiasmatic gliomas in children younger than age 5 years with a 6-year follow-up. Cancer 1995; 75: 1051-1059. [ Links ]
99. Hoschstrasser H, Boltshauser E, Valavanis A. Brain tumors in children with Von Recklinghausen neurofibromatosis. Neurofibromatosis 1988; 1: 233-239. [ Links ]
100. Kuenzle C, Weissert M, Roulet E, Bode H, Scheter S, Huisman T et al. Follow up of optic pathway gliomas in children with neurofibromatosis type 1. Neuropediatrics 1994; 25: 295-300. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
M. J. Chueca Guinduláin
Unidad de Endocrinología Pediátrica
Hospital Virgen del Camino
C/Irunlarrea, 4
31008 Pamplona
Tfno. 848422612
Fax. 848429924















