Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Anales del Sistema Sanitario de Navarra
versão impressa ISSN 1137-6627
Anales Sis San Navarra vol.31 supl.3 Pamplona 2008
Manifestaciones oftalmológicas de la enfermedad cerebrovascular
Ophthalmological manifestations of cerebrovascular disease
J. Gállego, M. Herrera, M.C. Navarro
Servicio de Neurología. Hospital de Navarra.
Dirección para correspondencia
RESUMEN
El ojo constituye una diana para la enfermedad vascular. El estudio de la microcirculación retiniana constituye una oportunidad muy interesante para la valoración del riesgo vascular al conocer la relación existente entre los cambios vasculares en la retina y el riesgo de padecer un ictus. Es además una ventana excepcional para conocer mejor la fisiopatología de la microcirculación.
La arteria oftálmica es la primera rama de la arteria carótida interna. La afectación ocular puede ser uni o bilateral. Los síntomas oculares o neuro-oftalmológicos son transitorios o persistentes y sus manifestaciones son muy heterogéneas abarcando alteraciones de la agudeza visual, trastornos de los campos visuales, síndromes oculomotores y manifestaciones clínicas corticales y subcorticales complejas. Su conocimiento puede resultar clave para instaurar las medidas preventivas pertinentes o establecer el correcto diagnóstico y la aproximación diagnóstica inmediata, tan importante en la atención de los procesos vasculares cerebrales.
Palabras clave: Amaurosis fugaz. Ataque isquémico transitorio. Neuropatía óptica. Parálisis oculomotora. Hemianopsia.
ABSTRACT
Transient or persistent loss of vision in one eye is a common and distinctive manifestation of occlusive vascular disease. Occasionally, both eyes are involved together or sequentially, with temporary or even permanent blindness. The internal carotid arteries supply blood to the organ of vision; therefore pathologies of those arteries caused by arteriosclerosis may have a direct influence on its functioning. The most common syndromes are temporary (amaurosis fugax) or constant reduction of visual acuity. In fundus examination central retinal artery occlusion and branch retinal artery occlusion are the most common diagnosis, while retinal vein occlusion, anterior ischemic optic neuropathy, ocular ischemic syndrome are less common. There are many clinical ophtlamological manifestations due to vascular brain damage. Proper recognition and diagnosis of the disease may protect the patient against serious life-threatening complications such as stroke.
Key words: Amaurosis fugax. Transient ischaemic attack. Optic neuropathy. Oculomotor paralysis. Hemianopsia.
Introducción
El ictus representa en los países desarrollados uno de los condicionantes más importantes de ingreso hospitalario, de incapacidad permanente y de muerte. Es la principal causa de discapacidad, dependencia y pérdida de la capacidad de relación social en los países occidentales. La mayoría de los ictus son de origen isquémico, y la mayor parte de los ictus isquémicos se deben a aterotrombosis1-4. En España la enfermedad vascular (cerebral y cardiaca) es la primera causa de morbimortalidad en la población5,6. Según datos del Instituto Nacional de Estadística, constituye en España la primera causa de mortalidad en la mujer y la segunda causa de muerte por detrás de la cardiopatía isquémica; es la primera causa de discapacidad grave en el adulto y la segunda causa de demencia6. El ictus representa la segunda causa de mortalidad en todo el mundo según las estadísticas de la Organización Mundial de la Salud7-9.
Además de las diferentes expresiones clínicas neuro-oftalmológicas de la enfermedad cerebrovascular, merece ser destacado que los vasos retinianos comparten características anatómicas, fisiológicas y embriológicas con los vasos cerebrales. La retina es una extensión del diencéfalo y posee una barrera hemato-retiniana similar a la hemato-encefálica10. Los cambios en los vasos retinianos reflejan probablemente cambios en los vasos cerebrales. Sin embargo, la irrigación retiniana es la única que puede ser visualizada en vivo y de forma directa sin utilizar medidas o medios invasivos. El estudio de signos vasculares retinianos puede darnos claves muy importantes para comprender la fisiopatología del ictus y de las enfermedades cerebrovasculares relacionadas11.
La arteria oftálmica es la encargada de irrigar las estructuras del ojo y de la órbita. Es la primera rama de la arteria carótida interna, se dirige hacia delante para atravesar el foramen óptico y penetra en la órbita junto al nervio óptico. En muy raras ocasiones puede tener su origen directo en la arteria cerebral media. Después, sigue el borde inferior del músculo oblicuo mayor hasta el ángulo interno de la órbita para dar múltiples colaterales (lagrimal, supraorbitaria, etmoidal, palpebral, arteria central de la retina) que forman anastomosis con ramas de la arteria carótida externa (maxilar interna, meníngea media, y temporal superficial) para finalmente bifurcarse en sus dos ramas terminales, las arterias frontal interna y nasal dorsal. Es una vía importante anastomótica entre las arterias carótidas interna y externa, que adquiere gran relevancia en la oclusión arterial carotídea en cuyo caso el flujo sanguíneo de la arteria oftálmica es retrógrado o invertido procedente de la arteria carótida externa para ayudar a irrigar la región intracraneal.
Junto a los síndromes clínicos de afectación oculomotora y visual de la enfermedad vascular, la patología oclusiva carotídea puede manifestarse a nivel ocular de múltiples formas. La ceguera monocular transitoria, oclusiones de la arteria central de la retina, oclusiones de rama de las arterias retinianas, embolias de la arteria retiniana, síndromes isquémicos oculares y neuropatías ópticas isquémicas entre otras son una muestra de ellas. La enfermedad arteriosclerótica de la arteria carótida interna puede producir una gran variedad de síntomas y signos clínicos oculares ipsilaterales que es muy importante conocer ya que constituyen el anuncio de ictus devastador o la posibilidad de riesgo coronario futuro. La retinopatía venosa de estasis y el síndrome isquémico ocular también se asocian a hipoperfusión ocular grave, manifestación externa de una enfermedad oclusiva carotídea.
Enfermedad vascular cerebral asintomática. estudio vascular de la retina y riesgo vascular
El estudio de la microcirculación retiniana constituye una oportunidad muy interesante para la valoración del riesgo vascular11-15. Recientes estudios poblacionales han enfatizado la relación existente entre los cambios vasculares en la retina y el riesgo de padecer un ictus13. Su presencia conlleva un riesgo dos o tres veces mayor de sufrir un ictus a los 3 años. La observación mediante fotogramas de cruces arteriovenosos, estrechamiento segmentario o difuso arteriolar, microaneurismas, exudados y hemorragias retinianas está relacionada con la incidencia de ictus y la mortalidad por enfermedad cerebrovascular, de la misma forma que con la aparición de deterioro cognitivo y cambios en la sustancia blanca y atrofia cerebral en los estudios con MRI, independientemente de la presencia de diabetes, hipertensión arterial u otros factores de riesgo vascular16-17, constituyendo para la mayoría de autores un marcador de microangiopatía cerebral.
Los émbolos retinianos son pequeñas placas alojadas en la luz de las arteriolas retinianas, compuestos de fragmentos de colesterol, agregados fibrinoplaquetares o partículas de válvulas calcificadas. Pueden ser émbolos de colesterol, amarillos, brillantes o fibrinoplaquetares blanco-grisáceos, fugaces y que se adaptan al perfil vascular por ser blandos y disgregables. Clásicamente se describen los émbolos cálcicos, blancos y de bordes irregulares. Tienen su origen en las úlceras de placas carotídeas o del arco aórtico, trombos murales carotídeos o materal cálcico valvular. Son infrecuentes en la población general, con una prevalencia poblacional del 0,2 al 1,4% de los adultos mayores de 40 años y rara vez bilaterales. Su presencia se asocia con una mayor mortalidad por ictus, casi 3 veces más en un periodo de 5 años10. El cateterismo cardiaco puede causar embolismo retiniano y constituir un marcador de embolismo cerebrovascular. En un reciente estudio prospectivo su frecuencia se estimó en un 2% sin manifestación clínica alguna visual o neurológica17. Mucho menos prevalentes son las manchas de Roth, no patognomónicas de endocarditis bacteriana. Se abre un camino para el desarrollo estandarizado de la técnica y para dilucidar el papel de las vénulas en la enfermedad vascular cerebral15.
Isquemia retiniana aguda. Amaurosis fugaz. Ataque isquémico transitorio retiniano
El ataque isquémico transitorio (AIT) es una disfunción neurológica focal de causa vascular con un perfil temporal definido y con características etiopatogénicas similares al infarto cerebral. La duración aceptada de 24 horas fue arbitrariamente elegida18, por lo que actualmente, un grupo de trabajo formado por expertos (TIA Working Group) ha propuesto una nueva definición. Estos autores proponen, fundamentándose en datos clínicos recientes y en un mejor conocimiento fisiopatológico de la isquemia cerebral, que el AIT es un episodio breve de disfunción focal originado por isquemia cerebral o retiniana en el que los síntomas tienen una duración habitualmente inferior a una hora y no debe existir evidencia de infarto cerebral19. Con esta redefinición consideran que se cumplen los principales objetivos que deben guiar la asistencia a pacientes con enfermedad cerebrovascular aguda. Así, se le da más valor al hecho biológico de objetivar una lesión isquémica cerebral y por tanto se debe contar con una exploración urgente de imagen que analice esta posibilidad. Aunque es reconocido un solapamiento de síntomas entre la circulación anterior y posterior (sólo la amaurosis fugax es exclusiva del sistema carotídeo), se distinguen estos subtipos de AIT según las manifestaciones clínicas: retiniano, hemisférico cortical, subcortical o lacunar y atípico. Existe una evidencia reconocida en numerosos estudios de ámbito comunitario y hospitalario de que el AIT es un predictor clínico de eventos vasculares graves (infarto cerebral, cardiopatía isquémica, muerte de causa vascular y hospitalización por enfermedad vascular). Por este motivo la atención a los pacientes que presentan un AIT es una de las intervenciones más importantes en prevención secundaria20.
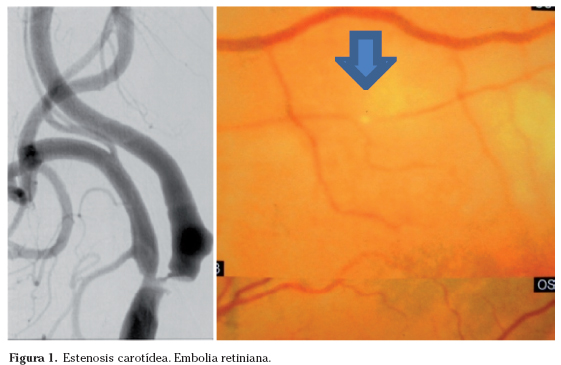
La amaurosis fugax (AF) denomina un fenómeno de pérdida visual transitoria monocular generalmente de menos de 10 minutos de duración producida por una alteración de la circulación retiniana en la mayoría de los casos por émbolos procedentes de la arteria carótida ipsilateral o del corazón, este último con menor frecuencia18. Ocasionalmente los émbolos pueden ser observados en el estudio oftalmoscópico. La pérdida unilateral y transitoria de la visión por la exposición a la luz brillante se ha descrito como manifestación de la estenosis carotídea ipsilateral crítica o una oclusión de la arteria carótida interna, atribuida a la incapacidad del metabolismo retiniano a responder a la estimulación lumínica como consecuencia de una disminución crítica del flujo sanguíneo a nivel del sistema carotídeo ipsilateral. La luz consume el pigmento fotorreceptor, que debe ser resintetizado por un proceso dependiente de energía y esta capacidad puede estar comprometida por la isquemia retiniana. Durante la exposición a la luz intensa se produce un incremento del flujo sanguíneo focal del 22% en el ojo explorado con respecto al contralateral o basal. La AF de un lado puede combinarse en el mismo episodio, o sucesivamente, con un trastorno motor o sensitivo del hemicuerpo contralateral, o con un trastorno del lenguaje, es el llamado síndrome óptico-cerebral21 (Fig. 1).
La historia natural de los pacientes con AF varía según la edad del paciente y la etiología. El riesgo de muerte en pacientes con AF y estenosis carotídea es aproximadamente del 4% por año y se debe principalmente a la cardiopatía isquémica o al infarto de miocardio22. En la tabla 1 se detallan las numerosas causas de trastorno monocular de la visión.
La pérdida visual transitoria binocular tiene su causa más frecuente en el aura migrañosa23. El diagnóstico diferencial debe incluir hipotensión, arteritis temporal, migraña con aura y la isquemia cerebral. En pacientes mayores o con factores de riesgo vascular los episodios transitorios de pérdida de visión binocular pueden ser la manifestación de la isquemia transitoria en el territorio vertebrobasilar. Los trastornos visuales de la isquemia transitoria vertebrobasilar incluyen además: ceguera bilateral transitoria, ambliopía bilateral o hemianopsia homónima. En ocasiones puede producirse la inclinación de la imagen visual, consistente en que ésta aparece rotada en cualquier graduación, como 90 ó 180 grados, sin modificación de su forma, color ni tamaño24,25. Las alteraciones cardiacas con hipoperfusión, por embolismo cardiaco o embolismo arteria-arteria desde segmentos proximales de las arterias vertebrales o de la propia basilar pueden dar los mismos síntomas. Sin embargo, en estas circunstancias se pueden presentar otros síntomas y signos clínicos asociados24.
Neuropatía óptica isquémica (NOI)
La NOI traduce una pérdida brusca de visión de etiología vascular. Es la causa más frecuente de pérdida unilateral de visión de instauración repentina o aguda en el adulto. Clásicamente se ha dividido en la NOI no arterítica y la arterítica.
La pérdida visual monocular persistente es por lo general el resultado de una enfermedad vascular con oclusión de las arterias o venas retinianas y la isquemia del nervio óptico. La arteria oftálmica irriga al ojo a través de las dos circulaciones arteriales. La circulación ciliar o coroidea se origina a través de la arteria oftálmica en la órbita e irriga las capas externas de la retina y la cabeza del nervio óptico. La circulación central de la retina irriga las capas más internas de la retina a través de la arteria central y sus ramas. La repentina pérdida de visión monocular puede ser el resultado de la trombosis de la arteria oftálmica o más frecuentemente de cualquiera de las circulaciones finales. Cuando la circulación ciliar es la afectada la isquemia de la cabeza del nervio óptico se conoce con el nombre de neuropatía óptica isquémica anterior26.
La pérdida visual es de instauración repentina o aguda, pero puede progresar en pocos días. El dolor ocular está presente en el 10% de los casos. La pérdida de visión puede ser leve en el 49% de los casos y en el 34% grave (pérdida mayor a 20/200). En la exploración además de un defecto pupilar aferente se aprecia un déficit campimétrico que manifiesta un patrón altitudinal, generalmente inferior. El edema papilar puede ser difuso o sectorial, dependiendo de la arteria afectada y se asocia a microhemorragias y capilares dilatados en la superficie27.
La NOI no arterítica se relaciona con enfermedad de pequeño vaso asociada a hipertensión, diabetes y a veces con la alteración congénita de la cabeza del nervio óptico, de menor tamaño que el normal. Es muy rara la etiología embólica o en relación con patología carotídea ipsilateral, de tal manera que no se puede considerar como un marcador de enfermedad carotídea ipsilateral28,29. La afectación contralateral se constata en el 15% de los pacientes con la forma no arterítica dentro de los 5 años posteriores. Otros autores han publicado un riesgo de recurrencia contralateral del 30-40%, incluso mayor en pacientes más ancianos y en enfermos con diabetes e hipertensión (Tabla 2).
Los estudios diagnósticos que se deben realizar son: hemograma, velocidad de sedimentación globular (VSG), bioquímica, angiografía con fluoresceína para distinguir otras causas de edema unilateral del nervio óptico no isquémico y RM craneal para descartar causas compresivas del nervio óptico y la asociación con enfermedad cerebral de pequeño vaso que apoye la causa vascular26. No existe un tratamiento de probada eficacia en la forma no arterítica de NOI. La actitud más extendida es la administración de tratamiento antiagregante y ácido acetilsalicílico 300 mg/ día por vía oral29.
Neuropatía óptica isquémica arterítica
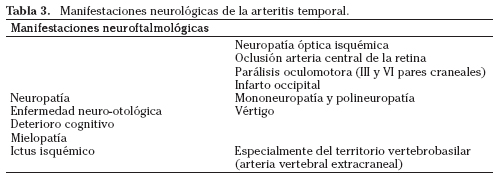
La neuropatía óptica isquémica arterítica constituye una de las manifestaciones más frecuentes de la arteritis temporal (AT), generalmente en mayores de 60 años (Tabla 3). En cerca del 25% de los pacientes, es aislada sin síntomas sistémicos o signos sugerentes de enfermedad sistémica. Episodios previos de alteración visual uni o binocular, fotopsias y diplopia deben hacer pensar en esta causa. De la misma forma, una afectación bilateral de forma consecutiva debe hacer sospechar una AT. El hallazgo de isquemia coroidea o retiniana junto a la NOI es también sugestiva de arteritis de células gigantes. En su sospecha además de los estudios analíticos y diagnóstico requeridos, debe instaurarse sin retraso el tratamiento esteroideo con realización de la biopsia de la arteria temporal tan pronto como sea posible. Existe alguna evidencia para sugerir que el tratamiento con esteroides a dosis altas por vía venosa en pacientes con pérdida visual puede proteger de la afectación contralateral además de revertir parte del daño provocado inicialmente. La pauta utilizada es 1g/día de metilprednisolona intravenosa (en una o cuatro dosis) durante 3-5 días. Esta pauta va seguida de 1g/kg/día de prednisona por vía oral, que se debe mantener mientras persistan síntomas sistémicos o se normalice la VSG, con las reducciones controladas durante 6-12 meses26,29,30.
Oclusión de la arteria central de la retina
La obstrucción de arteria central de la retina (OACR) es uno de los eventos más súbitos y dramáticos que se pueden encontrar en la práctica clínica oftalmológica. En la mayoría de los casos la OACR se produce por formación de trombos próximos a la lámina cribosa, siendo la arteriosclerosis el factor precipitante más frecuente en estos casos. No obstante, entre el 20 y 25% de las OACR son producidas por émbolos visibles. Los fenómenos de oclusión vascular retiniana pueden ser la primera manifestación de una enfermedad sistémica con una morbimortalidad importante. Su etiología va a ser variable dependiendo del grupo de edad y del contexto clínico.
Lo más habitual es su presentación en pacientes de edad avanzada con aterosclerosis, hipertensión y enfermedad carotídea, o en pacientes con cardiopatías. En muchos de estos casos se puede identificar una afectación de la arteria carótida ipsilateral, pero también pueden encontrarse OACR en el contexto de algunas patologías cardíacas como valvulopatías (por ejemplo, la fiebre reumática), mixomas cardíacos, trombos murales, arritmias, endocarditis bacterianas subagudas, y defectos septales, como la persistencia del foramen oval. De nuevo resulta importante descartar una AT30,31. La obstrucción de la arteria central de la retina aparece generalmente en pacientes que se encuentran en la quinta o sexta década de la vida, y aunque el rango de edad en que suele presentarse es muy amplio, sólo en menos del 10% de los casos se presenta en pacientes con edad inferior a los 30 años32,33. No obstante, cuando se presenta en pacientes de 30 años o menos, tiende a estar asociada a migraña, trastornos de la coagulación (síndrome antifosfolípido), homocistinuria, alteraciones intraoculares y traumatismos33.
La OACR conlleva una pérdida aguda severa y permanente de la visión, debido a la afectación de las capas más internas de la retina, incluyendo las células ganglionares y sus fibras nerviosas. Además de un defecto pupilar aferente relativo o total, el fondo de ojo muestra la palidez isquémica de las porciones más internas de la retina con respeto de la circulación coroidea dando el clásico aspecto de la mancha rojo-cereza. En el fondo de ojo, la retina se hace opaca, blanquecina y edematosa, impidiendo que se transparente la coroides a su través, excepto en la región foveolar, donde al ser la retina más fina, se puede observar la típica mancha rojo cereza, que no es patognomónica de esta enfermedad.
Isquemia ocular crónica
Es menos frecuente que el trastorno ocular transitorio por hipoperfusión. La hipoperfusión crónica con el síndrome de isquemia ocular crónica resulta típicamente de una hipoperfusión retiniana por estenosis u obstrucción de carótida extra o intracraneal. Oftalmoscópicamente los primeros signos que podemos apreciar son los correspondientes al inicio de la mal llamada retinopatía de éstasis de Kearns y Hollenhorst34 presentándose en fondo de ojo: edema muy leve de papila, ingurgitación venosa con irregularidad de calibre y hemorragias en punto y mancha en periferia media, mostrando en la angiofluoresceingrafía áreas de no perfusión capilal35. En esta fase suele estar respetado el polo posterior y la A.V. es frecuentemente normal.
Signos de hipoxia retiniana más intensa los constituyen la presencia de neovasos retinianos y papilares, continuándose con la aparición de un síndrome de isquemia del polo anterior que se manifestaría con la aparición de neovasos en iris, modificaciones de la presión intraocular, edema de córnea, uveítis, reacciones pupilares perezosas y congestión vascular epiescleral. En raras ocasiones el síndrome de isquemia ocular asociado a estenosis de carótida puede manifestarse como un síndrome de isquemia del polo anterior sin ninguna afectación del segmento posterior.
El conocimiento y diagnóstico precoz de esta patología puede ser fundamental para el pronóstico vital de estos pacientes, ya que puede ser predictiva de futuras complicaciones vasculares cerebrales. Un síndrome de glaucoma neovascular de etiología incierta, debe hacer sospechar una isquemia ocular crónica por estenosis carotídea como una de las patologías diagnósticas. La enfermedad de Takayasu puede ser una causa de isquemia crónica bilateral36.
Alteraciones de los reflejos pupilares
En un breve recuerdo anatómico, las fibras oculosimpáticas desde el hipotálamo descienden por el tronco cerebral a través de la sustancia gris periacueductal, se colocan más lateralmente, hasta la médula espinal, en la denominada columna intermedio lateral C8-T1. Desde la columna intermedio lateral salen hacia el ganglio cervical superior, (GCS) justo en el ápex pulmonar, entre la arteria carótida interna y la vena yugular. La tercera neurona se sitúa en el GCS desde donde salen las fibras que van hacia la arteria carótida interna. Las fibras del dilatador del iris discurren con la arteria carótida interna y la primera rama del trigémino. Las fibras de la sudoración facial viajan sobre todo con la arteria carótida externa, excepto las destinadas a la primera rama del V que lo hacen con la arteria carótida interna37,38.
En las lesiones retinianas o del nervio óptico se produce un defecto pupilar aferente, pupila de Marcus Gunn, con pérdida del reflejo consensuado en el otro ojo por defecto aferente; sin embargo, si el estímulo se aplica en el ojo sano sí se produce reflejo consensuado en el amaurótico. El síndrome de Horner (miosis, ptosis y enoftlamos con reflejos pupilares normales) puede deberse a una lesión en cualquier punto de la vía simpática. El patrón de sudoración facial puede orientar acerca de la localización de la lesión, de forma que en presencia de anhidrosis de la mitad superior de la cara se debe pensar en una lesión posganglionar, distal a la bifurcación carotídea (recuérdese que las fibras sudomotoras de la mitad inferior de la cara viajan con la carótida interna y sus ramas), mientras que si la anhidrosis afecta a toda la cara, la lesión estaría localizada a nivel preganglionar, o en la neurona central de primer orden38.
El síndrome de Horner es característico de los infartos bulbares laterales en los que se afectan las vías simpáticas centrales. El síndrome de Wallenberg se presenta acompañado de un amplio abanico de manifestaciones clínicas: ataxia, disfagia, vértigo, parestesias, disfonía, dolor facial, hipo, visión borrosa, diplopia, nistagmus, náuseas, vómitos y ataxia39,40.
Las alteraciones pupilares producidas por lesiones centrales se acompañan de los síntomas y signos que configuran el cuadro clínico en función de la localización anatómica de la lesión. Por ejemplo, las lesiones mesencefálicas afectando al III par craneal se acompañan de pupilas de tamaño medio o midriáticas, arreactivas, con paresia de rectos inferior medio y superior (a veces este último bilateral), probable paresia de la mirada conjugada vertical, abolición de reflejos oculocefálicos verticales y datos de afectación de vías largas, con signos en el hemicuerpo contralateral. Puede encontrarse un síndrome de Horner en la oclusión carotídea ipsilateral. En lesiones pontinas extensas, fundamentalmente en hemorragias o en la trombosis de la arteria basilar, las pupilas son puntiformes y con frecuencia se acompañan de nistagmus vertical23.
La disección de las arterias cervicales y cerebrales hasta hace poco tiempo era considerada una causa extremadamente rara de infarto cerebral. La incidencia anual de la disección espontánea sintomática de la arteria carótida interna es de 2,6-2,9/100.000. En los últimos años se han publicado numerosos trabajos presentando a las disecciones como una causa importante de isquemia cerebral particularmente en gente joven. La disección ocurre cuando tiene lugar una ruptura interna de la pared arterial ocupándose este espacio por sangre que avanza a lo largo del vaso ocasionando una reducción de la luz y, a menudo, una dilatación arterial aneurismática. Con el progreso en las técnicas de exploración de neuroimagen (ATC y ARM) y el desarrollo de la neurosonología, se han ido reconociendo un amplio espectro de manifestaciones clínicas41-42.
Las disecciones arteriales suelen ocurrir espontáneamente, aunque a menudo junto a diversos factores predisponentes se recoge en la anamnesis el antecedente de un traumatismo trivial o un ejercicio físico intenso. Sus manifestaciones clínicas e historia natural diferirán según se trate de disecciones intracraneales o afecten al territorio carotídeo o vértebro-basilar. Estas diferencias abarcan aspectos fisiopatológicos y terapéuticos por lo que serán descritas por separado cada una de ellas. Varias arteriopatías primarias, se han relacionado con la presentación de disecciones arteriales cervicales, enfermedades del tejido conectivo como Ehlers Danlos, Síndrome de Marfan, pseudoxantoma elástico, enfermedad poliquística y la deficiencia de la alfa-1 antitripsina. En otros casos el estudio patológico del vaso demuestra una necrosis segmentaria de la capa media. La displasia fibromuscular se ha demostrado con angiografía en un 10 a 20% de los casos43,44.
Los síntomas de isquemia focal: AIT, escotomas centelleantes y déficits completos pueden presentarse con un intervalo libre de horas o semanas a la instauración del dolor. Esta última circunstancia debe tenerse siempre en consideración a la hora de la anamnesis, procurando ser exhaustivos en la búsqueda de un antecedente de traumatismo banal o maniobra cervical intempestiva que pudiera actuar como factor coadyuvante.
Es relativamente frecuente que las manifestaciones clínicas queden limitadas a la presentación de dolor de cuello, cara o cabeza asociado a un síndrome de Horner homolateral sin síntomas de isquemia cerebral, planteándose el diagnóstico diferencial con una cefalea agrupada, o una variante de migraña (Fig. 2). Algunos autores creen que las disecciones de la ACI que ocasionan un alto grado de estenosis y/o oclusión tienden a producir con más frecuencia alteraciones intracraneales y por tanto eventos isquémicos cerebrales o retinianos. Por el contrario, las lesiones sin estenosis suelen ocasionar más signos y síntomas locales44.
La parálisis oculomotora es rara en la disección arterial y se describe con participación del III, IV y VI pares de nervios craneales de forma aislada. La combinación de síntomas y signos de isquemia cerebral con participación de los pares craneales puede confundir con un síndrome de isquemia vertebrobasilar45. El mecanismo invocado en los casos de lesión de pares craneales inicialmente fue la compresión y/o tracción de estas estructuras por la dilatación sacular o el aneurisma durante su trayecto cervical en el espacio retroparotídeo y retro-estiloideo. Sin embargo, este mecanismo no puede admitirse en los casos en los que no se observa dilatación sacular arterial, y resulta difícil plantearlo en presencia de afectación oculomotora. El mecanismo más plausible parece ser el compromiso isquémico, embólico o hemodinámico o el origen anómalo de los vasos nutrientes de los nervios craneales. Baste recordar la suplencia a pares craneales de ramas de la a. carótida interna: tronco infero-lateral (III, IV, VI y V1), meníngeo medio (VII, V2, V3) y faríngeo ascendente (IX a XII). La parálisis del VI par craneal se ha descrito con la extensión de la disección hacia la porción intracavernosa de la carótida46.
La disección de la arteria vertebral predomina en mujeres, y en la mayoría ocurre alrededor de los 40 años. El cuadro clínico suele comenzar con dolor cráneo-cervical severo, brusco, uni o bilateral en 2/3 de los casos, seguido de signos y síntomas de isquemia en el territorio vértebro-basilar. El intervalo medio entre la aparición del dolor y los síntomas focales es de dos semanas. El síndrome de Wallenberg es el cuadro clínico más frecuente y en segundo lugar, la afectación talámica y cerebelosa45.
La hemorragia subaracnoidea (HSA) es la extravasación de sangre en el espacio subaracnoideo. Es la cuarta causa de enfermedad cerebrovascular tras la aterotrombosis, embolismo cerebral y hemorragia intracerebral. La rotura de un aneurisma constituye la causa más frecuente de HSA espontánea (75-80%). La cefalea es el síntoma más frecuente (85-95%). Un 1/3 de los casos (20 al 40%) experimentarán cefalea previa, horas o días antes, de menor intensidad. Desde el punto de vista oftlamológico merece ser destacada la hemorragia subhialoidea y del espacio prerretiniano, que se ven como áreas rojas y brillantes que descansan en la superficie retiniana adyacente al disco (Fig. 3). La extensión de la hemorragia subhialoidea dentro del vítreo se conoce como síndrome de Tearson y puede asociarse a pérdida de la agudeza visual. El aneurisma de la arteria comunicante posterior puede comprimir el III par craneal y producir malestar retroorbitario, dilatación pupilar (precoz), ptosis y déficit oculomotor; la rotura del aneurisma sigue en pocas horas o días. El reconocimiento de estos signos premonitorios, tanto de sangrado como de crecimiento, son fundamentales para reducir la morbimortalidad de la HSA.
Alteraciones de la motilidad ocular. Parálisis de la mirada conjugada
Los cuatro tipos de movimientos oculares conjugados son sacadas, movimientos de seguimiento, reflejos oculovestibulares y nistagmo optocinético. Los dos primeros son movimientos voluntarios y los dos últimos son involuntarios. Las sacadas son movimientos rápidos destinados a refijar las dos fóveas en un nuevo objetivo. Pueden ser voluntarias, reflejas y espontáneas. El principal control cortical de las sacadas horizontales y de un modo especial las voluntarias, depende de los campos oculares frontales de cada uno de los hemisferios, situados en la porción posterior de la segunda circunvolución precentral (área 6 ó 8 de Broadmann). Con conexiones en otras áreas frontales envían fibras supranucleares que se cruzan a nivel de los núcleos oculomotor y troclear para llegar a la formación reticular pontina paramediana contralateral y de ahí al núcleo del VI par craneal ipsilateral. Los movimientos de seguimiento son controlados por áreas corticales cercanas a la unión occipitoparieto-temporal (áreas 20, 38 y 40 de Brodmann)47,48. Las principales estructuras encargadas de la mirada vertical están en mesencéfalo, a nivel del prectectum.
En las lesiones unilaterales hemisféricas con afectación frontal producen alteración de las sacadas contralaterales y la mirada puede estar desviada hacia el lado de la lesión. Es frecuente la coexistencia de una desviación cefálica. Este hallazgo es temporal, en la fase aguda independientemente de la etiología isquémica o hemorrágica. Aunque la disfunción selectiva de áreas que controlan los movimientos oculares y la atención espacial pueden producir desviación forzada de la mirada, en el ictus agudo en la mayoría de los casos es indicador de la extensión de la lesión afectando a estructuras corticales y subcorticales48.
En la hemorragia talámica, tálamo medial, y excepcionalmente en las lobares, puede observarse una desviación forzada de la mirada hacia el lado contrario a la lesión, denominada wrong way eyes49. Los mecanismos involucrados son la compresión a nivel mesencefálico de las conexiones frontopontinas, o la disfunción de los núcleos intralaminares talámicos. También pueden producir alteraciones en la mirada vertical, infraversión forzada de la mirada y cambios pupilares con pupilas pequeñas.
Las lesiones vasculares del tronco cerebral con afectación bulbar paramediana cursan con nistagmus que bate hacia arriba y en ocasiones, es horizontal y evocado por la mirada. Lesiones de los núcleos vestibulares se asocian a nistagmus, que puede ser estrictamente horizontal, vertical o torsional.
En infartos o hemorragias unilaterales de tronco cerebral, especialmente de la protuberancia, que lesionen la formación reticular pontina paramediana o el VI par craneal se observa una paresia ipsilateral de la mirada, con preferencia de la mirada contralateral. En la vecindad del VI par se encuentra la formación reticular pontina (FRPP), o centro de la mirada conjugada lateral, que recibe aferencias contralaterales frontales. La lesión nuclear del VI par puede producir una parálisis ipsilateral de la mirada para los movimientos reflejos y voluntarios. En el caso de afectarse solamente la FRPP quedan comprometidos los movimientos voluntarios. En lesiones bilaterales del tegumento pontino afectando a los núcleos del VI y FRPP se produce una parálisis de todos los movimientos horizontales, quedando preservados los verticales. Puede ser la expresión de una extensa lesión cerebelosa con compresión del tronco.
En la oftalmoplejia internuclear unilateral hay una paresia de la aducción ipsilateral a la lesión. El segundo signo es el nistagmo de abducción en el ojo contralateral. Puede verse una desviación oblicua. Si la convergencia está preservada la lesión es caudal.
Síndrome del uno y medio
Se trata de la combinación de una parálisis de la mirada conjugada horizontal hacia el lado de la lesión y una oftlamoplejia internuclear ipsilateral. El único movimiento respetado es la abducción del ojo contralateral, por lo general expresión de una lesión pontina unilateral con participación del núcelo del VI par craneal y/o de la formación reticular pontina paramediana y del fascículo longitudinal del mismo lado 38.
Ocular bobbing
Este término fue acuñado por Fisher, quien lo observó en dos pacientes con trombosis basilar e infarto pontino extenso50. Consiste en movimientos pendulares intermitentes de los globos oculares, que se desplazan hacia abajo describiendo un arco de unos milímetros para volver después a la posición primaria. En lesiones pontinas extensas, al existir una parálisis de la mirada horizontal, estando conservados los movimientos verticales, se acentúa el vector vertical y aparecen los movimientos del péndulo hacia abajo. Por tanto, es lógico pensar que el bobbing aparecerá sólo en aquellas situaciones en las que exista afectación de la mirada horizontal y esté conservada la vertical.
Desviación oblicua de la mirada
En esta afectación, uno de los ojos se mantiene dirigido por encima del otro, tanto en posición primaria de la mirada como durante los desplazamientos. Carece de valor localizador. Guarda relación con lesiones asimétricas localizadas en los núcleos vestibulares, cerebelo, mesencéfalo rostral y región bulbar dorsolateral.
En lesiones mesencefálicas puede observarse de manera muy infrecuente una parálisis aislada de la infraversión. En lesiones vasculares tálamo-mesencefálicas unilaterales, en ocasiones aparece una monoparesia de la infraversión con paresia bilateral de la supraversión51 (Fig. 4). Las lesiones del mesencéfalo dorsal producen alteraciones de los movimientos oculares horizontales, especialmente las vergencias. El síndrome de Parinaud con paresia supranuclear de la supraversión, pupilas de tamaño medio-dilatadas con alteración del reflejo fotomotor, nistagmus convergencia-retracción y la retracción palpebral (Signo de Collier) es una manifestación de una lesión vascular cerebral con afectación mesencefálica.
Trastornos de la vía visual
Aproximadamente en el 70% de casos, las arterias cerebrales posteriores se originan del tronco basilar; en un 20-25% una lo hace de la carótida y la otra del tronco basilar y en el resto de casos ambas provienen del sistema carotídeo. Esta variabilidad anatómica puede justificar las múltiples expresiones clínicas que tiene este síndrome vascular. La oclusión ateromatosa de la ACP es rara, así como también el infarto completo, afectándose con mayor frecuencia ramas distales, especialmente la calcarina. El mecanismo más frecuente es el embólico. La oclusión de ramas témporo-occipitales determina alteraciones visuales y trastornos gnósicos. Se produce una hemianopsia homónima en un tercio de los casos de oclusión de la ACP, por afectación del córtex calcarino o estriado y/o de las fibras genículo-calcarinas. El trastorno campimétrico puede ser incompleto, afectando sólo a los cuadrantes superiores. Puede estar respetada la visión macular. En lesiones del hemisferio dominante la disnomia para colores y la afasia amnésica son más frecuentes que la dislexia sin agrafia. La negligencia visual puede ser la manifestación clínica de grandes infartos témporo-parietales derechos. No es raro observar perseveraciones visuales asociadas con hemianopsia24,39. La amnesia se observa asociada a lesiones mediales del lóbulo temporal izquierdo, incluyendo a menudo al hipocampo y la sustancia blanca adyacente. La afasia transcortical puede darse en grandes infartos de la región témporo-occipital posterior izquierda.
Un aspecto de interés extraordinario desde el punto de vista clínico lo constituyen los síndromes corticales bilaterales que pueden ocurrir como consecuencia de la oclusión completa de la porción superior del tronco basilar, especialmente si las comunicantes posteriores son incompetentes. Las lesiones occipitales bilaterales ocasionan ceguera cortical o hemianopsia homónima bilateral, asociada a alucinaciones visuales y anosognosia, amnesia y síndrome delirante. Si se afectan los polos occipitales puede apreciarse únicamente pérdida de visión central.
El síndrome de Balint se manifiesta con alteración de la atención espacial con asimultagnosia, ataxia óptica y dificultad para ejecutar movimientos bajo control visual y déficit de generar movimientos oculares hacia objetivos presentes en el campo visual, como una apraxia oculomotora, manteniéndose los movimientos oculares reflejos a estímulos vestibulares, auditivos y a estímulos visuales inesperados. Esta sintomatología es el resultado de infartos cerebrales calcarinos y parieto-occipitales bilaterales.
El síndrome de Antón es la situación de ceguera cortical y anosognosia de la misma en ausencia de demencia o confusión.
La prosopagnosia es un desorden que se caracteriza por la incapacidad de reconocer los rostros; resulta de lesiones bilaterales, pero la participación del hemisferio occipital derecho parece esencial para su desarrollo.
Trastorno de la percepción invertida o inclinada. La ilusión de la inversión de la imagen visual consiste en una percepción alterada de la situación de los objetos que se produce por rotaciones completas en los distintos planos del espacio. Es más frecuente en el plano vertical y sobre todo en la isquemia vertebrobasilar. El mecanismo fisiopatológico se produce por una disfunción de la corteza parietal posterior52.
No pocos pacientes que sufren un ictus presentan alteraciones visoespaciales con dificultad para percibir dibujos de objetos superpuestos y para identificar correctamente las agujas del reloj. Éstas se deben a lesiones parietooccipitales53. La alexia pura es incapacidad para leer estando preservadas la escritura y el dictado. Está alterada también la copia. La topografía lesional suele ser la paraventricular al asta occipital del ventrículo lateral izquierdo54. La agnosia visual se produce por lesiones bilaterales del sector subcalcarino. Las lesiones del lóbulo occipital inferior u occipitotemporales afectan a estructuras de la región ventral del córtex visual asociativo.
Fístula carótido-cavernosa
Es una comunicación anómala entre el seno cavernoso y la arteria carótida, con el paso de sangre arterial hacia el complejo venoso del seno cavernoso. Estas lesiones se localizan en la porción cavernosa de la carótida a nivel del segmento C4. Se produce exoftalmia que puede ser bilateral o unilateral, espontánea o traumática. Clínicamente se manifiesta con dolor ocular y cefalea. El paciente puede referir un ruido constante en la cabeza, a veces pulsátil, molestándole sobre todo para dormir; diplopia y en la exploración se observan exoftalmos, quemosis, inyección conjuntival, parálisis de VI par craneal que de continuar afectando la lesión puede conllevar a lesionar el III y IV55 (Fig. 5).
Apoplejía hipofisaria
Aunque es una entidad rara, es importante conocer que clínicamente cursa con un cuadro agudo muy similar al de la hemorragia subaracnoidea con frecuencia asociado a diplopia, parálisis oculomotora y disminución de la agudeza visual. El diagnóstico se realiza mediante TC o RM, siendo fundamental un alto índice de sospecha56.
Vasculopatías cerebro-retinianas
Síndrome de Susac
Es mucho más frecuente en mujeres y se caracteriza por la combinación de una microangiopatía cerebral y de retina con sordera neurosensorial. Su mecanismo es desconocido. La presencia de microinfartos cerebrales se manifiesta con una encefalopatía subaguda con trastorno de de la personalidad y episodios transitorios o persistentes de disfunción neurológica focal con tendencia a la remisión y recurrencia. Esta enfermedad se confunde con frecuencia con la esclerosis múltiple, pero en el síndrome de Susac no hay bandas oligoclonales57.
Enfermedad de Eales
Se trata de un raro trastorno esporádico que afecta fundamentalmente a jóvenes que desarrollan una perivasculitis venosa retiniana con hemorragias recurrentes bilaterales, retinianas y del vítreo. Se han descrito manifestaciones isquémicas cerebrales como expresión de la vasculitis cerebral y leptomeníngea58.
Síndrome de Cogan
Es una rara enfermedad que se manifiesta en adultos jóvenes y se caracteriza por una queratitis intersticial no luética junto a vértigo, acúfenos y sordera, que puede semejar un síndrome de Meniére. Existen síntomas sistémicos junto a la vasculitis que afecta a la aorta, y vasos de medio y pequeño tamaño, afectando en ocasiones al cerebro59.
Bibliografía
1. Bogousslavsky J, van Melle G, Regli F. The Lausanne Stroke Registry: An analysis of 1.000 consecutive patients with first stroke. Stroke 1988: 19; 1083-1092. [ Links ]
2. Arboix A, Oliveres M, Massons J, García-Eroles L, Bechich S, Targa C. Implicaciones clínicas y asistenciales de la aplicación durante 10 años de un registro de enfermedades cerebrovasculares. Análisis descriptivo de los últimos 1000 pacientes y comparativo con los 1.000 primeros pacientes. Med Clin (Barc) 1998; 111: 286-289. [ Links ]
3. Rosamond WD, Folsom AR, Chambless LE, Wang CH, McGovern PG, Howard G et al. Stroke incidence and survival among middle-aged adults: 9-year follow-up of the Atherosclerosis Risk in Communities (ARIC) cohort. Stroke 1999; 30 : 736-743. [ Links ]
4. Fuster V. Epidemia of cardiovascular disease and stroke: the three main challenges. Circulation 1999; 99: 1132-1137. [ Links ]
5. Instituto Nacional de Estadística. Defunciones según la causa de muerte 2004. www.ine.es, 30 Diciembre 2004. [ Links ]
6. Encuesta Nacional de Morbilidad Hospitalaria. INE 2005. http://www.ine.es/. [ Links ]
7. Mathers CD, Stein C, Fath DM et al (2002). Global Burden of Disease 2000: versión 2, methods and results. Discussion paper nº 50. World Health Organisation, Geneva. Home page:http://www3.who.int/whosis/discussion-papers. [ Links ]
8. Previsiones de cambio en la población. Organización Mundial de la Salud 2002. http://who.int/home-page/index.es.shtml. [ Links ]
9. Aymerich N, Zandio B, Martín M, Muruzábal J, Delgado G, Gállego J et al. Incidencia de Ictus y mortalidad precoz en la comarca de Pamplona. Neurología 2007: 22; Supl 9; 603. [ Links ]
10. Baker ML, Hand PJ, Wang JJ, Wong TY. Retinal signs and stroke: revisiting the link between the eye and brain. Stroke 2008; 39: 1371-1379. [ Links ]
11. Wong Ty, Klein R, Sharrett AR, Couper DJ, Klein BE, Liao DP et al for the ARIC Investigators Atherosclerosis Risk in Communities Study. Cerebral white matter lesions, retinopathy, and incident clinical stroke JAMA 2002; 288: 67-74. [ Links ]
12. Tien Yin Wong. Is retinal photography useful in measurement of stroke risk. Lancet Neurology 2004; 3: 179-183. [ Links ]
13. Mitchell P, Wang JJ, Wong TY, Smith W, Klein R, Leeder SR. Retinal microvascular signs and risk of stroke and stroke mortality. Neurology 2005; 65: 1005-1009. [ Links ]
14. Cooper SL, Wong TY, Klein R, Sharrett AR, Bryan RN, Hubbard LD et al. Retinal microvascular abnormalities and MRI-defined subclinical cerebral infarction: the atherosclerosis risk in communities study. Stroke 2006; 37: 82-86 [ Links ]
15. Gállego J, Martínez Vila E, Muñoz R. Patients at high risk for ischemic stroke: identification and actions. Cerebrovasc Dis 2007; 24 (Suppl 1): 49-63. [ Links ]
16. Ikram MK, De Jong FJ, Van Dijk EJ, Prins ND, Hofman A, Breteler MM, De Jong PT. Retinal vessel diameters and cerebral small vessel disease: the Rotterdam Scan study Brain 2006; 129: 182-188. [ Links ]
17. Kreis AJ, Nguyen T, Rogers S, Wang JJ, Harper CA, Clark DJ et al. Acute retinal arteriolar emboli after cardiac catheterization Stroke 2008; 39: 3086-3087. [ Links ]
18. Fisher CM. Transient ischemic attacks. N Engl J Med 2002; 347: 1642-1643. [ Links ]
19. Albers GW, Caplan LR, Easton JD, Fayad PB, Mohr JP, Saver JL et al. TIA Working Group. Transient ischemic attack-proposal for a new definition. N Engl J Med 2002; 21; 347: 1713-1716. [ Links ]
20. Lovett JK, Dennis MS, Sandercock PA, Bamford J, Warlow CP, Rothwell PM. Very early risk of stroke after a first transient ischemic attack. Stroke 2003; 34: 138-142. [ Links ]
21. Calleja S, Vega F, Zeidán N, Lahoz CH. Amaurosis fugaz inducida por la luz intensa. Neurologia 2006; 21: 159-161 [ Links ]
22. Benavente O, Eliasziw M, Streifler JY, Fox AJ, Barnett HJ, Meldrum H. North American Symptomatic Carotid Endarterectomy Trial Collaborators. Prognosis after transient monocular blindness associated with carotid-artery stenosis. N Engl J Med 2001; 345: 1084-1090. [ Links ]
23. Fisher CM. Late-life migraine accompaniments: Further experience. Stroke 1986; 17: 1033-1042. [ Links ]
24. Caplan LR. The posterior cerebral arteries (PCAs). Posterior Circulation Disease. Clinical Findings, Diagnosis and Management. Cambridge, Blackwell Science, 1996; 444-491. [ Links ]
25. Irimia P, Martinez Vila E. Transient blurred vision as the only manifestation of basilar stenosis. Cerebrovasc Dis 2004; 18: 88-89. [ Links ]
26. García R, Moreno Ramos T. Neuropatías ópticas: revisión sindrómica y etiológica. Neurol 2007; 3 Supl 8:16-26. [ Links ]
27. Mathews MK. Nonarteritic anterior ischemic optic neuropathy. Curr Opin Ophthalmol 2005; 16: 341-345. [ Links ]
28. Fry CL, Carter JE, Kanter MC, Tegeler CH, Tuley MR. Anterior ischemic optic neuropathy is not associated with carotid artery atherosclerosis. Stroke 1993; 24: 539-542. [ Links ]
29. Lin MC, Hsu FM, Sheu SJ. Nonarteritic ischemic optic neuropathy. J Chin Med Assoc 2007; 70: 61-64. [ Links ]
30. Gonzalez-Gay MA, Miranda-Filloy JA, Lopez-Diaz MJ, Perez-Alvarez R, Gonzalez-Juanatey C, Sanchez-Andrade A et al. Giant cell arteritis in northwestern Spain: a 25-year epidemiologic study. Medicine (Baltimore) 2007; 86: 61-68. [ Links ]
31. Taylor-Gjevre R, Vo M, Shukla D, Resch L. Temporal artery biopsy for giant cell arteritis J Rheumatol 2005; 32: 1279-1282. [ Links ]
32. Ahuja RM, Chaturvedi S, Eliott D, Joshi N, Puklin JE, Abrams GW. Mechanisms of retinal arterial occlusive disease in African American and Caucasian patients. Stroke 1999; 30: 1506-1509. [ Links ]
33. Disorders of Vision. Continuum: Lifelong Learning in Neurology. Neuro-ophthalmology Update 2003, 9:11-78. [ Links ]
34. Chawluk JB, Kushner MJ, Bank WJ, Silver FL, Jamieson PG, Bosley TM et al. Atherosclerotic carotid artery disease in patients with retinal ischemic syndromes. Neurology 1988; 38: 858-863. [ Links ]
35. Carter JE. Chronic ocular ischemia and carotid vascular disease. Stroke 1985; 16: 721-728. [ Links ]
36. Worrall M, Atebara N, Meredith T, Mann ES. Bilateral ocular ischemic syndrome in Takayasu disease. Retina 2001; 21: 75-76. [ Links ]
37. Ezpeleta D. Trastornos pupilares eferentes. Neurol Supl 2007; 3: 342-348. [ Links ]
38. Brazis PW, Masdeu JC, Biller J. eds. Ocular motor system. Localization in Clinical Neurology. Fourth edition Lippncott Williams Wilkins 2001: 171-270. [ Links ]
39. Caplan LR, Wityk RJ, Glass TA, Tapia J, Pazdera L, Chang HM et al. New England Medical Center Posterior Circulation registry. Ann Neurol 2004; 56: 389-398. [ Links ]
40. Nowak DA, Topka HR. The clinical variability of Wallenbergs syndrome. The anatomical correlate of ipsilateral axial lateropulsion. J Neurol 2006; 253: 507-511. [ Links ]
41. Schievink WI. Spontaneous dissection of the carotid and vertebral arteries. N Engl J Med 2001; 344; 898-906. [ Links ]
42. Brandt T, Orberk E, Hacke W. Cervical artery dissection syndromes. Ed. Julien Bogousslavsky and Louis Caplan. Stroke Syndromes 2 ed, Cambridge 2001: 660-666. [ Links ]
43. Brandt Th, Gisnbach CP. Spontaneous cervical artery dissection: from risk factors toward pathogenesis. Stroke 2002: 33: 657-658. [ Links ]
44. Baumgartner RW, Arnold M, Baumgartner I, Mosso M, Gönner F, Studer A et al. Carotid dissection with and without ischemic events Local symptoms and cerebral artery findings. Neurology 2001; 57: 827-832. [ Links ]
45. Caplan LR. Dissections of brain-supplying arteries. Nat Clin Pract Neurol 2008; 4: 34-42. [ Links ]
46. Caplan LR, Biousse V. Cervicocranial arterial dissections. J Neuroophthalmol 2004; 24: 299-305. [ Links ]
47. Morrow MJ, Sharpe JA. Cerebral hemispheric localization of smooth pursuit asymmetry. Neurology 1990; 40: 284-292. [ Links ]
48. Deseillingny Ch P. Eye movement abnormalities. Stroke Syndromes 2nd Edition Edited by Julien Bogousslavsky, Louis R. Caplan Eds. Cambrigde 2001; 76-86. [ Links ]
49. Messe SR, Cucchiara BL. Wrong-way eyes with thalamic hemorrhage Neurology 2003; 60: 1524. [ Links ]
50. Fisher CM. Ocular bobbing. Arch Neurol 1961; 11: 543-549. [ Links ]
51. Ajuria I, Gállego J, Erro ME. Obnubilación y parálisis de la mirada vertical secundarias a infarto talámico bilateral. Neurología 2004; 19: 272. [ Links ]
52. López Domínguez JM, Rocas-Marcos I, Sanz Fernández G, Díaz Espejo C. Ilusión de inversión de la imagen visual: una manifestación excepcional de aura migrañosa. Neurologia 2007; 22: 58-60. [ Links ]
53. Kertsez A. Localization in neuropsychology. Academic Press New York, 1994. [ Links ]
54. Damasio AR, Geschwind N. Anatomic localization in clinical neuropsychology. En: Fredericks JAM (Ed) Handbook of Clinical Neurology vol 1 (45): Clinical Neuropsychology Elseiver Amsterdam 1985: 7-22. [ Links ]
55. Bhatti MT. Orbital syndromes. Semin Neurol 2007; 27: 269-287. [ Links ]
56. Berthelot JL, Rey A. Pituitary apoplexy. Presse Med 1995; 24: 501-513. [ Links ]
57. Magariños Losada M del M, Correra García E, Orizaola P, Maciñeiras Montero JL. Susac syndrome. Differential diagnosis Med Clin (Barc) 2004; 123: 558-559. [ Links ]
58. Jiménez PE, Marsal C, Velázquez JM, Álvarez A. Eales disease with bilateral brain strokes and jaw-closing dystonia Neurologia 2003; 18: 750-753. [ Links ]
59. Bicknell JM, Holland JV. Neurologic manifestations of Cogan syndrome. Neurology 1978; 28: 278-281. [ Links ]
60. Jen J, Cohen AH, Yue Q, Stout JT, Vinters HV, Nelson S, Baloh RW. Hereditary endotheliopathy with retinopathy, nephropathy, and stroke (HERNS). Neurology 1997; 49: 1322-1330. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Jaime Gállego Culleré
Servicio de Neurología. Unidad de Ictus
Hospital de Navarra
Irunlarrea, 3
31008 Pamplona
E-mail: jgallegoc@meditex.es