Meu SciELO
Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Anales del Sistema Sanitario de Navarra
versão impressa ISSN 1137-6627
Anales Sis San Navarra vol.32 supl.2 Pamplona 2009
Descripción de equipos de última generación en radioterapia externa
Description of latest generation equipment in external radiotherapy
S. Pellejero, S. Lozares, F. Mañeru
Servicio de Radiofísica y Protección Radiológica. Hospital de Navarra. Pamplona.
Dirección para correspondencia
RESUMEN
Tanto los sistemas de planificación como la forma de administración de los tratamientos radioterápicos han cambiado radicalmente desde la introducción de la planificación tridimensional 3D. En la actualidad la planificación de los tratamientos basada en imágenes de tomografía axial computarizada (TAC) es el estándar de los servicios de radioterapia. En los últimos años los aceleradores lineales para uso médico, han incorporando tecnología capaz de administrar haces de tratamiento de intensidad modulada, IMRT. Con esta modalidad se generan distribuciones de dosis altamente conformadas que se ajustan a la forma tridimensional del volumen blanco, proporcionando una cobertura adecuada y una menor dosis a los órganos de riesgo cercanos.
El uso de la IMRT rápidamente se está extendiendo entre los centros de radioterapia de todo el mundo. Este creciente uso de la IMRT ha focalizado la atención en la necesidad de un mayor control de las incertidumbres geométricas en el posicionamiento del paciente y un control de los movimientos internos, por ello se han incorporado a los equipos de tratamiento sistemas de imagen tanto planar como volumétrica, que posibilitan una radioterapia guiada por la imagen, IGRT. En este trabajo se presenta una breve descripción de los últimos avances incorporados a la planificación y administración del tratamiento radioterápico.
Palabras clave: Radioterapia con intensidad modulada (IMRT). Tomoterapia. Cyberknife. Planificación inversa. Radioterapia guiada por la imagen (IGRT).
ABSTRACT
Both the planning systems and the form of administering radiotherapy have changed radically since the introduction of 3D planning. At present treatment planning based on computerised axial tomography (CAT) images is standard practice in radiotherapy services. In recent years lineal accelerators for medical use have incorporated technology capable of administering intensity modulated radiation beams (IMRT). With this mode distributions of conformed doses are generated that adjust to the three dimensional form of the white volume, providing appropriate coverage and a lower dose to nearby risk organs.
The use of IMRT is rapidly spreading amongst radiotherapy centres throughout the world. This growing use of IMRT has focused attention on the need for greater control of the geometric uncertainties in positioning the patient and control of internal movements. To this end, both flat and volumetric image systems have been incorporated into the treatment equipment, making image-guided radiotherapy (IGRT) possible. This article offers a brief description of the latest advances included in the planning and administration of radiotherapy treatment.
Key words: Intensity modulated radiotherapy (IMRT). Tomotherapy. Cyberknife. Inverse planning. Image-guided radiotherapy (IGRT).
Introducción
El origen de la radioterapia surge al poco tiempo de dos importantes hitos en la historia de la física, el descubrimiento de los RX y de la radiactividad en la década de los años 1890. A partir de ese momento y hasta nuestros días las radiaciones ionizantes están siendo utilizadas en el tratamiento del cáncer. Con el tiempo se han ido incorporando diferentes avances tecnológicos que hacen de la radioterapia actual una técnica de tratamiento altamente sofisticada.
Desde su origen, la colaboración entre la física y la medicina ha sido fundamental para el desarrollo y evolución de la radioterapia, no tan sólo en el día a día del tratamiento, en el que los radiofísicos se encargan de la parte más cuantitativa del procedimiento y los oncólogos de la visión clínica de la radioterapia, sino también en el desarrollo de nuevas tecnologías, que permiten una continua evolución en la administración y planificación de los tratamientos radioterápicos.
Los aceleradores lineales de electrones, Linac (Fig. 1), son actualmente el equipamiento básico de la mayoría de los centros de radioterapia. Son máquinas tecnológicamente sofisticadas controladas por ordenador, que proporcionan haces de electrones y de RX de alta energía; el rango clínico va desde unos pocos MeV (mega electronvoltios) hasta la veintena de MeV. Entre los accesorios con los que vienen equipados destacan el colimador multiláminas, MLC, que se usa para colimar el haz de radiación a formas irregulares y consiste en dos carros opuestos de láminas en los que cada lámina se puede mover independientemente. Otro accesorio destacable es el detector electrónico de imagen portal (EPID), usado para obtener imágenes digitales de los campos de tratamiento.
Los haces de electrones tienen un alcance de unos pocos centímetros en el interior del paciente y sólo se utilizan en el tratamiento de tumores superficiales y en técnicas intraoperatorias.
Los haces de fotones de RX de alta energía es la radiación más utilizada en radioterapia externa. Uno o varios haces son dirigidos desde el exterior hacia la zona del paciente que queremos tratar: en su trayectoria van interaccionando con las células de los diferentes tejidos u órganos que atraviesan. Para cuantificar la interacción y valorar el daño ocasionado a las células, tanto tumorales como sanas, empleamos la magnitud dosimétrica de la dosis absorbida.
El objetivo de la radioterapia es irradiar con dosis suficientemente altas el volumen tumoral como para conseguir su control manteniendo en niveles aceptables las dosis a los tejidos sanos que inevitablemente se irradian tanto alrededor del volumen tumoral como a la entrada y salida de los haces de tratamiento. La introducción de cualquier avance tecnológico que potencie este objetivo supondrá un nuevo paso para la radioterapia.
En este trabajo se describe el estado actual tanto del equipamiento como de las técnicas de administración de tratamiento y de las últimas innovaciones en el campo de la radioterapia externa.
Radioterapia conformada tridimensional, 3D-CRT
Un avance tecnológico, que supuso un cambio radical en la radioterapia, fue la incorporación de los ordenadores y las herramientas informáticas a la radioterapia allá por los años 1980 y 19901, posibilitando la obtención y transferencia de imágenes médicas digitales y el desarrollo de potentes sistemas de planificación de tratamiento radioterápico, de tal manera que posibilitó la transición de una radioterapia 2D basada en placas de RX a una radioterapia en 3D basada en imágenes volumétricas de tomografia computarizada,TC.
Se realiza una adquisición de datos anatómicos del paciente. Esta información se obtiene mediante un estudio de tomografía computarizada (TC) realizado en la posición de tratamiento y adicionalmente se puede realizar fusión con otras modalidades de imagen como pueden ser la resonancia magnética (RM) o la tomografía por emisión de positrones (PET).
En los sistemas de planificación se delimitan los volúmenes blanco, la extensión palpable o visible del tumor maligno, que constituye el Volumen de Tumor Macroscópico2,3 (GTV, Gross Target Volume), el GTV y un margen local de enfermedad subclínica constituyen un Volumen Blanco Clínico (CTV, Clinical Target Volume). Se definen también los órganos de Riesgo (OAR, Organ at Risk), que son tejidos normales cuya sensibilidad a la radiación y su localización en la vecindad del CTV podrían influir significativamente en la planificación o el nivel de dosis absorbida que se empleará.
Con esta información se genera una representación 3D de los volúmenes del paciente y se realiza una planificación del tratamiento adaptado a cada caso, seleccionando diferentes parámetros como son el número de haces, su ángulo de incidencia, su apertura, energía, etc. Esta forma de planificar se denomina planificación directa, ya que el usuario elige todos los parámetros del tratamiento y luego calcula la distribución de dosis y decide si es aceptable o no.
La 3D-CRT se ha convertido en el estándar del tratamiento radioterápico, sin embargo, cada vez más, se están introduciendo técnicas más complejas que permiten alcanzar distribuciones de dosis adaptadas al tumor con un mayor control y precisión en el posicionamiento del paciente y en la administración de las dosis. Estas nuevas modalidades son la radioterapia con intensidad modulada y la radioterapia guiada por la imagen.
Radioterapia con modulación de intensidad (IMRT)
Aunque se empezó a desarrollar hace tiempo, uno de los primeros artículos en el que se introducen los conceptos de intensidad modulada y planificación inversa es de Brahme y col4 en 1982. No obstante, es en estos últimos años cuando los tratamientos con intensidad modulada se han extendido entre los servicios de radioterapia.
La IMRT permite generar distribuciones de dosis ajustadas a la forma tridimensional del tumor mediante la modulación o control de la intensidad de los haces de radiación. Al mismo tiempo se logra disminuir la exposición a dosis altas de los órganos críticos cercanos, consiguiendo una menor toxicidad en el tratamiento que en ocasiones puede permitir un incremento en las dosis aplicadas al volumen blanco para conseguir una mayor probabilidad de control tumoral, lo que se conoce como escalada de dosis.
La planificación de los tratamientos con IMRT se realizan mediante objetivos de dosis, se establecen dosis mínimas y máximas admisibles en el volumen blanco de tratamiento, restricciones de dosis para los diferentes órganos de riesgo, se prioriza la consecución de unos u otros objetivos y se inicia un cálculo iterativo hasta conseguir el plan óptimo de tratamiento. A esta forma de cálculo se le denomina planificación inversa.
El desarrollo en la fiabilidad y precisión de los algoritmos de planificación inversa5 ha sido determinante para lograr la implementación clínica de las técnicas de IMRT. Son estos sistemas de planificación los que calculan la modulación necesaria en los haces de tratamiento para conseguir las distribuciones de dosis que mejor se adaptan a los objetivos de cálculo. Posteriormente, los equipos de tratamiento deberán ser capaces de modular la intensidad calculada y de administrarla correctamente. Es un proceso complejo que requiere un programa minucioso de aseguramiento de la calidad.
IMRT con campos de ángulos fijos
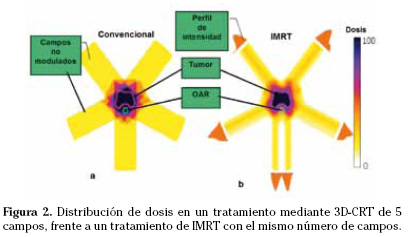
A pesar de que los primeros trabajos sobre IMRT fueron sobre la técnica rotacional4, la IMRT con campos de ángulos fijos es ahora la modalidad de IMRT más utilizada. Ésta se implementó clínicamente por primera vez en 19956,7 (Fig. 2). Esta técnica utiliza aceleradores convencionales dotados de colimador multiláminas (MLC). Usando varios haces con intensidad modulada desde ángulos fijos, sin giro, se pueden generar distribuciones de dosis altamente conformadas. Cada uno de los haces de los que consta el tratamiento se divide en subhaces o segmentos; la intensidad de cada segmento se ajusta individualmente hasta conseguir la fluencia de dosis planificada. Existen dos modalidades para conseguir modular la fluencia de un haz de RX mediante un colimador multiláminas: una es la basada en múltiples segmentos estáticos, también llamada step-and-shoot, que mediante una superposición de sub-campos o segmentos estáticos -sin radiación entre segmento y segmento-, consigue crear la fluencia planificada, y la otra es la técnica de multiláminas dinámico (dMLC), en la que durante la irradiación las láminas se mueven, realizan un barrido unidireccional desde un lado del campo hasta el opuesto, a velocidades y distancias entre láminas variables, consiguiendo crear la fluencia planificada. En general se requiere de tiempos de radiación más largos que en 3D-CRT.
Tomoterapia
La tomoterapia es una técnica de tratamiento rotacional, en la que se administra la radiación usando un haz estrecho en forma de abanico, fan-beam, que gira alrededor del paciente y su intensidad se modula de manera diferente para diferentes intervalos angulares (Fig. 3).
Tomoterapia axial
Mark Carol, fundador de NOMOS Corporation (North America Scientific, Chatswoth, CA, USA) presentó el concepto de tomoterapia axial en el congreso de la Asociación Americana de Física Médica (AAPM) de 1992. Meses después, ese mismo año, presentó su primer prototipo8 y en 1994 ya estaba disponible comercialmente el MIMiC®. Se trataba de un dispositivo capaz de implementarse en cualquier acelerador convencional de cualquier fabricante. Básicamente consta de colimador multiláminas binario, compuesto de dos carros de 20 hojas de 1 cm de anchura en isocentro, en el que sus láminas sólo pueden estar en dos posiciones, posición de haz abierto o posición de haz cerrado, tapando o no la parte correspondiente del haz estrecho producido por el acelerador. La intensidad del haz en abanico se modula dependiendo del tiempo que cada hoja está dentro del campo. Durante la irradiación de cada arco, la mesa de tratamiento no se mueve. Un tratamiento completo consta de varios arcos en el que cada uno trata cortes contiguos del paciente hasta cubrir la longitud total del volumen de tratamiento. Actualmente el nombre comercial del equipo es nomosSTAT con el sistema de planificación inversa CORVUS.
Durante el periodo de 1992-1997 el uso del MIMiC fue dominante en la práctica clínica de la IMRT.
Tomoterapia helicoidal
Se comenzó a desarrollar en la Universidad de Wisconsin en el año 19939, el primer paciente se trató en el 2002, el equipo lo comercializa Tomotherapy Inc (Madison, WI, USA) con el nombre de TomoTherapy® Highly Integrated Adaptive Radiotherapy (HI-ART). Se puede describir como una combinación de un CT helicoidal con un acelerador lineal. Su diseño se aparta del de un acelerador convencional y nos recuerda más a un equipo de tomografía axial computarizada10,11, un gantry en forma de Donut y en su interior un acelerador lineal compacto que puede girar continuamente, y que genera un haz de RX de energía nominal de 6MV. El haz se colima en forma de abanico, su anchura puede ser de 1, 2`5 ó 5 cm; lateralmente la fluencia se puede modular mediante un colimador multiláminas binario, compuesto por 64 hojas de espesor nominal 6,25 mm en isocentro. Las hojas operan de manera binaria, es decir con dos posiciones, completamente abierto o completamente cerrado. La modulación de intensidad se consigue variando la fracción de tiempo en el que las diferentes hojas están abiertas. El acelerador irradia y gira a una velocidad constante mientras la mesa y paciente se desplazan longitudinalmente hasta completar la irradiación del volumen blanco.
CyberKnife
El sistema CyberKnife desarrollado por Accuray Inc. (Sunnyvale, CA, USA) inicialmente para aplicaciones de radiocirugía estereotáxica, es un sistema que consta de un acelerador compacto de 6MV montado en un brazo robotizado12-15, que permite unas posibilidades de movimiento mayores que las que tienen los aceleradores convencionales, pudiendo irradiar al volumen blanco casi desde cualquier dirección.
El sistema proporciona haces colimados circularmente, desde un diámetro de 5 mm hasta 60 mm, pero su fluencia no es modulada, sin embargo, puede conseguir distribuciones espaciales de dosis similares a los sistemas de IMRT como superposición de un gran número de haces estrechos, incidiendo desde un gran rango de posiciones y ángulos, que puede ser considerada como una IMRT espacial.
Intensidad modulada volumétrica en arcoterapia, VMAT
Se trata de aceleradores dotados de MLC capaces de realizar tratamientos rotacionales modificando continuamente tanto la apertura del haz, la velocidad de giro y la tasa de dosis. Se consiguen distribuciones de dosis conformadas en tiempos de tratamientos inferiores al de otras técnicas de IMRT. A diferencia de la tomoterapia en la que la irradiación se realiza corte a corte, con esta técnica -en una sola rotación- se trata el volumen blanco completamente, además puede utilizar arcos coplanares y no coplanares. Comercialmente están disponibles los sistemas Elekta VMAT (Elekta, Crawley, UK) y RapidArc (Varian Medical Systems, Palo Alto, Calif, USA).
Radioterapia guiada por la imagen (IGRT)
En la planificación de los tratamientos radioterápicos se deben añadir márgenes alrededor del CTV para asegurar una adecuada irradiación de los volúmenes tumorales. Se define el margen interno con el fin de tener en cuenta las variaciones en el tamaño, forma y posición del CTV. Se define también el margen de configuración (SM, Setup Margin) que se añade para tener en cuenta todas las incertidumbres en el posicionamiento haz/paciente. El Volumen Blanco Clínico expandido con estos márgenes constituye el Volumen Blanco de Planificación (PTV, Planning Target Volume).
Las nuevas técnicas de IMRT, en las que la dosis se conforma muy ajustada al PTV y podemos encontrar regiones de alto gradiente de dosis en la cercanía de órganos de riesgo, son mucho más sensibles a estas incertidumbres geométricas. Por otra parte, los tratamientos de IMRT suelen durar más tiempo, lo que hace más probable que el paciente se mueva a lo largo de una sesión de tratamiento.
Para paliar este problema, se han diseñado máquinas de tratamiento con sistemas de imagen integrados y de esta manera ha surgido la radioterapia guiada por la imagen, IGRT.
La hipótesis de la IGRT es la posibilidad de reducir los márgenes de configuración y poder realizar un manejo más preciso de los movimientos internos. La IGRT asociada con la IMRT puede posibilitar un incremento de dosis que consiga mejorar los objetivos clínicos de la radioterapia16-19; por otro lado, junto con elementos de inmovilización adecuados se puede facilitar el paso de radiocirugía craneal a radiocirugía extracraneal.
El concepto de radioterapia guiada por la imagen, se puede decir que es una evolución de lo que ya se venía utilizando, simuladores de RX, imágenes portales de los campos de tratamiento, sistemas de posicionamiento por ultrasonido etc.
Sin embargo, el desarrollo de equipos de tratamiento con imagen integrada, bien en el propio brazo del acelerador -On-Board Imaging (OBI)- o en la sala de tratamiento y de equipos con posibilidad de imagen volumétrica tridimensional de tejido blando, incluido el tumoral, ha resultado en el desarrollo de esta nueva técnica, la radioterapia guiada por la imagen.
Equipos con imagen integrada, IGRT
Existen equipos que integran imagen tomográfica de kilovoltaje mediante la técnica de reconstrucción llamada cone beam CT (CBCT), por ejemplo elekta Synergy (Elekta, Crawley, UK)y Trilogy (Varian Medical Systems, Palo Alto, Calif, USA), que montan un tubo de rayos X y un detector digital en brazos replegables como puede verse en la imagen (Fig. 4).
El equipo Tomotherapy HiArt dispone de imagen tomográfica de megavoltaje, el mismo acelerador que se utiliza para tratamiento puede emitir en modo de baja energía a unos 3,5MV de energía nominal y en este modo realizar una adquisición de imagen tomográficas.
Hay sistemas que usan proyecciones radiográficas biplanares, que consiguen con tubos de RX y detectores digitales situados en techo y suelo de la sala de tratamiento, por ejemplo el equipo CyberKnife o el sistema de radiocirugía NovalisTX ExacTrack de brainLAB.
Bibliografía
1. Nyströn H, Thwaites D. Physics and high-technology advances in radiotherapy: Are they still worth it? Radiother Oncol 2008; 86: 1-3. [ Links ]
2. Prescribing, Recording and Reporting Photon Beam Therapy (Report 50). ICRU Report No. 50, 1993 ICRU Reports. [ Links ]
3. Prescribing, Recording and Reporting Photon Beam Therapy (Report 62) (Supplement to ICRU Report 50), ICRU Report 62, 1999 ICRU Reports. [ Links ]
4. Brahme A, Roos E, Lax I. Solution of an integral equation encountered in rotation therapy. Phys Med Biol 1982; 27: 1221-1229 [ Links ]
5. Bortfeld T. Optimized planning using physical objectives and constraints. Semin Radiat Oncol 1999; 9: 20-34. [ Links ]
6. Ling CC, Burman C, Chui CS, Kutcher GJ, Leisbel SA, LoSassa T et al. Conformal radiation treatment of prostate cancer using inversely-planned intensity-modulated photon beams produced with dynamic multileaf collimation. Int J Radiat Oncol Biol Phys 1996; 35: 721-730. [ Links ]
7. Memorial Sloan-Kettering Cancer Center Staff: A Practical Guide to Intensity-Modulated Radiation Therapy. Madison, WI, Medi Phys Publishing, 2003. [ Links ]
8. Carol MP, Targovnik H, Campbell C, Bleier A, Strait J, Rosen B et al. An automatic 3D treatment planning and implementation system for optimised conformal therapy. En: Three-dimensional Treatment Planning. P. Minet (ed.). Geneva: WHO, 1993, pp.173-187. [ Links ]
9. Mackie TR, Holmes T, Swerdloff S, Reckwerdt P, Deasy JO, Yang J et al. Tomotherapy: A new concept for the delivery of dynamic conformal radiotherapy. Med Phys 1993; 20:1709-1719. [ Links ]
10. Kalender WA, Polacin A. Physical performance characteristics of spiral CT scanning. Med Phys 1991; 18: 910-915. [ Links ]
11. Mackie TR, Olivera GH, Kapatoes JM, Ruchala KJ, Balog JP, Tomé WA et al. Helical tomotherapy. En: Palta JR, Mackie TR (eds). Intensity-Modulated Radiation Therapy-The State of the Art. Madison, WI, Medi Phys Publishing, 2003, pp 247-284. [ Links ]
12. Adler JR, Chang SD, Murphy MJ, Doty J, Geis P, Hancock SL. The Cyberknife: a frameless robotic system for radiosurgery. Stereotact Funct Neurosurg 1997; 69: 124-128. [ Links ]
13. Adler JR, Murphy MJ, Chang SD, Hancock SL. Image-guided robotic radiosurgery. Neurosurgery 1999; 44:1299-1306. [ Links ]
14. Chang SD, Adler JR. Robotics and radiosurgery-The Cyberknife. Stereotact Funct Neurosurg 2001; 76: 204-208. [ Links ]
15. Kuo JS, Yu C, Petrovich Z, Apuzzo ML. The CyberKnife stereotactic radiosurgery system: Description, installation, and an initial evaluation of use and functionality. Neurosurgery 2003; 53: 1235-1239. [ Links ]
16. McKenzie AL, van Herk M, Mijnheer B. The width of margins in radiotherapy treatment plans. Phys Med Biol 2000; 45: 3341-3342. [ Links ]
17. Van Herk M. Errors and margins in radiotherapy. Semin Radiat Oncol 2004; 1: 52-64. [ Links ]
18. Guckenberger M, Meyer J, Wilbert J, Baier K, Sauer O, Flentje M. Precision of image guided radiotherapy (IGRT) in six degrees of freedom and limitations in clinical practice. Strahlenther Onkol 2007; 6: 307-313. [ Links ]
19. Polat B, Guenther I, Wilbert J, Goebel J, Sweeney RA, Flentje M et al. Intra-fractional uncertainties in image guided intensity modulated radiotherapy (IMRT) of prostate cancer. Strahlenther Onkol 2008; 12: 668-673. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Santiago Pellejero Pellejero
Servicio de Radiofísica y Protección Radiológica
Hospital de Navarra
Irunlarrea, 3
31008 Pamplona
Tfno. 848422217
E-mail: santiago.pellejero.pellejero@navarra.es