My SciELO
Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Anales del Sistema Sanitario de Navarra
Print version ISSN 1137-6627
Anales Sis San Navarra vol.32 suppl.3 Pamplona 2009
Métodos de procesamiento y análisis de señales electromiográficas
Electromyographic signal processing and analysis methods
L. Gila1, A. Malanda2, I. Rodríguez Carreño3, J. Rodríguez Falces2, J. Navallas2
1. Servicio de Neurofisiología Clínica. Hospital Virgen del Camino. Pamplona.
2. Departamento de Ingeniería Eléctrica y Electrónica. Escuela Técnica Superior de Ingenieros Industriales y de Telecomunicación. Universidad Pública de Navarra.
3. Departamento de Métodos Cuantitativos. Facultad de Ciencias Económicas y Empresariales. Universidad de Navarra.
Dirección para correspondencia
RESUMEN
La electromiografía clínica es una metodología de registro y análisis de la actividad bioeléctrica del músculo esquelético orientada al diagnóstico de las enfermedades neuromusculares. Las posibilidades de aplicación y el rendimiento diagnóstico de la electromiografía han evolucionado paralelamente al conocimiento de las propiedades de la energía eléctrica y al desarrollo de la tecnología eléctrica y electrónica. A mediados del siglo XX se introdujo el primer equipo comercial de electromiografía para uso médico basado en circuitos electrónicos analógicos. El desarrollo posterior de la tecnología digital ha permitido disponer de sistemas controlados por microprocesadores cada vez más fiables y potentes para captar, representar, almacenar, analizar y clasificar las señales mioeléctricas. Es esperable que el avance de las nuevas tecnologías de la información y la comunicación pueda conducir en un futuro próximo a la aplicación de desarrollos de inteligencia artificial que faciliten la clasificación automática de señales así como sistemas expertos de apoyo al diagnóstico electromiográfico.
Palabras clave. Electromiografía. Potencial de acción de unidad motora. Procesamiento de señal. Estudios neurofisiológicos.
ABSTRACT
Clinical electromyography is a methodology for recording and analysing the bioelectrical activity of the skeletal muscle tissue in order to diagnose neuromuscular pathology. The possibilities of application and the diagnostic performance of electromyography have evolved parallel to a growing understanding of the properties of electricity and the development of electrical and electronic technology. The first commercially available electromyography equipment for medical use was introduced in the middle of the 20th century. It was based on analog electronic circuits. The subsequent development of digital technology made available more powerful and accurate systems, controlled by microprocessors, for recording, displaying, storing, analysing, and classifying the myoelectric signals. In the near future, it is likely that advances in the new information and communication technologies could result in the application of artificial intelligence systems to the automatic classification of signals as well as expert systems for electromyographic diagnosis support.
Key words. Electromyography. Motor unit action potential. Signal processing. Neurophysiological studies.
Propiedades bioeléctricas del tejido muscular estriado
Los músculos estriados son los efectores de la motilidad voluntaria. Las fibras musculares (FMs) estriadas son células alargadas con bandas claras y oscuras alternantes (estriaciones) debidas a la disposición longitudinal y paralela de las proteínas contráctiles en su interior. La contracción se verifica por el deslizamiento de estas proteínas entre sí. El sistema nervioso central codifica el grado de contracción de las FMs según la frecuencia de impulsos nerviosos de las motoneuronas alfa, cuyos cuerpos se sitúan en las astas anteriores de la médula espinal. Los impulsos nerviosos son potenciales de acción (PAs) de las motoneuronas que se transmiten a las células musculares a lo largo de sus axones, las ramificaciones terminales de éstos y las uniones neuromusculares.
El conjunto que forma una motoneurona alfa y las FMs inervadas por ella se conoce como unidad motora (UM) y constituye la unidad anatómica y funcional del músculo. El número de FMs de la UM varía de unos músculos a otros: desde muy pocas en los músculos oculomotores, que requieren finos ajustes hasta varios centenares en los grandes músculos de las extremidades inferiores1.
Como en toda célula viva, entre ambos lados de la membrana de las FMs existe una diferencia de potencial eléctrico (potencial de membrana en reposo) de unos 90 mV, siendo el interior de la célula negativo respecto al exterior. Este potencial es el resultado de:
- La desigual distribución de cargas asociadas a iones (sodio, potasio, cloro, etc.), proteínas y otras moléculas presentes en los medios intra y extracelular.
- La diferente permeabilidad de la membrana a los distintos iones (alta para el potasio, baja para el sodio).
- La acción de la enzima ATPasa Na-K dependiente (la bomba de sodio-potasio), un sistema metabólico de extracción activa del sodio intracelular.
Una propiedad básica de las FMs y de las neuronas es la posibilidad de que el potencial de membrana, en determinadas circunstancias, cambie y se haga momentáneamente positivo en el interior. Esta inversión del potencial o despolarización se denomina PA y se desencadena por la súbita apertura de los canales de sodio presentes en la membrana, con el consiguiente aumento de la permeabilidad para dicho ión. Los cambios de los flujos iónicos asociados al PA se transmiten a puntos adyacentes de la membrana, conduciéndose a lo largo de la fibra muscular a una velocidad de entre 3 y 5 m/s. En una contracción voluntaria débil sólo se activa un escaso número de UMs que descargan potenciales de acción a frecuencias bajas (en torno a 5 por segundo). El aumento de la fuerza de contracción implica un aumento progresivo de la frecuencia de descarga y el reclutamiento o activación de más UMs.
Protocolo de estudio electromiográfico
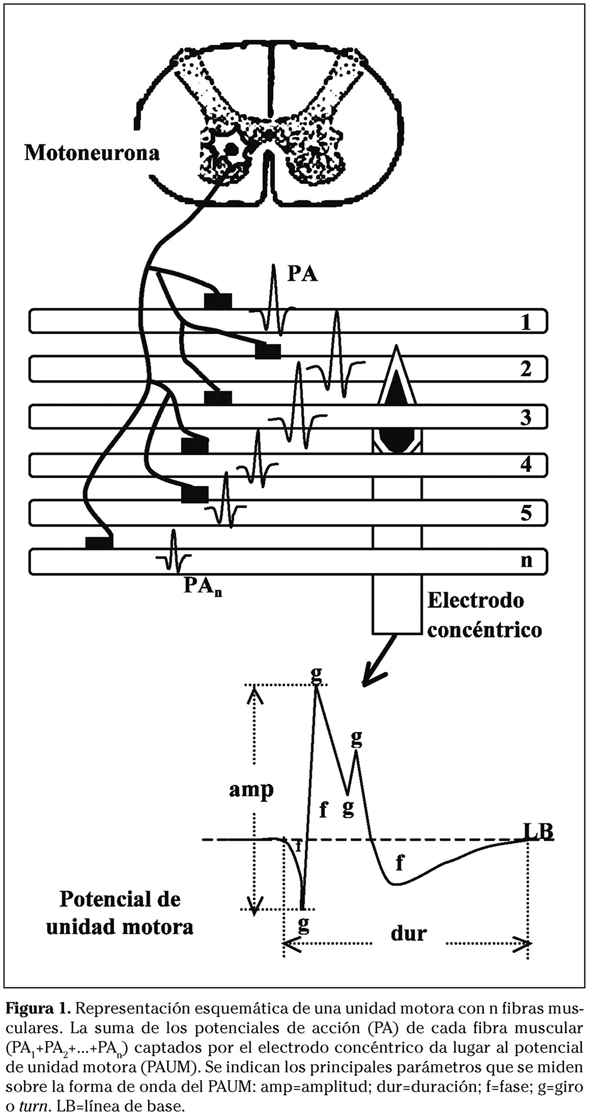
Los estudios electromiográficos habituales (EMG convencional) se realizan con electrodos de aguja que captan la actividad de las FMs presentes en una semiesfera de 2,5 mm de radio en torno a la punta. En nuestro medio se utilizan electrodos de aguja concéntricos, formados por un electrodo activo rodeado por el electrodo de referencia en forma de cánula (disposición similar a una aguja de punción lumbar en la que el fiador fuera el electrodo activo) y separados por un aislante eléctrico. El registro de los cambios producidos por la descarga de las FMs de una UM se conoce como PA de unidad motora (PAUM) (Fig. 1). En condiciones normales, la amplitud media de los PAUMs es de unos 0,5 mV y la duración varía entre 8 y 14 ms según el tamaño de las UMs. El tamaño y la forma del PAUM dependen de determinadas dimensiones estructurales y funcionales de las UMs. Los procesos patológicos neurógenos y miopáticos pueden alterar esas dimensiones, lo que se expresa por desviaciones anormales de los parámetros del PAUM.
La exploración EMG, una vez insertado el electrodo de aguja en un músculo, comprende el registro de la señal bioeléctrica en tres estados funcionales:
1. En reposo. Estando el músculo completamente relajado no debe registrarse ninguna actividad. La presencia de actividad espontánea, sea de FMs aisladas (fibrilaciones, ondas positivas, descargas miotónicas, etc.) o de UMs (fasciculaciones, mioquimias, etc.), debe considerarse anormal.
2. Durante una contracción débil. Para registrar PAUMs, el paciente debe realizar una contracción débil y mantenida. Con ello activa un escaso número de UMs y pueden captarse las descargas de los PAUMs correspondientes. Si el grado de contracción es excesivo, se activan demasiadas UMs y las curvas de las descargas se superponen unas a otras y sus respectivas formas de onda (FOs) se distorsionan.
3. Durante una contracción voluntaria máxima. La actividad EMG o actividad mioeléctrica alcanzada durante una contracción máxima informa sobre la población de UMs funcionantes: reducida en los procesos neurógenos y normal con reclutamiento precoz de todas las UMs con grados bajos de contracción en las miopatías.
En conjunto, la señal EMG traduce las remodelaciones patológicas de las UMs. Las variaciones respecto a los patrones normales en cada músculo, junto con la valoración de otros datos neurofisiológicos y el contexto clínico de cada paciente, constituyen la base del diagnóstico EMG.
Registro de la actividad electromiográfica
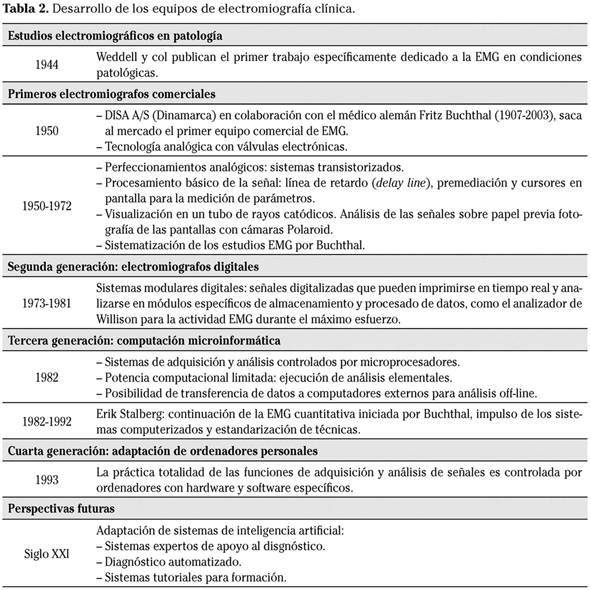
Hasta aquí hemos expuesto a grandes rasgos los principios teóricos del diagnóstico EMG. La adquisición y consolidación de este cuerpo de conocimientos, que hoy se admite doctrinalmente, han corrido paralelas a los avances en el conocimiento de la electricidad y al desarrollo de técnicas de estudio de los fenómenos bioeléctricos. Las tablas 1 y 2 muestran una sinopsis de los hitos científicos y tecnológicos relacionados con la bioelectricidad y la EMG, que puede ayudarnos a comprender el status actual y el sentido de los nuevos avances esperables en este terreno2-4.
Se presentan a continuación las técnicas básicas de procesamiento de la señal electromiográfica.
Amplificación
Toda la instrumentación EGM va dirigida a obtener una representación inteligible de los PAs musculares. Para ello los sistemas deben ser suficientemente sensibles porque las magnitudes bioeléctricas son muy pequeñas, siendo necesario amplificar la señal entre 50 y 250.000 veces. Las señales amplificadas son de entre 1 y 10 V, que es el rango en el que funcionan los circuitos electrónicos de los microprocesadores5.
Eliminación del ruido
El ruido, sea de origen técnico o biológico, acompaña invariablemente a la señal que se pretende registrar y generalmente supera la magnitud de ésta en varios órdenes. Los amplificadores diferenciales pueden neutralizar buena parte del ruido porque miden la diferencia de potencial entre los electrodos activos y de referencia y sólo magnifican la diferencia entre ellos. Si los dos electrodos están muy próximos, como ocurre en el electrodo concéntrico, las perturbaciones que afectan por igual a ambos electrodos (entradas comunes) quedan canceladas.
Filtrado
La FO de los PAUMs es una representación bidimensional de voltaje frente a tiempo, pero el PAUM también puede representarse como una suma de ondas sinusoidales de diferente frecuencia, amplitud y fase mediante un procedimiento matemático denominado transformación o análisis de Fourier. Los cambios rápidos de voltaje implican presencia de frecuencias altas y los cambios lentos, de frecuencias bajas. Los sistemas de registro cuentan con filtros para eliminar frecuencias superiores o inferiores a las propias de la señal fisiológica. Para los PAUMs se recomienda eliminar las frecuencias inferiores a 2-5 Hz (debidas a fluctuaciones lentas por movimiento de aguja) y superiores a 10 kHz (oscilaciones rápidas de la señal de origen técnico). Asimismo debe eliminarse, mediante un filtro específico (filtro notch), la oscilación de la señal a 50 Hz (60 en el continente americano) debida a la corriente alterna de la red eléctrica. Los filtros pueden ser analógicos (circuitos con resistencias y condensadores) o digitales (algoritmos ejecutados sobre la señal tras su digitalización). En cualquier caso, los efectos sobre la señal dependen de la frecuencia de corte, orden y tipo de filtro. Según los valores de estos parámetros, los filtros eliminan ruido pero también pueden distorsionar la FO de las señales fisiológicas5.
Presentación en pantalla
En los primeros equipos la señal aparecía en osciloscopios (tubos de rayos catódicos). Para transferirla a papel y analizarla se necesitaba fotografiar la pantalla. En los monitores de vídeo actuales se pueden representar múltiples curvas con rangos de sensibilidad entre 0,01 mV/cm y 100 mV/cm y barridos de 0,5 ms/cm a 100 s/cm. Dos funciones básicas para facilitar la adquisición (implementadas ya en los primeros equipos analógicos) son el umbral o trigger, que permite detener la señal en pantalla cuando supera un determinado valor de amplitud fijado por el usuario, y la línea de retardo o delay line, mediante la cual se mantiene en memoria la señal precedente al momento en que alcanzó el valor umbral.
Salida de audio
Las variaciones de voltaje propias de las señales EMG pueden ser transferidas a un altavoz. Los componentes frecuenciales de las señales son convertidos en vibraciones, es decir, en sonidos, cuya percepción es fundamental para guiar la colocación de la aguja y para reconocer determinados fenómenos como los distintos tipos de actividad espontánea6.
Digitalización
Los sistemas analógicos operan con la señal como una variación continua de voltaje. La digitalización, ejecutada en conversores analógico-digitales, consiste en la obtención de medidas (muestras) a intervalos regulares de tiempo. La frecuencia de muestreo del conversor debe ser lo suficientemente alta como para no perder cambios significativos del voltaje. Como establece el teorema de Nyquist, la frecuencia de muestreo debe ser al menos el doble de la componente frecuencial más alta (frecuencia máxima) de la FO que se pretende registrar (3-5 kHz en el caso de los PAUMs)7. Los equipos modernos trabajan con frecuencias de muestreo superiores a 20 kHz (intervalos inferiores a 50 μs). La resolución en la medida del voltaje depende del número de bits (dígitos binarios) del conversor. Con 12 bits, la ganancia del amplificador queda dividida en 4.096 (212) valores discretos de amplitud. La mayoría de los equipos actuales cuentan con conversores de 16 bits, con lo cual se pueden obtener medidas del orden de nanovoltios8. Sobre las señales, convertidas en series de números, se puede operar matemáticamente en un microprocesador para controlar la presentación de las curvas en pantalla, el almacenamiento de datos en memoria, análisis de las señales y gestión de datos en general.
Algoritmos de análisis de señal
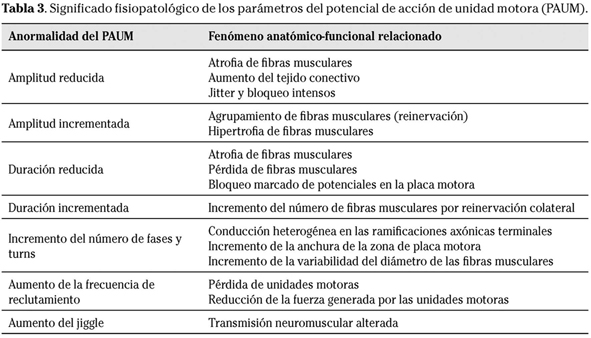
Los equipos actuales incorporan algoritmos para el cálculo automático de parámetros. La actividad durante el máximo esfuerzo puede analizarse cuantitativamente midiendo el número y amplitud de los picos (giros) presentes en la señal con diferentes algoritmos, algunos ya implementados en los primeros sistemas modulares, como el analizador de Willison (Tabla 2)9. En lo que respecta al análisis de la FO del PAUM, los aparatos convencionales cuentan con algoritmos para determinar los puntos inicial y final de la curva (y la duración como la diferencia de tiempo entre ambos), la amplitud máxima (diferencia entre las muestras de menor y mayor valor), el área bajo la curva, el número de fases (partes de la curva a uno y otro lado de la línea de base) y el número de giros (cambios de dirección de la curva) (Fig. 1)7,10. Estos parámetros informan sobre el tamaño y la estructura de las UMs. Los parámetros de tamaño (duración, amplitud, área) expresan el número de FMs de la UM. En las enfermedades miopáticas, las UMs pierden FMs, lo que resulta en una reducción de la amplitud y de la duración de los PAUMs. Por el contrario, en los procesos neurógenos el número de UMs está reducido, pero las UMs supervivientes aumentan el número de FMs por reinervación colateral. En estas circunstancias, los PAUMs muestran amplitud y duración aumentadas (Tabla 3).
Los parámetros que informan sobre la morfología de la onda (número de fases y giros) dependen del grado de dispersión temporal de los PAs de las FMs. Esta dispersión puede aumentar tanto en procesos neurógenos como miopáticos. La caracterización del PAUM a través de dichos parámetros permite establecer de forma cuantitativa el estado normal o patológico de un músculo, así como definir el patrón de anormalidad, severidad y estadio evolutivo del mismo (Tabla 3)7.
Técnicas especiales de procesado de señales electromiográficas
Para los procesados referidos anteriormente se han empleado distintos sistemas según las posibilidades técnicas disponibles en cada momento. Con los avances tecnológicos, los estudios EMG han ido mejorando en rapidez y consistencia, pero el juicio diagnóstico aún depende en gran medida de la experiencia y conocimientos de cada electromiografista. Los métodos cuantitativos intentan sustituir las apreciaciones subjetivas por medidas precisas y fisiopatológicamente significativas. Su rendimiento es en general satisfactorio cuando las condiciones de estudio son favorables (paciente colaborador, patología plenamente establecida, ruido escaso). Pero no siempre se dan estas circunstancias, existiendo aún importantes limitaciones derivadas de dos factores que de momento sólo pueden controlarse parcialmente: la variabilidad y el ruido.
En condiciones normales, las dimensiones de las UMs, como el número y distribución de las FMs, muestran grandes rangos de variación. Consiguientemente, los límites normales de los parámetros EMG son muy amplios, lo que reduce notoriamente su sensibilidad11. Así, las alteraciones sutiles pueden pasar desapercibidas o no ser igualmente interpretadas por distintos exploradores.
Respecto al ruido, un factor destacado es la distorsión de las FOs de los PAUMs por superposición de descargas cuando se activan demasiadas UMs. Para la extracción manual de FOs se necesita minimizar estas distorsiones por lo que la contracción voluntaria tienen que ser muy débil. Esto incrementa el tiempo de exploración así como el número de inserciones necesarias del electrodo de aguja y las molestias dolorosas para el paciente.
En relación con estas limitaciones, los desarrollos actuales tienen como principales objetivos:
- Mejorar la extracción de señales para reducir el tiempo de adquisición.
- Optimizar el análisis automático de las señales.
- Conseguir sistemas de clasificación de señales que mejoren la consistencia de los estudios, su sensibilidad (discriminación entre normal y patológico) y especificidad (tipificación de los patrones patológicos).
A nivel de hardware se están ensayando sistemas de adquisición con multielectrodos12,13 y con electrodos cutáneos. La electromiografía de superficie (EMGs) es incruenta pero las señales obtenidas no tienen suficiente definición como para poder realizar un análisis morfológico detallado. La EMGs se ha difundido ampliamente en el ámbito de la kinesiología para aplicaciones como estudio de la marcha y de movimientos anormales, desarrollo de prótesis electromecánicas y de sistemas de interacción con ordenadores, y en medicina deportiva14. Para estas aplicaciones el principal objeto de análisis sobre la señal es su contenido frecuencial. Además del análisis convencional con transformadas de Fourier, se están desarrollando otros procedimientos que, a diferencia de aquél, son aplicables a señales no estacionarias (como las de EMG) y ofrecen información sobre la variación frecuencial en el tiempo (representación tiempo-frecuencia). Diferentes tipos de análisis tiempo-frecuencia, como las transformadas wavelet (TW) o la distribución de Choi-Williams, se han aplicado a la señal EMGs durante la contracción muscular para estudiar la fatiga y las relaciones entre la actividad eléctrica y mecánica del músculo15,16. Por otra parte, están apareciendo los primeros trabajos de EMGs aplicada al diagnóstico de enfermedades neuromusculares: mediante algoritmos basados en clustering, análisis de componentes principales de coeficientes wavelet (wavelet spectrum matching)17 y otras técnicas, se está intentando descomponer la señal de superficie para extraer PAUMs aislados y otros datos de valor diagnóstico en patologías como radiculopatías lumbosacras18,19.
A nivel de software específico para tratamiento de las señales EMG de aguja, en las últimas décadas se han producido importantes avances, relacionados con el aumento de la potencia computacional de los microprocesadores. Se exponen a continuación los métodos más destacados aplicados a la extracción, análisis y clasificación de las señales EMG.
Extracción de PAUMS
Cancelación de ruido y artefactos
Durante la adquisición se obtiene una señal continua (cruda) que incluye las descargas sucesivas de los PAUMs junto con ruido de diferente origen: del propio equipo, de la corriente alterna, interferencias electromagnéticas del entorno, señales biológicas (electrocardiograma, actividad de UMs lejanas), movimientos de la aguja, etc. Los filtros eliminan parte del ruido pero resultan insuficientes, por lo que se han introducido nuevos procedimientos como el análisis de componentes independientes (ICA: independet components analysis) y TW, que se muestran especialmente robustos frente al ruido gaussiano de alta frecuencia20.
Tratamiento de la línea de base
Conceptualmente, la señal EMG se considera como una línea de base (LB) isoeléctrica (de valor cero) sobre la que se disponen las descargas de los PAUMs. Pero en los registros reales la LB siempre muestra fluctuaciones lentas producidas por la actividad de UMs lejanas y movimientos del electrodo. El filtro paso-alto no elimina totalmente la fluctuación lenta y si se eleva excesivamente su frecuencia de corte, la FO de los PAUMs puede verse distorsionada, con aparición artefactual de una fase negativa en su parte final21,22. El criterio convencional de considerar la LB como una recta10 conlleva desajustes en el manejo ulterior de los PAUMs, sobre todo en la medida automática de la duración. Nosotros valoramos la posibilidad de trazar el curso de la LB para cancelar específicamente la fluctuación presente en cada registro concreto sin distorsionar las FOs de los PAUMs. Los métodos estándar como los filtros adaptativos no rindieron satisfactoriamente, siendo necesaria la aplicación secuencial de varias técnicas de procesado:
- TW para identificar segmentos de la señal libres de descargas
- Promediado de las muestras de estos segmentos
- Reconstrucción de curvas sobre los puntos promedio mediante splines
- Análisis frecuencial de la LB así reconstruida
- Filtrado específico basado en modelado autorregresivo (AR)23
Identificación de potenciales
Para analizar la FO de los PAUMs, primero deben indentificarse las descargas presentes en la señal cruda. Este proceso puede realizarse de forma manual o semiautomática utilizando trigger y delay line. Ambos procedimientos consumen mucho tiempo. Para automatizar la extracción de descargas, en la década de los 80 comenzaron a desarrollarse los primeros sistemas de descomposición de la señal EMG y sistemas multipotenciales o multi-MUP24,25. Estos sistemas generan plantillas (templates) con las FOs de descargas aisladas, las comparan entre sí mediante correlación cruzada y otras funciones, y las clasifican en conjuntos según su grado de similitud, correspondiendo cada uno de dichos conjuntos a las descargas de una misma UM26,27. Todos los equipos modernos incorporan sistemas multi-MUP con los que pueden extraerse hasta 6 PAUMs diferentes a partir de una señal cruda adquirida durante 5-10 segundos de contracción muscular. De esta forma se reduce el número de inserciones y el tiempo de registro necesario para obtener una muestra suficiente de PAUMs. Además de la confrontación de plantillas (template matching), se están ensayando métodos basados en estadísticos de alto orden (higher-order statistics o HOS)28 y en TW17, así como redes neuronales29, algoritmos genéticos30 y otras técnicas de inteligencia artificial, por lo que cabe esperar que las nuevas generaciones de electromiógrafos incorporen sistemas multi-MUP más potentes.
Extracción de formas de onda representativas de los PAUMs
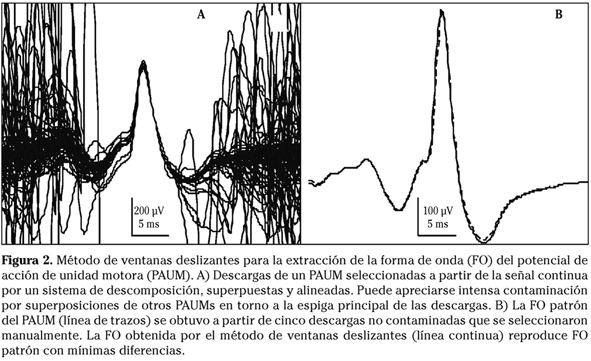
Una vez aisladas las descargas de una misma UM, sus curvas se superponen (generalmente tomando como referencia el pico máximo) y se obtiene la FO del PAUM mediante promediación de las curvas (media aritmética de las muestras). El objetivo es conseguir una FO que incluya todos los detalles morfológicos significativos, o sea, que represente fielmente los cambios fisiológicos ocurridos en el sistema. El procedimiento convencional conlleva ciertas imprecisiones por desajustes en la alineación y por la frecuente presencia de distorsiones que artefactan la curva promedio. Para resolver estas limitaciones se han diseñado diversas estrategias como la utilización de la mediana (menos sensible que la media a valores extremos artefactuales)31. También se ha aplicado el cálculo de medias ponderadas (weighted average) y la selección de un número fijo descargas de máxima similitud. Nosotros hemos propuesto un procedimiento de selección para establecer el número óptimo de descargas similares que maximiza la relación señal/ruido32,33. Asimismo hemos introducido un sistema de alineamiento de las descargas por maximización de la correlación, que ofrece un grado óptimo de superposición, mejor que tomando como referencia el pico máximo. También hemos aplicado un método de ventanas deslizantes para obtener la FO del PAUM rechazando selectivamente los segmentos distorsionados de las descargas (Fig. 2)34.
Análisis de la forma de onda del PAUM
Medición automática de parámetros
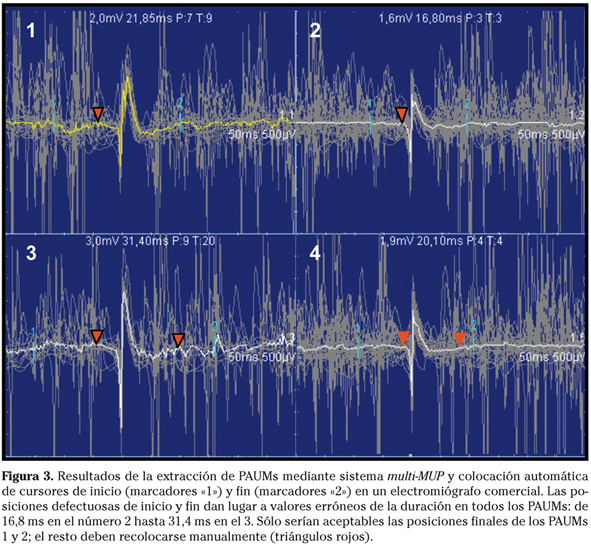
Una vez obtenida la FO, se miden los parámetros para caracterizar cuantitativamente el tamaño y la morfología del PAUM. La amplitud pico a pico y el área son calculados con exactitud empleando algoritmos sencillos. Pero la medida automática de otros parámetros, como el número de fases y de giros es menos precisa, siendo necesario el cómputo manual35,36. El parámetro que presenta mayor dificultad es la duración: el tiempo entre los puntos inicial y final de la curva del PAUM. La parte final de los PAUMs suele ser una pendiente suave sobre la que resulta difícil determinar manualmente la posición del punto final. Esto es causa de una importante variabilidad intra e interobservador en las medidas manuales de la duración37 como hemos podido constatar en un estudio específico38. Los métodos automáticos convencionales, que tratan de reproducir la medición manual, aplican criterios de amplitud y pendiente para situar los marcadores de inicio y fin10 pero comenten muchos errores, siendo necesario recolocar manualmente los marcadores en más del 80% de los PAUMs (Fig. 3). La rectificación de la LB con nuestro método, referido arriba, mejora parcialmente el rendimiento de algunos algoritmos convencionales39, pero hemos desarrollado nuevos métodos basados en TW que ofrecen buenos resultados en más del 90% de PAUMs, normales y patológicos40,41.
Definición de nuevos parámetros
El objetivo del análisis del PAUM es medir en su FO dimensiones que estén relacionadas con las variables anatomofisiológicas de la UM. Los parámetros definidos para cuantificar dichas dimensiones deberían mostrarse robustos y ofrecer estimaciones fiables aunque varíen las condiciones de registro. La amplitud y el área están relacionadas con el número de FMs de la UM presentes en el radio de captación del electrodo, pero muestran una amplia variabilidad dependiendo de la distancia del electrodo a las FMs42. Para superar esta limitación se intenta formular parámetros e índices que expresen el número de FMs de la UM con independencia de la distancia entre el electrodo y las FMs y que tengan, por tanto, mayor capacidad discriminativa entre la normalidad y la patología. Así se propusieron el índice de grosor o thickness (relación área/amplitud)43, útil para diferenciar PAUMs normales y miopáticos; y el índice de tamaño o size index (2 x log10 amplitud + thickness). Éste fue formulado mediante la aplicación de un análisis discriminante (una modalidad de análisis estadístico multivariante) y se muestra sensible para diferenciar entre PAUMs normales y neuropáticos, y robusto frente a las variaciones de la posición relativa del electrodo44.
Los parámetros que caracterizan la forma del PAUM se relacionan con la dispersión temporal de la activación de las FMs de la UM. El llamado coeficiente de irregularidad se definió para mejorar la caracterización morfológica del PAUM respecto al número de fases y de giros y ha mostrado cierta capacidad de diferenciación entre procesos agudos y crónicos (neurógenos o miopáticos)45.
Una característica del PAUM que informa sobre la transmisión neuromuscular es la variabilidad de la FO en descargas consecutivas o jiggle. Para cuantificar esta variabilidad se han definido dos parámetros: el valor normalizado de las diferencias consecutivas de amplitud (CAD: consecutive amplitude differences) y el coeficiente de correlación cruzada de las descargas consecutivas (CCC: crosscorrelational coefficient of consecutive discharges)46. Estos parámetros se probaron con señales simuladas. Nosotros introdujimos modificaciones en el método de alineamiento de las curvas y en la estimación del ruido de la LB, mejorando el rendimiento en señales reales47. No obstante, tanto éstos como otros parámetros ensayados hasta ahora muestran limitaciones y ninguno se ha incorporado a la rutina. Es necesario seguir profundizando en esta línea y para ello una herramienta básica es el simulador de UMs y PAUMs.
Clasificación de los PAUMS
Criterios convencionales
Para juzgar el estado de un músculo hay que analizar un cierto número de PAUMs. Un solo PAUM de un músculo normal puede mostrar alteraciones y viceversa; en un músculo patológico se puede registrar un cierto número de PAUMs normales. De acuerdo con las indicaciones de Buchthal, la muestra debe incluir un mínimo de 20 PAUMs48. Una vez efectuado el análisis del conjunto de PAUMs extraídos, disponemos de los valores medios y de la dispersión de los parámetros. El criterio clásico para establecer los límites de normalidad para cada parámetro es el valor medio más dos desviaciones estándar o el valor del percentil 95 obtenido en una muestra aleatoria de sujetos normales49. Con esta metodología se han elaborado tablas de valores normales para diferentes músculos y grupos de edad50.
Estrategias específicas
Los valores medios de los parámetros superan los límites normales en casos netamente patológicos, pero el criterio no es suficientemente sensible en los casos limítrofes, prevaleciendo entonces la valoración subjetiva. Se han propuesto algunas alternativas a los criterios clásicos. Una de ellas es la consideración de los valores extremos (outliers) de forma que cuando en un músculo se registran 3 PAUMs con valores superiores o inferiores a 3 desviaciones estándar de la media, el músculo se puede considerar patológico sin necesidad de extraer más señales51. Otro método, basado en la estadística bayesiana, establece una valoración ponderada de los hallazgos según el diagnóstico sospechado por la clínica y otros datos disponibles52,53.
Nuevos desarrollos
Puesto que ningún parámetro tiene por sí solo suficiente capacidad discriminativa entre PAUMs normales y patológicos y todos muestran un considerable margen de penumbra, se han aplicado estrategias de valoración conjunta de múltiples parámetros mediante sistemas automáticos de clasificación y reconocimiento de patrones. Dichos sistemas incluyen métodos estadísticos multivariantes54,55 y técnicas de inteligencia artificial como redes neuronales56, algoritmos genéticos57 y técnicas basadas en lógica difusa (fuzzy logic)58.
Las redes neuronales requieren ser entrenadas, es decir, se necesita transferir conocimiento humano a la red, que ésta integra reorganizando sus conexiones internas en la fase de entrenamiento de acuerdo con los datos de entrada que se le presentan y las salidas que se le exigen. Además de la clasificación automática, estos métodos pueden actuar como sistemas expertos de apoyo al diagnóstico, en términos de posibilidades diagnósticas y sugerencias de actuación en cada caso. Los sistemas basados en lógica difusa pueden incorporar el conocimiento de expertos, incluso a nivel de matices intuitivos, ya que toleran la introducción de datos contradictorios y pueden inferir reglas y patrones a partir de ellos14. Estos sistemas emulan mejor que las redes neuronales el proceso humano de toma de decisiones, por lo que su aplicación en EMG resulta especialmente interesante dado el amplio margen de incertidumbre que muchas veces presentan los estudios EMG. Los sistemas de inteligencia artificial aún se encuentran en fase experimental, pero es previsible que se consiga el grado de desarrollo suficiente para que puedan ser incorporados a nuevas generaciones de electromiógrafos.
Nuestros primeros trabajos se dedicaron a la clasificación automática de PAUMs mediante sistemas estadísticos y redes neuronales59,60. Los resultados, como los de otros autores, eran aceptables siempre que las desviaciones de la normalidad fueran manifiestas, pero el rendimiento descendía considerablemente con casos limítrofes. Probablemente esta merma dependiera no tanto de la capacidad de las redes como de la mala calidad de los datos introducidos en ellas, derivada de los errores en las medidas automáticas de los parámetros, comentados anteriormente. En consecuencia dirigimos nuestra atención a la depuración de los procesos de extracción y análisis, previos a la clasificación, considerando entonces imprescindible disponer de un simulador de actividad EMG para acometer la formulación de nuevos parámetros más robustos.
Modelos matemáticos del músculo esquelético
El número, diámetro y distribución de FMs de una UM, así como la señal que genera su actividad eléctrica (el PAUM), sólo pueden conocerse con exactitud mediante sofisticados experimentos en animales61,62. De los PAUMs registrados en humanos no se puede conocer datos como el número de FMs generadoras, dimensiones y disposición geométrica de las mismas. El estudio de las relaciones entre la señal y las dimensiones anatomofuncionales de las UMs sólo puede realizarse con simulaciones por ordenador, es decir, con modelos abstractos en los que están representados matemáticamente los elementos del sistema y las leyes que rigen su funcionamiento.
Los elementos constitutivos de un modelo de PAUM son el PA de las FMs, la conducción por volumen de ese potencial a través del tejido muscular, la forma y disposición geométrica de las FMs, y las dimensiones y situación del electrodo de registro. Partiendo de las formulaciones de los fenómenos biofísicos del PA transmembrana y de los datos morfométricos micro y macroscópicos aportados por los estudios anatómicos de los músculos esqueléticos1,63,64, se han desarrollado diversos modelos matemáticos específicos de PA de FM, de músculo y de señal EMG65,66. Ninguno de ellos ha sido formalmente contrastado con los PAUMs reales. Al intentar validar algunos modelos, observamos ciertas discrepancias con los datos morfométricos publicados (número total de FMs, diámetro medio, sección del músculo, etc.)67. Tras la revisión crítica de varios modelos estamos introduciendo modificaciones en magnitudes estructurales como densidad de FMs, patrón de inervación (distribución de las uniones neuromusculares), tamaño y solapamiento de los territorios de las UMs y distribución de los mismos (considerando las regiones próximas al contorno de la sección muscular), con lo que se está consiguiendo armonizar los datos fisiológicos y las estimaciones morfométricas de los estudios anatómicos68,69.
Observamos también que los modelos de PA de fibra no reproducen la forma y dimensiones esperados. Comparados con fibrilaciones (PAs generados por FMs denervadas), los PA generados por los modelos publicados muestran menor duración y distinta morfología: bifásicos con fases positiva y negativa relativamente simétricas, frente a la morfología trifásica y generalmente asimétrica de las fibrilaciones70,71. Para ajustar estas diferencias hemos propuesto diversas modificaciones en las funciones del PA de fibra, introduciendo nuevos términos y rangos de variación aleatoria en varios coeficientes que se habían asumido axiomáticamente como constantes72. Con ello el simulador consigue sintetizar PAs superponibles a las fibrilaciones73,74.
Los modelos matemáticos también pueden simular condiciones reales de registro como ruido y artefactos. Así pues, el diseño de modelos de simulación constituye en sí mismo un terreno específico de investigación tanto para profundizar en el conocimiento anatomofisiológico de la UM como para el desarrollo de nuevos métodos de procesado de señal.
Bibliografía
1. Feinstein B, Lindegard B, Nyman E, Wohlfart G. Morphologic studies of motor units in normal human muscles. Acta Anat 1955; 23: 127-142. [ Links ]
2. Brazier, MAB. A history of neurophysiology in the 17th and 18th centuries: from concept to experiment. Nueva York: Raven Press, 1984. [ Links ]
3. Brazier, MAB. A history of neurophysiology in the 19th century. Nueva York: Raven Press, 1984. [ Links ]
4. Ladegaard J. Story of electromyography equipment. Muscle Nerve 2002; Suppl 11: S128-S133. [ Links ]
5. Gitter A, Stolov W. Instrumentation and measurement in electrodiagnostic medicine - Part I. Muscle Nerve 1995; 18: 799-811. [ Links ]
6. Okajima Y, Tomita Y, Ushijima R, Chino N. Motor unit sound in needle electromyography: assessing normal and neuropathic units. Muscle Nerve 2000; 23: 1076-1083. [ Links ]
7. Stalberg E, Nandedkar S, Sanders D, Falck B. Quantitative motor unit potential analysis. J Clin Neurophysiol 1996; 13: 401-422. [ Links ]
8. Gitter A, Stolov W. Instrumentation and measurement in electrodiagnostic medicine- Part II. Muscle Nerve 1995; 18: 812-824. [ Links ]
9. Willison R.G. Analysis of electrical activity in healthy and dystrophic muscle in man. J Neurol Neurosurg Psychiat 1964; 27: 386-394. [ Links ]
10. Stalberg E, Andreassen S, Falck B, Lang H, Rosenfalck A, Trojaborg W. Quantitative analysis of individual motor unit potentials - a proposition for standardized terminology and criteria for measurement. J Clin Neurophysiol 1986; 3: 313-348. [ Links ]
11. Nirkko AC, Rösler KM, Hess CW. Sensitivity and specificity of needle electromyography: a prospective study comparing automated interference pattern analysis with single motor unit potential analysis. Electroencephalogr Clin Neurophysiol 1995; 97: 1-10. [ Links ]
12. Farina D, Yoshida K, Stieglitz T, Koch KP. Multichannel thin-film electrode for intramuscular electromyographic recordings. J Appl Physiol 2008; 104: 821-827. [ Links ]
13. Akaboshi K, Masakado Y, Chino N. Quantitative EMG and motor unit recruitment threshold using a concentric needle with quadrifilar electrode. Muscle Nerve 2000; 23: 361-367. [ Links ]
14. Raez MBI, Hussain MS, Mohd-Yasin F. Techniques of EMG signal analysis: detection, processing, classification and applications. Biol Proced Online 2006; 8: 11-35. [ Links ]
15. Kumar DK, Pah ND, Bradley A. Wavelet analysis of surface electromyography to determine muscle fatigue. IEEE Trans Neural Syst Rehabil Eng 2003; 11: 400-406. [ Links ]
16. González M, Izquierdo M, Malanda A. Estimación de la fatiga muscular basada en la transformada Choi-Williams. XXV Congreso Anual de la Sociedad Española de Ingeniería Biomédica, 2007: 111. [ Links ]
17. Yamada R, Ushiba J, Tomita Y, Masakado Y. Decomposition of electromyographic signal by principal component analysis of wavelet coefficient. IEEE EMBS Asian-Pacific Conference on Biomedical Engineering. Keihanna, 2003: 118-119. [ Links ]
18. Uesugi H, Sonoo M, Stalberg E, Ugawa Y, Shimizu T, Kanazawa I. A new technique of analysing surface EMG on voluntary contraction which can differentiate between neurogenic and myopathic changes: a proporsal of clustering index. Clin Neurophysiol 2000; 111: 2343-2344. [ Links ]
19. Wimalaratna HS, Tooley MA, Churchill E, Preece AW, Morgan HM. Quantitative surface EMG in the diagnosis of neuromuscular disorders. Electromyogr Clin Neurophysiol 2002; 42: 167-174. [ Links ]
20. Ren X, Yan Z, Wang Z, Hu X. Noise reduction based on ICA decomposition and wavelet transform for the extraction of motor unit action potentials. J Neurosci Methods 2006; 158: 313-322. [ Links ]
21. Lang A, Vaahtoranta K. The baseline, the time characteristics and the slow afterwaves of the motor unit potential. Electroencephalogr Clin Neurophysiol 1973; 35: 387-394. [ Links ]
22. Chu J, Chan RC, Bruyninckx F. Effects of the EMG amplifier settings on the motor unit action potential parameters recorded with concentric and monopolar needles. Electromyogr Clin Neurophysiol 1986; 26: 627-639. [ Links ]
23. Rodríguez I, Malanda A, Gila L, Navallas J, Rodríguez Falces J. Filter design for cancellation of baseline-fluctuation in needle EMG recordings. Comput Methods Programs Biomed 2006; 81: 79-93. [ Links ]
24. McGill KC, Cummins KL, Dorfman LJ. Automatic decomposition of the clinical electromyogram. IEEE Trans Biomed Eng 1985; 32: 470-477. [ Links ]
25. Stalberg E, Falck B, Sonoo M, Astrom M. Multi-MUP EMG analysis-a two year experience with a quantitative method in daily routine. Electroencephalogr Clin Neurophysiol 1995; 97: 145-154. [ Links ]
26. LeFever R, DeLuca C. A procedure for decomposing the myoelectric signal into its constituent action potentials.1. Technique, theory and implementation. IEEE Trans Biomed Eng 1982; 29: 149-157. [ Links ]
27. Florestal JR, Mathieu PA, Malanda A. Automated decomposition of intramuscular electromyographic signals. IEEE Trans Biomed Eng 2006; 53: 832-839. [ Links ]
28. Nikias CL, Mendel JM. Signal processing with higher-order spectra. IEEE Signal Processing Magazine 1993; 10: 10-37. [ Links ]
29. Hassoun MH, Wang C, Spitzer AR. NNERVE: neural network extraction of repetitive vectors for electromyography. I. Algorithm. IEEE Trans Biomed Eng 1994; 41: 1039-1052. [ Links ]
30. Florestal JR, Mathieu PA, Plamondon R. A genetic algorithm for the resolution of superimposed motor unit action potentials. IEEE Trans Biomed Eng 2007; 54: 2163-2171. [ Links ]
31. Nandedkar S, Sanders D. Median averaging of electromyographic motor unit action potentials. Med Biol Eng Comput 1989; 27: 556-571. [ Links ]
32. Navallas J, Malanda A, Gila L, Rodríguez J, Rodríguez I, Florestal JR et al. An algorithm for optimal discharge selection for MUAP waveform extraction. XVI Congress of the International Society of Electrophysiology and Kinesiology, 2006: 12-13. [ Links ]
33. Navallas J, Malanda A, Gila L, Rodríguez J, Rodríguez I. Evaluación del algoritmo de promediado ordenado de descargas para la extracción de la forma de onda del PAUM. XXIV Congreso Anual de la Sociedad Española de Ingeniería Biomédica, 2006: 181-184. [ Links ]
34. Malanda A, Navallas J, Gila L, Rodríguez J, Rodríguez I. Extraction of representative potentials in MUAP sets. XVIIth Congress of the international society of electrophysiology and kinesiology, 2008: 54. [ Links ]
35. Pfeiffer G, Kunze K. Turn and phase counts of individual motor unit potentials: correlation and reliability. Electroencephalogr Clin Neurophysiol 1992; 85: 161-165. [ Links ]
36. Bromberg MB, Smith AG, Bauerle J. A comparison of two commercial quantitative electromyographic algorithms with manual analysis. Muscle Nerve 1999; 22: 1244-1248. [ Links ]
37. Takehara I, Chu J, Li TC, Schwartz I. Reliability of quantitative motor unit action potential parameters. Muscle Nerve 2004; 30: 111-113. [ Links ]
38. Rodríguez I, Gila L, Malanda A, Gurtubay I, Mallor F, Gómez S et al. Motor unit action potential duration, I: variability of manual and automatic measurements. J Clin Neurophysiol 2007; 24: 52-58. [ Links ]
39. Alvarez I, Rodríguez I, Gila L, Malanda A, Navallas J, Rodríguez J. Influence of baseline fluctuation cancellation on automatic measurement of the motor unit action potential duration. Clin Neurophysiol 2006; 117 (Suppl 1): S193. [ Links ]
40. Rodríguez I, Gila L, Malanda A, Gurtubay I, Mallor F, Gómez S et al. Motor unit action potential duration, II: a new automatic measurement method based on the wavelet transform. J Clin Neurophysiol 2007; 24: 59-69. [ Links ]
41. Rodríguez I, Gila L, Malanda A, Gurtubay IG, Navallas J, Rodríguez J. Medición automática de la duración del potencial de acción de unidad motora (PAUM). Rendimiento de un nuevo método basado en transformadas wavelet en potenciales normales y patológicos. Rev Neurol 2007; 44: 117. [ Links ]
42. Brownell AA, Bromberg MB. Effects of intramuscular needle position on motor unit action potential metrics. Muscle Nerve 2007; 35: 465-470. [ Links ]
43. Nandedkar S, Barkhaus P, Sanders D, Stalberg E. Analysis of the amplitude and area of the concentric needle EMG motor unit action potentials. Electroencephalogr Clin Neurophysiol 1988; 69: 561-567. [ Links ]
44. Sonoo M, Stalberg E. The ability of PAUM parameters to discriminate between normal and neurogenic PAUMs in concentric EMG: analysis of the PAUM «thickness» and the proposal of «size index». Electroencephalogr Clin Neurophysiol 1993; 89: 291-303. [ Links ]
45. Zalewska E, Rowinska-Marcinska K, Hausmanowa-Petrusevicz I. Shape irregularity of motor unit potentials in some neuromuscular disorders. Muscle Nerve 1998; 21: 1181-1187. [ Links ]
46. Stalberg E, Sonoo M. Assessment of variability in the shape of the motor unit action potential, the «jiggle», at consecutive discharges. Muscle Nerve 1994; 17: 1135-1144. [ Links ]
47. Campos C, Malanda A, Gila L, Segura V, Lasanta MI, Artieda J. Quantification of jiggle in real electromyographic signals. Muscle Nerve 2000; 23: 1022-1034. [ Links ]
48. Buchthal F, Rosenfalck P. Action potential parameters in different human muscles. Acta Psychiatr Scand 1955; 30: 125-131. [ Links ]
49. Dorfman L, Robinson L. AAEM Minimonograph 47: normative data in electrodiagnostic medicine. Muscle Nerve 1997; 20: 4-14. [ Links ]
50. Buchthal F, Rosenfalck P. Action potential parameters in different human muscles. Acta Psychiatr Scand 1955; 30: 125-131. [ Links ]
51. Stalberg E, Bischoff C, Falck B. Outliers-a way to detect abnormality in quantitative EMG. Muscle Nerve 1994; 17: 392-399. [ Links ]
52. Patock T, Nandedkar S, Sanders D. MUAP analysis using Bayes classifier. Muscle Nerve 1992; 15: 967-968. [ Links ]
53. Pfeiffer G. The diagnostic power of motor unit potential analysis: an objective bayesian approach. Muscle Nerve 1999; 22: 584-591. [ Links ]
54. Pfeiffer G, Kunze K. Discriminant classification of motor unit potentials (MUPs) successfully separates neurogenic and myopathic conditions. A comparison of multi-and univariate diagnostical algorithms for MUP analysis. Electroencephalogr Clin Neurophysiol 1995; 97: 191-207. [ Links ]
55. Zalewska E, Hausmanowa-Petrusewicz I. The SIIR index-a non-linear combination of waveform size and irregularity parameters for classification of motor unit potentials. Clin Neurophysiol 2005; 116: 957-964. [ Links ]
56. Pattichis C, Schizas C, Middleton L. Neural network models in EMG diagnosis. IEEE Trans Biomed Eng 1995; 42: 486-496. [ Links ]
57. Pattichis C, Schizas C. Genetics-based machine learning for the assessment of certain neuromuscular disorders. IEEE Trans Neural Net 1996; 7: 427-439. [ Links ]
58. Rasheed S, Stashuk D, Kamel M. A software package for interactive motor unit potential classification using fuzzy k-NN classifier. Comput Methods Programs Biomed 2008; 89: 56-71. [ Links ]
59. Lasanta MI, Campos C, Malanda M, Gila L, Labarga A. Statistical analysis and classification of motor unit action potentials. 11th Nordic-Baltic Conference on Biomedical Engineering. Tallinn, 1999: 377-378. [ Links ]
60. Segura V, Gila L, Campos C, Lasanta MI, Malanda A. A Statistical and neural network classification of motor unit action potentials. A comparative study. IX International Symposium on Motor Control, 2000: 62. [ Links ]
61. Burke RE, Levine DN, Salcman M, Tsairis P. Motor units in cat soleous muscle: physiological, histochemical and morphological characteristics. J Physiol 1974; 238: 503-514. [ Links ]
62. Griep PAM, Gielen FLH. Calculation and registration of the same motor unit action potential. Electroencephalogr Clin Neurophysiol 1982; 53: 388-404. [ Links ]
63. Bodine-Fowler S, Garfinkel A, Roy RR, Edgerton VR. Spatial distribution of muscle fibers within the territory of a motor unit. Muscle Nerve 1990; 13: 1133-1145. [ Links ]
64. Adams RD, De Reuk J. Metrics of muscle. En: Kakulas BA, editor. Basic research in myology. Proceedinsgs of the Second International Congress on Muscle Diseases. Nueva York: Elsevier, 1971: 3-11. [ Links ]
65. Hamilton-Wright A, Stashuk DW. Physiologically based simulation of clinical EMG signals. IEEE Trans Biomed Eng 2005; 52: 171-183. [ Links ]
66. Duchene J, Hogrel J. A Model of EMG Generation. IEEE Trans Biomed Eng 2000; 47: 192-201. [ Links ]
67. Zabalza J, Malanda A, Gila L, Campos C. Validation study of MUAP models. XIV Congress of the International Society of Electrophysiology and Kinesiology 2002: 242-243. [ Links ]
68. Navallas J, Malanda A, Gila L, Rodríguez J, Rodríguez I. Mathematical analysis of a muscle architecture model. Math Biosci 2009; 217: 64-76. [ Links ]
69. Navallas J, Malanda A, Gila L, Rodríguez J, Rodríguez I. A new muscle architecture model with non-uniform distribution of muscle fiber types. XXIV Internacional Conference on Computer Electrical and System Sciences and Engineering (WASET), 2007: 288-292. [ Links ]
70. Dimitrov GV, Dimitrova NA. Precise and fast calculation of motor unit potentials detected by a point and rectangular plate electrode. Med Eng Phys 1998; 20: 374-381. [ Links ]
71. Nandedkar SD, Stalberg E. Simulation of single fiber action potentials. Med Biol Eng Comput 1983: 21: 158-165. [ Links ]
72. Rodríguez J, Malanda A, Gila L, Rodríguez I, Navallas J. A mathematical analysis of SFAP convolutional models. IEEE Trans Biomed Eng 2005; 52: 769-783. [ Links ]
73. Rodríguez J, Malanda A, Gila L, Rodríguez I, Navallas J. Modeling fibrillation potentials - a new analytical description for the muscle intracellular action potential. IEEE Trans Biomed Eng 2006; 53: 581-592. [ Links ]
74. Rodríguez J, Malanda A, Gila L, Rodríguez I, Navallas J. Modelling fibrillation potentials - analysis of time parameters in the muscle intracellular action potential. IEEE Trans Biomed Eng 2007; 54: 1361-1370. [ Links ]
 Dirección para correspondencia:
Dirección para correspondencia:
Luis Gila Useros
Servicio de Neurofisiología Clínica
Hospital Virgen del Camino
Irunlarrea, 4
31008 Pamplona
Tfno. 848429475
Fax 848429924
E-mail: lgilause@cfnavarra.es