Mi SciELO
Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Anales del Sistema Sanitario de Navarra
versión impresa ISSN 1137-6627
Anales Sis San Navarra vol.37 no.3 Pamplona sep./dic. 2014
https://dx.doi.org/10.4321/S1137-66272014000300004
ARTÍCULOS ORIGINALES
Tratamiento del cáncer de próstata en función de la esperanza de vida, la comorbilidad y las guías de práctica clínica
Treatment of prostate cancer according to life expectancy, comorbidity and clinical practice guidelines
A. Barceló Obrador1, M. Ramos1, M.T. de la Iglesia2 y M. Zaforteza2
1. Registro de Cáncer de Mallorca, Dirección General de Salud Pública y Consumo, Islas Baleares, España.
2. Hospital Universitario Son Espases, Islas Baleares, España.
Dirección para correspondencia
RESUMEN
Fundamento: Describir el tratamiento de pacientes con cáncer de próstata en función de esperanza de vida, riesgo y comorbilidad, explorar el grado de seguimiento de las guías de práctica clínica (GPC) y registrar los efectos secundarios tras un año.
Método: Estudio retrospectivo de pacientes diagnosticados y tratados de cáncer de próstata en un hospital el 2011. Se recogieron variables sociodemográficas, comorbilidad (índice de Charlson), del tumor, del tratamiento y efectos secundarios. Se realizó análisis bivariante con Ji cuadrado.
Resultados: Se identificaron 114 pacientes. El 92,1% tenía esperanza de vida mayor de 10 años; el 50% comorbilidad baja, el 36% media y el 14% alta. Se practicó cirugía en el 56,2%, más en pacientes de riesgo medio y comorbilidad baja; radioterapia en el 13,2%, más en pacientes de riesgo alto y comorbilidad baja; hormonoterapia en el 21,9%, más en comorbilidad media, y tratamiento diferido en el 12,3%. El no seguimiento de la GPC alcanzó el 38,6% y en riesgo alto el 58,1% El 70% de los tratados con cirugía presentaron incontinencia urinaria y el 48,3% disfunción eréctil. De los tratados con hormonoterapia, un 17,15% presentó enfermedades cardiovasculares y un 32,5% agravamiento de factores de riesgo cardiovascular.
Conclusiones: El tratamiento del cáncer de próstata tiene en cuenta el riesgo y la comorbilidad, pero el seguimiento de las GPC puede mejorarse, principalmente en pacientes de riesgo alto. Es necesario adoptar medidas preventivas para reducir efectos secundarios cardiovasculares en pacientes sometidos a hormonoterapia.
Palabras clave: Cáncer de próstata. Guías de práctica clínica. Efectos adversos. Tratamiento. Índice de Charlson.
ABSTRACT
Background: To describe the treatment of prostate cancer patients according to life expectancy, risk and comorbidity, to examine the degree to which Clinical Practice Guidelines (CPG) are followed, and to register secondary effects after one year.
Methods: Retrospective study of patients diagnosed with prostate cancer in a hospital in 2011. Socio-demographic variables, as well as comorbidity (Charlson index), tumor characteristics, treatments and secondary effects were collected. A bivariate analysis was performed using the Chi square test.
Results: One hundred and fourteen patients were identified. Life expectancy was higher than 10 years in 92.1%; 50% had low comorbidity, 36% medium and 14% high. Surgery was performed in 56.2%, more often in patients with intermediate-risk and low comorbidity; radiotherapy in 13.2%, more often in patients with high-risk and low comorbidity; hormonal therapy in 21.9%, more often in patients with medium comorbidity, and deferred treatment in 12.3%. CPG recommendations were not followed in 38.6%, especially in high-risk patients, 58.1%. Regarding adverse effects, 70% of patients treated with surgery presented urinary incontinence, and 48.3% erectile dysfunction. On the other hand, 17.15% of patients treated with hormonal therapy presented a cardiovascular disease, and 32.5% worsening of a cardiovascular risk factor.
Conclusions: Treatment of prostate cancer takes into account risk and comorbidity, but there could be improvement in following CPG guidelines, especially in elderly patients. It is advisable to develop preventive strategies to avoid cardiovascular effects in patients with hormonal therapy.
Key words: Prostate neoplasm. Practice Clinic Guidelines. Adverse effects. Treatment. Charlson index.
Introducción
El cáncer de próstata es, en los hombres, el segundo cáncer más frecuente en el mundo, y el primero en la Unión Europea, donde la tasa de incidencia ajustada a población mundial se ha estimado para 2012 en 71,4 casos por 100.000 habitantes1. En España, la red de registros poblacionales de cáncer (REDECAN), ha estimado para 2014 la tasa en 67,6 (55,5-81,2) (datos no publicados). En cambio, las tasas de mortalidad por cáncer de próstata son mucho más bajas, de 10,9 para la Unión Europea1 y de 8,6 para España2 para el 2012.
Las opciones terapéuticas para el tratamiento del cáncer de próstata son diversas y con una importante variabilidad en la práctica clínica3. La selección del tratamiento del cáncer de próstata se realiza a partir del riesgo del paciente, obtenido a partir del estadio de la enfermedad, del grado de agresividad del tumor o Gleason y de los niveles de PSA en el momento del diagnóstico, de la esperanza de vida del paciente, así como de sus preferencias.
Por lo que se refiere a la edad, se recomienda un tratamiento curativo para los pacientes cuya esperanza de vida sea de al menos 10 años4,5, ya que aquellos con una esperanza de vida inferior a 10 años tienen más probabilidades de morir por causas diferentes al cáncer de próstata5. Esta regla de los 10 años goza de una amplia aceptación entre los expertos6,7.
Llama la atención que las guías de práctica clínica (GPC) para el cáncer de próstata tengan en cuenta la esperanza de vida pero no la comorbilidad de los pacientes, cuando ésta influye significativamente en los resultados8 y en la calidad de vida9, así como en las complicaciones de los tratamientos, en el consumo de los recursos y en la progresión de las enfermedades concurrentes. En un estudio reciente se observó que pacientes con comorbilidades severas (índice de Charlson > 3) y cáncer de próstata de bajo riesgo, fueron tratados con terapias agresivas en un 54% de los casos, teniendo estos individuos un 70% de probabilidades de morir en los siguientes 10 años10.
Tampoco hay que olvidar la agresividad de los tratamientos aplicados. En este sentido la mayoría de los enfermos tratados sufren trastornos posteriores en su vida diaria, lo cual incide de manera importante en la calidad de vida del paciente. Así la cirugía es la opción terapéutica que ocasiona más episodios de impotencia y pérdidas de orina, la radioterapia presenta más riesgo de problemas intestinales, mientras que la braquiterapia ocasiona más síntomas urinarios de irritación y obstrucción11. El tratamiento hormonal tiene como efectos secundarios: enfermedades cardiovasculares, diabetes, y aumento del riesgo de fracturas óseas12.
Los objetivos del presente estudio son: describir el tratamiento de los pacientes con cáncer de próstata en función del riesgo, la comorbilidad y la esperanza de vida, explorar el grado de seguimiento de las recomendaciones de las GPC de cáncer de próstata y registrar los efectos secundarios aparecidos tras un año de tratamiento.
Material y métodos
Estudio descriptivo, transversal, mediante revisión de historias clínicas.
Los sujetos del estudio han sido pacientes diagnosticados de cáncer de próstata invasivo (Código C61.9 de la CIE-10 3a edición) durante el año 2011 en el hospital Universitario Son Espases (HUSE) de Palma de Mallorca que cubre una área de 330.000 habitantes y que a la vez es el hospital de referencia para todas las Islas Baleares. Se han incluido los pacientes residentes en Mallorca, diagnosticados en el HUSE que inician tratamiento por cáncer de próstata. Se han excluido los pacientes no diagnosticados en el HUSE y pacientes diagnosticados en el HUSE que no se pueda garantizar que hayan iniciado el tratamiento en el HUSE. A partir de la historia clínica electrónica del HUSE y de Atención Primaria (AP) se ha obtenido información clínica y sociodemográfica.
Para comprobar que el tratamiento aplicado se ha ajustado a la mejor evidencia del momento se ha utilizado la Guideline on Prostate Cancer del año 2011 de la European Association of Urology13 como guía de referencia y concretamente los grados de recomendación que figuran en el resumen del apartado 13 en las páginas 102 y 103.
El seguimiento a los pacientes se ha realizado por el período de 1 año en todos ellos.
El proyecto ha sido presentado y aprobado por el Comité Ético de Investigación Clínica de las Illes Balears, por la Comisión de Investigación del HUSE y por la Comisión de Investigación de Atención Primaria. No se ha considerado necesario el consentimiento informado dado que la revisión de las historias clínicas se ha realizado durante la identificación de los casos en el Registro de Cáncer de Mallorca.
Las variables recogidas del paciente han sido la edad en el momento del diagnóstico, clasificando a los individuos según si la esperanza de vida era mayor o menor de 10 años teniendo en cuenta la esperanza de vida al nacer ajustada a la edad en el momento del diagnóstico de los varones en las Islas Baleares en el año 2011, según datos del Instituto Balear de Estadística; la comorbilidad (enfermedades que componen el índice de Charlson14 y otras enfermedades crónicas de elevada prevalencia15 como HTA, depresión, fibrilación auricular, anemia, obesidad, trastornos en el metabolismo de los lípidos y osteoporosis. Se ha evaluado la comorbilidad según el Charlson clasificando a los pacientes en 3 grupos en función del resultado: comorbilidad baja (Charlson = 0), media (1 y 2) y alta (>3)16.
Además se ha recogido la fecha del diagnóstico; valor del PSA categorizándose en <10 ng/ml, entre 10 y 20 ng/ml y >20 ng/ml17,18; índice de Gleason agrupando en <7, 7 y >7; TNM y estadio en el momento del diagnóstico: I (T1, T2a), II (T2b-T2c), III (T3) y IV (T4; N+,M0; M+). Y a partir de estas variables se ha obtenido el riesgo: bajo (T1-T2a y gleason 2-6 y PSA <10), medio (T2b-T2c o gleason=7 o PSA 10-20), alto (T3a o gleason 8-10 o PSA>20) y muy alto (T3b-T4 o cualquier T si N1)13.
Otro dato recogido ha sido el tipo de tratamiento aplicado (cirugía, radioterapia, hormonoterapia, tratamiento diferido) y la fecha de inicio del tratamiento. Se ha englobado bajo el concepto tratamiento diferido las opciones terapéuticas actitud expectante y vigilancia activa.
Se ha clasificado el seguimiento de la guía en los tipos: «Sí tipo A» cuando se ha seguido una recomendación de grado A (basado en estudios clínicos de buena calidad y consistencia que abordan recomendaciones concretas e incluyen al menos un ensayo clínico aleatorizado), «Sí tipo B» cuando se ha seguido una recomendación de grado B (basado en ensayos clínicos bien realizados, pero sin ensayos clínicos aleatorizados) y no había de grado A, y «No» cuando no se ha seguido la recomendación de la guía. Se han tenido en cuenta los comentarios que figuran en la tabla resumen del apartado 13 de la guía.
Los efectos adversos se han registrado como agrupando, insuficiencia cardiaca, angina infarto, accidente cerebro-vascular, enfermedad arterial periférica y arritmia como eventos cardiovasculares; y trastornos en el metabolismo de los lípidos, diabetes e hipertensión arterial como factores de riesgo cardiovascular. Cuando diabetes, osteoporosis y/o fracturas óseas, depresión, hipertensión arterial y trastornos en el metabolismo de los lípidos ya figuraban como enfermedades preexistentes, solo se ha registrado si ha habido empeoramiento de la enfermedad, considerando empeoramiento el que se haya obligado a modificar el tratamiento que hasta ese momento estaba siguiendo el paciente.
Análisis estadístico
Se ha hecho un análisis descriptivo mediante frecuencias relativas para las variables cualitativas y medias o medianas para las cuantitativas en función de si seguían o no una distribución normal. A continuación se ha hecho análisis bivariante mediante el test de Chi2 para explorar la relación entre el tipo de tratamiento y el riesgo, el índice de Charlson, la esperanza de vida y los efectos secundarios, y la prueba no paramétrica U de Mann-Whitney para la variable número de enfermedades. Finalmente, se ha hecho un análisis estratificado para evaluar si se seguían las recomendaciones de la guía en función del riesgo y de la esperanza de vida.
Para el análisis estadístico se ha utilizado el programa SPSS v20.
Resultados
Se identificaron 132 casos de los cuales 9 se excluyeron por no haber sido diagnosticados en el HUSE, y 9 porque no se pudo garantizar que el tratamiento se hubiera realizado en el HUSE. Con lo que finalmente el estudio se realizó con 114 casos, resultando excluidos el 13,6% de los pacientes inicialmente identificados
La media de edad de los pacientes era de 66,2 años (desviación estándar de 7,7), presentando 43 años el más joven y 83 años el de mayor edad. El 9,7% tenía una edad < 55 años, el 36,8% una edad comprendida entre 56 y 65 años, el 36,8% entre 66 y 75, y el 16,7% era > 75 años. El 92,1% tenía en el momento del diagnóstico una esperanza de vida >10 años y el 7,9% <10 años.
Las enfermedades previas de los pacientes se muestran en la tabla 1. La mediana de estas enfermedades fue de 3 correspondiendo el primer cuartil a una enfermedad y el tercer cuartil a 4 enfermedades. De los 114 pacientes, 10 no presentaban ninguna enfermedad previa, mientras que el individuo que mayor número de enfermedades previas padecía eran 9. La enfermedad previa registrada que apareció con mayor frecuencia fue la hipertensión, seguida del trastorno en el metabolismo de los lípidos y de la diabetes. El 50% de los pacientes presentó una comorbilidad baja, el 36% una comorbilidad media y el 14% una comorbilidad alta.
Las características de los cánceres de próstata identificados y el tratamiento aplicado se muestran en la tabla 2, en la que las combinaciones cirugía-hormonoterapia y radioterapia-hormonoterapia se han contabilizado como cirugía y radioterapia respectivamente. Casi la mitad de los cánceres presentaba un riesgo medio en el momento del diagnóstico. Más de la mitad de los pacientes fueron tratados mediante cirugía, correspondiendo el 25,4% a cirugía abierta, el 20,2% a cirugía laparoscópica tradicional y el 7% a cirugía laparoscópica robotizada. La hormonoterapia sola se suministró en el 21,9% de los casos y combinada en un 13,2%. Las modalidades de administración combinada fueron como terapia neoadyuvante en un 3,5% de los casos, en un 6,1% como neoadyuvante, concomitante y adyuvante, y en un 3,5% neoadyuvante y concomitante. Los fármacos utilizados en un 80% de los casos fueron agonistas de la hormona liberadora de gonadotrofinas (Ag LHRH) con antiandrógenos, en un 17,5% Ag LHRH solo, y en un 2,5% antiandrógenos solo. De los 114 pacientes, 3 rechazaron la totalidad del tratamiento o una parte de él, concretamente 2 radioterapia y uno prostatectomía radical.
La relación entre el tipo de tratamiento aplicado y las variables riesgo, esperanza de vida y Charlson se describe en la tabla 3. Destaca que la cirugía y la radioterapia se aplicaron siempre a pacientes con esperanza de vida mayor de 10 años. Respecto a la comorbilidad, la cirugía y la radioterapia se aplicaron en un mayor porcentaje en pacientes con Charlson bajo, mientras que la terapia hormonal se suministró principalmente en valores medios. En relación al riesgo, la cirugía se utilizó mayoritariamente en riesgo medio, la radioterapia en riesgo alto, la terapia hormonal, exceptuando un caso, se repartió a partes iguales en riesgo medio, alto y muy alto, y el tratamiento diferido se utilizó únicamente en riesgo bajo y medio.
En cuanto a si los tratamientos aplicados se adaptaron a la mejor evidencia actual, solo en el 56,1% de los casos se siguió una recomendación de grado A, en el 5,3% se aplicó una evidencia grado B, y en el 38,6% no se siguió la recomendación de primera elección. La no adaptación a la mejor evidencia actual se produjo principalmente en los pacientes con riesgo alto, es decir, con estadio T3a o gleason entre 8 y 10 o PSA > 20, seguida de la de los pacientes con riesgo medio o pacientes con estadio T2b-T2c o gleason=7 o PSA 10-20. En pacientes con riesgo alto la no adaptación a la guía fue causada por la aplicación de la cirugía, mientras que en pacientes de riesgo medio se debió a la utilización de terapia hormonal. La cirugía fue la opción terapéutica que más no seguimientos de la guía ocasionó, alcanzando el 36,4% del total. El análisis estratificado del tratamiento aplicado en función del estadio de la enfermedad y de la esperanza de vida se puede ver en la tabla 4.
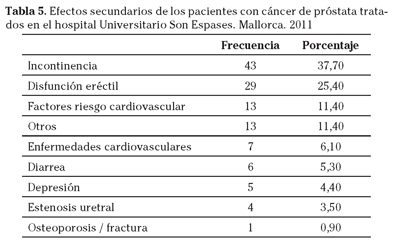
En relación a la toxicidad de los tratamientos, la frecuencia de aparición de los efectos secundarios se detalla en la tabla 5, destacando la incontinencia urinaria y la disfunción eréctil: uno de cada 3 pacientes tratados presentaron incontinencia urinaria y uno de cada 4 disfunción eréctil. A continuación se situaron los factores de riesgo cardiovascular y los eventos cardiovasculares. Para los factores de riesgo cardiovascular, 8 individuos (7%) presentaron trastornos en el metabolismo de los lípidos, 4 (3,5%) diabetes y 2 (1,8%) hipertensión arterial. Para los eventos cardiovasculares, insuficiencia cardiaca y angina se observaron en 2 pacientes (1,8%) cada uno de ellos, mientras que infarto, accidente cerebro-vascular, enfermedad arterial periférica y arritmia se presentaron en un individuo (0,90%) cada uno de ellos.
La aparición de efectos secundarios más frecuentes en función del tratamiento aplicado se muestra en la tabla 6. Los porcentajes de efectos secundarios en pacientes tratados con cirugía abierta no variaron demasiado en relación a la cirugía laparoscópica o laparoscópica robotizada. Asimismo, destacan los porcentajes de enfermedades cardiovasculares y factores de riesgo cardiovascular que aparecieron o se agravaron tras la terapia hormonal.
Discusión
La aplicación de tratamientos agresivos como cirugía y radioterapia se realiza principalmente en pacientes con comorbilidades bajas, mientras que en pacientes con comorbilidades medias se da preferencia a la terapia hormonal. Si bien la comorbilidad no figura en las recomendaciones de la guía revisada, en menor o mayor medida se tiene en cuenta a la hora de la selección del tratamiento.
Llama la atención que de las 4 enfermedades previas más prevalentes como son hipertensión, trastorno en el metabolismo de los lípidos, diabetes y obesidad solo la diabetes forme parte del instrumento más utilizado para medir la comorbilidad como es el Charlson19. Puesto que el 50% de los pacientes no padecía ninguna de las enfermedades del Charlson, y puesto que el tratamiento hormonal puede tener efectos sobre las enfermedades más prevalentes del estudio, cabe plantearse si el índice de Charlson es el más útil para medir la comorbilidad de estos pacientes.
En el 38,6% de los pacientes tratados no se ha seguido la recomendación que figuraba en la guía como de primera elección. El no seguimiento de las recomendaciones de la guía se ha producido principalmente en aquellos pacientes clasificados de alto riesgo alcanzando el 58,1%, siendo la cirugía, la opción terapéutica que ha dado lugar al mayor número de no seguimientos. Dicha terapia solamente tiene un grado de recomendación C para pacientes estadio T3a, gleason < 8, PSA < 20 mg/ml y esperanza de vida < 10 años. Nos encontramos ante un sobretratamiento con terapia agresiva como es la prostatectomía radical. En este sentido, uno de los aspectos más controvertidos en el tratamiento del cáncer de próstata sigue siendo, a día de hoy, el tratamiento de los estadios que se extienden más allá de la cápsula prostática o estadios T320 residiendo la dificultad en el diagnóstico de si es o no un estadio T3, ya que las pruebas disponibles en patología tumoral prostática tienen un poder de discriminación relativamente bajo. Estudios posteriores han sugerido que el grupo de pacientes de alto riesgo, dada su heterogeneidad, se desglose en tres grupos diferentes21. Tampoco hay que obviar que las guías son recomendaciones y en ningún caso una norma legal de obligado cumplimento en cuanto a la toma de decisiones.
Además de la ausencia de ensayos clínicos aleatorizados, otros autores atribuyen el bajo seguimiento de las recomendaciones de la guía a la desconfianza que pueda generar la organización responsable de la elaboración de la guía, a la oposición a lo que en medicina se conoce como «libro de cocina» y a la simple resistencia al cambio22. Aunque en opinión de los autores de este estudio sería interesante empezar a introducir otros aspectos en las guías como los costes económicos y los costes en calidad de vida de las diferentes opciones terapéuticas.
En cuanto a efectos secundarios destacan los relacionados con hormonoterapia como son eventos cardiovasculares y factores de riesgo cardiovascular. Así en el presente estudio se ha detectado que de los pacientes tratados con terapia hormonal un 17,1% presentó algún evento cardiovascular y un 32,5% sufrió o vio aumentados alguno de los factores de riesgo cardiovascular como hipertensión arterial, trastorno del metabolismo de los lípidos, o diabetes. Por ello parece razonable evaluar los posibles beneficios de la terapia hormonal teniendo en cuenta el riesgo cardiovascular, y establecer unas estrategias o recomendaciones para pacientes que vayan a recibir terapia hormonal para mitigar dichos efectos. A esta misma conclusión se ha llegado en estudios recientes23.
La principal limitación del estudio está relacionada con el hecho de que la información que figura en las historias clínicas de los pacientes es incompleta. Para minimizar este hecho se ha consultado la historia clínica de AP además de la hospitalaria. Dicha limitación afecta principalmente a los efectos secundarios relacionados con las terapias agresivas como prostatectomía y radioterapia, que sin duda podría haberse reducido mediante la realización de entrevistas con cuestionarios de calidad de vida y por periodos superiores al año11. Otra limitación que no debe dejar de mencionarse es que la selección del tratamiento no depende únicamente de la decisión clínica sino que también interviene la decisión del paciente, cosa que puede haber influido en menor o mayor medida en el resultado del seguimiento de las recomendaciones de la guía. Por lo que se refiere a este estudio, tanto incontinencia urinaria como disfunción eréctil han sido detectados mediante la revisión de las historias clínicas de AP, básicamente por el registro de prescripciones de absorbentes de incontinencia y de fármacos para tratar los síntomas de la disfunción eréctil. El porcentaje de pacientes con incontinencia urinaria y disfunción eréctil es mucho más alto que el hallado, principalmente en el caso de la disfunción eréctil, puesto que el hecho de recibir tratamiento para esta patología responde en muchas ocasiones a la voluntariedad del paciente a diferencia de la incontinencia urinaria. Tampoco hay que olvidar que para el caso de la radioterapia, la disfunción eréctil puede alcanzar su pico máximo entre los 18 y 24 meses24, por lo que un seguimiento más prolongado del estudio podría haber sido más eficaz en la detección concreta de este efecto secundario y en general para el resto de tratamientos. Para el caso de los efectos secundarios de los tratamientos hormonales, el periodo de seguimiento de 1 año puede haber sido suficiente puesto que el riesgo de aparición de éstos es significativamente superior en pacientes tratados en periodos < 12 meses que en pacientes que reciben tratamiento >12 meses25.
En referencia al tamaño de la muestra, si bien puede parecer pequeño, a diferencia de otros estudios recoge todos los estadios del cáncer de próstata.
De la realización de este estudio puede concluirse que:
1) La cirugía y la radioterapia se aplicaron exclusivamente en pacientes con esperanza de vida >10 años, siendo en riesgo medio donde más se utilizó la cirugía y en riesgo alto la radioterapia. El tratamiento diferido únicamente se utilizó en riesgos bajo y medio. A medida que aumentó la comorbilidad, aumentó la aplicación de la terapia hormonal.
2) El grado de seguimiento de las guías, en este caso, de la Guidelines on Prostate Cancer de la European Association of Urology en versión del año 2011 fue bajo en un alto porcentaje. El elevado número de factores a tener en cuenta y la ausencia de ensayos clínicos aleatorizados contribuyen sin duda a este hecho.
3) El elevado número de efectos secundarios cardiovasculares, tanto eventos como factores de riesgo, como consecuencia de la terapia hormonal requieren la adopción de medidas preventivas por lo que sería importante contar con profesionales de atención primaria que son especialistas en este tipo de medidas.
Bibliografía
1. Globocan 2012: Estimated Cancer Incidence, Mortality and Prevalence Worldwide in 2012. (Consultado 25/04/2014). Disponible en: http://globocan.iarc.fr/. [ Links ]
2. Mortalidad de cáncer en España. (Consultado 25/04/2014). Disponible en: http://www.isciii.es/ISCIII/es/contenidos/fd-servicios-cientifico-tecnicos/fd-vigilancias-alertas/fd-epidemiologia-ambiental-y-cancer/mortalidad-cancer-en-espana.shtml. [ Links ]
3. Núñez C, Angulo J, Sánchez-Chapado M, Alonso S, Portillo JA, Villavicencio H. Variabilidad de la práctica clínica urológica en cáncer de próstata en España. Actas Urol Esp 2012; 36: 333-339. [ Links ]
4. Chodak GW, Thisted RA, Gerber GS, Johansson JE, Adolfsson J, Jones GW, et al. Results of conservative management of clinically localized prostate cancer. N Engl J Med 1994; 33: 242-248. [ Links ]
5. Albertsen PC, Hanley JA, Fine J. 20-year outcomes following conservative management of clinically localized prostate cancer. JAMA 2005; 293: 2095-2101. [ Links ]
6. Menon M, Parulkar BG, Baker S. Should we treat localized prostate cancer? An opinion. Urology 1995; 46: 607-616. [ Links ]
7. Krahn MD, Bremner KE, Asaria J, Alibhai SM, Nam R, Tomlinson G, et al. The ten-year rule revisited: accuracy of clinicians' estimates of life expectancy in patients with localized prostate cancer. Urology 2002; 60: 258-263. [ Links ]
8. Wolff JL, Starfield B, Anderson G. Prevalence, expenditures and complications of multiple chronic conditions in the elderly. Arch Intern Med 2002; 162: 2269-2276. [ Links ]
9. Gijsen R, Hoeymans N, Schellevis FG, Ruwaard D, Satariano WA, van den Bos GA. Causes and consequences of comorbidity: A review. J Clin Epidemiol 2001; 54: 661-674. [ Links ]
10. Daskivich TJ, Chamie K, Kwan L, Labo J, Palvolgyi R, Dash A, et al. Overtreatment of men with low-risk prostate cancer and significant comorbidity. Cancer 2011; 117: 2058-2066. [ Links ]
11. Ferrer Forés M, Rueda Martínez de Santos JR, Latorre García K, Gutiérrez Ibarluzea I; Grupo Multicéntrico Español de Cáncer de Próstata Localizado. Efectividad a largo plazo de la prostatectomía radical, la braquiterapia y la radioterapia conformacional externa 3D en el cáncer de próstata órgano-confinado. Madrid: Plan de Calidad para el Sistema Nacional de Salud. Ministerio de Sanidad y Consumo. Agència d'Avaluació de Tecnologia i Recerca Mèdiques de Cataluña, 2008. Informes de Evaluación de Tecnologías Sanitarias, AATRM núm. 2006/08. [ Links ]
12. Pagliarulo V, Bracarda S, Eisenberger MA, Mottet N, Schröder FH, Sternberg CN, et al. Contemporany role of androgen deprivation therapy for prostate cancer. Eur Urol 2012; 61: 11-25. [ Links ]
13. Heindenreich A, Bastian J, Bolla M, Joniau S, Mason M.D, Matveev V, et al. EAU Guidelines on Prostate Cancer. Eur Urol 2011. [ Links ]
14. Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J Chronic Dis 1987; 40: 373-383. [ Links ]
15. Palomo L, Rubio C, Gérvas J. The comorbidity in primary care. Gac Sanit 2006; 20: 182-191. [ Links ]
16. Nguyen-Nielsen M, Froslev T, Friis S, Borre M, Harving N, Sogaard M. Completeness of prostate cancer staging in the Danish Cancer Registry, 2004-2009. Clin Epidemiol 2012; 4: 17-23. [ Links ]
17. D'Amico AV, Cote K, Loffredo M, Renshaw AA, Schultz D. Determinants of prostate cancerspecific survival after radiation therapy for patients with clinically localized prostate cancer. J Clin Oncol 2002; 20: 4567-4573. [ Links ]
18. D'Amico AV, Whittington R, Malkowicz SB, Schultz D, Blank K, Broderick GA, et al. Biochemical outcome after radical prostatectomy, external beam radiation therapy, or intersticial radiation therapy for clinically localized prostate cancer. JAMA 1998; 280: 969-974. [ Links ]
19. De Groot V, Beckerman H, Lankhorst GJ, Bouter LM. How to measure comorbidity: a critical review of available methods. J Clin Epidemiol 2003; 56: 221-229. [ Links ]
20. MarusiC G, Vojinov S, Levakov I. Treatment of locally advanced prostatic cancer. Med Pregl 2010; 63: 689-695. [ Links ]
21. Rincón Mayans A, Zudaire B, Brugarolas J, Rioja J, Zudaire J, Rosell D, et al. Cáncer de próstata localizado de alto riesgo tratado mediante prostatectomía radical. Pronóstico y estudio de variables influyentes. An Sist Sanit Navar 2012; 35: 9-18. [ Links ]
22. Wolf JS Jr, Hubbard H, Faraday MM, Forrest JB. Clinical practice guidelines to inform evidence-based clinical practice. World J Urol 2011; 29: 303-309. [ Links ]
23. Saylor PJ, Smith MR. Metabolic complications of androgen deprivation therapy for prostate cancer. J Urol 2013; 189: 34-42. [ Links ]
24. Akbal C, Tinay I, SimSek F, Turkeri LN. Erectile dysfunction following radiotherapy and brachytherapy for prostate cancer: pathophysiology, prevention and treatment. Int Urol Nephrol 2008; 40: 355-363. [ Links ]
25. Saigal CS, Gore JL, Krupski TL, Hanley J, Schonlau M, Litwin MS; Urologic Diseases in America Project. Androgen deprivation therapy increases cardiovascular morbidity in men with prostate cancer. Cancer 2007; 110: 1493-1500. [ Links ]
![]() Dirección para correspondencia:
Dirección para correspondencia:
Antoni Barceló Obrador
Camí de Jesús 38-A
07003 - Palma de Mallorca
E-mail: abarcelo@dgsanita.caib.es
Recepción: 26 de mayo de 2014
Aceptación provisional: 3 de julio de 2014
Aceptación definitiva: 28 de julio de 2014