Introducción
Si bien el concepto de demencia rápidamente progresiva no ha sido formalmente definido, el criterio temporal más aceptado es de 1-2 años desde el primer síntoma hasta la instauración de la demencia (habitualmente semanas o meses). Aunque las causas más frecuentes son neurodegenerativas (36-47%) y el ejemplo paradigmático son las prionopatías (13-30%), existe un grupo tratable y potencialmente reversible que supone un porcentaje no desdeñable (17-27%), lo que nos obliga a estar alerta para identificar precozmente estos pacientes. Una de estas causas tratables es el virus de la inmunodeficiencia humana (VIH)1.
Las quejas cognitivas son el síntoma de presentación del 4-15% de pacientes con VIH2. El virus se disemina por el sistema nervioso central (SNC) en los primeros días tras la infección y causa alteraciones neurológicas a través de mecanismos directos e indirectos (infecciones oportunistas, neoplasias, toxicidad farmacológica). Cuando el daño se produce por la propia patogenicidad del virus, se engloba dentro del trastorno neurocognitivo asociado al VIH (HIV associated neurocognitive disorder, HAND). Desde 2007 se clasifica el HAND según los criterios de Frascati en HAD (HIV associated dementia), MND (mild neurocognitive disorder) y ANI (asymptomatic neurocognitive impairment)4. La HAD es una demencia predominantemente subcortical con afectación en la velocidad de procesamiento, atención, función ejecutiva, y fluidez y memoria verbales; los síntomas corticales y motores son menos comunes, aunque pueden estar presentes en fases avanzadas.
Se presenta el caso de un varón con VIH que debutó en forma de HAD con puntuación GDS de 5 (Global Deterioration Scale). Este caso recalca la importancia de mantener un alto índice de sospecha dado que, aunque el perfil de pacientes haya cambiado, el VIH sigue siendo una causa tratable de deterioro cognitivo prevalente en nuestro medio.
Caso clínico
Varón de 57 años, comercial de profesión, casado con una mujer y con antecedentes de hipertensión y epilepsia focal estructural (por traumatismo en su juventud), en tratamiento con enalapril y carbamazepina. Presentaba cuadro ansioso-depresivo de un año de evolución, atribuido al confinamiento por COVID-19, tratado con escitalopram.
Inicialmente no repercutía en su funcionalidad, pero acudió a Urgencias porque en los últimos dos meses había iniciado conducta social inadecuada con posterior pérdida de habilidades aprendidas y de autocuidado, así como disminución del rendimiento laboral, que propiciaron su despido a pesar del tratamiento antidepresivo.
La exploración quedó limitada por una marcada inatención, inquietud e impersistencia motora; el lenguaje espontáneo era escaso pero con correcta gramaticalidad, experimentaba dificultades en la nominación y comprensión de órdenes complejas así como en la ejecución de praxias bimanuales; no mostraba reflejos de liberación frontal ni otra focalidad. Ingresó en Neurología como demencia rápidamente progresiva a estudio.
Se realizó resonancia magnética craneoencefálica que mostró alteración difusa de sustancia blanca (Fig. 1). En el despistaje de causas tratables de demencia se observó positividad para VIH con 90.600 copias/mL en sangre y 462.000 en líquido cefalorraquídeo (LCR), así como 31 CD4/mm3 y cociente CD4/CD8 de 0,05; se detectaron 5 leucocitos/µL en LCR con proteinorraquia normal. Paralelamente se recibieron resultados de virus JC (John Cunningham) negativo, proteína 14.3.3 por debajo de los puntos de corte y biomarcadores de enfermedad de Alzheimer en LCR (proteína tau total = 1800 pg/mL, elevada, y proteínas fosfo-tau y beta-amiloide-42 normales) compatibles con muerte neuronal inespecífica.
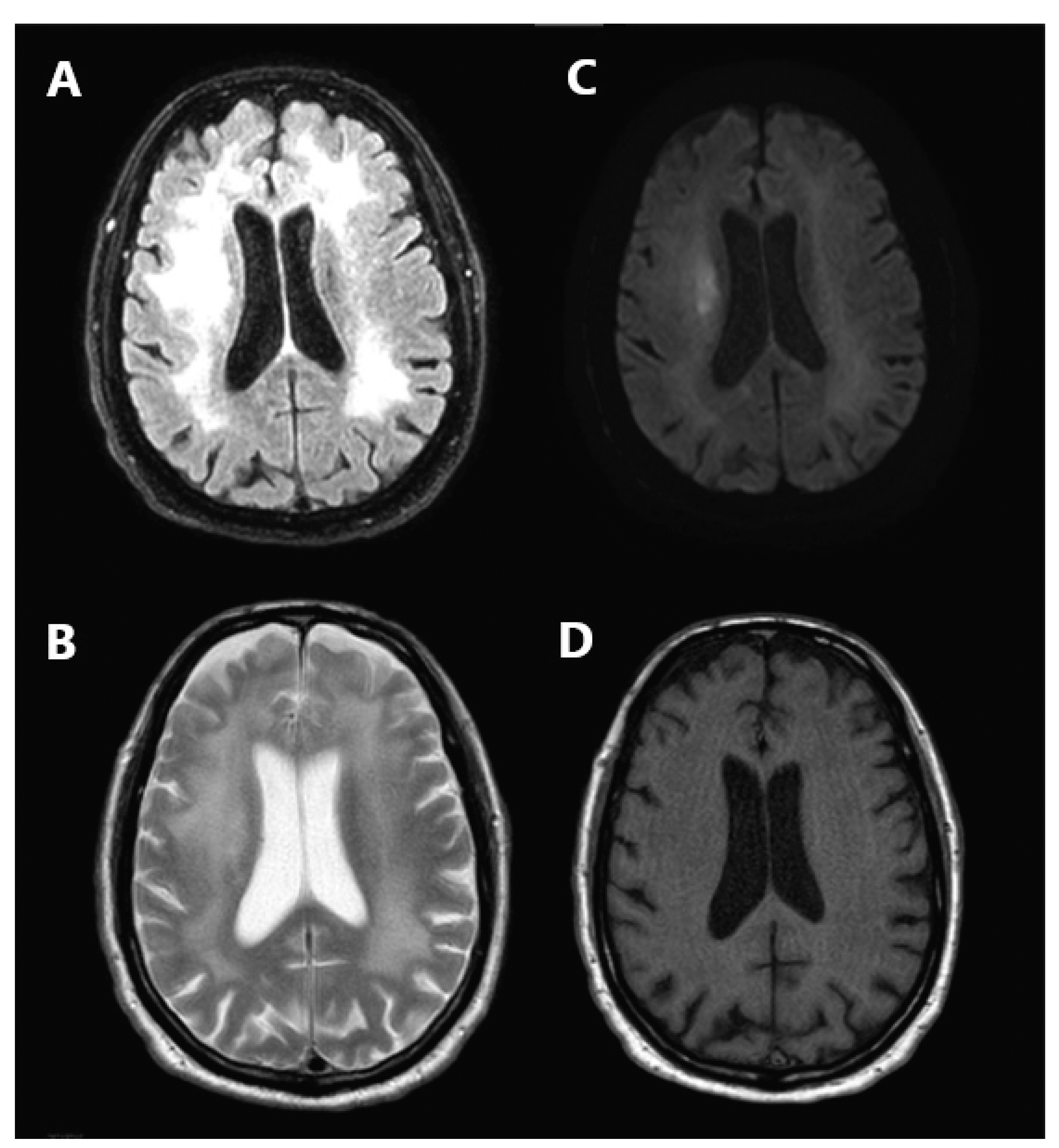
Figura 1. Resonancia magnética craneoencefálica. Cortes axiales en fluid-attenuated inversión recovery (FLAIR) (A), T2 (B), difusión (C) y T1 (D). En T2 y FLAIR se observa hiperintensidad difusa a nivel de sustancia blanca bilateral, con discreta restricción de la difusión hídrica, más marcada a nivel de corona radiata derecha.
Descartadas otras etiologías, se estableció el diagnóstico de HAD como forma de presentación de infección por VIH categoría C3 debido a la clínica definitoria de SIDA (demencia) y a la inmunodepresión celular severa (<200 CD4), y se instauró terapia antirretroviral con bictegravir / emtricitabina / tenofovir alafenamida 50 / 200 / 25 mg. Durante el ingreso presentó una evolución tórpida, con complicaciones infecciosas (bacteriemia por Staphylococcus aureus, neumonía y candidiasis oral) y descompensación de su epilepsia, con crisis sintomáticas agudas de inicio focal con evolución a tónico-clónica bilateral; se sustituyó carbamazepina 200 mg/12h por eslicarbazepina 800 mg/día, por su menor riesgo de interacción. El paciente se estabilizó tras la resolución de las infecciones intercurrentes pero la exploración neuropsicológica se vio dificultada por la persistente inatención. Tras dos semanas de terapia antirretroviral se observó descenso de la carga viral en sangre (638 copias/mL) pero aumento en LCR (1.180.000 copias/mL). Al alta, la puntuación en la evaluación cognitiva Montreal (MoCA) fue de 9/30, con mayor afectación del recuerdo diferido, atención y lenguaje; 8/18 en la batería de evaluación frontal (Frontal Assesment Battery, FAB), con una capacidad de abstracción intacta, pero fluencia léxica de 0 e importante compromiso del control inhibitorio, ejecución de series motoras e instrucciones conflictivas; el test del trazo (Trail Making Test, TMT) resulta imposible debido al déficit atencional; la Figura compleja de Rey-Osterrieth3 y el test del reloj a la orden se muestran en la Figura 2.
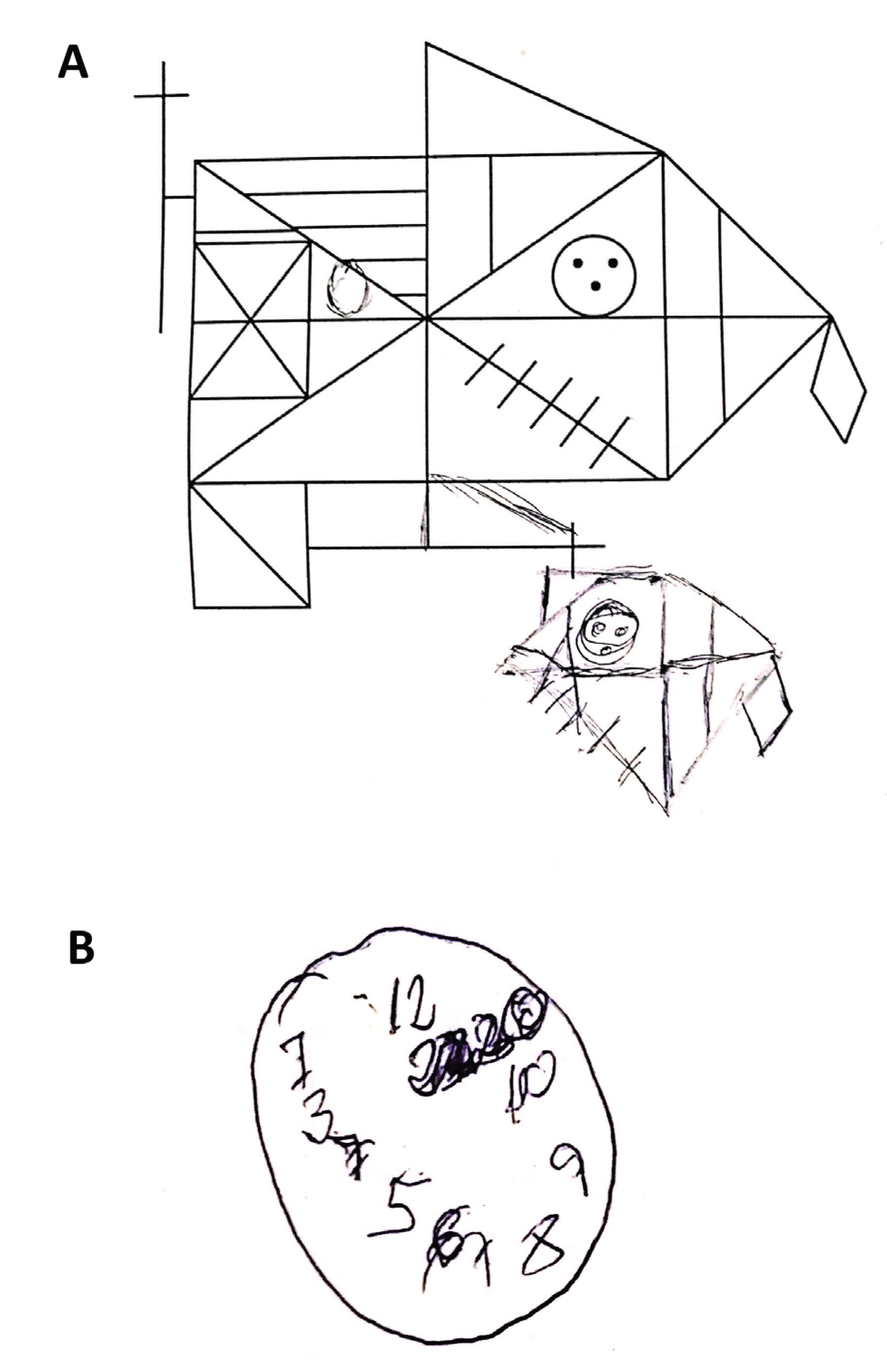
Figura 2. Fragmento de la valoración neuropsicológica en las primeras semanas del ingreso. A. Copia de la Figura compleja de Rey-Osterrieth, que se clasificaría dentro del tipo V (el sujeto realiza un grafismo poco estructurado en el que no se puede reconocer el modelo, pero sí se identifican ciertos detalles) y para la que el paciente requirió 4 minutos; en la reproducción de memoria el paciente no realizó ningún trazado. B. Test del reloj a la orden. Esfera correcta, algo ovalada; números en rotación inversa y con ausencia de manecillas y de algunos de ellos. Al pedirle que el reloj marcara las 10:10, el paciente escribió "23:20" sobre el número 11.
En el control realizado a los tres meses tras el alta hospitalaria, tanto el paciente como su familia refirieron mejoría subjetiva de su funcionalidad. Para monitorizar esta mejoría se repitió la determinación de carga viral en plasma y LCR, observándose una reducción en ambos (136 y 75.263 copias/mL, respectivamente), lo que conformó la adecuada penetración al SNC. Asimismo, se constató un mejor rendimiento en la evaluación neuropsicológica: MoCA 23/30 (fallos en dominio visual-espacial, atención y fluencia léxica), FAB 16/18 (déficit en control inhibitorio), TMT-A sin fallos en 40 segundos y TMT-B con 3 fallos no autocorregidos en 3 minutos 53 segundos; la Figura compleja de Rey-Osterrieth y el reloj se muestran en la Figura 3.
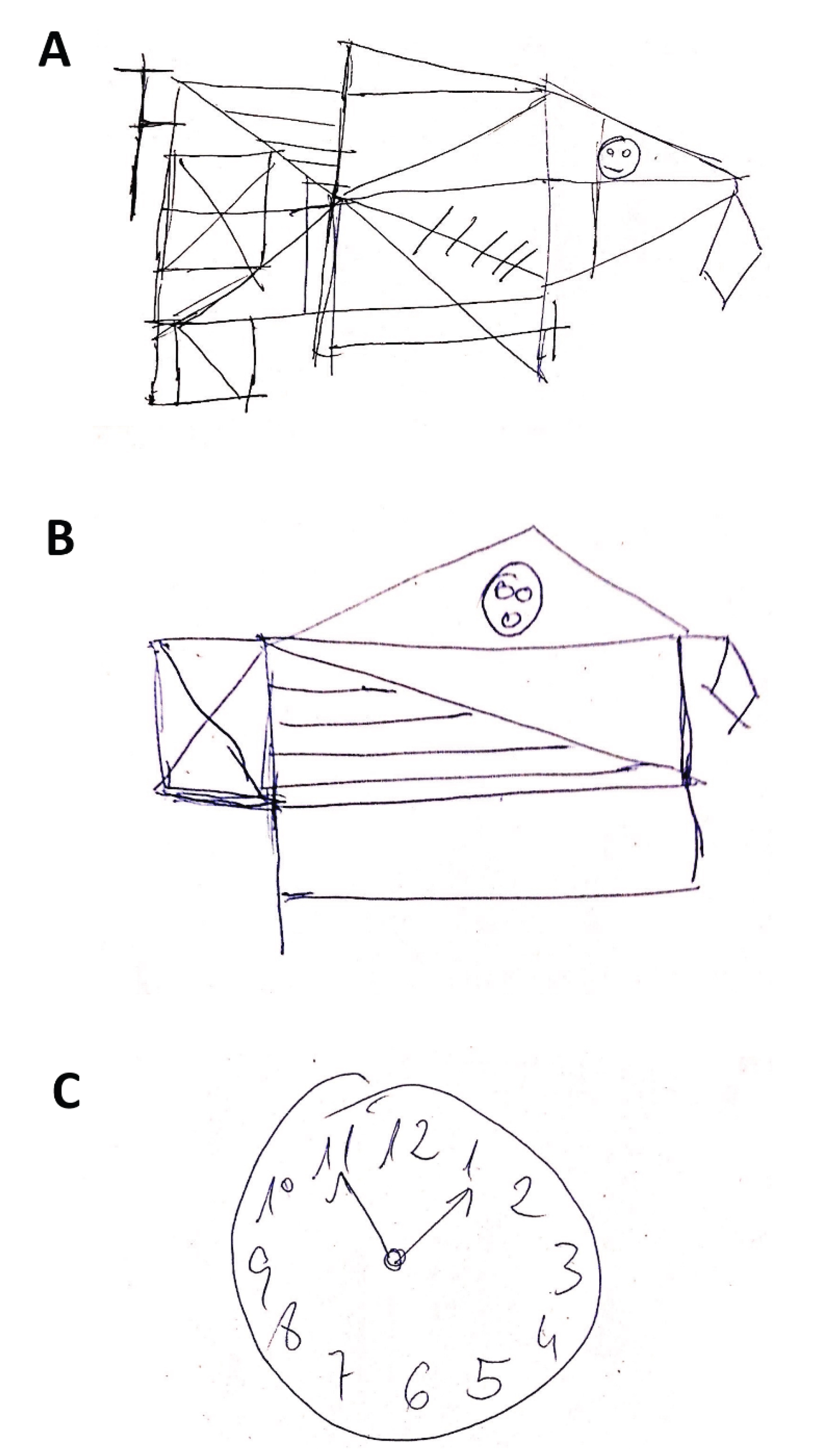
Figura 3. Valoración neuropsicológica a los 3 meses del alta (fragmento). A. Copia de la Figura compleja de Rey-Osterrieth tipo IV (yuxtaposición de detalles; el sujeto va construyendo los detalles contiguos sin una adecuada planificación, pero con un adecuado resultado final) en 4 minutos y 40 segundos. B. Reproducción de la Figura compleja de Rey-Osterrieth tipo VI (reducción a un esquema familiar; el sujeto utiliza los elementos que recuerda para trasladarlos a una Figura familiar, en este caso, una casa) en 3 minutos y 40 segundos. C. Test del reloj con esfera. números y manecillas correctamente posicionados.
Discusión
El diagnóstico de HAD en un paciente con VIH confirmado requiere un alto índice de sospecha. La técnica de neuroimagen de elección es la resonancia magnética; aunque los hallazgos son inespecíficos, en las secuencias ponderadas en T2 se puede detectar hiperintensidad parcheada a nivel de sustancia blanca2, como se observó en nuestro paciente. Casos más larvados se presentan con atrofia de predominio subcortical, con preferencia por ganglios basales (principalmente el núcleo caudado) y sustancia blanca. En el LCR de personas con VIH no tratadas es habitual hallar hiperproteinorraquia y carga viral elevada. Aunque no se ha demostrado asociación entre déficit neurológico y carga viral en LCR, un número de copias en LCR igual o mayor que en sangre, como en el caso actual, sugiere la presencia de HAD5. La batería neuropsicológica recomendada incluye la prueba de dígitos WAIS-III (Wechsler Adult Intelligence Scale) para evaluar la atención y memoria de trabajo, el TMT para la atención y velocidad de procesamiento; la Figura de Rey-Osterrieth para el aprendizaje y la visuoconstrucción, y el Grooved Pegboard Test para las habilidades motoras7.
La principal herramienta para tratar y prevenir el HAND es la terapia antirretroviral, que ha supuesto un descenso en la frecuencia de formas más graves. Se han descrito mejores puntuaciones en pruebas neuropsicológicas de pacientes con terapia antirretroviral que en pacientes no tratados6. Datos del estudio europeo CASCADE sugieren una incidencia de HAD de 0,66 por 1.000 personas-año, diez veces menor respecto a la era pre-terapia antiretroviral. No obstante, la tasa de formas más leves de HAND ha aumentado. En España se estima una frecuencia de HAND de 40-50%, similar a la descrita en otros países7. La persistencia de esta prevalencia de trastornos cognitivos en la actualidad puede estar justificada por la escasa penetración de algunos antirretrovirales al SNC o la peor adherencia de estos pacientes al tratamiento. Otros factores relevantes implicados en el desarrollo de HAND son la neuroadaptación y la compartimentalización. La neuroadaptación es el fenómeno por el cual un determinado virus se adapta con mayor facilidad al SNC; un indicador de neuroadaptación es una carga viral en LCR tan alta como en plasma, que se traduce en un mayor riesgo de HAND; en nuestro paciente era cinco veces mayor en LCR que en plasma. En cuanto al concepto de compartimentalización, sabemos que inicialmente los virus aislados en LCR y en sangre son genéticamente idénticos, pero con el tiempo pueden evolucionar y desarrollar un distinto patrón de resistencias; de esta manera, fármacos que suprimen eficazmente la replicación viral a nivel sistémico, pueden no ser capaces de hacerlo en el SNC. Otros factores de riesgo de HAND son la predisposición genética, edad avanzada, co-infección por virus de hepatitis C o nadir (número más bajo de recuento) de CD4+, que en este paciente fue de 13/mm3.
La concienciación de la población en la prevención de enfermedades de transmisión sexual ha disminuido el diagnóstico de VIH en fase de SIDA. La tasa de presentación tardía de VIH (definida por recuento de CD4+ al diagnóstico <350/mm3 o con enfermedad definitoria de SIDA) así como de presentación avanzada (diagnóstico con CD4+ <200/mm3 o enfermedad definitoria de SIDA en los seis meses siguientes al diagnóstico) aumentó en la década de los 80-90 para posteriormente estabilizarse y reducirse levemente a partir del año 2000. En personas heterosexuales, sin embargo, el porcentaje de presentación tardía ha aumentado de un 37% en 1985 a un 67% en 2013. Otros grupos de riesgo para presentación tardía son varones, >50 años o migrantes8. Este cambio de paradigma en factores de riesgo y perfil de paciente podría haber supuesto pasar por alto el hecho de que nuestro paciente cumplía varios de estos factores. Además, revisando la historia clínica, en el último año constaban múltiples consultas a Atención Primaria por infecciones leves pero recurrentes, que tal vez en otro perfil de paciente sí habría despertado la sospecha de inmunodepresión secundaria.
Tampoco podemos minimizar el papel que haya jugado el contexto epidemiológico actual de pandemia por COVID-19. Por un lado, el colapso del sistema sanitario ha obligado a redistribuir recursos y priorizar la atención telefónica; por otro, algunos pacientes han preferido consultar menos o más tardíamente por miedo al contagio. Además, nuestro paciente debutó con un cuadro ansioso-depresivo; y el confinamiento y aislamiento social de esta época han servido en ocasiones para justificar este tipo de cuadros, que en algunos casos solo enmascaraban la verdadera causa subyacente. Probablemente, la valoración inicial del paciente realizada telefónicamente desde Atención Primaria dificultó la correcta catalogación del cuadro y facilitó que pasaran desapercibidos los síntomas cognitivos iniciales.
La importancia de un diagnóstico precoz radica no solo en la reducción de la mortalidad y costes sanitarios, sino también en una reducción del riesgo de transmisión en pacientes tratados (de hecho, la pareja del paciente resultó infectada). Es crucial despojarnos de los perfiles tradicionales de personas con VIH y tener siempre en cuenta el HAND dentro el diagnóstico diferencial de demencia rápidamente progresiva, pues, a pesar de su baja frecuencia, se trata de una de las pocas causas de demencia con potencial tratamiento efectivo.














