Introducción
Las infecciones Relacionadas con la Asistencia en Salud (IRAS) son infecciones causadas por gran variedad de hongos, bacterias y virus adquiridos durante la asistencia a la salud en el tratamiento de otras afecciones, ya sea en el período de ingreso en establecimientos de salud o en la atención domiciliaria 1)(2.
Estos agentes son transmitidos por contaminación cruzada al entrar en contacto con el ambiente de salud, ya que las superficies sirven de abrigo a los microorganismos cuando ocurren fallas en la limpieza ambiental, en el procesamiento de artículos y ropas y en el uso de las precauciones-estándar. De este modo, la infección puede instalarse en el organismo del paciente, dependiendo de las condiciones de salud1)(2)(3.
En las unidades de terapia intensiva neonatal (UTIN), se exige que las directrices enfocadas en la prevención y control de las IRAS sean cumplidas de forma rigorosa, principalmente al tomar en cuenta que el recién nacido (RN), aún en las mejores condiciones, nace susceptible a las infecciones debido a que su sistema inmunológico es naturalmente inmaduro. Adicionalmente, desde el momento del parto, se inicia en el RN el proceso de colonización por agentes virulentos que continúa por el contacto con la madre, familiares, el equipo multiprofesional, así como también, con objetos utilizados en la asistencia, muchas veces contaminados, como termómetros, estetoscopios, incubadoras, y otros transductores4.
En ese ambiente hospitalario, las superficies, manos y delantales de los trabajadores de la salud están muchas veces contaminados por microorganismos resistentes a los antimicrobianos, que pueden sobrevivir en estos lugares por días, semanas y hasta meses, constituyendo el principal mecanismo para la colonización e infección del RN5.
La ocurrencia de la infección, a partir de la colonización, va a depender del grado de madurez inmunológica del neonato y de la virulencia del microorganismo6. Mientras tanto, los RN internados en UTIN son prematuros, de bajo peso al nacer y frecuentemente pasan por procedimientos invasivos7)(8. Otro factor agravante es que la UTIN es un lugar considerado insalubre por agregar en sus superficies microorganismos patógenos y resistentes a los antimicrobianos9.
Por lo antes expuesto, las medidas establecidas para la prevención de las IRAS incluyen rigurosa Higiene de las Manos (HM), uso correcto de equipo de protección individual, y proceso de limpieza y desinfección de artículos y superficies del ambiente de salud10. La no adhesión a tales prácticas expone al RN a la colonización por microorganismos, configurando en incumplimiento de los principios de seguridad del paciente, pudiendo generar incidentes graves para la salud del niño, inclusive el óbito11.
La mortalidad neonatal global es estimada en 31 por 1000 nacidos vivos. Y 36% de todas las muertes de niños menores de cinco años son de RN, sumando cuatro millones de muertes anualmente. Se estima que las principales causas de las muertes neonatales sean por partos prematuros (28%), infecciones severas (26%), y asfixia (23%)12. En Brasil, 60% de las muertes entre los niños en el primer año de vida ocurren en el período neonatal, y las sepsis constituyen las principales causas de muerte13.
Apoyados en la problemática de las IRAS en el contexto de las UTIN, y entendiendo la relevancia de la prevención y el control de las infecciones en este lugar, el presente estudio tuvo por objetivo analizar las evidencias científicas con respecto a las infecciones relacionadas con la asistencia a la salud en Unidades de Terapia Intensiva Neonatal.
Metodología
Se trata de un estudio de revisión integradora, cuya técnica reúne y sintetiza los conocimientos producidos por estudios originales a través del análisis de los resultados14.
La pesquisa bibliográfica fue realizada en la Biblioteca Virtual de Salud - Bireme, utilizando los siguientes descriptores (DeCS): Unidades de Terapia Intensiva Neonatal, Recién Nacido e Infección Hospitalaria, de todos los artículos científicos publicados e indexados en los bancos de datos disponibles.
Los resultados de la investigación señalaron 108 artículos científicos en los bancos de datos electrónicos del LILACS y 1260 en el MEDLINE. Así, fueron incluidos en el estudio: artículos científicos indexados en estos bancos de datos, completos y disponibles on line, con los descriptores de salud señalados arriba. Se incluyeron estudios con respecto a IRAS ocasionadas por bacterias y hongos publicados en el período de 2000 a 2015, en los idiomas portugués, inglés y español. Se excluyeron los artículos relacionados con las transmisiones cruzadas de infecciones virales en el ambiente hospitalario. La muestra final estuvo conformada por 36 artículos publicados nacional e internacionalmente.
Después de realizar la lectura exploratoria y selección del material, se inició la lectura analítica e interpretativa de las obras escogidas. Posterior a eso, se procedió a realizar anotaciones del problema de pesquisa, resaltando las principales ideas y los datos más importantes14.
Se confeccionaron fichas estructuradas para la identificación de las obras consultadas, el registro del contenido y las anotaciones del análisis de cada una de ellas. El proceso de lectura y análisis posibilitó la creación de tres categorías: caracterización de los artículos científicos, principales microorganismos causadores de las IRAS en recién nacidos y, determinantes de la ocurrencia de IRAS en recién nacidos.
Los datos fueron insertados en tablas del programa Microsoft Office Excel 2010 para Windows y analizados por estadística descriptiva, utilizándose frecuencia simple. Las variables categóricas fueron presentadas en sus valores absolutos (n) y relativos (porcentajes). Posteriormente, los resultados fueron discutidos basándose en estudios científicos, para la construcción del informe final.
Resultados
Caracterización de los artículos científicos
La figura a continuación presenta los 36 artículos analizados en este estudio, la mayoría publicado en la base de datos LILACS, 21 (58%).
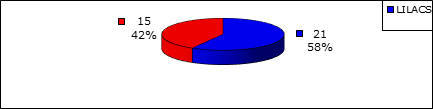
Figura 1 Artículos completos publicados en las bases de datos LILACS y MEDLINE con respecto a la ocurrencia de IRAS en UTIN en el período de 2000 a 2015.
El número de artículos según la distribución por año de publicación varió de 1 a 5, encontrándose el menor número en el año 2000, un artículo, y el mayor número en el año de 2007, cinco artículos.
Las principales revistas de publicación de los artículos fueron la Journal of Clinical Microbiology, con 11 artículos (30,5%), seguida por la revista The Brazilian Journal of Infectious Disease, con 4 artículos (11,1%), la Revista de la Sociedad Brasileira de Medicina Tropical y la BMC Pediatrics, con tres artículos cada una (8,3%), la BioMed Central (BMC) Infecious Diseases, la Journal of Pediatriae, la Arch Dis Child Fetal Neonatal, y la Antimicrobial Agents and Chemotherap con dos artículos cada una (5,5%), y las demás: Arquivos de Ciencias da Saúde, Revista Chilena de Infectología, American Journal Infection Control, West Indian Med Journal, Brazilian Journal of Microbiology, Rev Peru Med Exp Salud Publica, Infect Control Hosp Epidemiology, con un artículo cada una (2,78%).
Algunas de las publicaciones analizadas se presentan en el cuadro a continuación con informaciones sobre el contenido y lugar de publicación.
Cuadro 1 Distribución de los principales estudios científicos sobre Infecciones Relacionadas con Asistencia en Salud en Unidades de Cuidados Intensivos Neonatal, de 2000 a 2011.
| Artículos | Objetivo | Metodología | Micro-organismos | Factores asociados a las IRAS en UTIN | Lugar |
|---|---|---|---|---|---|
| Brito DVD, Oliveira EJ, Abdallah VOS, Darini ALC, Gontijo Filho PP. An Outbreak of Acinetobacter baumannii Septicemia in a Neonatal Intensive Care Unit of a University Hospital in Brazil. The Brazilian Journal of Infectious Diseases 2005;9(3):301-309. | Describir un brote de infección nosocomial causada por clones de A.baumannii multidrogarresis tente (MDR) en una UTIN. | Investigación epidemiológica por tipificación molecular. | Acinetobacter baumannii | Exposición a antibióticos y procedimientos invasivos, peso al nacer ≤1500g, edad ≤ 7 días y duración de la hospitalización ≥ 7 días. | Minas Gerais, Brasil |
| Lupetti A, Tavanti A, Davini P, Ghelardi E, et al. Horizontal Transmission of Candida parapsilosis Candidemia in a Neonatal Intensive Care Unit. Journal of clinical microbiology, July 2002, p. 2363-2369 | Describir la adquisición nosocomial de Candida parapsilosis con ocurrencia de candidemia en uno de los seis prematuros internados. | Investigación epidemiológica por Tipificación molecular. | Candida parapsilosis | Transmisión cruzada por las manos de trabajadores de la saud. | Italia |
| Caubilla-Barron J, Hurrell E, Townsend S, Cheetham P, et al. Genotypic and Phenotypic Analysis of Enterobacter sakazakii Strains from an Outbreak Resulting in Fatalities in a Neonatal Intensive Care Unit in France. Journal of clinical microbiology. 2007, p. 3979-3985. | Investigar un brote de infecciones Enterobacter sakazakii en una UTIN. | Investigación epidemiológica por secuenciamien to genético. | Enterobacter sakazakii | Fórmula infantil contaminada. | Francia |
| Strabelli TMV , Cais DP, Zeigler R, Rinaldo Siciliano, et al. The Brazilian Journal of Infectious Diseases.The Brazilian Journal of Infectious Diseases 2006;10(2):113-6. | Determinar el origen de las infecciones. | Estudio epidemiológico. | Enterococcus faecalis | Contacto con los equipamientos y superficies del ambiente de salud. | São Paulo, Brasil |
| Cassettari VC, Silveira IR, Balsamo AC, Franco F. Outbreak of extended-spectrum beta-lactamase-producing Klebsiella pneumoniae in an intermediate-risk neonatal unit linked to onychomycosis in a healthcare worker.J Pediatr (Rio J). 2006;82(4):313-6. | Describir brote por Klebsiella pneumoniae productora de beta-lactamase de espectro extendido en vivero de riesgo intermedio. | Estudio de caso. | Klebsiella pneumoniae | Profesional de salud que presentaba onicomicosis y era portadora de Klebsiella pneumoniae productora de beta-lactamase de espectro exstendido en las manos. | São Paulo, Brasil |
| Crivaro V, Popolo AD, Caprio A, Lambiase A, Resta MD, et al. Pseudomonas aeruginosa in a neonatal intensive care unit: molecular epidemiology and infection control measures.BMC Infectious Diseases 2009, 9:70. | Analizar la epidemiología molecular y susceptibilidad antimicrobiana de aislados de P. aeruginosa; Describir las medidas de control de infección. | Investigación epidemiológica por Tipificación molecular. | Pseudomonas aeruginosa | Contaminación de las manos de un profesional de salud, y de la superfície ambiental (pia). Hubo una actividad educativa con los profesionales para la limpieza y desinfección de las manos. | Italia |
| Trotman H, Bell Y. Neonatal Sepsis in very Low Birthweight Infants at the University Hospital of the West Indies. West Indian Med J. 2006; 55 (3): 165 | Describir la presentación clínica, los micro-organismos causadores y los resultados de la sepsis bacteriana en RN. | Análisis retrospectivo de cultivo de casos de sepsis. | Klebsiella sp; Streptococcus Grupo B e D; E. coli; | Prematuridad, muy bajo peso al nacer, inicio precoz de la septicemia. Estrategias de prevención: limitar el uso de antibióticos de largo espectro y refuerzo de las políticas de control de infección. | Jamaica |
| Bizzarro MJ, Dembry LM, Baltimore RS, Gallagher PG. Case-control analysis of endemic Serratia marcescens bacteremia in a neonatal intensive care unit. Arch Dis Child Fetal Neonatal Ed. 2007;92:F120-F126 | Identificar los factores de riesgo, señales y resultados asociados a la S. marcescens causadora de bacteriemia no epidémica enUTIN. | Estudio de caso-control. | Serratia marcescens | Prematuridad, bajo peso al nacer. Está asociado a casos de meningitis con mortalidad elevada. | EUA |
| Gomez-Gonzalez C, Alba C, Otero JR,Sanz F, et al. Long Persistence of Methicillin-Susceptible Strains of Staphylococcus aureus Causing Sepsis in a Neonatal Intensive Care Unit.Journal of clinical microbiology. July 2007, p. 2301-2304 | Determinar la tipificación molecular y el posible papel de profesionales de salud como reservorio de infección. | Estudio epidemiológico de tipificación molecular. | Staphyloco ccus aureus | Tres clones causadores de bacteriemia fueron encontrados en los trabajadores de salud, evidenciando aspectos de la transmisión cruzada. | España |
Principales microorganismos causadores de IRAS en recién nacidos
En el análisis de los artículos seleccionados, 30 microorganismos fueron causantes de IRAS en recién nacidos. Los principales están distribuidos en la tabla a continuación.
Tabla 1 Principales microorganismos causantes de IRAS en Unidades de Terapia Intensiva Neonatal, distribuidos entre los estudios analizados (N) en el período de 2000 a 2015.
| Variables | N | % |
|---|---|---|
| Acinetobacter | 2 | 6,7 |
| Candida | 7 | 23,3 |
| Enterobacter | 1 | 3,3 |
| Enterococcus | 1 | 3,3 |
| Klebsiella pneumoniae | 4 | 13,3 |
| Pseudomonas aeruginosa | 4 | 13,3 |
| Serratia marcescens | 2 | 6,7 |
| Sthaphylococcus spp. | 9 | 30,0 |
| Total | 30 | 100 |
Durante el análisis de los 36 artículos seleccionados, se verificó la ocurrencia de infecciones por 30 tipos de microorganismos, entre las diversas especies. Así, Acinetobacter y Serratia marcescens fueron relatadas, cada una, en 6,7% de los artículos. El género Candida fue citado en 23,3% de los artículos, con más de una especie. Los géneros Enterobacter y Enterococcus fueron relatados en 3,3%, respectivamente. Así como Klebsiella pneumoniae y Pseudomonas aeruginosa en 13,3% de los estudios. En la mayoría investigada, 30% resultó ser Sthaphylococcus spp.
Tabla 2 Principales microorganismos causadores de septicemia en recién nacidos internados en UTIN distribuidos entre los estudios analizados (n) entre 2000 y 2015.
| Septicemia por: | n | % |
|---|---|---|
| Acinetobacter baumannii | 2 | 20 |
| Candida spp. | 3 | 30 |
| Staphylococcus spp. | 5 | 50 |
| Total | 10 | 100 |
De los 36 artículos analizados, 10 relataron la ocurrencia de septicemia en recién nacidos ingresados en UTIN. De estos, los principales microorganismos causadores de sepsis neonatal fueron Acinetobacter baumannii, relatado en 20% de los artículos, Candida spp en 30%, y Staphylococcus spp en 50% de los estudios analizados.
Determinantes de la ocurrencia de IRAS en recién nacidos
Entre los 36 artículos analizados se identificaron 46 fuentes de infección y/o causas de la infección en los recién nacidos ingresados en UTIN. Esto incluye los factores asociados y los factores de riesgo para la ocurrencia de IRAS, así como las propias características de la población asistida en la localidad, el tiempo de internación prolongado, el uso indiscriminado de antimicrobianos y los procedimientos invasivos utilizados en el tratamiento.
Tabla 3 Determinantes para la ocurrencia de IRAS en recién nacidos ingresados en UTIN, distribuidos entre los estudios analizados (n= 46) en el período entre 2000 y 2015.
| Fuentes de Infección del RN: | n | % |
|---|---|---|
| Transmisión cruzada - ambiente y manos contaminadas | 16 | 34,8 |
| Uso indiscriminado de antibióticos | 7 | 15,2 |
| Características del RN - prematuridad, bajo peso y patologías asociadas | 7 | 15,2 |
| Uso de cateter venoso central | 5 | 10,9 |
| Uso de nutrición parenteral total | 3 | 6,5 |
| Uso de ventilación mecánica | 3 | 6,5 |
| No identificado fuente de transmisión del patógeno Tiempo de internación prolongado | 3 2 | 6,5 4,3 |
Se resalta que la mayoría de las IRAS, 34,8% fue determinada por la contaminación cruzada y, por lo tanto, causada por el propio ambiente insalubre y por las manos contaminadas de los trabajadores de salud que actúan en la UTIN.
Discusión
La revisión integradora realizada permitió comprender la problemática de las Infecciones Relacionadas con la Asistencia a la Salud en recién nacidos ingresados en UTIN, considerando que estos incidentes repercuten en todo el mundo, aumentando los índices de morbilidad y mortalidad de esa población.
Los artículos analizados señalaron la ocurrencia de surtos infecciosos de difícil control que culminaron empeorando el pronóstico y, muchas veces, en óbitos de RN. Esto debido a los determinantes de la ocurrencia de IRAS asociados a los factores de riesgo propios de esa población, como prematuridad, bajo peso al nacer, condiciones al nacer y patologías asociadas. Así como los factores asociados con la ocurrencia de IRAS, período prolongado de internación, realización de procedimientos invasivos, fallas en las precauciones estándar y condiciones de insalubridad del ambiente de la UTIN.
Los principales microorganismos causadores de Infecciones Relacionadas con la Asistencia a la Salud en UTIN son los Staphylococcus spp., mencionados en 30% de los artículos. Y de todos los episodios de IRAS analizados, 27,8% tuvieron como resultado la septicemia en recién nacidos.
Las sepsis ocurrieron principalmente por la contaminación de los RN por Staphylococcus epidermidis, aureus, capitis y hominis siendo la causa de la mitad (50%) de las sepsis registradas en las publicaciones.
Los Staphylococcus, especialmente S. epidermis y S. aureus, están entre los principales microorganismos asociados a las IRAS. El S. epidermidis es más común en la piel y puede ser introducido en el ambiente por pacientes o profesionales de la salud, siendo agravada por las cepas resistentes. En el estudio fueron aislados S. epidermidis de la UTI neonatal, pediátrica y adulto. La frecuencia de tipos multiresistentes fue de 67,7% en la unidad neonatal, 66,6% en la pediátrica y 60,8% en la UTI adulto16.
La sepsis es definida como una respuesta inflamatoria sistémica asociada a una infección sospechosa o comprobada originada por hongos, bacterias o virus, y que se manifiesta clínicamente por medio de signos y síntomas característicos como hipoglicemia e hipertermia, que puede o no ser confirmada por exámenes de cultivo8,17.
La cantidad de catéteres periféricos, la edad gestacional y la duración de la nutrición parenteral son atribuidas al riesgo de desarrollar una o más infecciones en la corriente sanguínea relacionada con el cateter18.
Un estudio identificó por medio de tipaje molecular, que la septicemia causada en la UTIN ocurrió por Staphylococcus coagulase-negativo multiresistente a antimicrobianos. Y que la principal forma de contaminación fue la transmisión cruzada debido a la colonización de los trabajadores de la salud y del ambiente de la UTIN por tales microorganismos19.
Los microorganismos multirresistentes son aquellos que sobreviven frente a diferentes clases de antimicrobianos, siendo comprobado por examen microbiológico. Los principales patógenos multirresistentes causadores de IRAS son Enterococcus spp resistente a los glicopéptidos, Staphylococcus spp resistente o con sensibilidad intermedia a vancomicina, Pseudomonas aeruginosa, Acinetobacter baumannii, y Enterobacterias resistentes a carbapenémicos (ertapenen, meropenem o imipenem)20.
En otro estudio el Staphylococcus coagulase-negativo, de la especie epidermidis, fue responsable por 56 (30,4%) de las 184 infecciones que ocurrieron en la UTIN. De estas, 35 (39,8%) infecciones ocurrieron en la corriente sanguínea, 14 (29,8%) infecciones de superficie, la mayoría conjuntivitis, y siete (58,3%) casos de meningitis. Otros patógenos menos frecuentemente aislados en infecciones fueron S. aureus (27,2%), Klebsiella pneumoniae (16,3%), y Candida albicans (9,2%)21. Algunos estudios consideran que deben ser tomadas medidas rigurosas para la prevención y el control de las infecciones, así como la reducción del uso indiscriminado de antimicrobianos19,21.
Otro caso de infección de la corriente sanguínea por Staphylococcus coagulase-negativo ocurrió en un prematuro ingresado en UTIN. La especie identificada fue Staphylococcus capitis, resistente a la vancomicina. La infección permaneció por tres semanas, a pesar del tratamiento con antibiótico y sustitución de todos los catéteres intravenosos. El neonato fue a óbito debido a la enterocolitis necrotizante durante el seguimiento de la sepsis. Así, la resistencia a la vancomicina puede ser la causa de las fallas durante el tratamiento en la UTIN, y tornarse endémica en dichas unidades22.
En otro estudio se aisló Staphilococcus hominis de la subespecie novobiosepticus (SHN), en 32 muestras de 21 pacientes, 18 de ellos eran neonatos, siendo que 13 ocasionaron sepsis. Estos datos evidencian los SHN como un importante patógeno causador de bacteriemias en neonatos23.
Un caso de IRAS por Candida parapsilosis ocurrió en uno de los seis prematuros que estaban ingresados en UTIN, en un hospital de la ciudad de Pisa, Italia. El neonato era un paciente crítico, con enfermedad degenerativa, y no estaba colonizado por C. parapsilosis en la admisión. Posteriormente, presentó conjuntivitis sintomática que evolucionó hacia una candidemia. Al evaluar la fuente de infección, fue detectado C. parapsilosis, genéticamente idéntico, en las manos de dos enfermeras que atendieron al neonato, concluyendo que la infección ocurrió por transmisión cruzada, por medio de manos contaminadas24.
Otro estudio mencionó Candida tropicalis como significativa para adquisición de fungemia en neonatos, habiendo ocurrido dos episodios de infección en la UTIN25.
De los estudios encontrados en la literatura, cuatro (13,33%) relacionaron las IRAS en recién nacidos con la Klebsiella pneumoniae e, otros cuatro estudios analizaron Pseudomonas aeruginosa.
La bacteria Klebsiella pneumoniae, productora de beta-lactamasa de espectro extendido, causó surto en guardería de riesgo intermedio. El surto duró seis meses y afectó 36 recién nacidos, causando 29 colonizaciones y siete infecciones. En la primera fase del surto los neonatos desarrollaron infección, pero la segunda fase fue asintomática, siendo identificados por cultivo de vigilancia. La fuente de infección era un profesional de la salud que presentaba onicomicosis en las manos, siendo portador de Klebsiella pneumoniae productora de beta-lactamasa de espectro extendido. Se intensificaron las medidas básicas de prevención de infecciones hospitalarias26.
Un estudio analizó 22 neonatos de muy bajo peso al nacer, que fueron admitidos en la UTIN con cultivo positivo para sepsis. De estos, 16 (73%) sobrevivieron y seis (27%) murieron. El peso de nacimiento y la edad gestacional aumentan el riesgo de infección. Los principales aislados fueron Klebsiella sp. (10,37%), Streptococcus tipo D (4,15%), Escherichia coli (3,11%) y Streptococcus tipo B (3,11%). La Klebsiella sp afectó ocho de los 13 neonatos (62%) con infecciones tardías. Las complicaciones incluyeron anemia, trombocitopenia, hemorragia y muerte múltiple de órganos. Estrategias de prevención como, limitar el uso excesivo de antibióticos de amplio espectro y una revisión y refuerzo continuo de las políticas de control de infección fueron adoptadas para ayudar en la reducción de la mortalidad y morbilidad asociada a las IRAS27.
Un tipo de Klebsiella pneumoniae, con alto nivel de resistencia a un amplio espectro de cefalosporinas, fue aislado en una UTIN durante una infección nosocomial de un hospital en Japón28.
Los BGN multiresistentes pueden ser divididos en dos grupos. Los no fermentadores de glucosa, como Pseudomonas aeruginosa y Acinetobacter spp, causadores de infección del tracto respiratorio, de alto costo para el tratamiento de los pacientes infectados, y la Stenotrophomonas maltophylia y Burkholderia cepacea. Y, los fermentadores de glucosa, Enterobacter spp., E. coli, Klebsiella spp., Serratia spp., Citrobacter spp., Proteus spp., que causan infecciones respiratorias y urinarias29.
Un surto de conjuntivitis debido a Pseudomonas aeruginosa involucró siete neonatos de una UTIN. Tres neonatos desarrollaron complicaciones sistémicas, resultando en una sepsis y dos pneumonías. Uno de ellos presentó septicemia fulminante y, consecuentemente, óbito, debido a la prematuridad y peso al nacer menor a 1000g. Los otros neonatos respondieron bien al tratamiento con imipenem y ciprofloxacino. La cepa aislada era resistente a ceftazidima y aminoglicosídios. La diseminación puede haber ocurrido por las manos de los profesionales o por el tracto respiratorio debido a intubación30.
Ocho infecciones por P. aeruginosa en neonatos ocurrieron en un período de dos meses debido al consumo de leche humano pasteurizado contaminado. Durante la investigación del surto, se descubrió que la leche estaba siendo contaminada durante la descongelació. A pesar de ser rutinario el análisis microbiológico antes de ser embalado y congelado, los análisis en la leche no eran repetidos después de descongelar. El mismo microorganismo causador de la infección en los RN fue encontrado en la UTIN, en el equipo utilizado para calentar todos los recipientes para alimentar los neonatos. El uso de estos materiales fue descartado inmediatamente y se intensificaron las técnicas asépticas durante el transporte de los recipientes. Así, la detección y prevención de la transmisión de paciente a paciente es necesaria, pero también la prevención de la contaminación ambiental31.
En un estudio se identificaron 25 casos de bacteriemia por Serratia marcescens. Se evaluaron once aislados, que pertenecían a cepas diferentes. Los neonatos infectados tenían edad promedio gestacional de 28 semanas y peso al nacer de 1235 g. La infección ocurrió probablemente por el uso de catéter venoso central, procedimiento quirúrgico e intubación prolongada. También se observó mayor tasa de meningitis causada por S. marcescens, al compararse con E. coli( 22 ).
En 1994, un surto de infección por Enterobacter sakazakii ocurrió en una UTIN de Francia. Durante el surto, 13 neonatos fueron infectados con E. sakazakii, resultando en 3 muertes. Otros cuatro neonatos fueron colonizados, sin embargo, se mantuvieron asintomáticos33.
Un surto de infección por E. coli ocurrió entre abril y mayo de 2004 en una UTIN, donde cuatro neonatos tuvieron la infección. Los Enterococcus spp. son microorganismos considerados de baja patogenicidad por constituir la flora bacteriana normal de los tractos gastrointestinal y genitourinario. Sin embargo, en los últimos años, ha causado infecciones y aumentado las tasas de mortalidad. Así, se han redoblado las medidas de prevención y control de las IRAS como precauciones de contacto, limpieza y desinfección adecuada de equipos y superficies, baño del RN con clorhexidina-gluconato al 2%, reeducación de los profesionales y refuerzo de las medidas de prevención34.
Entre los Bacilos Gran-Positivos (BGP), los del género Enterococcus spp de las especies E. faecalis y E. faecium, causan la mayoría de las infecciones siendo la primera la más frecuente en Brasil 90%, y la segunda con 5% a 10%. Esos BGP crecen en soluciones salinas y en detergentes, pudiendo sobrevivir hasta siete días en superficie, siendo naturalmente resistentes a varios antimicrobianos29.
En un estudio se analizaron muestras de jabón cuyos principales microorganismos aislados fueron: Burkholderia cepacia, Pseudomonas putidas, P. aeruginosa, Klebsiella pneumoniae, Enterobacter cloacae, P. luteola. La B. cepacea, BGN, puede colonizar diversas superficies ambientales húmedas y está asociada a IRAS35.
Las recomendaciones de las directrices para la prevención y el control de IRAS se refieren a indicaciones adecuadas para uso de catéteres y período de permanencia, inserción aséptica de catéteres y técnica correcta, equipo estéril, uso de antisépticos en el lugar de inserción, mantenimiento de técnica aséptica durante los cuidados con los catéteres y curativos, técnica correcta de higiene de manos, uso de EPIs (gorro, máscara, capote estéril, guantes estériles y campo estéril), cuidados con el ambiente y la limpieza y desinfección de superficies36.
La prevención y el control de infección también implican el control ambiental. La escasez de material de limpieza, rutina inadecuada de limpieza y desinfección de superficies ambientales, de equipos y artículos no críticos, como grifos y lavamanos, incubadoras, estetoscopios, termómetros y engrasadores, así como el uso impropio de EPI puede agravar la salud de los pacientes y también de los profesionales1) (2) (3) (4.
Teniendo claro esto, son necesarios, para la prevención de infecciones, estructura física, instalaciones y materiales adecuados, así como, el entrenamiento de funcionarios y acciones en conjunto del equipo multiprofesional37.
Conclusión
A pesar de la amplia divulgación en la literatura, las medidas de prevención y control de las IRAS no son aún desempeñadas adecuadamente en los servicios de salud. Se puede afirmar, por medio de los estudios aquí analizados que surtos infecciosos ocurren con frecuencia en UTIN por falta de adhesión a higiene de manos, fallas en técnicas asépticas, y en la limpieza y desinfección de superficies y materiales hospitalarios.
Resaltamos la importancia del enfermero en este contexto, pues este profesional es el principal responsable por el cuidado con el ambiente de salud, y, su equipo es el que más manipula y realiza procedimientos con los RN.
Así, para garantizar la seguridad de estos RN ingresados en UTIN es necesario capacitar a los trabajadores en el intento de alcanzarse la concienciación y cambio de actitud para garantizar prácticas seguras en este ambiente, tanto para el paciente como para el trabajador de la salud.











 text in
text in 


