INTRODUCCIÓN
La aparición de GMA, es una grave amenaza para la salud pública a nivel mundial. El desarrollo de estas resistencias es un fenómeno biológico natural que se va ampliando año tras año.1
Entre los factores relacionados con las infecciones/colonizaciones por GMA, cabe describir: la hospitalización prolongada, las enfermedades crónicas, las intervenciones quirúrgicas, la estancia en UCI, la inserción de dispositivos invasivos, el incumplimiento de las normas de aislamiento y de las medidas de bioseguridad y el uso inadecuado de antibióticos.2
Cuando un paciente presenta una infección/colonización por un GMA, el pronóstico empeora, ya que la misma se asocia a mayor morbi-mortalidad y coste del tratamiento. Un GMA se caracteriza por presentar resistencias a tres o más grupos de antibióticos habitualmente utilizados en el tratamiento de infecciones y que esta resistencia tenga relevancia clínica.
En el año 2009, el Centro Europeo para la Prevención y Control de Enfermedades (ECDC) estimó que en la Unión Europea aproximadamente 400.000 pacientes/año sufren una infección causada por una de las cinco bacterias multirresistentes más comunes, y unos 25.000 pacientes/año mueren a consecuencia de una infección causada por este grupo de microorganismos.3
Además, los costes que generan (sanitarios y pérdida de productividad) se aproximan a los 1.500 millones de €/año. Cifras similares se describen en EEUU donde, cada año, por lo menos 2 millones de personas adquieren infecciones graves causadas por GMA.4
La vigilancia epidemiológica, la divulgación e información a los profesionales y a la familia, la aplicación de soluciones hidroalcohólicas para la higiene de las manos y el aislamiento a nivel hospitalario de los enfermos portadores de gérmenes multirresistentes, han demostrado una eficacia en la reducción de estos gérmenes y a su vez, en la negativización de los pacientes infectados y/o colonizados con un ahorro considerable en el gasto sanitario y a nivel sociolaboral.5
MATERIAL Y MÉTODOS
Hemos realizado un estudio observacional descriptivo prospectivo de la incidencia de los pacientes portadores de GMA.
El periodo de duración ha sido el tiempo comprendido entre el 1 de enero de 2013 al 30 junio de 2016.La población objeto de estudio ha sido la atendida en las áreas sanitarias III-IV de Cantabria. Según estimaciones de los padrones municipales asciende a 200.000 habitantes, distribuidas en dos Hospitales Comarcales: Hospital Sierrallana (Torrelavega), Hospital de Tres Mares (Reinosa), 14 Centros de Salud y Centros Sociosanitarios. Se ha aplicado el proceso de vigilancia, control y seguimiento epidemiológico, realizado desde el Servicio de Medicina Preventiva Calidad y Seguridad del Paciente con la colaboración del Servicio de Microbiología y de Atención Primaria.
Los datos sobre GMA, han sido obtenidos de: la base de datos en la aplicación informática DIAS, que contiene a todos los pacientes históricos y actuales portadores de infecciones por GMA, de los informes de alta de los servicios médico-quirúrgicos y por los volantes de resultados del laboratorio de microbiología.
Una vez detectados los pacientes con GMA, se introducen en la base de datos DIAS; si precisa ingreso hospitalario se le aplica el aislamiento de contacto en su habitación para evitar la propagación a otros pacientes, informando a los profesionales que le atienden para que apliquen el protocolo de GMA y sigan las medidas de precauciones estándar oportunas a adoptar (higiene de manos, guantes y bata). En su domicilio no es preciso aplicar medidas de aislamiento, ya que en su entorno habitualmente no suelen convivir con personas que padecen inmunosupresión o no tengan mecanismos inmunitarios defensivos frente a los citados gérmenes.
Durante su estancia en el hospital, se le realizan series de cultivos de frotis cada siete días, si resultan positivas y a partir de tres series en ese mismo ingreso, no se repetirán (salvo que permanezca ingresado más de un mes desde la última recogida de frotis); pero se mantendrá el aislamiento hasta el alta. Si la serie es negativa se repiten sin esperar el tiempo de una semana entre cada serie. Al obtener tres series negativas se retira de los positivos en la base de datos DIAS y se la quita el aislamiento.
Si tiene compañero en el momento de la detección de GMA, se saca de la habitación pero no se aplica asilamiento alguno; pero se le realiza una serie cultivos de frotis para el mismo germen aislado en su compañero.
Si resultaran negativos no se hace nada más; pero si el resultado de la serie de cultivos es positiva, se realiza el aislamiento y el seguimiento igual que a su antiguo compañero.
No hace falta que las tres series de frotis de cultivos se realicen necesariamente durante el mismo ingreso hospitalario, ya que este puede ser corto y no dar tiempo a finalizar el estudio. En ese caso, se realizará el seguimiento desde Atención Primaria o en los sucesivos ingresos si los hubiera.
Si el próximo ingreso tiene lugar pasado un año desde el anterior, se le realizará una sola serie de frotis de cultivos del germen; y si el resultado fuera negativo se le retirará de los positivos en la base de datos DIAS.
En Atención Primaría, también salta la alarma en el programa informático OMI-AP; cada vez que el paciente acuda al Centro de Salud.
En el entorno extrahospitalario no hace falta recoger los frotis cada siete días; sino que si los resultados obtenidos son positivos se espacian un periodo de tiempo de un mes entre una toma de frotis y otra. También se retiran de la base de los pacientes positivos cuando se obtienen tres series negativas. Cuando el GMA es mayor de un año desde su detección sin tener ingreso o muestras de seguimiento de su infección/colonización, se saca de la base de datos DIAS al obtener una sola muestra con resultado microbiológico negativo.
Cada vez que el paciente acuda al Hospital, en la etiqueta de los datos de filiación personal saltará un código ERUDINET y el GMA, con lo que de precisar ingreso hospìtalario, lo hará aislado.
Todos los días a primera hora de la mañana, se accede a la base de datos DIAS, que cruza la información con el listado de pacientes ingresados y nos proporciona la relación de usuarios con GMA en el hospital; posteriormente se lleva a cada planta de hospitalización la hoja de seguimiento individualizada para cada profesional, tanto médico como de enfermería. Así mismo, el envío mediante fax a los Centros de Salud de la información al personal sanitario responsable de los pacientes portadores de los GMA y la recogida si procede de la serie de frotis necesarios para realizar un correcto seguimiento del estado de infección /colonización del paciente, con el objetivo último de descolonizarlo y pasarlo a estado de negativizado. Posteriormente causa baja como activo en la base de datos DIAS; si tiene que acudir nuevamente a un centro sanitario no tendrá que ingresar en una habitación con aislamiento, o ser atendido al final de la actividad asistencial para evitar la transmisión entre pacientes de los GMA.
RESULTADOS
Desde el 1 de Enero de 2013, fecha en la que hemos empezado a recoger datos específicos para el presente estudio, hasta el 30 de junio de 2016, que hemos realizado el final del corte, se han obtenido un total de 3446 pacientes con GMA, lo que representa el 1,72% de toda la población atendida.
Los datos se pueden dividir en dos grandes apartados: Pacientes que llevan menos de 1 año, y los que llevan más de 1 año en la base de datos DIAS desde la fecha de su detección.
De los menores de 1 año, hemos detectado 1.164 pacientes de los cuales se han podido negativizar 372; lo que representa el 31,95%.
En los mayores de 1 año existían 2.282 pacientes, de los que se han podido negativizar 711; lo que refleja el 31,15%.
Aplicando la vigilancia y seguimiento epidemiológico desde el Servicio de Medicina Preventiva Calidad y Seguridad del Paciente durante el este periodo (2013-2016), se puede deducir que de un total de 3.446 pacientes con GMA en ese periodo, se han podido negativizar 1.083; lo que representa el 31,42% del total. (Fig. 1)
En el grupo de pacientes con GMA menores de 1 año y que no estaban negativizados, han fallecido 160 ( 13,74%). (Fig .2)
En el otro grupo de pacientes con GMA mayores de 1 año y que no estaban negativizados, ha fallecido 323 (14,15%). (Fig. 3)
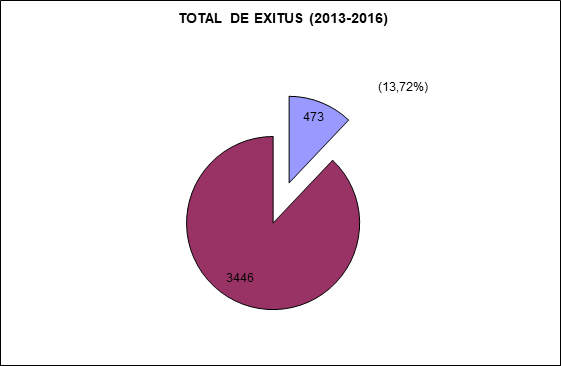
De todos los pacientes contenidos en los dos grupos, han fallecido sin estar negativizados 473 lo que resulta el 13,72% del total. (Fig. 4)
Cabe destacar que los pacientes fallecidos, tenían pluripatologías concomitantes que favorecían la morbimortalidad, y que el hecho de estar infectados y/o colonizados empeoraban el pronóstico clínico; aunque el fallecimiento no ha sido debido a la causa única de ser portador de un GMA.
En el grupo de pacientes menores de 1 año desde su detección, y que no hemos tenido respuesta 65 (5,58%)
En el otro grupo, los pacientes mayores de 1 año desde su detección, y que no hemos tenido respuesta 615 (26,95%).
El total de pacientes de los grupos y de los que no hemos recibido respuesta, han sido 680 lo que representa el 19,73%.
Atendiendo a la denominación de GMA y haciendo la división entre los menores de 1 año y los mayores de 1 año, tenemos los siguientes resultados:
En el grupo de los menores de un año, hemos detectado 403 Stafilococcus Aureus meticilinresistente (SARM) y 332 Eschericha Coli betalactamasa de expectro extendido (E COLI BLEE) de un total de 917 GMA; lo que supone el 43,94% y el 36,20% respectivamente. (Fig. 5)
En el grupo de los mayores de un año, hemos detectado 745 SARM y 1109 E COLI BLEE de un total de 2058 GMA; lo que supone el 36,20% y el 53,88% respectivamente. (Fig. 6)
En el total de los dos grupos de estudio, hemos detectado 1148 SARM y 1441 E COLI BLEE de un total de 2975 GMA; lo que representa el 38,58% y el 48,43% respectivamente. Ahora, si agrupamos el SARM y E COLI BLEE, obtenemos el 87,02% del total de GMA.
En el total de los dos grupos de estudio, hemos detectado 1148 SARM y 1441 E COLI BLEE de un total de 2975 GMA; lo que representa el 38,58% y el 48,43% respectivamente. Ahora, si agrupamos el SARM y E COLI BLEE, obtenemos el 87,02% del total de GMA.
Las localizaciones más frecuentes de estos dos GMA mayoritarios durante este periodo, se han encontrado en UPP (úlceras por presión) y en tejidos blandos para SARM, y en vías urinarias y en heridas quirúrgicas para E COLI BLEE, respectivamente.
La estancia medía de los pacientes ingresados portadores de GMA es de 5 días más larga, frente a los que ingresan y no están infectados y/o colonizados por estos gérmenes multirresistentes.
DISCUSIÓN
Dada la complejidad del problema de los GMA, la aplicación de políticas de uso racional requiere una aproximación multidisciplinar.6)(7)(8
La aplicación de los programas de de prevención y control de los GMA y más concretamente la vigilancia epidemiológica, es la herramienta más efectiva para mejorar la calidad de los servicios sanitarios y supone una reducción importante de las tasas de la infección relacionada con la asistencia sanitaria; disminuyendo los costos de la atención a la salud de los pacientes.
Llama sustancialmente la atención en el presente estudio que en el grupo de GMA de pacientes mayores de 1 año desde su detección, no hayamos tenido respuesta por parte de los profesionales sanitarios en 26,95% frente al 5,58% enel otro grupo de pacientes menores de 1 año.
Esto es debido en parte, a la falta de implicación y concienciación de los mismos; ya que cuanto más tiempo pasa el paciente siendo portador de GMA el seguimiento va decreciendo. Y también en que durante este periodo ha habido un proceso de traslados de médicos y enfermeras que han precisado un lapso de tiempo para adaptarse, conocer y aplicar las medidas de prevención, control, seguimiento y vigilancia epidemiológica frente a los GMA.
El seguimiento y control de los GMA, aplicando los protocolos existentes de aislamiento de contacto con las medidas de prevención universales, han permitido que 1083 pacientes se pudieran beneficiar que sus infecciones y/o colonizaciones fueran curadas de GMA y lo que representa para él y sus familiares las horas laborales perdidas, las incomodidades y lo que suponen para los sanitarios que le atienden en el aislamiento hospitalario.
Teniendo en cuenta, que cada uno de los usuarios portadores de GMA permanecen ingresados una media de 5 días más en una habitación sin poder utilizar la cama del compañero por el centro hospitalario; y el aumento de la presión asistencial que esto supone.9)(10
Además conociendo que el GRD (Grupo relacionado con el diagnóstico) es similar a una neumonía simple & pleuritis edad > 17 años sin complicaciones, y tiene un coste de facturación para el Servicio Cántabro de Salud, de 1.737,88 € por proceso.11
Se puede estimar que durante el periodo del presente estudio, que va del 1 de enero de 2013 al 30 de junio de 2016; desde el Servicio de Medicina Preventiva Calidad y Seguridad del Paciente con aplicación de las medidas preventivas antes mencionadas, se ha producido un ahorro teórico de 1.882.124,04 €, lo que redunda en la mejora de la eficiencia en la gestión y en el nivel de calidad de los cuidados sanitarios prestados.
Cabe destacar la higiene de manos de los profesionales sanitarios, como la medida más efectiva para disminuir la diseminación de los GMA en las infecciones relacionadas a la asistencia sanitaria; en segundo lugar, el seguimiento y control en la aplicación de las medidas de aislamiento y la vigilancia epidemiológica.
Los factores de riesgo que van asociados a la resistencia a los antibióticos son:12
● Gravedad del paciente.
● Enfermedad subyacente.
● Grado de Inmunidad.
● Uso indiscriminado de antibióticos
La aplicación de la vigilancia epidemiológica y el control de los GMA no tiene como fin el ahorro económico, sino la prevención de las infecciones y mejorar la calidad de vida en la salud de los pacientes. Para lograr aumentar estos objetivos se debe de hacer hincapié fundamentalmente en las siguientes medidas:13











 texto en
texto en